9
L'hygiène dans la symbiose
Le maintien du haut niveau de vitalité et d'hygiène des jardins à champignons est indispensable à la survie et à la reproduction de la colonie de fourmis hôtes. Le niveau adéquat n'est pas facile à atteindre : le champignon ne se portera bien que si des températures tropicales corrélées à un haut taux d'humidité règnent dans les chambres de culture souterraines requises. Les fourmis recourent à un nombre impressionnant de techniques sanitaires pour assurer la propreté de leurs jardins : elles arrachent les champignons étrangers ; elles inoculent les mycéliums fongiques appropriés dans le substrat frais ; elles fertilisent le substrat avec des gouttelettes fécales dont les composants incompatibles repoussent les souches étrangères de l'espèce fongique hôte ; elles sécrètent des antibiotiques qui affaiblissent les champignons et les micro-organismes rivaux ; et elles fabriquent des hormones de croissance1.
En 1970, Ulrich Maschwitz et ses collaborateurs ont fait œuvre pionnière en découvrant que des substances antibiotiques sont produites dans les glandes métapleurales – paire de structures glandulaires localisées près de l'extrémité distale du segment corporel médian des fourmis appelé « mésosome » ou « alitronc » – des ouvrières Atta sexdens2. Ils ont suggéré que les composés suivants jouent différents rôles dans la purification de la culture du champignon symbiote : l'acide phénylacétique empêche la prolifération bactérienne ; la myrmicacine (ou acide hydroxydécanoïque) inhibe la germination des spores des champignons étrangers ; et l'acide indolacétique (une hormone végétale) stimule la croissance mycélienne3. Récemment, une analyse plus complète des sécrétions des glandes métapleurales des Acromyrmex octospinosus a permis de détecter vingt composés supplémentaires4 : ils couvrent toute la gamme des acides carboxyliques, depuis l'acide acétique jusqu'aux acides gras à longue chaîne, en plus des cétoacides, des alcools et des lactones.
Les glandes métapleurales des ouvrières coupe-feuilles sont plus volumineuses que celles des autres types de fourmis – et, détail intéressant, c'est d'autant plus vrai que les ouvrières sont petites5 : cette dernière disproportion laisse entrevoir que les ressources attribuées aux sécrétions de ces glandes sont des plus importantes chez les ouvrières minor, sous-caste surtout chargée de s'occuper du champignon et du couvain.
L'hypothèse, auparavant dominante, selon laquelle les fourmis champignonnistes préserveraient la pureté intégrale de leurs jardins à champignons a dû être révisée depuis qu'on s'est aperçu que ces jardins sont souvent contaminés par des bactéries, des levures et d'autres sortes de mycoflores6. Une recherche plus exhaustive et approfondie des agents pathogènes et des parasites des colonies de coupeuses de feuilles a montré que, même si ces fourmis sont incapables de prévenir la contamination, elles font néanmoins en sorte que la croissance des micro-organismes invasifs et des champignons étrangers se maintienne à de très bas niveaux. En matière de lutte contre les champignons parasites, la principale contre-mesure myrmécéenne résiderait dans le maintien à 5 du pH acide des cultures fongiques, valeur optimale pour le champignon symbiote mais dommageable aux champignons envahisseurs pathogènes7 : ce qui vient à l'appui de cette hypothèse, c'est que le pH grimpe à 7 ou à 8 quand les fourmis sont retirées de leurs jardins, quelques jours suffisant ensuite pour que les champignons parasites et les bactéries se diffusent rapidement dans les cultures de champignons symbiotes. Il a été avancé pour cette raison que l'une des fonctions majeures des sécrétions des glandes métapleurales des ouvrières Acromyrmex et Atta consiste à abaisser de 7 ou 8 à 5 environ le pH du matériel foliaire introduit dans la colonie – le fait que chacun des acides présents dans ces sécrétions ait aussi des propriétés antibiotiques serait un bénéfice secondaire de cette réduction8.
Des découvertes frappantes ont jeté une lumière nouvelle sur la « pathologie agricole » des jardins à champignons des fourmis. Après avoir minutieusement isolé des champignons non mutualistes des jardins de fourmis attines où ils proliféraient, Cameron Currie et son équipe ont constaté que certains parasites spécialisés de ces jardins appartiennent au genre de microchampignon dit Escovopsis (Ascomycota : Hypocreales anamorphiques) : ces parasites se transmettent horizontalement d'une colonie de coupeuses de feuilles à l'autre, l'Escovopsis étant si virulent qu'il peut assez dévaster les jardins d'une colonie de fourmis pour la condamner entièrement à mort (Planche 38). Point remarquable entre tous, le genre Escovopsis paraît s'être spécialisé dans l'invasion des jardins à champignons des fourmis attines : non seulement il n'a été observé dans aucun autre habitat, mais il est particulièrement répandu dans les colonies d'Atta et d'Acromyrmex.
Pour ce groupe de chercheurs, le succès de ce parasite s'explique ainsi : la prévalence accrue d'Escovopsis au sein des genres d'attines plus dérivés porte à croire que la longue histoire clonale des cultivars fongiques des coupeuses de feuilles – elle remonte peut-être à 23 millions d'années – rend ceux-ci plus susceptibles de perdre leur « course aux armements » avec les parasites. Les attines inférieures sont habituées au contraire à tirer leurs nouveaux cultivars fongiques de populations sexuées vivant en milieu naturel, ce qui augmente la diversité génétique de leurs champignons mutualistes – d'où, sans doute, la moindre tendance apparente des lignées attines moins dérivées à être en proie au parasitisme9.
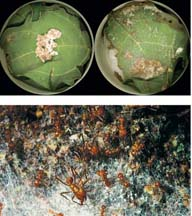
PLANCHE 38. Champignon parasite Escovopsis. En haut : À gauche, morceau de champignon intact provenant du jardin à champignons d'un nid d'Atta. À droite, filaments d'Escovopsis recouvrant un cultivar fongique après que des fourmis Atta y ont introduit des spores d'Escovopsis. (Préparation et photo : Michael Poulson.) En bas : Hyphes filamenteux du champignon parasite Escovopsis envahissant le jardin à champignons d'une colonie d'Atta colombica du Panama. (Photo : Hubert Herz.)
Contrairement à cette hypothèse, cependant, on vient d'obtenir la preuve que les symbiontes fongiques des taxons de fourmis défoliatrices se recombinent sexuellement ; si l'universalité de ce phénomène était avérée, on pourrait en déduire que la clonalité et la transmission verticale n'ont pas exercé une influence capitale sur l'évolution symbiotique des coupeuses de feuilles10.
À quoi que tienne cette virulence, la question demeure. Comment les champignonnistes Atta et Acromyrmex parent-elles cette menace perpétuellement mortelle ? De toute évidence, un jardin à champignons ne demeurera sain qu'à condition que les incursions d'Escovopsis soient contrées en permanence et, si dissuasives que puissent être les sécrétions des glandes métapleurales, la principale arme anti-Escovopsis semble consister dans le troisième mutualiste des fourmis attines, à savoir une bactérie filamenteuse actinomycète du genre Pseudonocardia11 : non seulement les antibiotiques produits par cet autre symbionte réduisent fortement la croissance d'Escovopsis12, mais l'analyse moléculaire récente du système concerné a révélé que l'actinobactérie associée à la fourmi champignonniste Apterostigma dentigerum sécrète une substance, dite dentigerumycine, qui inhibe sélectivement le champignon parasite Escovopsis13. En plus d'être de vrais mutualistes évolués, les bactéries Pseudonocardia vivent dans des régions de la cuticule des fourmis qui paraissent spécifiques à ces insectes : chez les Acromyrmex, en particulier, elles se concentrent sur les plaques latérocervicales des propleures (Figure 6), zone où les fourmis de cette espèce présentent des modifications morphologiques telles que des cryptes garnies de protubérances tégumentaires en forme de tubercules que des canaux cuticulaires relient à de nombreuses cellules de glandes exocrines – c'est à l'intérieur de ces cryptes que les bactéries filamenteuses mutualistes se développent. Bien que ces sortes de structures renfermant des bactéries n'aient été découvertes jusqu'à présent que chez les fourmis champignonnistes et que leur configuration et leur emplacement varient beaucoup d'une branche à l'autre de l'arbre phylogénétique des fourmis attines14, même chez les ouvrières Acromyrmex, les actinomycètes résident souvent sur la tête et le thorax, leur accumulation donnant l'impression que ces fourmis sont couvertes de poussière blanche (Planche 39) : il est vraisemblable que la persistance de ces cultures d'actinomycètes a quelque chose à voir avec les sécrétions des cryptes glandulaires.
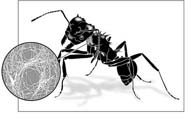
FIGURE 6. La bactérie filamenteuse du genre Pseudonocardia (ordre des actinomycètes) est un symbionte des fourmis coupe-feuilles : les antibiotiques qu'elle produit inhibent fortement la croissance des champignons parasites. Chez les fourmis Acromyrmex, ce symbionte vit dans la région frontale du thorax (dans les plaques latérocervicales des propleures), où des structures spéciales abritent les bactéries ; mais il peut se répandre au-delà de ces structures, allant quelquefois jusqu'à couvrir de vastes parties du corps. (Illustration de Margaret Nelson.)

PLANCHE 39. Les ouvrières Acromyrmex transportent l'actinomycète symbiotique blanchâtre du genre Pseudonocardia sur leur cuticule : l'épaisse excroissance filamenteuse de cette actinobactérie est parfois présente sur la totalité de la surface corporelle de la fourmi, et les antibiotiques produits par les bactéries symbiotes jugulent spécifiquement la croissance du champignon parasite Escovopsis. (Photos du haut : Christian Ziegler. Photo du bas : Michael Poulsen.)

PLANCHE 40. Des fourmis ouvrières « jardinières » Atta cephalotes débarrassent un jardin à champignons de ses spores fongiques étrangères, de ses débris et des tissus de ses champignons parasites. (Photo : Alex Wild.)
Plus surprenante encore est la manière dont les jardinières préviennent l'invasion et la propagation des parasites microbiens. Les ouvrières affectées à l'entretien du champignon (Planche 40) ramassent les débris et les spores pathogènes – celles d'Escovopsis, par exemple –, puis les placent dans leur poche infrabuccale avant de les recracher dans les chambres à ordures de leurs nids ou sur leurs dépotoirs extérieurs : c'est par cette poche située dans la cavité orale de toutes les espèces de fourmis que la nourriture est filtrée ; chez les fourmis champignonnistes, cette structure fonctionne comme une « chambre de stérilisation » fatale aux spores des parasites de leurs jardins – les bactéries actinomycètes de leur poche infrabuccale produisent probablement des antibiotiques qui inhibent le développement des spores15.
Les bactéries mutualistes sont transmises verticalement (de la colonie mère à ses filles) sur le corps de la reine fondatrice, de la même façon que le champignon symbiote. Ces bactéries ne sont pas seulement adaptées à la lutte contre le champignon parasite : elles favorisent en outre la croissance du champignon symbiote in vitro. Quand l'infestation est extrême, la colonie de fourmis atteinte peut être forcée d'échapper à Escovopsis en émigrant dans un autre nid, auquel cas les bactéries transportées permettent de poursuivre la lutte dans le nouvel habitat16.
Il faut tenir compte également de la riche communauté de micro-organismes que les nids de coupeuses de feuilles abritent. D'après une première étude, dix-neuf espèces de micro-organismes associées aux fourmis défoliatrices ont été identifiées : elles comprennent une souche de Streptomyces qui est un très puissant inhibiteur de la croissance d'Escovopsis17. Parmi tous les composés isolés à partir de ces bactéries Streptomyces, l'agent le plus actif contre Escovopsis s'est révélé être la candicidine après que cette substance eut été testée en laboratoire, alors qu'un au moins des isolats microbiens de chacune des espèces d'Acromyrmex en produit18 : c'est donc peut-être par cette autre massue chimique que les parasites microbiens des jardins à champignons sont écrasés. En réalité, des bactéries actinomycètes ont été aussi détectées sur les cuticules de fourmis appartenant à des espèces qui ne cultivent pas de champignons : la présence de bactéries productrices de substances fongicides bénéficie manifestement aux insectes endogés exposés à de multiples risques d'infection, et, s'agissant des fourmis champignonnistes, les divers assemblages d'actinomycètes produisant tel ou tel fongicide pourraient pareillement offrir une protection supplémentaire contre le risque d'infection fongique – il est à noter que ni le composé isolé à partir des Pseudonocardia ni celui isolé à partir des Streptomyces n'influe sur la croissance du champignon symbiote des coupe-feuilles.
Pour parler de symbiose, il faut bien entendu se demander si l'association de microbes avec les coupeuses de feuilles et leur champignon, d'une part, et le parasite spécialisé Escovopsis, d'autre part, s'enracinent dans une profonde histoire coévolutionnaire ou si ces éléments s'assemblent plutôt par hasard dans le nid particulier où ils cohabitent. Par exemple, certains microbes pourraient provenir des fragments de feuilles que les porteuses acheminent jusqu'à leur nid : seules de futures recherches pourront résoudre ces problèmes.
Diverses données fort convaincantes attestent pourtant que Pseudonocardia fait partie intégrante d'un système symbiotique véritablement coévolutif dont les fourmis champignonnistes ne sont qu'un sous-ensemble19 : l'originalité tout autant que l'étroitesse de la relation entre les fourmis attines et Pseudonocardia témoignent de l'origine ancienne du mutualisme – voici la conclusion générale de Cameron Currie et de ses collègues : « Même si le mutualisme fourmi-champignon est souvent tenu pour l'un des exemples les plus fascinants de symbiose très évoluée, il est clair désormais que sa complexité a été largement sous-estimée. La symbiose attine a tout d'une “course aux armements” évolutionnaire entre le parasite Escovopsis, d'un côté, et l'association tripartite de l'actinomycète, de la fourmi hôte et du mutualiste fongique, de l'autre20 » (Figure 7).
Mais ce n'est pas tout, car un quatrième participant de ces systèmes symbiotiques si complexes vient d'être identifié : il s'agit d'une levure noire qui, en mangeant les bactéries Pseudonocardia sur la cuticule des fourmis coupe-feuilles, atténue l'efficacité de la lutte que les dérivés antibiotiques de ces bactéries permettent de mener contre le champignon parasite Escovopsis – le fait est que les colonies infectées par cette levure noire défendent beaucoup moins efficacement leurs jardins à champignons contre les invasions d'Escovopsis21.
Enfin, un cinquième acteur de ce réseau symbiotique a été récemment détecté. Des collaborateurs du bactériologiste Cameron Currie ont réussi à isoler les bactéries fixatrices d'azote des jardins à champignons de quatre-vingts colonies de fourmis coupe-feuilles : ces types de bactéries convertissent l'azote présent dans l'atmosphère en ammoniac, processus d'autant plus essentiel à la vie que ce gaz est une brique élémentaire des acides aminés et des protéines. Bien qu'assez peu de plantes – les légumineuses appartenant à la famille des fabacées, principalement – soient capables de fixer l'azote atmosphérique, quelques-unes y parviennent malgré tout grâce aux bactéries symbiotiques qui vivent dans leurs appareils radiculaires ; et des chercheurs ont démontré que les jardins à champignons des fourmis coupeuses de feuilles contiennent des bactéries (du genre Klebsiella, semble-t-il) fixatrices de l'azote atmosphérique qui facilitent la culture de leur champignon symbiote22.
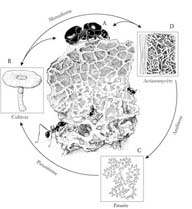
FIGURE 7. Symbiose quadripartite des fourmis coupe-feuilles. A : La reine est l'unité reproductrice de la colonie de coupeuses de feuilles. B : Habitus des champignons leucocoprins à l'état naturel. C : Microchampignon parasite Escovopsis. D : Actinomycète filamenteux Pseudonocardia, qui pousse sur la cuticule des fourmis et produit des antibiotiques inhibant la croissance d'Escovopsis. Les flèches indiquent les composants en interaction. (Redessiné par Margaret Nelson, à partir d'une illustration originale de Cara Gibson in C. R. Currie, « A community of ants, fungi, and bacteria : a multilateral approach to studying symbiosis », Annual Review of Microbiology, 55, 2001, p. 357-380.)
1 Pour une vue d'ensemble, voir B. Hölldobler, E. O. Wilson, The Ants, Cambridge, MA, Belknap Press of Harvard University Press, 1990 ; et R. Wirth, H. Herz, R. J. Ryel, W. Beyschlag, B. Hölldobler, Herbivory of Leaf-Cutting Ants : A Case Study on Atta colombica in the Tropical Rainforest of Panama, New York, Springer-Verlag, 2003.
2 U. Maschwitz, K. Koob, H. Schildknecht, « Ein Beitrag zur Funktion der Metathorakaldrüse der Ameisen », Journal of Insect Physiology, 16(2), 1970, p. 387-404 ; U. Maschwitz, « Vergleichende Untersuchungen zur Funktion der Ameisenmetathorakaldrüse », Oecologia, 16(4), 1974, p. 303-310.
3 H. Schildknecht, K. Koob, « Plant bioregulators in the metathoracic glands of myrmicine ants », Angewandte Chemie, 9(2), 1970, p. 173 ; H. Schildknecht, K. Koob, « Myrmicacin, the first insect herbicide », Angewandte Chemie, 10(2), 1971, p. 124-125.
4 D. Ortius-Lechner, R. Maile, E. D. Morgan, J. J. Boomsma, « Metapleural gland secretion of the leaf-cutter ant Acromyrmex octospinosus : new compounds and their functional significance », Journal of Chemical Ecology, 26(7), 2000, p. 1667-1683.
5 E. O. Wilson, « Caste and division of labor in leaf-cutter ants (Hymenoptera : Formicidae : Atta), I : The overall pattern in A. sexdens », Behavioral Ecology and Sociobiology, 7(2), 1980, p. 143-156 ; E. O. Wilson, « Caste and division of labor in leaf-cutter ants (Hymenoptera : Formicidae : Atta), II : The ergonomic optimization of leaf cutting », Behavioral Ecology and Sociobiology, 7(2), 1980, p. 157-165 ; E. O. Wilson, « Caste and division of labor in leaf-cutter ants (Hymenoptera : Formicidae : Atta), III : Ergonomic resiliency in foraging by A. cephalotes », Behavioral Ecology and Sociobiology, 14(1), 1983, p. 47-54 ; E. O. Wilson, « Caste and division of labor in leaf-cutter ants (Hymenoptera : Formicidae : Atta), IV : Colony ontogeny of A. cephalotes », Behavioral Ecology and Sociobiology, 14(1), 1983, p. 55-60 ; A. N. M. Bot, M. L. Obermayer, B. Hölldobler, J. J. Boomsma, « Functional morphology of the metapleural gland in the leaf-cutting ant Acromyrmex octospinosus », Insectes Sociaux, 48(1), 2001, p. 63-66.
6 C. R. Currie, « Prevalence and impact of a virulent parasite on a tripartite mutualism », Oecologia, 128, 2001, p. 99-106. Voir le remarquable tour d'horizon de C. R. Currie dans « A community of ants, fungi, and bacteria : a multilateral approach to studying symbiosis », Annual Review of Microbiology, 55, 2001, p. 357-380.
7 R. J. Powell, D. J. Stradling, « Factors influencing the growth of Attamyces bromatificus, a symbiont of attine ants », Transactions of the British Mycological Society, 87(2), 1986, p. 205-213.
8 D. Ortius-Lechner, R. Maile, E. D. Morgan, J. J. Boomsma, « Metapleural gland secretion of the leaf-cutter ant, Acromyrmex octospinosus : new compounds and their functional significance », Journal of Chemical Ecology, 26(7), 2000, p. 1667-1683.
9 C. R. Currie, U. G. Mueller, D. Malloch, « The agricultural pathology of ant fungus gardens », Proceedings of the National Academy of Sciences USA, 96(14), 1999, p. 7998-8002.
10 A. S. Mikheyev, U. G. Mueller, P. Abbot, « Cryptic sex and many-to-one coevolution in the fungus-growing ant symbiosis », Proceedings of the National Academy of Sciences USA, 103(28), 2006, p. 10702-10706.
11 On pensait à l'origine que cet actinomycète était du genre Streptomyces (Streptomycetaceae : Actinomycetes). Mais cette identification semble être incorrecte (R. Wirth, communication personnelle), des analyses de phylogénétique moléculaire venant de révéler que la bactérie symbiotique en question appartient à la famille actinomycète des Pseudonocardiaceae (C. R. Currie, communication personnelle). Voir aussi l'erratum de Nature, 423, 2003, p. 461.
12 C. R. Currie, J. A. Scott, R. C. Summerbell, D. Malloch, « Fungus-growing ants use antibiotic-producing bacteria to control garden parasites », Nature, 398, 1999, p. 701-704.
13 D.-C. Oh, M. Poulsen, C. R. Currie, J. Clardy, « Dentigerumycin : a bacterial mediator of ant-fungus symbiosis », Nature Chemical Biology, 5, 2009, p. 391-393.
14 C. R. Currie, M. Poulsen, J. Mendenhall, J. J. Boomsma, J. Billen, « Coevolved crypts and exocrine glands support mutualistic bacteria in fungus-growing ants », Science, 311, 2006, p. 81-83.
15 A. E. F. Little, T. Murakami, U. G. Mueller, C. R. Currie, « The infrabuccal pellet piles of fungus-growing ants », Naturwissenschaften, 90, 2003, p. 558-562 ; A. E. F. Little, T. Murakami, U. G. Mueller, C. R. Currie, « Defending against parasites : fungus-growing ants combine specialized behaviours and microbial symbionts to protect their fungus gardens », Biology Letters, 2(1), 2006, p. 12-16.
16 R. Wirth, H. Herz, R. J. Ryel, W. Beyschlag, B. Hölldobler, Herbivory of Leaf-Cutting Ants : A Case Study on Atta colombica in the Tropical Rainforest of Panama, New York, Springer-Verlag, 2003.
17 C. Kost, T. Lakatos, I. Bötcher, W.-R. Arendholz, M. Redenbach, R. Wirth, « Nonspecific association between filamentous bacteria and fungus-growing ants », Naturwissenschaften, 94, 2007, p. 821-828.
18 S. Haeder, R. Wirth, H. Herz, D. Spiteller, « Candicidin-producing Streptomyces support leaf-cutting ants to protect their fungus garden against the pathogenic fungus Escovopsis », Proceedings of the National Academy of Sciences USA, 106(12), 2008, p. 4742-4746.
19 E. J. Caldera, M. Poulsen, G. Suen, C. R. Currie, « Insect symbiosis : a case study of past, present, and future fungus-growing ant research », Environmental Entomology, 38, 2009, p. 78-82.
20 C. R. Currie, U. G. Mueller, D. Malloch, « The agricultural pathology of ant fungus gardens », Proceedings of the National Academy of Sciences USA, 96(14), 1999, p. 7998-8002.
21 A. E. F. Little, C. R. Currie, « Black yeast symbionts compromise the efficiency of antibiotic defenses in fungus-growing ants », Ecology, 89, 2008, p. 1216-1222.
22 A. A. Pinto-Tomás, M. A. Anderson, G. Suen, D. M. Stevenson, F. A. T. Chu, W. W. Cleland, P. J. Weimer, C. R. Currie, « Symbiotic nitrogen fixation in the fungus gardens of leaf-cutter ants », Science, 326, 2009, p. 1120-1123.