Kapitel 6
Tanz der Elemente
Im Laufe des 17 . und 18 . Jahrhunderts hatte sich die Physik, nicht zuletzt dank Isaac Newton, zu einer verlässlichen, ernst zu nehmenden Wissenschaft gemausert. Die Bewegungen von Körpern konnten präzise beobachtet, dokumentiert und vorhergesagt werden, und es entwickelte sich ein immer besseres Verständnis davon, wie die Schwerkraft funktioniert. Von der Chemie ließ sich dasselbe allerdings nicht behaupten. Tatsächlich hatte man immer noch keine wirkliche Ahnung, woraus Materie überhaupt besteht oder warum sich Substanzen so verhalten, wie sie sich verhalten, wenn sie miteinander reagieren. Die Chemie war damals noch keine eigene Wissenschaftsdisziplin, sondern der Alchemie untergeordnet.
Aber was ist eigentlich der Unterschied zwischen Chemie und Alchemie? War das nicht ursprünglich mal dasselbe? Nun, Alchemie beschäftigte sich zunächst, ähnlich wie die Chemie, mit der Verarbeitung verschiedener Stoffe. Zum Beispiel stellten Alchemisten Schießpulver her oder entwickelten frühe Formen pharmazeutischer Medizin. Aber sie glaubten auch, man könne mithilfe des sogenannten Steins der Weisen unedle Metalle wie Quecksilber in Gold und Silber verwandeln. 168 Auf der (vergeblichen) Suche nach dieser Substanz, die sich dabei nicht verbrauchen würde, erlangten Alchemisten einige beeindruckende wissenschaftliche Erkenntnisse, und so kam es, dass sich die »seriöse« Chemie irgendwann abspaltete und die Alchemie mehr und mehr zur Pseudowissenschaft verkam.
Der deutsche Apotheker und Alchemist Hennig Brand entdeckte zum Beispiel im Jahr 1669 das Element Phosphor, als er Urin bei großer Hitze verdampfen ließ (eine Prozedur, die ganz fürchterlich gestunken haben muss). Das Verfahren verkaufte er gewinnbringend weiter, und Phosphor wurde zunächst als Heilmittel, schließlich aber vor allem für die Produktion von Streichholzköpfen verwendet. 169
Eine andere Frage, die man sich zu jener Zeit stellte, war, wieso Dinge überhaupt brennen. Was ist Feuer, was hat es damit auf sich? Der deutsche Wissenschaftler Georg Ernst Stahl glaubte, dass alles, was brennen kann, eine Komponente namens »Phlogiston« enthält. 170 Wenn zum Beispiel Kohle verbrannt werde, verliere sie einen Teil ihres Phlogiston-Anteils und werde deshalb messbar leichter. Diese über viele Jahre erfolgreiche These zweifelte der Franzose Antoine-Laurent Lavoisier Ende des 18 . Jahrhunderts an. Er selbst verbrannte Stoffe wie Schwefel oder Phosphor (auch er spielte anscheinend gerne mit Urin) und stellte fest, dass sie dabei Gewicht hinzugewinnen, nicht verlieren. Später entdeckte er, dass Sauerstoff für die Reaktion verantwortlich ist, und schrieb einen Aufsatz, der die beliebte Phlogiston-Theorie aus dem Rennen kegelte.
Lavoisier war damit den chemischen Elementen auf der Spur, und er fing nun an, durch vorsichtiges Experimentieren und präzises Dokumentieren Substanzen in ihre Einzelteile zu zerlegen. Er versuchte, bis zum kleinsten unteilbaren Level der Elemente vorzustoßen; dabei teilte er Gase wieder und wieder in ihre Bestandteile, bis nichts mehr ging. Unterstützung erhielt er von seiner Frau Marie-Anne Paulze, die nicht nur maßgeblich daran beteiligt war, neue Maßstäbe für die wissenschaftliche Methodik zu entwickeln, sondern auch dazu beitrug, dass Lavoisiers Erkenntnisse nicht in Vergessenheit gerieten. Aber zunächst zu seinem bekanntesten Experiment:
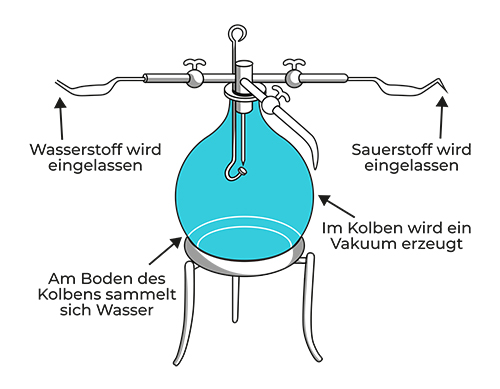
Im Jahr 1783 experimentierte Lavoisier mit einem Gas, das knapp 20 Jahre zuvor von Henry Cavendish entdeckt und als »inflammable air« 171 bezeichnet worden war. Cavendish (wir erinnern uns aus Kapitel 4 an den Engländer, der die Masse der Erde bestimmte, ohne sein Haus zu verlassen) hatte diese »brennbare Luft« in einem geschlossenen System mit normaler Luft reagieren lassen und festgestellt, dass sich dabei Tau bildete. Der Forscher erklärte das mit der damals noch weitverbreiteten Phlogiston-Theorie 172 und schenkte der Sache wenig Beachtung. Lavoisier ließ nun ebenfalls reine Luft (oder Sauerstoff, wie er es mittlerweile nannte) mit Cavendishs »brennbarer Luft« (heute bekannt als Wasserstoff) reagieren. Dafür stellte er in einem Glasbehälter ein Vakuum her (Abbildung 6 .1 ) und ließ anschließend Wasser- und Sauerstoff im Verhältnis 2 :1 hinein. Als dabei in seinem Apparat ebenfalls Tau entstand, verstand Lavoisier, dass er Wasser erschaffen hatte, dass Wasser also irgendwie aus Wasser- und Sauerstoff bestehen musste. 173 Eine Annahme, mit der er absolut recht hatte, denn Wasser ist, wie wir heute wissen, aus zwei Wasseratomen und einem Sauerstoffatom zusammengesetzt: H2 O.
Basierend auf dieser Erkenntnis legte Lavoisier nicht nur den Grundstein für das heutige Periodensystem, sondern formulierte auch das Prinzip der Massenerhaltung aus, das Folgendes besagt: Vor und nach jedem Experiment in einem geschlossenen System existiert stets die gleiche Masse an Materie. Nichts geht verloren!
Eine wichtige Erkenntnis.
Lavoisiers Hauptwerk, Traité élémentaire de chimie, erschien 1789 , in dem Jahr, als im Zuge der Französischen Revolution die Bastille gestürmt wurde, was auch für Lavoisier dramatische Folgen haben sollte. Da er über 20 Jahre als Leiter des Pariser Schießpulver-Arsenals sowie als Steuereintreiber gearbeitet hatte, geriet er auf die schwarze Liste der Generalversammlung, die ihn am 8 . Mai 1794 schließlich zum Tode verurteilte. Seine Frau versuchte verzweifelt, gegen das Urteil vorzugehen, doch ohne Erfolg. Noch am selben Tag wurde er zur Guillotine gezerrt, wo er der Legende nach ein letztes Experiment durchführte. Angeblich hatte er sich vorgenommen, noch so oft wie möglich zu blinzeln, nachdem sein Kopf von seinem Körper abgetrennt worden war. Damit wollte er zeigen, wie lange ein Mensch nach seiner Enthauptung weiterlebt. Er soll es elf Mal geschafft haben. 174
Marie-Anne, nun Witwe, machte sich daran, die Arbeiten ihres verstorbenen Mannes ins Englische zu übersetzen und zu veröffentlichen. Die neue Regierung hatte seine Notizbücher und seine Laborausrüstung beschlagnahmt, und so ist es allein Marie-Anne Paulze zu verdanken, dass viele Erkenntnisse und Experimente von Lavoisier bis heute »überlebt« haben und die Wissenschaft damals vor einem neuerlichen Absturz in ein dunkles Zeitalter bewahrt wurde.