Was ist ein Atom?
Das Ehepaar Lavoisier ging mit seinen Experimenten und mit der Suche nach der kleinsten unteilbaren Einheit einer Frage nach, die schon Tausende von Jahren alt war: Woraus besteht eigentlich alles? Wie weit kann ich Dinge in ihre Einzelteile zerlegen, bis es nicht mehr weitergeht? Der große griechische Denker Platon war zu dem Ergebnis gekommen, dass alles, was wir sehen können, aus vier grundlegenden Elementen besteht: Feuer, Wasser, Luft und Erde. 175 Heute haben wir ein wesentlich besseres Verständnis von der Beschaffenheit unserer Welt: Schon in der Schule lernen wir, dass alles um uns herum aus Atomen zusammengesetzt ist. 13 Und wir wissen auch, dass verschiedene Atome so ziemlich alles abbilden, was Materie ist. Ein 80 kg schwerer Mensch zum Beispiel besteht aus etwa 52 kg Sauerstoff, 14 ,4 kg Kohlenstoff, 8 kg Wasserstoff, 2 ,4 kg Stickstoff sowie kleineren Mengen Kalzium, Phosphor, Magnesium und so weiter. 176 Aber was soll das überhaupt sein, ein Atom? Und wie kommt man auf so eine Idee?
Der wohl erste Mensch, der eine Art Atomtheorie entwickelte, war der indische Gelehrte Kanada, der irgendwann zwischen dem 6 . und 2 . Jahrhundert v.u.Z. lebte. Über die indischen Philosophen ist nur sehr wenig überliefert, und so erreichte die Hypothese Kanadas (dessen traditioneller Name übersetzt »Atom-Esser« bedeutet 177 ) die wissenschaftliche Revolution in Europa gar nicht, aus der schließlich das Teilgebiet der Chemie hervorging. Seine Idee, die Welt könnte aus Atomen – er nannte sie paramanu 178 – bestehen, also winzigen, untrennbaren Teilchen, wurde einige Hundert Jahre nach seinem Tod, komplett unabhängig von ihm, erneut von einem griechischen Philosophen geäußert.
Die Rede ist von Demokrit, einem Gelehrten, der vor über 2400 Jahren den Begriff atomon prägte, was so viel bedeutet wie »unteilbar«. 179 In unserem heutigen westlichen Verständnis gilt Demokrit als Großvater der Atomtheorie, auch wenn wir mittlerweile wissen, dass ihm vermutlich ein indischer Gelehrter zuvorgekommen ist (und wer weiß, wie viele andere Denkerinnen und Gelehrte, deren Ideen und Schriften nicht überliefert sind, diesen Gedanken schon hatten). Demokrit glaubte, dass man, wenn man Objekte immer weiter zerteilen könnte, irgendwann auf eine Ebene winziger Teilchen stoßen würde, die sich nicht weiter zertrennen ließen: die Atome. Demokrits atomare Welt bestand aus unendlich vielen solcher Atome, die alle unterschiedlich geformt waren und sich in unendlich vielen Konstellationen miteinander kombinieren ließen.
Hunderte Jahre später stellte der arabische Alchemist Jabir ibn Ḥayyan fest, dass man Objekte tatsächlich in kleinere, reinere Einzelteile trennen kann. Seine Experimente legten das Fundament für die Alchemie, die sich bis nach Europa ausbreiten sollte. 180 Er entdeckte grundlegende chemische Prozesse wie zum Beispiel die Kristallisation, bei der Flüssigkeiten oder Gas in Kristalle umgewandelt werden können. 181
Als sich im 17 . Jahrhundert langsam die modernen Naturwissenschaften von den Pseudowissenschaften abspalteten – so die Chemie von der Alchemie und die Astronomie von der Astrologie –, machte sich in der Elemente-Lehre vor allem ein Mann einen Namen: Robert Boyle. Er lehnte die Vier-Elemente-Theorie von Platon ab und trug jede Menge zum heutigen Verständnis der chemischen Elemente bei. So prägte er den Begriff des »Elements« als eines chemisch unzerlegbaren Bausteins der Materie. 182 In seinem 1661 erschienenen Buch Der skeptische Chemiker spricht er sich außerdem vehement für die Empirie, also die wissenschaftliche Erschließung neuer Theorien durch Experimente und Beobachtungen, aus. Zudem gründete er die erste große Wissenschaftsakademie der Welt: die Royal Society in London.
Die erste konkrete Definition des Atoms stammt von dem englischen Naturforscher John Dalton. Und zwar vermutete er, dass Atome die Basis jeglicher Materie darstellen. Würde man dieses Buch in unendlich kleine Teile zerlegen, müsste man also irgendwann auf die kleinstmögliche Einheit stoßen. Atome sind laut Dalton nicht weiter zertrennbar, wie auch Demokrit es schon behauptet hatte. Heute wissen wir, dass das nicht so ganz stimmt, aber dazu gleich mehr. Dalton fügte noch hinzu, dass Atome sich vor allem durch ihre Masse unterscheiden. Alle Atome eines Elements haben die gleiche Größe und Masse. Die Atome anderer Elemente haben eine andere Masse. 183
Die Atomtheorie Daltons half Chemikerinnen und Physikern dabei, Elemente zu entdecken und Moleküle, also die Kombination solcher Elemente, weiter in ihre Einzelteile zu zerlegen und zu kategorisieren.
Der britische Physiker J.J. Thomson führte 1897 ein Experiment durch, welches das Undenkbare mit Daltons Atom anstellte: Es enthüllte die Existenz eines noch kleineren Bestandteils desselben. In seinem Experiment stellte Thomson in einer Röhre einen vakuumähnlichen Zustand her und schickte Teilchen hindurch, die er elektrisch sowie magnetisch ablenken konnte. Mit anderen Worten, er untersuchte die Ladung von Atomen, wollte überprüfen, ob sie eher positiv oder negativ geladen waren. Und siehe da: Als sich die Teilchen wieder und wieder in Richtung einer positiv geladenen Metallplatte innerhalb der Röhre orientierten, schlussfolgerte Thomson, dass Atome negativ geladene Partikel enthalten müssen. Damit bekamen Atome erstmals eine Struktur, die komplexer war als die »grobe« Vorstellung von Dalton. Thomson hatte gerade das erste subatomare Teilchen entdeckt: das Elektron. 184 Da Atome insgesamt aber neutral geladen sind, konstruierte er das »Plumpudding-Modell«, das davon ausgeht, dass Atome zusätzlich noch eine Massekugel mit positiver Ladung besitzen. Seine neu entdeckten Elektronen (er nannte sie damals noch Korpuskel) seien innerhalb dieser Massekugel gleichmäßig verteilt, wie Trockenobst in einem englischen Pudding oder Rosinen in einem Brötchen. Für die Entdeckung der Elektronen erhielt Thomson 1906 den Nobelpreis für Physik.
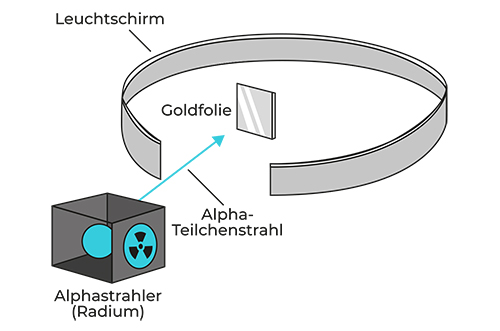
Das Plumpudding-Modell begann aber schon bald zu wackeln (kein Wunder, war ja auch Pudding), als einer der wohl talentiertesten experimentellen Physiker aller Zeiten sich der Sache annahm: Ernest Rutherford sollte im Laufe seines Lebens unser Verständnis des Atoms mehrfach revolutionieren. Gemeinsam mit seinen Mitarbeitern Hans Geiger und Ernest Marsden entwickelte er 1909 das Goldfolien-Experiment, auch rutherfordscher Streuversuch genannt, bei dem etwas wahrhaft Merkwürdiges passierte.
Im Zentrum der Versuchsanordnung befindet sich eine dünne Goldfolie, die mit Alphateilchen beschossen wird. Ein Alphateilchen entsteht, wenn ein spezieller radioaktiver Atomkern zerfällt, zum Beispiel Radium. 185 Der Kern ist instabil und wirft ein Teilchen ab, um einen stabileren Zustand zu erreichen. 14 Um die Goldfolie herum wurde ein Leuchtschirm aufgebaut, der messen sollte, was mit den Alphateilchen passierte, wenn sie auf die Goldfolie trafen.
Nach dem Plumpudding-Modell von Thomson, das eine gleichmäßige Verteilung von positiver und negativer Ladung innerhalb des Atoms postulierte, hätten die Alphateilchen allesamt durch die Goldfolie hindurchfliegen müssen, als würde sie nicht existieren. Genau das erwarteten Rutherford, Geiger und Marsden bei ihrer Versuchsanordnung, doch dann staunten sie nicht schlecht, als sie sahen, was tatsächlich passierte.
Wie erwartet, gingen die meisten Alphateilchen durch die Goldfolie wie ein Messer durch warme Butter. Anschließend landeten sie auf der gegenüberliegenden Seite an dem Leuchtschirm, wo Rutherford und Kollegen sie als Lichtblitze registrierten. Doch etwa eins von 8000 Teilchen wurde von der Folie nicht durchgelassen. Schlimmer noch: Es wurde sogar »zurückgeschossen«, also um 90 ° oder sogar mehr abgelenkt. 186 Rutherford traute seinen Augen nicht: »Es war das wohl unglaublichste Erlebnis, das ich je hatte. Es war fast so, als würde man mit einem Raketenwerfer auf ein Papiertaschentuch schießen, und die Rakete prallt davon ab und trifft den Schützen!« 187
Seine Erklärung dafür lautete wie folgt: Atome sind anders strukturiert, als Thomson angenommen hatte. Sie müssen einen winzigen positiv geladenen Kern besitzen, in dem sich fast die komplette Masse konzentriert. Die negativ geladene Elektronenhülle umgibt diesen winzigen Atomkern. 188
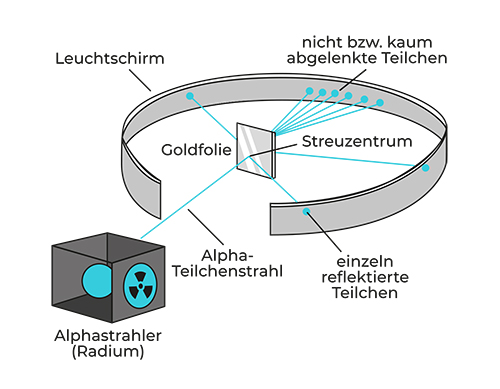
Es wurden nur so wenige Alphateilchen von den Atomen innerhalb der Metallfolie abgelenkt, weil sie nur in den seltensten Fällen direkt auf den winzigen Atomkern trafen (siehe Abbildung 6 .4 ). Und warum wurden sie in diesen Fällen zurückgeschleudert? Weil der Atomkern, auf den sie trafen, positiv geladen war, genau wie sie selbst, und gleiche Ladungen stoßen sich ab.
Damit hatte Rutherford einen weiteren wichtigen Schritt bei der Suche nach der wahren Struktur des Atoms getan. Der Atomkern ist, wie wir heute wissen, tatsächlich verantwortlich für über 99 ,9 Prozent der Masse eines jeden Atoms. In ihm finden wir weitere subatomare Teilchen: die positiv geladenen Protonen und die ladungslosen Neutronen. Dabei ist der Atomkern winzig im Vergleich zur Elektronenhülle, die ihn umgibt. Wenn der Kern etwa so groß ist wie eine Erbse, dann entspricht die Elektronenhülle einem Fußballstadion, in dessen Mitte sie liegt. 189 Ein Atom ist etwa 10 –10 Meter groß, das heißt, wenn man etwa 100 Millionen Atome nebeneinander platzieren würde, wären sie gerade mal einen Fingernagel breit.

Mit ihren Experimenten öffneten Rutherford und Thomson die Büchse der Pandora. Bei genauerer Untersuchung des Verhaltens subatomarer Partikel stellten Wissenschaftlerinnen und Physiker in der Folge nämlich fest, dass ihre Vorstellungen darüber, wie unser Universum aufgebaut ist, dringend eine Reform nötig hatte. Die Rede ist von der Entwicklung der Quantenmechanik, auf die wir in Kapitel 8 noch näher eingehen werden. Zunächst werfen wir aber einen Blick auf die Alphateilchen, die Rutherford in seinem Experiment so nonchalant nutzte, und auf eine Entdeckung, die ungeahnte und vor allem weitreichende Folgen gehabt hatte: die der Radioaktivität.