3
LAS CÉLULAS NUNCA DUERMEN
Los efectos microscópicos del paso del tiempo en nuestros tejidos
Cuando uno empieza a estudiar qué ocurre en nuestro cuerpo a medida que envejecemos, la primera impresión es de confusión. Si nos guiamos por el sentido común, podemos partir de la idea de que es un proceso de deterioro progresivo. Pero pronto nos damos cuenta de que esta idea es demasiado simple. No todo se deteriora. O por lo menos no todo se deteriora igual.
La inteligencia cristalizada, por ejemplo, que se basa en conocimientos y habilidades que hemos adquirido a lo largo de la vida, mejora con la experiencia y por lo tanto con la edad. La capacidad de reconocer emociones en la cara de otras personas también se perfecciona con los años. Hay otros tipos de inteligencia, por el contrario, que declinan.
Si nos fijamos en lo que ocurre en las células, que son las unidades básicas que forman nuestro cuerpo, el panorama que emerge es de una complejidad enorme. Se han identificado decenas de moléculas involucradas en el proceso de envejecimiento, sin que esté claro de entrada qué relación hay entre ellas.
¿Actúan de manera independiente, como guerrilleros que atentan contra nuestro bienestar sin estar coordinados? ¿O estamos programados para envejecer de manera controlada, ser retirados a tiempo y dejar paso a las generaciones siguientes? La diferencia es importante, porque, si son guerrilleros autónomos, de poco nos servirá combatir contra uno solo, ya que los demás seguirán atacando. Pero si están organizados y hay alguna molécula alfa al mando, podremos concentrarnos en eliminarla, o en negociar con ella, para frenar el envejecimiento.
No todo se deteriora. O por lo menos no todo se deteriora igual. La inteligencia cristalizada, por ejemplo, que se basa en conocimientos y habilidades que hemos adquirido a lo largo de la vida, mejora con la experiencia y por lo tanto con la edad. La capacidad de reconocer emociones en la cara de otras personas también se perfecciona con los años.
Empecemos por los telómeros, de los que ya hemos hablado en el capítulo 1 cuando hemos dicho que hay un test que los utiliza para calcular la edad biológica. Si se puede hacer una estimación de la edad de nuestras células solo a partir de los telómeros, es porque son importantes. Tan importantes, de hecho, que los científicos que descubrieron cómo funcionan recibieron el Premio Nobel de Medicina en 2009.
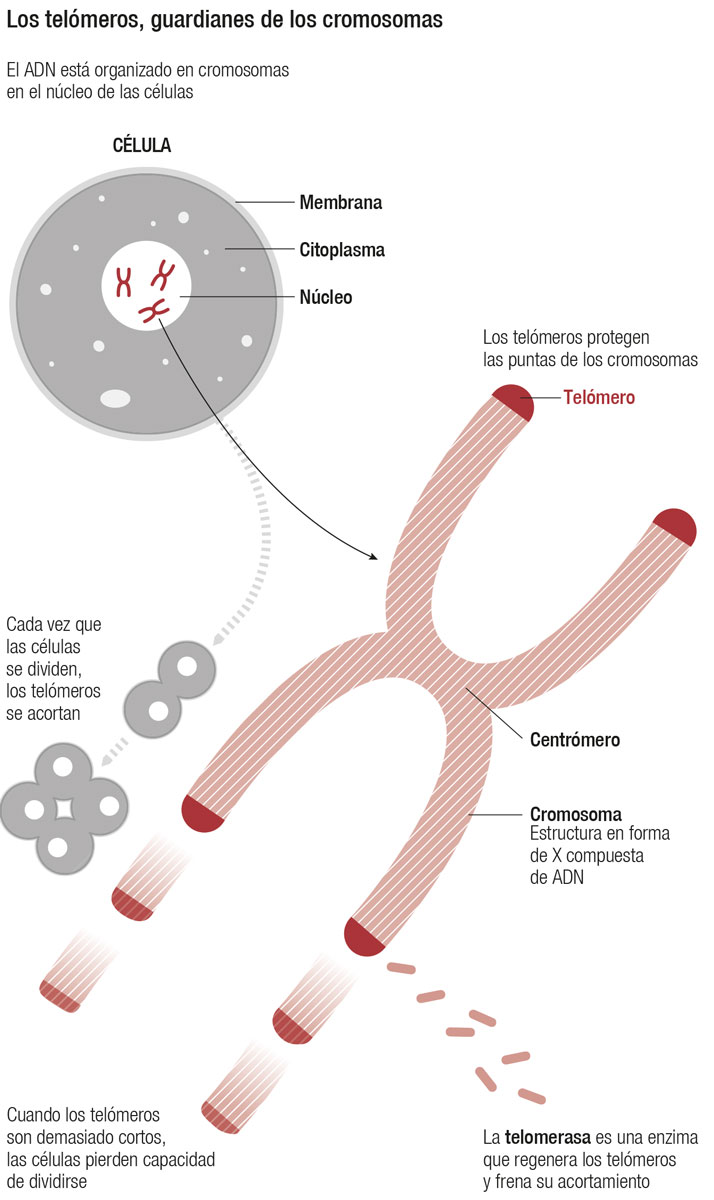
Para explicar qué son, los telómeros se comparan a menudo a los pequeños cilindros de plástico que protegen la punta de los cordones del calzado. Lo que protegen los telómeros son las puntas de los cromosomas, es decir, de los paquetes de ADN que hay en el núcleo de nuestras células. Los cromosomas tienen una forma que recuerda a una X, con cuatro brazos. En el extremo de cada brazo de los cromosomas están los telómeros protectores. Del mismo modo que las puntas de los cordones de los zapatos se desgastan con el uso, los telómeros se desgastan a medida que las células se dividen. Más exactamente, se acortan.
Cuanto más hemos vivido, más veces se han dividido nuestras células y por lo tanto más cortos tenemos los telómeros. Hasta que llega un punto en que son tan cortos que ya no pueden seguir protegiendo los cromosomas. Igual que el cordón del zapato se deshilacha cuando el cilindro de plástico se degrada, los cromosomas dejan de funcionar bien cuando se quedan sin telómeros. Lo cual tiene consecuencias graves para las células, porque los cromosomas son imprescindibles para que estas se dividan. De modo que, cuando una célula se queda con telómeros demasiado cortos, deja de dividirse. Se dice que entra en estado de senescencia.
El cuerpo humano tiene un antídoto para evitar que los telómeros se acorten de manera acelerada. Se trata de una enzima llamada telomerasa, que se dedica a reparar los telómeros. Naturalmente, no trabaja con la misma dedicación en todas las células del cuerpo. En las neuronas, por ejemplo, que son un tipo de células que no se dividen y por lo tanto que no sufren por sus telómeros, está inactiva. Por el contrario, en las células de la pared del intestino grueso, que se dividen sin cesar hasta el punto de que cada cuatro días las renovamos por completo, está siempre activa.
Como cualquiera que trabaja mucho, la telomerasa no es infalible. A veces actúa donde no debería, como en las células cancerosas, que pueden proliferar sin freno gracias a que producen telomerasa en abundancia. Y otras veces no actúa donde debería, como en aquellas células que entran en un estado de senescencia prematura. De modo que, incluso con telomerasa, se acaba produciendo un acortamiento progresivo de los telómeros, las células caen en estado de senescencia y los tejidos y órganos donde residen estas células entran en declive. Este declive es lo que nosotros percibimos como envejecimiento.
Si todo esto les parece muy técnico, tengan paciencia. Unas páginas más adelante le encontrarán el sentido. Pero para comprender bien qué sentido tiene, vamos a tener que adentrarnos un poco más en el fascinante mundo de las células. Porque los telómeros son protagonistas importantes en la historia del envejecimiento, pero no son los únicos.
Si nos fijamos en la parte de ADN que no son telómeros, se observa que acumula alteraciones genéticas a lo largo de la vida. Algunas de estas alteraciones se producen de manera espontánea, porque el ADN no es una molécula perfectamente estable y sufre pequeños cambios sin querer. Otras alteraciones se producen cuando las células se dividen y deben copiar su ADN entero, formado por tres mil millones de letras, para que las dos células hijas tengan un genoma completo cada una; con tantas letras, es comprensible que se cuele alguna falta de ortografía. Además están las muchas alteraciones producidas por agresiones externas, como los tóxicos del tabaco o los rayos ultravioleta del sol. En definitiva, el ADN va estropeándose poco a poco a medida que vivimos.
Igual que tenemos telomerasa para reparar los telómeros, nuestras células tienen una variada caja de herramientas para detectar y reparar las pequeñas averías que se producen a diario en el ADN. Unas herramientas tan importantes, por cierto, que sus descubridores recibieron el Premio Nobel de Química en 2015. Pero estas herramientas, igual que ocurre con la telomerasa, no son suficientes para reparar todos los daños y, con la acumulación de alteraciones genéticas, muchas de nuestras células dejan de funcionar correctamente porque sufren una especie de enfermedad celular llamada inestabilidad genómica.
Se podría pensar que, como nuestras células son microscópicas, han de ser necesariamente simples. Nada más alejado de la realidad: cada una de las células de nuestro cuerpo es de una complejidad asombrosa.
—
Se podría pensar que, como nuestras células son microscópicas, tienen que ser simples. Pero nada más alejado de la realidad. Hay células que son un ser vivo completo en sí mismas. Por ejemplo, las bacterias, las criaturas más numerosas de la Tierra. Pues bien: cada una de las células de nuestro cuerpo es más compleja que una bacteria. Tiene miles de proteínas que deben trabajar de manera perfectamente coordinada como músicos de una orquesta sinfónica. Cada una de estas proteínas debe ejecutar la nota precisa en el momento preciso.
De modo que, más allá del ADN, en nuestras células hay una multitud de moléculas que actúan en el drama del envejecimiento. Algunas son actrices principales, otras no son más que comparsas. Habrán oído hablar probablemente de los radicales libres. Han sido los malos de la película durante años. Hay una popular teoría del envejecimiento, llamada precisamente teoría de los radicales libres, que los acusa de ser los culpables principales del deterioro progresivo de la salud.
A primera vista, es una teoría plausible. Los radicales libres suelen ser moléculas que provocan reacciones químicas de oxidación en nuestras células. Se les acusa de cometer graves delitos microscópicos, como estrés oxidativo o, más ampliamente, daños oxidativos. Estos daños, que se acumulan con la edad, se han asociado a múltiples enfermedades, como, entre otras, cáncer, aterosclerosis y alzhéimer, lo cual ha llevado a defender los antioxidantes como beneficiosos para la salud y como antídotos del envejecimiento.
Pero esta teoría se propuso en los años cincuenta, cuando no se sabía todo lo que se sabe ahora sobre la vida íntima de nuestras células. Y, aunque ha evolucionado desde entonces, las investigaciones realizadas en estos últimos años ponen en duda que los radicales sean tan malos y los antioxidantes, tan buenos.
Cuando se ha aplicado una sobredosis de radicales libres a levaduras y a gusanos, que son dos de los organismos más estudiados en biología, se ha observado, contra todo pronóstico, que alargaban la vida en lugar de acortarla. En ratones, que son mamíferos y por lo tanto más parecidos a nosotros, se ha observado que ni los radicales libres aceleran el envejecimiento ni los antioxidantes alargan la vida. Y en personas fumadoras se ha descubierto con asombro que tienen más riesgo de cáncer de pulmón si toman suplementos de antioxidantes que si no los toman. Todo lo cual indica que los radicales libres y las reacciones de oxidación son necesarios para el correcto funcionamiento de nuestro cuerpo.
Otras moléculas, por el contrario, parecían buenas personas y han resultado tener un lado oscuro. Tomen el ejemplo de la hormona IGF-1 (nombre completo: factor de crecimiento insulínico tipo 1), que es necesaria para el crecimiento durante la infancia, pero acelera el envejecimiento en la etapa adulta, por lo menos en gusanos. De hecho, los gusanos a los que se inactiva la IGF-1 viven el doble que los normales, lo que, trasladado a la especie humana, equivaldría a vivir unos ciento cincuenta años con buena salud.
Otro ejemplo: la proteína IL-6 (o interleucina-6), que está segregada por células del sistema inmunitario y es necesaria para combatir infecciones y para otras funciones beneficiosas, al mismo tiempo parece favorecer el envejecimiento.
Un grupo de moléculas particularmente interesantes son las sirtuinas, que actúan como ángeles de la guarda de nuestras células. Tenemos siete tipos distintos de sirtuinas, todas ellas aparentemente beneficiosas. La sirtuina 1 (SIRT1), por ejemplo, ha prolongado la vida un 44 por ciento en un experimento realizado con ratones y se han empezado a desarrollar fármacos que imiten sus efectos, aunque es demasiado pronto para saber qué utilidad tendrán. La sirtuina 6 (SIRT6) ayuda a reparar el ADN —entre otras funciones— y ha alargado la vida un 16 por ciento, también en un experimento con ratones.
Hay otras muchas moléculas involucradas en el envejecimiento: PGC-1alfa, mTOR, CETP, AMPK, NF-KB... Si todas estas siglas no les dicen nada, no son los únicos. Hay que admitir que parecen una sopa de letras. El panorama que emerge de toda esta confusión recuerda a un rompecabezas. Tenemos muchas piezas sueltas sobre la mesa sin que esté claro a primera vista cómo encajan unas con otras. ¿Qué relación tienen, si es que tienen alguna, las lesiones del ADN con las diferentes sirtuinas? ¿Y los telómeros con la hormona IGF-1, o con la proteína IL-6? Cada una de estas piezas es un detalle de un cuadro más amplio. Para comprender cómo encajan y poder unirlas, nos falta tener una visión de conjunto. Es lo que vamos a hacer en el próximo capítulo: empezar a montar el rompecabezas.