
Körper und Geist des homo sapiens gehören zweifelsohne zu den ausgefeiltesten und am besten funktionierenden Errungenschaften der Evolution. Das Instrument, dem wir unsere intellektuellen Fähigkeiten verdanken, ist unser Gehirn und seine Intelligenzleistung. Wir haben zwar, verglichen mit dem Tierreich, nicht die besten Augen, nicht die stärksten Muskeln und nicht die größte Ausdauer, aber unser Intellekt ermöglicht es uns, jedes dieser Defizite durch Denken und Entwerfen, den Gebrauch von Werkzeugen und die Herstellung von Maschinen oder anderen Hilfsmitteln auszugleichen. Andererseits zeigt unser Körper – genau wie unser Denken – allerlei Schwächen. Sowohl Körper als auch Gehirn produzieren regelmäßig „Ausschussware“: organische Krankheiten wie Krebs oder fehlerhafte Denk- und Urteilsleistungen.
Wie ich in Kapitel 3 zeigen werden, laufen in den Zellen des menschlichen Körpers in jeder Sekunde unvorstellbar viele Mechanismen ab, die natürlich auch fehleranfällig sind. Theoretisch würde diese Erkenntnis schon genügen, um Erkrankungen wie Krebs zu erklären. Der Mensch ist allerdings deutlich mehr als das: ein denkendes und fühlendes Wesen, das sich auf unterschiedlichen Ebenen an seine Umwelt anpassen muss. Hierzu bedarf es spezialisierter Systeme – etwa der Denkleistungen und der Psyche, die unser Handeln steuern, sowie des Immunsystems, das uns vor Angriffen (sei es von außen oder innen) schützt.
Psyche und Immunsystem haben große Bedeutung für die Gesundheit des Menschen. Auch die Psyche kann erkranken – etwa bei Depressionen oder Schizophrenie – oder bei der Entstehung von psychosomatischen Krankheiten (z. B. Magengeschwüren) mitverantwortlich sein. Das Immunsystem bildet durch ein ausgeklügeltes Netzwerk von zellulären und proteinogenen4 Faktoren eine effektive Abwehrbarriere gegen Krankheitserreger von außen (Bakterien, Viren) und spielt auch eine wichtige Rolle bei der Kontrolle und dem Abbau der täglich entstehenden fehlerhaften Proteine und Zellen (also auch von Krebszellen) in unserem Körper. Nun kann aber auch das Immunsystem in Form von Autoimmunerkrankungen, bei denen es sich paradoxerweise gegen körpereigene, funktionierende Strukturen wendet, erkranken.
Schwächen des Immunsystems spielen wahrscheinlich eine nicht zu unterschätzende Rolle bei der Entstehung von Krebs. Man hat festgestellt, dass bestimmte Krebserkrankungen bei Menschen mit Immunschwäche5 deutlich häufiger als in der Normalbevölkerung auftreten. Viele Patienten bringen die Entstehung ihrer Krebserkrankung auch mit einer starken emotionalen Belastung in Zusammenhang – wahrscheinlich zu Recht: Seit Mitte der 1970er Jahre ist eine gegenseitige Beeinflussung von Immunsystem, Nervensystem und Psyche definitiv nachgewiesen. Basierend auf diesen Erkenntnissen haben sich Wissenschaftszweige wie die Psychoimmunologie und die Immunonkologie entwickelt.6
Wenn wir über die Funktionsweise des Lebens als Grundlage des Verständnisses von Krankheit sprechen, müssen wir außer den genetischen, proteinogenen und zellulären Faktoren auch das Individuum als Ganzes im Auge behalten. Nur so lässt sich eine so komplexe Erkrankung wie Krebs ergründen und das Wesen von Krebs verstehen. Insbesondere in den Bereichen der Interaktionen und Überschneidungen der unterschiedlichen Felder wie Genetik, Zellbiologie, Immunologie und Psychologie gibt es noch viel zu erforschen. Erst dann können wir von einem Gesamtbild der Funktionen des Lebens sprechen und unsere Suche nach einer adäquaten Therapie wissensbasiert durchführen.
Die Probleme der effektiven Behandlung einer Krebserkrankung liegen aber nicht ausschließlich in der Erkrankung an sich, sondern zu einem erheblichen Teil in unserer Verhaltensweise, also darin, wie wir mit einer bedrohlichen Situation im Allgemeinen umgehen; darüber hinaus machen gewisse Faktoren unseres Gesundheitssystems, beispielsweise wirtschaftliche Konkurrenz oder zeitliche bzw. finanzielle Zwänge, es den Betroffenen nicht leicht, ihr erstrebtes Ziel – die Heilung der Krebserkrankung – zu erlangen. Umso mehr ist es von größter Wichtigkeit, dass jedem, der mit Krebs direkt oder indirekt in Berührung kommt, bewusst wird, warum er gerade so reagiert, wie er reagiert, warum verschiedene Ärzte unterschiedliche Therapien empfehlen und wie das alles mit dem hiesigen Gesundheitssystem zusammenhängt.
Um das Wesen vom Krebs zu verstehen, reicht es deshalb nicht – auch wenn das ein sehr wichtiger Faktor ist – sich mit den biologischen Grundlagen der Erkrankung und den diagnostischen und therapeutischen Verfahren auszukennen. Man muss auch die Hintergründe verstehen, also durchblicken, wer die Akteure des Systems sind – Ärzte, Wissenschaftler, Unternehmer etc.
In erster Linie sollte man aber sich selbst und seine menschlich-psychischen Limitationen kennen. Jede unserer Handlungen ist positiv motiviert – auch wenn das nicht immer auf den ersten Blick zu erkennen ist. Ein Triathlet, der sich durch wochen- und monatelanges Training quält (was für eine zweite Person nicht nachvollziehbar sein mag), erträgt Schmerzen und Entbehrungen, um irgendwann den Pokal nach Hause zu tragen, den er jetzt schon – während er trainiert und ächzt – vor seinem inneren Auge sieht. Ein anderer Sportler erlebt allein schon durch sein Training so viel positive Rückkopplung, dass er es regelmäßig in seinen Alltag integriert. Warum er das tut, erschließt sich auch nicht jedermanns Verständnis, obwohl es inzwischen zum common sense gehört, dass Sport in gewissem Umfang gesund und vernünftig ist. Abgesehen davon, ob nun aus Vernunftgründen oder um des Pokals wegen geschwitzt wird: Unsere Handlungen sind in der Tat nicht immer so vernünftig, wie es auf den ersten Blick erscheinen mag. Oft sind sie durch die Evolution oder unsere Gewohnheiten geprägt und geradezu unvernünftig – siehe nächstes Kapitel.
Zu Beginn jeder Auseinandersetzung mit Krebs steht meistens der vom Arzt ausgesprochene Krebsverdacht. In dieser Sekunde beginnt für den Betroffenen eine schlimme Zeit der Ungewissheit, die sich gelegentlich lange hinziehen kann – so lange, bis der Verdacht ausgeräumt oder bestätigt wird. Diese Ungewissheit ist für die meisten Menschen schwer zu ertragen – genauso aber ist auch die Gewissheit, an Krebs erkrankt zu sein, mit großer Angst verbunden, handelt es sich doch um eine Krankheit mit nicht selten tödlichem Verlauf. Wie soll man sich nun verhalten? Bewusst entscheiden kann man das kaum, denn es sind zuallererst häufig reflexartige und emotionale Verhaltensweisen, mit denen wir auf die Diagnose Krebs reagieren.
Die Evolution hat uns nämlich so geprägt, dass wir auf Gefahr und Angst mit einer Fluchtreaktion antworten. Diese wird von unserer Vernunft nicht hinterfragt und kann in gewissen Situationen auch ganz sinnvoll sein. Wenn wir vom Säbelzahntiger gejagt werden, bleibt nicht viel Zeit zum Nachdenken: „Rennen!“ lautet die Devise. Langes Überlegen, in welche Richtung in dieser Situation am besten zu rennen sei, würde das Risiko vergrößern; die automatische, instinktive Fluchtreaktion setzt sofort ein und befiehlt unseren Beinen, ihr Bestes zu geben. Dabei kann es natürlich vorkommen, dass man in eine Sackgasse läuft und trotz neuem Geschwindigkeitsrekord als Frühstück des Säbelzahntigers endet; hätte man jedoch wertvolle Zeit und Energie mit dem Austüfteln der optimalen Fluchtroute vergeudet, wäre die Wahrscheinlichkeit des Gefressen-Werdens ungleich größer – daher der evolutionäre Vorteil beim unüberlegten Davonrennen.
Auch wenn eine schwerwiegende Diagnose kein Säbelzahntiger ist, passiert es doch sehr häufig, dass insbesondere bei Krebserkrankungen so etwas wie „mentale Kurzschlüsse“ auftreten. Rationale, der Situation angemessene Reaktionen sind geradezu die Ausnahme und meistens das Ergebnis einer bewussten geistigen Anstrengung.7
Ein Beispiel für einen Fluchtversuch: Unlängst hatte ich einen Patienten, den ich wegen eines Prostatakarzinoms in meiner Praxis ausführlich beriet. Nach langem Gespräch kamen wir gemeinsam zu dem Ergebnis, dass eine Bestrahlungstherapie der Prostata in seinem Fall die beste Therapiemaßnahme sei. Ich hatte ausreichende Daten zur Verfügung und insgesamt ein gutes Gefühl, dass wir seine Tumorerkrankung in den Griff bekommen würden.
Nach sieben Monaten kam ein Anruf vom Hausarzt des Patienten: Dieser stecke in Schwierigkeiten und benötige sofortige Hilfe, traue sich jedoch nicht, zu mir zu kommen. Bei mir läuteten alle Alarmglocken. Ich bat den Hausarzt, den Patienten davon zu überzeugen, dass er dringend bei mir vorstellig werden müsse. Eine Woche später saß Letzterer mir tatsächlich gegenüber. Was war geschehen? Nach unserer gemeinsamen Entscheidung war er guten Mutes gewesen und wollte die empfohlene Strahlungstherapie der Prostata auf jeden Fall durchführen lassen. Nachdem er aber mit einem Bekannten über sein Vorhaben gesprochen hatte und dieser ihm empfahl, sich nach der tollen, „sanften“ Behandlungsmethode zu erkundigen, von der eine entfernte Bekannte dieses Bekannten gehört hatte und die ihn von den „schlimmen Nebenwirkungen“ verschonen würde, kam er vom ursprünglich gewählten Weg ab. Er landete bei einem Behandlungsinstitut, wo sein Prostatakarzinom zwar ohne Nebenwirkungen, dafür aber mit einer nicht komplett evaluierten – also wissenschaftlich überprüften – Methode behandelt wurde.
Ich erfuhr nun, dass er zwar keinerlei Komplikationen oder Nebenwirkungen durch die Therapie zu beklagen hätte, seine private Krankenversicherung eine vollständige Übernahme der Behandlungskosten jedoch ablehnte. Der Patient saß plötzlich auf 7.000 Euro Kosten. Viel schlimmer war jedoch, dass der Verlauf des PSA-Wertes (ein Tumormarker für das Prostatakarzinom, den ich in Kapitel 4 beschreiben werde) ein Weiterbestehen und Wachsen des Prostatakarzinoms anzeigte – die Behandlung des Tumors hatte sich als unzureichend erwiesen. Der Patient saß vor mir wie ein Häufchen Elend, von Angst und vernichtenden Selbstvorwürfen geplagt – dabei handelte es sich keinesfalls um einen einfältigen Menschen, ganz im Gegenteil: Er ist ein hochgebildeter Akademiker. Er hatte sich in seinem persönlichen Netzwerk schlau gemacht – war das falsch gewesen? Sich zu informieren ist meiner festen Überzeugung nach prinzipiell richtig – man muss nur sehr genau auf die Qualität der Information achten.
Wie sieht es mit dem Internet als Informationsquelle aus? Im Kontext Krebs ist es nicht immer der beste Berater. Es bietet zwar jede Menge korrekter Informationen zu Krebserkrankungen und -therapien; Betroffene tendieren jedoch ohne den Beistand eines erfahrenen Arztes oder profunden Kenners der Materie eher dazu, nach einer Behandlungsmethode zu fahnden, die sanft, unkompliziert und nebenwirkungsfrei zu sein verspricht. Ich sage immer: Dr. Google ist ein mäßiger Arzt. Was aber nicht heißen soll, dass es von der Hand zu weisen ist, wenn Betroffene das Internet oder andere Informationsquellen (Bücher, Fachzeitschriften, wissenschaftliche TV-Sendungen etc.) durchforsten, um sich im Krankheitsfall auf das Gespräch mit dem Arzt8 vorzubereiten. Das kann die Kommunikation zwischen Patient und Arzt beträchtlich verbessern – und diese ist, wie wir gleich sehen werden, von allergrößter Wichtigkeit.
Kommunikation ist ein weit gefasster Begriff, der in viele Aspekte unseres täglichen Lebens hineinwirkt. Nicht umsonst gibt es ganze Wissenschaftszweige, die sich mit dem Thema Kommunikation befassen (Kommunikationstechnik, Kommunikationswissenschaften, Kommunikationsverhalten etc.). Ich werde mich im Folgenden aber nur auf den Austausch von Information zwischen den von Krebs Betroffenen und ihren Beratern und Behandlern beziehen und diese Auswahl noch einmal einschränken, indem ich hier vor allem auf den mündlichen Aspekt fokussiere.
Die Kommunikation zwischen Menschen ist schon an und für sich nicht immer frei von Missverständnissen; in einer Extremsituationen jedoch, wie sie bei schwerwiegenden Erkrankungen gegeben ist, potenzieren sich die Probleme. Vom Moment der Diagnosestellung an leidet ein Betroffener häufig unter starken Angstgefühlen, die sich zu regelrechten Panikattacken steigern können, und empfindet sich nicht selten als Fremdkörper in einer Welt von Gesunden. Trotz dieses deprimierenden Gefühls wünscht er sich in seiner schwierigen Lage wahrscheinlich besonders viel Kontakt zu Angehörigen und Freunden – ein Widerspruch, der durchaus Kommunikationsprobleme herbeiführen kann. Dafür, wie ein Betroffener in dieser Situation anzusprechen und zu behandeln ist, gibt es leider kein Patentrezept – weder für den Arzt noch für Angehörige, Freunde oder Bekannte. Jeder Betroffene braucht aber Unterstützung und Zuspruch. In vielen Fällen ist deshalb eine frühzeitige psychoonkologische Begleitung sinnvoll.
Neben der Kommunikation im Familien-, Freundes- und Bekanntenkreis spielt die Kommunikation und gute Verständigung zwischen Arzt und Betroffenem eine essentielle Rolle. Arzt und Patient gehen im Falle einer derart schweren Erkrankung wie Krebs eine längerfristige und sehr enge Beziehung ein. Noch ein Umstand ist hier zu erwähnen: Die Spezialisierung in der Medizin ist der Grund dafür, dass eine Krebserkrankung oft nicht nur von einem Arzt diagnostiziert und behandelt wird. Das bedeutet, dass der Betroffene auf den Rat und die Hilfe von gleich mehreren Medizinern, die er in den meisten Fällen auch noch zum ersten Mal in seinem Leben sieht, angewiesen ist. Mit allen sollte er wirklich gut kommunizieren können.
Das Anamnesegespräch9 stellt die Grundlage der Diagnosefindung dar und darf in seiner Bedeutung keinesfalls unterschätzt werden. Hier möchte ich einen weiteren wichtigen Aspekt der Kommunikation hervorheben: Kein Arzt erwartet von seinen Patienten, dass sie zu allem Ja und Amen sagen. Besser wäre ihre Mitarbeit. Sie bedeutet mehr als die gewissenhafte Einnahme der vom Arzt verordneten Medikamente, was in der Medizin als Compliance (Therapietreue) bezeichnet wird. Sicherlich ist die Compliance des Patienten wichtig – ohne Medikamente keine Wirkung. Da es aber bei einer Krebserkrankung keinesfalls die Regel ist, dass gleich bei der ersten Medikamentengabe die richtige und im individuellen Fall beste Therapie gefunden wird, ist der Arzt auf Signale und Rückmeldungen über das aktuelle Patientenbefinden, über Verbesserungen oder Verschlechterungen durch die verabreichte Therapie und über eventuelle neue Befunde angewiesen. Es ist deshalb von großem Vorteil für den Betroffenen, wenn er die beobachteten und erlebten Veränderungen so objektiv wie möglich beschreiben kann.
Für eine gelungene und zielführende Kommunikation ist allerdings nicht der Betroffenene allein verantwortlich. Auch der Arzt muss sich in seinem Kommunikationsverhalten auf den jeweiligen Patienten einstellen. Ärzte beherrschen normalerweise durch die im Laufe der Jahre gesammelten Erfahrungen die Gesprächsführung mit ihren Patienten gut – dennoch ließe sich diese ganz sicherlich durch eine spezielle Aus- und Weiterbildung verbessern.
Allerdings gibt es einen weiteren Aspekt, der eine effektive Kommunikation behindert – und zwar: Ein Arzt muss jeden Tag viele Patienten behandeln und sich innerhalb weniger Minuten auf den nächsten Befund, eine neue Situation und eine andere Kommunikationsstrategie einstellen – der eine Gesprächspartner ist temperamentvoll und kann sich gut ausdrücken, der andere ist verschlossen oder unsicher etc. Schafft der Arzt das, ist schon viel gewonnen – vor allem, wenn der Betroffene sich als informierter, ambitionierter und ehrlicher Gesprächspartner erweist. Eine schlechte Compliance hinsichtlich der Medikamenteneinnahme zu haben, diese jedoch nicht zu kommunizieren – sei es aus Angst, falsch verstandenem Respekt oder sonstigen Gründen –, ist die schlechteste Konstellation. Ein Betroffener hat quasi immer einen Grund für eine schlechte Compliance, sollte darüber aber unbedingt mit seinem Arzt sprechen. Es gilt dann, gemeinsam einen Weg zu finden, der für beide akzeptabel ist. Das heißt: Der Betroffene muss von seinem Arzt ganz genau darüber informiert werden, welche Vor- oder Nachteile die Abkehr von der ursprünglich verordneten Medikation oder Therapie für ihn hat. Dann sollte der Arzt eine alternative Therapie vorschlagen und alle damit verbundenen Vor- und Nachteile aufzeigen. Erst mit diesem Wissen kann der Betroffene eine rationale Entscheidung darüber treffen, ob er die zur Non-Compliance (Therapieuntreue) führenden Gründe überwinden oder eine veränderte Therapie aufnehmen möchte.
In der Regel sind die Hausärzte10 die primären Ansprechpartner für Menschen, die über eine Veränderung an ihrem Körper oder bezüglich ihres Wohlbefindens (also über einen Befund oder ein Symptom) besorgt sind. Auch bei der Erstdiagnose von Krebserkrankungen spielen Hausärzte eine große Rolle. Mit ihrer Ausbildung sind sie durchaus dazu befähigt, die oft unspezifischen ersten Symptome einer Krebserkrankung als solche zu erkennen. Für die weitere Abklärung auffälliger Befunde ziehen die Hausärzte meistens entsprechende Spezialisten – wie z. B. Fachärzte für Urologie, Hals-Nasen-Ohren-Heilkunde, Gynäkologie etc. – hinzu. Manchmal kennen sich Hausärzte aber auch mit einigen speziellen Tumorerkrankungen sehr gut aus; dann können sie die diagnostische Abklärung übernehmen. Wichtig ist in dieser Situation weniger die fachärztliche Ausrichtung des Arztes als die Tatsache, dass er die Befähigung und Erfahrung für die Erstellung der Diagnose besitzt. Ob es sich dabei um den speziell orientierten Allgemeinmediziner oder einen spezialisierten Facharzt handelt, ist unerheblich.
Auch ein Facharzt für Urologie muss sich nicht unbedingt besonders gut mit dem onkologischen Teil seines Faches auskennen. Schon ein kleines Fach wie die Urologie – um nur ein Beispiel zu nennen – ist heutzutage so umfangreich, dass es unter den Urologen bereits zahlreiche Subspezialisten gibt. Vielleicht interessiert sich der örtliche Urologe viel mehr für Kinderurologie oder Neurourologie und behandelt zwar auch uroonkologische Patienten, aber eben nicht mit demselben Enthusiasmus und demselben fundierten Wissen wie eventuell der Urologe aus dem Nachbarort, dessen Spezialgebiet die Uroonkologie ist. Bei der heutigen Komplexität der Medizin und dem rasanten Wissenszuwachs in all ihren Bereichen kann man sogar noch weiter gehen und sagen, dass ein Urologe, dessen Hauptinteresse dem Prostatakarzinom gilt, noch lange kein Spezialist für das Blasenkarzinom sein muss, obwohl beide Erkrankungen demselben Fachgebiet angehören.
Man darf hier generalisieren: Onkologen kennen sich mit manchen Krebserkrankungen besser aus als mit anderen. Und zwar nicht, weil der Arzt oder seine Ausbildung zu wünschen übrig lassen, sondern wegen der Menge an medizinischer Information. Wichtig ist lediglich, dass der für die jeweilige Tumorerkrankung geeignete Arzt gefunden wird. Hier einige Richtlinien:
Der behandelnde Arzt sollte sich auf jeden Fall mit dem den Patienten betreffenden Bereich sehr gut auskennen und entsprechend viel Untersuchungs- und Behandlungserfahrung aufweisen, um der aufwendigen Diagnostik und Therapie gewachsen zu sein. Dabei ist „viel Erfahrung“ natürlich eine relative Bezeichnung. Ein Anhaltspunkt wäre etwa, dass ein Chirurg eine schwierige Operation erst dann wirklich beherrscht, wenn er sie seit mehreren Jahren regelmäßig durchführt und dabei mehr als 150 solcher Operationen pro Jahr leistet. Diese Information kann und sollte der Betroffene einfach bei seinem Arzt erfragen.
In der Frühphase der Abklärung eines Symptoms gibt es praktisch keinen fataleren Fehler, als die Diagnostik nicht konsequent durchzuführen – das heißt z. B., Symptome zu bagatellisieren. Jedes Symptom muss bis zum Beweis des Gegenteils für den Arzt das Symptom einer Maximalerkrankung sein – also des Schlimmstmöglichen. Kann er den Verdacht dann durch die vorgenommene Diagnostik ausschließen, ist es gut. Die ärztliche Kunst besteht hier darin, den Befund einerseits nicht zu bagatellisieren, andererseits aber auch keine übertriebene Abklärung mit aufwendigen und beeinträchtigenden Untersuchungen zu veranlassen. Die Aufgabe des Arztes ist es, die richtige Balance zu finden, und das ist nicht immer einfach.
Was bedeutet denn nun Spezialist oder Experte und wie findet ein Betroffener „seinen“ Arzt? Im Internet gibt es zahlreiche Ärztebewertungsportale, die Patientenbewertungen der Ärzte veröffentlichen. Der Focus gibt jährlich eine Liste der besten Spezialisten für bestimmte Erkrankungen (darunter natürlich auch Krebserkrankungen) heraus, aus der inzwischen ein Buch geworden ist: Deutschlands umfangreichste Ärzteliste (2012). Außerdem verfügt jeder in einer Praxis tätige – also niedergelassene – Arzt über ein Netzwerk von Kollegen aus anderen Fachrichtungen, zu denen er bei speziellen Fragestellungen überweist. Aber wie gut helfen die Ärztebewertungsportale dem Betroffenen wirklich – und garantieren sie, dass er in die richtigen Hände kommt? Ich denke, dass sie einen guten Überblick über die Angebote in der Region oder auch überregional vermitteln. Es zahlt sich jedenfalls aus, Zeit in die Suche nach dem richtigen Arzt zu investieren und nichts zu übereilen. Der beste Arzt für eine Prostataoperation z. B. zeichnet sich nicht dadurch aus, dass er gut aussieht, nett ist, viel publiziert hat, besonders viele Methoden zur Prostataoperation anbietet oder eine schicke Praxis hat. Das einzige Kriterium, das einen Arzt als guten Prostataoperateur auszeichnet, ist die Qualität, in der er diese Operation durchführt.
Aber auch wenn er ein Top-Chirurg auf seinem Gebiet ist, muss das nicht heißen, dass er für den Betroffenen der beste Arzt ist. Abgesehen von der Qualifikation des beratenden und diagnostizierenden Arztes, die außer Frage stehen muss, gibt es zwischenmenschliche Faktoren, die bei der Auswahl des richtigen Arztes wichtig sind. Gerade in der Beziehung zwischen Arzt und Patient sollte die Chemie stimmen. Sind Arzt und Patient völlig unterschiedlicher Natur oder repräsentiert der Arzt einen Charaktertyp, mit dem der Patient überhaupt nicht auskommt, so ist eine Zusammenarbeit verständlicherweise schwierig. Ein Betroffener ist gut beraten, in einer derartigen Situation rasch zu handeln und die Kooperation (was eine Krebsbehandlung immer sein sollte!) zu beenden. Allerdings muss der Arzt genug Gelegenheit erhalten haben, seine Qualitäten unter Beweis zu stellen; der Patient sollte derartige Entscheidungen nicht von der Tagessituation abhängig machen. Jeder hat gute und schlechte Tage – auch ein Arzt.
Zur Veranschaulichung: Stellt man sich als behandelnde Ärzte zwei Extreme vor, so gibt es an einem Ende der Skala den etwas introvertierten, unspektakulären Bürokraten und hundertprozentigen Verfechter der sogenannten leitlinientreuen Medizin11, der gelegentlich schon ungehalten wird, wenn ein Patient die von ihm empfohlenen Behandlungsschemata nicht genauestens befolgt. Am anderen Ende steht der mit Empathie ausgestattete Arzt, der sich optimal in den Patienten hineinversetzen kann und viel Verständnis demonstriert. In den meisten Fälle wird ein Patient den empathischen Arzt vorziehen; ich weiß aber aus meiner ärztlichen Erfahrung, dass dieser die Patienten nicht unbedingt besser vorbereitet, versorgt und behandelt als sein strengerer Kollege. Es wäre ein Fehler, die Empathie eines Arztes mit seiner Kompetenz zu verwechseln – wobei für den anderen Kollegen natürlich dasselbe gilt: Stures Festhalten an den Leitlinien heißt nicht unbedingt Kompetenz.
Fazit: Der in meinen Augen perfekte Arzt arbeitet grundsätzlich auf Basis einer vorliegenden Leitlinie (dazu gleich mehr) und ergänzt diese mit aktuellen, wissenschaftlich überprüften Studienergebnissen. Er bezieht den Patienten und dessen Ziele in seine Entscheidungen mit ein; die Kommunikation mit dem Patienten und dessen Angehörigen ist ehrlich und verständlich. Seine Charakterzüge entsprechen den Vorstellungen des Patienten oder erscheinen ihm zumindest akzeptabel. Im Idealfall verfügt der gewählte Arzt sowohl über ein hohes diagnostisches und therapeutisches Wissen als auch über ein gutes Maß an Empathie.
Krebspatienten zu versorgen ist keine Routinearbeit. Jeder Betroffene ist einzigartig, und auch seine Erkrankung ist ganz individuell. Es ist zwar erfreulich, dass sich das onkologische Wissen rasant vermehrt; dies bringt aber auch gewisse Probleme mit sich: Trotz ständigen Engagements in seiner Praxis muss ein Arzt – wissenschaftlich betrachtet – auf dem Laufenden bleiben. Vielleicht spricht ja der Patient, den er gerade behandelt, auf einen neuen Therapieansatz besonders gut an. Wie behält er aber den Überblick über die fast täglich veröffentlichten onkologischen Neuigkeiten?
Eine große Hilfe beim Bestreben, der Flut neuer Informationen Herr zu werden, stellen Behandlungsrichtlinien in Form von Leitlinien dar. Diese Leitlinien sind wahre Wälzer: Die aktuelle Leitlinie zum Bronchialkarzinom12 beinhaltet beispielsweise 164 Seiten, zum Mammakarzinom13 362 Seiten und zum Prostatakarzinom14 mehr als 600 Seiten. Die Leitlinien bilden die neuesten Errungenschaften zu den diagnostischen und therapeutischen Vorgehensweisen der einzelnen Tumoren in gebündelter Form ab.
Leitlinien erscheinen in unterschiedlicher Qualität. Diese Qualität reicht von der reinen „Handlungsempfehlung von Experten“ (S1-Leitlinie) über die strukturierte Konsensfindung (S2k-Leitlinie) und die systematische Evidenzbasierung (S2e-Leitlinie) bis hin zur höchsten Qualität, der strukturierten Konsensfindung mit systematischer Evidenzbasierung (S3-Leitlinie). Für die Erstellung insbesondere der S3-Leitlinien setzt sich ein Gremium aus zahlreichen Experten verschiedener, in die Fragestellung der untersuchten Tumorerkrankung involvierter Fachärzte zusammen und diskutiert in unendlichen Sitzungen über die Ausgestaltung der Leitlinie. Dabei wird die aktuelle Literatur zum Thema gesichtet; die wissenschaftlichen Artikel werden nach einem genau vorgegebenen Muster in Evidenzklassen eingeteilt. Basierend auf den Evidenzgraden werden im festgelegten Konsensusverfahren Empfehlungsgrade (A = soll; B = sollte; C = kann) für diagnostische und therapeutische Maßnahmen vergeben und in die Leitlinie aufgenommen.15
Bis zum Erscheinen einer Leitlinie in Schriftform vergehen zumeist Jahre. Das Veröffentlichungsdatum der Leitlinie verzögert sich überdies nicht selten wegen schwieriger Konsensfindung. Sind alle Hindernisse überwunden, wird die Leitlinie üblicherweise von der Fachgesellschaft, in deren Zuständigkeitsbereich der behandelte Tumor fällt, herausgegeben. Leitlinien sind mit einem Verfallsdatum versehen; ab diesem Zeitpunkt muss eine überarbeitete oder aktualisierte Version vorliegen. In der Regel sind Leitlinien etwa drei bis fünf Jahre lang gültig.
In Deutschland werden die Leitlinien der medizinischen Fachgesellschaften zentral durch die Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) publiziert, verwaltet und betreut. Trotz des aufwendigen Produktionsprozesses sind Leitlinien nicht dafür geeignet, die Ärzte in rechtlicher Hinsicht abzusichern – selbst wenn diese sich in ihren diagnostischen und therapeutischen Vorgehensweisen strikt daran halten. Leider werden sie daher auch nicht überall in gleichem Maße geschätzt. Während der Dauer ihrer Gültigkeit finden außerdem Weiterentwicklungen statt, die naturgemäß nicht berücksichtigt werden können. Und last but not least stellt die Veröffentlichung mehrerer (von unterschiedlichen Fachgesellschaften herausgegebenen) Leitlinien zum selben Thema ein Problem dar, wenn unterschiedliche Empfehlungen gegeben werden. Die leitlinienbasierte Behandlung der Betroffenen steht aus den genannten Gründen unter Medizinern nicht besonders hoch im Kurs, auch wenn das manchem Patienten zum Nachteil gereicht. Ein Beispiel: Zu den wichtigen Supportivmaßnahmen16 bei der chemotherapeutischen Behandlung von Patienten mit bösartigen Tumoren gehört die medikamentöse Unterdrückung und Behandlung von Übelkeit und Erbrechen. Chemotherapeutische Substanzen haben nämlich unterschiedlich stark ausgeprägte emetogene17 Eigenschaften. Das therapeutische Vorgehen, um diese Nebenwirkung zu verhindern bzw. zu behandeln, ist in mehreren Leitlinien beschrieben. In einer wissenschaftlichen Studie wurde bei über 500 Patienten, die eine hoch emetogene Chemotherapie erhalten hatten, untersucht, ob sie leitlinienkonform hinsichtlich der Verhinderung und der Behandlung von Übelkeit und Erbrechen behandelt wurden. Die Studie zeigte, dass dieses in einigen Therapiezentren bei nur 32,5% der Patienten der Fall war, obwohl diese Supportivmaßnahme für eine bessere Lebensqualität gesorgt hätte. Ob die nicht leitlinienkonform behandelten Patienten mehr durch Übelkeit und Erbrechen geplagt wurden, ließ die Studie offen – es ist allerdings anzunehmen. Tatsache ist, dass ein leitlinienbasiertes Vorgehen eine gute Behandlungsbasis darstellt, auch wenn das „blinde“ Abarbeiten der Leitlinien nicht den Gepflogenheiten der guten ärztlichen Arbeit entspricht, die ja mithin auch als Kunst bezeichnet wird.
Ein Arzt muss einen Patienten immer individuell behandeln, also seine aktuelle Situation und seine Wünsche berücksichtigen. Das ist sogar gesetzlich verankert: Die Unversehrtheit des menschlichen Körpers ist unser höchstes Gut und wird im Art. 2 Abs. 2 unseres Grundgesetzes geregelt.18 Die invasiven ärztlichen Maßnahmen – z. B. Biopsien, Operationen, Bestrahlungs- und Chemotherapien – sind per definitionem „Körperverletzungen“, jedoch solche mit ausdrücklicher Genehmigung des Betroffenen. Nur so können sie gerechtfertigt werden (rechtlich gesehen ist diese Art der Körperverletzung nur zu rechtfertigen und nicht zu legitimieren – aber hier befinden wir uns auf dem Feld juristischer Spitzfindigkeiten).
Ein Betroffener, der in medizinischen Fragestellungen zumeist Laie ist, sollte eine Einwilligung zu einer therapeutischen Maßnahme nur in voller Kenntnis ihres Nutzens und ihrer Nebenwirkungen erteilen. Dass der Patient vor der Durchführung einer Maßnahme umfassende Informationen hinsichtlich aller Risiken und Begleiterscheinungen erhält, liegt in der Verantwortung des behandelnden Arztes. Wichtig dabei ist, dass nicht der Arzt den Patienten von der Notwendigkeit einer Maßnahme „überzeugt“ – im Sinne von Überreden –, sondern dass der Patient die Notwendigkeit der Maßnahme selbst erkennt und unter Abwägung aller Vor- und Nachteile eine freie Entscheidung trifft. Kommt der Betroffene unter diesen Voraussetzungen zu dem Schluss, dass er eine medizinische (vielleicht sogar überaus sinnvolle) Maßnahme nicht durchführen lassen will, so hat der Arzt diese Entscheidung zu respektieren und – was ebenfalls wichtig ist – Alternativen vorzuschlagen.
Angesichts einer solchen Entscheidungsfreiheit der Betroffenen können Leitlinien immer nur eine Orientierungshilfe für die optimale medizinische Vorgehensweise darstellen und sind in keinem Fall verbindlich. Ob eine medizinische Therapie für einen Betroffenen sinnvoll und optimal war, zeigt sich leider häufig nur retrospektiv. Eine Therapie, die bei dem einen Patienten zu optimalen Ergebnissen führt, kann bei einem anderen Patienten mit demselben Krankheitsbild komplett versagen. Die Ärzte können ihre Entscheidungen immer nur anhand von Zahlen und Statistiken treffen, und diese sind – wie ich im folgenden Kapitel zeigen werde – oft tückisch und fehlerhaft.
Zahlen üben häufig eine geradezu magische Faszination auf uns aus. Aufgrund der Exaktheit der mathematischen Wissenschaften haben wir zu Zahlen vollstes Vertrauen. Zahlen werden selten hinterfragt, und Menschen, die gut mit Zahlen umgehen können, gelten im Allgemeinen als intelligent.
Nun ist aber die Medizin keine der Mathematik oder Physik vergleichbare exakte Wissenschaft, sondern eine Erfahrungswissenschaft: Das besagt, dass die beobachteten Gesetzmäßigkeiten mit dem derzeit vorhandenen Wissen erklärt und begründet werden. Sobald es einen Zugewinn oder eine Veränderung von Wissen gibt, entstehen neue Erklärungsansätze. Wegen der fehlenden Exaktheit der Medizinwissenschaft ist es notwendig, die beobachteten Ergebnisse mit statistischen Daten zu „unterfüttern“ und als „medizinische Wahrheit“ oder „Wahrheit in gewissen Grenzen“ zu handhaben. Genau hier liegt die Ursache dafür, dass ein Betroffener im medizinischen Alltag praktisch nie eine diagnostische oder eine therapeutische Aussage zu hören bekommt, die zu 100 Prozent gilt.
Eine statistische Aussage ist dadurch kennzeichnet, dass sie, auf große Gruppen angewendet, Gültigkeit besitzt, für den Einzelfall aber nur sehr beschränkt zutrifft. Je größer die betrachtete Gruppe, desto größer auch die Wahrscheinlichkeit, dass das statistische Ergebnis auch im Einzelfall zutrifft.
Und so sitzt der Mediziner in der Zwickmühle. Im klinischen Alltag behandelt und berät der Arzt immer einen einzelnen Patienten, und für diesen einzelnen Patienten muss die auf statistischen Daten fußende Aussage des Arztes nicht zwingend gelten. Fragt der Betroffene also in der Sprechstunde: „Wie sind meine Überlebenschancen?“ oder „Wie lange habe ich noch zu leben?“, kann der Arzt nur auf der Grundlage von Statistiken antworten. Er könnte z. B. feststellen: „Mit Ihren Tumorparametern leben nach einem Jahr noch 80% der Patienten.“ Oder: „75% der Patienten mit Ihrem Tumor leben damit länger als fünf Jahre.“ Diese Aussagen sind anhand großer Patientengruppen belegt und stellen die „medizinische Wahrheit“ zum Zeitpunkt ihrer Erhebung dar. Aber was bedeutet diese Wahrheit für den Einzelnen? Nur so viel: Wenn der Patient nach einem Jahr noch lebt, gehört er zu den 80%, die überlebt haben; wenn nicht, zu den 20%, die verstorben sind. Oder: Wenn der Patient nach fünf Jahren noch lebt, gehört er zu den 75%, ansonsten zu den 25%. Jeder muss für sich selbst entscheiden, was diese Aussagen für ihn bedeuten. Auch Angelina Jolie hat aufgrund statistischer Daten, die ihr eine bestimmte Wahrscheinlichkeit für die Entwicklung eines Mammakarzinoms – also auch für das damit einhergehende Risiko, daran zu versterben – prognostiziert haben, ihre Entscheidung getroffen, sich vorsorglich die Brustdrüsen entfernen zu lassen. Für sie war die statistische Aussage ausreichend, damit sie ihre Wahl treffen konnte. Für Betroffene ist es also sehr wichtig, zu wissen, wie statistische Aussagen zu verstehen sind, bevor sie einen so radikalen Weg gehen. Der Arzt kann ihnen dabei eventuell helfen – nicht jeder Mediziner ist allerdings auch ein guter Statistiker.
Statistisch basierte Aussagen haben jedoch noch ein weiteres Manko: Sie fußen immer auf Studien, die in der Vergangenheit durchgeführt wurden. Je länger die Untersuchungen zurückliegen, desto weniger wahrscheinlich ist es, dass ihre Ergebnisse mit den aktuellen medizinischen Gegebenheiten übereinstimmen.
Beim Prostatakarzinom, aber auch beim Nierenzellkarzinom zeichnet sich zurzeit genau dieses Dilemma ab. Zahlreiche neue Wirkstoffe sind innerhalb der letzten Monate und Jahre für die Behandlung des fortgeschrittenen Prostatakarzinoms sowie des metastasierten Nierenzellkarzinoms zugelassen worden. In welcher Kombination und Abfolge diese Medikamente am sinnvollsten und effektivsten einzusetzen sind, ist aber noch völlig unklar. Jeder dieser neuen Wirkstoffe führt – für sich allein genommen – zu einer gewissen Überlebensverlängerung; wie sich die Einzelwirkstoffe bei gemeinsamer oder aufeinanderfolgender Einnahme in ihrer Wirkung addieren oder potenzieren oder ob sie sich gegenseitig wieder aufheben, kann man im Moment noch nicht sagen. Insofern sind wir zum aktuellen Zeitpunkt nicht in der Lage, für diese Tumorentitäten19 eine angemessene, statistisch basierte Aussage zum Gesamttherapieerfolg zu machen. Es drängt sich jedoch die Annahme auf, dass man mit den aktuell zur Verfügung stehenden Therapiemaßnahmen wahrscheinlich um ein Vielfaches erfolgreicher sein wird als mit den älteren Therapieoptionen – auch wenn hierzu noch keinerlei Statistikaussagen vorliegen.
Ein extremes Beispiel in diesem Sinne ist die Einführung des Chemotherapeutikums Cisplatin für die Behandlung des metastasierten Hodenkarzinoms im Jahre 1979. Der Hodenkrebs ist ein histologisch uneinheitlicher Tumor20, der vorwiegend junge Männer im Alter zwischen zwanzig und vierzig Jahren befällt. In den 1960er und 1970er Jahren galt, dass ein Hodentumor lediglich durch eine komplette operative Entfernung im lokalisierten Stadium (wenn also noch keine Metastasen vorliegen) geheilt werden kann. Bei metastasierten Erkrankungen wurde zusätzlich zur Operation eine Chemotherapie mit Actinomycin D (einem schon länger eingesetzten Chemotherapeutikum) durchgeführt. Diese nebenwirkungsträchtige Therapie führte allerdings nur zu Heilungsraten im einstelligen Prozentbereich. In den Jahren 1974 bis 1976 leiteten Lawrence Eichhorn und John Donohue an der University of Indiana eine Studie mit der neuen Kombinationschemotherapie21 bei 47 Patienten mit metastasierten Hodenkarzinomen. Als die Studiendaten 1977 und weitere Nachbeobachtungen 1979 veröffentlicht wurden, zeigte sich, dass über 90% der Patienten mit dieser Kombinationschemotherapie geheilt werden konnten; die Anwendung dieser Wirkstoffe war also noch ohne jeden statistischen Beleg bezüglich ihrer Wirkung erfolgreich durchgeführt worden. Sollten die Probanden damals Fragen zur Prognose gestellt haben, hätten ihre Ärzte schlicht und einfach passen müssen.
Auch die Statistik selbst hat allerdings ihre Probleme. Wer sein Wissen hierzu vertiefen möchte, dem empfehle ich die Lektüre des Buches Lügen mit Zahlen von Gerd Bosbach und Jens Jürgen Korff. Hier werden vielfältige Gefahren der Statistik aufgezeigt: beispielsweise, dass sich durch die Auswahl ungeeigneter Parameter sehr schnell Fehler in statistische Betrachtungen einschleichen oder dass Daten jeweils so dargestellt werden können, dass genau das dabei herauskommt, was man sich als Forscher insgeheim gewünscht hat.
Ein Beispiel für Krebsstatistiken: Überlebenszahlen werden vereinbarungsgemäß in 1-, 5- oder 10-Jahres-Überlebenswahrscheinlichkeit angegeben. Wird bei einer Therapie eine 2-, 3- oder 7-Jahres-Überlebenswahrscheinlichkeit genannt, kann dies zwei Gründe haben – erstens: Die Therapie ist so neu, dass die vereinbarungsgemäß anzugebenden Zahlen noch nicht vorliegen. Zweitens: Die Zahlen sollen besser aussehen, als sie sind. Der Leser darf sich also merken: Auf statistische Daten ist immer nur bedingt Verlass, und Zahlen bedeuten nicht automatisch Sicherheit. Und manchmal kann die Statistik einem sogar ein Schnippchen schlagen.
Verschiedene statistische Phänomene können sowohl Patienten als auch Mediziner in die Irre führen. Besondere Erwähnung sollen an dieser Stelle das Will-Rogers-Phänomen sowie das Simpson-Paradoxon finden.
Das Will-Rogers-Phänomen wurde nach dem amerikanischen Humoristen und Philosophen Will Rogers benannt, dem der Ausspruch „When the Okies left Oklahoma and moved to California, they raised the average intelligence level in both states“ zugeschrieben wird. Es geht um einen tückischen Effekt bei der Erhebung des Durchschnittswertes zweier Gruppen. Durch den Wechsel eines Elementes von einer Gruppe in die andere kann der Durchschnitt in beiden Gruppen steigen oder fallen. Hört sich schon mal komisch an – intuitiv geht man ja davon aus, dass der Durchschnittswert in der einer Gruppe sinkt, in der anderen jedoch steigt (oder umgekehrt).
Zur Verdeutlichung ein Zahlenbeispiel: Ein Kindergarten hat zwei Gruppen mit Kindern unterschiedlichen Alters:
Gruppe 1:
3 / 3 / 4 / 5 / 6 Jahre – Durchschnittsalter = 4,2 Jahre
Gruppe 2:
5 / 6 / 6 / 6 / 6 / 6 Jahre – Durchschnittsalter = 5,8 Jahre
Wechselt das 5-jährige Kind von Gruppe 2 in Gruppe 1, ergibt sich folgendes Bild:
Gruppe 1:
3 / 3 / 4 / 5 / 6 / 5 – Durchschnittsalter = 4,33 Jahre
Gruppe 2:
6 / 6 / 6 / 6 / 6 – Durchschnittsalter = 6,0 Jahre
Somit hat sich das Durchschnittsalter überraschend in beiden Gruppen erhöht! Ist das nun Hexerei oder gibt es eine plausible Erklärung dafür?
Das Will-Rogers-Phänomen fand Eingang in die wissenschaftliche Debatte, als A. Feinstein und seine Kollegen den Einfluss neuer diagnostischer Methoden auf die Prognose für Krebspatienten untersuchten. Dabei wurden die Überlebenszeiten zweier Gruppen von Patienten mit Bronchialkarzinom – die eine war nach 1977 behandelt worden, die andere zwischen 1953 und 1964 – analysiert. Die Gruppe, die nach 1977 behandelt wurde, zeigte eine deutlich höhere 6-Monats-Überlebensrate. Es war naheliegend, dass dieser Vorteil einer Verbesserung der Therapiemöglichkeiten zuzuschreiben war. Allerdings gab es nach 1977 auch deutlich bessere diagnostische Methoden als in dem Jahrzehnt zwischen 1953 und 1964. Dadurch konnten die Tumoren in der 1977er-Gruppe viel genauer klassifiziert werden – mit der Konsequenz, dass ein Teil der Erkrankungen, die man früher einer prognostisch günstigeren Gruppe zugerechnet hatte, nun weniger günstig klassifiziert wurde. Die Prognose der Tumoren, die jetzt genauer klassifiziert werden konnten, war zwar schlechter als die Prognose jener Tumoren, die früher in der prognostisch günstigeren Gruppe landeten, aber doch besser als die Prognose der Tumoren, die sich von vornherein in der prognostisch ungünstigen Gruppe befanden. Dadurch nahm die 6-Monats-Überlebensrate in beiden Gruppen zu – ohne dass diese erfreuliche Tatsache auf eine verbesserte Therapie zurückzuführen war!
Werner Golder verfasste im Jahre 2009 eine lesenswerte Übersichtsarbeit über das Will-Rogers-Phänomen im Zusammenhang mit diagnostischen Methoden in der Medizin.22 Er wies nach, dass die Gefahr eines „virtuellen Vorteils“ insbesondere immer dann besteht, wenn historische Vergleichsgruppen zur Beurteilung einer aktuellen medizinischen Fragestellung herangezogen werden – also wenn eine Gruppe von Patienten, die heute mit einem neuen Medikament behandelt wird, mit einer unbehandelten Kontrollgruppe von vor fünf oder zehn Jahren verglichen wird. Das Will-Rogers-Phänomen tritt aber nicht immer ein. Zwei ungünstige Voraussetzungen müssen gegeben sein, wenn sich bei der Verschiebung von einem oder mehreren Elementen aus einer Gruppe in eine andere der Durchschnittswert beider Gruppen erhöht und so das Ergebnis verfälscht wird:
1.Das Element, das verschoben wird, hat einen geringeren Wert als der Durchschnittswert der Elemente der Gruppe, aus der es entfernt wird.
2.Das Element, das verschoben wird, hat einen höheren Wert als der Durchschnittswert der Elemente der Gruppe, in die es verschoben wird.
Bei umgekehrten Voraussetzungen verringert sich der Durchschnittswert in beiden Gruppen. Und noch ein statistisches Paradoxon spielt in der Medizin eine Rolle: das Simpson-Paradoxon, das von Edward Hugh Simpson im Jahre 1951 entdeckt wurde. Das wohl bekannteste Beispiel hierfür ist die Diskriminierungsklage gegen die University of California, Berkeley. Im Herbst 1973 kam es zu einer offiziellen Untersuchung hinsichtlich der geschlechtsspezifischen Aufnahmepolitik der Universität. Die Aufnahmezahlen für das Herbstsemester, differenziert nach Frauen und Männern, sahen folgendermaßen aus:

Das bedeutete eine Aufnahmequote von 44% für Männer, aber von nur 35% für Frauen – waren die Frauen also diskriminiert worden? Eine Untersuchung der Qualifikationen der beiden Gruppen erbrachte keinen diesbezüglichen Unterschied. Es schien offensichtlich, dass die Hochschule den männlichen Bewerbern den Vorzug gab. Oder doch nicht?
Schaut man sich die Aufnahme- und Ablehnungszahlen hinsichtlich der unterschiedlichen Fachbereiche an, so ergibt sich ein völlig anderes – und überraschendes – Bild. Aus Gründen der Einfachheit stellen wir uns vor, die Universität Berkeley hätte vier Fachbereiche (1, 2, 3, 4), auf die sich die Aufnahmen und Ablehnungen von Frauen und Männern wie folgt verteilen:
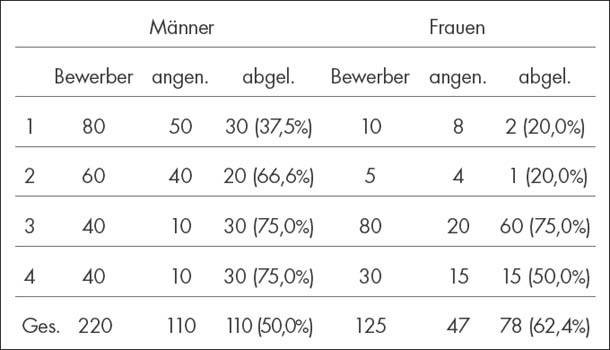
(modifiziert nach Bosbach und Korff, Lügen mit Zahlen)
Nimmt man die Zahlen genauer in Augenschein, wird der Fehler schnell offensichtlich. Obwohl die Frauen bei der Gesamtablehnungsquote mit 62,4% (versus 50,0% bei den Männern) deutlich häufiger abgelehnt wurden, werden sie doch bei der Betrachtung der einzelnen Fachbereiche in drei von vier Fachbereichen seltener und in einem genauso oft abgelehnt wie ihre männlichen Kollegen. Die Bewertung der Gruppen (Männer versus Frauen) fällt also unterschiedlich aus, je nachdem, ob man die Ergebnisse der Gruppen in Summe oder ob man sie einzeln betrachtet (alle Fachbereiche vs. einzelne Fachbereiche). Hier entstand die „Verzerrung“, weil sich die weiblichen Bewerber übermäßig häufig in genau jenen Fachbereichen beworben hatten, bei denen eine hohe Ablehnungsquote die Regel ist (die Fachbereiche 3 und 4).
Welche Relevanz hat dieses Paradoxon nun für die Medizinstatistik? Wenn eine Untersuchung je nach Beurteilungsweise stark voneinander abweichende Ergebnisse aufweist, so kann dies gegebenenfalls auf Einflussfaktoren beruhen, die nicht beachtet oder erkannt wurden (wie in unserem Berkeley-Beispiel die Neigung der Frauen, sich insbesondere für jene Fachbereichen zu bewerben, die eine hohe Ablehnungsquote aufweisen). Hält man sich angesichts dieser Fakten die zahlreichen Faktoren, die den Erfolg oder Misserfolg einer Krebstherapie herbeiführen können, vor Augen, wird einem schnell die Tragweite dieses statistischen Phänomens bewusst.
Medizinische Statistiken werden außerdem auch durch den sogenannten „systematischen Fehler“ – den Bias23 – verfälscht. Der Bias beschreibt die Tendenz, bei einer Untersuchung Ergebnisse zu erhalten, die regelmäßig in einer bestimmten Richtung von den korrekten Ergebnissen abweichen. Warum kommt es aber dazu?
In medizinischen Studien wird zumeist eine Therapieform im Vergleich zu einer anderen untersucht. Das Ergebnis der Studie soll zeigen, welche der untersuchten Therapieformen die bessere ist. Bei der Durchführung einer derartigen Studie muss darauf geachtet werden, dass der einzige wirkliche Unterschied der behandelten Gruppen die Therapieform ist. Ein Bias liegt vor, wenn nicht die Therapieform allein, sondern zusätzliche Faktoren das Ergebnis bedingen – etwa das Alter der Probanden, ihre Vorerkrankungen etc. Wenn beispielsweise ein Studienleiter von einer neuen Therapie überzeugt ist, kann es passieren, dass er unbewusst die Zusammensetzung der Gruppen zugunsten der neuen Therapie verändert. Die Anwendung von Instrumenten, die der Bias-Verhinderung dienen (z. B. die „Verblindung“, also die Unkenntlichmachung der verschiedenen Therapiegruppen für die Studienkoordinatoren), ist ein unabdingbares Qualitätsmerkmal für medizinische Studien. Studien ohne angemessene „Biasprotektion“ könnten einen Therapienutzen aufzeigen, wo keiner vorhanden ist – also schlicht und einfach zu Falschaussagen führen.
Der Leser dürfte nun die Relativität der statistisch belegten medizinischen Aussagen verstanden haben. Statistische Aussagen werden umso ungenauer, je kleiner die untersuchten Gruppen sind. Vorsicht ist insbesondere bei der Anpreisung neuester Therapieformen angezeigt, deren „beeindruckende“ Ergebnisse auf der Beobachtung einiger weniger Fälle oder gar auf Einzelfallbetrachtungen beruhen.
Bei statistischen Betrachtungen ist es deshalb immer sinnvoll, die Umkehrprobe zu machen oder sich – statt mit Wahrscheinlichkeiten und Prozenten – mit den absoluten Zahlen zu befassen. Betrachtet man 5- und 10-Jahres-Überlebenswahrscheinlichkeiten, so muss einem immer bewusst sein, dass diese Ergebnisse von der Anzahl der diagnostizierten Tumoren abhängig sind. Diagnostiziert man mehr Tumoren bei einer steigenden 5- bzw. 10-Jahres-Überlebensrate, dann kann es sein, dass die Art bzw. das Verhalten der zusätzlich diagnostizierten Tumoren zu diesem Anstieg führt, ohne dass dabei therapeutische Erfolge im Spiel waren.24
Warum dann überhaupt noch statistische Daten verwendet werden, fragt sich der Leser jetzt wahrscheinlich. Weil die Medizin trotz der angeführten Fehleranfälligkeit auf statistische Daten angewiesen ist, wenn es um Therapieeffekte und Prognosen geht. Ärzte wie Betroffene sollten sich also immer die Relativität statistischer Daten vor Augen halten und auf Fehlerquellen achten. Es ist sicherlich nicht notwendig, jedes Studienergebnis in Frage zu stellen oder sich immer die Rohdaten einer Studie vorlegen zu lassen, um versteckte Fehler ausfindig zu machen. Nein, man muss nicht Detektiv spielen – aber besonders beim Einsatz neuer Therapieoptionen kann es auch nicht schaden, die Validität der Ergebnisdaten im Gespräch mit dem empfehlenden Arzt zu hinterfragen. Und auch das reicht zur Beurteilung einer Therapieempfehlung nicht immer aus: Ein Betroffener sollte darüber hinaus wissen, auf Basis welcher Vorgaben der Arzt die Behandlung verschreibt, und dazu ist eine detaillierte Betrachtung unseres Gesundheitssystems mit seinen therapeutischen und finanziellen Rahmenbedingungen unbedingt notwendig. Im nächsten Kapitel darf der Leser einen Blick in die Abläufe, Zwänge und Funktionsweisen unseres Gesundheitssystems werfen.
Das deutsche Gesundheitssystem hat Krebserkrankungen durchaus im Fokus seiner Bemühungen. Zu hoch ist die Zahl der jährlich Erkrankten und Verstorbenen, um dieser Krankheit nicht besondere Aufmerksamkeit zu widmen. Zu groß auch ihre volkswirtschaftlichen Auswirkungen für unser Land.
Unser Gesundheitssystem ist solidarisch: Die Last des Einzelnen wird auf die Schultern von vielen verteilt; Erkrankte werden indirekt von den Gesunden unterstützt. Ermöglicht wird das durch die Existenz von Krankenversicherungen: Zum einen gibt es die gesetzliche Krankenversicherung (GKV), in der über 90% der Gesellschaft versichert sind, zum anderen die private Krankenversicherung (PKV) mit etwa 8 bis 9% der Bevölkerung.
Die gesetzliche Krankenversicherung (GKV) ist als Körperschaft des öffentlichen Rechts in Form von Krankenkassen, die sich selbst verwalten und der staatlichen Aufsicht unterliegen, organisiert. Maßgeblich für die gesetzliche Krankenversicherung sind die Paragraphen und Artikel des Sozialgesetzbuches V (SGB V). Hiernach gliedern sich ihre Aufgaben in vier Bereiche: Der erste Bereich umfasst die Leistungen zur Verhütung von Krankheiten bzw. Verhütung von Verschlimmerung von Krankheiten sowie zur Empfängnisverhütung, Sterilisation und Schwangerschaftsabbruch; zum zweiten Bereich gehören die Leistungen zur Früherkennung von Krankheiten; im dritten Bereich finden sich die Leistungen zur Behandlung einer Krankheit; im vierten schließlich die Leistungen der medizinischen Rehabilitation, soweit diese dazu dient, eine Behinderung oder Pflegebedürftigkeit abzuwenden, zu beseitigen oder zu mindern. Im SGB V (§ 12) ist weiterhin vorgesehen, dass die Leistungen der gesetzlichen Krankenversicherung „notwendig, ausreichend, zweckmäßig und wirtschaftlich“ sein müssen. Der diagnostische und therapeutische Nutzen sowie die medizinische Notwendigkeit und die Wirtschaftlichkeit einer Leistung müssen nachgewiesen sein, bevor diese in den Leistungskatalog der GKV aufgenommen werden darf, sprich von dieser bezahlt wird.
Im Jahre 2004 wurde der Gemeinsame Bundesausschuss (G-BA) gebildet – das oberste Gremium für die Beurteilung von medizinischen Leistungen hinsichtlich ihrer Finanzierung durch die gesetzliche Krankenversicherung. Der G-BA setzt sich aus insgesamt 13 stimmberechtigten Mitgliedern zusammen: fünf Vertretern der Kostenträger (Krankenkassen), fünf Vertretern der Leistungserbringer (z. B. Ärzte- oder Krankenhausorganisationen) und drei unparteiischen Vertretern, wobei einer dieser unparteiischen Vertreter gleichzeitig der Vorsitzende des Gremiums ist. Zusätzlich können bis zu fünf Vertreter von Patientenorganisationen an den Sitzungen des Gemeinsamen Bundesausschusses teilnehmen und Anträge einbringen; sie haben jedoch keine Stimme (was ich bedauerlich finde).
Die Bestimmungen des SGB V besagen ganz eindeutig, dass ein Patient nicht unbegrenzt Anspruch auf Leistungen durch die gesetzliche Krankenversicherung hat. Leistungsanspruch besteht ausdrücklich nur hinsichtlich der bereits erwähnten „notwendigen, ausreichenden, zweckmäßigen und wirtschaftlichen“ Maßnahmen. Wegen der hohen volkswirtschaftlichen Konsequenzen von Krebserkrankungen sind für diese Patientengruppe vereinzelte Ausnahmen von der üblichen Vorgehensweise der GKV vorgesehen. Verpflichtende Zuzahlungen, die sonst von den Erkrankten übernommen werden müssten, fallen ab einer gewissen Höhe weg; außerdem gelten Generikaquoten25 hier nicht. Die behandelnden Ärzte erhalten außerdem zusätzliche Honorare für die ambulante Versorgung krebskranker Patienten. All das entlastet die Erkrankten und ihre Angehörigen und erleichtert die Versorgung der Betroffenen. Trotzdem bedeutet eine Krebserkrankung in den meisten Fällen eine nicht unerhebliche finanzielle Belastung des Erkrankten und seiner Familie.26
Unser Gesundheitssystem hat den Krebsbetroffenen also offensichtlich eine Sonderstellung zugewiesen, und das finde ich aufgrund der Schwere der Erkrankung auch angemessen. Vieles erscheint mir allerdings verbesserungswürdig. Die Tatsache etwa, dass die Politik die flächendeckende, schnell erreichbare medizinische Versorgung für ein hochgelobtes Qualitätsmerkmal des deutschen Gesundheitssystems hält, kann ich bei hausärztlichen und notfallmedizinischen Leistungen noch nachvollziehen; wenn es sich allerdings um fach- oder spezialärztliche Versorgung (wie das im onkologischen Bereich der Fall ist) handelt, erachte ich eine hohe Qualität der Versorgung für wesentlich wichtiger. „Flächendeckend“ ist im Falle komplexer Erkrankungen wie Krebs ein wenig aussagekräftiges Kriterium für die Qualität des Gesundheitssystems. Weitaus nützlicher und wahrscheinlich kostengünstiger als die Errichtung zahlreicher „durchschnittlicher“ Zentren wäre die Einrichtung eines geeigneten Transportsystems zum Erreichen gegebenenfalls weiter entfernt gelegener, von der Qualität her aber optimaler Einrichtungen.
Die zeitnahe Versorgung ist ebenfalls eines der angestrebten Qualitätsmerkmale des deutschen Gesundheitssystems. Abgesehen davon, dass dieses Ziel insbesondere für die gesetzlich versicherten Patienten ab und zu in weite Ferne rückt, besteht im onkologischen Bereich – außer bei Notfällen – definitiv kein Grund zur übertriebenen Eile hinsichtlich der Einleitung diagnostischer und therapeutischer Maßnahmen. Wichtiger als eine hektische Abklärung und Behandlung ist ein wirklich durchdachtes Vorgehen, das kein Detail der Erkrankung übersieht. Im Hinblick auf die psychische Belastung eines Betroffenen, der auf eine Klärung der auffälligen Befunde wartet, ist die zeitnahe Diagnosestellung und Therapieeinleitung natürlich sinnvoll. Aufgrund der Überlastung insbesondere der Fachärzte müssen jedoch Betroffene oft wochen- und monatelang auf ihre definitive Diagnose, die häufig Untersuchungen bei mehreren Ärzten notwendig macht, warten; hier sind erhebliche Verbesserungen tatsächlich notwendig. Aber auch in anderen Punkten, für die unser Gesundheitssystem zuständig ist, sehe ich Handlungsbedarf – etwa bei den Zulassungsbestimmungen für neue Wirkstoffe.
Die Zulassungsrichtlinien der Arzneimittelaufsichtsbehörden (EMA = European Medicines Agency; das deutsche Pendant ist das BfArM = Bundesinstitut für Arzneimittel und Medizinprodukte), die verbindlich sind, kennzeichnen sich durch äußerste Strenge. Jeder medizinische Wirkstoff (ob im onkologischen oder anderen medizinischen Bereichen) muss mit einem aufwendigen Zulassungsverfahren, in dem man seine Sicherheit und Wirksamkeit untersucht, evaluiert werden. Diese Zulassungsverfahren kosten die durchführenden Pharmakonzerne pro zugelassenem Wirkstoff etwa eine Milliarde Euro. Am Ende des Zulassungsprozesses steht, nach entsprechend positivem Votum der zulassenden Kommission, eine begrenzte Zulassung des Wirkstoffes für eine genau spezifizierte onkologische Erkrankung in einer ganz bestimmten Situation, nämlich jener, die für die Zulassungsstudie ausgesucht wurde. Der Einsatz dieses Wirkstoffes bei anderen Indikationen (also bei anderen Tumorentitäten) und in anderen Situationen ist zwar erlaubt, aber nicht zugelassen und wird von den gesetzlichen Krankenkassen daher nicht ohne Weiteres bezahlt.
Zusätzlich zu dem aufwendigen und kostspieligem Zulassungsverfahren müssen die Pharmakonzerne seit 2011 einen in Deutschland neu zugelassenen Wirkstoff durch das Bundesgesundheitsministerium (BGM), den Gemeinsamen Bundesausschuss (G-BA) und das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hinsichtlich seines Zusatznutzens im Vergleich zu den schon existierenden Medikamenten bewerten lassen. Dieses Verfahren muss innerhalb von 12 Monaten nach Zulassung des Wirkstoffes abgeschlossen sein (es handelt sich um die sogenannte frühe Nutzenbewertung). Wobei das IQWiG seine Stellungnahme, auf der dann die Empfehlung des G-BA und die Entscheidung des Bundesgesundheitsministeriums basieren, bereits innerhalb von drei Monaten abgeben muss. Abhängig von den Ergebnissen der Nutzenbewertung wird die Preisgestaltung für den Wirkstoff vorgenommen. Ist ein Zusatznutzen erkennbar, tritt der Pharmakonzern mit dem Bund der Krankenkassen in Preisverhandlungen, deren Grundlage der ursprüngliche Einführungspreis des Wirkstoffes in Deutschland darstellt. Sollte kein Zusatznutzen erkennbar sein, darf der Pharmakonzern den betroffenen Wirkstoff in Deutschland nur zu einem bestimmten Festbetrag anbieten, der sich an den günstigen generischen Vergleichspräparaten orientiert.
Prinzipiell dienen solche Einschränkungen bei der Herstellung und Distribution neuer Wirkstoffe durchaus dem Patientenwohl und sind positiv zu bewerten. Bei einem solchen Vorgehen ist allerdings die Möglichkeit politischer Einflussnahme in die Entscheidungen gegeben. Außerdem erscheint mir eine dreimonatige Phase für die Klärung des Zusatznutzens als viel zu kurz27, so dass sich meine Euphorie in Grenzen hält. War ein Pharmakonzern also hinsichtlich der Zulassung eines Wirkstoffes aufgrund der Zulassungsstudiendaten erfolgreich, muss er sich auf eine weitere Unsicherheit hinsichtlich des zu erzielenden Abgabepreises und damit des returns on invest einstellen. Hier sollten die entscheidenden Gremien vorsichtig sein, damit lebensrettende Innovationen in der Krebsmedizin nicht frühzeitig abgewürgt werden bzw. die Konzerne aufgrund der bestehenden Unsicherheiten vor den hohen Investitionen zurückschrecken.
Durch die sehr spezifische Zulassungsstrategie der EMA kam es in den letzten Jahren immer wieder zu grotesken Situationen: so beispielsweise bei der medikamentösen Therapie des Prostatakarzinoms, die ich hier kurz beschreiben möchte.
Die primäre medikamentöse Therapie eines fortgeschrittenen oder metastasierten Prostatakarzinoms ist die Hormontherapie, bei der die Produktion und Wirkung des männlichen Geschlechtshormons Testosteron gehemmt wird. Erst nach Ausschöpfung dieser im Allgemeinen gut verträglichen und leicht zu applizierenden Behandlung ist eine Chemotherapie angezeigt, die zumeist deutlich aufwendiger ist und von stärkeren Nebenwirkungen begleitet wird. Im Jahre 2011 wurde ein neues, gut wirksames, einfach zu verabreichendes und nebenwirkungsarmes Medikament zur Erweiterung der bisherigen Hormontherapie des Prostatakarzinoms in Deutschland zugelassen. Die Zulassungsstudien für diesen Wirkstoff fanden an Patienten mit metastasierten Prostatakarzinomen nach Gabe einer Docetaxel-haltigen Chemoterapie28 statt. Deshalb bezog sich die Zulassung der EMA für diesen neuen Wirkstoff ausschließlich auf die Behandlung eines hormonresistenten metastasierten Prostatakarzinoms nach einer Docetaxel-haltigen Chemotherapie. Praktisch musste ein Patient also von der einfachen Hormonbehandlung zunächst durch die aufwendigere Chemotherapie mit Docetaxel geleitet werden, um anschließend von der viel verträglicheren, erweiterten Hormontherapie profitieren zu können. Dieses Vorgehen war lediglich den Zulassungsvoraussetzungen geschuldet und entbehrte – medizinisch betrachtet – jeglicher vernünftigen Basis, was natürlicherweise häufig zu Unverständnis und Verunsicherung bei den Patienten führte. Nach der Durchführung weiterer kostspieliger und zeitaufwendiger Studien hat der Wirkstoff Anfang 2013 (also gut zwei Jahre später!) in Deutschland endlich die erweiterte Zulassung für seine Anwendung vor der Docetaxel-haltigen Chemotherapie erhalten. Solche bürokratischen Umwege sind natürlich keinesfalls im Sinne des Patientenwohles.
Auch wenn Sicherheitsmaßnahmen wie die oben beschriebenen von den Zulassungsbehörden zum Zwecke der Patientensicherheit ersonnen wurden, haben die Betroffenen etwa bei fortgeschrittenen Tumorerkrankungen häufig nicht mehr viel zu verlieren, und eine Strategie, die möglichst viel Lebensqualität bietet, sollte bei der Wahl der Therapie ausschlaggebend sein. Im Jahr 2012 hätte die Hormonbehandlung mit dem neuen Wirkstoff vor der Chemotherapie bedeutet, dass man sich im Off-lable-use29 befindet, der eine aufwendige und zeitraubende Beantragung der Finanzierung durch die Krankenkassen und eine zusätzliche detaillierte Aufklärung der Patienten durch den behandelnden Arzt hinsichtlich des Off-lable-use erfordert. Wahrscheinlich haben zahlreiche Betroffene aufgrund dieser Bestimmungen erst nach langer Wartezeit – oder im Extremfall gar nicht – die Möglichkeit einer erweiterten Hormontherapie vor der Docetaxel-haltigen Chemotherapie bekommen. Die Situation bei Patienten mit einer privaten Krankenversicherung gestaltet sich etwas anders. Nach dem Papier erhalten Privatpatienten durch die Einzahlung deutlich höherer und individueller Beiträge quasi eine „Luxuskrankenversicherung“. Prinzipiell gilt bei den privaten Krankenversicherern die SGB-V-Vorgabe des „notwendigen, ausreichenden, zweckmäßigen und wirtschaftlichen“ Leistungsanspruches nicht. Privat versicherte Patienten haben freie Arzt- und Behandlungswahl und müssen nicht zuerst zum Hausarzt pilgern, bevor sie an den Facharzt überwiesen werden.
Angesichts der in den letzten Jahren – wahrscheinlich zumindest teilweise – durch gesetzliche Zwangsregelungen30 verursachten Finanzierungsprobleme der Privatversicherer wird der Leistungskatalog der privaten Krankenversicherungen jenem der gesetzlichen Krankenkassen jedoch immer ähnlicher. Der Versicherte, der seine höheren Beiträge (die in den letzten Jahren um durchschnittlich 5% pro Jahr gestiegen sind) im festen Glauben daran einzahlt, eine diesem Preis angemessene und damit umfangreiche Behandlung zu erhalten, ist zu Recht mit dem schrumpfenden Leistungsangebot nicht zufrieden. Zum aktuellen Zeitpunkt empfehle ich Privatpatienten daher, zumindest bei kostenintensiven diagnostischen oder therapeutischen Prozeduren eine schriftliche Kostenübernahmezusage des privaten Versicherers (und zwar vor Durchführung der Maßnahme) einzuholen. Auch im folgenden Kapitel geht es um Kosten, auf die man sich im Falle einer Krebserkrankung einstellen sollte.