CAPÍTULO 27
El triunfo de los átomos
La obra de Copérnico y Newton, la gran Revolución Científica, y los largos y complicados procesos que remataron en las teorías de Lavoisier y Darwin ayudaron a cercar vastos sectores de la informal y difícil naturaleza y del mundo, y a construir un edificio magnífico, presidido por la razón —no siempre presta— y corroborado por la empiria —no siempre dócil—. Pero cada conquista permitía, a la vez, problematizar nuevos territorios y plantear renovadas exigencias: una vez dominada la combustión y ordenada la química, libre de flogisto, apareció la vieja pregunta sobre la estructura de la materia; una vez comprendida la manera en que las especies cambiaban a lo largo de los eones, el darwinismo necesitaba desesperadamente entender los mecanismos de la herencia. Y continuamente aparecían nuevos interrogantes que ayudaban —o retrasaban, tanto da— el armado del rompecabezas.
Así, a lo largo del siglo XIX, la ciencia avanzó espectacularmente, pero, como siempre, a los tumbos, confundiendo lo verdadero con lo erróneo, ensayando explicaciones disparatadas hasta dar —por casualidad, por genialidad o por descarte— con la correcta (o con la que parecía correcta). Y tropezando una y otra vez con la misma piedra se construyó la cosmogonía actual que va desde las tortugas a las estrellas y de los átomos al universo entero.
El mundo es impiadoso con los que no tienen éxito y la ciencia no lo es menos. Cuando se reconstruye la manera en que creció y se expandió el conocimiento, se suele ignorar, por economía de la narración, los miles de esfuerzos vanos, las vidas perdidas detrás de una hipótesis equivocada, los espejismos, los errores, las tonterías y hasta los fraudes. Y sin embargo, nadie sabe a priori cuál es el error que ayudará a encontrar el camino correcto.
Uno piensa que si algunos científicos vieron más lejos es porque estaban subidos a hombros de gigantes. A veces es verdad, pero en la mayoría de los casos estuvieron subidos en los hombros de hombres y mujeres comunes y corrientes, igual que ellos, y que no tuvieron tanta suerte.
El siglo XIX, que muchos califican, un poco apresuradamente, como «el siglo de la ciencia», de alguna manera representa la culminación del programa newtoniano. Así como en biología se estableció una teoría central —la teoría de la evolución—, casi todos los fenómenos del mesomundo, es decir, el mundo a escala media —que es la nuestra— fueron más o menos dominados.
En esta pelea victoriosa, antes de que la crisis de fin de siglo pusiera todo en cuestión, la química, y luego la física, consiguieron descifrar el persistente misterio de la estructura de la materia, y el viejo asunto de los átomos, el desacuerdo esencial entre quienes creían y quienes negaban su existencia, se resolvió de manera definitiva.
Justamente porque era una cuestión casi tan antigua como la ciencia misma, creo que vale la pena repasarla y volver a su punto de partida con Demócrito. Ya lo conté en su momento, en los lejanos capítulos en que hablamos sobre la Antigüedad, pero permítanme una recapitulación, que muestra que las ideas científicas son siempre culturales, y que la evolución de la ciencia se desliza entre ellas, hacia adelante y hacia atrás, una y otra vez.
Recordemos, pues, al viejo Demócrito.
La primera teoría atómica
Sólo existen los átomos y el espacio vacío. Todo lo demás es opinión.
DEMÓCRITO DE ABDERA
Si bien Lavoisier completó su revolución en la química sin pronunciarse sobre la estructura profunda de la materia, una cuestión que consideraba de índole «metafísica» y, por ende, fuera del alcance y las obligaciones de una ciencia newtoniana, ya cinco siglos antes de Cristo (y más de veinte antes de Lavoisier) los filósofos griegos sí consideraban legítimo plantearse la pregunta y de hecho hasta ensayaron algunas respuestas. Dos respuestas distintas y opuestas, en realidad. Por un lado, estaba la de Leucipo y Demócrito, quienes sostuvieron que todo lo que existe está compuesto por «átomos», minúsculas partículas indivisibles, «sin partes» (eso es lo que significa precisamente «a-tomo» en griego; «a», sin y «tomo», parte). Ya recordaran cómo razonaba Demócrito: si un cuchillo penetra la materia es porque hay en ella vacíos, intersticios naturales por donde abre el cuchillo su camino separando a los átomos; si no existieran esos intersticios, el cuchillo jamás podría penetrar. Así, concluía, cada sustancia no es más que un conjunto de pequeñas partículas macizas, indivisibles y específicas de esa sustancia. Hay infinitos átomos que, gracias a sus formas complementarias, pueden combinarse dando todas las demás. Aunque invisibles, los percibimos por sus propiedades secundarias: por ejemplo, aquellas sustancias con átomos redondeados acarician la lengua (y tienen gusto agradable), mientras que las que están formadas por átomos rugosos resultan ácidas e irritantes.
Los átomos de Demócrito eran invisibles, pero para nada abstractos o teóricos, sino perfectamente reales. Y aunque no pudiera haber evidencia empírica sobre su existencia, para los atomistas eran una realidad contundente.
La otra respuesta fue la de Aristóteles, quien se opuso al atomismo de la escuela de Abdera y lo criticó ácidamente al sostener que la materia podía dividirse de manera indefinida. Y era coherente, porque Aristóteles, al negar en forma radical la posibilidad del vacío, no podía aceptar que entre átomo y átomo no hubiera nada. Además, argumentaba, si los átomos tenían volumen, por chico que fuera éste… ¿por qué no se iban a poder dividir? Bastaría con tener un instrumento suficientemente fino.
Pero el asunto es que como la controversia era imposible de resolver experimentalmente, ambas posiciones (o creencias) se mantuvieron en equilibrio a lo largo de los siglos. A pesar de la enorme autoridad de Aristóteles, un atomismo larvado empujaba a los alquimistas; Galileo, Newton y los hombres de la Revolución Científica —en Inglaterra especialmente— en general fueron atomistas, y los físicos del siglo XVIII, que se interesaron por los gases, tendían a pensarlos como conjuntos de partículas, imaginando que la presión sobre las paredes de una caja se debía al golpeteo simultáneo de grandes cantidades de átomos. Descartes y los cartesianos, por el contrario, sostuvieron la continuidad e infinita indivisibilidad de la materia, que identificaban con el espacio mismo.
Así las cosas, cuando en el año 1771 se publicó la primera edición de la Enciclopedia Británica, la palabra «átomo» se describía casi con la misma definición de Demócrito:
En filosofía (sic), una partícula de materia tan pequeña que no admite división. Los átomos son la minima naturae (los cuerpos más pequeños) y se conciben como los primeros principios de toda magnitud física.
Lo cual muestra que no se había avanzado nada y los átomos seguían siendo tan especulativos como siempre. Lavoisier, de hecho, escribió imprudentemente:
Respecto de esos simples e indivisibles átomos de los cuales toda la materia está compuesta, es muy probable que nunca sepamos nada sobre ellos.
Es decir, una especie de programa negativo, que hablaba de lo que nunca se podría hacer. Siempre es peligroso. Y en este caso, justamente, los átomos químicos estaban a punto de entrar en escena.
Un señor que confundía los colores
Tal vez no haya que culparlo demasiado a Lavoisier por no haber redondeado «del todo» su revolución; al fin y al cabo, la Revolución Francesa se encargó de cortarle la cabeza antes de que pudiera intentarlo. Bastante hizo, de todos modos, pero la tarea quedó en manos de John Dalton (1766-1844), que le dio rango constitucional y cuantitativo, a la vez que un contenido empírico, a la gran intuición de Demócrito sobre la estructura de la realidad.
Dalton nació en la pequeña localidad inglesa de Eaglesfield, pero en 1793 se trasladó a Manchester, donde habría de vivir el resto de su vida y donde regularmente presentó trabajos ante la Literary and Philosophical Society, que presidió a partir de 1817. El primero de ellos trataba «de la ceguera ante los colores», enfermedad que padecía y que desde entonces se llama daltonismo.
Más o menos desde 1800, nuestro amigo venía reflexionando sobre el hecho —bien conocido por los químicos— de que si un compuesto contenía dos elementos en la proporción de cuatro a uno, siempre iba a mantener esas proporciones y nunca 9 a 1, o 4 a 2. Esto es: no importaba qué cantidad de ese compuesto se tuviera, las proporciones siempre serían fijas. Y lo curioso es que, además, involucraban números enteros. Louis Joseph Proust (1754-1826) pudo demostrarlo pesando los compuestos cuidadosamente.
Dalton llegó entonces a la conclusión de que este fenómeno era una buena prueba de la existencia de los átomos de Demócrito, dado que se entiende fácilmente si se supone que cada elemento está formado por partículas indivisibles: si la partícula de un elemento pesa cuatro veces más que la partícula de otro y el compuesto se forma al unir una partícula de cada uno, las relaciones de peso serán justamente ésas (4:1) y ninguna otra. Para elaborar una teoría científica de los átomos, Dalton usó esta ley de las proporciones simples y también la ley de las proporciones múltiples, en las que un elemento se combina en dos proporciones definidas, como por ejemplo el carbono, que puede hacerlo con una parte de oxígeno, y da monóxido (CO) o dos y da dióxido de carbono (CO2).
Y así fue cómo en 1808 dio a conocer estas ideas en su Nuevo Sistema de Filosofía Química, basándose en un nutrido aporte de hechos experimentales y cuatro supuestos.
• Toda la materia está compuesta de átomos sólidos, indivisibles y completamente homogéneos, es decir, sin huecos en su interior.
• Los átomos son indestructibles y preservan su identidad en todas las reacciones químicas; no pueden descomponerse para formar otros átomos. Las reacciones químicas implican un cambio en la distribución de esos átomos: las cenizas que quedan después de la combustión y los gases que se liberan son de la misma materia que había al comienzo, pero reorganizada.
• Hay tantas clases de átomos como elementos químicos; a cada elemento químico corresponde un tipo de átomo definido y específico y, por supuesto, no es posible transmutar un átomo en otro distinto.
Hasta aquí, seguía los pasos de Demócrito (salvo en el hecho de que para Demócrito había infinitas clases de átomos), pero el cuarto supuesto iba más lejos:
• Cada átomo está asociado con una magnitud propia que lo caracteriza: el peso atómico.
Resumiendo: los átomos daltonianos son sólidos, indivisibles, incompresibles y completamente homogéneos —sin huecos en su interior—; son indestructibles y preservan su identidad en todas las reacciones químicas. Hay tantas clases de átomos como de elementos químicos, a cada elemento químico corresponde un tipo de átomo definido, y difieren ligeramente en peso. Precisamente, la característica que define a un átomo es su peso (peso atómico, para ser más precisos), el encargado de darle entidad experimental y de sacarlos del limbo especulativo.
Con estos supuestos, Dalton daba a los átomos entidad científica y experimental, ya que el peso atómico se podía medir y de paso permitía cuantificar completamente la química. Y ahí, justamente ahí, estaba el asunto.
Porque lo que hizo nuestro amigo fue calcular los pesos atómicos de los elementos definidos por Lavoisier (tomando como unidad el peso del hidrógeno) y sentar firmemente la nueva teoría, que fue aceptada por la mayoría de los químicos, sorprendentemente, con relativamente poca oposición. Con Dalton, la química se hizo atomista y, aunque las discusiones subsistieron, especialmente acerca de si los átomos eran «reales» o no, ya no habría marcha atrás: aunque los átomos aún no se podían ver, ahora por lo menos se podían pesar; y pasaban definitivamente, pues, del terreno de la filosofía al de la química.
Las pequeñas bolitas de Dalton, además, se combinaban en «átomos compuestos» (en terminología actual, moléculas), lo cual parecía resolver el problema de la estructura de la materia. Eran como los de Demócrito, macizos, y así habrían de perdurar; sólo hacia comienzos del siglo XX cada uno de los presupuestos de Dalton empezó a ser demolido por nuevos y asombrosos descubrimientos.
Si bien Dalton era cuáquero y sus principios no le permitían admitir ninguna forma de gloria, el éxito de la teoría atómica daltoniana crecía y su fama también; empezaron a lloverle honores de las sociedades científicas extranjeras y su entierro, en 1844, estuvo muy lejos de su deseada intimidad: se acercaron allí más de 40.000 personas.
La hipótesis de Prout
Los átomos de Dalton se impusieron, pero las dudas respecto de su existencia real se mantuvieron durante muchas décadas. Todo el mundo estaba convencido de que la teoría atómica era esencial y conveniente para calcular proporciones y compuestos, pero los átomos propiamente dichos no se podían ver ni tocar y, de hecho, se manejaban como entidades puramente abstractas o matemáticas (algo así como los meridianos y los paralelos: aunque la geografía no funciona sin ellos, nadie espera tropezar con un meridiano cuando viaja por la superficie de la Tierra). ¿Se trataba entonces de elementos teóricos o tenían existencia —y consistencia— física? La verdad es que nadie era capaz de contestar esa pregunta.
Aun en 1860 los átomos eran tomados con mucha precaución por los químicos, y no había, por cierto, ninguna prueba de su existencia real.
Pero además había otro asunto, un reparo de tipo metafísico y si se quiere hasta religioso. Dalton había supuesto que a cada uno de los elementos químicos —en esa época se conocían ya unos cuantos— le correspondía un átomo distinto, lo cual implicaba que el mundo estaba construido por lo menos con cincuenta bloques básicos elementales. Y esto ya resultaba increíble. ¿Cómo podía ser, argumentaban algunos, que Dios hubiera utilizado tantos bloques distintos para construir el mundo? Entre los detractores de la teoría estaba Humphry Davy, el hombre que puso en el camino de la ciencia a Faraday y que encima había encontrado, él mismo, más bloques, como el sodio, el potasio y el cloro. Era difícil de creer. La vieja obsesión por la simplicidad, la firme y enraizada creencia de que el fondo de la naturaleza es sencillo, la obsesiva convicción de que la arquitectura del mundo es elegante y simple reaparecía una vez más.
Es una creencia, por supuesto, porque no hay ninguna razón para suponer que el mundo en el fondo es simple. Podría perfectamente ser muy complicado, y hasta se puede decir que lo es. Este asunto de la simplicidad se había planteado en astronomía: el sistema astronómico griego, elaborado por Tolomeo, era extraordinariamente complejo, era infernalmente complicado y Copérnico lo reformó, entre otras cosas, por eso. Algo por el estilo pensaría el físico inglés William Prout en 1815, casi una década después de la formulación de Dalton.
Prout observó un fenómeno muy interesante: los pesos atómicos de casi todos los elementos se aproximaban mucho a números enteros y eso, pensaba, no podía ser porque sí ni por casualidad.
El hidrógeno es el más simple de los elementos y su peso atómico es 1. Los pesos son los pesos de los átomos, pero medidos en relación con el peso de un átomo de hidrógeno. Si se lo midiera en gramos, sería 0,000000000000000000000001 de gramo o poco menos que 10 a la menos 23 gramos.
El peso atómico del carbono es 12, es decir, que pesa como doce átomos de hidrógeno, y el peso atómico del nitrógeno es 14, es decir, equivalente a 14 átomos de hidrógeno. El oxígeno tiene un peso atómico de 16, el sodio 23 y así sucesivamente. Tenía que haber una explicación para semejante fenómeno.
A Prout se le ocurrió que, de alguna manera, todos los elementos eran conglomerados de átomos de hidrógeno. El peso atómico del carbono era 12 porque el átomo de carbono estaba formado por un paquete de 12 átomos de hidrógeno, y el peso atómico del oxígeno era 16 porque 16 átomos de hidrógeno formaban uno de oxígeno.
Vistas las cosas de esta manera, el hidrógeno se transformaba en una especie de sustancia primordial, el protohylo, que de alguna manera formaba todas las demás.
Debemos considerar que el «protohylo» de los griegos es, en realidad, el hidrógeno,
decía Prout.
Así formulada, esta conjetura, que rescataba y al mismo tiempo proponía la vieja idea de la unidad profunda de la materia, que tuvo partidarios y acérrimos opositores —entre ellos, y notablemente, Mendeleiev—, fue conocida como «la hipótesis de Prout». Y aunque nadie podía imaginárselo, es impresionante lo cerca que estaba de la verdadera pista.
De todos modos, la refutación (provisoria) no tardó en llegar cuando se empezaron a medir los pesos atómicos con mayor precisión y se encontró que no eran números enteros.
El enigma de los elementos
Todo lo que se puede decir del número y la naturaleza de los elementos está, en mi opinión, confinado a discusiones de tipo puramente metafísico.
LAVOISIER
La teoría atómica tuvo una inmediata aceptación, aunque los químicos, como ya les conté, siguieron discutiendo sobre la realidad» de los átomos: ¿eran objetos verdaderos, contantes y sonantes, o simples «ficciones útiles»? ¿Y las moléculas? ¿Existían o eran puramente teóricas? El congreso de Karlsruhe de 1860, al que acudieron los grandes químicos de Europa y en el que no se resolvió demasiado (excepto la distinción entre átomos y moléculas), marcó una época porque todos tomaron conciencia de estar trabajando en un terreno y con un programa común y porque fue el primer congreso científico internacional.
La existencia de átomos y moléculas no era por cierto la única incógnita: también era desconcertante la proliferación de los elementos: ¿Podía ser que el mundo se edificara a partir de cincuenta elementos químicos? ¿Cincuenta sustancias elementales? ¿No era demasiado? ¿No tenía que haber un orden subyacente? En busca de ese orden esquivo estaban los químicos.
Porque lo cierto es que a cada rato se descubrían nuevos elementos, lo cual planteaba inquietudes e interrogantes nuevos: ¿Cuántos elementos había exactamente? ¿Habría un límite o se irían multiplicando ad infinitum? ¿No había algo de arbitrario a la hora de definir un elemento, puesto que siempre era esperable que algo que había sido reconocido como elemento se subdividiera aún más (como pensaba el viejo Aristóteles)?
Además, se podía percibir que ciertos grupos contaban con propiedades similares, de modo que se imponía la necesidad de pensar en algún criterio que permitiera poner orden en el caos de la profusión elemental. Johan Dóbereiner, catedrático de química en la Universidad de Jena, percibió en 1829 que uno de los elementos recientemente descubiertos, el bromo, tenía ciertas propiedades y un peso atómico que lo situaban a mitad de camino entre el cloro y el yodo. Lo mismo ocurría, según se dio cuenta un tiempo después, con el estroncio (que estaba a mitad de camino entre el calcio y el bario) y con el selenio (que se posicionaba entre el azufre y el telurio). Llamó tríadas a los grupos, pero pensó que podía tratarse de una simple coincidencia y no elaboró ninguna explicación ulterior.
Recién más de treinta años después hubo un nuevo intento de encontrar un patrón que ordenara todo. Alexandre Emile Béguyer de Chancourtois ideó en 1862 un ingenioso «tornillo telúrico», que, por más nombre de invento que tuviera, en realidad no era otra cosa que una conjetura que permitía organizar los elementos que presentaban entre sí similitudes físicas y químicas. Consistía, como ustedes pueden ver en la imagen siguiente, en un cilindro sobre el que había trazada una línea en espiral descendente, a lo largo de la cual se ubicaban los elementos a intervalos regulares, en función de su peso atómico. Cada dieciséis unidades de peso atómico, las propiedades de los elementos correspondientes tendían a exhibir llamativas similitudes con los que estaban por encima de ellos en el cilindro. El problema es que, a diferencia del volátil autor de estas páginas (que pretende que sus lectores entiendan lo que escribe), Chancourtois no se preocupó demasiado y su artículo fue publicado sin la ilustración del cilindro: fue, como pueden imaginar, virtualmente incomprensible.
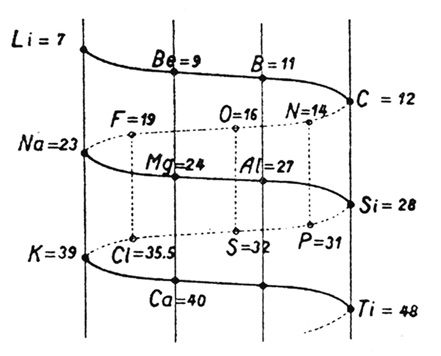
Dos años más tarde, el científico inglés John Newlands (1837-1898), sin haber escuchado nada de lo que hacía su colega, elaboró su propio patrón: descubrió que si listaba los elementos en orden ascendente de pesos atómicos, en líneas verticales de siete, las propiedades de los elementos correspondientes a las líneas horizontales eran notablemente similares.
En otras palabras, el octavo elemento a partir de uno dado es una especie de repetición del primero, como la primera octava en una escala musical.
La llamada «ley de las octavas» tenía sus problemas, uno de los cuales (acaso el más importante) era que las propiedades de algunos elementos, en especial de los de peso atómico más elevado, no encajaban para nada. Cuando comunicó sus hallazgos a la Chemical Society de Londres, sus integrantes se limitaron a ridiculizarlo. En medio del jolgorio general, uno llegó incluso a preguntarle si había pensado en organizar los elementos por orden alfabético. Recién en 1887 su trabajo fue reconocido y la Royal Society lo condecoró con la Medalla Davy en 1887.
Era el turno de Mendeleiev.
Mendeleiev resuelve el problema
Dimitri Ivanovich Mendeleiev (1834-1907) nació en Tobolsk, Siberia, el mismo año en que su padre se quedó ciego. Fue el menor de los catorce hijos que tuvo Maria Dimitrievna Kornilieva, quien debió hacerse cargo ella sola de la familia porque su marido, que era director de la escuela local, fue echado de su trabajo. Para mantener a sus hijos, Maria reabrió la fábrica de cristal de su abuelo, situada en una remota aldea, con tanta mala suerte que, en 1847, ardió hasta los cimientos. En 1849, cuando Dimitri Mendeleiev tenía quince años y Maria ya era viuda, nuestro protagonista partió junto con una de sus hermanas y su madre hacia Moscú, un viaje de más de dos mil kilómetros, donde consiguió una plaza para estudiar matemáticas y ciencias naturales, además de una pequeña beca del gobierno, suficiente para sustentarse.
Mendeleiev comenzó a trabajar en los laboratorios del instituto, donde pronto empezó a realizar experimentos originales y publicó algunos trabajos. En 1855 obtuvo la calificación de profesor, junto con la medalla de oro como mejor estudiante del año, y a la prematurísima edad de veintidós años fue nombrado privatdozent (profesor sin cargo ni salario, que dependía del dinero pagado por los estudiantes que asistían a su curso). En 1859, con una beca del gobierno para estudiar dos años en el extranjero, se mudó a París.
A su regreso a San Petersburgo obtuvo un puesto docente en el Instituto Técnico, pero pronto se dio cuenta de que no existía un solo libro de texto ruso sobre la química orgánica moderna. Entonces se sentó a escribir uno y completó quinientas páginas en sesenta días. Mendeleiev empezaba a hacerse un nombre. Y de hecho, a los treinta y dos años, fue nombrado profesor de Química General en la Universidad de San Petersburgo, un puesto excepcionalmente prestigioso para una persona tan joven.
A comienzos de 1869, Mendeleiev había completado el primer volumen de los dos que pensaba escribir para Los principios de la química. Allí, los elementos y sus compuestos eran organizados conjuntamente en grupos que exhibían propiedades similares, cada uno a continuación de los anteriores: el final del primer volumen, por ejemplo, cubría el grupo de los halógenos —cloro, bromo, yodo—. Cada miembro del grupo de los halógenos se combinaba con el sodio para producir sales que tenían propiedades muy similares (la más conocida de las cuales era, por supuesto, la sal de mesa, el cloruro de sodio). Los halógenos se combinaban también fácilmente con el potasio. Así pues, era natural que el segundo volumen comenzara por los grupos de metales alcalinos, al que pertenecía, justamente, el potasio. En cálculos de Mendeleiev, éstos ocuparían los dos primeros capítulos.
La mañana del viernes 14 de febrero de 1869 estos dos capítulos estaban ya completos. Y entonces fue que se presentó el problema: no tenía ni la menor idea de cómo seguir. Si hasta entonces la vorágine de la escritura había impuesto un orden medio arbitrario, conseguido un poco a los tumbos, ahora era necesario descubrir algún principio subyacente que permitiera organizar los elementos. Tenía que haber una clave en alguna parte. Pero el tiempo apremiaba: tres días más tarde, Dimitri tenía programada una breve excursión para inspeccionar las granjas de un pequeño pueblo rural y aconsejar a una cooperativa acerca de los métodos convenientes para la producción de queso.
Fueron tres días de angustia: la solución no aparecía por ninguna parte. Porque por entonces, como cualquier químico de la época, pensaba que el patrón debía estar relacionado con los pesos atómicos de los elementos. Fue entonces que se le ocurrió una gran idea. En sus recorridos en tren, a falta de algo mejor que hacer, Mendeleiev acostumbraba jugar solitarios. La inminente partida y el pensamiento obsesivo que lo tenía ocupado desde hacía días se unieron en su cabeza y se le ocurrió hacer de cuenta que cada elemento fuera una carta de la baraja, para lo cual empezó a escribir sus nombres en una serie de tarjetas en blanco, añadiendo sus pesos atómicos y sus propiedades químicas.
Estaba ahí, a un pasito de encontrarlo todo, y sin embargo no podía. Entonces se quedó dormido. Cuando despertó, había resuelto el problema.
Sueños
En un sueño, vi una tabla en la que todos los elementos encajaban en su lugar. Al despertar, tomé nota de todo en un papel.
MENDELEIEV
La historia del sueño puede ser más mitológica que real, pero lo cierto es que ese día Dimitri descubrió que cuando se listaban los elementos por orden de pesos atómicos, sus propiedades se repetían en una serie de intervalos periódicos. Por este motivo, llamó a su descubrimiento tabla periódica de los elementos.
Su histórico trabajo fue publicado dos semanas después bajo el título «Una propuesta para un sistema de los elementos». Empezando por la parte superior de la columna de la izquierda, las columnas verticales listan los elementos en orden ascendente de pesos atómicos, mientras que las horizontales agrupan los elementos de acuerdo con propiedades similares.
A primera vista parecía haber una serie de problemas con su tabla. Para empezar, si todos los elementos se agrupaban horizontalmente en función de sus propiedades, algunos de los pesos atómicos no encajaban en el orden ascendente exacto. En tales casos, Mendeleiev sugería que el peso del elemento en cuestión había sido mal calculado. Pero lo más audaz de todo fue que, donde no había un elemento que encajara en el patrón, dejaba un espacio vacío: algún día aparecería, en la naturaleza, el elemento destinado a ocupar ese sitio. Por poner sólo un ejemplo: en la novena fila horizontal predijo que debía haber un elemento aún no descubierto entre el aluminio y el uranio. Llamó a este elemento eka-aluminio, vaticinó cuáles serían sus propiedades y anunció que cuando fuera descubierto su peso atómico sería 68.
El sueño de Mendeleiev necesitaba, para convertirse en realidad, que la empiria lo avalara: hacía falta que hiciera su aparición estelar (o mejor dicho, atómica) alguno de los elementos destinados a ocupar los huecos dejados ad hoc por el creador. Y así fue: a finales del verano de 1874, la Academia de las Ciencias de París recibió una trascendental carta del químico francés Paul Lecoq de Boisbaudran:
Hace dos noches, el 24 de agosto de 1875, entre las tres y las cuatro de la mañana he descubierto un elemento nuevo en una muestra de sulfuro de zinc procedente de la mina Pierrefitte, en los Pirineos.
El gallium (galio) tenía un peso atómico de 69, pertenecía al grupo del boro y estaba situado entre el aluminio y el uranio: el nuevo elemento respondía casi a la perfección a las propiedades que Mendeleiev había predicho para el «eka-aluminio». Cinco años después, el químico alemán Clemens Winkler detectó la presencia de otro elemento —el germanio—, cuyo lugar había quedado hueco en la tabla a la espera de su hallazgo.
Los descubrimientos de estos nuevos elementos, predichos por Mendeleiev, tuvieron un impacto similar al que tuvo el retorno del cometa Halley para la Ley de Gravitación: ya nadie podía dudar de la ley periódica. Con la tabla, quedaban posicionados los ladrillos de los que estaba construido el universo. Sufrirían algunos movimientos a lo largo del siglo XX, es cierto, pero la estructura se mantendría prácticamente incólume.
Aunque persistían ciertas incógnitas
Algunas cosas, sin embargo, no estaban contestadas, y tenían que ver con la también vieja historia de los cómo y los porqués. Mendeleiev había mostrado cómo se ordenaban los elementos, es cierto, pero… ¿por qué ocurría eso? Era una pregunta que muchos podían tratar de «metafísica», sobre todo aquellos que se basaban en la vieja cantinela de que en ciencia no interesa el porqué, sostenida por el «no formulo hipótesis» newtoniano: desde esta perspectiva, las cosas son como la experiencia: la única guía certera muestra que son, el discurso de las cosas es el resultado de los experimentos, y punto. Así como los jueces hablan por sus fallos, la naturaleza sólo habla a través de los experimentos.
Pero lo que ocurre es que el discurso de las cosas no es un código, es un lenguaje y, en consecuencia, tiene su gramática, su sintaxis, incluso su retórica y su literatura. Y ahí hay mucha tela para cortar, ya que la pregunta por el porqué es equivalente a preguntarse si no habrá otra estructura, más profunda, que explique, por ejemplo en este caso, los motivos por los cuales la tabla periódica se ordena como se ordena.
La iniciativa por entender esta estructura profunda ya no corría por cuenta de los químicos sino que estaba, desde hacía tiempo, en manos de los físicos.
Los físicos juegan con los tubos de vacío
Y es que mientras los químicos se entretenían con la tabla periódica y discutían sobre la «realidad» de los átomos y las moléculas, los físicos estudiaban los efectos de la electricidad cuando se la hacía atravesar un tubo de vacío —o con un gas muy enrarecido—: en el electrodo positivo (ánodo) aparecía un resplandor verdoso y era lógico pensar que se debía a algún tipo de radiación que salía del cátodo (electrodo negativo). A esta emisión se la llamó, de manera no demasiado creativa, «radiación catódica».
Lo que no estaba para nada claro era la naturaleza de esos rayos catódicos, asunto sobre el que se armó una verdadera controversia: había quienes los consideraban ondas electromagnéticas como las que existían según las ecuaciones de Maxwell, que habían unificado definitivamente la electricidad y el magnetismo, y los que pensaban (como los físicos ingleses en general) que se trataba de partículas. Joseph John Thomson (1856-1940), en 1897, demostró categóricamente que se trataba de partículas, ya que eran desviadas por campos eléctricos y magnéticos de una manera que no cuadraba con las ondas electromagnéticas.
¿Pero de qué partículas podía tratarse? La verdad es que no había demasiadas alternativas. Puesto que eran atraídas hacia el electrodo positivo, era obvio que estaban cargadas negativamente. Thomson intuyó que se trataba de las partículas que transportaban la unidad de carga, algo así como los «átomos de la electricidad» meramente teóricos, por supuesto a los que el físico alemán Joseph Goldstein, que andaba más o menos en lo mismo, ya había llamado «electrones».
Pero había algo más. Cuando midió la masa de sus electrones, encontró que era extraordinaria, ridículamente pequeña: ¡Un electrón pesaba solamente un milésimo de un millonésimo de millonésimo de millonésimo de millonésimo de millonésimo de gramo! Y sobre todo, pesaba menos que un átomo de hidrógeno. ¡Menos que un átomo de hidrógeno, el más liviano y sencillo de los átomos! ¿Cómo podía ser? ¿Y de dónde salían esos electrones?
Y aquí es donde Thomson lanzó una hipótesis afortunada y audaz, muy audaz, una de esas hipótesis que hacen historia: que los electrones salían de adentro de los átomos.
Era una afirmación terrible: los átomos de Demócrito, los átomos de Dalton, macizos, indivisibles, compactos, fundamento último de la materia… ¡tenían partes, después de todo! ¡No eran indivisibles! ¡Tenían cosas adentro! Como dijo el propio Thomson, muy a la inglesa:
La suposición de que exista un estado de la materia más finamente dividido que el átomo es en cierto modo sorprendente.
No era «en cierto modo sorprendente»… Era increíble.
El asunto no terminaba ahí
En realidad, nadie se imaginaba todavía que lo pequeño encerraba un mundo. Pero así era: los experimentos demostraban que los electrones eran todos iguales, sin importar el material del cual salían, lo cual permitía sospechar que no sólo eran partes de algunos átomos, sino que eran partes de todos los átomos. Ya era una sorpresa y una novedad: si era así, la electricidad, que parecía hasta entonces un fenómeno particular y, si se quiere, lateral, estaba en verdad implicada en la esencia misma de la materia… ¡y buena parte de la naturaleza del mundo resultaba ser eléctrica!
Thomson elucubró un modelo del átomo que mantenía, en cierta forma, la idea del átomo macizo de Demócrito y Dalton, pero ya no era una esfera homogénea sino una extensión de materia más o menos tenue (y cargada positivamente) en la que los electrones estaban incrustados como las pasas de uva en un pan dulce, de tal manera que resultara eléctricamente neutro.
Es muy probable que Thomson, al diseñar su átomo, pensara que estaba dando la puntada final al problema de la estructura de la materia. Ni se imaginó que la cosa recién empezaba.
Porque el átomo de Thomson que no era muy lindo, dicho sea de paso no estaba destinado a durar. En 1896 llegó a su laboratorio un joven físico que se llamaba Ernest Rutherford (1871-1937). Nacido en Nueva Zelanda, había trabajado con sus padres, granjeros, en tareas campestres; cuando recibió la noticia de que había ganado una beca para la Universidad de Cambridge, estaba plantando papas en la granja familiar y dijo «¡ésta es la última papa que planto en mi vida!». O por lo menos, eso es lo que cuenta la leyenda.
Rutherford trabajó un tiempo junto a Thomson, pero enseguida se orientó hacia la radiactividad, el nuevo campo abierto por Roentgen, Becquerel y Marie Curie, de los que pronto hablaremos, aunque no en este capítulo. En 1898 viajó a la Universidad McGill, en Montreal, Canadá, donde le fue muy bien: pronto comprobó que los elementos radiactivos emitían por lo menos dos clases de rayos diferentes: unos, que llamó alfa, cargados positivamente, y otros más penetrantes y cargados negativamente que llamó beta (más tarde se observaría una tercera radiación, la gamma). Las partículas alfa salían de los elementos radiactivos con una velocidad que las transformaba en proyectiles interesantes para estudiar los átomos: se las lanzaba a toda velocidad contra ellos y se veía luego cómo se comportaban.
Por ejemplo, para ver cómo estaban distribuidos los electrones en el pan dulce de Thomson, Rutherford probó, en 1908, lanzar partículas alfa contra una lámina de oro de sólo cinco diezmilésimas de milímetro de espesor (es decir, relativamente pocos átomos). Observó, con bastante sorpresa, que la mayoría de los proyectiles atravesaba la hoja de oro sin sufrir desviaciones, pero de tanto en tanto algunas partículas se desviaban en ángulos enormes y no faltaban aquellas que volvían para atrás, como si hubieran chocado con algún obstáculo sólido y pesado.
¿Por qué era una sorpresa? Porque Rutherford, como todos los físicos, tenía en la cabeza el modelo «budín inglés» de átomo que había propuesto Thomson, el de una esfera más o menos llena de materia tenue y cargada de electricidad positiva, donde estaban incrustados los electrones de carga negativa. El resultado del experimento, sin embargo, desmentía esa imagen; si algunas partículas eran desviadas tan violentamente, incluso en ángulos rectos, y aun mayores, en alguna parte del átomo tenía que haber algo duro y macizo: las partículas fuertemente desviadas eran aquellas que por casualidad rozaban esa región o chocaban con ella.
¿Qué podía ser? Un golpe de intuición feliz le permitió a Rutherford decidir que toda o casi toda la masa del átomo estaba concentrada en un espacio muy reducido en su centro, el núcleo, y era contra ese núcleo que habían chocado las partículas alfa. El átomo «lleno» de Thomson saltó hecho pedazos y así apareció el átomo «modelo Rutherford»: un centro (el núcleo) compuesto de partículas que Rutherford llamó «protones» (los primeros), a cuyo alrededor giraban los electrones, muy lejos, ya que si el núcleo fuera una pelota de tenis en medio de un estadio de fútbol, los electrones estarían en las tribunas.
Los protones del núcleo, mucho más pesados que los electrones y cargados positivamente, compensaban las cargas negativas de los electrones. El número de protones que tenía el núcleo, por su parte, determinaba de qué elemento era el átomo (un protón significa hidrógeno; dos, helio; tres, litio; cuatro, berilio, y así; el hierro tiene 26 y el oro 79 protones). Al fin y al cabo, Prout no andaba tan equivocado cuando sugirió que todos los átomos eran agregados de átomos de hidrógeno. Puesto que un protón era, efectivamente, un núcleo de hidrógeno, y puesto que todos los núcleos eran agregados de protones, es decir, de núcleos de hidrógeno, ¡resultaba que Prout había dado, casi, casi, en la tecla!
Era interesante, además, ese núcleo compuesto por protones. Puesto que el número de protones en el núcleo era la marca de identidad del elemento, se abría una inquietante posibilidad: bombardeando al nitrógeno, Rutherford comprobó que su carga de siete protones pasaba a nueve pero enseguida perdía un protón y se quedaba con ocho… ¡y por lo tanto se había convertido en oxígeno! ¡Se habían transmutado átomos! La cosa era tan extraordinaria que Rutherford y su discípulo Soddy vacilaron en anunciarla… la palabra «transmutación» tenía tan mala fama que tuvieron que hacer verdaderos malabarismos de lenguaje para dar a conocer el fenómeno al público y llevó algunos años que se aceptara del todo.
Además, había algo vertiginoso en el átomo de Rutherford: estaba constituido, casi en su totalidad (el 99,99999%), por espacio vacío. La materia, finalmente, estaba compuesta por trocitos de nada, duros núcleos rodeados por una lejanía de electrones: si les quitáramos el espacio vacío a los trillones de átomos de nuestro cuerpo, el resultado cabría holgadamente en la cabeza de un alfiler: todo lo que nos rodea, lo que somos y lo que hay es, casi íntegramente, espacio vacío.
Sin embargo, y a pesar de ese irremediable y terrible vacío, este modelo tenía un atractivo profundo, entroncado con uno de los más antiguos mitos humanos: la identidad entre micro y macrocosmos, que lo más pequeño se pareciera a lo más grande. Pensar que en el fondo de la materia se repetía una estructura parecida a la del sistema solar, con el núcleo en el lugar del Sol, los electrones como planetas y la atracción eléctrica en el papel de la gravedad, que el universo tuviera una sola impronta repetida en diferentes escalas, excitaba la imaginación. En verdad, era de un encanto irresistible: ¡en el reino de lo diminuto aparecía la misma estructura que en lo inmenso!
No es de extrañar que el átomo, concebido como un sistema solar en miniatura, tuviera un éxito fulminante y que su imagen perdure hasta hoy, como si fuera un logotipo de nuestra época.
Nada es perfecto
Sin embargo, el átomo de Rutherford, a pesar de su indudable encanto, tenía un gravísimo defecto: ocurre que, según las leyes del electromagnetismo establecidas por Maxwell, cuando una carga eléctrica gira, como los electrones alrededor del núcleo, emite ondas electromagnéticas y en consecuencia pierde energía, que pronto no le alcanza para mantenerse en órbita y cae irremisiblemente hacia el centro. El hermoso átomo de Rutherford no era estable: los electrones tenían que caer forzosamente hacia el núcleo y el átomo se derrumbaba sobre sí mismo. ¿Habría que abandonar la bella idea de un sistema solar en miniatura?
No. Ya estaba lista la mano —o mejor dicho la mente— salvadora. Niels Bohr (1885-1962), que había nacido en Copenhague, en 1911 se doctoró en física, se destacó en fútbol y ganó una beca que le permitió viajar a una de las mecas de la física del momento, Cambridge, para trabajar con J. J. Thomson, el descubridor del electrón. Parece que no se llevó muy bien con Thomson (las malas lenguas dicen que era muy autoritario, pero quizá valía la pena aguantarlo; al fin y al cabo siete de las personas que trabajaron con él ganaron el Premio Nobel), y pronto se orientó hacia Rutherford, cuyo átomo inestable se sostenía tenuemente en el vacío, con la amenaza de inmediata catástrofe.
Bohr actuó con rapidez y un poco alocadamente: siguiendo los pasos de Planck y Einstein, y con una increíble audacia, en 1913 elaboró una teoría del átomo completamente novedosa. Puesto que los electrones de Rutherford, mientras giraban, debían irradiar energía y caer al núcleo, decidió inventar un modelo en el que los electrones no irradian. Era mucho decir, pero no era todo. Bohr decidió también que los electrones no pueden girar en cualquier lugar, sino en ciertas órbitas absolutamente prefijadas, del mismo modo que los autos no pueden circular por cualquier lugar, sino por las calles que son mano. Así, sostuvo Bohr, hay una primera capa donde giran (circulan) los electrones menos energéticos, una segunda capa con órbitas más energéticas que la primera, pero menos que la tercera y así. Cada nivel corresponde a cierta cantidad fija de energía y no hay órbitas intermedias (así como entre dos calles contiguas no hay calles intermedias y un automóvil no puede seguir cualquier trayectoria). Los electrones no irradian mientras se mueven en sus órbitas; sólo lo hacen cuando saltan de una órbita más energética a una menos energética.
Es una situación parecida a la de los autos que giran alrededor de una plaza. A medida que la calle inmediatamente alrededor de la plaza se llena, los autos deben empezar a dar vueltas por las calles siguientes (que requieren mayor energía, mayor consumo de nafta, porque el trayecto es más largo); cuando ésas también se llenan, los autos-electrones deben ir una calle más allá, y así sucesivamente. Cuando se desocupa algún lugar en una calle más cercana al centro, inmediatamente el lugar es ocupado por un auto que gira más lejos, pero como para alcanzar la órbita más cercana al centro debe doblar, debe poner la luz de guiño y emitir (luz), es decir, perder energía.
Era una idea absolutamente radical, como si Bohr hubiera sostenido que hay «calles» en un lugar donde todos pensaban que sólo existía una enorme planicie asfaltada en la que los vehículos podían circular por donde se les antojaba. Pero con ella conseguía zanjar la dificultad del átomo de Rutherford y lo que es todavía mejor lograba explicar una buena cantidad de fenómenos empíricos.
Y otra cosa: el esquema de Bohr explicaba la estructura obsesiva y repetitiva de la Tabla Periódica. A medida que las capas se van llenando (la primera se llena con dos electrones, la segunda con ocho, la tercera también con ocho y así), como si sus calles se fueran embotellando, los electrones no tienen más remedio que circular por las calles más alejadas y ocupar las capas subsiguientes. Es el número de electrones en la última capa el que determina las propiedades químicas, ya que es la última capa la que interactúa con el resto de los átomos.
Al fin y al cabo, son los autos del último de los trayectos alrededor de la plaza los que interactúan con el resto del tránsito. El cobre, la plata y el oro, por ejemplo, tienen un solo electrón en la capa más externa y por eso sus propiedades son parecidas.
Era un paso peligroso. Es verdad que se conservaba la plácida imagen de un minúsculo sistema solar, pero a costa de violar las leyes clásicas de la física. Y era peligroso porque marcaba un límite entre macro y microcosmos: las leyes del electromagnetismo que claramente establecían que el electrón debía emitir no valían en el mundo del átomo de Bohr: allí el electrón no emitía mientras estaba en la órbita, sino sólo cuando saltaba de una a otra. No era fácil de digerir y las reacciones a la propuesta de Bohr fueron una mezcla de entusiasmo y escepticismo que a veces llegaba a la incredulidad. El mismo Rutherford, que seguía de cerca a su alumno, fue muy cauto. Pero el nuevo modelo ¡funcionaba en los experimentos!
Y es que las cosas son así: la ciencia avanza con pasos de ciego, con audacia e irresponsabilidad, y a veces una propuesta temible es la base sobre la que pueden apoyarse los que vendrán después. El átomo de Bohr (o el de Rutherford salvado por Bohr), con su núcleo ocupado por protones, de carga positiva, y los electrones en órbitas fijas a su alrededor, fue un hallazgo feliz y permitió los modelos más complicados que vinieron después.
Naturalmente, ésta no era la idea que había tenido Dalton de sus átomos (ni Demócrito, desde ya). Ahora resultaba que los átomos no sólo eran divisibles, sino que tenían una complicada estructura interna. Pero con sólo dos partículas, el electrón y el protón, se explicaban todas las propiedades de la materia y la profusión de elementos de la Tabla Periódica.
Y sin embargo, todavía faltaba algo.
En ciencia, las cosas son así: siempre falta algo.