CAPÍTULO 37
EL NÚCLEO ATÓMICO Y EL MODELO ESTÁNDAR
Uno de los terrenos en los que el siglo XX indagó con enormes resultados fue el del átomo, aquella unidad constitutiva de todas las cosas donde se escondían (y probablemente se siguen escondiendo) los secretos mejor guardados del universo.
El descubrimiento del electrón, a fines del siglo XIX, había llevado a la conclusión evidente de que los átomos no eran, como se creía, partículas indivisibles sino estructuras compuestas, lo cual diseñó todo un programa de investigación.
Resultaba obvio que los electrones no podían ser los únicos componentes de los átomos, cualquiera fuera la estructura de éstos, por una razón muy sencilla. O dos, mejor dicho: por un lado, los átomos son eléctricamente neutros y, por lo tanto, en algún lugar tenía que haber una carga positiva que neutralizara la carga negativa de los electrones; por el otro, la masa total de los átomos es mucho más grande que la de los electrones. En algún lugar tenían que estar la carga y la masa que faltaban.
Thomson resolvió este inconveniente con su modelo del plum pudding (según el cual los electrones estaban incrustados en una esfera de carga positiva), y pareció que se tenía la clave de la estructura de la materia.
Pero resulta que, como ya vimos, los átomos radiactivos emitían partículas alfa a gran velocidad. Y, como también vimos, Rutherford usó esas partículas para bombardear una lámina de metal y vio, contra todo pronóstico, que la mayoría atravesaba la lámina sin desviarse, mientras que algunas se desviaban mucho, como si hubieran chocado contra algo muy grande y pesado: concluyó entonces que, al revés de lo sugerido en el modelo de Thomson, la masa y la carga positiva del átomo no estaban distribuidas sino concentradas en el centro del átomo. Y concentradas en un espacio muy pequeño, al que llamó núcleo. Así se elaboró el modelo del átomo como un sistema solar en miniatura. Un núcleo en el centro y los electrones girando alrededor.
Lo cual explicaba por qué se repetían las propiedades de los elementos en la Tabla Periódica. Los electrones se mueven en órbitas alrededor del núcleo y esas órbitas tienen la capacidad de alojar un cierto número de electrones, nada más. Cuando una capa se llena, los electrones se van a la siguiente.
Las propiedades químicas de un átomo dependen exclusivamente de la última capa. El litio, el sodio y el potasio tienen un único electrón en la última capa, y por eso sus propiedades se parecen. También se parecen los que tienen dos en la última capa, como el magnesio y el calcio, y los que tienen tres, como el aluminio y el galio. A medida que las capas se van llenando, se empieza con la siguiente, y es por eso que las propiedades se repiten.
Electrones y núcleo: otra vez los físicos pensaron que habían alcanzado la llave que abría el secreto de la materia.
Los protones
Pero volvamos al asunto del núcleo. Fíjense que se planteaba de nuevo la misma pregunta de siempre: ¿qué era el núcleo? ¿Se trataba de una esfera de materia cargada positivamente, o era a su vez algo compuesto de cosas aún más pequeñas? Las dos respuestas eran razonables, pero sólo la segunda era cierta. En 1919, el propio Rutherford demostró que el núcleo estaba compuesto de partículas que llamó «protones» (lo cual significa «los primeros»). Los protones que definió Rutherford tenían una carga eléctrica exactamente igual a la del electrón, aunque de signo opuesto: son los encargados de equilibrar las cargas electrónicas de modo tal que el átomo sea efectivamente neutro. Si hay siete protones, hay siete electrones. La diferencia es que los primeros son muchísimo más grandes (1.836 veces, para ser precisos) que los últimos.
A su vez, son los protones los que le dan identidad a los elementos: un átomo de hidrógeno, el más simple de todos los átomos, tiene en su núcleo un único protón alrededor del cual se mueve un único electrón. Un protón y un núcleo de hidrógeno son exactamente la misma cosa. Pero si se agrega otro protón, ya no tenemos un núcleo de hidrógeno, sino de helio. Y si hay tres ya estamos ante el litio; cuatro, berilio; seis, carbono. Si el oro no es lo mismo que el hierro, es porque el hierro tiene veintiséis protones en su núcleo y el oro setenta y nueve. Si uno tiene un átomo de hierro y le agrega 53 protones, tiene uno de oro. Eso es todo.
Así, cada elemento de la Tabla Periódica tiene un número de protones que lo identifica, que se llama «número atómico» y es lo mismo que el nombre. Uno puede decir «elemento 1» o hidrógeno, «elemento 26» o hierro. Normalmente, el número atómico se escribe abajo a la izquierda del nombre del elemento: 1H, 26Fe. El número atómico (es decir, el número de protones) es el documento de identidad del elemento. Ahora fíjense que si uno puede (y se puede) agregarle protones al núcleo de un elemento y obtener otro… está realizando una transmutación, ¡el sueño delirante de los alquimistas!
Además, observen también que si los núcleos son agregados de protones y cada protón es un núcleo de hidrógeno, Prout no andaba tan equivocado cuando en 1815 supuso que todos los átomos eran agregados de átomos de hidrógeno.
Hay un pequeño problema, sin embargo. Los protones, que están apelotonados en el núcleo, tienen todos cargas eléctricas positivas, razón suficiente para que pensemos que se deberían rechazar los unos a los otros. ¿Por qué, entonces, no se desparraman? La razón es que están unidos por una fuerza mucho más poderosa que el rechazo eléctrico. Pero para entrar en este tema tenemos que hablar, antes, de la segunda gran partícula del núcleo atómico.
Algo llamado neutrón
Rutherford, que de joven había cosechado papas, conocía a la perfección el antiguo consejo de no dormirse sobre los protones, consejo útil si los hay. Y no se durmió.
Hacia junio de 1920, cuando pronunció su conferencia ante la Royal Society de Londres, Rutherford ya era uno de los héroes de la física. La disertación, sin embargo, no la dedicó a su aclamado modelo del átomo sino que comenzó hablando de la transmutación del átomo de hidrógeno, luego hizo una recapitulación sobre el estado de la física en el momento, y después, y sin previo aviso, se puso a divagar sobre la estructura del núcleo atómico. Imaginó un núcleo neutro, un núcleo de hidrógeno sin carga eléctrica. Una especie de asociación entre un protón y un electrón pegados que anularan mutuamente sus cargas y compusieran una especie de sistema de carga cero, un átomo neutro. No le parecía para nada imposible la existencia de un objeto semejante.
Este átomo tendría novedosas propiedades: su campo eléctrico sería cero, y por lo tanto se movería con mucha comodidad por dentro de la materia. Podría meterse directamente dentro de la estructura de otros átomos y sería una herramienta ideal para explorar la materia,
dijo.
Nadie entendió muy bien por qué razón Rutherford había empezado a fantasear con probabilidades tan exóticas sin que viniera demasiado a cuento.
Pero entre los asistentes a la conferencia estaba James Chadwick, un joven físico que colaboraba con Rutherford y que se tomó en serio las divagaciones de su maestro. Pensó que Rutherford estaba postulando una partícula neutra, una nueva partícula que bien podría llamarse «neutrón».
Durante mucho tiempo, Chadwick se dedicó a perseguir al neutrón sin ningún resultado. Pero en el otoño de 1930, el físico alemán W. Bothe, ayudado por un joven investigador, H. Becker, observó que el berilio (el cuarto elemento de la Tabla Periódica), al ser bombardeado por una fuente radiactiva, emitía una radiación muy penetrante que supuso que era radiación gamma, uno de los productos de la desintegración radiactiva. Pero esta radiación gamma era demasiado penetrante, mucho más que cualquier radiación gamma conocida hasta entonces.
Chadwick se enteró de estos resultados, y se enteró también de lo que ocurrió poco más de un año después, en París. Allí, en diciembre de 1931, Irene Curie —la hija de la gran Marie Curie— y su esposo Frédéric Joliot repitieron los experimentos de Berlín, y el 18 de enero de 1932 publicaron en las actas de la Academia de Ciencias un resultado sorprendente: la radiación del berilio era tan potente que podía arrancar protones a sustancias como la parafina, el agua y el celofán.
Cuando Chadwick leyó estos resultados en el Cavendish Laboratory de Cambridge corrió a mostrárselos a Rutherford, quien exclamó que no los creía «en absoluto», y le pidió que verificara las mediciones de los Joliot-Curie. El discípulo tampoco creía en esas mediciones: le parecía imposible que la radiación gamma fuera capaz de arrancar partículas tan pesadas como el protón. Para arrancar protones, hacían falta partículas más o menos como ellos, pero capaces de penetrar sin demasiado problema en los núcleos… tal como había sugerido Rutherford en aquella lejana conferencia, más de diez años antes.
En otras palabras, Chadwick pensaba que en la misteriosa radiación del berilio no había ningún rayo gamma, sino las anheladas y hasta ahora ausentes «partículas neutras». Con esa hipótesis, dedicó diez fatigosos días a refinar las mediciones. El fin de semana del 13 y 14 de febrero, creyó haber obtenido su meta. El miércoles 17 de febrero de 1932 envió a la revista un informe con el título: «Sobre la posible existencia del neutrón».
Finalmente, lo había encontrado.
La verdad es que era imposible creer que el núcleo atómico estaba compuesto solamente de protones. Como ya vimos, un átomo de hidrógeno tiene en su núcleo un único protón, cuya carga eléctrica es neutralizada por un electrón. Sin embargo, el núcleo de helio, el elemento que sigue al hidrógeno en la Tabla Periódica, y que tiene dos cargas positivas en su núcleo (es decir, dos protones), no pesa el doble del núcleo de hidrógeno, sino el cuádruple. Lo cual sugiere que ahí hay algo más.
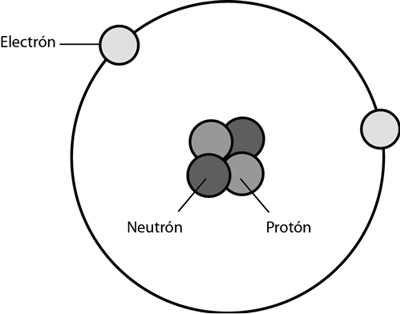
EL NÚCLEO DE HELIO
Y efectivamente, en el núcleo de helio, además de los dos protones de rigor, hay dos neutrones: aquellas partículas que imaginó Rutherford en su conferencia de 1920, y que Chadwick encontró en 1932.
Los neutrones son muy parecidos a los protones, aunque su masa es ligeramente mayor. Un protón equivale a 1836,1 electrones. En cambio, un neutrón equivale a 1838,6 electrones. Es una diferencia mínima, pero, en fin, son más grandes.
Aunque, naturalmente, la diferencia principal entre protones y neutrones es que el protón está eléctricamente cargado y los neutrones no. Al no tener carga, son excelentes proyectiles para bombardear el núcleo. Si se bombardea un núcleo con protones, va a sufrir el rechazo de las cargas eléctricas positivas. Pero con los neutrones no existe ese problema y, por eso, pueden penetrar profundamente en la materia. De hecho, son los responsables de los procesos de fisión nuclear, y los que se utilizan para bombardear núcleos, transmutarlos y volverlos radiactivos.
A diferencia de los protones, si se agregan neutrones a un núcleo, el elemento no cambia. Si era carbono, sigue siendo carbono. Sin embargo, el núcleo no es el mismo, ya que el número de partículas ha variado. Dos núcleos con el mismo número de protones pero diferente número de neutrones son isótopos (se llaman isótopos —que significa «el mismo lugar», porque efectivamente ocupan el mismo lugar en la Tabla Periódica, ya que el elemento no cambia—). Casi todos los elementos naturales existen en diferentes formas isotópicas (es decir, en variedades de acuerdo a la cantidad de neutrones). Por ejemplo, un núcleo de hidrógeno tiene un solo protón en su núcleo. Si además del protón hay un neutrón, sigue siendo hidrógeno, por supuesto, pero en la variante llamada deuterio. Si tiene dos neutrones, se llama tritio.
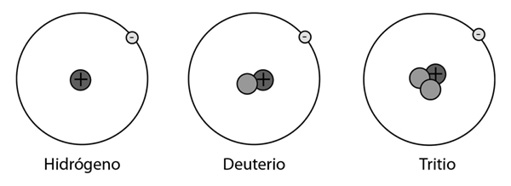
NÚCLEO DE HIDRÓGENO, NÚCLEO DE DEUTERIO, NÚCLEO DE TRITIO
Sigue siendo hidrógeno, claro está; el deuterio y el tritio son sólo variantes o isótopos. Por eso, junto al nombre del elemento, se ponen dos números: uno es el número de protones (el número atómico) y el otro es el «número másico», que se marca como superíndice a la izquierda del elemento, y que indica la suma de protones y neutrones. Así, 2⁴He indica que se trata de helio, con dos protones (número atómico 2). Pero el cuatro informa que en ese núcleo hay cuatro partículas (cuatro nucleones) —«nucleones» es la palabra que se utiliza para referirse a los integrantes del núcleo, sin discriminar si son protones o neutrones— en total. Es decir, que además de los protones, hay dos neutrones. 23592U nos dice que el uranio, de número atómico 92 (con 92 protones por lo tanto), tiene 235 partículas en total. Es decir, 235-92 =143 neutrones. El 23892U es otro isótopo o variante del uranio, esta vez con 146 neutrones.
Los neutrones juegan un papel central en la estabilidad del núcleo atómico. Sin los neutrones, probablemente en el mundo no habría nada más que hidrógeno. Para comprender esto, hablemos primero de las cuatro fuerzas que existen en el mundo.
Las cuatro fuerzas
Cuatro hijuelos hubo el rey, cuatro hijuelos, que no más.
Romance popular español
Que la compleja arquitectura del universo esté basada solamente en cuatro fuerzas, que se encargan de mantener en pie y en funcionamiento todo lo existente, es sin duda asombroso. Y recién en los últimos ochenta años el esquema quedó completo.
Primero, la fuerza gravitacional, la fuerza que nos adosa a la Tierra y nos dota de peso, la que mantiene a los planetas en sus órbitas y agrupa a las galaxias en grandes cúmulos. Su universalidad es verdaderamente espeluznante: todos los cuerpos ejercen atracción gravitatoria sobre todos los otros cuerpos, sin excepción. Es la amalgama cósmica que mantiene unido al universo, es bella y armoniosa. Y así y todo, es la más débil de todas las fuerzas. Es triste, pero es verdad.
La gravitación parece muy pobre cuando se la compara con la fuerza electromagnética: ésta es un billón de billones de billones de veces más poderosa. Aunque lo que gana en fuerza, lo pierde en universalidad, ya que solamente actúa allí donde hay cargas eléctricas o campos magnéticos. Es la que hace que dos cuerpos con cargas de distinto signo se atraigan y que dos cuerpos con carga de igual signo se rechacen, es la que mueve las limaduras de hierro hacia el imán, la que mantiene a los electrones ligados al núcleo atómico, la responsable de que los átomos se combinen formando moléculas, y que las moléculas se enlacen entre sí.
Pero estas dos fuerzas, solas, no bastarían. En el núcleo de los átomos conviven partículas con cargas de igual signo sin que la fuerza electromagnética que les ordena rechazarse las haga salir disparando unas de otras. Si esto ocurre así, es porque una tercera fuerza, más poderosa aún que la electromagnética, brilla en el fondo de la materia y es capaz de vencer el rechazo eléctrico. Es la fuerza nuclear fuerte, cien veces más intensa que la electromagnética, y que ata a los protones y a los neutrones del núcleo atómico entre sí, y que dentro de los neutrones y protones amarra a los quarks las partículas fundamentalísimas que los forman, a las cuales ya nos referiremos. Aunque de corto alcance, e imperceptible fuera del núcleo, gracias a ella éste no se desparrama en un delirio electromagnético. Allí donde haya que juntar dos cargas de igual signo, la fuerza nuclear fuerte es altamente recomendable. Es la más poderosa de las cuatro fuerzas y la que garantiza la estabilidad de la materia.
Y, en fin, hay una cuarta fuerza: la fuerza nuclear débil, que no provoca atracciones ni rechazos, sino que actúa en determinados procesos radiactivos, como la radiación beta (en que los núcleos expulsan electrones a gran velocidad), o hacen a veces estallar un neutrón en un protón, un electrón y un neutrino. Es una fuerza mucho más débil que la nuclear fuerte o que la electromagnética (aunque más potente que la gravitatoria), y, de las cuatro, probablemente la de menor estatus.
Y punto. La fuerza gravitatoria, la electromagnética, la nuclear fuerte y la nuclear débil bastan para explicar todos los fenómenos de la física. Es una realidad bastante simple, sin duda, pero los físicos sueñan con encontrar una superfuerza única que lo explique todo, una Gran Fuerza Unificada de la cual las cuatro existentes sean aspectos parciales. Y aunque esa meta parece estar lejos todavía, algo se ha avanzado en el camino: en 1967 Steven Weinberg y Abdus Salam consiguieron unificar la fuerza electromagnética y la nuclear débil en una sola: la fuerza electrodébil. Fue un enorme paso adelante en la persecución de una teoría unificada.
El núcleo atómico
El vacío, aquella Nada que horrorizaba a la escuela eleática, que para Parménides era el paradigma de lo que «No Es» y que, según Aristóteles —y Descartes— no podía existir, constituye, sin embargo, la forma predominante de existencia en este oscuro agujero que llamamos universo.
No es sólo el vacío de los espacios interestelares, con sus raros átomos flotando en inmensas colmenas de oscuridad donde aparecen de a ratos burbujas del gas de galaxias que da la apariencia al cosmos.
Nada de eso. En lo más íntimo, en el centro mismo de la materia, allí donde uno debería confiar en encontrar lo sólido, el sostén de Lo Que Es, no hay más que espacio vacío. El átomo es sólo un miserable paquete de «casi nada»: prácticamente toda su masa se concentra en el núcleo, y el volumen del núcleo es insignificante en relación al átomo total. Si el núcleo tuviera el tamaño de una nuez colocada en el centro de una cancha de fútbol, los electrones de la primera órbita andarían por las tribunas. Y en el medio, nada. Aunque el núcleo contiene casi toda la materia del átomo, su volumen es un centésimo de millonésimo de millonésimo (0,00000000000001) del volumen total del átomo; apenas una esferita de un diezmilésimo de millonésimo de millonésimo de milímetro de radio.
Pero así como su volumen es mínimo, la densidad del núcleo es impresionante: cien millones de millones de veces la densidad del agua. Una taza de café compactamente llena de núcleos atómicos pesaría mil millones de toneladas.
El átomo coloca a cualquiera frente al vértigo del vacío, eco lejano de aquel horror vacui que tanto daño produjo en su momento: si concentráramos los núcleos de toda la materia de la Tierra en una esfera compacta, no tendría más de cincuenta metros de radio. Si lo hiciéramos con el Sol, obtendríamos un astro de pocos kilómetros de radio (como ocurre, por otra parte, en las estrellas de neutrones). En realidad, si la naturaleza tuviera horror al vacío, como se creyó durante siglos, la naturaleza no podría existir. Parecería más bien que a la naturaleza le encanta el vacío, ya que lo desparrama tan alegre y generosamente que da vértigo.
En fin: el núcleo está compuesto de protones y neutrones. Los protones, para darle identidad. Los neutrones, para aportar fuerza nuclear sin rechazo eléctrico. Los protones se rechazan eléctricamente, aunque se atraen con la fuerza fuerte, que actúa sólo a muy corta distancia. Es como si uno quisiera aproximar dos imanes de igual polo, cada uno de los cuales estuviera embadurnado con un pegamento de buena calidad. Los imanes se rechazarían, sí, pero si uno consiguiera que se tocaran, quedarían pegados, porque la fuerza del pegamento neutraliza el rechazo magnético. Cuando un núcleo es grande y hay muchos protones, la cosa se pone brava, porque el rechazo electromagnético es muy grande y amenaza con hacer un desastre. Y entonces, para eso están los neutrones. Los neutrones agregan fuerza fuerte —agregan pegamento— y refuerzan la cohesión del núcleo al tiempo que, como son neutros, no agregan rechazo eléctrico.
Los protones dan identidad al núcleo, le dan un número atómico y le dan su carga (oportunamente neutralizada por los lejanos electrones). Los neutrones colaboran con la estabilidad, evitando que estalle por efecto de la repulsión electromagnética entre las cargas de igual signo (positivo) de los protones. Además, un neutrón se puede convertir en un protón y viceversa. Si uno agarra un protón, y le agrega un electrón, se transmuta en un neutrón. Si un neutrón emite un electrón (y un neutrino), se transforma en un protón.
El núcleo atómico es todo un mundo, un mundo dinámico donde todo es movimiento y cambio y donde rigen, como en una cárcel, una fábrica o un paraíso, leyes propias. Pero no todos los núcleos son posibles —o mejor dicho, estables—. No cualquier amalgama de protones y neutrones se mantendrá firme. No se pueden juntar treinta protones sin ningún neutrón, o cuatrocientos neutrones y sólo dos protones. Como las especies, no todos los núcleos pueden sobrevivir en la lucha por la existencia. Pero aquí no rige la ley del más apto, sino las estrictas exigencias de la física: para cada número de protones, hay un número óptimo de neutrones que permite que el núcleo esté en el nivel de energía más bajo posible.
Todo, en el mundo, «trata» de alcanzar el nivel de energía más bajo posible y de desprenderse de la energía que le sobra. Una piedra en lo alto de una montaña «trata» de caer y de perder energía potencial. O, si se quiere un ejemplo más prosaico, un chico, cuando está muy excitado, se mueve y molesta a sus padres hasta que agota su energía, se cansa y se duerme. Y como la ley es la ley —y en la naturaleza no hay coimas ni corrupción que permitan esquivarla— cuando un núcleo tiene exceso de neutrones o de protones, no sobrevive. Eso (y no otra cosa) es el fenómeno al que llamamos radiactividad.
Un repaso: la radiactividad
Les voy a contar una leyenda guaraní que acabo de inventar: cuando todos los hombres (y las mujeres también) estuvieron formados, se presentaron ante Guandeí, el dios responsable de esos asuntos y le dijeron: «Fíjate que nos hicieron de manera apresurada, y así algunos tienen muchos brazos y otros ninguno, y algunos tienen dos cabezas y otros marchan con los ojos pelados, y sobran por aquí los ojos, y por allá faltan orejas. ¿No podrías hacer algo más equitativo?». El dios contestó: «No. Ya terminó el momento de la creación y nada puede remediarse». Y los hombres dijeron: «¿Y entonces, que haremos?» Y el dios pensó un poco y contestó: «Inventaré algo para que todo quede en su lugar, y desaparezcan los brazos y las piernas de más, y el mundo esté un poco más ordenado».
E inventó la guerra. Y en las guerras que se sucedieron, se cortaron los brazos y las piernas que sobraban y lentamente las cosas volvieron a la normalidad, si es que eso se puede llamar normalidad.
Algo parecido ocurrió con los núcleos atómicos, pero de manera menos expeditiva, ya que la burocracia del universo, aunque menos personal, es más compleja. Poco después del Big Bang —la explosión que dio origen al Universo— empezaron a formarse los núcleos: hidrógeno, helio y núcleos livianos; luego, apenas se encendieron las primeras estrellas, en su interior se cocinaron los núcleos más pesados. Pero en aquellos tiempos primarios el Universo tenía poca experiencia y los núcleos se formaron casi de cualquier manera, juntando protones y neutrones a la fuerza. Algunos núcleos quedaron con neutrones de más, a otros les faltaron neutrones, los de más allá quedaron con más energía de la que pueden soportar y en su interior las partículas empezaron a agitarse y moverse. Otros núcleos, en fin, tuvieron la suerte de tener la configuración óptima que las leyes de la naturaleza permiten.
Lo cierto es que, inmediatamente, los núcleos inestables —los mal formados— inventaron un mecanismo de corrección: la radiactividad. Del mismo modo que todos los hombres aspiran a la felicidad, todos los núcleos aspiran a la estabilidad y entonces se liberan de las partículas excedentes hasta alcanzar una configuración óptima —y estable—. Y lo hacen desintegrándose. Para conseguir la estabilidad, un núcleo tiene varios caminos. Uno de ellos es emitir una partícula alfa, compuesta de dos protones y dos neutrones (que es un núcleo de helio, dicho sea de paso), con lo cual se liberó de cuatro partículas. Al dejar ir dos protones, el átomo cambia su posición en la Tabla Periódica, descendiendo dos lugares. Con una partícula alfa menos, el núcleo es más estable.
También puede ser que emita una partícula beta, que no es otra cosa que un electrón. Al emitir un electrón, el núcleo se libera de una carga negativa, un neutrón se convierte en protón, y al acceder a esa posición más estable, asciende un lugar en la Tabla Periódica, porque adquiere un protón extra.
O puede emitir rayos gamma, que son simplemente radiación de muy corta longitud de onda: con la emisión gamma, el núcleo simplemente pierde energía y alcanza niveles de energía más bajos y, por lo tanto, más estables. La radiactividad es así: una partícula alfa y se baja dos lugares en la Tabla Periódica, una partícula beta y se sube un escalón, un haz de rayos gamma y uno se queda donde estaba.
Sin embargo, este mecanismo de corrección que el Universo encontró para remediar los errores iniciales cometidos en materia nuclear no es sencillo. Porque cuando un núcleo se desprende de una partícula alfa, pierde dos neutrones y dos protones. Cuando se desprende de una partícula beta, un neutrón se vuelve protón, con lo cual pierde un neutrón y gana un protón. En cualquiera de los dos casos, al modificarse el número de protones, se transforma en un núcleo distinto.
La vida exagerada de un núcleo de uranio
Sigan el itinerario, nada fácil, de un núcleo de uranio 238. Primero, emite una partícula alfa, pierde dos protones, y por lo tanto desciende dos lugares en la Tabla Periódica y se vuelve torio, el elemento 90. Pero aún así, sigue siendo inestable, por lo cual emite una partícula beta, sube un peldaño en la Tabla y se transforma en protactinio. Luego emite otra partícula beta, ¡y vuelve a ser uranio! Pero no el mismo que el original, sino una variante, un isótopo. Naturalmente, no se queda quieto: emite una alfa, baja dos lugares, y hete aquí que se transforma nuevo en torio. Nueva alfa y es radio. Alfa otra vez y es radón, en la casilla 86. Y ya va barranca abajo, como le ocurre a cualquiera que emita muchas partículas alfa. Otra alfa y será polonio, en el lugar 84. Ni corto ni perezoso, nueva alfa y se transforma en plomo, pero una variante inestable del plomo, y en un último estertor emite una partícula beta, trepa un escalón y se convierte en bismuto. Una beta más, nuevo escalón hacia arriba y vuelve ser polonio, y tras una alfa alcanzará el anhelado plomo 206, un núcleo realmente estable. Todas estas idas y vueltas valieron al fin la pena y, feliz, se entregará a las delicias de la estabilidad: allí, como plomo, se quedará para siempre.
Ya lo dice el refrán: uranio eres y en plomo serás tornado.
Pero este nuevo núcleo puede ser inestable también, con lo cual se reinicia el proceso: nueva desintegración, nuevo núcleo y así sucesivamente. Así aparecen verdaderas familias radiactivas que, como las de la mafia, tienen una impresionante coherencia interna, pero también sus idas y vueltas. Una familia radiactiva es algo digno de verse.
Materia y energía
A esta altura de nuestro conocimiento, podemos pensar que en el universo hay solamente dos cosas: materia y energía. Tenemos una idea de lo que es la materia: el brillo del oro, la contundencia del hierro, el carbono que invisible late en el petróleo, el papel y nuestros cuerpos. El mundo de la materia es nuestro mundo: vemos una montaña, vemos el agua, vemos el vapor que se escapa de la ducha, sentimos al aire refrescar la piel. Las estrellas y los árboles, los protones y los pájaros, los electrones y las vísceras son claramente materia. Pero sólo tenemos una idea vaga de lo que es la energía.
El mundo se mueve, cambia, choca, chisporrotea. Y lo que permite que las cosas del mundo se transformen es la energía, que es más difícil y elusiva que la materia. La energía es la capacidad de producir transformaciones: desplazar materia, transformar agua en vapor, subir una roca hasta lo alto de una montaña, mantener encendida una lámpara eléctrica, quemar un leño, caminar.
La historia del hombre es la historia de su relación con la energía y la forma de dominarla. La primera forma primaria de utilización de la energía fue el control del fuego. El siglo XVIII presenció la domesticación del vapor, capaz de mover telares y pistones: el resultado fue la revolución industrial. En el siglo XIX, el motor de explosión produjo la revolución de los transportes. La utilización masiva de la energía eléctrica cambió la vida de la humanidad.
La energía, como la materia, se transforma. En una lámpara eléctrica, la energía eléctrica se transforma en energía luminosa. En las turbinas hidroeléctricas que generaron esa electricidad, la energía cinética del agua que caía por la catarata se transformó en la energía mecánica del movimiento de las turbinas, y esa energía mecánica a su vez se transformó en energía eléctrica. Cuando hierve una pava de agua, la energía calórica entregada por la llama se transforma en energía cinética —de movimiento— de las moléculas del líquido, que se mueven cada vez más rápido y escapan en forma de vapor. El mundo es un escenario donde permanentemente las formas de energía se intercambian. Así como los científicos del siglo XVII pensaban el mundo como un enorme mecanismo que se da cuerda a sí mismo, los físicos del siglo XIX, una vez asentada la idea de energía como concepto estructurante de la física, se imaginaban al mundo como un motor con la energía en el papel del combustible (aunque a diferencia del combustible, la energía no se gasta, sino que se transforma —y si nos ponemos estrictos, el combustible de, digamos, un auto, tampoco se gasta, sino que se transforma en otras cosas—).
A finales del siglo XIX, los científicos estaban muy seguros de saber qué era la energía y de conocer una de sus leyes fundamentales: la primera ley de la termodinámica, que establece que la cantidad de energía presente en el universo es constante, es siempre la misma.
Pero la radiactividad los desconcertó. Las emisiones radiactivas liberaban una cantidad enorme de energía, que obviamente no podía venir de la nada. ¿De dónde salía? Ningún proceso conocido era capaz de producir tanto.
Y es que, en realidad, los científicos no sabían todo sobre la energía. Así se los demostró la Teoría de la Relatividad, en la que Einstein —además de los malabarismos con el espacio y el tiempo— sustituyó la visión dual de materia y energía por una concepción unitaria en que ambas son aspectos diferentes de una misma cosa. Recuerden: decir «materia» y decir «energía» es equivalente, y la estricta medida de la equivalencia está dada por la fórmula E = mc2. Para la Teoría de la Relatividad, la masa no es sino una forma más de la energía.
Pero la fórmula E=mc2 dice más que eso: la presencia del término «c» —la velocidad de la luz, unos 300.000 kilómetros por segundo, para colmo elevada al cuadrado— significa que en realidad cantidades muy modestas de masa equivalen a cantidades muy grandes de energía. Con el equivalente en energía de solamente una tonelada de materia podríamos satisfacer el consumo energético anual del país que más energía devora en el mundo: los Estados Unidos.
La verdad es que la fórmula de equivalencia entre la masa y la energía fue una sorpresa fenomenal. Pero, así y todo, el mundo de las partículas todavía iba a deparar bastantes sorpresas más: si los físicos pensaban que con el protón, el neutrón y el electrón habían llegado a descifrar la estructura de la materia, estaban equivocados.
Una de las grandes sorpresas fue la antimateria.
Las unidades en que se mide la energía
La unidad que se usa habitualmente es el joule –como homenaje a James Prescott Joule, uno de los descubridores de la ley de conservación de la energía—. Como el kilo, el metro y el segundo, un joule es solamente una unidad: es la energía que cuesta aplicar una fuerza de un kilo a lo largo de diez centímetros, o la que se necesita para que un cuerpo de un kilo que está quieto, alcance, en un segundo, una velocidad de un metro por segundo.
Es poco, realmente: encender un fósforo implica una energía de cuatro mil joule; caminar durante una hora requiere 1 millón de joule. Una tonelada de TNT que explota involucra cuatrocientos millones. La bomba de Hiroshima, ochenta millones de millones; la erupción de un volcán, un millón de billones.
Una bombita de cien watt, prendida durante una hora, consume cien joule. Una copa de leche nos entrega 159 calorías, equivalentes a 670 mil joule. La bomba de Hiroshima liberó una energía equivalente a 12 mil millones de copas de leche.
Un átomo de uranio que se parte libera solamente una cienmilésima de una millonésima parte de un joule. Parece muy poco, pero en un gramo de uranio hay muchísimos átomos. Un hombre joven necesita unas 3.000 calorías por día, que el cuerpo transforma en movimiento y calor.
¿Qué es esa cosa llamada «antimateria»?
Para saber un poco qué es esa cosa curiosa llamada «antimateria», tenemos que hablar de Paul Dirac (1902-1984). Nació en Inglaterra, donde estudió ingeniería eléctrica con una fuerte formación matemática y física, y pronto se encaminó a Cambridge, la gloriosa Meca de la física donde reinaba Su Majestad Rutherford.
En Cambridge, Dirac colaboró en la edificación de la mecánica cuántica (cuyas líneas maestras trazaban Heisenberg y Schrödinger) y en 1927 encontró una ecuación que describía el comportamiento del electrón pero respetando los principios de la Teoría de la Relatividad.
La ecuación de Dirac pareció milagrosa a los físicos, en gran parte porque predecía un montón de resultados experimentales, pero también porque había sido una deducción a partir de los primeros principios, a la manera de Newton. Pero el fruto más espectacular de la ecuación «milagrosa» todavía estaba por venir.
Y es que enseguida Dirac se dio cuenta de que la ecuación milagrosa no tenía una sino dos soluciones posibles, del mismo modo que una raíz cuadrada tiene dos resultados posibles (la raíz cuadrada de cuatro, por ejemplo, tiene como soluciones a 2 y a –2). Uno de los resultados correspondía a una partícula de carga negativa y otro a una de carga positiva. Con la partícula de carga negativa no había ningún problema, ya que era el electrón. Pero… ¿y la otra solución? ¿A qué partícula podía corresponder?
«Al protón», pensó Dirac. Corría el año 1930 y se conocían solamente dos partículas elementales: el electrón —de carga negativa— y el protón, de carga positiva. Era natural que Dirac pensara lo que pensó.
Pero la verdad es que había algo malo: el protón no encajaba del todo como contrapartida del electrón, aunque más no fuera por la enorme superioridad de su masa. Que el protón, tan diferente en realidad del electrón, fuera su contrapartida positiva hería la delicada debilidad que los físicos (y acaso la naturaleza) tienen por la simetría. Si no era el protón, hacía falta una partícula de carga positiva, pero más parecida al electrón: en 1931 Dirac dio marcha atrás con su propuesta protónica y sugirió que esa solución extraña correspondía a una partícula exactamente igual al electrón en todo, salvo en un «detalle»: su carga, que sería positiva. Una especie de «antielectrón».
Era una predicción teórica, una conjetura, y nada más. Pero a veces las conjeturas parecen tener vida propia: en septiembre de 1932 Carl D. Anderson, un joven físico experimental del Instituto de Física de California, envió a la revista Science un artículo donde contaba que, estudiando los rayos cósmicos, había encontrado «una partícula cargada positivamente y con una masa comparable a la del electrón». Increíblemente, era el «antielectrón» imaginado teóricamente por Dirac, al que le fue concedido el no demasiado original nombre de «positrón». Su descubridor fue el primer hombre que vio «antimateria», que de manera sutil había hecho su aparición en un mundo muy seguro de su materialidad.
Después, naturalmente, la antimateria arreció. En 1955 se vio por primera vez el antiprotón y, casi inmediatamente, el antineutrón. En los grandes aceleradores se logró producir átomos de antihidrógeno: un antielectrón girando alrededor de un antiprotón. En realidad, hoy en día todas las partículas tienen su correspondiente antipartícula. Una partícula sin antipartícula perdería instantáneamente toda consideración social, sería expulsada de los círculos selectos, las asociaciones y los clubes de partículas.
¿Pero qué quiere decir «antipartícula»? ¿Por qué el electrón y el positrón, el protón y el antiprotón, el neutrón y el antineutrón son «anti», cada uno del otro, en vez de tratarse sencillamente de dos pacíficas partículas diferentes?
¿Por qué esa oposición irremediable? La respuesta es triste pero verdadera: ante todo, las partículas y sus respectivas antipartículas son idénticas, salvo en su carga eléctrica, cuando la hay. Y también difieren en algo que llama «spin», y que gruesamente —muy gruesamente— puede interpretarse como la capacidad de rotar sobre sí misma. Y esta diferencia dista de ser superficial: una danza y una contradanza pueden sucederse sin inconvenientes; en El Arte de la Fuga, el infinito Johann Sebastian Bach nos muestra extrañas composiciones en espejo (fugas y contrafugas) y el conjunto es maravilloso. Pero entre la materia y la antimateria no puede haber ninguna clase de componendas. Cuando una partícula y una antipartícula entran en contacto, ¡adiós! Sencillamente se aniquilan: desaparece toda materialidad y se volatilizan en un torrente de radiación gamma.
Es posible también el proceso inverso: en cualquier laboratorio de medicina nuclear un rayo gamma emitido por el cobalto 60 choca, de repente, con un átomo de plomo. Y entonces la energía del rayo gamma se materializa en un electrón y un antielectrón.
De modo que la antimateria existe, sí, y aunque las antipartículas son altamente evanescentes (en muy poco tiempo chocan contra la materia y se aniquilan), prestan una notable contribución a la medicina, por ejemplo con la Tomografía de Emisión de Positrones.
Y si la materia y la antimateria no se aniquilan en gran escala, destruyendo el universo, es solamente porque hay muy poca antimateria. Sólo por eso. Y si hay poca antimateria es porque ya hubo una aniquilación a escala cósmica: fue en los tempranos momentos del universo, en los cuales un ligero exceso de la materia sobre la antimateria nos salvó (o mejor dicho: nos permitió) la vida.
Un personaje extraño: el neutrino
Ésta es una historia que se parece a la de Dirac y el positrón. La desintegración radiactiva, en especial la desintegración beta, tenía un serio problema: al final del proceso había siempre un poco menos de energía que al principio, de modo que el balance energético no se equilibraba. Una cierta cantidad de energía se esfumaba por completo, violando el sacrosanto principio de conservación. ¿Qué ocurría con la energía faltante? Algo había que hacer al respecto, y fue entonces cuando apareció en escena Wolfang Pauli, otro de los héroes de la «época de oro» de la física, ese período entre 1900 y 1940 en el cual se logró —o se creyó que se logró— desentrañar la estructura del átomo.
Pauli había nacido en Viena en 1900, estudiado con el gran físico Sommerfeld en Munich y, en 1925, había anunciado su Principio de Exclusión, que permitía explicar ya no cómo sino por qué los electrones de un átomo se distribuyen en capas superpuestas y producen las propiedades químicas de los elementos de la Tabla Periódica y que en otro relato merecería un capítulo entero, pero que por su dificultad lo saltearé. Lo cierto es que es uno de los basamentos en los que se apoya la física nuclear y atómica.
Pero no es ésa la causa por la que entra en escena aquí sino, como sospecharán, por haber contribuido a disipar el misterio de la energía desaparecida durante la emisión beta. En 1931, Pauli sugirió que durante la desintegración beta se emitía otra partícula, sin carga y tal vez sin masa. La energía de esa partícula —dijo Pauli— era justamente la que estaba «faltando». Lo pongo entre comillas porque en realidad no faltaba: se utilizaba para emitir una partícula a la que se llamó «neutrino», que significa «pequeña cosa neutra».
El neutrino, así planteado, no era más que una construcción teórica de propiedades realmente sorprendentes: un neutrino puede atravesar la Tierra de lado a lado con la misma facilidad con que un rayo de luz atraviesa un vidrio. La interacción de los neutrinos con la materia ordinaria es mínima, casi ridícula: mientras yo escribo esto (y ustedes lo leen) estamos siendo atravesados por cientos de miles de millones de neutrinos, que siguen su camino tan campantes sin prestarnos la más mínima atención.
Una partícula tan escurridiza, obviamente, es casi imposible de detectar. Pero en 1956 se intentó un experimento que resultó exitoso: se trató de pescar neutrinos en lo profundo de una mina de Dakota del Sur, Estados Unidos, esperando que algunos de esos cientos de miles de millones de ellos interactuaran con el material contenido en tanques dispuestos con ese fin. Por supuesto, se utilizaron instrumentos ultrasensibles y las nuevas partículas fueron, efectivamente, detectadas: los instrumentos midieron la incidencia de algunos neutrinos, confirmando así de manera experimental la predicción de Pauli.
En contra de lo que se pensó al principio, el neutrino tiene masa, y, es más, hay tipos de neutrinos.
Dicho sea de paso, Pauli no era tan afortunado con todas sus predicciones. En 1933, el día siguiente del incendio del Reichstag que proyectó a Hitler al poder absoluto, hubo una reunión en Gotinga. Varios físicos, entre los cuales se encontraba Edward Teller (que más tarde sería el cerebro de la bomba de hidrógeno norteamericana) discutieron la situación política de Alemania. Pauli declaró enfáticamente que la idea de una dictadura en Alemania era un disparate: «He visto una dictadura en Rusia; en Alemania simplemente no puede suceder».
Ensaladas de partículas
La verdad es que cuando los neutrones entraron en escena pareció que hasta ahí se llegaba y que el problema de la estructura de la materia había encontrado una solución permanente: estaba hecha de átomos, a su vez formados por neutrones, protones, electrones. Y punto. No era la idea de Dalton o Demócrito, para quienes los átomos eran las partículas verdaderamente elementales, pero era así. Si se lo pensaba bien, era incluso mejor: en lugar de muchas clases de átomos, había sólo tres partículas verdaderamente elementales que, en sus múltiples combinaciones, formaban todo lo que había. Demócrito hubiese estado contentísimo.
Pero la naturaleza no respeta las decisiones humanas, ni siquiera las de alguien tan grande y genial como Demócrito: en la misma década del treinta, el análisis de la materia, los bombardeos con partículas, el uso de los inmensos aceleradores y demás yerbas fueron ampliando cada vez más el menú de las partículas elementales, hasta formar una verdadera e insoportable selva: piones, kaones (en tres versiones: positivos, negativos y neutros), muones, partículas tau, tres tipos de neutrinos y una larguísima lista (cada uno con su antipartícula, además).
El panorama empezaba a complicarse de tal modo que crecieron los suspiros por un orden subyacente. Al fin y al cabo, pensaban los físicos de partículas, la naturaleza nunca es tan complicada (lo cual, desde ya, es una creencia, pero una creencia que al fin y al cabo sostiene buena parte del impulso científico y que hasta ahora ha dado resultado). Como cuenta el físico León Lederman: «En los 30, a quien descubría una nueva partícula elemental se le daba el Premio Nobel. En los 50, se lo maldecía».
Los quarks
Three quarks for Muster Mark!
Sure he has not got much of a bark
And sure any he has it’s all beside the mark.
JAMES JOYCE, Finnegans Wake
Y así fue como en los años sesenta, Murray Gell-Mann (n. 1929) y George Zweig (n. 1937) presentaron una propuesta: la existencia de entidades aun más fundamentales y todavía más chicas que los neutrones y los protones, a los que Gell-Mann llamo quarks (en honor a una frase irónica de James Joyce en Finnegans Wake). Había en la naturaleza—según ellos—, tres tipos de quarks, a los que se les pusieron extraños nombres: los quarks «up» (arriba), los quark «down» (abajo) y los quark «strange» (extraño). Las combinaciones entre ellos daban cuenta de todas las partículas conocidas hasta el momento: dos quarks up y uno down formaban un protón; dos down y uno up, un neutrón; los mesones y piones se formaban con dos quarks.
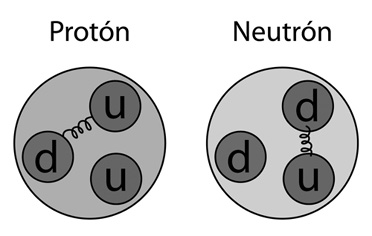
UN PROTÓN Y UN NEUTRÓN CON SUS TRES RESPECTIVOS QUARKS
El electrón y su no muy numerosa familia (en la cual se cuentan los muones, la partícula tau y unos tipos específicos de neutrinos), en cambio, eran los únicos que no estaban compuestos por quarks y que parecían verdaderamente elementales.
Gell-Mann, como siempre, se cuidó de aclarar que sus quarks eran entidades meramente especulativas, objetos matemáticos, pero (también como siempre, o como casi siempre) en 1968, los físicos del gran Acelerador Lineal de Stanford, bombardeando protones (una operación a escala aún más reducida del famoso experimento de Rutherford), comprobaron que dentro del protón había, efectivamente, tres partículas más pequeñas. La rueda no se detuvo allí, y fueron apareciendo nuevos e insospechados quarks: hoy se conocen seis (y sus respectivos antiquarks, claro está).
La verdad es que se había recorrido un largo camino desde aquellos primitivos átomos de tierra, agua, aire y fuego de Empédocles que se unían simplemente por «amor» y «discordia».
El modelo estándar
La experiencia de todo un siglo y los quarks de Gell-Mann permitieron construir lo que hoy se llama el «modelo estándar», que refleja lo más profundo que se llegó a conocer sobre la estructura de la materia.
Y es así: la materia observable, una molécula de agua, un fragmento de ADN o un caballo, está formada básicamente por átomos que miden un diezmillonésimo de milímetro de diámetro. A su vez, los átomos están formados por electrones que giran muy lejos de un núcleo central, de diámetro diez mil veces más chico, de un cienmilésimo de millonésimo de milímetro. Pero el núcleo está formado por protones y neutrones diez veces más diminutos (menos de un millonésimo de millonésimo de milímetro). Y esos protones y neutrones a su vez están formados por partículas más de cien mil veces más pequeñas: los quarks, de menos de un cienmilésimo de millonésimo de millonésimo de milímetro de diámetro.
Los seis tipos distintos de quarks, combinados de a tres o de a dos, pueden dar una variedad enorme de otras partículas intermedias, como los mesones y los piones.
Por otro lado están los leptones, que no están formados por quarks: el electrón, el muón (una especie de electrón más pesado), la partícula tau, y tres clases de neutrinos, que aparentemente sí son elementales.
Pero con esto no alcanza: hay que agregar las partículas que transportan las cuatro fuerzas que mantienen a los trocitos de materia unidos y sin las cuales quarks y leptones flotarían sueltos por el universo y nunca podría llegarse a estructuras más complejas como un protón, un átomo, una molécula, este libro o su lector.
La interacción fuerte, la débil, el electromagnetismo y la gravitación funcionan, hasta donde se sabe, a través de partículas, aunque una de ellas, la que transportaría la fuerza de gravedad (el graviton) aun no pudo ser detectada a pesar de los tremendos esfuerzos por hacerlo.
El modelo estándar podría parecer simple (o mejor dicho, ordenado). Claro, siempre y cuando no hubiera nada más. Pero extrañamente, en un mundo que parece amar la simplicidad, aparecen de manera constante y fugaz otras partículas huidizas, aunque la gran mayoría tiene una estabilidad tan endeble que si logran crearse espontáneamente no sobreviven en los laboratorios más que unas pocas fracciones de segundos (en el mejor de los casos).
En apariencia, hasta aquí se llegó y es lo último que se puede encontrar en el interior de la materia. Así y todo, para que el modelo estándar cerrara de manera definitiva (como si tal cosa fuera posible en el campo de la ciencia) faltaba algo: la famosa partícula divina.
Las tres generaciones de la Materia (Fermiones)
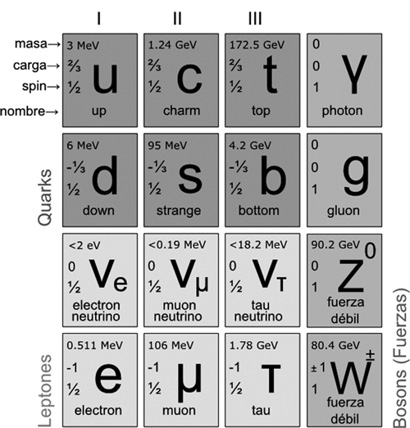
TABLA DE PARTÍCULAS ELEMENTALES