8. De que são feitas as coisas
QUANDO CHEGUEI À ADOLESCÊNCIA, fiquei intrigado com dois tipos bem diferentes de abordagens científicas acerca dos segredos do Universo. Comecei a ouvir boatos estranhos sobre o que os físicos faziam, suas descobertas das leis quânticas, que pareciam dizer que eu estava em dois lugares ao mesmo tempo. Tive dúvidas de que essas afirmações se aplicassem à vida real. Mas também ouvi falar sobre outros tipos de segredo, aqueles que os químicos procuravam, mais pé no chão, segredos violentos e perigosos que pareciam ter pouco a ver com uma chave mestra do Universo, mas que apelavam para meu senso de aventura e prometiam me proporcionar o tipo de poder que a gente não tem quando é criança. Logo eu estava misturando amoníaco com tintura de iodo, perclorato de potássio com açúcar, pó de zinco com nitrato e cloreto de amoníaco – e explodindo coisas. Arquimedes disse que, se tivesse uma alavanca longa o bastante, conseguiria mover o mundo; eu acreditava que, com as substâncias químicas domésticas apropriadas, poderia explodir o mundo. Esse é o poder de compreender as substâncias ao nosso redor.
Os primeiros pensadores científicos do mundo pavimentaram o caminho para essas duas linhas de investigação nos procedimentos do mundo real. Eles perguntaram o que causava a mudança, descobriram do que as coisas eram feitas e como suas composições determinam suas propriedades. Aristóteles apresentou o mapa da mina para as duas coisas, mas os caminhos propostos se revelaram becos sem saída.
Newton e seus predecessores percorreram uma longa via em direção ao entendimento da questão da mudança. Newton ainda tentou entender a ciência da matéria, mas nem de longe era um químico tão genial quanto era físico. O problema não foi de uma deficiência de seu intelecto nem o fato de ter trilhado o longo caminho sem saída da alquimia. O que o restringiu foi que, apesar de a química – a ciência da substância – evoluir junto com a física – a ciência da mudança –, elas são duas ciências com características bem diferentes. A química é mais suja, mais complicada, e explorá-la – como ele fez com a mudança – exigia o desenvolvimento de inúmeras inovações tecnológicas. A maioria ainda não havia sido inventada no tempo de Newton. Consequentemente, Newton ficou bloqueado, e faltou na química uma figura de destaque que catapultasse a ciência (e a si mesma) à grandiosidade. Por isso, o desenvolvimento da química foi mais gradual, com diversos pioneiros dividindo a ribalta.
A história de como a humanidade descobriu do que as coisas são feitas mora no meu coração, pois a química foi o meu primeiro amor. Fui criado num pequeno apartamento dúplex em Chicago, com aposentos pequenos e atulhados, mas com um grande porão onde consegui construir minha Disneylândia particular no meio da bagunça – um sofisticado laboratório com várias prateleiras cheias de potes, lindos pós coloridos e frascos com os mais potentes ácidos e álcalis.
Algumas substâncias eu precisava obter ilegalmente ou com a ajuda involuntária dos meus pais (“Se eu tivesse um galão de ácido muriático poderia limpar aquele xixi de gato do piso”). Sem me importar em ter de apelar para esses truques, descobri que estudando química eu podia aprender a criar fogos de artifício legais e ao mesmo tempo saciar minha curiosidade a respeito do mundo. Assim como Newton, suponho, também percebi que tinha uma série de vantagens em relação às minhas tentativas de levar uma vida social. É mais fácil arranjar substâncias químicas que amigos, e elas nunca diziam que não podiam sair ou que precisavam lavar a cabeça quando eu queria brincar; ou, com menos delicadeza, que não queriam se associar a tipos esquisitos como eu. No final, porém, como acontece com muitos primeiros amores, eu e a química nos separamos. Comecei a flertar com outro assunto, a física. Foi então que aprendi que diferentes áreas da ciência não apenas se concentram em diferentes questões, mas também têm diferentes culturas.
A diferença entre a física e a química transpareceu claramente com os diversos erros que cometi. Aprendi bem depressa, por exemplo, que se meus cálculos físicos acabassem se reduzindo à equação “4 = 28”, isso não significava que eu tinha descoberto alguma verdade profunda até então desconhecida, mas que tinha cometido algum erro. Mas era um erro inofensivo, um equívoco que só existia no papel. Na física, esses vexames quase sempre levam a absurdos matemáticos benignos, ainda que frustrantes. Na química é diferente. Meus equívocos na química tendiam a produzir grandes quantidades de fogo e fumaça, além de queimaduras de ácido na pele que me deixaram cicatrizes ao longo de décadas.
Meu pai caracterizava as diferenças entre a física e a química de acordo com duas pessoas que conhecia e que chegavam mais perto de praticá-las. O “físico” era o homem do campo de concentração – na verdade, um matemático – que explicava como resolver um enigma matemático em troca de pão. O homem que ele chamava de “químico” era alguém que tinha conhecido na resistência judaica, antes de ser deportado para Buchenwald.a1
Meu pai tinha feito parte de um grupo que planejava sabotar a ferrovia que passava pela sua cidade, Czestochowa. O químico disse que poderia descarrilar o trem com um explosivo colocado estrategicamente nos trilhos, mas era preciso escapar do gueto judeu para ir atrás de algumas substâncias, que ele afirmava poder roubar ou obter com subornos. Foram diversas saídas, mas ele não voltou de sua última missão e nunca mais ninguém soube dele.
O físico, segundo meu pai me contou, era um homem calado e elegante, que se refugiou dos horrores do campo da melhor forma para ele: retirando-se em seu mundo interior. O químico tinha a personalidade de um caubói arrebatado e sonhador, que se atirava de cabeça para entrar em ação no confronto contra o caos do mundo. Esta, segundo a avaliação do meu pai, era a diferença entre a química e a física.
Era verdade que, ao contrário dos primeiros físicos, os primeiros químicos precisavam ter certa coragem natural, pois explosões acidentais eram um risco de seu ofício, bem como envenenamentos, pois era costume experimentar as substâncias para ajudar a identificá-las. Talvez o mais famoso entre os primeiros experimentalistas tenha sido o químico e farmacêutico sueco Carl Scheele. Mesmo sendo o primeiro químico a produzir o gás clorídrico, tremendamente corrosivo e venenoso, Scheele conseguiu sobreviver. Conseguiu também, de uma forma meio miraculosa, descrever com precisão o sabor do cianureto de hidrogênio, gás extremamente tóxico, sem morrer por causa disso. Mas Scheele sucumbiria em 1786, aos 43 anos, de uma doença que se suspeita ter sido sequela de envenenamento agudo por mercúrio.2
Num nível mais pessoal, me pareceu que a diferença entre a química e a física refletia a diferença entre mim e meu pai. Quando o químico não voltou de sua última missão, meu pai e quatro outros conspiradores prosseguiram com o plano, usando somente instrumentos manuais – “todos os tipos de chave de fenda”, ele me explicou – em lugar de explosivos, na tentativa de deslocar os trilhos do trem.3 As coisas desandaram quando um dos sabotadores entrou em pânico e atraiu a atenção de oficiais da SS que estavam por perto. O resultado foi que só meu pai e outro sabotador conseguiram escapar vivos – deitando-se nos dormentes, escondidos, enquanto um longo comboio passava por cima deles. Eu, por outro lado, raramente exercia qualquer ação relevante no mundo exterior, limitando-me a calcular as consequências das coisas rabiscando equações no papel.
O abismo entre a física e a química reflete tanto as origens quanto as culturas das duas disciplinas. Enquanto a física começou com a teorização mental de Tales, Pitágoras e a Aristóteles, a química nasceu no quarto dos fundos de mercadores e na toca escura dos alquimistas. Embora praticantes das duas disciplinas fossem motivados pelo puro desejo de saber, a química também tinha raízes na prática – às vezes no desejo de melhorar a vida das pessoas, às vezes na ambição. Existe nobreza na química, a nobreza da busca de conhecer e conquistar a matéria; mas também sempre existiu o potencial para grandes lucros.
AS TRÊS LEIS DO MOVIMENTO que Newton descobriu eram de certa forma simples, ainda que ocultadas pela névoa do atrito, da resistência do ar, da invisibilidade e da força da gravidade. A química, no entanto, não é regida por um conjunto de leis análogas às três leis universais do movimento de Newton. Ela é muito mais complicada. A ciência química teve de ir separando as coisas gradualmente.
A primeira descoberta a ser feita foi a de que algumas substâncias – os elementos – são fundamentais, enquanto outras são compostas de várias combinações de elementos. Isso foi reconhecido intuitivamente pelos gregos. Segundo Aristóteles, por exemplo, um elemento é “um desses corpos em que outros corpos podem ser decompostos e que não é capaz de ser decomposto em outros”.4 Ele identificou quatro elementos: terra, ar, água e fogo.
É óbvio que muitas substâncias são feitas de outras substâncias. Sal mais água produz água salgada; ferro mais água forma ferrugem; vodca e vermute resultam num martíni. Por outro lado, podemos decompor muitas substâncias, em geral aquecendo-as. Por exemplo, quando aquecido, o calcário se transforma em cal e um gás, o dióxido de carbono. O açúcar gera carbono e água. Esse tipo de observação ingênua, porém, não vai muito longe, pois não é uma descrição universalmente aplicável do que acontece. Por exemplo, se você aquecer água, ela vai virar gás, mas esse gás não é quimicamente diferente do líquido; ele apenas tomou uma forma física diferente. O mercúrio, quando aquecido, também não se divide em seus componentes, pelo contrário – combina-se com o oxigênio invisível do ar e forma um composto de óxido metálico.
E ainda existe a combustão. Imagine a madeira queimando. Quando queima, a madeira se transforma em fogo e cinzas, mas seria errado concluir que a madeira é feita de fogo e cinzas. Ademais, contrariando a classificação de Aristóteles, o fogo não é uma substância, mas luz e calor emitidos quando outras substâncias passam por uma reação química. O que realmente é emitido na queima da madeira são gases invisíveis – principalmente dióxido de carbono e vapor d’água, junto com mais de uma centena de gases. Os antigos não tinham nada da tecnologia que permite coletar esses gases, muito menos separá-los e identificá-los.5
Desafios desse tipo tornaram difícil determinar de que são feitas duas ou mais substâncias e quais eram as fundamentais. Como resultado dessa confusão, muitos antigos, como Aristóteles, identificaram erroneamente água, fogo etc. como elementos fundamentais, mas não reconheceram como tal os sete elementos metálicos que já conheciam – mercúrio, cobre, ferro, chumbo, estanho, ouro e prata.
Assim como o nascimento da física dependeu de inovações matemáticas, o nascimento da verdadeira química teve de esperar certas invenções tecnológicas – equipamentos para pesar substâncias com precisão, medir o calor absorvido ou emitido nas reações, determinar se uma substância é ácida ou alcalina, para captar, evacuar e manipular gases e para aferir temperatura e pressão. Somente com esses avanços, nos séculos XVII e XVIII, os químicos começaram a desemaranhar os fios retorcidos de seu conhecimento e a desenvolver maneiras frutíferas de pensar sobre as reações químicas. É um testemunho da perseverança humana, contudo, o fato de que, mesmo antes do surgimento dessas técnicas, aqueles que se dedicavam ao comércio nas cidades antigas tenham reunido conhecimentos em diversos campos como tintura, fabricação de perfumes, de vidros, na metalurgia e no embalsamamento.
O EMBALSAMAMENTO FOI o primeiro. Nesse domínio, os primórdios da ciência química podem ser rastreados até Çatalhöyük, onde, embora não embalsamassem os mortos, eles chegaram a desenvolver uma cultura da morte e um jeito específico de lidar com os mortos. Nos tempos do antigo Egito, uma crescente preocupação com o destino dos mortos levou à invenção da mumificação. Acreditava-se que ela fosse a chave para uma feliz vida após a morte – e decerto nenhum cliente exigente voltou para reclamar. Daí surgiu a demanda por agentes embalsamadores. Uma nova indústria nasceu, segundo as palavras da DuPont, buscando coisas melhores para uma vida melhor após a morte, por meio da química.
O mundo sempre teve seus sonhadores, e entre eles os felizes indivíduos que realizam seus sonhos, ou ao menos ganham a vida correndo atrás deles. Os membros do segundo grupo não se destacam necessariamente pelo talento ou o conhecimento, mas pelo trabalho empenhado. Deve ter sido um sonho dos empreendedores e inovadores egípcios enriquecer com o aperfeiçoamento de processos de embalsamamento, pois eles investiam longas e árduas horas nessa tarefa. Com o tempo, por meio de grandes sequências de tentativa e erro, os embalsamadores egípcios aprenderam a utilizar uma potente combinação de sais de sódio, resinas, mirra e outros conservantes que protegiam os corpos da decomposição – tudo descoberto sem qualquer conhecimento acerca dos processos envolvidos nem do que faz um corpo apodrecer.
Como o embalsamamento era um negócio, não uma ciência, suas descobertas eram tratadas mais como receitas de produtos de sucesso que como teorias, e eram segredos muito bem guardados. Como a arte de embalsamar estava associada aos mortos e ao mundo pós-vida, os praticantes dessa arte vieram a ser considerados magos ou feiticeiros. Com o tempo, outras profissões secretas se desenvolveram, gerando conhecimentos sobre minerais, óleos, extratos de flores, raízes e vagens de plantas, vidro e metais. Aqui, na protoquímica praticada pelos mercadores, estavam as origens da cultura mística e misteriosa da alquimia.
Na condição de grupo, os praticantes dessa atividade reuniram um extenso corpus de conhecimentos especializados porém desconexos. Esse diversificado conjunto de conhecimentos técnicos afinal se cristalizou num campo de estudo unificado quando o grego Alexandre o Grande fundou sua capital egípcia, Alexandria, na foz do Nilo, em 331 a.C.
Alexandria era uma cidade arrojada, com edificações elegantes e avenidas de muitos metros de largura. Algumas décadas depois de sua fundação, o rei grego do Egito, Ptolomeu II, construiu sua joia da coroa cultural, o Museu. Diferente dos museus modernos, o Museu não expunha artefatos, mas abrigava mais de uma centena de cientistas e estudiosos, que recebiam um estipêndio do Estado, casa e comida de graça, preparada na cozinha da instituição. Associada ao Museu havia uma grande biblioteca de meio milhão de pergaminhos, um observatório, laboratórios para dissecação, jardins, um zoológico e outras instalações de pesquisa. Esse era um glorioso centro de exploração do conhecimento, um monumento vivo e funcional para a busca humana de conhecimento. Foi o primeiro instituto de pesquisa do mundo, desempenhando o mesmo papel que mais tarde a universidade iria ter na Europa, embora, infelizmente, estivesse condenado à destruição pelo fogo no século III d.C.6
Alexandria logo se tornou uma meca da cultura e, em alguns séculos, a maior e mais importante cidade do mundo. Ali, diversas teorias dos gregos sobre matéria e mudança se cruzaram com toda a abrangência da vocação química egípcia. Esse encontro de ideias mudou tudo.
Antes da invasão dos gregos, durante milênios, o conhecimento dos egípcios acerca das propriedades das substâncias havia sido puramente prático. Mas agora os físicos gregos dispunham de uma estrutura teórica para fornecer aos egípcios um contexto para seus conhecimentos. Em especial, a teoria da matéria de Aristóteles propiciou uma explicação para a maneira como as substâncias mudavam e interagiam. A teoria de Aristóteles, claro, não estava certa, mas inspirou uma abordagem mais unificada da ciência das substâncias.
Um dos aspectos da teoria de Aristóteles foi especialmente influente: suas ideias sobre a transformação das substâncias. Vamos considerar o processo de ebulição. Aristóteles julgava que o elemento água tinha duas características essenciais: a de ser molhada e fria. Por outro lado, ele classificava o elemento ar como molhado e quente. A fervura, de seu ponto de vista, era o processo em que o elemento fogo atuava para converter a frieza da água em calor, e portanto transformar a água em ar. Pressentindo um potencial lucrativo nesse conceito, os egípcios quiseram forçar a barra: se a água podia ser transformada em ar, não seria possível transformar algum material inferior em ouro? De certa forma como a minha filha Olivia, que, ao saber que poderia ganhar um dólar da fada do dente se deixasse seu dente de leite embaixo do travesseiro, imediatamente perguntou: “E quanto eu poderia ganhar pelas pontinhas das minhas unhas cortadas?”
Os egípcios notaram que o ouro, a exemplo dos elementos fundamentais de Aristóteles, parecia apresentar algumas características essenciais: é um metal, dúctil e amarelo. Só o ouro apresenta todas essas características, mas elas podem ser encontradas em muitas substâncias, em diferentes combinações. Não seria possível encontrar um jeito de transferir propriedades entre as substâncias? Em especial, se o processo de ebulição permitia a utilização do fogo para alterar a propriedade física da água, transformando-a em ar, talvez houvesse um processo análogo pelo qual se transformasse uma combinação de substâncias metálicas, amarelas e dúcteis em ouro.
Como resultado dessas considerações, por volta do ano 200 a.C. os primeiros sinais de uma verdadeira compreensão da química se mesclaram com ideias da filosofia grega, e a antiga protoquímica de embalsamamento, metalurgia e outras propostas práticas originaram uma abordagem unificada da transformação química. Assim nasceu a alquimia, com o objetivo central de produzir ouro e também um “elixir da vida” que garantisse a eterna juventude.
Historiadores debatem quando exatamente nasceu a ciência da química, mas a química não é alfafa, portanto, a data desse florescimento é mais uma questão de opinião que de fatos exatos. Uma coisa que ninguém pode discutir, porém, é que a alquimia teve um propósito útil: a química, quando chega à sua manifestação moderna, é a ciência que se originou das artes e do misticismo daquelas antigas disciplinas.
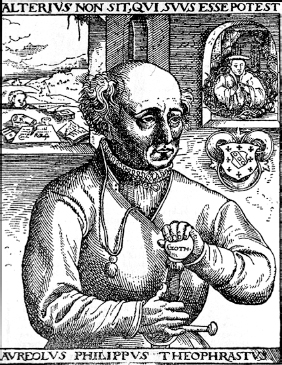
O PRIMEIRO EMPURRÃO orientando o feitiço da alquimia para os métodos científicos veio de um dos mais peculiares personagens da história do pensamento humano. Nascido num pequeno vilarejo hoje pertencente à Suíça, Theophrastus Bombastus von Hohenheim (1493-1541), aos 21 anos, foi mandado pelo pai à Alemanha a fim de estudar metalurgia e alquimia, mas depois alegou ter se formado em medicina e adotou essa profissão. Ainda com pouco mais de vinte anos adotou o nome de Paracelso, ou “maior que Celso”, médico romano do século I d.C. muito popular no século XVI. Com a mudança, conseguiu deixar de se chamar Bombastus, mas houve algo mais que bombástico na mudança: Paracelso queria trombetear seu desdém pelo método então corrente na medicina. Demonstrou o descaso de forma bem explícita quando, na reunião com estudantes numa fogueira tradicional de verão, jogou nas chamas, junto com um punhado de enxofre, a obra do conceituado médico grego Galeno.
A oposição de Paracelso a Galeno era a mesma expressada por Galileu e Newton contra Aristóteles: o trabalho do médico grego havia sido invalidado por observações e experiências posteriores. Em particular, Paracelso estava convencido de que a ideia tradicional de que a doença era causada pelo desequilíbrio de misteriosos fluidos corpóreos, chamados humores, não resistira ao teste do tempo. Ele julgava que as doenças eram ocasionadas por agentes externos – e que essas causas podiam ser tratadas com drogas adequadas.
Foi a busca dessas “drogas adequadas” que levou Paracelso a tentar transformar a alquimia. O campo já tinha dado bons frutos, como a descoberta de novas substâncias – sais metálicos, ácidos minerais e o álcool –, mas Paracelso queria que a procura de ouro fosse abandonada em favor do objetivo mais importante de criar substâncias que atuassem no laboratório orgânico e curassem doenças específicas. Tão importante quanto isso era o desejo de reformular os métodos alquímicos, que ele considerava imprecisos e negligentes. Sendo bom marqueteiro, além de estudioso, Paracelso inventou um novo nome para sua versão repaginada da alquimia. Ao substituir o prefixo árabe al (que significa “o”) pela palavra “medicina” em grego, iatro, ele criou o termo iatroquimia. Isso é um “palavrão”, e pode ser esta a razão de logo ter sido abreviado para quimia, a base da palavra “química”.
Paracelso em cópia de retrato (original perdido do século XVII) feito pelo pintor flamengo Quentin Massys (1466-1529).
Mais tarde, as ideias de Paracelso influenciariam tanto o grande Isaac Newton quanto o rival deste, Leibniz, e ajudariam a alçar a alquimia a uma nova identidade, como ciência da química. Paracelso era um cruzado apaixonado por seu novo método, mas sua eficácia na persuasão pessoal era limitada por problemas de personalidade. Ele sabia ser bastante ofensivo – e quando digo “ofensivo” quero dizer “se comportar como um lunático furioso”.
Paracelso era imberbe e efeminado, não se interessava por sexo. No entanto, se as Olimpíadas outorgassem um prêmio no esporte de encher a cara, Paracelso ganharia a medalha de ouro. Estava bêbado boa parte do tempo, e seus contemporâneos diziam que “vivia como um porco”. Não era muito sutil em se promover e tendia a fazer afirmações do tipo: “Todas as universidades e todos os velhos escritores juntos têm menos talento que minha bunda.”7 E parecia gostar de irritar o establishment, às vezes como um fim em si mesmo. Por exemplo, quando foi chamado a dar um ciclo de conferências na Universidade da Basileia, apareceu na primeira aula usando jaleco de couro, em lugar da toga-padrão acadêmica; falou em alemão na Suíça, em vez do esperado latim; e, depois de anunciar que iria revelar o maior segredo da medicina, mostrou uma panela cheia de fezes.
Essas palhaçadas tiveram o mesmo efeito que teriam hoje: isolaram-no de seus colegas médicos e professores, mas o tornaram muito popular entre vários de seus alunos. Mesmo assim, quando Paracelso falava, as pessoas ouviam, pois alguns de seus remédios realmente funcionavam. Ao descobrir, por exemplo, que os opiáceos eram muito mais solúveis em álcool que na água, criou uma solução com base em ópio chamada láudano, muito eficaz no alívio da dor.
No final, contudo, talvez a economia tenha sido o motor principal na disseminação das ideias de Paracelso. A promessa de novas substâncias para curar doenças aumentou os rendimentos, o status social e a popularidade dos boticários, que criaram uma demanda para o conhecimento nesse campo. Textos e aulas sobre o assunto se difundiram, e quando os termos e técnicas da alquimia foram traduzidos para a nova linguagem da química, eles se tornaram mais exatos e padronizados, como desejava Paracelso. No início dos anos 1600, embora muitos ainda praticassem a velha alquimia, o novo estilo de alquimia de Paracelso – a quimia – também tinha se alastrado.
Assim como os estudiosos do Merton College, Paracelso foi uma figura de transição que ajudou a transformar sua disciplina e erigiu as fundações primitivas sobre as quais praticantes posteriores puderam construir. A maneira como Paracelso tinha um pé no velho mundo e outro no novo universo da química fica evidente a partir de sua vida: apesar de tão crítico da alquimia tradicional, ele se encharcava com ela. Durante a vida, realizou experimentos com o objetivo de criar ouro, e uma vez afirmou ter descoberto e bebido o elixir da vida, dizendo que estava destinado a viver para sempre.
Contudo, em setembro de 1541, quando estava hospedado num estabelecimento chamado White Horse Inn, em Salzburgo, na Áustria, Deus pagou para ver o blefe. Paracelso voltava para a estalagem por uma rua estreita e escura, e tomou um tombo feio, ou foi agredido por valentões contratados por médicos locais que ele ofendera. As duas versões levam ao mesmo fim: o dele. Paracelso sucumbiu aos ferimentos alguns dias depois, aos 47 anos. Diziam que quando morreu parecia bem mais decrépito do que deveria, por causa das noites insones e de muita bebida. Se tivesse vivido mais um ano e meio, teria visto a publicação do grande trabalho de Copérnico, De Revolutionibus Orbium Coelestium (Sobre a revolução das esferas celestes), que costuma ser considerado o início da revolução científica, um movimento que Paracelso decerto teria aprovado.
O SÉCULO E MEIO seguinte à morte de Paracelso, como já vimos, foi um período em que pioneiros como Kepler, Galileu e Newton, baseados em trabalhos anteriores, criaram uma nova abordagem da física e da astronomia. Com o tempo, teorias sobre o cosmo qualitativo, regido por princípios metafísicos, deram lugar ao conceito de Universo quantitativo e mensurável, seguindo leis fixas. A abordagem do conhecimento baseada na autoridade acadêmica e em argumentos metafísicos deu lugar à noção de que deveríamos aprender as leis da natureza por meio de observação e experimentos, articulando as leis na linguagem da matemática.
Assim como na física, o desafio intelectual das novas gerações de químicos não era apenas de desenvolver rigorosos caminhos de pensamento e experimentação, mas também se libertar da filosofia e das ideias do passado. Para começar a amadurecer, o novo campo da química teve ao mesmo tempo de aprender as lições de Paracelso e descartar as teorias sem saída de Aristóteles – não as teorias de movimento, o que Newton e outros físicos e matemáticos estavam fazendo, mas suas teorias sobre a matéria.
Antes de resolver um quebra-cabeça, é preciso identificar as peças; e no quebra-cabeça da natureza da matéria as peças são os elementos químicos. Enquanto as pessoas acreditavam que tudo era feito de terra, ar, fogo e água – ou algum esquema análogo –, a compreensão dos corpos materiais se basearia em fábulas, e a capacidade de criar novas substâncias químicas mais úteis continuaria uma questão de tentativa e erro, sem possibilidade de um verdadeiro entendimento. E assim aconteceu que, na nova atmosfera intelectual do século XVII – enquanto Galileu e Newton estavam finalmente banindo Aristóteles da física e substituindo suas ideias por uma teoria pautada na observação e na experimentação –, um dos homens cujo trabalho sobre ótica ajudou a inspirar Newton se posicionou contra as ideias de Aristóteles na química. Estou falando de Robert Boyle, filho do primeiro conde de Cork, da Irlanda.8
Um dos caminhos para dedicar a vida à ciência é obter um cargo universitário. Outro é ser podre de rico. Ao contrário dos professores universitários que inovaram a física, muitos dos campeões dos primórdios da química eram homens independentes financeiramente que, numa época em que os laboratórios eram escassos, puderam financiar e montar seus próprios laboratórios. Robert Boyle era o filho de um conde não apenas rico, mas talvez o homem mais rico da Grã-Bretanha.
Pouco se sabe sobre a mãe de Boyle, a não ser que se casou aos dezessete anos e teve quinze filhos nos 23 anos seguintes, antes de cair morta de tuberculose. Robert era o décimo quarto filho e o sétimo varão. Parece que o conde gostava mais de fazer filhos que de cuidar deles, pois assim que nasciam todos eram embarcados para ser criados por babás, depois para o internato e a faculdade, ou para o exterior, a fim de serem educados por professores particulares.
Boyle passou a época mais impressionável de sua vida em Genebra. Aos catorze anos, acordou uma noite, em meio a uma violenta tempestade, e jurou que iria se dedicar a Deus caso sobrevivesse. Se todo mundo seguisse (ou até se lembrasse das) as promessas feitas sob ameaça, nós viveríamos num mundo melhor. Mas, no caso de Boyle, a promessa foi para valer. Independentemente de a tempestade ter sido a verdadeira causa, ele se tornou profundamente religioso; e, apesar de sua grande fortuna, levou uma vida ascética.
No ano seguinte à tempestade que mudou sua vida, Boyle estava em visita a Florença quando Galileu morreu em seu exílio ali perto. De alguma forma Boyle obteve o livro de Galileu sobre o sistema copernicano, Diálogo sobre os dois principais sistemas do mundo. Esse foi um acaso fortuito e notável na história das ideias, pois Boyle, então com quinze anos, se apaixonou pela ciência depois de ler o livro.9
Nenhum registro histórico deixa clara a razão de Boyle ter optado pela química, mas desde sua conversão ele vinha procurando uma maneira de servir adequadamente a Deus, e decidiu que aquela seria a melhor maneira. Como Newton e Paracelso, Boyle era celibatário e se tornaria obsessivo pelo trabalho; assim como Newton, acreditava que a luta para entender os caminhos da natureza era uma forma de descobrir os desígnios de Deus. Mas, ao contrário do físico Newton, o químico Boyle também considerava a ciência importante porque podia ser usada para aliviar o sofrimento e melhorar a vida das pessoas.
Em certo sentido, Boyle era cientista por ser um filantropo. Ele se mudou para Oxford em 1656, aos 29 anos, e, embora a universidade não ministrasse um curso oficial de química, montou um laboratório com seu próprio dinheiro para se dedicar à pesquisa – sobretudo, mas não exclusivamente, à pesquisa química.
Oxford tinha sido um bastião da monarquia durante a Guerra Civil e abrigava muitos refugiados da Londres parlamentarista. Boyle não tinha convicções claras a respeito, mas, de qualquer forma, entrou para um grupo de refugiados que se reunia semanalmente para discutir interesses comuns relacionados ao novo método experimental da ciência. Em 1662, não muito depois da restauração da monarquia, Carlos II concedeu um alvará ao grupo, que se tornou a Royal Society (ou, traduzindo o nome completo, a Real Sociedade de Londres para o Progresso do Conhecimento Natural), com papel muito importante na carreira de Newton.
A Royal Society logo se tornou um local onde muitas das melhores cabeças científicas se reuniam para discutir, debater, criticar ideias uns dos outros e apoiar conclusões que merecessem ser encaminhadas para o mundo exterior. O lema da Royal Society, Nullius in verba, significa mais ou menos “Não acredite só nas palavras de alguém”, mas se referia particularmente a “Não acredite só nas palavras de Aristóteles” – pois todos os membros entendiam que era crucial se afastar da visão de mundo aristotélica para progredir.
Boyle também assumiu o mantra do ceticismo em sua vida pessoal, tal como está refletido no título de seu livro de 1661, O químico cético, em grande parte um ataque a Aristóteles. Pois Boyle, assim como seus pares, percebeu que, para conferir rigor científico à compreensão de um tema que o atraía, teria de refutar boa parte do passado. A química podia ter suas raízes nos laboratórios de embalsamadores, vidraceiros, tintureiros, metalúrgicos, alquimistas e, desde Paracelso, boticários, mas Boyle via a disciplina como um campo unificado, que valia ser estudado por si só, tão necessário para a compreensão básica do mundo natural como a astronomia e a física, e merecedora de uma rigorosa abordagem intelectual.
Em seu livro, Boyle apresentava exemplo após exemplo de processos químicos discordantes das ideias de Aristóteles quanto aos elementos. Discutia em grandes detalhes, por exemplo, a queima da madeira para produzir cinzas. Quando você queima um tronco, observou Boyle, a água fervendo nas pontas “está longe de ser água elementar” e a fumaça “está longe de ser ar”, pois, quando destilados, produzem óleo e sais.10 Por isso, dizer que o fogo converte o tronco em substâncias elementares – terra, ar e água – não resiste a um exame rigoroso. Além disso, outras substâncias, como ouro e prata, pareciam impossíveis de se reduzir a componentes mais simples, e portanto talvez devessem ser consideradas elementos.
O maior trabalho de Boyle veio de sua discordância de que o ar fosse um elemento. Ele baseava sua afirmação em experimentos que realizou com o auxílio de um jovem e mal-humorado assistente, um estudante de Oxford e monarquista fervoroso chamado Robert Hooke. Pobre Hooke, que mais tarde seria menosprezado por Newton – e que segundo muitos registros históricos recebeu poucos créditos também pelos experimentos executados com Boyle, nos quais provavelmente construiu todo o equipamento e fez a maior parte do trabalho.11
Numa dessa série de experimentos, os dois pesquisaram a respiração, tentando entender de que maneira nossos pulmões interagem com o ar que inalamos. Eles achavam que alguma coisa importante acontecia. Afinal, se não houvesse interação de algum tipo, o ato de respirar seria uma grande perda de tempo, ou, para alguns, apenas uma maneira de manter os pulmões ocupados entre um charuto e outro. Para investigar o fenômeno, realizaram experimentos com a respiração de animais como ratos e pássaros. Observaram que, quando os animais eram colocados em recipientes vedados, a respiração se tornava difícil e acabava por cessar.
O que os experimentos de Boyle demonstraram? A lição mais óbvia é que Robert Boyle não era um homem que você gostaria de ter em casa ao lado do seu bicho de estimação. Mas também mostraram que, quando os animais respiram, eles estão absorvendo algum componente do ar cujo esgotamento causa a morte, ou estão expelindo algum gás que se mostra fatal em altas concentrações. Ou as duas coisas. Boyle acreditava que era a primeira; de qualquer forma, seus experimentos sugeriam que o ar não é um elemento, mas uma substância formada por componentes diversos.
Boyle também investigou o papel do ar na combustão, usando uma versão bem-aperfeiçoada da bomba de vácuo que Hooke havia inventado havia pouco tempo. Ele observou que quando a bomba retirava todo o ar de um recipiente vedado contendo objetos queimando, as chamas se extinguiam. Por isso, concluiu que, na combustão, assim como na respiração, existe alguma substância não conhecida no ar necessária para o processo ocorrer.
A busca da identidade dos elementos estava no cerne do trabalho de Boyle. Ele sabia que Aristóteles e seus sucessores estavam errados, mas, dadas as limitações das pesquisas disponíveis, só conseguiu um progresso incompleto na substituição daquelas ideias por noções mais precisas. De todo modo, a simples demonstração de que o ar é composto por diferentes gases era um golpe efetivo nas teorias de Aristóteles, assim como a observação de Galileu acerca das colinas e crateras da Lua e das luas de Júpiter. Com seu trabalho, Boyle ajudou a libertar aquela ciência emergente de sua dependência da sabedoria convencional do passado, substituindo-a pela observação e por experimentos meticulosos.
HÁ ALGO ESPECIALMENTE significativo no estudo químico do ar. Saber sobre o salitre ou sobre óxidos de mercúrio não nos diz nada sobre nós mesmos, mas o ar é a fonte da vida. Antes de Boyle, porém, o ar nunca foi uma substância preferida dos estudos. Era difícil estudar os gases, dadas as restrições do estado da tecnologia disponível. Isso só mudaria no final do século XVIII, quando a invenção de novos equipamentos laboratoriais, como a câmara pneumática, permitiu a coleta de gases produzidos em reações químicas.12
Infelizmente, como a absorção e a emissão de gases invisíveis são uma coisa comum em reações químicas, sem uma compreensão do estado gasoso os químicos foram levados a realizar análises incompletas e mesmo equivocadas de muitos processos importantes – em especial a combustão. Para que a química realmente saísse da Idade Média, isso tinha de mudar. Era preciso compreender a natureza do fogo.
Um século depois de Boyle, finalmente foi descoberto o gás necessário para a combustão – o oxigênio. É uma ironia da história que a residência do homem responsável por essa descoberta tenha sido incendiada por uma turba furiosa em 1791. O que provocou a turba foi o apoio do homem à Revolução Francesa e à Americana. Por conta da controvérsia, Joseph Priestley (1733-1804) trocou sua Inglaterra natal pelos Estados Unidos, em 1794.13
Priestley era adepto do unitarismo e famoso por ser um apaixonado defensor da liberdade religiosa. Começou a carreira como pastor, mas em 1761 tornou-se professor de línguas modernas em uma das academias não conformistas que faziam o papel de universidade para os dissidentes da Igreja anglicana. Lá, inspirou-se nas palestras de um colega professor para escrever uma história sobre a nova ciência da eletricidade. Sua pesquisa do assunto o levou a realizar experimentos originais.
O contraste radical entre a vida e a formação de Priestley e de Boyle reflete o contraste das épocas em que eles viveram. O segundo morreu no começo do Iluminismo, período da história do pensamento e da cultura ocidentais transcorrido mais ou menos entre 1685 e 1815. Priestley, por sua vez, trabalhou no auge desse período.
O Iluminismo foi uma era de revoluções drásticas, tanto na ciência quanto na sociedade. O próprio termo, nas palavras de Immanuel Kant, representa “a saída da humanidade de sua imaturidade autoimposta”.14 O lema de Kant para o Iluminismo era simples: Sapere aude – “Ouse saber”. E o Iluminismo de fato destacou-se por uma grande valorização do avanço da ciência, um fervor pela contestação de antigos dogmas e o princípio de que a razão deveria desbancar a fé cega e gerar benefícios sociais práticos.
Outro fator importante era que, nos tempos de Boyle (e de Newton), a ciência era província de uma pequena elite de pensadores. O século XVIII, contudo, representou o início do período industrial, da contínua ascensão da classe média e do declínio do domínio da aristocracia. Em consequência, por volta da segunda metade do século, a ciência tinha se tornado tema para um grupo relativamente maior de pessoas cultas, um grupo mais diverso, que incluía membros da classe média, muitos dos quais movidos pela busca de melhorar sua própria posição econômica. A química, em especial, ganhou muito com essa base mais ampla de praticantes – pessoas como Priestley – e com o espírito inventivo e empreendedor daí decorrente.
O livro de Priestley sobre eletricidade foi lançado em 1767, mas no mesmo ano ele mudou seu interesse da física para a química, em particular para o estudo dos gases. Não que tenha se desviado de área por ter tido uma grande ideia sobre a ciência ou por acreditar que fosse um campo de estudo mais importante. Simplesmente tinha se mudado para a casa ao lado de uma cervejaria, com gases borbulhando copiosa e furiosamente em barris de madeira para fermentar o conteúdo, e isso atiçou sua curiosidade. Ele conseguiu afinal recolher grandes quantidades de gases e, em experimentos que lembravam os de Boyle, descobriu que o fogo de lascas de madeira em chamas colocadas em recipientes vedados se extinguia, e que um rato colocado nesse recipiente logo morria. Também percebeu que, se fosse dissolvido na água, o gás criava um líquido borbulhante de sabor agradável. Hoje conhecemos esse gás como dióxido de carbono. Sem querer, Priestley tinha inventado um modo de criar bebidas gaseificadas, porém, como era um homem de poucos recursos, não comercializou a invenção. Isso foi feito alguns anos depois por um tal de Johann Jacob Schweppe, cuja empresa continua até hoje no ramo.
O fato de Priestley ter sido levado à química pelo fascínio por um produto residual faz sentido, pois só agora, com o advento da Revolução Industrial, no final do século XVIII, vemos a ciência e a indústria se instigando por novas realizações. Poucos usos práticos imediatos resultaram dos grandes avanços da ciência nos séculos anteriores, mas os progressos iniciados no fim do século XVIII transformaram radicalmente a vida cotidiana. Os resultados diretos das colaborações entre ciência e indústria incluem o motor a vapor, inovações no domínio da energia da água para uso nas fábricas, o desenvolvimento de maquinarias e, posteriormente, o surgimento de estradas de ferro, telégrafo e telefone, eletricidade e lâmpada elétrica.
Em seus primeiros estágios, por volta de 1760, a Revolução Industrial dependia mais da contribuição de artesãos inventores que da descoberta de novos princípios científicos; mas, ainda assim, estimulou um movimento de apoio à ciência entre os mais ricos como forma de melhorar a arte da manufatura. Um dos abonados patrocinadores a mostrar interesse pela ciência foi William Petty, conde de Shelburne. Em 1773, ele nomeou Priestley bibliotecário e professor particular de seus filhos, mas também construiu um laboratório e lhe concedeu bastante tempo livre para realizar suas pesquisas.
Priestley era um experimentalista inteligente e meticuloso. Em seu novo laboratório, começou a fazer experiências com o que conhecemos hoje como óxido de mercúrio – em outras palavras, “ferrugem” de mercúrio. Os químicos da época sabiam que, quando era aquecido, o mercúrio absorvia alguma coisa do ar, mas não sabiam o quê. O mais intrigante era que quando o óxido era mais aquecido ainda, voltava a ser mercúrio, supostamente expelindo o que tinha absorvido.
Priestley descobriu que o gás expelido pelo óxido de mercúrio tinha propriedades notáveis. “Esse ar é de natureza exaltada”, ele escreveu. “Uma vela queimou nesse ar com uma chama surpreendentemente forte. … Mas, para completar a demonstração da qualidade superior desse ar, introduzi um rato no recinto; e, com uma quantidade que, se fosse ar comum, ele teria morrido em um quarto de hora, o rato viveu … uma hora inteira, e foi retirado bem vigoroso.”15 Priestley continuou a fazer experiências com o ar “exaltado” – que era oxigênio, claro: “A sensação em meus pulmões não foi sensivelmente diferente da do ar comum; mas senti meu peito peculiarmente leve e tranquilo durante algum tempo depois.” Talvez, ele especulou, o misterioso gás pudesse se tornar um novo vício popular entre os ricos e ociosos.
Priestley não se transformou em traficante de oxigênio para os ricos. Preferiu continuar estudando o gás. Expôs o gás a amostras de sangue escuro e coagulado, e descobriu que o sangue ficava vermelho brilhante. Também observou que, se o sangue escuro fosse colocado num pequeno espaço vedado para absorver o gás do ar, quando o sangue assumia um tom vermelho mais claro qualquer animal presente sufocava rapidamente.
Priestley interpretou essas observações como a maneira de nossos pulmões interagirem com o ar para revitalizar nosso sangue. Também fez experiências com hortelã e espinafre, e descobriu que o crescimento das plantas também podia restaurar a capacidade do ar de manter a respiração e o fogo – em outras palavras, foi a primeira pessoa a perceber os efeitos do que hoje chamamos de fotossíntese.
Apesar de ter entendido muitos dos efeitos do oxigênio e hoje ser considerado seu descobridor, Priestley não compreendeu seu papel no processo de combustão. Continuou acreditando na teoria popular e complicada da época, segundo a qual os objetos não queimavam como resultado de uma reação com algo no ar, mas por liberarem alguma coisa chamada “flogisto”.
Priestley realizou experimentos reveladores, mas fracassou em perceber o que revelavam. Isso ficou para um francês chamado Antoine Lavoisier (1743-1794), cujo trabalho estabeleceu a verdade revelada pelos experimentos de Priestley – que a respiração e a combustão eram processos que envolviam a absorção de algo do ar (oxigênio), e não a liberação de “flogisto” no ar.16
PODIA PARECER um sonho fútil imaginar que um campo originário da alquimia pudesse ascender à rigorosa precisão matemática da física newtoniana, mas muitos químicos do século XVIII acreditavam nisso. Houve até especulações de que as forças de atração entre os átomos que compõem as substâncias fossem essencialmente de natureza gravitacional e que poderiam ser usadas para explicar propriedades químicas. (Hoje sabemos que eles estavam certos, só que as forças são eletromagnéticas.) Essas ideias se originaram de Newton, que afirmava existir “agentes na natureza capazes de fazer as partículas dos corpos [isto é, átomos] se manterem unidas por atrações muito fortes. E é o assunto da filosofia experimental descobri-los”.17 Essa foi uma das grandes aflições da química: a questão de quão literalmente as ideias de Newton poderiam ser traduzidas da física para outras ciências.
Lavoisier foi um desses químicos muito influenciados pela revolução newtoniana. Considerava a química praticada em sua época um assunto “fundado em apenas poucos fatos, … composto de ideias absolutamente incoerentes e suposições não comprovadas, … intocado pela lógica da ciência”.18 Mesmo assim, ele queria que a química emulasse a rigorosa metodologia quantitativa da física experimental, e não os sistemas puramente matemáticos dos físicos teóricos. Essa foi uma escolha sábia, dados o conhecimento e a capacidade técnica de sua época. Os físicos teóricos acabaram conseguindo explicar a química por meio de suas equações, mas isso só aconteceria com o desenvolvimento da teoria quântica e, mais ainda, com os computadores digitais de alta velocidade.
A visão que Lavoisier tinha da química refletia o fato de ele adorar tanto esta disciplina quanto a física. Na verdade ele poderia ter optado pela última, mas, como filho de um abastado advogado de Paris, numa família intensamente protetora de seu status e dos privilégios, ele acabou considerando-a árida e controversa demais. Embora encorajasse suas ambições, a família de Lavoisier esperava que ele fosse socialmente apto e também trabalhador, e enfatizavam a cautela e a parcimônia – características que não tinha naturalmente.
Para todos os que o conheciam, devia estar evidente que o verdadeiro amor de Lavoisier era a ciência. Ele vivia cheio de ideias fantásticas e grandes planos para levá-las adiante. Quando ainda adolescente, quis estudar os efeitos das dietas sobre a saúde, ingerindo nada mais que leite durante um longo período, e se propôs a ficar fechado num quarto escuro por seis semanas para aumentar a capacidade de discernir diferenças na intensidade da luz. (Parece que um amigo o convenceu a não fazer isso.) A mesma paixão pela pesquisa científica transpareceria por toda a sua vida numa enorme capacidade de se envolver, como tantos outros pioneiros da ciência, em longas horas de entediante trabalho na busca de compreender as coisas.
Lavoisier teve a sorte de nunca ter tido problemas de dinheiro: com pouco mais de vinte anos, recebeu um adiantamento da herança, num valor de mais de 10 milhões de dólares em valores atuais. Fez um investimento lucrativo ao comprar parte de uma instituição chamada Companhia de Fazendeiros Gerais. Os fazendeiros gerais não cultivavam aspargos; coletavam certos impostos que a monarquia decidira terceirizar.
Os investimentos de Lavoisier envolviam participação ativa, tornando-o responsável pela supervisão do sistema de regulamentações do tabaco. Por esse trabalho, a Fazenda pagava a Lavoisier uma média equivalente a cerca de 2,5 milhões de dólares por ano, como parte dos lucros. Ele usou o dinheiro para construir o mais sofisticado laboratório particular do mundo, tão bem fornido de recipientes de vidro que nos perguntamos se ele não gostava tanto de apreciar sua coleção de provetas quanto de usá-la. Também empregou o dinheiro para inúmeras obras de caridade.
Lavoisier tomou conhecimento das experiências de Priestley no outono de 1774, pelo próprio Priestley, que passou por Paris durante uma turnê pela Europa com Lord Shelburne, atuando como uma espécie de guia científico. Os três, com outros dignitários da ciência parisiense, jantaram juntos e depois ficaram conversando.
Quando Priestley falou sobre os trabalhos que vinha fazendo, Lavoisier imediatamente percebeu que os experimentos com a combustão tinham algo em comum com suas experiências com a ferrugem, e isso o deixou surpreso e enlevado. Mas ele também percebeu que Priestley não entendia muito dos princípios teóricos da química nem das implicações de seus experimentos. O trabalho dele, escreveu Lavoisier, era “uma trama tecida de experimentos que mal se deixa interromper por algum raciocínio”.19
É raro alguém sobressair tanto no aspecto teórico quanto no experimental de uma ciência. Conheço poucos cientistas de destaque que possam se gabar disso. Pessoalmente, desde cedo fui identificado como um teórico promissor, por isso só precisei cursar uma cadeira de laboratório em física. Meu projeto era construir um rádio a partir de componentes básicos, projeto que me consumiu o semestre inteiro. No fim, meu rádio só funcionava se fosse sacudido de cabeça para baixo, e mesmo assim sintonizado em uma única estação, uma emissora de Boston que só tocava música dissonante de vanguarda. Por isso fiquei muito grato com a divisão de trabalho na física, como a maioria dos meus amigos, tanto teóricos quanto experimentalistas.
Lavoisier era um mestre nos aspectos experimentais e teóricos da química. Descartando Priestley como intelecto inferior, e entusiasmado com a possibilidade de explorar os paralelos entre a ferrugem e a combustão, logo na manhã seguinte repetiu meticulosamente o trabalho de Priestley com o mercúrio e seu óxido. Aperfeiçoou os métodos experimentais, medindo e pesando tudo com minúcia. Depois forneceu uma explicação para as descobertas de Priestley que este nunca tinha imaginado: quando o mercúrio queima (formando o óxido), o elemento se mistura com um gás fundamental da natureza e – suas mensurações mostraram – ganha uma quantidade de peso igual à do gás com o qual se mistura.
As cuidadosas mensurações de Lavoisier também demonstraram algo mais: quando acontece o inverso – quando é aquecido para formar mercúrio –, o óxido fica mais leve, presumivelmente liberando o mesmo gás absorvido e perdendo a mesma quantidade de peso ganho quando o mercúrio forma o óxido. Embora Priestley tenha recebido o crédito da descoberta de que o gás era absorvido e liberado no decorrer desses experimentos, foi Lavoisier quem explicou seu significado – e acabou dando o nome ao oxigênio.b
Em seguida, Lavoisier centrou suas observações numa das mais famosas leis da ciência, a lei da conservação de massa: a massa total de produtos gerada numa reação química deve ser igual à massa dos reagentes iniciais. Talvez esse tenha sido o principal marco na transição da alquimia para a química moderna: a identificação da transformação química como combinação e recombinação de elementos.
A associação com cobradores de impostos financiou o importante trabalho científico realizado por Lavoisier. Mas também foi uma maldição, porque chamou a atenção dos revolucionários que derrubaram a monarquia francesa. Em qualquer lugar e em qualquer época, os cobradores de impostos são recebidos como um sujeito tuberculoso que tosse muito. No entanto, aqueles cobradores de impostos eram especialmente desprezados, pois muitos dos impostos que arrecadavam eram considerados irracionais e injustos, sobretudo pelo impacto causado nas finanças dos pobres.
Sob todos os aspectos, Lavoisier realizou suas tarefas com justiça e honestidade, até com alguma solidariedade com os que pagavam impostos, mas a Revolução Francesa não era conhecida pela flexibilidade de seus julgamentos. E Lavoisier tinha fornecido muitas razões para ser odiado pelos revolucionários.
A pior ofensa foi uma enorme muralha de alvenaria pesada que mandara o governo construir em torno da cidade de Paris, a um custo de centenas de milhões de dólares em dinheiro atual. Só se podia entrar ou sair da cidade por um dos portões de pedágio da muralha, patrulhados por guardas armados que verificavam todos os bens que entravam e saíam, e os registravam para cobrar impostos. Dessa forma – para mortificação do povo –, Lavoisier transferiu sua tendência a medir meticulosamente as coisas no laboratório para a tarefa de cobrador de impostos.
Quando começou a Revolução, em 1789, a muralha de Lavoisier foi uma das primeiras edificações a ser atacadas. Sob o reinado do Terror, ele foi preso, em 1793 – com outros fazendeiros de impostos – e condenado à morte. Pediu que sua execução fosse adiada até a conclusão da pesquisa em que trabalhava. Dizem que o juiz respondeu: “A República não precisa de cientistas.”20 Talvez não, mas a química precisava, e felizmente, em seus cinquenta anos de vida, Lavoisier já tinha conseguido revolucionar a disciplina.
Quando foi executado, Lavoisier já tinha identificado 33 substâncias conhecidas como elementos. Acertou todas elas. Ainda criou um sistema padronizado para dar nomes aos compostos de acordo com os elementos constituintes, substituindo a linguagem estonteante e pouco esclarecedora da química da época. Costumo dar muito valor à matemática como linguagem da física, mas uma linguagem viável é igualmente crucial na química. Antes de Lavoisier, por exemplo, óxido de hidrargírio e óxido de mercúrio eram dois nomes para o mesmo composto. Na terminologia de Lavoisier, esse composto se tornou “óxido mercúrico”.
Lavoisier não chegou a inventar as equações da química moderna como “2Hg + O2 → 2HgO”, que descreve a produção do óxido de mercúrio, mas estabeleceu as bases para isso. Suas descobertas produziram uma revolução na química e provocaram entusiasmo na indústria, que por sua vez forneceu aos futuros químicos novas substâncias para trabalhar e novas perguntas para responder.
Em 1789, Lavoisier publicou um livro sintetizando suas ideias, Traité élémentaire de chimie. Hoje, esse trabalho é visto como livro-texto moderno, ao esclarecer que o conceito de elemento é: uma substância que não pode ser decomposta – e ao negar a teoria dos quatro elementos, a existência do flogisto, estabeler a lei da conservação da matéria e apresentar uma nomenclatura nova e racional para a química. Em uma geração, o livro se tornou um clássico, informando e inspirando inúmeros pioneiros posteriores. A essa altura, Lavoisier já tinha sido morto, e seu corpo, descartado numa vala comum.
Lavoisier passou a vida a serviço da ciência, mas também desejava desesperadamente ser famoso, e lamentou nunca ter isolado um novo elemento pessoalmente (apesar de ter tentado dividir o crédito pela descoberta do oxigênio). Finalmente, em 1900, um século depois de negar que a França precisava de cientistas, seu país erigiu uma estátua de bronze em sua homenagem em Paris. Os dignitários presentes à cerimônia de descerramento observaram que ele “merecia a estima dos homens” e fora um “grande benfeitor da humanidade”, pois havia “estabelecido as leis fundamentais que regem as transformações químicas”. Um dos oradores proclamou que a estátua havia captado Lavoisier “em todo lustre de seu poder e inteligência”.21
Isso soa como o reconhecimento que Lavoisier teria desejado, mas duvido que ele gostasse da cerimônia. Como se soube depois, o rosto da estátua não era de Lavoisier, mas de um filósofo e matemático francês, o marquês de Condorcet, secretário da Academia de Ciências durante os últimos anos de Lavoisier. O escultor, Louis-Ernest Barrias (1841-1905), copiou a cabeça de uma escultura feita por outro artista sem identificar corretamente o modelo.22 Essa revelação não incomodou os franceses, que deixaram a estátua de bronze errada de pé – homenagem a um homem que eles guilhotinaram, exibindo a cabeça de outro.c Enfim, a estátua acabou vítima de políticas da guerra – foi fragmentada durante a Ocupação nazista e reciclada para fazer munição.24 Pelo menos as ideias de Lavoisier se mostraram duráveis. Elas reformularam o campo da química.
AS PESSOAS COSTUMAM falar de “marcha da ciência”, mas a ciência não anda sozinha. São as pessoas que seguem adiante, e nosso progresso parece mais uma corrida de revezamento que uma marcha. Além disso, é uma corrida de revezamento bem estranha, pois os que pegam o bastão costumam seguir numa direção que o corredor anterior não previra, nem aprovaria. Foi exatamente o que aconteceu quando o posterior grande visionário da química retomou a grande corrida feita por Lavoisier.
Estátua de Lavoisier com a cabeça de Condorcet.
Lavoisier esclareceu o papel dos elementos nas reações químicas e promoveu uma abordagem quantitativa para descrevê-las. Hoje sabemos que, para entender realmente a química – e, em especial, para se ter um entendimento quantitativo das reações químicas –, é preciso entender o átomo. Mas Lavoisier abominava o conceito de átomo. Não que fosse preconceituoso ou tivesse pouca visão. Ele se recusava a pensar em termos de átomos por uma razão totalmente prática.
Desde os gregos, os estudiosos vinham conjecturando sobre os átomos – embora às vezes os chamassem por outros nomes, como “corpúsculos” ou “partículas de matéria”. Mas, como eram tão pequenos, durante o transcorrer de duas dezenas de séculos, ninguém pensou numa forma de relacioná-los à realidade das observações e mensurações.
Para ter uma ideia de como os átomos são pequenos, imagine todos os oceanos do mundo cheios de bolinhas de gude. Agora imagine cada uma dessas bolinhas encolhida até o tamanho de um átomo. Que espaço que ocupariam? Menor que uma colher de chá. Que esperança poderia haver de observar os efeitos de uma coisa tão minúscula?
Como se viu, havia muita esperança – e essa realização miraculosa foi conseguida por um professor quacre, John Dalton (1766-1844).25 Muitos grandes cientistas da história foram pessoas radiantes, mas Dalton, filho de um tecelão pobre, não estava entre eles. Era metódico em tudo, desde a ciência até a maneira como tomava chá todos os dias às cinco da tarde, seguido por um jantar de carne com batatas, às nove da noite.
O livro pelo qual Dalton é conhecido, A New System of Chemical Philosophy, é um meticuloso tratado em três partes, mais surpreendente por ter sido pesquisado e escrito nas horas vagas. A Parte I, publicada em 1810, quando o autor já tinha mais de quarenta anos, é um catatau de 916 páginas. Destas, apenas um capítulo, com menos de cinco páginas, apresenta a monumental ideia pela qual ele é conhecido hoje: um modo de calcular os pesos relativos dos átomos a partir de mensurações que podem ser feitas em laboratório. Isso mostra bem o poder e o alcance das ideias na ciência – cinco páginas podem reverter 2 mil anos de teorias incorretas.
Dalton chegou à sua ideia de forma indireta, como acontece com muitas ideias, e, apesar de já estar no século XIX, foi influenciado por um homem nascido em meados do século XVII – de novo, estamos diante da influência de Newton.
Dalton gostava de fazer caminhadas, e, como passou a juventude em Cumberland, a região mais úmida da Inglaterra, se interessou por meteorologia. Desde cedo se mostrou um prodígio, tendo lido e estudado o Principia de Newton ainda na adolescência. Esses dois interesses se revelaram uma poderosa combinação, pois o fizeram voltar a atenção para as propriedades físicas dos gases – como os do ar úmido da zona rural de Cumberland. Intrigado com a teoria dos corpúsculos, de Newton, que em essência era o conceito grego de átomo atualizado segundo as ideias de Newton sobre força e movimento, Dalton começou a raciocinar que as diferentes solubilidades dos gases se deviam aos diferentes tamanhos de átomo, o que, por sua vez, o levou a considerar o peso desses elementos.
A abordagem de Dalton se baseava na ideia de que, se considerarmos cuidadosamente apenas os compostos puros, estes devem ser formados por seus constituintes exatamente na mesma proporção. Por exemplo, há dois tipos diferentes de óxido de cobre. Se os examinarmos separadamente, vamos descobrir que, para cada grama de oxigênio consumido, a criação de um dos óxidos usa quatro gramas de cobre, enquanto a criação do outro óxido consome oito gramas. Isso implica que, neste último tipo de óxido, um número duas vezes maior de átomos se combinará com cada átomo de oxigênio.
Agora, para simplificar as coisas, vamos supor que, no primeiro caso, cada átomo de oxigênio se combina com um átomo de cobre, enquanto no segundo caso cada átomo de oxigênio se combina com dois. Então, como no primeiro caso o óxido é formado a partir de quatro gramas de cobre para cada grama de oxigênio, pode-se concluir que o átomo de cobre pesa mais ou menos quatro vezes mais que um átomo de oxigênio. A suposição se mostrou correta, e foi o tipo de raciocínio que Dalton usou para calcular os pesos atômicos relativos dos elementos conhecidos.
Como estava calculando os pesos relativos, Dalton precisava começar de algum lugar, por isso designou o peso de “1” ao mais leve elemento conhecido – o hidrogênio – e calculou o peso de todos os outros em relação a ele.
Infelizmente, seu pressuposto de que os elementos se combinam nas proporções mais simples nem sempre funciona. Por exemplo, essa premissa designava para a água a fórmula HO, e não a bem mais complicada H2O que conhecemos hoje. Por isso, quando Dalton calculou o peso do átomo de oxigênio em relação ao de hidrogênio, o resultado foi a metade do que deveria ser. Dalton estava ciente das incertezas em relação à água, pois reconheceu que tanto HO2 quanto H2O eram alternativas possíveis. Os pesos relativos seriam muito mais difíceis de decifrar se os compostos comuns tivessem fórmulas como H37O22, mas felizmente não foi esse o caso.
Dalton sabia que suas estimativas eram provisórias, que precisava se basear em dados de um número maior de compostos para registrar incoerências que apontassem erros nas supostas fórmulas. Essa dificuldade atormentaria os químicos pelos cinquenta anos seguintes, mas o fato de ter levado muito tempo para elaborar os detalhes não diminuiu a importância da descoberta, pois a versão do atomismo de Dalton foi a que finalmente deu sentido prático e pôde ser relacionada a mensurações de laboratório. Mais ainda, baseado no trabalho de Lavoisier, Dalton utilizou suas ideias a fim de criar uma linguagem quantitativa para a química, articulada em termos de trocas de átomos entre moléculas – uma nova maneira de entender os experimentos que os químicos realizavam. Na versão moderna, por exemplo, para descrever a produção de água a partir de oxigênio e hidrogênio, um químico (ou estudante do ensino médio) escreveria “2H2 + O2 → 2H2O”.
Essa nova linguagem da química revolucionou a capacidade de entender e raciocinar sobre o que era observado e medido durante as reações químicas, tornando-se crucial para a teoria química desde então e fazendo de Dalton uma pessoa mundialmente famosa. Apesar de infenso a homenagens públicas, ele recebeu honrarias, tendo sido inclusive indicado como membro da Royal Society, apesar de seus veementes protestos. Quando morreu, em 1844, embora ele desejasse algo modesto, seu funeral atraiu mais de 40 mil pessoas.
Com o trabalho de Dalton, o pensamento em relação à natureza das substâncias abandonou as teorias propostas por antigos mitos e tradições, e despertou para uma compreensão da matéria num plano bem além do alcance dos nossos sentidos. No entanto, se cada elemento se diferencia pelo peso de seus átomos, como essa propriedade atômica se relaciona com as características físicas e químicas observáveis? Este seria o estágio seguinte da corrida de revezamento, na verdade, a última das questões essenciais da química que pode ser respondida sem se ultrapassar a ciência newtoniana. As visões mais aprofundadas teriam de esperar a revolução quântica da física.
STEPHEN HAWKING, que há décadas sobrevive apesar de paralisado por uma doença que deveria tê-lo matado em poucos anos, me disse certa vez que considerava a teimosia sua maior qualidade, e acredito que ele esteja certo. Embora às vezes isso torne difícil trabalhar com ele, Hawking sabe que é sua obstinação que o mantém vivo e lhe propicia forças para prosseguir em suas pesquisas.
As teorias acabadas da ciência podem parecer quase evidentes depois de formuladas, mas a batalha para criá-las em geral só é vencida com muita perseverança. Os psicólogos falam de uma característica que poderíamos chamar de “fibra”, atributo relacionado à perseverança e à teimosia, mas também à paixão, todas elas características que já vimos muito nestas páginas. Definida como “disposição de perseguir objetivos de longo prazo, mantendo o interesse e o esforço ao longo do tempo”, não surpreende que os psicólogos relacionem fibra ao sucesso em quase tudo, desde a manutenção de um casamento até as Forças de Operações Especiais.26 Talvez seja essa a razão de tantos dos personagens que encontramos até agora tenham sido tão turrões, até arrogantes. Assim, são eles os grandes inovadores. Eles precisam ser assim.
Nosso pioneiro seguinte, Dmitri Mendeleiev (1834-1907), químico russo conhecido por seus chiliques e acessos de raiva (e por aparar a barba e o cabelo só uma vez por ano), cabe direitinho nesse panteão de mulas teimosas.27 De fato, ele tinha uma personalidade tão forte que sua esposa acabou desistindo de conviver com ele e foi morar na casa de campo do casal – quando ele ia até lá, ela pegava os filhos e voltava para a cidade.
Assim como Hawking, Mendeleiev foi um sobrevivente. Na adolescência, foi hospitalizado com tuberculose, mas não somente sobreviveu, como encontrou um laboratório nas proximidades do sanatório, onde passou os dias de recuperação realizando experiências químicas. Mais tarde, quando obteve suas credenciais como professor, teve de lecionar num colégio na longínqua Crimeia como castigo por ter enfurecido um funcionário do Ministério da Educação. Corria o ano de 1855, e quando Mendeleiev chegou à Crimeia, descobriu que o colégio ficava numa zona de guerra e já estava fechado havia algum tempo. Imperturbável, voltou para casa, desistiu da carreira de professor do ensino médio e arrumou um trabalho como privatdozent – um palestrante pago – na Universidade de São Petersburgo, onde acabou se tornando professor.
Dmitri Mendeleiev.
Mendeleiev só chegou a ser químico ou até a cursar faculdade por causa da mãe. Nascido em uma família pobre no oeste da Sibéria, o mais jovem de catorze ou dezessete filhos – os relatos variam – não foi bom aluno, porém gostava de improvisar experiências científicas. A mãe, contudo, acreditou em seu intelecto. Quando ele tinha quinze anos e seu pai morreu, ela pegou a estrada e partiu com o filho em busca de uma universidade que o aceitasse.
Aquela foi uma viagem de 2.250 quilômetros, boa parte em carona nas carroças puxadas a cavalo; afinal, ele conseguiu uma módica bolsa de estudos no Instituto Pedagógico Central, em São Petersburgo, onde o diretor era velho amigo de seu falecido pai. Sua mãe morreu logo depois. Trinta e sete anos mais tarde, ele dedicou um tratado científico à memória dela, citando o que chamou de suas últimas palavras “sagradas”: “Evite ilusões, insista no trabalho, não nas promessas. Tenha paciência na busca da verdade científica.” Assim como muitos grandes cientistas antes dele, Mendeleiev levaria a vida de acordo com a recomendação.
Em certo sentido, Mendeleiev teve sorte de ter nascido na época em que nasceu. Quase todas as grandes descobertas e inovações surgem da combinação de uma visão humana com circunstâncias fortuitas. Einstein teve a sorte de ter começado a carreira pouco depois que a moderna formulação da teoria do eletromagnetismo passou a propagar que a velocidade da luz era constante – ideia que se tornaria a essência de sua teoria da relatividade. Steve Jobs também teve a sorte de iniciar sua carreira num período em que a tecnologia atingia o estágio no qual se podia desenvolver o computador pessoal. Por outro lado, o inventor e empresário armênio-americano Luther Simjian obteve muitas patentes, mas teve sua melhor ideia uma década antes da hora: em 1960, ele concebeu o caixa eletrônico automático (ATM, na sigla em inglês) de banco, que chamou de Bankograph.28 Conseguiu convencer um banco de Nova York a instalar algumas máquinas, mas as pessoas não confiaram nelas para realizar depósitos, por isso só eram usadas por prostitutas e jogadores que não queriam lidar pessoalmente com atendentes do banco. Uma década depois, os tempos mudaram, e as máquinas eletrônicas baseadas em outros projetos tiveram o maior sucesso.
Ao contrário de Simjian, Mendeleiev teve o espírito da época a seu lado. Chegou à idade adulta num momento em que a química estava madura para avançar – desde os anos 1860, a ideia de que os elementos podiam ser organizados em famílias estava no ar em toda a Europa. Não tinha passado despercebido, por exemplo, que o flúor, o cloro e o bromo – classificados como “halógenos” pelo químico sueco Jöns Jakob Berzelius em 1842 – pareciam pertencer a um mesmo grupo: eram todos gases extremamente corrosivos, que se tornavam inativos quando ligados ao sódio, formando inofensivos cristais salinos. (O sal de cozinha, por exemplo, é cloreto de sódio.) Tampouco foi difícil detectar as semelhanças entres os metais alcalinos como o sódio, o lítio e o potássio. Eles eram brilhantes, dúcteis e altamente reativos. Aliás, os membros da família dos metais alcalinos são tão parecidos que, se você trocar o sódio pelo potássio no sal de cozinha, o resultado é bem próximo do cloreto de sódio e pode ser usado como substituto para o sal.
Químicos inspirados pelo esquema de Carl Lineu de classificação de organismos biológicos procuravam desenvolver um sistema de famílias abrangente próprio para explicar as relações entre os elementos. Mas nem todos os agrupamentos eram óbvios, nem se sabia como eles se relacionavam uns com os outros, ou quais propriedades atômicas eram responsáveis pelas semelhanças nas famílias. Essas questões atraíram pensadores de toda a Europa. Até uma refinaria de açúcar entrou na parada – pelo menos o químico responsável pelo estabelecimento. Apesar de vários pensadores terem batido na porta da resposta, apenas um homem, Mendeleiev, conseguiu abri-la e entrar.
Como a organização dos elementos “estava no ar”, é fácil imaginar que a pessoa que conseguisse resolver a questão fosse aclamada, mas não necessariamente que fosse considerada um dos maiores gênios do mundo em sua disciplina. Mas foi o que aconteceu com Mendeleiev. O que o situaria na classe dos titãs, como Boyle, Dalton e Lavoisier?
A “tabela periódica” desenvolvida por Mendeleiev não é a versão química de um guia para identificação de pássaros no campo, é a versão química das leis de Newton, ou ao menos o mais próximo dessa façanha mágica que a química poderia chegar. Não se trata apenas de uma tabela relacionando famílias de elementos, é um verdadeiro tabuleiro Ouija que permite aos químicos entender e prever as propriedades de qualquer elemento, mesmo os ainda não conhecidos.
Olhando para trás, é fácil atribuir a realização de Mendeleiev ao fato de ele ter formulado a pergunta certa na hora certa, à sua ética no trabalho, à sua paixão, teimosia e extrema autoconfiança. Mas como quase sempre acontece com as descobertas e inovações – e também na nossa vida –, tão importante quanto os atributos intelectuais foi a casualidade, ou pelo menos as circunstâncias não correlacionadas que estabeleceram o cenário para essas características triunfarem. Em seu caso, a circunstância foi uma decisão casual de Mendeleiev: escrever um livro-texto de química.
A decisão de escrever o livro foi tomada em 1866, quando Mendeleiev foi nomeado professor de química em São Petersburgo, aos 32 anos. A cidade fora fundada um século e meio antes por Pedro o Grande, e finalmente começava a se transformar num dos centros intelectuais da Europa. Sua universidade era a melhor da Rússia, embora esse país estivesse atrás do resto da Europa. Ao pesquisar a literatura química russa, Mendeleiev não encontrou nenhum bom livro atualizado para adotar em suas aulas, por isso resolveu escrever seu próprio texto. Demoraria anos para concluí-lo, e no entanto, nas décadas seguintes, ele seria traduzido para as principais línguas e usado em universidades de todo o mundo. O livro era uma obra heterodoxa, cheia de casos, especulações e excentricidades. Era também um ato de amor, e a motivação de torná-lo o melhor livro possível levou Mendeleiev a se concentrar em questões que iriam levá-lo à sua grande descoberta.
O primeiro desafio enfrentado por Mendeleiev para escrever o livro foi como organizá-lo. Ele decidiu lidar com os elementos e seus compostos em grupos ou famílias definidos de acordo com suas propriedades. Depois da tarefa relativamente fácil de descrever os halógenos e os metais alcalinos, ele enfrentou a questão sobre qual grupo descrever em seguida. Será que a ordem devia ser arbitrária? Ou haveria algum princípio organizacional determinante?
Mendeleiev batalhou com esse problema, pesquisando a fundo seus vastos conhecimentos de química em busca de pistas acerca de como os diferentes grupos estariam relacionados. Num sábado, ele ficou tão absorto que trabalhou a noite toda até o amanhecer. Não chegou a lugar nenhum, mas em seguida alguma coisa fez com que escrevesse os nomes dos elementos dos grupos do oxigênio, nitrogênio e halógenos – doze elementos ao todo – no verso de um envelope, em ordem ascendente, de acordo com seus pesos atômicos.
De repente, ele notou um padrão surpreendente: a lista começava com nitrogênio, oxigênio e flúor – os membros mais leves de cada grupo –, continuava com os membros mais leves de cada grupo, e assim por diante. A lista, em outras palavras, formava um padrão repetitivo ou “periódico”. O padrão só não se mantinha no caso de dois elementos.
Mendeleiev tornou sua descoberta mais clara organizando os elementos de cada grupo numa fila e escrevendo as filas uma em cima da outra, traçando uma tabela. (Hoje nós escrevemos os grupos em colunas.) Será que aquilo significava alguma coisa? E se aqueles doze elementos formassem mesmo um padrão significativo, será que os outros 51 elementos conhecidos na época se encaixariam no esquema?
Mendeleiev e seus amigos costumavam jogar paciência, jogo em que se organizam as cartas do baralho segundo certa disposição. As cartas formavam uma figura muito parecida com a tabela de doze elementos que ele construiu naquele dia, como contaria mais tarde. Mendeleiev resolveu escrever os nomes e pesos atômicos de todos os elementos conhecidos em cartões e tentar construir uma tabela com eles, jogando o que ele chamou de “paciência química”. Começou a remexer nas cartas ao acaso, tentando organizá-las de maneira a fazer sentido.
Havia sérios problemas com o método de Mendeleiev. Um deles é que não ficava evidente a qual grupo pertenciam alguns elementos. As propriedades de outros não eram muito bem conhecidas. Havia ainda algumas discordâncias sobre os pesos atômicos de certos elementos porque, como sabemos agora, os pesos atribuídos a alguns deles estavam totalmente errados. Talvez o mais grave: ainda havia elementos a serem descobertos, e isso fazia com que a sequência não funcionasse muito bem.
Todos esses problemas dificultaram a tarefa de Mendeleiev, mas ali havia alguma coisa mais sutil: não havia razão alguma para acreditar que um esquema baseado no peso atômico funcionasse, pois ninguém na época entendia quais aspectos químicos eram influenciados pelos átomos. (Hoje sabemos que é o número de prótons e nêutrons no núcleo, e que o peso dos nêutrons não interfere nas propriedades químicas do átomo.) Foi aqui, especificamente, que a teimosia de Mendeleiev manteve sua paixão acesa em busca de uma ideia: ele continuou a pesquisa baseado somente na intuição e na fé.
O trabalho de Mendeleiev mostra, de forma mais literal que a maioria, como o processo científico é uma atividade semelhante à solução de um quebra-cabeça. Mas também ilustra importantes diferenças, pois, ao contrário das peças de um quebra-cabeça que você compra na loja, as peças de Mendeleiev não se encaixavam. É próprio da ciência e de toda inovação às vezes ignorar aspectos que parecem indicar que o método não vai dar certo, mantendo-se a convicção de que afinal um caminho será encontrado, que no fim esses aspectos serão irrelevantes. Nesse caso, com notável genialidade e extraordinária persistência, Mendeleiev criou sua imagem refazendo algumas peças do quebra-cabeça e produzindo outras que não existiam.
Em retrospecto, é fácil definir a realização de Mendeleiev como um ato de heroísmo, como eu próprio já devo ter feito. Mesmo quando suas ideias parecem loucas, se elas funcionam você se torna um herói. No entanto, existe o outro lado, pois muitos esquemas malucos deram errado ao longo da história. Aliás, os esquemas que funcionam são em muito menor número que aqueles que fracassam. Estes últimos são esquecidos, bem como o desperdício de dias e anos de trabalho investidos pelos que acreditaram neles. É normal chamarmos os proponentes desses esquemas de loucos ou fracassados. Mas o heroísmo tem a ver com correr riscos, e o que é realmente heroico numa pesquisa, dando ou não dando certo, é o risco assumido pelos cientistas e outros inovadores – as longas horas, dias, meses ou até anos de intensa batalha intelectual que podem ou não dar em algum produto ou resultado frutífero.
Mendeleiev sem dúvida investiu muito tempo. Quando um elemento não encaixava no lugar que ele desejava, se recusava a aceitar que seu esquema estava errado. Preferia confiar no próprio taco e concluir que os que haviam medido aquele peso atômico estavam enganados – e ousadamente substituía o peso medido pelo valor que fazia o elemento se encaixar naquele lugar.
Suas declarações mais audaciosas surgiram quando sua tabela o deixou com alguns hiatos – regiões em que não havia nenhum elemento com as propriedades necessárias. Em vez de abandonar suas ideias ou tentar alterar o princípio organizacional, Mendeleiev continuava insistindo, convencido de que aqueles espaços representavam elementos ainda não descobertos. Chegou a prever até as propriedades desses novos elementos – o peso, as características físicas, com que outros elementos combinariam e o tipo de compostos que formariam – baseado apenas nos espaços que continuavam vazios.
Havia um lugar vago ao lado do alumínio, por exemplo. Mendeleiev preencheu-o com um elemento que chamou de eka-alumínio, e chegou a prever que, quando algum químico o identificasse, o eka-alumínio seria um metal brilhante, bom condutor de calor, com baixo ponto de fusão, e que um centímetro cúbico do elemento pesaria exatamente 5,9 gramas. Poucos anos depois, um químico francês chamado Paul-Émile Lecoq de Boisbaudran identificou em amostras de minério um elemento que se encaixava no quadro, mas que pesava somente 4,7 gramas por centímetro cúbico. Imediatamente Mendeleiev mandou uma carta a Lecoq informando que sua amostra devia ser impura. Lecoq repetiu sua análise com uma nova amostra, que fez questão de purificar com o maior rigor. Dessa vez o peso foi exatamente o previsto por Mendeleiev: 5,9 gramas por centímetro cúbico. Lecoq batizou o elemento de gálio, em homenagem ao nome latino da França, Gália.
Mendeleiev publicou sua tabela em 1869, primeiro numa obscura revista científica russa, depois numa respeitada publicação alemã, com o título de “Sobre as relações das propriedades dos elementos com seus pesos atômicos”.29 Além do gálio, a tabela incluía vagas para outros elementos ainda desconhecidos – hoje chamados escândio, germânio e tecnécio. O tecnécio é um elemento radioativo, tão raro que só foi descoberto em 1937, quando foi sintetizado num cíclotron – espécie de acelerador de partículas –, quase trinta anos depois da morte de Mendeleiev.
Tabela periódica original de Mendeleiev, publicada em 1869, e a tabela periódica atual.
O Prêmio Nobel de Química foi concedido pela primeira vez em 1901, seis anos antes da morte de Mendeleiev. Um dos grandes erros de julgamento da história da premiação foi que Mendeleiev nunca o recebeu, pois sua tabela dos elementos era o princípio organizacional nuclear da química moderna, a descoberta que tornou possível dominarmos a ciência da substância, a pedra angular que coroaria 2 mil anos de trabalho iniciado nos laboratórios de alquimistas e embalsamadores.
Mas Mendeleiev acabou se tornando membro de um clube muito mais seleto. Em 1955, cientistas de Berkeley conseguiram produzir doze átomos de um novo elemento, mais uma vez num cíclotron, e em 1963 eles o chamaram de mendelévio, em homenagem às magníficas realizações do cientista. O Prêmio Nobel foi outorgado a mais de oitocentos cientistas, mas somente dezesseis pesquisadores têm um elemento com o seu nome. Mendeleiev é um deles, tendo conquistado seu lugar na tabela que criou, onde aparece com o número 101, bem perto do einstêinio e do copernício.
a Fiquei sabendo que meu pai tinha participado da resistência não por ele, mas quando vi seu nome mencionado num livro sobre o assunto que encontrei na biblioteca da universidade. Depois que li sobre ele, comecei a questioná-lo sobre suas experiências.
b “Oxigênio” significa “gerador de ácido”, nome que Lavoisier escolheu porque o oxigênio estava presente em todas as composições ácidas que ele conhecia.
c Ironicamente, em 1913, relatou-se que um busto em tamanho natural de Condorcet, presenteado à Sociedade Americana de Filosofia da Filadélfia, não era Condorcet, mas Lavoisier!23