
12.8 Calcoli di variazioni di entropia
In questo paragrafo trattiamo alcuni processi tipici, in cui sistemi costituiti da corpi solidi o liquidi scambiano calore tra loro o con sorgenti, e calcoliamo le corrispondenti variazioni di entropia. L’argomento è completato nel paragrafo 12.9, dove ci occupiamo di sistemi costituiti da gas ideali.
Trasformazioni adiabatiche
Un sistema che compie una trasformazione adiabatica costituisce un caso particolare di universo termodinamico, in cui si assume che il sistema sia isolato termicamente dall’ambiente: l’ambiente non scambia calore col sistema, ma soltanto lavoro; pertanto ΔSamb = 0 e

Se la trasformazione è reversibile ΔSsist = 0, la trasformazione cioè è isoentropi-ca. Come già detto nel paragrafo 12.6, il risultato si ottiene anche direttamente dalla definizione (12.14).
Per una trasformazione adiabatica irreversibile invece ΔSsist > 0, l’entropia aumenta. In effetti questa volta dQ = 0 non implica dS = 0: il calore scambiato lungo la trasformazione è nullo, però ΔSsist non è calcolabile lungo questa trasformazione, bensì lungo un’altra con gli stessi estremi, ma reversibile, che non può essere adiabatica a sua volta. Questo perché due stati collegati con una adiabatica irreversibile hanno necessariamente entropia diversa e non possono quindi essere collegati anche con una adiabatica reversibile, che è isoentropica (e viceversa, due stati diversi per i quali è ΔS = 0 non possono essere collegati con un’adiabatica irreversibile).
Scambi di calore con sorgenti
Consideriamo prima il caso della cessione di calore Q da una sorgente a temperatura T2 a una sorgente a temperatura T1 < T2 .
La sorgente che assorbe il calore Q ha una variazione di entropia
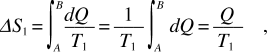
mentre per la sorgente a T2 che cede il calore – Q si ha

L’universo è costituito dalle due sorgenti e

si verifica che la variazione è positiva, dato che T1 < T2 . L’entropia della sorgente fredda è aumentata, quella della sorgente calda è diminuita, però | ΔS2 | < ΔS1 . Il processo contrario è proibito perché comporterebbe una diminuzione di entropia dell’universo.
Il fenomeno descritto è irreversibile; esso si può realizzare ponendo a contatto termico le sorgenti per il tempo necessario a scambiare il calore Q. Comunque sia, per definizione il processo di scambio di calore da parte di una sorgente è isotermo; per tale ragione abbiamo utilizzato (12.17) nel calcolo ΔS1 e ΔS2 , immaginando di compiere, per ciascuna sorgente, una trasformazione isoterma reversibile tra gli stessi stati iniziale e finale.
Esempio 12.3
Due sorgenti, una alla temperatura T2 = 380 K e l’altra alla temperatura T1 = 280 K, vengono messe in contatto termico tramite una lastra di alluminio, di area S = 100 cm2 e spessore d = 2.5 cm. Calcolare, a regime, quanto calore passa in un secondo da una sorgente all’altra e la variazione di entropia dell’universo in un minuto.
Soluzione
Ricorriamo alla formula di Fourier per la trasmissione del calore per conduzione (paragrafo 10.9):

In un minuto passa il calore Q' = 4.824 · 105 J e la variazione di entropia richiesta vale
 L’entropia della lastra non varia, in quanto il calore assorbito è eguale, in modulo, al calore ceduto e la distribuzione di temperatura è costante nel tempo.
L’entropia della lastra non varia, in quanto il calore assorbito è eguale, in modulo, al calore ceduto e la distribuzione di temperatura è costante nel tempo.Un passaggio di calore tra due sorgenti avviene anche quando tra di esse lavora una macchina, secondo la figura 12.16. La variazione di entropia del sistema macchina è nulla in un ciclo; l’ambiente è costituito dalle due sorgenti e la variazione complessiva di entropia è


Figura 12.16
Il segno meno è dovuto al fatto che con Q1 e Q2 intendiamo i calori scambiati dal sistema, mentre ora stiamo calcolando la variazione di entropia dell’ambiente, per il quale i calori hanno segno opposto. Dal teorema di Clausius (12.10) vediamo che il termine tra parentesi è non positivo e quindi ΔSu ≥ 0, come deve. Se la macchina è reversibile vale (12.12) e ΔSu = 0, altrimenti ΔSu > 0.
Il ragionamento resta valido se la macchina della figura 12.16 è frigorifera.
Esempio 12.4
Tra due sorgenti alle temperature T2 = 330 K e T1 = 280 K lavora una macchina termica: il lavoro W = 100 J prodotto in un ciclo viene utilizzato integralmente per fare compiere un ciclo tra le stesse temperature ad un frigorifero reversibile. In un ciclo completo delle due macchine la variazione di entropia dell’universo è ΔSu = 0.28 J/K. Calcolare il rendimento della macchina termica e i calori scambiati complessivamente con le sorgenti.
Soluzione
L’entropia dell’universo può cambiare solo durante il ciclo della prima macchina, poiché la seconda è reversibile. Chiamiamo Q2 e Q1 i calori scambiati dalla prima macchina e utilizziamo (12.24) e il primo principio:

da cui ricaviamo
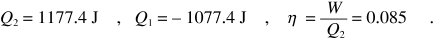
Invece il rendimento di una macchina reversibile che lavora tra le stesse sorgenti è
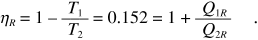
Se questa macchina produce il lavoro W = 100 J, pari a Q1R + Q2R , si ha
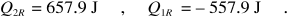
Cambiati di segno, questi sono gli scambi energetici del frigorifero reversibile: assorbe – Q1R = 557.9 J a T1 , assorbe –W = – 100 J e cede – Q2R = – 657.9 J a T2. Facendo il bilancio complessivo:
 Il risultato finale è il passaggio di 519.5 J dalla sorgente a 330 K a quella a 280 K. Se calcoliamo ΔSu per questo processo diretto con la formula – Q/T2 + Q/T1 troviamo ovviamente 0.28 J/K.
Il risultato finale è il passaggio di 519.5 J dalla sorgente a 330 K a quella a 280 K. Se calcoliamo ΔSu per questo processo diretto con la formula – Q/T2 + Q/T1 troviamo ovviamente 0.28 J/K.Consideriamo adesso lo scambio di calore tra un corpo di massa m, calore specifico c costante, temperatura T1 e una sorgente a temperatura T2 , con cui il corpo viene messo a contatto termico.
Il processo è irreversibile (non c’è equilibrio termico); per il calcolo della variazione di entropia del corpo immaginiamo un processo reversibile con scambio di calore tra il corpo e infinite sorgenti a temperatura crescente T1 + dT, T1 + 2 dT, … , T2 – dT, T2 . Con ciascuna sorgente viene scambiato il calore dQ = mcdT e, da (12.14),
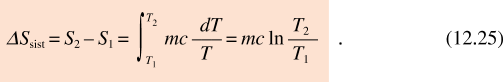
Se T1 < T2 il corpo assorbe calore dalla sorgente e la sua entropia aumenta; se T1 > T2 il corpo invece cede calore alla sorgente e la sua entropia diminuisce.
Il calore scambiato dal corpo è

e quindi il calore scambiato dalla sorgente è – Q. La variazione di entropia della sorgente è
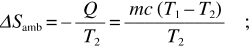
essa è di segno opposto rispetto aΔSsist ed è diversa in modulo. La variazione di entropia dell’universo è data da
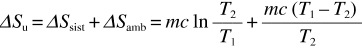
ed è facile verificare che essa è sempre positiva, sia per T2 > T1 che per T2 < T1 . Per esempio, nel caso T2 > T1 ,

essendo sempre T < T2 durante il processo, dSsist > | dSamb | e la diseguaglianza si mantiene a integrazione effettuata:

Quando T1 > T2 , cambiano i segni delle variazioni di entropia ed è sempre T > T2 , per cui dSamb > | dSsist | e si ottiene di nuovo ΔSu > 0.
Con un ragionamento quasi identico si verifica, per il corpo, (12.21): infatti

mentre nel processo reale irreversibile la temperatura a cui avviene lo scambio di calore è la temperatura T2 della sorgente per cui

Quando T2 > T1 , dT è positivo, T è minore di T2 , dT/T è maggiore di dT/T2 ; quando T2 < T1 , dT è negativo, T è maggiore di T2 e di nuovo dT/T è maggiore di dT/T2 (in modulo è minore, ma si tratta di numeri negativi).
Scambi di calore tra due corpi
Un corpo di massa m1 , calore specifico costante c1 e temperatura T1 , viene messo a contatto, in un recipiente isolato termicamente, con un altro corpo di massa m2 , calore specifico c2 e temperatura T2 > T1 . Avviene uno scambio di calore irreversibile, considerata la differenza iniziale di temperatura tra i due corpi (irreversibilità termica), e i due corpi raggiungono l’equilibrio termico alla temperatura Te data da
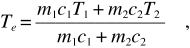
come si ricava eguagliando i moduli dei calori scambiati (vedi paragrafo 10.7). Per le variazioni di entropia dei due corpi utilizziamo (12.25):

L’intero processo è adiabatico (irreversibile) per cui ΔSu = ΔS1 + ΔS2 e si ha sempre .
Esempio 12.5
Due masse d’acqua, m2 = 100 kg e m1 = 240 kg, si trovano alle temperature T2 = 90°C e T1 = 10°C. I recipienti che le contengono vengono posti in contatto termico tra loro e isolati dall’ambiente esterno. Calcolare la variazione di entropia. Ripartendo dalle stesse condizioni iniziali si fa lavorare tra le due masse una macchina termica reversibile finché viene raggiunto l’equilibrio termico. Calcolare la temperatura di equilibrio.
Soluzione
Nel primo caso m1c (Te – T1) = – m2c (Te – T2) da cui risulta

La variazione di entropia vale
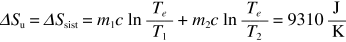
ricordando che c = 4186.8 J/kg K (e che le temperature devono essere espresse in kelvin).
Nel secondo caso il processo è reversibile e quindi la variazione di entropia dell’universo è nulla:

È interessante notare come sia l’espressione matematica del secondo principio a fornire l’equazione risolutiva. È anche importante rendersi conto che in questo caso la macchina non lavora tra due sorgenti, ma tra due corpi con capacità termica finita la cui temperatura varia durante il processo. Il calore assorbito dalla macchina è quello ceduto è , il lavoro prodotto è W = QA + QC , il rendimento η = W/QA .
Cambiamenti di fase
I cambiamenti di fase sono processi isotermi: mettendo insieme (12.17) e (10.18), la variazione di entropia di m chilogrammi di una sostanza che cambia fase alla temperatura T è

Esempio 12.6
Un blocco di ghiaccio alla temperatura T1 = 0°C viene posto a contatto, in un ambiente termicamente isolato, con un blocco di rame alla temperatura T2 = 100°C; ad equilibrio raggiunto si è sciolta una quantità mx di ghiaccio. La capacità termica del blocco di rame è C = 6 · 103 J/K e il calore latente di fusione del ghiaccio è λ = 3.34 · 105 J/kg. Calcolare il valore di mx e la variazione di entropia dell’universo.
Soluzione
Dal testo si deduce che la temperatura di equilibrio è T1 , in quanto non fonde tutto il ghiaccio. La massa che fonde si ricava da

La variazione di entropia del ghiaccio che cambia fase è, da (12.26),

mentre quella del blocco di rame si ricava da (12.25):
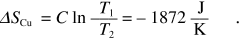
Per l’universo ΔSu = ΔSg + ΔSCu = 325 J/K .
Esempio 12.7
Una macchina termica lavora tra una massa d’acqua m2 = 106 kg alla temperatura T2 = 10°C e una massa di ghiaccio m1 = 0.2 · 106 kg alla temperatura T1 = 0°C. Calcolare il massimo lavoro ottenibile.
Soluzione
Il massimo lavoro si ha impiegando una macchina reversibile che assorbe calore dall’acqua e cede calore al ghiaccio facendolo fondere; nel processo la temperatura dell’acqua diminuisce e alla fine diventa T1 . Infatti il calore che il ghiaccio può assorbire dall’acqua è

inferiore al calore che sarebbe necessario per fondere tutto il ghiaccio

Essendo la macchina reversibile ΔSu = 0, ovvero, essendo ΔSsist = 0,

dove Q0 è il calore assorbito dal ghiaccio, che risulta pari a 4.11 · 1010 J. La macchina pertanto assorbe Q, cede – Q0 e compie il lavoro
 con rendimento η = W/Q = 0.019. Se la temperatura dell’acqua restasse costante durante il processo, il rendimento sarebbe
con rendimento η = W/Q = 0.019. Se la temperatura dell’acqua restasse costante durante il processo, il rendimento sarebbe
Riscaldamento per attrito
Riprendiamo dal paragrafo 10.6 l’esempio del corpo il cui moto viene frenato da una forza di attrito. Il lavoro dissipativo W è eguale all’opposto della variazione di energia interna del corpo e del sistema che esercita la forza di attrito, secondo (10.2): W = UA – UB e, siccome il lavoro è negativo, l’energia interna aumenta (UB > UA) e aumenta la temperatura da Tamb a T. Successivamente viene ceduto calore all’ambiente, Q = UA – UB = W e la temperatura dei corpi che hanno partecipato al fenomeno ritorna al valore iniziale Tamb , così come U ritorna da UB a UA .
In definitiva i corpi hanno subito una trasformazione ciclica: la loro entropia è aumentata durante il riscaldamento ed è calcolabile con formule tipo (12.25), immaginando una cessione di calore reversibile al posto del processo reale adiabatico irreversibile; però durante la cessione di calore all’ambiente l’entropia dei corpi diminuisce e alla fine l’unica variazione di entropia diversa da zero è quella dell’ambiente, che riceve il calore – Q (si ricordi che Q è negativo, in quanto è il calore ceduto dal corpo):

Quello descritto è solo un caso particolare; è possibile mantenere costante la velocità del corpo con la fornitura di lavoro motore che bilanci il lavoro resistente (equilibrio dinamico nel moto uniforme reale) e ciò comporta una cessione continua di calore all’ambiente. Oppure si può considerare il caso dell’innalzamento stabile di temperatura di un corpo in quiete in cui si raggiunge un equilibrio energetico nel senso che il calore ceduto dal corpo all’ambiente è compensato dall’energia fornita al corpo attraverso fenomeni di attrito. In ogni situazione si verifica sempre ΔSu > 0, segnale dell’irreversibilità di questi processi.