2. I meccanismi del sistema immunitario
Per arrivare a considerare la depressione in modo diverso, dobbiamo partire da un punto di vista poco familiare, quello dei linfonodi, della milza e dei globuli bianchi. Dobbiamo cioè entrare nel regno dell’immunologia, la scienza del sistema immunitario che spiega i meccanismi e la logica dell’infiammazione. Grazie all’immunologia sappiamo infatti che l’infiammazione compare quando il sistema immunitario ci difende dai nostri nemici.
Curare le infiammazioni è sempre stato fondamentale per la medicina infatti, mentre mi preparavo per diventare medico (fino al 1990 circa prima di dedicarmi alla psichiatria) ho studiato piuttosto diligentemente l’immunologia clinica. Poi non ho più preso in mano un libro di testo o un articolo di immunologia fino al 2012 e in quell’occasione sono rimasto sinceramente colpito dai progressi compiuti dall’ultima volta che me ne ero interessato.
L’immunologia del XXI secolo ha le stesse basi che avevo studiato nel XX secolo e anche gli elementi essenziali di alcuni degli schemi presenti nei libri di testo non sono cambiati, però da ogni punto di vista il quadro complessivo appare oggi straordinariamente più dettagliato e complesso. Sono state compiute molte scoperte nuove e, allo stesso tempo, numerose vecchie certezze sono state superate. La nuova immunologia ancora in via di sviluppo è una vera potenza in termini scientifici e terapeutici, in modo del tutto inedito.1 Soprattutto, per quanto ci riguarda, permette di pensare in modo diverso ai collegamenti tra sistema immunitario, cervello, comportamento e umore generale. Lo stato infiammatorio del corpo, l’aumento del livello di minaccia percepito dal sistema immunitario, possono avere un effetto diretto su come ci sentiamo e sui pensieri che formuliamo. Per dirla in modo più scientifico, l’infiammazione del corpo può indurre cambiamenti nel funzionamento del cervello e questo, a sua volta, può determinare modifiche dell’umore, della percezione e del comportamento, modifiche che chiamiamo complessivamente depressione.
Infiammazione e infezione
Per capire come funziona questo processo, da cima a fondo, partiamo dai mattoncini fondamentali del corpo umano, le nostre microscopiche cellule che esistono in milioni di varietà differenti, ognuna specializzata per svolgere una funzione diversa. I neuroni sono le cellule che formano la maggior parte del sistema nervoso, i globuli bianchi sono le cellule più importanti del sistema immunitario e le cellule endoteliali sono quelle che costituiscono il rivestimento delle arterie e delle vene nel sistema cardiovascolare. Tenendo conto della specifica funzione che svolgono, i globuli bianchi possono essere ulteriormente suddivisi in: macrofagi, linfociti e cellule della microglia. Insieme, tutte queste cellule sono le protagoniste principali del sistema immunitario (Figura 1).
La materia prima che distingue le varie cellule del corpo umano è rappresentata dalle proteine, cioè i miliardi di molecole diverse, costruite singolarmente a partire dal codice genetico del DNA che riceviamo in eredità dai nostri genitori. Tutti gli anticorpi e gli enzimi sono proteine, così come le citochine e molti ormoni, ad esempio l’insulina. Molte proteine agiscono da segnali biologici, trasmettendo informazioni all’interno di una cellula o tra una cellula e l’altra. Queste proteine segnale riconoscono un’altra proteina (chiamata recettore) sulla superficie delle cellule bersaglio e ad essa si legano. La gerarchia biologica costituita da sistemi, organi, tessuti, cellule, proteine e, alla fine, DNA, forma l’organismo, ad esempio un essere umano proprio come noi. Invariabilmente l’organismo umano (che nel complesso costituisce il self) viene attaccato da organismi non umani come i batteri (che fanno parte del non-self). L’infiammazione è lo strumento con cui il sistema immunitario difende il self dal non-self, proteggendo noi da loro.
Qualcosa sulle infiammazioni si sapeva già nell’antichità. La prima descrizione riconoscibile è attribuita a Celso, un medico romano così rinomato in passato nei circoli medici che perfino millecinquento anni dopo la sua morte il medico più originale e vanaglorioso dell’Europa medievale scelse di chiamarsi Paracelso («oltre Celso»), non potendo pensare a nessun nome d’arte più grandioso per se stesso.
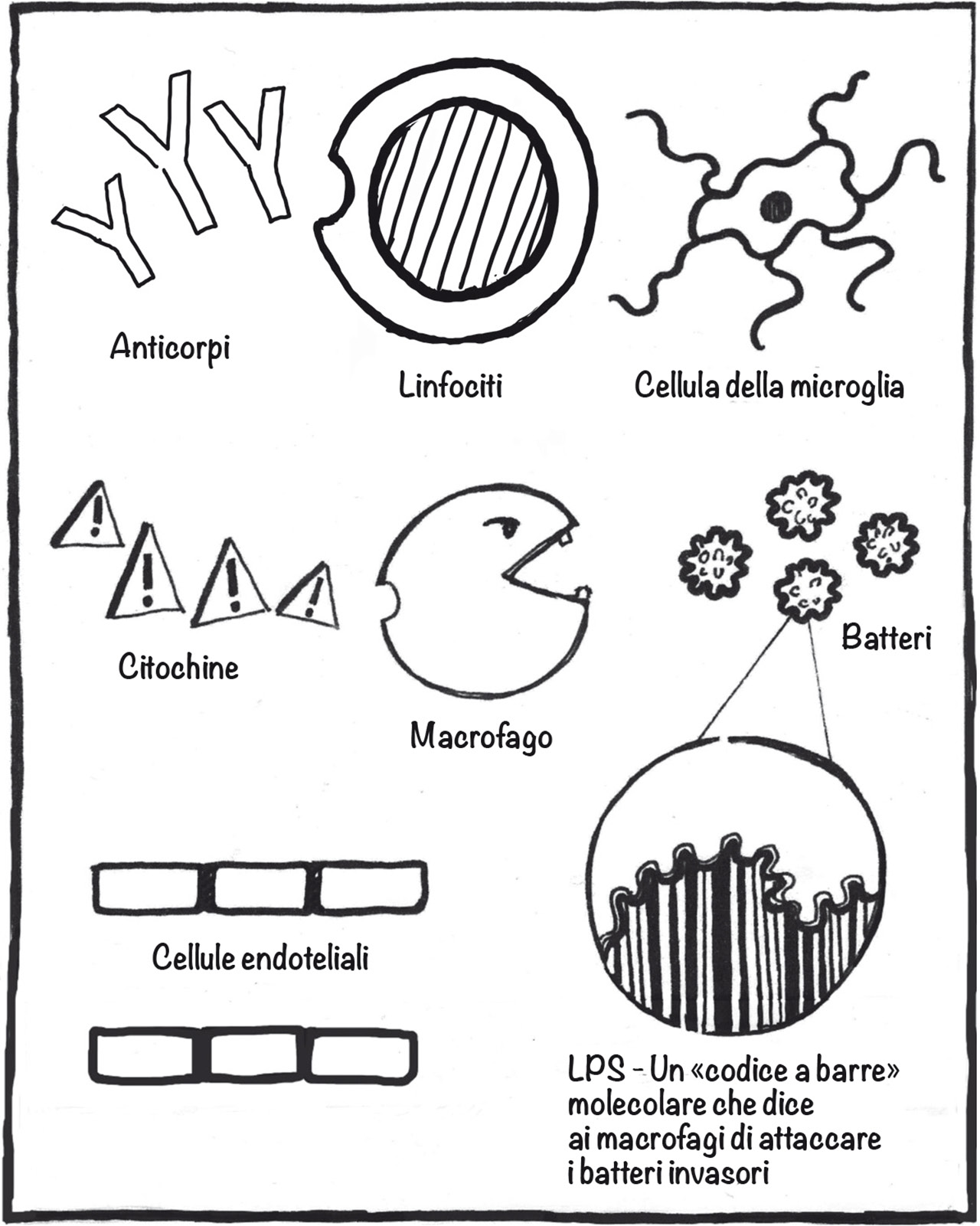
Figura 1. Cellule del sistema immunitario.
Le «immunoji» rappresentano gli attori principali del sistema immunitario. I macrofagi sono grosse cellule che fagocitano i batteri e producono citochine, o «ormoni dell’infiammazione». Queste cellule si trovano ovunque nel corpo. Le cellule della microglia sono macrofagi presenti esclusivamente nel cervello. I linfociti producono anticorpi che aiutano i macrofagi a combattere le infezioni. Le cellule endoteliali costituiscono il rivestimento interno delle arterie e delle vene.
Celso fu il primo a descrivere l’infiammazione come una sindrome, un insieme di sintomi e segni diagnostici tra cui arrossamento, calore, gonfiore e dolore. Egli capì anche che l’infiammazione spesso si sviluppava in seguito a una lesione. Così, ad esempio, se un uomo veniva pugnalato a una mano, l’area ferita diventava calda, rossa, gonfia e dolorante (Figura 2). La mano sviluppava un’infiammazione acuta, inequivocabilmente diagnosticabile con un esame clinico, tanto che il concetto di infiammazione acuta è tuttora utilizzato in campo medico. Soltanto in tempi più recenti sono state infine trovate le risposte ad alcune domande sui meccanismi dell’infiammazione, in particolare, come e perché il corpo rispondeva alla lesione in modo tanto particolare?
L’immunologia è riuscita alla fine a rispondere a queste domande con una notevole accuratezza. Oggi sappiamo che centinaia di proteine interagiscono tra loro lungo vie di segnalazione cellulare per tradurre lo stimolo di natura traumatica, costituito dalla ferita, in una risposta infiammatoria. Siamo in grado di descrivere, passo dopo passo, una catena molecolare di cause ed effetti che spiega come la risposta infiammatoria alla lesione determini la dilatazione locale dei vasi sanguigni, permettendo un maggior afflusso di sangue nell’area danneggiata e producendo calore, uno dei sintomi già noti in antichità. Sappiamo poi con precisione che l’infiammazione induce i vasi sanguigni a rilasciare fluidi che abbandonano la circolazione e si accumulano nei muscoli e negli altri tessuti interessati dalla lesione, causando il gonfiore, un altro sintomo «classico». Conosciamo questi e molti altri dettagli biologici della produzione della risposta infiammatoria da parte del sistema immunitario. Ma, soprattutto, oggi sappiamo anche perché le cose stanno così.
L’infiammazione e la difesa immunitaria sono i mezzi che ci permettono di sopravvivere in un mondo ostile. Gli individui sfortunati che nascono con un sistema immunitario non perfettamente funzionante a causa di qualche rara mutazione genetica, spesso non sopravvivono a lungo dopo la nascita. Senza un sistema immunitario siamo facili prede dei nostri nemici. E siamo letteralmente circondati da nemici che i medici antichi come Celso non riconoscevano o proprio non potevano vedere: artropodi minuscoli, germi di vario tipo, virus, batteri, vermi, protozoi, funghi. È lungo l’elenco degli organismi che si sono evoluti per riuscire a infettarci. E, di norma, quando loro hanno successo noi soccombiamo.
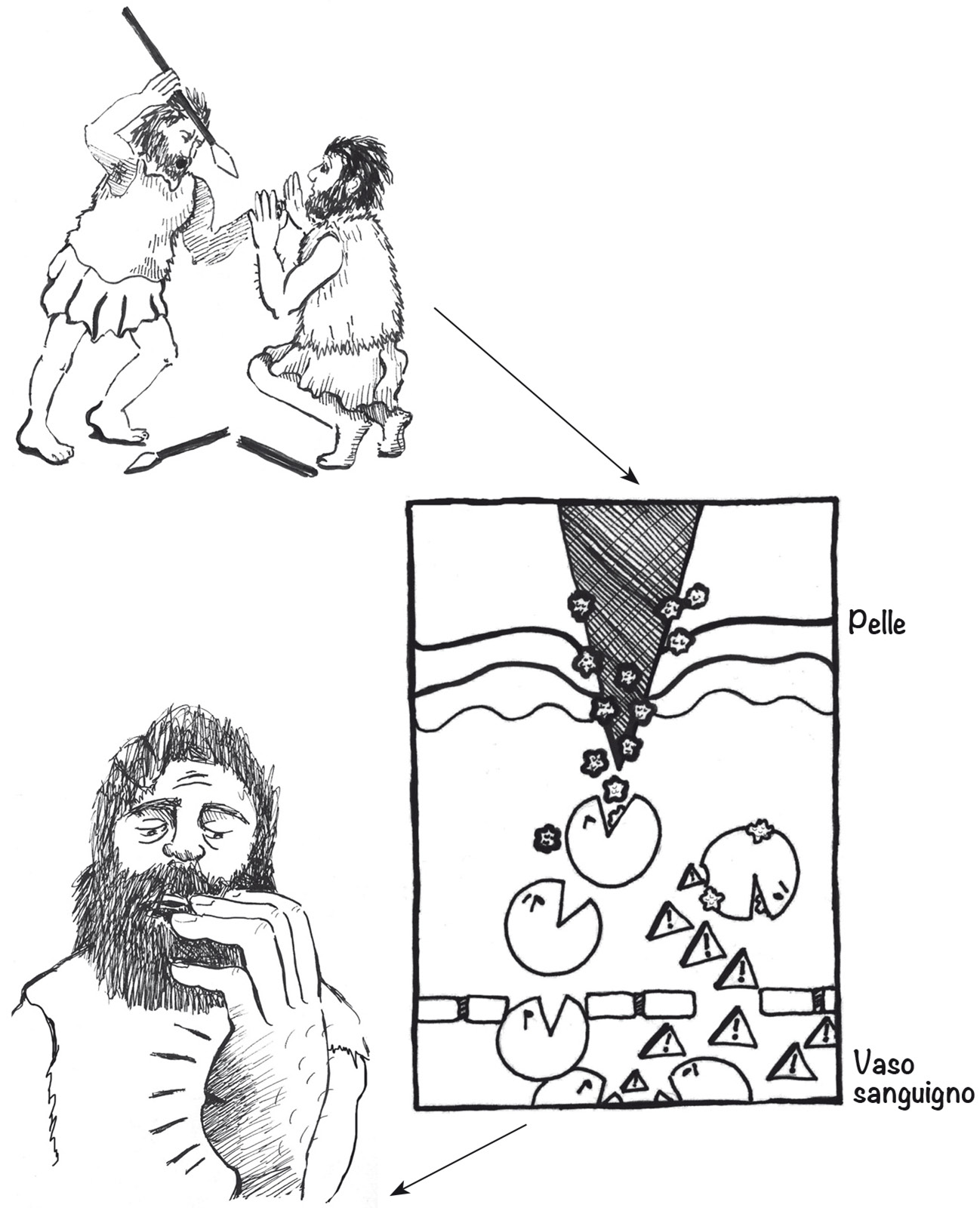
Figura 2. Infiammazione.
(In senso orario dall’alto) Nel corso di tutta la nostra storia, fin dall’antichità, scontri e lotte sono stati una causa comune di lesioni fisiche e infezioni. In epoca moderna l’immunologia ci ha permesso di capire come il corpo possa produrre una risposta infiammatoria in caso di lesione ed invasione di batteri ostili nella zona della ferita inferta con una lama. I macrofagi fagocitano i batteri che contaminano la lama e rilasciano nella circolazione sanguigna citochine, che attirano altri macrofagi i quali sciamano verso l’area danneggiata per sovrastare numericamente i batteri e difendere con successo il self dal non-self. Questi meccanismi a livello microscopico spiegano i sintomi macroscopici e i segni classici dell’infiammazione acuta: gonfiore, arrossamento e sensazione di dolore della mano ferita.
Se la lama con cui viene inferta la ferita è sporca, o anche se è pulita ma non rigorosamente disinfettata, sarà infatti coperta di batteri. La mano pugnalata verrà insomma infettata da qualsiasi batterio presente e, una volta insediatisi comodamente nei tessuti della mano, i batteri incominceranno a proliferare, riproducendosi con una velocità impressionante. Quale effetto avrà tutto questo? Le conseguenze dipendono in parte dalle specie di batteri presenti sulla lama, esistono milioni di specie batteriche differenti al mondo e non tutte sono ugualmente pericolose per gli esseri umani.
Però supponiamo che uno dei batteri che contaminavano la lama fosse della specie Clostridium tetani. Questo potrebbe trasformare una ferita non grave in una lesione letale, perché C. tetani, come è facile intuire dal nome, provoca il tetano. In termini più pratici, il batterio produce una tossina, cioè un tipo di veleno, che penetra nel sistema nervoso e sconvolge il normale equilibrio esistente tra eccitazione e inibizione dell’attivazione dei neuroni. I neuroni così si eccitano senza mai fermarsi e inviano segnali non-stop ai muscoli, facendoli contrarre con spasmi prolungati e dolorosi. Il primo segno dell’infezione è il trisma, la contrattura anomala dei muscoli della mandibola. I muscoli, che in condizioni normali aprono e chiudono la bocca, rimangono permanentemente contratti tanto che la bocca non può più aprirsi: il paziente non riesce quindi più a parlare, mangiare o bere. Contemporaneamente lo spasmo tetanico dei muscoli facciali induce gli angoli della bocca a sollevarsi così il paziente mantiene un’espressione fissa simile a un sorriso sardonico, nonostante soffra molto mentre la paralisi progredisce dolorosamente talvolta fino a causare immobilità e morte.
Ecco dunque contro chi dobbiamo combattere oggi e da sempre. Siamo costantemente sotto attacco da parte di nemici ostili e pericolosi. Ed è il nostro sistema immunitario che si occupa di difendere ognuno di noi (il self) nella guerra biologica scatenata contro di noi da organismi alieni (il non-self). L’organizzazione del sistema immunitario ha infatti alcune caratteristiche chiave che lo rendono perfettamente equipaggiato per questo ruolo difensivo vitale: la sua posizione, i suoi mezzi di comunicazione e la sua capacità di reagire e apprendere rapidamente.
Però, pur essendo così straordinario, il sistema immunitario non è infallibile. Può commettere errori. E quando il sistema immunitario sbaglia può provocare malattie altrettanto gravi di quelle da cui ci difende con tanta efficacia quando funziona bene. Cominciamo però a vedere le cose positive.
Quello che conta è la posizione
Con questo non vogliamo dire soltanto che la posizione è molto importante per il sistema immunitario, ma anche che il sistema immunitario si trova in tante posizioni diverse. La maggior parte del sistema nervoso è stipata (senza spreco di spazio) nel cranio, la maggior parte del sistema respiratorio si trova nel torace. Il sistema immunitario è diverso. Non possiamo indicare un punto del nostro corpo e dire «il mio sistema immunitario è qui»: non possiamo dirlo perché non è lì ma è ovunque.
Deve essere ovunque perché l’infezione può attaccarci da qualsiasi parte. Virus e batteri possono infettare il corpo sfruttando più ingressi: alcuni possono penetrare attraverso lesioni della pelle, altri ci infettano passando dai polmoni o dall’intestino. Qualsiasi superficie che divide il self dal non-self, il corpo dal mondo esterno, è esposta a un possibile attacco. E tutte quelle superfici sono linee di frontiera in una guerra biologica tra agenti non-self ostili (come C. tetani) e le difese perimetrali del self.
Le cellule del sistema immunitario distribuite più diffusamente in tutto il corpo e che fanno la guardia lungo la maggior parte del perimetro sono chiamate macrofagi. Questa parola è stata coniata nel XIX secolo a partire da due termini tratti dal greco antico: macro significa «grande» e fago deriva dal verbo «mangiare». Possiamo dunque pensare a un macrofago come a una cellula di grandi dimensioni che mangia molto (Figure 1 e 2). E di solito i macrofagi mangiano batteri: distruggono cioè i germi ostili inglobandoli in una membrana e digerendoli grazie ad appositi enzimi. Si tratta di macchine per uccidere estremamente efficaci ma le loro armi più potenti contro l’infezione sono però a corta gittata. Per mangiare il germe, il macrofago deve entrare in contatto diretto con lui, di conseguenza un singolo macrofago riuscirà soltanto a far fronte all’infezione batterica entro un raggio limitato, pari a pochi millimetri, dalla sua posizione. Per proteggere l’intero perimetro molti milioni di macrofagi devono essere disposti come guardie di confine, o come legionari al fronte ognuno impegnato a controllare un pezzetto limitato di tessuto, posizionato strategicamente nelle zone che hanno più probabilità di essere attaccate.
L’intestino è uno dei principali campi di battaglia contro le infezioni. Il rivestimento dell’intestino deve essere relativamente sottile e ricettivo per poter assorbire le sostanze nutritive contenute negli alimenti. Non può essere protetto fisicamente dalle infezioni come la pelle, cioè mediante uno spesso strato esterno di cheratina, e tuttavia è sempre in contatto con un denso brodo batterico e di cibo più o meno digerito che si sposta lungo le nostre viscere quotidianamente. La parete dell’intestino viene attraversata dunque senza sosta da batteri ed è difesa ininterrottamente da una legione di macrofagi che stazionano in ogni momento e si affastellano, dalla bocca all’ano.
Una situazione simile si osserva anche per i polmoni, i genitali e le varie parti del tratto urinario e la superficie dell’occhio: ovunque il corpo sia a diretto contatto con il mondo esterno, i macrofagi si trovano in abbondanza, in attesa del primo segno di pericolo. Ma quantunque siano efficaci le difese sulla linea del fronte, alcuni batteri invariabilmente riescono di tanto in tanto a penetrare. Riescono infatti a evitare di essere fagocitati immediatamente e quindi a proliferare e a diffondersi attraverso il flusso sanguigno e linfatico in tutto il corpo. Per offrire una difesa aggiuntiva agli organi interni fondamentali i macrofagi stazionano anche nella milza, nel fegato, nel cervello, nei reni, nei muscoli, nel tessuto adiposo e nelle ossa. L’elemento chiave della difesa è il fatto che il sistema immunitario, almeno in forma di macrofagi, si trova ovunque (Figura 3).
Comunicazione: il mezzo è il messaggio
Il secondo fattore chiave del piano difensivo del sistema immunitario è la comunicazione. Per agire come un unico sistema integrato e flessibile, le singole cellule dei macrofagi devono coordinarsi: questa è la differenza tra un centinaio di legionari isolati al fronte e un’intera legione romana. E proprio lo studio scientifico del modo in cui le cellule del sistema immunitario comunicano è stato il fulcro del recente sviluppo esplosivo dell’immunologia.
Oggi sappiamo che i macrofagi usano principalmente due metodi nella comunicazione con il resto del sistema immunitario: per contatto diretto con un’altra cellula, o mediante la secrezione di citochine, proteine che si muovono liberamente nel corpo e inviano segnali a più cellule. Il contatto cellula-cellula è utile soprattutto per trasmettere informazioni molto specifiche su un particolare agente patogeno. Il meccanismo di secrezione delle citochine è indicato per trasmettere un messaggio più generico sullo stato di un’infezione o sulla risposta infiammatoria messa in atto.
Le citochine secrete dai macrofagi entrano nella circolazione sanguigna, viaggiano in tutto il corpo nella veste di «ormoni dell’infiammazione» e quindi si legano a recettori specifici sulla superficie di altri macrofagi trasmettendo loro un segnale che li «irrita» o li «infiamma» di più. Per la maggior parte della sua vita (che può durare decenni) un macrofago se ne sta fermo e tranquillo per i fatti suoi, a guardia dello stesso lembo di tessuto nell’intestino o nella pelle, in attesa che accada qualcosa. Poi improvvisamente qualcosa succede davvero. Le zone vicine vengono invase da un esercito ostile costituito da batteri in rapida proliferazione e potenzialmente irrefrenabili. Il macrofago deve in questo caso avvisare il resto del sistema immunitario senza però abbandonare la sua postazione al fronte. Chiede quindi aiuto inviando forti segnali costituiti dalle citochine che possono diffondersi in fretta nel flusso sanguigno, trasmettendo l’allarme e chiamando alle armi ogni altra cellula del sistema immunitario del corpo in grado di cogliere il segnale con i recettori che ha sulla sua superficie. I macrofagi sono molto sensibili ai segnali delle citochine inviati da altri macrofagi che hanno bisogno di aiuto. Le citochine dell’infiammazione risvegliano i macrofagi quiescenti, che abbandonano le loro posizioni consuete e si dirigono verso la fonte del segnale infiammatorio per sostenere i loro commilitoni.
Per chiarire invece come funziona la comunicazione cellula-cellula torniamo alla mano pugnalata e supponiamo che la ferita si sia infettata e abbia innescato una risposta infiammatoria locale a causa della quale la mano è diventata rossa e gonfia. Un’esperienza simile, e più comune, potrebbe essere quella di un forte mal di gola (l’infiammazione locale della faringe) seguito, a qualche giorno di distanza, dal rigonfiamento del collo. Nel linguaggio di tutti i giorni diremmo che abbiamo «le ghiandole ingrossate», in termini medici si parla invece dell’aumento del volume dei linfonodi. I linfonodi coinvolti nel caso della mano pugnalata sono quelli ascellari, invece quelli che si gonfiano quando abbiamo il mal di gola sono i linfonodi cervicali nel collo.
I linfonodi, chiamati anche ghiandole linfatiche, entrano in gioco perché rappresentano un punto nevralgico, una sorta di hub che mantiene i contatti tra le cellule del sistema immunitario e permette loro di scambiare informazioni per contatto diretto. I linfonodi ascellari si gonfiano dopo che si è sviluppata un’infezione alla mano perché molti dei macrofagi che hanno combattuto con successo contro i batteri nemici si spostano dalla linea del fronte al linfonodo più vicino (ovvero nell’ascella se si parte dalla mano o nel collo se si parte dalla faringe). I macrofagi che si riversano nei linfonodi delle vicinanze non stanno fuggendo dal campo di battaglia ma fanno rapporto al sistema immunitario nel suo complesso, trasmettendo notizie dettagliate sulla natura del nemico. Ogni macrofago trasporta piccoli frammenti proteici dei batteri che ha fagocitato e digerito, pezzi dell’invasore non-self, complessivamente indicati come antigeni. Macrofagi diversi convogliano in modo disordinato frammenti differenti di antigeni casuali e affollano i linfonodi in cerca di un’altra cellula immunitaria (o linfocita) capace di riconoscere il loro pezzetto di puzzle antigenico e che sappia che cosa farne. Ogni macrofago si aggira dunque all’interno dei linfonodi, organizzando appuntamenti lampo e avendo brevi contatti con un linfocita dopo l’altro finché, letteralmente, non va a sbattere contro quell’unica, e sola, cellula immunitaria in grado di leggere l’informazione sul nemico portata dal macrofago al quartier generale dalla linea del fronte. Se il macrofago può essere paragonato a una guardia di frontiera, allora un linfocita è più simile a un generale. Se invece preferite pensare al macrofago come a un sicario robotico, una sorta di robocop, allora il linfocita sarà più simile a un agente dei servizi segreti o a una spia.
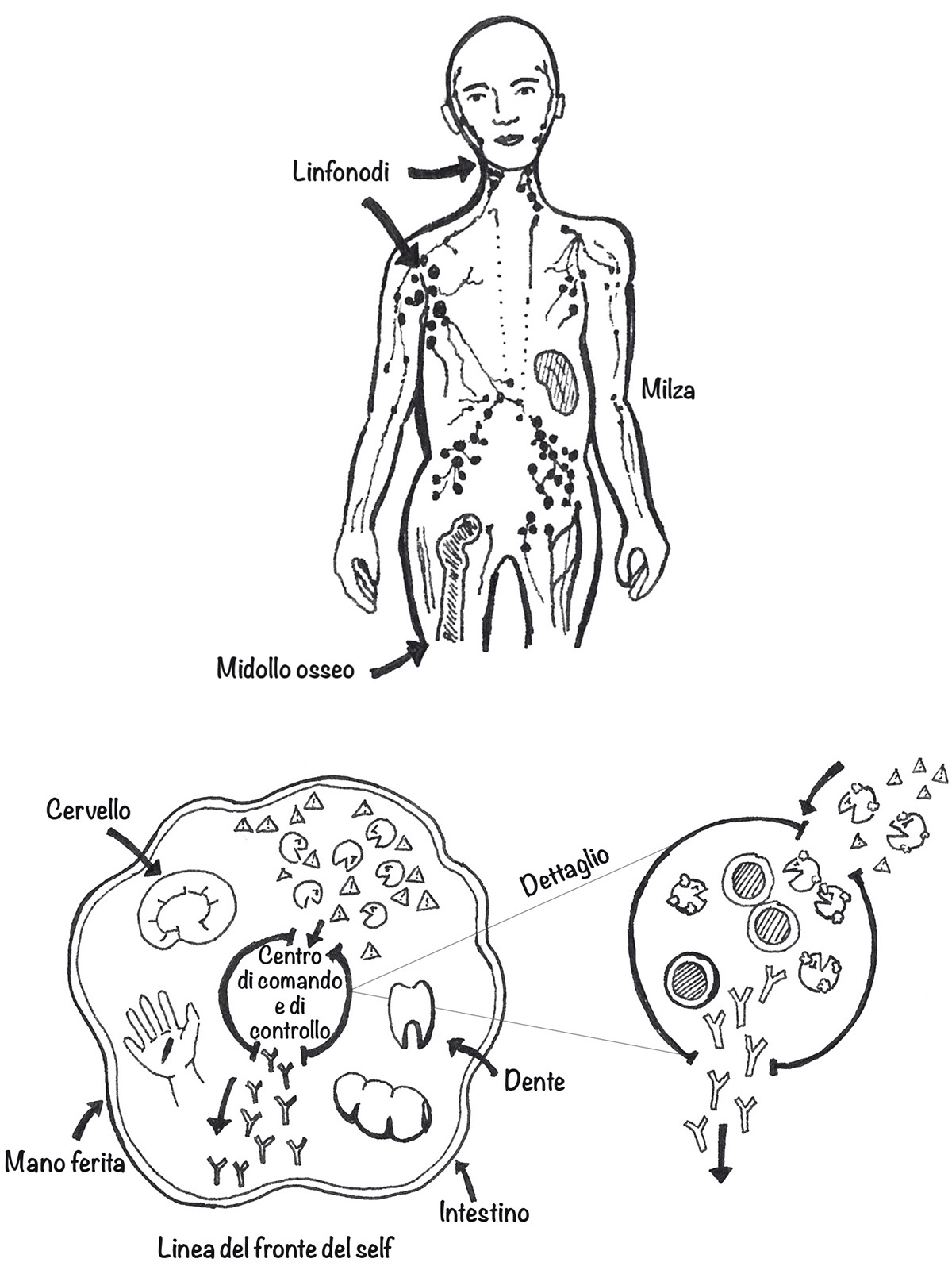
Figura 3. Il sistema immunitario.
Dal punto di vista anatomico il sistema immunitario dove si trova? I linfonodi delle ascelle e di altre zone del corpo sono connessi tra loro da una fitta rete di vasi linfatici, che consentono alle cellule immunitarie (linfociti) di circolare liberamente in tutto il corpo e di entrare nella circolazione sanguigna. I linfociti nel sangue sono chiamati globuli bianchi. Le cellule immunitarie si accumulano nella milza e il midollo osseo ne produce di nuove.
Il sistema immunitario dal punto di vista fisiologico come funziona? La funzione del sistema immunitario è quella di aiutarci a sopravvivere, difendendo il self dagli attacchi incessanti che riceviamo su tutti i fronti. I macrofagi sono le truppe sul fronte, addestrate dall’evoluzione ad attaccare a vista i batteri ostili, fagocitandoli e portandone i frammenti digeriti sulla loro superficie per trasmettere informazioni ai linfociti, i generali dell’esercito degli immunoji, sul preciso aspetto di un pezzo del nemico. I macrofagi comunicano con i linfociti nei linfonodi, nella milza, nel midollo osseo e negli altri centri di comando e di controllo del sistema immunitario. I linfociti possono pompare anticorpi nella circolazione per aiutare i macrofagi a difendere il self contro gli attacchi in corso e quelli futuri.
Quando il macrofago trova il linfocita giusto a cui fare il suo rapporto, le due cellule restano unite per alcuni giorni durante i quali si svolge una conferenza informativa sul contenuto dettagliato del messaggio antigenico. Al termine dell’incontro il linfocita decide di entrare in azione, spesso per intensificare o diversificare la risposta immunitaria inizialmente innescata dai macrofagi (Figura 3).
Il contatto diretto tra cellule immunitarie è fondamentale per trasmettere informazioni dettagliate sull’antigene, ovvero sulla natura del nemico. Questo processo è piuttosto lungo (occorrono giorni ai linfonodi per gonfiarsi dopo l’infezione), può avere successo oppure no (la maggior parte dei contatti tra cellule non determina la trasmissione di informazioni) e richiede luoghi di incontro speciali. Le cellule entrano in contatto soprattutto nei linfonodi che, a loro volta, sono concentrati nelle ascelle, nell’inguine, nel collo e lungo la linea mediana della cavità toracica e di quella addominale. Le cellule si incontrano anche nelle aggregazioni di tessuto linfatico che formano le tonsille e le adenoidi nella parte superiore della faringe oltre che nella milza, nel midollo osseo e nel timo, una ghiandola situata nella cavità toracica. In generale tutte queste zone di incontro sono indicate come organi del sistema immunitario (Figura 3). Possiamo pensare a questi organi come a centri di comando e controllo, luoghi in cui i linfociti si raccolgono per discutere faccia a faccia delle minacce presenti sul fronte e della strategia migliore per reagire.
Rigetto rapido e apprendimento
Il sistema immunitario è predisposto a riconoscere e reagire, sulla base di pregiudizi estremi, a qualunque cosa riconosca come non-self e ritenga potenzialmente pericolosa. Questo rigetto rapido viene messo a punto principalmente dall’esercito dei macrofagi schierati al fronte, cellule preparate dall’evoluzione a rispondere molto rapidamente e con estrema violenza ai primi segni di infezione.
La velocità della risposta è importante perché batteri e virus, che rappresentano il nemico, possono riprodursi molto in fretta. Un singolo batterio di C. tetani può duplicare in 20 minuti circa e questo numero raddoppierà dopo altri 20 minuti. Secondo la logica spaventosa della crescita esponenziale, un batterio può quindi diventare milioni di batteri nel giro di qualche ora. Il sistema immunitario pertanto deve vincere rapidamente la battaglia, o almeno indebolire molto il nemico, prima che l’equilibrio delle forze si sposti decisamente a favore degli invasori.
Ciascun macrofago sulla linea del fronte deve poter prendere d’impulso una decisione chiave: self o non-self, amico o nemico? Ogni cellula deve scegliere in modo autonomo, senza perdere tempo prezioso nella consultazione di altre cellule. Ma come può rispondere tanto rapidamente e con decisione se la minaccia arriva all’improvviso e, spesso, non si è mai vista prima? Là fuori, nel mondo ostile, ci sono milioni di batteri e virus diversi e nessun macrofago può conoscerli tutti in anticipo. Ciascun macrofago però eredita la conoscenza dei propri antenati. Ognuna di queste cellule è intrinsecamente preparata a riconoscere a prima vista un nemico che non ha mai incontrato prima.
La guerra biologica tra esseri umani e germi patogeni è iniziata nel momento in cui Homo sapiens si è evoluto come specie distinta oltre 150000 anni fa. Lo scontro tra mammiferi e batteri, o tra organismi pluricellulari e invasori unicellulari, va avanti da un tempo ancora più lungo. E nel corso dell’intera storia biologica, il «primo comandamento» dell’evoluzione viene da sempre rispettato: soltanto i più adatti sopravvivono. Gli antenati che sono riusciti a sopravvivere riuscendo a riprodursi e a trasmettere i propri geni ai discendenti spesso sono quelli che hanno sconfitto qualche infezione. Le mutazioni genetiche in grado di conferire anche il più lieve vantaggio nella lotta contro un’infezione sono state conservate per effetto della selezione naturale. In questo modo, percorrendo una strada lunga e tortuosa fatta di mutazioni genetiche casuali e di selezione naturale spietata, i nostri macrofagi si sono preparati a riconoscere e a reagire a minacce che noi personalmente potremmo non aver mai incontrato prima. Se però le nostre cellule, nel corso dei diversi decenni della nostra vita, non hanno mai incontrato quei nemici, le cellule dei nostri antenati di certo l’hanno fatto riuscendo a sopravvivere ed evolvere lungo una linea di discendenza che si può far risalire all’alba del tempo biologico.
È possibile, ad esempio, che non siamo mai stati in Africa. Se decidessimo di andarci in vacanza il nostro sistema immunitario, soprattutto la parte in relazione con il sistema digerente, si troverà improvvisamente esposta a sciami di batteri esotici non famigliari. Una minaccia biologica di questo tipo è imponente ed estranea perciò potrebbe anche rivelarsi fatale. Tuttavia nel corso dell’evoluzione, il nostro sistema immunitario ha appreso qualcosa di molto utile sui batteri. Potremmo dire che i nostri macrofagi sono stati programmati come robot dalla selezione naturale, sono infatti dotati di un software sofisticato preinstallato per il riconoscimento a vista e l’eliminazione fisica di molti batteri di tipo diverso.
I macrofagi «sanno» che, per la maggior parte, i batteri che infettano il sistema digerente in Africa come in qualunque altro posto, hanno qualcosa in comune. Questi microrganismi hanno infatti una struttura biochimica simile costituita da una parete esterna rigida che serve al batterio per proteggersi dalla digestione all’interno del sistema digerente, ed è composta da molecole di lipopolisaccaridi (o LPS per brevità). Un dettaglio importante è che noi non siamo in grado di produrre lipopolisaccaridi e non potevano farlo neppure i nostri antenati mammiferi. Queste molecole sono elaborate esclusivamente dai batteri. Si tratta pertanto di un indizio molto affidabile e pratico per distinguere dal punto di vista molecolare amici e nemici. Se sulla superficie esterna di una cellula ci sono molecole di LPS allora il macrofago non ha bisogno di nient’altro: quel modello, o codice a barre molecolare da solo, è sufficiente per stabilire che non è una delle nostre cellule, ma è una cellula nemica e deve essere distrutta. Io lo so perché l’ho letto nei libri di testo di immunologia; i macrofagi del sistema digerente «lo sanno» per selezione naturale.
L’identificazione del nemico e la sua eliminazione sono due processi rapidi, una risposta algoritmica all’applicazione dello schema di riconoscimento automatico, cioè sparare a vista. Ogni macrofago del nostro corpo è stato addestrato perfettamente dall’evoluzione ed equipaggiato con lettori di codici a barre LPS e altri dispositivi per mettere in atto una risposta immunitaria innata. È questa antichissima conoscenza ancestrale, espressa nei macchinari genetici e molecolari del macrofago, a proteggerci e a renderci meno sprovveduti di come potremmo pensare trovandoci per la prima volta a fare un viaggio in Africa.
Il sistema immunitario però non è soltanto nato conoscendo già il nemico, ma è anche abbastanza sveglio da acquisire nuove informazioni e apprendere qualcosa sui nostri nemici nel corso della sua vita. L’esempio più familiare di questo meccanismo di apprendimento è probabilmente la vaccinazione. Supponiamo che, prima di andare in vacanza in Africa, io decida di vaccinarmi contro il tetano perché ho scoperto che nei paesi tropicali il rischio di contrarre questa malattia è maggiore. Così decido, volontariamente, di farmi iniettare una forma attenuata dei batteri del tetano che potrebbero uccidermi se li incontrassi per la prima volta in natura. Quali sono le conseguenze della vaccinazione dal punto di vista immunologico?
Nelle prime ore, o nei primi giorni dopo la vaccinazione, probabilmente sentirò un po’ di dolore o potrò notare un lieve gonfiore nel punto dell’iniezione. Questi indizi classici di un’infiammazione indicano che i macrofagi locali stanno mettendo in atto una risposta immunitaria innata all’inoculazione deliberata di batteri provocatoriamente non-self e portatori di antigeni. Si tratta però di un effetto secondario della vaccinazione, non il suo scopo principale. Lo scopo della vaccinazione è quello di stimolare i linfociti del sistema immunitario a produrre anticorpi, proteine progettate specificatamente per riconoscere un antigene e legarsi ad esso. Infatti, dato che questi anticorpi sono stati selezionati in laboratorio per la produzione in massa proprio perché riconoscono specificatamente l’antigene del tetano, e poiché la produzione di anticorpi tende a protrarsi per molti anni una volta avviata, il mio sistema immunitario sarà indubbiamente più preparato la prossima volta che incontrerà C. tetani. Potrò contare quindi su una linea di difesa in più in aggiunta alle difese innate dei macrofagi del sistema immunitario, che attivano la risposta “spara a vista” che ho ereditato dai miei antenati evolutivi. Il sistema immunitario nel corso della mia vita ha imparato mediante apprendimento adattivo qualcosa di nuovo sul mondo e lo ricorda. I miei linfociti hanno imparato dal vaccino che C. tetani è là fuori e costituisce una minaccia reale contro la quale è meglio restare in guardia ricorrendo a una produzione costante di anticorpi.
Autoimmunità: il rovescio della medaglia
Fin qui ho descritto il sistema immunitario come una forza di difesa prodigiosa, un alleato del tutto affidabile che gestisce la sua presenza ubiquitaria attraverso chiari canali di comunicazione tra milioni di componenti cellulari ed è in grado di coordinare programmi sofisticati di rigetto rapido e di apprendimento di tipo adattativo per aiutarci a sopravvivere in un mondo pieno di microrganismi pronti ad attaccarci. Vero, ma non è tutto. Il sistema immunitario infatti ha anche un lato oscuro.
Adottando la guerra come una metafora dell’infiammazione potrei avervi incoraggiato a pensare che il sistema immunitario vinca sempre le sue battaglie, come siamo portati a credere che accada con gli eserciti moderni e tecnologicamente avanzati nei veri conflitti militari, grazie ad attacchi precisi, quasi chirurgici contro target identificati da sofisticati servizi segreti. A dire il vero però le «guerre infiammatorie», come quelle militari, provocano inevitabilmente gravi danni collaterali a scapito degli spettatori innocenti. Inoltre anche le armi usate dal sistema immunitario, proprio come le pistole e i missili, possono essere puntate nella direzione sbagliata, provocando le classiche vittime del fuoco amico.
I macrofagi seguono un programma rigoroso per individuare e distruggere alieni biologici che possono identificare a vista grazie a codici a barre molecolari come le molecole di LPS. Quando fagocitano i batteri invasori però, i macrofagi disperdono grandi quantità di enzimi digestivi e frammenti batterici nel tessuto circostante. Questo «scarico» del macrofago è tossico per le innocenti cellule vicine, ad esempio quelle delle ossa, dei muscoli o dei neuroni, che si trovino per caso dalle parti di un’infezione batterica pur non partecipando attivamente alla risposta immunitaria. Quando altri macrofagi vengono richiamati nel sito dell’infezione ricorrendo alla segnalazione basata sulle citochine, gli effetti collaterali dell’infiammazione a carico delle popolazioni locali di cellule diventano più acuti. Una guerra violenta dei macrofagi ricorda davvero le tattiche della terra bruciata o del bombardamento a tappeto nelle guerre tra esseri umani. In entrambi i tipi di conflitti i danni collaterali che colpiscono chi non partecipa possono essere molto rilevanti. I macrofagi nel nostro esempio potrebbero riuscire a evitare che l’infezione della mano ferita si diffonda con effetti letali in tutto il corpo. Se però non riesce a eliminare del tutto l’infezione, ma soltanto a contenerla, l’esercito dei macrofagi potrà stare in trincea mantenendo la sua posizione per mesi o anni, con la conseguenza che i tessuti normali e sani della mano ferita risulteranno danneggiati in modo permanente. Il muscolo, la pelle e l’osso saranno distrutti o, nella migliore delle ipotesi, sostituiti da ferite fibrose e poco flessibili. La difesa dei macrofagi potrebbe anche costare l’uso della mano all’uomo ferito per poter aver salva la vita.
Mentre i danni collaterali determinati dai macrofagi rovinano ampie fasce di cellule innocenti nei paraggi, il fuoco amico dei linfociti è più concentrato sulla distinzione tra self e non-self. Il sistema immunitario è estremamente efficace nel compiere questa distinzione però non ha sempre ragione. Qualche volta gli antigeni raccolti dai macrofagi e traghettati verso i linfociti non sono frammenti di proteine batteriche ma pezzetti delle nostre proteine, frammenti molecolari dei nostri stessi tessuti. In alcuni casi i linfociti, a cui per sbaglio sono state presentate queste proteine del self come se fossero potenziali codici a barre nemici, possono erroneamente innescare una risposta immunitaria ostile contro il self. Invece di produrre anticorpi contro i batteri e altri antigeni davvero non-self, i linfociti possono incominciare a sfornare anticorpi contro le proteine self, cioè i cosiddetti autoanticorpi.
Gli effetti degli autoanticorpi responsabili di malattie, possono essere altrettanto gravi degli effetti degli anticorpi che attaccano batteri e virus curando le malattie o prevenendole. Gli anticorpi «buoni» contro il C. tetani possono proteggermi da un’infezione letale di tetano, però gli autoanticorpi «cattivi» agendo contro il mio stesso corpo, possono provocare malattie altrettanto pericolose per la mia vita. Qualche volta, ad esempio, le cellule del pancreas che producono insulina finiscono sotto i colpi del fuoco amico del sistema immunitario. Attaccate dagli autoanticorpi queste cellule vengono distrutte, mentre tutte le altre cellule del pancreas restano illese. Le ferite non sono visibili ma questa forma di autolesionismo può essere letale. Senza cellule capaci di produrre insulina, il corpo non può più controllare i livelli di glucosio del sangue nonché molti altri dettagli del suo normale metabolismo e l’individuo diventa diabetico. In passato, prima che venisse scoperta la terapia sostitutiva con insulina per i diabetici, molti pazienti finivano rapidamente in coma e morivano in seguito a questo attacco discreto ma devastante al self da parte del sistema immunitario.
A questo punto però potreste incominciare a chiedervi che cosa ha che fare tutta questa discussione con la depressione. Ho parlato molto di infezioni e traumi, ma non ho detto nulla dell’umore o dello stato d’animo. Come sono connesse con la salute mentale tutte queste informazioni dettagliate sui globuli bianchi, i linfonodi, i macrofagi e le citochine?