Prohormonas
L as hormonasson mensajeros químicos producidos por glándulas que llevan sus mensajes a diversas partes del cuerpo. Las hormonas sintéticas, como los esteroides anabolizantes, se administran como fármacos y funcionan como las hormonas naturales (ver capítulo 8 ), o al menos ésta es la intención.
Las prohormonas son compuestos químicos sintéticos que son transformados por las enzimas del organismo en hormonas naturales o en compuestos con actividad hormonal comparable.
Existen prohormonas que son transformadas por las enzimas en el esteroide anabolizante natural testosterona. Otras prohormonas son convertidas en esteroides anabolizantes sintéticos como la norboletona o la nandrolona.
En Internet y otras fuentes de información hemos encontrado también los términos proesteroides y profármacos, habitualmente acompañados del término “legal”, referidos a compuestos puestos a la venta como prohormonas.
En este contexto, “legal” significa que la prohormona no ha sido prohibida todavía. En Europa, las prohormonas están prohibidas y, desde 2004, algunas lo están también en Estados Unidos. Sin embargo, las prohormonas se pueden conseguir fácilmente en Internet, donde los vendedores continúan anunciándolas con una terminología prometedora.
Los deportistas de competición, que son controlados habitualmente contra el dopaje, no deberían utilizar prohormonas incluso si éstas “son legales”. Las prohormonas se transforman en el cuerpo en el esteroide anabolizante real, el cual sí puede estar incluido en la lista de sustancias prohibidas. Además, la prohormona, después de haberse convertido en el anabolizante, también produce todos sus metabolitos, de manera que tanto el anabolizante real como sus metabolitos pueden ser detectados en la sangre o la orina por los inspectores antidopaje. De esta forma, el deportista puede ser acusado de dopaje incluso si ha estado utilizando una prohormona “legal” como suplemento alimenticio. Además, el término “legal” no significa que la prohormona haya sido probada, carezca de efectos secundarios y que su uso sea seguro.
El término proesteroide no tiene sentido. La propia prohormona ya es un esteroide. Las personas que utilizan este término están demasiado centradas en el esteroide anabolizante activo, el cual es producido por las enzimas a partir del llamado proesteroide. De acuerdo con este razonamiento, el término proanabolizante sería más adecuado.
El término profármaco es una alternativa razonable. Químicos y farmacéuticos consideran los esteroides anabolizantes como fármacos o medicinas. Estos compuestos se desarrollan inicialmente como fármacos, y por lo tanto sus precursores pueden considerarse como profármacos.
En este libro utilizaremos preferentemente el término prohormona ya que, aunque las prohormonas y los esteroides anabolizantes que se forman a partir de ellas sean de origen sintético, finalmente actúan como hormonas y esto es lo que importa.
En este capítulo estudiaremos en primer lugar prohormonas que son convertidas en las hormonas naturales testosterona y dihidrotestosterona, y a continuación analizaremos algunas prohormonas de esteroides anabolizantes sintéticos.
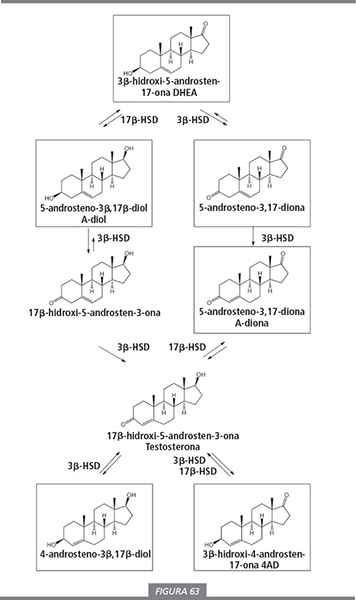
La conversión de las prohormonas de testosterona en la propia testosterona debe ser realizada por enzimas. Por esto podemos pensar que dichas prohormonas deben estar relacionadas o incluso ser parte del esquema biosintético para este esteroide natural (ver figura 63). Los compuestos enmarcados son o han sido comercializados como prohormonas de testosterona. Puede verse que cuatro de estas prohormonas son de hecho intermedios en la biosíntesis de la testosterona. Únicamente el 4-androsteno-3β,17β-diol, situado al final izquierda del esquema, no es un intermedio en la biosíntesis de la hormona. Este compuesto puede ser transformado por una 3β-deshidrogenasa en testosterona y, por lo tanto, también es una prohormona de la misma. En el Acta de control de los esteroides anabolizantes (Anabolic Steroids Control Act) de Estados Unidos no se menciona ninguna prohormona con un grupo carbonilo en C17 (17-ona). Los productores de suplementos han aprovechado esta omisión para introducir en el mercado la 3β-hidroxi-4-androsten-17-ona (4AD) como precursor de la testosterona. Este compuesto (final derecha de la figura 63) tampoco es un intermedio en la biosíntesis de la testosterona. Se necesitan dos reacciones enzimáticas, la reducción del grupo carbonilo en C17 y la oxidación del grupo hidroxilo en C3, para convertirlo en testosterona, de manera que podemos considerar este compuesto como una prohormona de “larga distancia”.
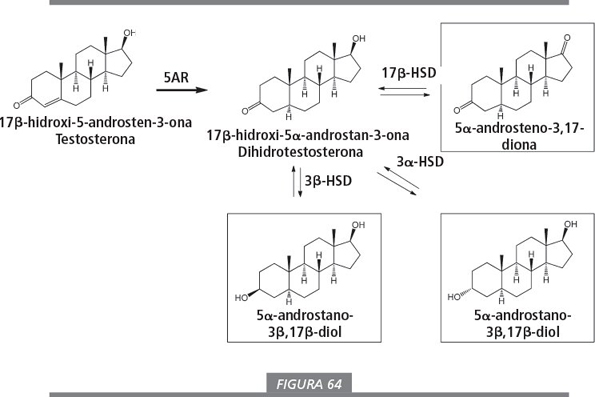
Todas las prohormonas de testosterona son también prohormonas de dihidrotestosterona, ya que la enzima 5α-reductasa (5AR) puede transformar testosterona en dihidrotestosterona. La reacción inversa no es posible: las prohormonas de dihidrotestosterona no se convierten en testosterona ya que no existen enzimas capaces de introducir un doble enlace Δ 4 en un esteroide. En las prohormonas que se quiere que proporcionen exclusivamente dihidrotestosterona, el átomo de hidrógeno 5α debe estar ya presente en la prohormona. Igual que ocurre con la testosterona, las C3- y C17-deshidrogenasas pueden convertir las prohormonas de la figura 64 en dihidrotestosterona. Las prohormonas enmarcadas han sido comercializadas.
El beneficio de las prohormonas de dihidrotestosterona para culturistas y practicantes de fitness no es evidente ya que la dihidrotestosterona es la hormona que provoca los efectos androgénicos, pero no tiene propiedades anabolizantes.
No hace falta mucha fantasía para pensar que las mismas reacciones enzimáticas que transforman la prohormona de la testosterona pueden hacer lo mismo con las prohormonas de otros esteroides anabolizantes sintéticos que se parezcan a la testosterona. Es fácil pensar en esteroides como la 17α-metiltestosterona y la 19-nortestosterona (nandrolona), pero existen también otras posibilidades:
■ Esteroides con un grupo metilo adicional en C7, C1, C2 y C17.
■ Esteroides con un grupo etilo. Este grupo algunas veces se encuentra en C13, aunque en la mayoría de los casos se sitúa en C17 debido a la mayor facilidad de síntesis de los compuestos con el grupo etilo en esta posición.
■ Esteroides con más de un grupo metilo o etilo adicionales combinados en las posiciones anteriores.
■ Esteroides sin el grupo metilo en C19 que conducen a prohormonas de la nandrolona u otros 19-noresteroides.
■ Esteroides sin el grupo metilo en C19 con un grupo metilo o etilo adicional en otra posición de la molécula.
Las transformaciones enzimáticas necesarias para la conversión de estas prohormonas en el esteroide anabolizante activo son generalmente la oxidación de un grupo hidroxilo en C3, la reducción de un grupo carbonilo en C17 y la isomerización de un doble enlace Δ5(6) o de un doble enlace Δ5(10) a un doble enlace en la posición deseada Δ4 . Esta última conversión puede ser llevada a cabo por los ácidos gástricos si la prohormona se toma oralmente.
En las figuras 63 y 64 podemos ver que algunas de estas modificaciones han sido ya aplicadas en prohormonas de testosterona y dihidrotestosterona. En principio, se pueden aplicar las mismas posibilidades para análogos de testosterona y nandrolona, y para muchos otros esteroides anabolizantes.
En la figura 65 se muestran cinco posibles prohormonas de 17α-metiltestosterona (esquina superior izquierda). La metil-4-AD ha sido comercializada, pero los otros esteroides también son compuestos conocidos. En nuestra opinión, las enzimas del organismo deben ser capaces de transformar estas prohormonas en metiltestosterona. Sin embargo, esta posibilidad no se ha investigado para todos los compuestos de la figura 65, y a veces es difícil predecir su comportamiento real.
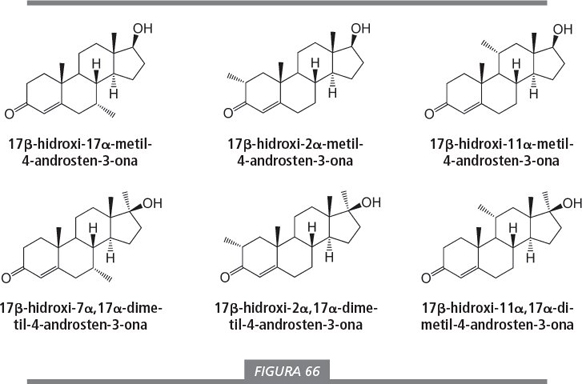
También se puede introducir el grupo metilo adicional en C7, C11 ó C2. Además, es posible introducir más de un grupo metilo, por ejemplo en C17 y C7, C11 ó C2, o en C7 y C11, etc. El esteroide con un grupo metilo 11α, y el esteroide con dos grupos metilo en 11α y 17β, descritos en la columna derecha de la figura 66, son compuestos que no se han preparado ni aislado hasta la fecha.
Las opciones para preparar prohormonas de los compuestos de la figura 66 son las mismas que se muestran en la figu ra 65 para la metiltestosterona. La combinación de las posibilidades mostradas en ambas figuras da un total de 30 posibles prohormonas “legales”.
En la figura 66 se muestran únicamente los compuestos con los grupos metilo en C7, C11 y C2 orientados en α, pero también podrían orientarse en β. Podríamos dibujar los compuestos con las mismas variantes con grupos etilo en C13 ó C17, combinados con grupos metilo adicionales. Muchas de estas moléculas, aunque no todas, son conocidas en la bibliografía o en patentes. En principio, los químicos deberían ser capaces de sintetizar las correspondientes prohormonas para todos estos esteroides.
El esteroide anabolizante nandrolona (19-nortestosterona) y sus análogos son el objetivo de la modificación enzimática de las 19-norprohormonas. Enmarcadas en la figura 67 se muestran algunas prohormonas de nandrolona comerciales.
Fabricantes e investigadores no son muy cuidadosos a la hora de indicar la posición del doble enlace en las 19-norprohormonas. El doble enlace Δ4 se indica correctamente, pero en los 19-noresteroides existen dos posibilidades para un doble enlace Δ5 . Este doble enlace puede estar situado entre los anillos A y B, en la posición Δ5(10) , o en el anillo B, en la posición Δ5(6) . Esto no siempre se indica correctamente [1 ]. Cuando la posición del doble enlace se indica con el nombre 19-nor-5-androsteno, se refiere a esteroides con el doble enlace Δ5(10) . En las prohormonas de androsteno este problema no es relevante porque en estos esteroides no puede existir un doble enlace Δ5(10) . En 5-androstenos el doble enlace sólo puede estar situado en la posición Δ5(6) . Para los usuarios, la posición exacta del doble enlace Δ5 en las prohormonas de los 19-noresteroides no es ningún problema porque ambas prohormonas se convierten en nandrolona. Sin embargo, los investigadores deberían ser más cuidadosos cuando indican la posición de este doble enlace.
Las enzimas pueden convertir los esteroides Δ5(10) de la parte baja de la figura 67 en compuestos con un grupo carbonilo en C3 y a continuación en nandrolona [2 , 3 , 4 ]. El compuesto carbonílico con el doble enlace Δ5(10) también es una prohormona (ver también figura 70), ya que, cuando se toma oralmente, los ácidos gástricos lo transforman en el compuesto deseado con el doble enlace Δ4 [5 , 6 ].
Las enzimas pueden convertir también en nandrolona a los compuestos con un doble enlace Δ5(6) que se muestran en la parte superior de la figura 67. Estos compuestos son, por lo tanto, posibles prohormonas, aunque son más difíciles de sintetizar y de disponer de ellos en grandes cantidades. La 5(6)-estreno-3,17-diona no es una prohormona adecuada porque no es muy estable e isomeriza fácilmente a nandrolona [6 ]. La razón de esta rápida isomerización de las agrupaciones Δ5(10) -3-ona y Δ5(6) -3-ona para dar el sistema de Δ4 -3-ona es la mayor estabilidad del sistema conjugado (C=C-C=O) resultante.
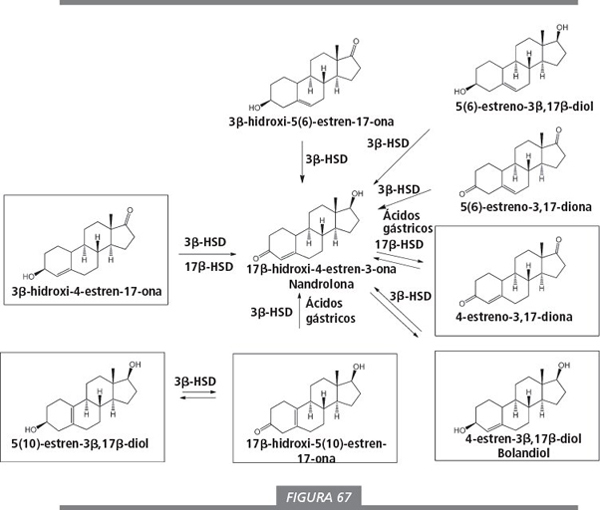
La 3β-hidroxi-4-estren-17-ona (figura 67, parte central izquierda) es una prohormona de nandrolona que se escapa de las restricciones del Acta de control de los esteroides anabolizantes por la misma razón que su análogo de la testosterona que aparece en la parte inferior de la figura 65. De nuevo, en este esteroide comercializado en 2008 con el nombre de Decavol se necesitan dos reacciones enzimáticas, la oxidación del hidroxilo 3β y la reducción del carbonilo en C17, para su conversión en nandrolona.
Los efectos biológicos de la 4-estreno-3,17-diona (224 mg) y del 4-estreno-3,17-diol (120 mg) sobre la resistencia en hombres entrenados han sido objeto de investigación. A las personas estudiadas se les suministraron 344 mg diarios de ambas prohormonas en la combinación indicada anteriormente durante un período de ocho semanas. En este estudio, los investigadores no pudieron constatar ninguna diferencia en la fuerza y composición corporal entre las personas tratadas y un grupo de control [7 ].
Todas las posibilidades para prohormonas de la nandrolona mostradas en la figura 67 son posibles también, en principio, para análogos de la nandrolona con grupos metilo adicionales en C7, C11, C2 ó C17, o con un grupo etilo en C13 ó C17 (ver figura 68). También son posibles todas las combinaciones con dos o más grupos metilo o etilo. Los esteroides enmarcados en la figura 68 han sido comercializados aunque todavía no se han encontrado prohormonas para ellos. El resto de los esteroides de la figura 68 se conocen en la bibliografía científica, pero no han sido comercializados como esteroides anabolizantes o prohormonas. El principal problema con estos compuestos es su síntesis a un precio razonable.
El compuesto con un anillo A aromático y un grupo carbonilo en C17 que se muestra en la esquina superior izquierda de la figura 69 se utiliza habitualmente como material de partida para la síntesis comercial de 19-noresteroides. La disponibilidad de este compuesto puede proporcionar procedimientos más económicos para preparar 19-norprohormonas.
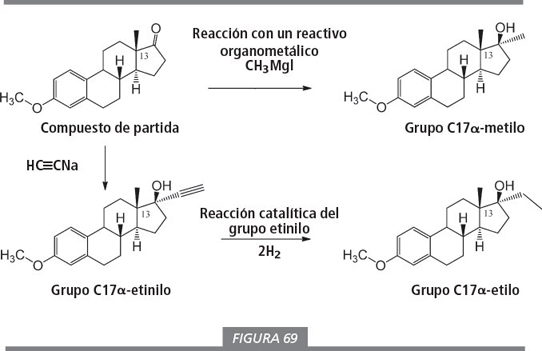
El grupo carbonilo se puede hacer reaccionar con reactivos organometálicos para introducir un grupo metilo (-CH3
) o etinilo (-C CH) en la molécula (ver figura 69). El grupo etinilo puede ser hidrogenado con dos moléculas de hidrógeno (2 H2
) para dar un grupo etilo (-CH2
-CH3
). Los cuatro átomos de hidrógeno adicionales introducidos en el esteroide de esta forma suelen aparecer en el nombre del compuesto con la palabra tetrahidro
. Debido a la facilidad de esta síntesis no es extraño que los grupos metilo y etilo en posición 17α se encuentren en muchos esteroides anabolizantes sintéticos. Los químicos pueden introducir otros sustituyentes en esta posición, pero los esteroides obtenidos son menos activos.
CH) en la molécula (ver figura 69). El grupo etinilo puede ser hidrogenado con dos moléculas de hidrógeno (2 H2
) para dar un grupo etilo (-CH2
-CH3
). Los cuatro átomos de hidrógeno adicionales introducidos en el esteroide de esta forma suelen aparecer en el nombre del compuesto con la palabra tetrahidro
. Debido a la facilidad de esta síntesis no es extraño que los grupos metilo y etilo en posición 17α se encuentren en muchos esteroides anabolizantes sintéticos. Los químicos pueden introducir otros sustituyentes en esta posición, pero los esteroides obtenidos son menos activos.
La reducción del anillo aromático en los esteroides de la figura 69 se puede llevar a cabo mediante la llamada reducción de Birch, que conduce a enol-éteres como productos (ver figura 70). Éstos pueden ser aislados o convertidos directamente en compuestos con una cetona en C3 y un doble enlace Δ5(10) (compuesto Δ5(10) -3-ona) por tratamiento con un ácido débil. Esta reacción se ha utilizado en muchas síntesis de 19-noresteroides mencionadas en la bibliografía más antigua [8 , 9 , 10 , 11 ] y en viejas patentes [12 , 13 ]. En algunos casos, los productos de partida o los intermedios que se mencionan en la figura 70 son los principios activos de píldoras anticonceptivas y se pueden obtener de fuentes comerciales.
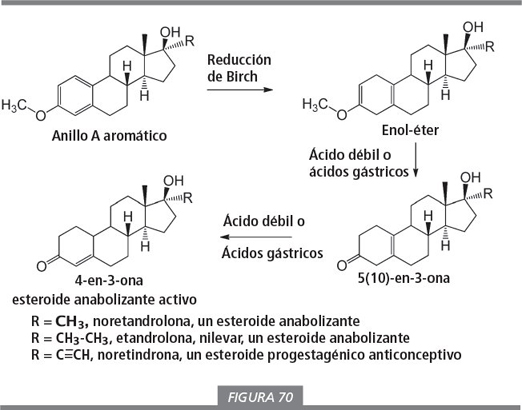
Los ácidos gástricos son capaces de convertir enol-éteres y los intermedios Δ5(10) -3-ona en el esteroide anabolizante activo sin la participación de enzimas. Los intermedios sólo presentan una actividad anabolizante débil [12 ], pero podrían ser comercializados como prohormonas, aunque nosotros no las hemos encontrado a la venta todavía. Su estructura es similar a la del esteroide con un doble enlace Δ5(10) en la parte inferior de la figura 67.
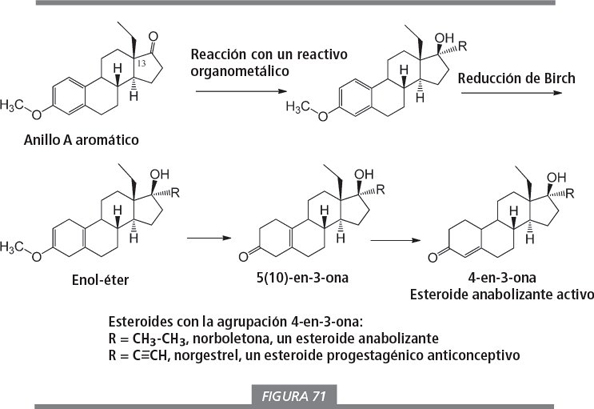
El compuesto de partida con un grupo etilo en C13 (ver figura 71, parte superior izquierda) también se puede comercializar. De una manera similar a como se muestra en las figuras 68 y 69, este compuesto puede ser transformado en esteroides anabolizantes (ver figura 71). Los intermedios en esta síntesis también son prohormonas potenciales.
En los últimos años, varias prohormonas han sido comercializadas por personas conocidas, como Patrick Arnold, Brock Strasser -alias Bruce Kneller-, Derek Cornelius, Bill Roberts y Bill Llewellyn. Estos productos son muy famosos en los ambientes de culturismo y fitness. Algunas de estas prohormonas han gozado de gran éxito, aunque otras han sido un verdadero desastre para los consumidores.
De sus estructuras (ver figura 72) se deduce que estas prohormonas cumplen con los razonamientos de este capítulo. En las partes izquierda y derecha de la figura 72 se describen las prohormonas, mientras que los esteroides anabolizantes en los que éstas se convierten por la acción de las enzimas se muestran en el centro. El 4-androstenodiol tiene actividad anabolizante por sí mismo, mientras que esto no se ha podido confirmar en el caso del bolandiol [3 ].
Para estas bien conocidas prohormonas se ha podido demostrar que su transformación enzimática para dar el esteroide anabolizante activo de hecho tiene lugar. Sin embargo, la eficacia de dicha conversión, es decir, la cantidad de prohormona que se convierte en hormona, no está muy clara.
La investigación sobre el metabolismo de los esteroides anabolizantes se ha llevado a cabo principalmente por organismos antidopaje y por la industria farmacéutica. La investigación farmacéutica tiene que demostrar no sólo que el fármaco no tiene efectos secundarios, sino también que ninguno de los metabolitos del fármaco los tiene.
El objetivo de las investigaciones de los organismos contra el dopaje es utilizar los análisis químicos para detectar no sólo el esteroide sino también los productos de su metabolismo (metabolitos) [14 , 15 , 16 ]. El análisis de estos metabolitos permite probar el abuso de anabolizantes no sólo con mayor eficacia, sino incluso después de que haya transcurrido un mayor período de tiempo después de producirse la toma. Por estos motivos se ha llevado a cabo el estudio de un buen número de prohormonas, esteroides anabolizantes normales y esteroides de diseño [17 ].
Por otra parte, las modificaciones químicas ofrecen numerosas posibilidades para la síntesis de nuevas prohormonas. No es de extrañar que de manera regular se comercialicen nuevas prohormonas que se anuncian a veces como suplementos de diseño. Los vendedores anuncian estos nuevos productos como “legales” y asumen que se producen las transformaciones enzimáticas necesarias para transformarlos en el esteroide anabolizante. Sin embargo, pocas veces se ha comprobado, ni se ha investigado, su actividad real ni sus efectos secundarios; esto sólo se puede hacer mediante la investigación científica. Los productores simplemente ponen la prohormona en el mercado. El consumidor se convierte entonces en el conejillo de indias.
REFERENCIAS BIBLIOGRÁFICAS
[1 ] Greene R.S. 08/01/1999. http://www.naturalproductsinsider.com/articles/1999/08/sorting-out-the-andro-question.aspx
[2 ] Uralets V.P.; Gillette P.A. Journal of Analytical Toxicology 2000; 24, 188-193.
[3 ] Tseng Y.L.; Kuo F.-H.; Sun K.-H. Journal of Analytical Toxicology 2005; 29, 124-134.
[4 ] Baume M.; Mahler N.; Kamber M.; Mangin P.; Saugy M. Scand. J. Med. Sci. Sports 2006; 16, 41-48.
[5 ] Ranjith H.; Dhamaratne W.; Kilgor J.L.; Roitman E.; Shackleton C.; Caspi E. Journal of the Chemical Society 1993; 1.529-1.535.
[6 ] Nes W.R.; Loeser E.; Kirdani R.; Marsh J. Tetrahedron 1963; 19, 299-307.
[7 ] Van Gammeren D.; Falk D.; Antonio J. Nutrition 2002; 18, 734-737.
[8 ] Colton F.B.; Nysted L.N.; Riegel B.; Raymond A.L. Journal of the American Chemical Society 1957; 79, 1.123-1.127.
[9 ] Philips D.K.; Wickham P.P.; Potts G.O.; Aaron A. Journal of the Chemical Society, Perkin transactions 1968; 11, 924-928.
[10 ] Baier H.; Dürner G.; Quinkert G. Helvetica Chimica Acta 1985; 68, 1.054-1.068.
[11 ] Djerassi C. Steroids 1992; 57, 631-641.
[12 ] Colton F.B. 17-Alkyl-17-hydroxy-5(10)-estren-3-ones, patente ameri cana US 2905676 A 19590922.
[13 ] Clinton R.O.; Christiansen R.G. 17-(Lower alkyl)-19-nor-5(10)-androstene-3,17-diols, patente americana US 3076826.
[14 ] Van Eenoo P.; Delbeke F.T. Journal of Steroid Biochemistry and Molecular Biochemistry 2006; 101, 161-178.
[15 ] Schanzer W.; Thevis M. Chemie Unserer Zeit 2004; 38, 230-241.
[16 ] Thieme D.; Anielski P.; Grosse J.; Sachs H.; Mueller R.K. Analytica Chimica Acta 2003; 483, 299-306.
[17 ] Levesque J.-F.; Templeton E.; Trimble L.; Berthelette C.; Chauret N. Analytical Chemistry 2005; 77, 3.164-3.172.