Los esteroides anabolizantes reales
H asta este capítulo toda la atención se ha centrado en prohormonas, derivados de hormonas y esteroides de diseño en suplementos nutricionales . En este libro también hemos mostrado algunos esteroides anabolizantes reales, principalmente ejemplos de cómo evitar transformaciones metabólicas o su detección. En este capítulo dedicaremos toda la atención a estos auténticos esteroides anabolizantes.
La época más importante en la química de los esteroides se sitúa en el período entre 1950 y 1970. Durante estos años, las compañías farmacéuticas se dedicaron al desarrollo de esteroides para el tratamiento de enfermedades hormonales, terapia hormonal, tratamiento posmenopáusico, anticoncepción, anemia, osteoporosis y cánceres de pecho y próstata. Estas aplicaciones requerían tratamientos largos con esteroides, y en estos casos no debía haber efectos secundarios. La administración debía ser sencilla y preferentemente por vía oral. Los esteroides debían ser efectivos durante períodos relativamente largos, de manera que no tuvieran que ser administrados demasiado a menudo. Esto significa que la inactivación metabólica del esteroide no debía producirse de forma rápida. Estas propiedades también son apreciadas por los culturistas, aunque, por supuesto, éstos están más interesados por las propiedades anabolizantes del esteroide.
Durante años, la industria farmacéutica ha preparado centenares de esteroides en un intento continuo de encontrar el esteroide anabolizante ideal. Sin embargo, sólo unos pocos cientos de estos esteroides han sido ensayados y patentados. Algunos han llegado al mercado, han desaparecido o han terminado en círculos ilegales.
De todos estos esteroides anabolizantes hemos hecho una selección basándonos en dos consideraciones: culturistas y levantadores de peso siempre han mostrado un gran interés por los esteroides anabolizantes. Existen varios libros sobre este tema, dirigidos principalmente a consumidores. En este capítulo discutiremos los esteroides anabolizantes mencionados en los libros de Duchaine [1 ] y Llewellyn [2 ]. Igualmente, los deportistas de competición están muy interesados por los esteroides anabolizantes (indetectables) para mejorar su rendimiento. El uso de esteroides anabolizantes entre deportistas está prohibido para evitar el fraude en la competición. La autoridad mundial antidopaje (WADA) ha publicado una lista de esteroides anabolizantes prohibidos [3 ] que también se discuten en este capítulo.
La sutil diferencia entre los esteroides de los suplementos nutricionales y los esteroides anabolizantes reales se ha mencionado ya varias veces en el capítulo 19. Muchas prohormonas y esteroides de los suplementos nutricionales son, de hecho, auténticos esteroides anabolizantes. La WADA no se deja engañar tan fácilmente como las autoridades y algunos consumidores, y ha puesto a muchos de estos esteroides en su lista de sustancias prohibidas.
En este capítulo hemos tratado de visualizar este entrelazamiento entre esteroides de suplementos y esteroides anabolizantes reales. Para ello, hemos escrito un código debajo de la fórmula estructural de todos los esteroides que aparecen en suplementos nutricionales y también en la lista de la WADA. Para marcar los esteroides que se venden en suplementos hemos utilizado el mismo número que éstos tienen en el capítulo 19. Los nombres de esteroides que aparecen en la lista de la WADA se han escrito en negrita y cursiva. De los 80 anabolizantes reales que se discuten en este capítulo, veinte de ellos se encuentran en suplementos a la venta y aparecen también en la lista de la WADA. Estos números se refieren únicamente a las moléculas básicas del esteroide (p. ej., nandrolona), no a sus derivados (p. ej., ésteres de nandrolona).
Los 80 ésteres anabolizantes de este capítulo se han dividido en grupos más pequeños para facilitar la discusión. Esta subdivisión se ha organizado de una manera similar a como hemos hecho en el capítulo 19. Los grupos más grandes se han subdividido de acuerdo con su estructura química. De esta forma hemos hecho 11 grupos, cada uno representado por un conocido esteroide anabolizante:
1. Esteroides de tipo testosterona
2. 19-Norandrostenos
3. 17α-Metilandrostenos
4. 19-Nor-17α-metil- y 17α-etilandrostenos
5. Esteroides de tipo dihidrotestosterona
6. Esteroides de tipo Δ1 -testosterona
7. Androstenos con más de un doble enlace
8. 19-Nor y 17α-metil y etil análogos de esteroides con más de un doble enlace
9. Esteroides con un grupo hidroxilo adicional en C4
10. Esteroides clorados
11. Esteroides con un anillo heterocíclico unido al anillo A
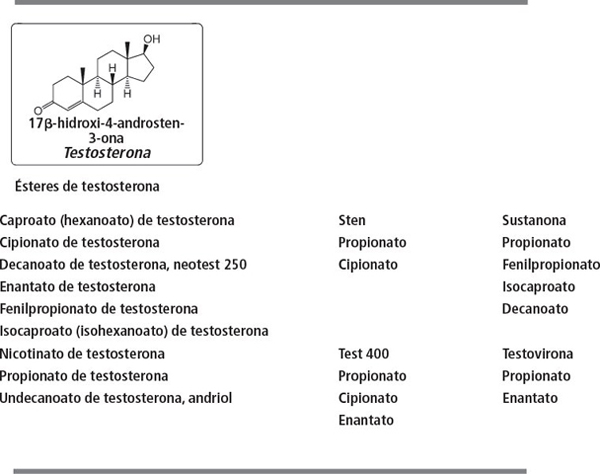
Grupo 1. Esteroides de tipo testosterona
La testosterona y muchos de sus ésteres se comercializan desde hace tiempo como preparados anabolizantes. En el capítulo 16 hemos explicado los ésteres de testosterona. La testosterona se metaboliza rápidamente en el organismo, y, por eso, los consumidores prefieren sus ésteres. Después de ser inyectados, los ésteres pasan lentamente a la sangre donde son hidrolizados por las esterasas, asegurando de esta forma un elevado nivel de testosterona durante un largo período.
El propio cuerpo produce los llamados esteroides anabolizantes endógenos, que son los intermedios normales y los productos finales de la biosíntesis de testosterona (ver capítulo 11 ).
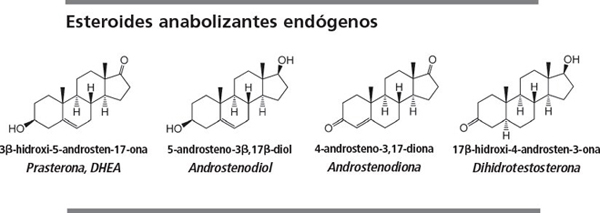
Cuando en los análisis antidopaje se descubren desviaciones sobre las concentraciones normales de estos esteroides en atletas de competición, la WADA lo considera un análisis positivo. Es lo mismo que cuando los inspectores pueden probar que el esteroide ha sido administrado. La WADA considera estos esteroides como de origen exógeno . Las mismas reglas son válidas para todos los metabolitos de los esteroides anabolizantes endógenos que se mencionan más adelante.

Ocho esteroides de este grupo de intermedios y metabolitos se venden en suplementos nutricionales. No importa si estos compuestos presentan algún efecto fisiológico por sí mismos o si se transforman en el anabolizante activo en el cuerpo. La WADA considera sospechosa cualquier desviación de las concentraciones normales de estos esteroides. Por lo tanto, los atletas que son controlados regularmente contra el dopaje no deberían utilizar estas prohormonas.
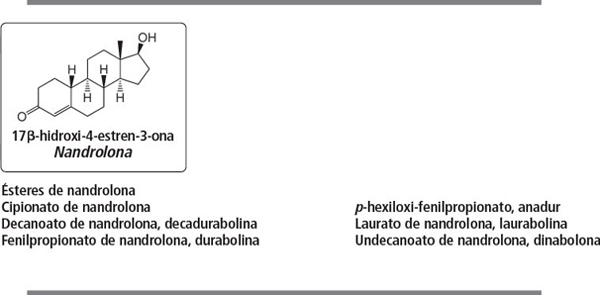
Grupo 2. 19-Norandrostenos
La nandrolona y sus ésteres son esteroides muy populares con buenas propiedades anabolizantes. Esta actividad de la nandrolona se conoce ya desde 1930. Al igual que los ésteres de testosterona, los ésteres de nandrolona tienen también una acción más duradera [4 ]. Los ésteres de nandrolona se han discutido en el capítulo 16.
En principio, la nandrolona puede aromatizar, pero esto ocurre únicamente bajo circunstancias especiales y en cantidades muy pequeñas. La aromatización normal de los androstenos producida por la enzima aromatasa no puede ocurrir con la nandrolona porque ésta carece del grupo metilo en C19. Se necesitan otras enzimas que oxiden el anillo A (eliminando dos hidrógenos en C1 y C10), y entonces, tras la enolización del carbonilo en C3, se produce la aromatización del anillo A.
La reducción del doble enlace Δ4 por la enzima 5AR puede producirse de una manera similar a como se produce con la testosterona, dando dihidronandrolona. La actividad androgénica de la dihidronandrolona y de sus análogos es inferior a la de los correspondientes derivados de testosterona. Esto significa que se producirán menos efectos secundarios en aquellos tejidos en los que la 5AR es activa y convierte la nandrolona en dihidronandrolona. Esto conduce a una mejor relación entre los efectos anabolizantes y androgénicos para la nandrolona, comparada con la testosterona.
Los cuatro metabolitos y análogos de nandrolona que se muestran en la figura están en la lista de la WADA. Los esteroides 9 y 10 también se comercializan como prohormonas de nandrolona y se han discutido en el capítulo 19.
En los controles antidopaje se analiza la presencia de 19-norandrosterona y 19-noretiocolanolona, los dos principales metabolitos de la nandrolona, para detectar el abuso de este anabolizante. Ya hemos comentado que se pueden formar pequeñas cantidades de nandrolona de manera natural en el cuerpo como subproducto de la aromatización de testosterona y androstenodiona. Los límites de concentración permitidos por el Comité Olímpico Internacional (COI) son todavía objeto de discusión [5 ].
Grupo 3. 17α-Metilandrostenos
Todos los esteroides del grupo 3 contienen un grupo 17α-metilo. Este grupo inhibe la oxidación del grupo hidroxilo en 17β. El impedimento estérico también dificulta la oxidación del carbono C16 y la reacción del grupo hidroxilo 17β con el ácido glucurónico o con los sulfatos. Por estos motivos, los 17α-metilesteroides se eliminan más lentamente del cuerpo y pueden ser administrados por vía oral.
La metiltestosterona es el esteroide básico en este grupo. Nosotros no hemos encontrado este anabolizante en suplementos nutricionales, aunque sí metil-4AD, una de sus prohormonas (ver capítulo 19, esteroide 14 ). La metiltestosterona es un anabolizante normal y uno de los primeros 17α-metilesteroides que apareció en el mercado. Los investigadores utilizan este compuesto, junto con el propionato de testosterona, como productos de referencia para comparar la actividad anabolizante y la actividad androgénica de otros esteroides.
El anillo A de la metiltestosterona tiene la misma estructura que en la testosterona, y por lo tanto puede sufrir las mismas transformaciones metabólicas. Esto significa que la metiltestosterona puede aromatizar para dar metilestradiol. Los efectos colaterales producidos por el metilestradiol son retención de grasas y agua, y ginecomastia; estos efectos son más acusados que los del mismo estradiol.
La enzima 5α-reductasa puede reducir metiltestosterona a metildihidrotestosterona (mestanolona, ver grupo 5), que es responsable de los efectos secundarios androgénicos.
La mayor toxicidad hepática de los 17α-metilesteroides se ha mencionado ya varias veces y no debería ser subestimada por los consumidores de metiltestosterona [6 , 7 ].
El esteroide anabolizante metandriol muestra propiedades anabolizantes razonables, no aromatiza rápidamente y la reducción por la enzima 5AR no está directamente implicada. La razón para ello es que la enzima 3β-HSD tiene que oxidar primero el grupo hidroxilo en C3 a grupo carbonilo y después debe desplazar el doble enlace a la posición conjugada Δ4 , de forma similar a como ocurre con la DHEA. Sólo después de estas transformaciones la reducción o aromatización metabólicas se vuelven posibles. Por esta razón, el metandriol no muestra demasiados efectos secundarios. Cuando estas dos transformaciones se producen, el metandriol se convierte en metiltestosterona; ésta es, por tanto, un metabolito del metandriol. De esta forma, el metandriol puede producir los mismos efectos secundarios que la metiltestosterona aunque en menor extensión. Los ésteres 3-propiónicos y 3,17-dipropiónicos de metandriol son comerciales. Los ensayos revelan una actividad razonable para el 3-propionato [8 ].
En épocas anteriores se publicaron varios estudios en los que se comparaban los efectos anabolizantes y androgénicos de varios esteroides anabolizantes de uso habitual. Los resultados de estos estudios llevados a cabo con ratas se muestran en las tablas 5-7 [9 ]. Estos estudios pueden dar una idea sobre las actividades relativas de los esteroides anabolizantes en humanos, aunque los resultados deberían considerarse con cierta reserva.
| TABLA 5. | |
| Esteroide anabolizante | Anabolizante:androgénico |
| 17 α-metil-4-clortestosterona (clostebol) | 5,4 : 2,7 |
| 17 α-metil-5-androsteno-3,17-diol (metandriol) | 1,1 : 0,7 |
| 17 α-metil-19-nortestosterona (metilnortestosterona) | 4,2 : 5,3 |
| Acetato de 1-metilandros-1-enolona (primobolan) | 0,004 : 4,8 |
Este estudio confirma la relativamente modesta actividad anabolizante del metandriol, como ya se había descrito en otros estudios. Lo mismo es cierto para la relación entre su actividad anabolizante y su actividad androgénica, cercana a uno [10 ]. A partir de ensayos en humanos se puede concluir que el metandriol tiene una actividad anabolizante relativamente baja y no presenta ventajas clínicas respecto a la testosterona [11 ].
En una patente británica de 1960 se mencionan por primera vez las buenas propiedades anabolizantes de los 7-metilandrostenos [12 ]. El grupo C7-metilo adicional en la bolasterona y la calusterona aumenta su superficie molecular, posibilitando una mejor interacción con el receptor androgénico. El grupo 7α-metilo se orienta hacia la cara inferior y protege el doble enlace Δ4 contra la reducción por parte de la enzima 5AR. Los grupos reactivos en el centro activo de la enzima se ven severamente impedidos en su aproximación desde la cara inferior del doble enlace, y la reducción para dar un 7α-metil análogo de dihidro testosterona no se produce. En los productos en que el grupo metilo se encuentra en 7β, este grupo se sitúa horizontalmente en el plano del esqueleto del esteroide, y esta reducción se encuentra menos dificultada.
Las propiedades anabolizantes y androgénicas de la bolasterona fueron investigadas extensivamente en la década 1960-70 y se han comparado con las de otros esteroides. Algunos resultados se recogen en la tabla 6 [13 ]. En 1964, Upjohn afirmaba que la bolasterona era un anabolizante oral más potente que la metandrostenolona y la oximetolona y que cualquier esteroide conocido [14 ], con una relación favorable entre actividad anabolizante y actividad androgénica en ratas [15 ].
| TABLA 6. | |
| Esteroide anabolizante | Anabolizante:androgénico |
| 7 α,17 α-dimetiltestosterona (bolasterona) | 4,2 : 1,3 |
| 7 α,17 α-metil-4-hidroxitestosterona (oximesterona) | 1,8 : 0,36 |
| 7 α,17 α-metil-androstanolona (mestanolona) | 0,8 : 1,0 |
| 9 α-fluoro-11 β-hidroxi-17 β-metiltestosterona (fluoximesterona) | 3,8 : 1,4 |
La fluoximesterona (halotestina) es otro anabolizante de uso habitual. La buena actividad oral de los 11β-hidroxi-, 11β-hidroxi-9α-fluoro- y 11-ceto-9α-fluoroesteroides se conoce desde 1956 [16 ]. En una publicación posterior se menciona que la actividad anabolizante de la fluoximesterona es comparable a la de la metiltestosterona y a la del propionato de testosterona [17 ]. Sin embargo, los manuales para consumidores no suelen recomendar su uso debido a su elevada actividad androgénica.
La tiomesterona (protabol) es descrita por Duchaine como un esteroide difícil de conseguir [1 ]. Fue sintetizada y probada por primera vez en los laboratorios Merck en 1964. Éstos describen la tiomesterona como un esteroide con una actividad anabolizante excelente y pocos efectos secundarios [18 ,19 ].
En la tabla 7 se comparan los resultados, obtenidos en experimentos con ratas, de diversas actividades de algunos esteroides anabolizantes bien conocidos [20 ].
En esta tabla se muestran las dosis mínimas que causan algún efecto. A menor dosis, mayor efectividad del esteroide. Las actividades que han sido estudiadas son las siguientes:
■ Pérdida de peso de los testículos, que mide la influencia sobre el eje HPT (ver capítulo 21 ).
■ Aumento de peso de la próstata, que es una medida de la actividad androgénica.
■ Aumento de peso de los conductos seminales, que es otra medida de la actividad androgénica.
■ Aumento de peso del músculo levator anni , que es una medida de la actividad anabolizante.
La testosterona muestra la menor dosis efectiva para todos estos efectos. El mejor resultado para un esteroide se obtiene cuando los efectos anabolizantes son evidentes a menor dosis, y al mismo tiempo los tres efectos restantes, responsables de los molestos efectos androgénicos, aparecen a mayores dosis. Fenilpropionato de nandrolona, norboletona, bolasterona, noretandrolona, oximesterona y acetato de metenolona dan todos resultados razonables para estos efectos.
Grupo 4. 19-Nor-17α-metil- y 17α-etilandrostenos

Los 19-noresteroides muestran buena actividad anabolizante y moderada actividad androgénica, y los 17α-metilesteroides poseen una actividad oral más duradera. Era por lo tanto previsible que se sintetizaran y probaran esteroides que combinan ambos elementos estructurales. Se han preparado esteroides que incorporan no sólo grupos metilo, sino también otros grupos alquilo en C17. Los ensayos han mostrado que las actividades más altas se obtienen con grupos etilo y metilo. Con grupos alquilo más voluminosos se produce una caída drástica de la actividad [21 , 22 ], y estos esteroides nunca se han comercializado.
Igualmente, el grupo metilo en C13 se ha sustituido por cadenas alquílicas más largas y de nuevo aquí se obtienen los mejores resultados con los grupos metilo y etilo. Nilevar y norboletona son los esteroides de este tipo mejor conocidos. En la mibolerona existe otro grupo 7α-metilo adicional que evita la reducción metabólica del doble enlace Δ4 .
Metilnortestosterona y noretandrolona son dos de los primeros ejemplos de este grupo de norandrostenos. Ambos 17α-metilnorandrostenos han sido probados, muchas veces en los mismos ensayos, y la noretandrolona habitualmente es el compuesto más anabolizante de los dos, también con la mejor relación entre actividad anabolizante y androgénica (ver también tablas 5 y 7) [23 , 25 ].
La norboletona se ha incluido regularmente en estos estudios [26 ] (ver tabla 7), y su alta actividad anabolizante y baja actividad androgénica se mencionan con aprecio. Más tarde se demostró que los efectos androgénicos de este esteroide de diseño pueden llegar a ser más bien elevados. La norboletona se ha descrito ya en el capítulo 18.
La mibolerona posee un grupo 7α-metilo adicional. La compañía Upjohn de Beijing (China) sintetizó y ensayó varios derivados de 7α,17α-dimetil-19-nortestosterona a principios de los años sesenta del siglo XX [27 , 28 ]. Las actividades de la mibolerona han sido comparadas con las de la fluoximesterona utilizando ratas y simios como animales de prueba. En un artículo publicado en la revista Steroids se concluye que la actividad anabolizante de la mibolerona es 14 veces mayor que la de la fluoximesterona en simios. En otro artículo se describe una actividad androgénica 14 veces mayor y una actividad anabolizante 41 veces mayor que la de la metiltestosterona en ratas. En ese artículo se menciona que la actividad anabolizante de la mibolerona es 144 veces mayor que la de la fluoximesterona. Aunque estos números muestran una gran variación en las actividades medidas, queda claro que la mibolerona es un esteroide con propiedades anabolizantes buenas y con actividad androgénica moderada.
Ya hemos mencionado que los investigadores se sorprendieron de la buena actividad anabolizante de algunos esteroides sin grupo carbonilo en C3. En la serie de los androstanos, la desoximetiltestosterona (DMT o madol, ver grupo 5 y capítulo 18 ) es un buen ejemplo, pero también en el grupo de los 19-norandrostanos se han sintetizado y estudiado esta clase de desoxiesteroides, principalmente por Organon [29 ].
El etilestrenol se comercializa con los nombres de orabolin y maxibolin. Es un anabolizante medio, oral. A la vista de su estructura se deduce que el etilestrenol no puede aromatizar (no posee carbonilo C3 ni metilo C19). Tampoco la reducción 5α puede tener lugar ya que esto requiere que el doble enlace esté conjugado con un grupo carbonilo, el cual no existe. El etilestrenol tiene pocos efectos secundarios.
El esteroide tibolona fue sintetizado y patentado por Organon en la mitad de los años sesenta del siglo XX [30 ]. La tibolona y sus metabolitos muestran actividad anabolizante, estrogénica y progestagénica. Es el principio activo de Livial (fabricado por Organon), un preparado para el tratamiento posmenopáusico. Se trata también de un buen intermedio para la preparación de otros esteroides activos. Recientemente han aparecido varias patentes relacionadas con su síntesis.
Grupo 5. Esteroides de tipo dihidrotestosterona
Todos los esteroides del grupo 5 tienen un átomo de hidrógeno 5α, lo que significa que no aromatizan ya que todos carecen del doble enlace Δ4 necesario para la aromatización (ver capítulo 14 ).
Por otra parte, muchos de los esteroides de este grupo muestran fuertes efectos androgénicos. Sin embargo, es difícil predecir las actividades de estos esteroides. Todavía se requieren ensayos y experiencias de los consumidores para establecer la relación entre la actividad anabolizante y la androgénica. Mestanolona, mesterolona y drostanolona muestran propiedades androgénicas en primer lugar.
Las azinas bolazina y mebolazina fueron desarrolladas y patentadas en Italia a principios de los años sesenta del siglo XX [31 ]. Investigadores mexicanos establecieron una actividad anabolizante para la mebolazina tres veces superior a la del propionato de testosterona [32 ]. Los investigadores italianos habían encontrado una actividad anabolizante para ambas azinas mayor que la de la metiltestosterona [33 , 34 ]. Recientemente, la mebolazina ha reaparecido en el mercado.
Bolazina y mebolazina no aparecen en la lista de esteroides prohibidos de la WADA, aunque no deberían ser utilizadas por deportistas ya que se hidrolizan en el estómago para dar drostanolona y metasterona (más conocida como superdrol ), los cuales sí se encuentran en la lista de la WADA. Por lo tanto, los usuarios de bolazina y mebolazina darían positivo en los análisis de dopaje. Lo mismo es válido para el propionato de drostanolona (masterona); las esterasas dejan libre drostanolona en el cuerpo, la cual sería detectada con toda seguridad en los análisis.
Las síntesis de drostanolona y superdrol fueron publicadas ya en 1956 [35 ]. Poco después las síntesis de drostanolona, 17-propionato de drostanolona (masterona), superdrol y oximetolona fueron publicadas por Syntex [36 ]. En esta publicación se menciona la fuerte actividad anabolizante oral y la relativamente baja actividad androgénica de estos esteroides. También se indica su elevada actividad anabolizante en patentes posteriores de Upjohn [37 ] y en la patente italiana anterior [31 ]. Sin embargo, últimamente la masterona ha perdido popularidad, y el superdrol es muy conocido por su elevada toxicidad hepática [38 ].
Los anabolizantes mejor conocidos de este grupo son la oximetolona, la oxandrolona y el madol (DMT). Todos ellos presentan un átomo de hidrógeno 5α, pero no son muy androgénicos y muestran actividades anabolizantes buenas o muy buenas.
Químicamente es sencillo introducir un grupo hidroximetileno en un carbono contiguo a un grupo carbonilo. Esto se ha llevado a cabo en el carbono C2 contiguo al carbonilo C3 de algunos esteroides anabolizantes. De esta forma, la mestanolona puede transformarse en oximetolona [36 ]. El grupo hidroximetileno puede convertirse en otros grupos funcionales permitiendo la síntesis de otros esteroides sustituidos en el anillo A. Algunos de estos esteroides han sido preparados, probados y comercializados. En el capítulo 18 ya hemos indicado las posibilidades de la oximetolona como intermedio en la síntesis de varios esteroides de diseño. Uno de estos esquemas se muestra aquí de nuevo (ver figura 123).
La oximetolona es un potente esteroide anabolizante con una actividad androgénica relativamente moderada. Este compuesto se ha utilizado durante mucho tiempo como medicina para el tratamiento de la anemia, aunque últimamente ha sido sustituido por la epo, que es más eficaz. La oximetolona todavía se utiliza en el tratamiento de la distrofia muscular en pacientes con VIH.
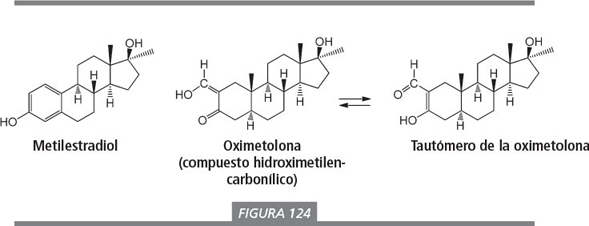
Algunos efectos secundarios importantes de la oximetolona son la retención de agua y la ginecomastia, esta última a pesar de la ausencia del doble enlace Δ4 . Debido a esto, las aromatasas no pueden aromatizar la oximetolona. Arnold y Llewellyn [39 ] especulan que la propia oximetolona puede interaccionar con el receptor de estrógenos debido a la presencia de un grupo hidroxilo de tipo fenólico en el anillo A. En la figura 124 se da una explicación química plausible para esta especulación.
El grupo hidroxilo en el metilestradiol se encuentra conectado a un anillo aromático. Los químicos definen este grupo hidroxilo como un grupo hidroxilo fenólico. El átomo de H de este grupo está unido débilmente al átomo de oxígeno. Esto significa que es relativamente ácido (pierde H+ con relativa fa-cilidad) y que es un buen dador en la formación de enlaces por puente de hidrógeno. Un razonamiento similar es válido también para el átomo de hidrógeno del grupo hidroxilo en un compuesto hidroximetilen-carbonílico . Este grupo hidroxilo es incluso más ácido que el grupo hidroxilo fenólico. Además, en los compuestos hidroximetilen-carbonílicos existe la posibilidad de tautomería. Esto significa que se produce un equilibrio en que el átomo de H salta de un átomo de oxígeno al otro, produciéndose un movimiento de los dobles enlaces. La situación en el tautómero de la derecha se asemeja muchísimo a la del metilestradiol. Esto podría explicar por qué la oximetolona interacciona con el receptor de estrógenos. Sin embargo, esto es sólo especulativo y no existen estudios en la bibliografía que corroboren esta explicación.
La inhibición de la enzima aromatasa no evita la ginecomastia causada por la oximetolona, ya que la aromatización del esteroide no se produce y, posiblemente, no es necesaria para la unión de la oximetolona con el receptor de estrógenos. Para evitar la ginecomastia por oximetolona es necesario bloquear el propio receptor de estrógenos.
La oxandrolona (anavar) fue desarrollada en los inicios de los sesenta del siglo XX por Searle [40 , 41 ]. La oxandrolona presenta un anillo A poco habitual en el esqueleto de esteroide. El carbono C2 ha sido sustituido por un átomo de O, transformando el carbonilo en C3 en un carbonilo de éster. Este éster forma parte del anillo A; los ésteres cíclicos reciben también el nombre de lactonas . La lactona mantiene el grupo carbonilo en C3, lo que le permite interaccionar con el receptor androgénico. Sin embargo, la lactona no se reduce metabólicamente a grupo hidroxilo.
El anillo A de la oxandrolona tampoco puede aromatizar, ya que el átomo de oxígeno que ocupa la posición en el interior del anillo no puede formar más enlaces adicionales. Además, tampoco existe doble enlace en Δ4 , lo cual es otra razón para que no se produzca la aromatización.
El grupo 17β-metilo inhibe la oxidación del grupo hidroxilo 17α y dificulta la formación de glucuronatos y sulfatos. Todo esto hace que la oxandrolona no se metabolice fácilmente. El anabolizante es activo por vía oral y es excretado sin cambios después de cierto tiempo [42 ].
La actividad anabolizante de la oxandrolona es cerca de seis veces superior a la de la metiltestosterona [43 , 44 ], y no muestra demasiados efectos androgénicos. En dosis bajas, la oxandrolona es también adecuada para mujeres, sin demasiados riesgos de masculinización. El esteroide presenta un grupo 17α-metilo pero no es muy tóxico para el hígado. En los Estados Unidos, la FDA (del inglés, F ood and D rug A dminis-tration ) ha aprobado su uso en pacientes con VIH.
La oxandrolona estimula el desarrollo muscular en hombres jóvenes [45 ]. Se especula que produce un aumento en la concentración de receptores androgénicos en los músculos. El efecto anabolizante de la oxandrolona también tiene un efecto favorable en hombres ancianos [46 ]. Estimula el crecimiento muscular y reduce el tejido graso. Cuando se interrumpe el tratamiento con oxandrolona, el efecto sobre los músculos desaparece en doce semanas, pero la reducción de grasas permanece.
El esteroide de diseño madol (DMT) se ha discutido extensamente en el capítulo 18. Recientemente se han establecido las propiedades de tipo SARM para este compuesto (ver capítulo 21 ). El madol se ha encontrado también en algunos suplementos nutricionales [47 ], aunque esto no se indicaba claramente en las etiquetas (ver capítulo 19 ).
Grupo 6. Esteroides de tipo Δ 1 -testosterona
La 1-testosterona (esteroide 26 ) es un potente anabolizante por sí misma, aunque los fabricantes la anuncian como prohormona. La mesabolona es un acetal (ver capítulo 17 ) que probablemente se hidroliza en el estómago para dar 1-testosterona. Los otros dos esteroides de la fila superior son prohormonas de 1-testosterona que se han mencionado en el capítulo 19 con los números 27 y 28 .
En el capítulo 19 se menciona también el esteroide metil-1-testosterona con el número 33 . Es un anabolizante fuerte que también se encuentra a la venta como suplemento nutricionaI.
Los esteroides metenolona y estembolona poseen un grupo metilo adicional en el doble enlace Δ1 . El acetato (primobolan) y el enantato (primobolan depot) son derivados de metenolona bien conocidos. Ambos fueron desarrollados y patentados en los años sesenta del siglo XX por Schering [48 , 49 ]. Metenolona y primobolan pertenecen al pequeño grupo de anabolizantes orales que carecen del grupo 17α-metilo. Por lo tanto carecen de toxicidad hepática. Un inconveniente de los mismos es la dosis necesaria relativamente alta, debido a que se producen transformaciones metabólicas aunque más lentamente que con la testosterona. El enantato, que posee una acción más prolongada, se inyecta. La metenolona es un anabolizante suave con pocos efectos androgénicos, bastante popular entre las mujeres.
La estembolona fue introducida primero por Schering y después por Syntex a principios de los años sesenta del siglo XX [50 , 51 ]. El acetato de estembolona se conoció con el nombre comercial de anatrofin [51 ]. Es un anabolizante suave que no aromatiza y muestra pocos efectos androgénicos. También se conoce un derivado con un grupo 17α-metilo con un poder anabolizante mayor y pocos efectos androgénicos, aunque probablemente con mayor toxicidad hepática [50 , 52 ].
Grupo 7. Androstenos con más de un doble enlace
Los esteroides de este grupo tienen un doble enlace adicional Δ1 en el anillo A respecto a la testosterona. Los esteroides más conocidos de este grupo son la boldenona y, especialmente, su 17α-metil derivado, el dianabol. La introducción del sistema de dienona Δ1,4 característico en el anillo A fue una de las primeras modificaciones de la testosterona que produjo una mejora en sus prestaciones.

Los efectos androgénicos de estos esteroides son moderados, al menos en dosis bajas. La agrupación dienona puede aromatizar. Una explicación para ello se ha avanzado en el capítulo 14. La enzima aromatasa posiblemente participa sólo en los dos primeros pasos de oxidación, la formación de los intermedios con un grupo hidroxilo y un grupo carbonilo en C19. Gracias a la presencia del doble enlace Δ1 , estos intermedios pueden perder formaldehído o ácido fórmico por la acción de un hidróxido (OH- ) para formar el anillo aromático sin la participación de aromatasas. Esta explicación es especulativa pero razonable desde el punto de vista químico (ver figura 125).
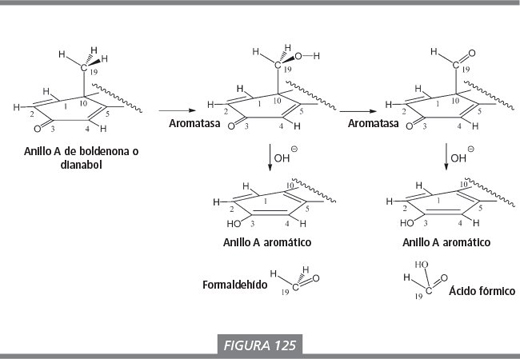
La boldenona y dos de sus derivados, equipoise y quimbolona, son anabolizantes bien conocidos [52 ]. La equipoise es un éster inyectable, el undecanoato de boldenona, y su actividad es similar a la de la decadurabolina (deca), el éster decanoico de la nandrolona. La equipoise es un anabolizante medio desarrollado originalmente para uso veterinario. El grupo hidroxilo en C17 se encuentra esterificado con una molécula de un ácido graso, el ácido undecanoico, por lo que este derivado es apolar. Se inyecta en los tejidos grasos también apolares. De esta forma permanece durante largo tiempo en el cuerpo, al igual que la decadurabolina. Por esta razón, puede aparecer en los análisis antidopaje incluso mucho tiempo después de haber sido administrada.
La quimbolona es un enol-éter derivado de la boldenona. El enol-éter se localiza en el anillo de cinco miembros unido al grupo hidroxilo C17 y se hidroliza en el estómago para dar boldenona. La quimbolona es el principio activo de Anabolicum Vister, un preparado activo oral que es conocido sobre todo en Italia [53 ].
El esteroide boldiona ha sido patentado como prohormona de boldenona. Una 17β-deshidrogenasa tiene que reducir el grupo carbonilo en C17 a grupo hidroxilo 17β para dar boldenona [54 ]. Equipoise, quimbolona y boldiona son todas precursoras de boldenona. Se ha podido demostrar que los consumidores de estos tres esteroides excretan los mismos metabolitos que los consumidores de boldenona, lo que prueba que la boldenona es el intermedio y el compuesto activo en todos estos esteroides [55 ]. La boldenona es un anabolizante suave con pocos efectos secundarios androgénicos. La aromatización supone un problema únicamente a dosis altas.
El dianabol es el 17α-metil análogo de la boldenona. Este compuesto fue desarrollado por CIBA [18 , 25 , 52 ] y es uno de los esteroides anabolizantes utilizado durante más tiempo. Los levantadores de peso (halteras) lo utilizaban ya en los años cincuenta y sesenta del siglo XX , y después se popularizó en otros deportes [56 , 57 ]. El dianabol es un potente esteroide anabolizante oral con pocos efectos androgénicos. Se aromatiza dando 17α-me til estradiol (ver anteriormente). Puesto que el metilestradiol es más activo que el estradiol, el efecto secundario del dianabol es más molesto que el mismo efecto en la boldenona y sus derivados. El grupo 17α-metilo aumenta también su toxicidad hepática.
La formebolona es un esteroide un poco extraño. Induce inflamaciones locales en el músculo inyectado, que como consecuencia se hincha y se vuelve más grande. Este efecto es más visible en los músculos más pequeños y perdura durante aproximadamente cinco días. Los culturistas usan este efecto para mejorar su apariencia durante las competiciones [2 ]. Este esteroide es un anabolizante medio y débilmente androgénico. Fue patentado en Italia en los años sesenta del siglo XX [58 ].
Grupo 8. 19-Nor y 17α-metil y etil análogos de esteroides con más de un doble enlace
Ninguno de los esteroides de este grupo posee grupo C19-metilo, por lo que se ha tendido a compararlos con otros 19-norandrostenos como, por ejemplo, la nandrolona. Sin embargo, esta comparación no tiene sentido por varias razones:
■ Todos los esteroides de este grupo tienen un doble enlace entre C9 y C11 que no existe en la nandrolona. Este doble enlace hace la molécula del esteroide más plana y flexible, lo que permite una mejor interacción con el receptor androgénico. Por este motivo, los esteroides de este grupo son más activos.
■ El doble enlace Δ9,11 también inhibe la aromatización, y la ginecomastia no es un efecto secundario de estos esteroides. La nandrolona, en cambio, puede aromatizar, aunque este efecto no es muy fuerte.
■ El sistema de dobles enlaces conjugados (C4=C5-C9=C10-C11=C12) estabiliza el doble enlace Δ4 . Por esta razón, la enzima 5α-reductasa no puede reducir este doble enlace y modificar la actividad del esteroide en tejidos sensibles. Los esteroides de este grupo muestran habitualmente un efecto secundario androgénico sustancial. La enzima 5α-reductasa sí convierte, en cambio, la nandrolona en dihidronandrolona, que es menos activa.
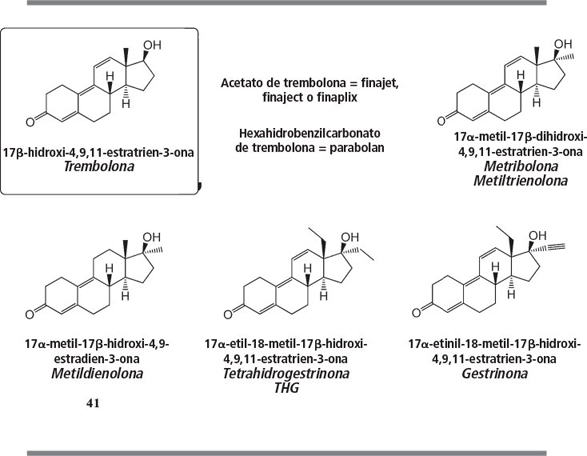
La trembolona, el esteroide clave en este grupo, fue desarrollada por Roussel-Uclaf [59 ] a finales de los años sesenta del siglo XX . Se trata originalmente de un preparado veterinario, aunque también es popular entre culturistas. Es un esteroide fuertemente anabolizante. Ya hemos explicado anteriormen te que la trembolona no aromatiza, lo que es una ventaja respecto a otros anabolizantes fuertes como el dianabol o la testosterona. La trembolona tiene efectos secundarios androgénicos importantes. Estos efectos también provocan el endurecimiento y la definición de los músculos sin retención de agua. La trembolona también está disponible en forma de acetato inyectable, y anteriormente como hexahidrobencilcarbonato (parabolan). En el cuerpo, las esterasas convierten estos ésteres en el anabolizante activo trembolona.
La metribolona (metiltrienolona o metiltrembolona) se menciona también en la misma patente de Roussel-UCLAF [59 ]. Es el esteroide anabolizante más potente que se conoce actualmente. Su actividad es tan alta que resulta incluso difícil compararla con la del propionato de testosterona o la de la metiltestosterona. En la bibliografía se le atribuye una actividad 30.000 veces mayor que la de la metiltestosterona. La metribolona se conoce en el mundo científico por su código R1881, y se utiliza frecuentemente para comparar la actividad de otros esteroides. Es también el esteroide con mayor toxicidad hepática conocido actualmente. Es un esteroide peligroso de usar, completamente inadecuado para humanos. Los consumidores tendrán problemas con toda seguridad.
La metildienolona es también un anabolizante fuerte con relativamente pocos efectos androgénicos. Su actividad es mucho menor que la de la metribolona, pero mayor que la de la metiltestosterona. Este compuesto se encuentra en suplementos nutricionales y ha sido estudiado en el capítulo 19 como el esteroide 41 [60 , 61 ]. Tampoco es necesario discutir de nuevo la THG. Este esteroide ha sido uno de los temas principales del capítulo 18.
La gestrinona fue desarrollada inicialmente como anticonceptivo oral y fue patentada con este fin por Roussel-Uclaf [62 ] en los años sesenta del siglo XX . La gestrinona presenta un amplio espectro de actividades. Se utiliza en el tratamiento de la endometriosis, disminuye la espermatogénesis y tiene propiedades anabolizantes suaves. Debido a esta última actividad aparece en la lista de la WADA. La gestrinona ha sido utilizada por Pat Arnold como producto de partida para la preparación de THG (ver figura 100, pág. 223, del capítulo 18 ).
Grupo 9. Esteroides con un grupo hidroxilo adicional en C4
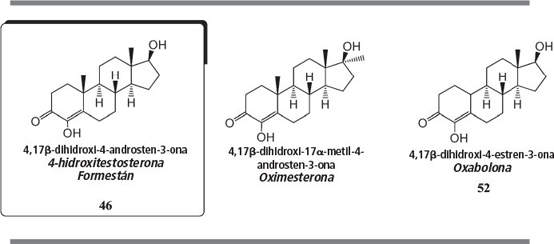
Los esteroides con un grupo hidroxilo adicional en C4 se han discutido también en el grupo 5 del capítulo 19. Algunos miembros de este grupo son inhibidores de la aromatasa y otros tienen propiedades anabolizantes.
El formestán es el esteroide básico de este grupo y se ha descrito como esteroide 46 en el capítulo 19. Es un potente inhibidor de la aromatasa [63 , 64 ]. También se encuentra en algunos suplementos nutricionales y se comercializa en gel.
La oximesterona es el 17α-metil análogo del formestán. Las propiedades anabolizantes de este esteroide fueron ya mencionadas a principios de los años sesenta del siglo XX [65 ] y son mejores que las de la metiltestosterona. Sus efectos androgénicos son inferiores, y consecuentemente este esteroide presenta una buena relación entre su actividad anabolizante y su actividad androgénica.
La oxabolona es el 19-nor análogo del formestán. En el capítulo 19 se la menciona como esteroide 52 . Es un esteroide anabolizante que no inhibe la aromatasa. En el capítulo 19 hemos propuesto una explicación para este hecho [66 ]. Las propiedades anabolizantes de la oxabolona fueron investigadas y patentadas por un grupo italiano en los años sesenta del siglo XX [67 ]. Posteriormente se patentaron algunos de sus éteres y ésteres [68 ].
Grupo 10. Esteroides clorados
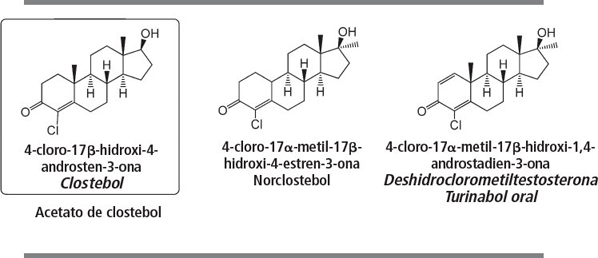
El acetato de clostebol es un esteroide, oral o inyectable, con actividad media. Presenta una relación adecuada entre sus propiedades androgénicas y anabolizantes, no aromatiza y no es tóxico para el hígado. Es un esteroide adecuado para mujeres y hombres ancianos.
El norclostebol es un esteroide anabolizante medio con pocos efectos androgénicos. Clostebol y norclostebol fueron desarrollados por los laboratorios italianos Farmitalia Milan a mitad de los años cincuenta del siglo XX [69 ]. También Syntex ha investigado estos esteroides [70 ].
El turinabol oral es famoso por ser el esteroide anabolizante utilizado por los deportistas de la RDA comunista. El esteroide ya era conocido al principio de los años sesenta del siglo XX y presenta una buena actividad anabolizante, junto con una modesta actividad androgénica [71 , 72 ]. Más tarde, cuando su abuso por parte de los atletas de la RDA se hizo evidente, se estudió su metabolismo [73 ]. Después de la caída de la RDA, el turinabol oral desapareció. Sin embargo, este producto ha sido reintroducido en el mercado negro por laboratorios chinos y otros laboratorios clandestinos.
Grupo 11. Esteroides con un anillo heterocíclico unido al anillo A
Los esteroides con un anillo heterocíclico unido al anillo A fueron investigados entre finales de los años cincuenta e inicios de los sesenta del siglo XX por Sterling-Winthrop [74 , 75 ]. El estanozolol es el esteroide mejor conocido de este grupo. La mayoría de los esteroides de este grupo no poseen un doble enlace Δ4 y, por lo tanto, no aromatizan. La mayoría presentan efectos androgénicos sustanciales.
El estanozolol ya era un esteroide anabolizante conocido y muy buscado, aunque alcanzó la fama mundial cuando el plusmarquista y récord mundial de los 100 metros lisos, Ben Johnson, fue cazado utilizando este anabolizante en los Juegos Olímpicos de Los Ángeles en 1988. El estanozolol es un buen anabolizante oral o inyectable con una actividad mejor que la metiltestosterona, pero inferior a la del dianabol. La relación entre las actividades anabolizantes y androgénicas de este compuesto ha sido investigada de diferentes maneras por varios grupos con resultados dispares. Una media de 6 indica que esta relación es favorable. Una dosis baja de este esteroide es adecuada también para mujeres.
El prostanozol posee el mismo anillo de pirazol unido al anillo A que el estanozolol, pero no presenta el grupo 17α-metilo. El prostanozol se encuentra a la venta en suplementos nutricionales y se anuncia como una prohormona. Sin embargo, esto no es cierto, sino que se trata de un derivado. Su actividad es comparable a la del estanozolol. El grupo hidroxilo en C17 se encuentra protegido como éter de THP. Cuando este éter está ausente, el esteroide no es activo oralmente [74 ]. Recientemente, un campeón olímpico ha sido descubierto usando prostanozol [76 ].
El furazabol es un esteroide heterocíclico de origen japonés [77 ]. Es un anabolizante relativamente suave con efectos secundarios androgénicos considerables. Un éter de THP sin el grupo metilo en el 17α-derivado de este compuesto se ha comercializado en un suplemento nutricional (ver capítulo 19, estructura 71 ).
El anillo de isoxazol en el androisoxazol se une al anillo A de forma [3,2-c ]. Esto significa que el átomo de N ocupa la posición del grupo carbonilo en C3. Este anabolizante puede tomarse por vía oral y es 1,5 veces más activo que la metiltestosterona, aunque su actividad androgénica es sólo del 20%. Por lo tanto, presenta una buena relación entre actividad anabolizante y actividad androgénica. Esta relación es incluso mejor en el compuesto en que el anillo heterocíclico se une de forma [2,3-d ] al anillo A. Esto significa que el átomo de oxígeno del anillo heterocíclico se encuentra unido al carbono C3. Este esteroide se muestra en el centro de la fila inferior. Sorprendentemente no existe un nombre comercial para el mismo y tampoco aparece en la lista de la WADA. Su actividad anabolizante oral es nueve veces mayor y su actividad androgénica cuatro veces menor que las de la metiltestosterona [75 ].
En el esteroide danazol el anillo de isoxazol se encuentra unido también de forma [2,3-d ] al anillo A. Este esteroide se utiliza para el tratamiento de la endometriosis. Posee propiedades anabolizantes suaves, aunque algunas personas opinen de manera diferente [1 ] y aparece en la lista de la WADA. El compuesto posee un grupo α-etinilo. La presencia de este grupo habitualmente no es favorable para la actividad anabolizante, y la presencia de un grupo metilo o etilo en su lugar suele ser mejor.
Se han sintetizado y ensayado varios esteroides heterocíclicos con anillos de [3,2-c ]pirazol, [3,2-c ]isoxazol y [2,3-d ]isoxa-zol con o sin doble enlace Δ4 y con o sin grupo metilo o etilo en 17α [74 , 75 ]. Algunos presentan buena actividad anabolizante, pero la mayoría no se han puesto nunca a la venta.
Conclusiones
Los esteroides anabolizantes de este capítulo son el resultado de una larga búsqueda por parte de la industria farmacéutica de compuestos que actúen de forma óptima y selectiva. La elevada actividad y una buena separación entre la actividad anabolizante y la actividad androgénica era y continúa siendo uno de los objetivos. Este objetivo no se ha alcanzado todavía, aunque se ha progresado en su consecución. La comprensión de los factores que determinan la interacción entre el ligando y el receptor ha aumentado enormemente, especialmente a partir de la determinación por rayos X de las estructuras de los dominios de unión del ligando (LBD) en los complejos ligando-receptor androgénico (ver capítulo 7 ). Este mayor conocimiento ha inducido a buscar otros compuestos de estructura no esteroidal. Las compañías farmacéuticas esperan conseguir sus objetivos de manera más fácil y rápida con los llamados moduladores selectivos del receptor androgénico o SARM (ver capítulo 21 ).
Podemos hacer algunas puntualizaciones generales sobre la relación estructura-actividad de los esteroides anabolizantes:
■ En los esteroides de tipo testosterona, la variación estructural más habitual es la reducción de C3 y la oxidación y derivación de C17. La aromatización es prácticamente inevitable en estos esteroides, y su consecuencia es la retención de agua y grasas. La reducción del doble enlace Δ4 es una transformación metabólica habitual que conduce a esteroides de tipo dihidrotestosterona, los cuales muestran a menudo efectos androgénicos considerables.
■ 19-Norandrostenos. La omisión del grupo metilo en C19 normalmente aumenta la actividad anabolizante de estos compuestos. La aromatización puede tener lugar, aunque no suele ser un problema importante. La reducción metabólica del doble enlace Δ4 conduce normalmente a esteroides menos activos y con menos efectos androgénicos secundarios.
■ 17α-metil y 17α-etilandrostenos. La introducción de un grupo metilo o etilo en C17 tiene un efecto positivo en la actividad anabolizante. Estos esteroides son activos por vía oral porque las transformaciones metabólicas en los alrededores de C17 no se producen o se ralentizan. Sin embargo, los cambios en C17 no afectan a la reactividad del anillo A y las modificaciones metabólicas de este anillo como la aromatización o la reducción del doble enlace son posibles y pueden producir metabolitos con sus correspondientes efectos secundarios.
■ La introducción de uno o más grupos metilo en C17, C7, C11 y a veces en C1 y C2 tiene un efecto positivo en la actividad anabolizante del esteroide. Estos compuestos, llamados esteroides puercoespín (porcupine), presentan una mayor superficie e interaccionan fuertemente con el receptor androgénico mediante fuerzas de Van der Waals.
■ Los esteroides tipo dihidrotestosterona muestran a menudo efectos androgénicos secundarios considerables, aunque éstos no son fáciles de predecir.
■ Esteroides de tipo Δ 1 -testosterona. El doble enlace Δ1 a menudo aumenta la actividad anabolizante de los esteroides. La aromatización no suele ser habitual (excepto en el caso del dianabol) y la reducción del doble enlace Δ4 no se produce. La actividad androgénica de estos esteroides no se ve modificada y puede ser considerable.
■ Los 19-norandrostenos con varios dobles enlaces son esteroides anabolizantes activos o muy activos. Estos esteroides más planos y flexibles interaccionan mejor con el receptor androgénico. La aromatización y reducción del doble enlace Δ4 no tienen lugar, pero sus efectos androgénicos colaterales pueden ser considerables.
■ Esteroides con un grupo hidroxilo adicional en C4. La actividad de estos esteroides depende de la estructura del resto de la molécula del esteroide. Algunos de ellos son inhibidores de la aromatasa; otros tienen actividad anabolizante.
■ Esteroides con un átomo de cloro en C4. La introducción de un átomo de cloro en C4 normalmente disminuye la actividad anabolizante, aunque este efecto es más acusado sobre la actividad androgénica. Estos esteroides son anabolizantes suaves.
■ Esteroides con un anillo heterocíclico unido al anillo A. La unión de un anillo heterocíclico al anillo A aumenta la actividad anabolizante. Estos esteroides no aromatizan, pero sus efectos androgénicos secundarios son considerables.
■ Es casi imposible de predecir de qué manera una combinación de cambios estructurales en la molécula del esteroide afectará finalmente a la actividad y selectividad del esteroide anabolizante resultante. Los ensayos son la única forma de determinarlo, y a menudo la experimentación será superior al conocimiento científico.
REFERENCIAS BIBLIOGRÁFICAS
[1 ] Duchaine D. Underground steroid handbook.
[2 ] Llewellyn W. Anabolics 2002.
[3 ] World Anti-Doping Agency (WADA). The 2007 prohibited list.
[4 ] Solveig H.; Hemmersbach P. Kjemi 2006; 66, 8-12.
[5 ] Bricout V.; Wright F. European Journal of Applied Physiology 2004; 92, 1-12.
[6 ] Velázquez I.; Alter B.P. American Journal of Hematology 2004; 77, 257-267.
[7 ] Koller M.; Ercoli A. Bollettino della Societa Italiana di Biologia Sperimentale 1952; 28, 1.726-1.729.
[8 ] Iriarte J., Djerassi C., Ringold H.J. Journal of the American Chemical Society 1959; 81, 436-438.
[9 ] Arnold A.; Potts G.O. Acta Endocrinologica 1966; 52, 489-496.
[10 ] Saunders F.J.; Drill V.A. (Searle). Proceedings of the Society for Experimental Biology and Medicine 1957; 94, 646-649.
[11 ] Partridge J.W.; Boling l.; de Wind L.; Margen S.; Kinsell L.W. Journal of Clinical Endocrinology and Metabolism 1953; 13, 189-202.
[12 ] 7,17-Dimethyl-4,6-androstadien-3-ones, patente británica GB 863662 19610322.
[13 ] Arnold A.; Potts G.O.; Beyler A.L. Journal of Endocrinology 1963; 28, 87-92.
[14 ] Stucki J.C.; Duncan G.W.; Lyster S.C. (Upjohn). Hormonal Steroids, Proceedings of the International Congress on Hormonal Steroids 1965; 2, 119-132.
[15 ] Campbell J.A.; Babcock J.C. (Upjohn). Hormonal steroids, Proceedings of the International Congress on Hormonal Steroids 1965; 2, 59-67.
[16 ] Herr M.E.; Hogg J.A.; Levin R.H. (Upjohn). Journal of the American Chemical Society 1956; 78, 500-501.
[17 ] Marinosci A.; Peruzy A.D.; De Martino C.; Sabella G. Folia Endocrinologica 1960; 13, 133-140.
[18 ] Kraft H.G.; Bruecker K. Artzneimittel Forschung 1964; 14, 326-330.
[19 ] Kraft H.G.; Kieser H. Artzneimittel Forschung 1964; 14, 330-335.
[20 ] Boris A.; Stevenson R.H.; Trmal T. Steroids 1970; 15, 61-71.
[21 ] Perrine J.W. Acta Endocrinologica 1961; 37, 376-384.
[22 ] Colton F.B. (Searle). 17-Alkyl derivatives of 19-nortestosterone, patente americana US 2721871 19551025.
[23 ] Drill V.A.; Saunders F.J. (Searle). Hormones and aging process. Proceedings of the Conference Harriman, New York 1955; 99-113. Proceedings of the Society for Experimental Biology and Medicine. Society for Experimental Biology and Medicine New York 1957; 94, 646-649.
[24] Overbeek G.A.; de Visser J. Annales d’endocrinologie 1956; 17, 268-269.
[25 ] Dorfman R.I.; Kincl F.A. Endocrinology 1963; 72, 259-266.
[26 ] Edgren R.A. (Wyeth Labs). Acta Endocrinologica 1963; 87, 21.
[27 ] Campbell J.A.; Lyster S.C.; Duncan G.W.; Babcock J.C. Steroids 1963; 1, 317-324.
[28 ] Lyster S.C.; Duncan G.W. Acta Endocrinologica 1963; 43, 399-411.
[29 ] Szpilfogel S.A. et al. Compounds of the estrene series, patente holandesa NL 89813 19581215; 19-Nor steroids, patente británica GB 91082 19590515, 3-Deoxy-19-nor-4-androstenes, patente americana US 3112328 19631126.
[30 ] Organon N.V. 7-Methylestrenes , patente holandesa NL 6406797 19651 217.
[31 ] Ruggieri P. Steroidal azines, patentes italianas IT 199611123, IT 19630403, patente americana US 3062847 1962166952.
[32 ] Vazques E.; Hinojosa C.; Guevara G.; Guerrero A.; Bruciaga V.; Llaca V.; Velasco S.; Vazques P.; Ortega L. Ginecología y Obstetricia de México 1963; 18, 549-567.
[33 ] Matscher R.; Lupo C.; Ruggieri P. Bollettino della Societa di Biologia Sperimentale 1962; 38, 988-990.
[34 ] Ruggieri P.; Gandolfi C.; Chiaramonti O. Bollettino della Societa di Biologia Sperimentale 1962; 38, 985-987.
[35 ] Ringold H.J.; Rosenkranz G. Journal of Organic Chemistry 1956; 21, 1.333-1.335.
[36 ] Ringold H.J.; Batres E.; Halpern O.; Necoechea E. (Syntex). Journal of the American Chemical Society 1959; 81, 427-432.
[37 ] Babcock J.C.; Campbell J.A.; Pederson R.L. (Upjohn). Steroids, patente alemana DE 1117114 19611116.
[38 ] Krishnan P.V.; Feng Z.Z.; Gordon S.C. Journal of Clinical Gastroenterology 2009; 43, 672-675.
[39 ] Llewellyn W. Anabolics 2002, pág. 48.
[40 ] Pappo R. (Searle). 2-Oxa-3-oxosteroids, patente alemana DE 1171425 19640604 (Priority US 19600517).
[41 ] Pappo R.; Jung C. 17-Alkylated 17-oxygenated 2-oxaandrostanes,patente americana US 3101349 19630802.
[42 ] Fennessey P.V.; Gotlin R.W.; Martin D.; Smith S.; Harrison L.M. Journal of Pharmaceutical and Biomedical Analysis 1987; 6, 999-1.002.
[43 ] Fox M.; Minot A.N.; Liddle G.W. Journal of Clinical Endocrinology and Metabolism 1962; 22, 921-924.
[44 ] Lennon H.D.; Saunders F.J. Steroids 1964; 4, 689-697.
[45 ] Sheffield-Moore M.; Urban R.J.; Wolf S.E.; Jiang J.; Catlin D.H.; Herndon D.N.; Wolfe R.R.; Ferrando A.A. Journal of Clinical Endocrinology and Metabolism 1999; 84, 2.705-2.711.
[46 ] Schroeder E.T.; Zheng L.; Yarasheski K.E.; Qian D.; Stewart Y.; Flores C.; Martínez C.; Terk M.; Sattler F.R. Journal of Applied Physiology 2004; 96, 1.055-1.062.
[47 ] Okano M.; Sato M.; Ikekita A.; Kageyama S. Drug Testing and Analysis. vol. 1 (11-12), 518-525.
[48 ] Wiechert R.; Goedicke V. (Schering A.-G.). 1-Methylandrost-1-en-17-ol-3-ones, patente alemana DE 1152103 19630801.
[49 ] Wiechert R.; Caspar E. Chemische Berichte 1960; 93, 1.710-1.715.
[50 ] Counsel R.E.; Klimstra P.D.; Cotton F.B. Journal of Organic Chemistry 1962; 27, 248-253.
[51 ] Kincl F.A.; Dorfman R.I. Steroids 1964; 3, 109-122.
[52 ] Nutting E.F.; Klimstra P.D.; Counsel R.E. Acta Endocrinologica 1966; 53, 627-634; Acta Endocrinologica 1966; 53, 635-643.
[53 ] Ercoli A.; Gardi R.; Vitali R. Chemistry and Industry London 1962; 1.284-1.285.
[54 ] Llewellyn W.C. Use of 1,4-androstadienedione as a method of increasing levels of the anabolic/androgenic steroid boldenone in humans, patente americana US 20030027805 A1 20030206.
[55 ] Galetti F.; Gardi R. Steroids 1971; 18, 39-50.
[56 ] Todd T. Journal of Sport History 1987; 14, 87-107.
[57 ] Fair J.D. Journal of Sport History 1993; 20, 1-24.
[58 ] Laboratorio Prodotti Braglia. Anabolic 2-formyl-11-hydroxy-1-methyl -testosterones, patente británica GB19691168931, patente francesa FR 19696061.
[59 ] Vignau R.; Bucourt R.; Tessier J.; Costerousse G.; Nedelec L.; Gasc J.-C.; Joly R.; Warnant J.; Goffinet B. (Roussel-UCLAF). 7-Methyl estra-4,9,11-trienes, patente americana US 3453267 A 1965-517061.
[60 ] Perelman M.; Farkas B.; Fornefeld E.J.; Kraay R.J.; Rapala R.T. Journal of the American Chemical Society 1960; 82, 2.402-2.403.
[61 ] Nutting E.F.; Calhoun D.W. (Searle). Endocrinology 1969; 84, 441-442.
[62 ] Roussel-Uclaf. Gonatrienes, patente holandesa NL 6607609, patente alemana DE 1593307, patente británica GB 1069709, patente francesa FR 1503984.
[63 ] Marsh D.A.; Brodie H.J.; Garrett W.; Tsai-Morris C.H.; Brodie A.M.H. Journal of Medical Chemistry 1985; 28, 788-795.
[64 ] Rowlands M.G.; Foster A.B.; Mann J.; Pietrzak B.; Wilkinson J.; Coombes R.G. Steroids 1987; 49, 371-382.
[65 ] Dorfman R.I.; Kincl F.A. Endocrinology 1963; 72, 259-266.
[66 ] Covey D.F.; Hood W.F. Molecular Pharmacology 1982; 21, 173-180.
[67 ] Camerino B.; Patelli B.; Sciaky R. 4-Hydroxy steroids, patente italiana IT 19610210, patente americana US 3068225 19621211.
[68 ] Sal A. Use of ester and ether derivatives of 4-hydroxy-19-noran dros -terone to increase the level of the anabolic/androgenic hormone 4-hy -dro xy-19-nortestosterone in humans, patentes americanas US 2004 -0002483 A1 20040101, US 20030199486 A1 20031023.
[69 ] Sala G.; Baldratti G.; Ronchi R.; Clini V.; Bertazolli C. Sperimentale 1956; 106, 490-510.
[70 ] Ringold H.J.; Batres E.; Mancera O.; Rosenkranz G. (Syntex). Journal of Organic Chemistry 1956; 21, 1.432-1.435.
[71 ] Schubert A.; Stachowiak D.; Onken D.; Specht K.; Barnikol-Oetler K.; Bode E.; Heller K.; Polnert S.; Schwartz S.; Zepter R. Pharmazie 1963; 18, 323-331.
[72 ] Dorner G.; Stahl F.; Zabel R. Endokrinologie 1963; 45, 121-128.
[73 ] Musshof F.; Daldrup T.; Ritsch M. Journal of Forensic Sciences 1997; 42, 1.119-1.125.
[74 ] Clinton R.O.; Manson A.J.; Stonner F.W.; Neumann H.C.; Christiansen R.G.; Clarke R.L.; Ackerman J.H.; Page D.F.; Dean J.W.; Dickinson W.B.; Carabateas C. Journal of the American Chemical Society 1961; 83, 1.478-1.491.
[75 ] Manson A.J.; Stonner F.W.; Neumann H.C.; Christiansen R.G.; Clarke R.L.; Ackerman J.H.; Page D.F.; Dean J.W.; Phillips D.K.; Potts G.O.; Arnold A.; Beyler A.L.; Clinton R.O. Journal of Medicinal Chemistry 1963; 6, 1-9.
[76 ] Nicolai Durmanov. Radio New Zealand, 5-Jul-2006.
[77 ] Shimizu M.; Ohta G.; Veno K.; Takegoshi T.; Oshima Y.; Kasahara A.; Onodera T.; Mogi M.; Tachizawa H. Chemical and Pharmaceutical Bulletin 1965; 13, 895-897.