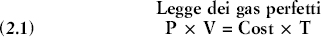
. 2 .
In tutte le università del mondo circolano delle leggende metropolitane. Forse qualcuno di voi ha già sentito una storia simile a quella che stiamo per raccontarvi. A noi l’ha riferita un ex studente di fisica poco prima che iniziassimo a scrivere questo libro, giurandoci che era tutto vero.
Era una giornata fredda, del resto era l’appello di febbraio. Ricordo che entrando nell’aula percepii subito la differenza di temperatura con l’esterno. Ma non era l’impianto di riscaldamento; immagino che a far salire il termometro fosse la paura degli studenti. Mi sentii chiamare e per poco non mi caddero i libri per terra. Il mio primo esame, capite? Mi sedetti cercando di tenere a mente almeno le nozioni basilari, come il mio nome. La prima domanda arrivò come un temporale. A pormela era niente meno che il professor Edoardo Amaldi, un protagonista della fisica italiana del ventesimo secolo. Iniziò interrogandomi su argomenti facili a cui sapevo rispondere; poi, agitando la matita in aria mi chiese: «Fa caldo qui, vero?» Annuii, pensando che si fosse reso conto, non so come, che sotto il maglione avevo la camicia fradicia di sudore. «Quanti gradi ci saranno? 23, 24? Diciamo 25 per semplicità». Annuii di nuovo, stavolta più dubbioso. «Invece stamani, quando sono arrivato, in quest’aula ci saranno stati sì e no 18 gradi» continuò guardandomi con un sorriso che non mi convinceva affatto. «Bene, mi calcoli allora la variazione di entropia di questa stanza ».
Certo, conoscendo l’imprevedibilità dell’illustre professore, è possibile che questa storia sia successa realmente.
Spesso ci imbattiamo in questioni che, a prima vista, sembrano assurde. Non siamo abituati a collegare le nozioni teoriche con le applicazioni pratiche. Però, con semplici ragionamenti, è sempre possibile riuscire a fornire una risposta, applicando concetti di fisica elementare o un po’ di buon senso.
Ad esempio, si racconta che, nel corso di un altro esame di fisica, un professore chiedesse con insistenza a più di uno studente perché i termosifoni venissero generalmente collocati a un’altezza di circa venti centimetri dal pavimento. Le risposte furono le più varie, ma nessuna venne considerata valida. Alla fine uno studente più preparato degli altri, dopo aver fornito una serie di risposte corredate da calcoli complicatissimi sulla trasmissione del calore, sulle dispersioni termiche, sui moti piani e turbolenti, spazientito di fronte alle continue scrollate di capo del professore, pretese di conoscere la soluzione: a che cosa servivano quei maledetti venti centimetri di distanza dal pavimento? «Ma per infilarci la scopa e spazzare, no?» fu la beffarda risposta.
La termodinamica è la branca della fisica che ha per oggetto le trasformazioni di calore in lavoro e viceversa, ma qualche volta vi si fa rientrare tutto ciò che riguarda gli effetti del calore sulla materia.
La termodinamica riveste un’importanza fondamentale in ogni campo della scienza, della tecnica e della vita di ogni giorno. In ogni momento abbiamo a che fare con grandezze come la temperatura, la pressione e il volume (dette variabili termodinamiche) che condizionano le nostre azioni. Quando, ad esempio, decidiamo di usare una pentola a pressione o incidiamo le castagne prima di metterle al forno, stiamo applicando, anche se non ne siamo consapevoli, delle equazioni che legano tra loro le variabili termodinamiche. E quando mettiamo l’antigelo nel radiatore, stiamo sfruttando una legge termodinamica per abbassare il punto di congelamento dell’acqua.
È chiaro che possiamo sopravvivere anche senza alcuna cognizione di fisica, ma talvolta un minimo di approfondimento può rivelarsi utile, come nel caso di un subacqueo che decida di immergersi con un autorespiratore o in quello della melanzana assassina descritto in seguito.
In questo capitolo cercheremo di capire che cos’è la termodinamica attraverso una serie di esempi legati alla vita di ogni giorno. Definiremo il calore e descriveremo come si propaga, rispondendo anche ad alcune domande ricorrenti. Perché, ad esempio, la pasta si cuoce meglio al mare che in montagna? Come mai, se l’acqua gela a zero gradi, di notte si possono vedere delle pozzanghere ghiacciate anche quando la temperatura è sopra lo zero? E perché può succedere che una brocca di vetro cada da un tavolo e finisca in frantumi, mentre non succede mai che una brocca in frantumi sul pavimento risalga sul tavolo e ritorni integra?
Chi non ha mai sperimentato quella fastidiosa sensazione alle orecchie che si prova quando ci si immerge in mare anche a un solo metro di profondità, oppure durante le fasi di atterraggio o di decollo di un aeroplano? La soluzione è quella di «compensare» soffiando con il naso tappato e la bocca chiusa oppure deglutendo per immettere aria nella parte interna delle orecchie. Ma perché?
Quando carichiamo un accendino con il gas di una bomboletta, come mai vediamo formarsi del ghiaccio sulla superficie dell’accendino?
Questi due fenomeni, pur tanto diversi in apparenza, rappresentano entrambi dei processi termodinamici, e sono descritti da una stessa classe di equazioni: le equazioni di stato. Poiché stabiliscono precise relazioni tra la pressione, il volume e la temperatura di ogni sistema reale, definendone così lo stato termodinamico, queste equazioni sono alla base di moltissime applicazioni pratiche. È grazie a esse, ad esempio, che funzionano il frigorifero, il barometro e la pentola a pressione.
In particolare, le equazioni di stato rivestono un ruolo fondamentale nelle transizioni di fase, i passaggi della materia da uno stato all’altro, ovvero, come avrebbero detto gli alchimisti qualche secolo fa, le «trasmutazioni» dell’acqua in ghiaccio o di una pallina di naftalina in vapore contro le tarme.
Per capire meglio i meccanismi che regolano le transizioni di fase, consideriamo una sostanza che ci è molto familiare: l’acqua. In realtà tutte le sostanze – da un gas nobile come l’elio a un metallo come il mercurio – possono esistere in tre stati distinti, e cioè solido, liquido e aeriforme. Ma solo l’acqua si trova comunemente in natura in tutti e tre gli stati, e noi tutti sappiamo per esperienza che a temperatura ambiente l’acqua può evaporare (passare dallo stato liquido a quello aeriforme) e condensarsi (compiere la transizione inversa, da vapore a liquido), mentre quando la temperatura scende sotto lo zero si solidifica trasformandosi in ghiaccio.
Già da queste osservazioni elementari si deduce che la temperatura è un fattore fondamentale per le transizioni di fase della materia. Se ad esempio vogliamo far evaporare rapidamente l’acqua contenuta in una pentola, la mettiamo sul fuoco in modo da innalzare la sua temperatura. Per favorire il processo opposto dobbiamo invece abbassare la temperatura del vapore. E infatti, se appoggiamo un coperchio freddo sopra la nostra pentola piena d’acqua riscaldata dal fuoco, il vapore si condensa immediatamente sulla sua superficie: l’acqua ritorna allo stato liquido.
L’altra variabile termodinamica che incide sulle transizioni di fase è la pressione. In particolare, esiste un’equazione di stato importantissima che mette in relazione queste due variabili:
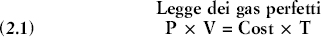
La legge afferma che il prodotto del volume e della pressione di un gas deve sempre essere proporzionale alla sua temperatura. Benché a rigore valga solo per un gas ideale – un gas composto da molecole puntiformi che non interagiscono in alcun modo tra loro – questa legge è anche molto utile per comprendere come i valori delle variabili termodinamiche determinino le transizioni di fase delle sostanze reali.
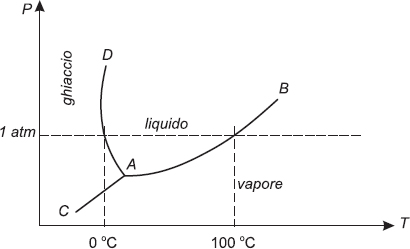
Fig. 2.1 Le transizioni di fase dell’acqua avvengono in corrispondenza di particolari coppie di valori della pressione e della temperatura.
Torniamo al caso dell’acqua e osserviamo il diagramma della figura 2.1. L’asse orizzontale rappresenta la temperatura e quello verticale la pressione. Le transizioni di fase hanno luogo in corrispondenza di particolari coppie di valori di pressione e temperatura, ovvero in corrispondenza di alcuni punti del diagramma. Alla temperatura di 100 °C e alla pressione di 1 atmosfera, ad esempio, l’acqua bolle, passando dallo stato liquido a quello di vapore. L’insieme di questi punti di transizione è una curva (quella sorta di grande ipsilon tracciata in neretto nella figura) che divide il diagramma in zone diverse, a ognuna delle quali corrisponde un diverso stato dell’acqua. A sinistra della linea che congiunge i punti C, A e D, l’acqua è allo stato solido; nell’area compresa tra i segmenti DA e AB è in quello liquido; mentre a destra di CA e AB è sotto forma di vapore. Ora consideriamo le transizioni di fase dell’acqua in condizioni di pressione atmosferica normale. Nel diagramma, la linea tratteggiata orizzontale rappresenta una pressione costante di 1 atmosfera (il valore « normale », appunto, che l’atmosfera terrestre esercita al livello del mare). Come si vede, a questa pressione l’acqua può esistere in tutti e tre gli stati: è ghiacciata al di sotto di 0 °C, liquida tra 0 e 100 °C, aeriforme sopra i 100 °C. Potreste obiettare che a pressione atmosferica l’acqua evapora anche sotto i 100 °C, come si osserva ad esempio quando si fa una doccia molto calda o quando ci si asciuga al tepore del sole dopo una nuotata. Avete ragione, ma in questi casi a evaporare sono solo le molecole d’acqua che si trovano in superficie, cioè a diretto contatto con l’aria. La transizione di fase avviene invece a 100 °C, quando l’intera massa d’acqua passa allo stato gassoso (come indicano le bolle di vapore che si formano al suo interno e salgono in superficie).
Adesso immaginiamo che la pressione atmosferica diminuisca. Il diagramma mostra che, in questo caso, la transizione di fase liquido-vapore avviene a temperature sempre più basse. Se potessimo arrivare a un duecentesimo della normale pressione atmosferica terrestre, pari a quella esistente sulla superficie di Marte, osserveremmo l’acqua sublimare, trasformarsi cioè direttamente da ghiaccio in vapore senza passare per la fase liquida. Sul diagramma, questa transizione ghiaccio-vapore avviene in corrispondenza di ogni punto del segmento CA (la gamba della ipsilon). Tuttavia, non c’è bisogno di andare fin su Marte per sperimentare alcune conseguenze pratiche della termodinamica dell’acqua. E sufficiente raggiungere la cucina…
Una volta un amico ci chiese: « Sapete che amo cucinare e che sono anche bravo. Voi che siete degli scienziati, spiegatemi un po’. Perché gli spaghetti alle vongole mi vengono meglio al mare che in montagna? »
Lo guardammo sorridendo: « Se ci avessi chiesto perché non ti venivano bene gli spaghetti ai funghi porcini forse ti avremmo potuto dare una risposta scientifica, ma così possiamo dartene solo una da gourmet».
Era una persona di spirito, perciò riformulò la domanda: «Perché, considerando il sugo una variante che non incide sul problema, gli spaghetti mi vengono meglio al mare? »
«Adesso la domanda è più chiara» rispondemmo. «Esiste un principio che mette in relazione volume, temperatura e pressione, o meglio, a meno di qualche costante che non ci interessa, afferma che la pressione è direttamente proporzionale alla temperatura, ragion per cui se diminuisce la pressione esterna diminuisce anche la temperatura di ebollizione dell’acqua».
« E quindi? »
« E quindi in montagna la pressione è più bassa che al mare e perciò l’acqua bolle a temperatura inferiore a 100 gradi. Per essere più precisi, a 3000 metri d’altitudine l’acqua bolle a circa 90 gradi. Ma la pasta è fatta per cuocersi a 100 gradi, mentre a temperature inferiori viene morbida fuori e cruda dentro ».
Una smorfia di disgusto gli si disegnò sulla bocca: «Volete dire… scotta?»
«E tu non fare l’ingordo. Aspetta che si raffreddi».
La smorfia divenne interrogativa. Poi dalla bocca del nostro amico uscì un’espressione piuttosto colorita.
«Va bene. Abbiamo capito. L’effetto è proprio quello della pasta scotta. Ma il peggio è che al centro resta cruda ».
«Allora come fanno i ristoranti?» insistette il nostro amico. «Ne conosco alcuni sulle Dolomiti che servono delle linguine funghi e tartufo eccezionali ».
«Elementare» rispondemmo all’unisono. «Non fanno altro che aumentare la pressione atmosferica con un piccolo stratagemma, e in questo modo aumentano anche la temperatura di ebollizione dell’acqua ». Lo anticipammo aggiungendo: « Per la tua casa in montagna, comprati una bella pentola a pressione! »
Ingredienti: 2 melanzane, 2 uova, la mollica di un panino, mezzo bicchiere di latte, pane grattato, sale e pepe quanto basta.
Mettete le melanzane in forno per farle appassire. Nel frattempo battete le uova che andranno poi incorporate con la mollica bagnata nel latte e la polpa delle melanzane. Dopo 15 minuti tirate fuori le melanzane dal forno e… Bum!
Questa è una storia vera, accadutaci durante la stesura del libro che state leggendo: una melanzana, della varietà lunga, appena toccata per essere tirata fuori dal forno è scoppiata, nel vero senso della parola. Filamenti bianchi a una temperatura di duecento gradi, proiettati ovunque. Anche sulle braccia e sulla faccia dello sfortunato cuoco, che è dovuto andare al pronto soccorso. L’esplosione si sarebbe potuta evitare ricordando la legge dei gas perfetti. Che cosa è successo alla melanzana?
Per prima cosa il forno era troppo caldo, così che la pelle dell’ortaggio killer si è biscottata diventando dura. Poi il calore è passato all’interno, facendo aumentare la temperatura. Ricordando che la pressione P moltiplicata per il volume V è proporzionale alla temperatura T, se il volume resta costante e aumenta la temperatura, deve necessariamente aumentare la pressione! A quel punto è stato sufficiente toccare la melanzana per rompere un delicato equilibrio e provocare un’esplosione.
Morale: prima di far appassire in forno le melanzane, ricordatevi di bucarne la superficie con una forchetta. In tal modo il gas interno troverà una via di fuga e il pericolo sarà scongiurato.
Bucare una melanzana o incidere una castagna equivale a costruire una valvola di sicurezza analoga a quella in dotazione alle pentole a pressione e alle caldaie.
L’atmosfera, lo sappiamo, è la massa d’aria che circonda la Terra, e l’aria è un fluido gassoso. Questa massa fluida esercita dunque una pressione su tutto ciò che vi è immerso, proprio come l’acqua del mare esercita una pressione sul nostro corpo quando ci immergiamo. In generale, la pressione atmosferica è massima al livello del mare e decresce con l’altitudine (è per questo che, come abbiamo visto, in montagna la temperatura di ebollizione dell’acqua diminuisce). Fu lo scienziato italiano Evangelista Torricelli a intuire, già nel Seicento, che l’atmosfera esercita una pressione e a escogitare un sistema per stimarne il valore. Nel barometro di Torricelli si stabilisce un equilibrio tra la pressione dell’aria a quella di una colonna di mercurio sotto vuoto, così che l’altezza della colonna di mercurio offre una misura della pressione esercitata dall’atmosfera. Per convenzione, si è stabilito che, a una temperatura di 0 °C, la pressione atmosferica « normale » al livello del mare è uguale a quella esercitata da una colonna di mercurio alta 760 millimetri. Tuttavia l’atmosfera è un sistema dinamico, e di conseguenza la sua pressione locale varia di continuo.
Da un punto di vista pratico, le variazioni della pressione atmosferica sono utili per le previsioni meteorologiche. Una sua diminuzione comporta in genere un peggioramento delle condizioni del tempo. Un suo aumento, al contrario, indica una tendenza al bel tempo.
Le previsioni del tempo richiedono l’utilizzo di sofisticati modelli matematici basati sui dati provenienti da una fittissima rete di rilevatori. Tuttavia è possibile costruirsi in casa un semplicissimo barometro che permetterà di avere un’indicazione approssimativa dell’evoluzione meteorologica. Tutto ciò che serve sono due bottiglie di plastica vuote e un po’ di tempo per tarare lo strumento.
Come tutti i barometri meccanici, infatti, anche il nostro ha bisogno di essere tarato. Per far questo aspettiamo una normale giornata di tempo sereno, schiacciamo leggermente la prima bottiglia (dovremo ridurre di un 20 per cento il suo volume) e la tappiamo fermamente. Questa sarà la bottiglia del brutto tempo. L’altra bottiglia, quella del bel tempo, andrà semplicemente chiusa così com’è.
Ed ecco come funziona lo strumento. Nel caso di un peggioramento delle condizioni meteorologiche, la pressione esterna scenderà fino ad avvicinarsi a quella della bottiglia del brutto tempo, che riprenderà così la sua forma originale. Nel caso di un miglioramento, la pressione esterna aumenterà e la bottiglia del bel tempo verrà schiacciata.
Il barometro a bottiglie è chiaramente uno strumento rozzo, ma è sufficiente per evidenziare il nesso tra pressione atmosferica e condizioni meteorologiche, a patto che si adottino alcuni semplici accorgimenti. Innanzitutto è necessario assicurarsi che il tempo sia bello al momento della taratura. Poi bisogna controllare che non ci siano sbalzi di temperatura significativi durante il periodo delle misurazioni. Infine, lo strumento deve essere tarato piuttosto spesso. Va in ogni caso ricordato che il nostro barometro registra solo le variazioni della pressione atmosferica e non il suo valore assoluto.
Molti degli oggetti che utilizziamo nella vita quotidiana sono il risultato della sperimentazione, della ricerca e dell’applicazione di principi fisici. Del resto, all’inizio di questo capitolo abbiamo affermato che in ogni momento della giornata abbiamo a che fare con i fenomeni descritti dalla termodinamica. Proviamo a guardarci intorno per verificare se le cose stanno proprio così. Mentre ci pensiamo, perché non berci una bella bibita fresca? Apriamo il frigorifero e…
Il frigorifero è una macchina che ha lo scopo di mantenere costantemente a bassa temperatura gli alimenti. Dal punto di vista termodinamico, ciò si ottiene mediante una trasformazione ciclica che trasferisce il calore dall’interno all’esterno dell’ambiente isolato in cui sono conservati gli alimenti. Il lavoro necessario per questo trasferimento di calore è fornito da un motore che entra in funzione non appena la temperatura all’interno del frigorifero supera i 4 o 5 gradi centigradi.
Per comprendere i processi termodinamici che producono il trasferimento di calore, vediamo molto schematicamente come funziona il frigorifero.
Le componenti fondamentali di un frigorifero (figura 2.2) sono l’ambiente chiuso che deve essere raffreddato, un sottile tubo a serpentina in cui circola un particolare gas, una valvola di espansione e un motore che aziona il pistone di un compressore.
Fig. 2.2 Il ciclo termodinamico del frigorifero.
Muovendosi dentro un cilindro, il pistone comprime il gas e lo riscalda. Dal compressore il gas caldo passa nel condensatore, il tratto di serpentina posto all’esterno del frigorifero, dove cede calore all’ambiente raffreddandosi fino a liquefarsi. Poi, il gas liquefatto viene raffreddato ulteriormente grazie alla valvola di espansione che ne riduce la pressione. A questo punto il gas liquefatto ed estremamente freddo entra nell’evaporatore, cioè nel tratto di serpentina che sta dentro il frigorifero, assorbe calore e ritorna allo stato aeriforme. Infine il gas viene compresso di nuovo e il ciclo riprende dall’inizio.
A ogni ciclo il gas subisce dunque due cambiamenti di stato (da vapore a liquido e viceversa). Sono queste continue transizioni di fase che consentono di prelevare il calore dall’interno del frigorifero e di riversarlo all’esterno. Per quanto abbiamo visto nel paragrafo 2.3, infatti, quando nella serpentina all’interno del frigorifero la sostanza passa dallo stato liquido a quello aeriforme, deve assorbire calore (proprio come l’acqua nella pentola prende il calore dal fuoco per passare allo stato di vapore), e questo calore lo sottrae agli alimenti che, di conseguenza, si raffreddano. Tutto il calore prelevato all’interno del frigorifero viene poi ceduto all’esterno mediante il condensatore. Ecco perché d’estate non conviene tenere aperto il frigo per rinfrescarsi.
La sostanza che circola nella serpentina deve essere tale da richiedere, anche a temperatura ordinaria, pressioni relativamente basse per passare dallo stato aeriforme a quello liquido. Per questo motivo si usano dei gas che liquefano a 20 °C se compressi a 5,6 atmosfere. In passato si usava il freon, poi messo al bando, perché dannoso per l’ambiente.
Nella descrizione del frigorifero abbiamo parlato di trasferimento di calore dal suo interno al suo esterno. In apparenza questa frase non necessita di tante spiegazioni: capiamo al volo che cosa significa. D’altra parte, nella vita quotidiana ricorriamo di continuo al concetto di calore senza doverci preoccupare di definirlo in maniera rigorosa. Sappiamo, ad esempio, che il calore è la causa prima delle sensazioni di caldo e freddo che si manifesta quando ci esponiamo alla luce del sole, quando portiamo a ebollizione l’acqua del tè o quando abbiamo la febbre. Sappiamo che se tocchiamo, anche nella stagione fredda, i copertoni di un’automobile che si è appena fermata dopo una corsa, percepiamo come calore il risultato dell’attrito della gomma sull’asfalto. Sappiamo che, quando li facciamo funzionare, i nostri elettrodomestici sviluppano calore per via delle correnti elettriche che attraversano i loro circuiti. Sappiamo anche che il calore può alterare le dimensioni dei corpi solidi, facendoli dilatare o contrarre, e ne determina lo stato di aggregazione.
Ma che cos’è realmente il calore? È solo una definizione astratta, matematica, oppure è qualcosa di concreto, che possiamo – come dire — toccare?
L’esperienza ci dice che quando un oggetto più caldo viene messo a contatto con uno più freddo, ha luogo una trasformazione spontanea che porta a uno stato di equilibrio termico, uno stato nel quale le temperature dei due corpi assumono lo stesso valore. E questo il motivo per cui mettiamo dei cubetti di ghiaccio nel bicchiere di whisky caldo: nel processo che conduce all’equilibrio termico il liquore si raffredda e il ghiaccio si riscalda!
Per spiegare questo fenomeno, gli scienziati del diciottesimo secolo supposero l’esistenza di una sostanza, presente in maggior quantità nel corpo più caldo, che passasse in quello più freddo. Questa ipotetica sostanza, battezzata calorico, era insomma un fluido capace di muoversi attraverso la materia. La termodinamica, al contrario, identifica il calore non come una sostanza materiale ma come un’energia, o, per essere più precisi, come un trasferimento di energia, come un’energia che fluisce. Una tipica definizione del concetto di calore che si può trovare in un testo di fisica è la seguente: dicesi calore l’energia che un corpo cede o riceve a causa di una differenza di temperatura con altri corpi. D’accordo, direte, tutto molto chiaro, ma energia di che tipo?
Per capirlo, pensiamo a quello che succede quando tocchiamo con la mano un oggetto caldo. La sensazione che proviamo – e che esprimiamo dicendo che quell’oggetto è, per l’appunto, caldo – è provocata dal passaggio di una certa quantità d’energia dall’oggetto alle nostre dita. È come se quest’energia fosse una proprietà intrinseca della materia, qualcosa di vivo nascosto al suo interno. E in effetti la termodinamica ci dice che questa forma di energia, chiamata energia interna, è dovuta ai moti di agitazione delle particelle microscopiche che compongono la materia. La temperatura di un corpo è la manifestazione palese di questa energia « nascosta »: se aumenta, vuol dire che l’energia interna del corpo è aumentata, se diminuisce, vuol dire che la sua energia interna è diminuita.
Qualche tempo fa apparve su un giornale la notizia della scoperta di un nuovo pianeta all’estrema periferia del nostro sistema solare. Questo decimo pianeta – riferiva con enfasi il giornale – si trova così lontano dal Sole che la sua temperatura è di —500 °C! L’articolo fece scalpore, non tanto per la notizia della scoperta (che si rivelò falsa), ma per l’incredibile refuso sulla temperatura del presunto pianeta. Nell’intero universo, infatti, una temperatura così bassa non può né potrà mai esistere. Vediamo perché.
Quando in termodinamica si parla di temperatura, solitamente si fa riferimento alla temperatura assoluta, che si esprime in gradi kelvin anziché in celsius. La scala kelvin parte da un valore minimo al di sotto del quale non è possibile scendere: lo zero assoluto, equivalente a –273,16 °C. Lo zero assoluto rappresenta un limite di temperatura invalicabile, il freddo più freddo che si possa concepire.
Ma per quale ragione non è possibile raffreddare un corpo, ad esempio, a —500 °C? Il motivo è banale. La capacità di riscaldarsi o di raffreddarsi è una caratteristica dei corpi cui la temperatura è legata al grado di agitazione delle molecole di cui sono fatti. Quando riscaldiamo l’acqua, ad esempio, aumentiamo l’agitazione delle sue molecole, ovvero la sua temperatura. Il raffreddamento è il processo opposto: una riduzione dell’agitazione molecolare. Ora, non può esistere qualcosa di più fermo di una molecola ferma? E le molecole si fermano appunto allo zero assoluto!
Il legame che esiste tra agitazione molecolare, temperatura e calore trova un’applicazione pratica nel forno a microonde. Narra la leggenda che questo elettrodomestico sia stato inventato per caso in America, quando qualcuno notò che nelle basi militari, in prossimità di potenti radar, il terreno era ricoperto di uccelli morti. Ma la cosa davvero strana era il fatto che quei poveri uccelli sembravano cotti. Alcuni si posero delle domande, altri diedero delle risposte e a qualcuno venne in mente che, anziché costituire un problema, quel metodo di cottura rapida di volatili poteva trasformarsi in un ottimo business. Fu così che nacque il forno a microonde.
All’interno di un forno a microonde non ci sono resistenze elettriche, né fuoco né piastre radianti. C’è solo un piccolo trasmettitore di onde elettromagnetiche (vedi il capitolo 6). Queste onde oscillano con una frequenza che fa vibrare le molecole d’acqua contenute negli alimenti, così come le onde sonore emesse da un diapason fanno vibrare la corda di una chitarra. Ma abbiamo visto che l’agitazione delle molecole di una sostanza – la sua energia interna – si manifesta come un aumento della temperatura. Perciò, grazie alle vibrazioni che le onde elettromagnetiche inducono nelle molecole d’acqua, il cibo messo nel forno a microonde si scalda e cuoce. I vantaggi sono tanti ed evidenti: la cottura è molto rapida (tanto più rapida quanto maggiore è l’acqua contenuta in un alimento), i piatti rimangono relativamente freddi (dato che non contengono acqua), è possibile usare contenitori che in un forno normale brucerebbero (quelli di plastica, ad esempio) e così via. L’unico inconveniente è di tipo organolettico: i cibi cotti nel forno a microonde sembrano tutti lessi. Per questo, nei modelli più recenti, al trasmettitore di onde elettromagnetiche è stata abbinata una resistenza elettrica che permette di ottenere quella crosticina croccante che rende il pollo più gustoso. Cucinare un buon roastbeef all’inglese nel forno a microonde, invece, è proprio impossibile, dato che le parti più interne cuoceranno sempre quanto quelle esterne. Ma, per verdure e pesci, le microonde offrono risultati migliori rispetto alla classica cottura al vapore.
Adesso che abbiamo acquisito un po’ di dimestichezza con il concetto di calore, possiamo provare a darne una definizione più pratica, operativa. Tanto per cominciare, come si misura il calore? Siccome è un’energia, è ovvio che lo si misurerà in unità di energia. E, infatti, i fisici esprimono spesso le quantità di calore in joule, proprio come esprimono i valori di energia o di lavoro. D’altronde la caloria, l’unità di misura del calore che vi è probabilmente più familiare, può essere tradotta in joule semplicemente moltiplicandola per un fattore di conversione: 1 caloria = 4,18 joule.
L’equivalenza di fondo tra energia, calore e lavoro ci offre l’opportunità di definire il calore in termini concreti e quantitativi come il lavoro che occorre svolgere per innalzare di un certo valore la temperatura di una certa massa d’acqua. Notate che questa definizione è in accordo con il fatto che, in generale, quando un corpo riceve calore la sua temperatura aumenta. Ci sono delle importanti eccezioni a questa regola, dei processi in cui il calore fornito a un sistema non produce un aumento di temperatura. Ma ne parleremo in seguito.
Ora dobbiamo parlare invece di una caratteristica importante del calore che non abbiamo ancora considerato: le diverse modalità con cui esso può passare da un corpo all’altro. Appoggiare una mano sul cofano di un’auto lucida e nera in un’assolata giornata d’agosto, ne converrete, è molto differente dallo stare seduti davanti a un caminetto acceso d’inverno. A parte il fatto che, nel secondo caso, proviamo una sensazione piacevole mentre, nel primo, c’è da dubitare della nostra furbizia, ciò che distingue questi due passaggi di calore dall’ambiente al nostro corpo è proprio il diverso processo di trasmissione coinvolto.
Per capire meglio queste differenze, nei prossimi paragrafi illustreremo con degli esempi pratici i tre possibili meccanismi di propagazione del calore, che sono:
Se qualcuno di voi ha una casa in montagna dove va saltuariamente, avrà sicuramente notato che d’inverno, per i primi giorni, fa sempre un freddo bestiale. Appena arriviamo ci affrettiamo ad accendere il camino. La combustione della legna produce energia calorica che si diffonde nell’ambiente circostante. E finché restiamo vicino al camino, riceviamo il calore direttamente dal fuoco.
Ma questo calore, per quanto intenso, non è sufficiente a riscaldare tutta la casa! Lontano dal camino continua a fare un gran freddo. Per fortuna c’è anche un impianto di riscaldamento. Lo accendiamo e, dopo qualche ora, constatiamo con piacere che l’aria delle stanze è calda. (Dopo un giorno, è ragionevole ritenere che l’aria della casa sia di circa 18 °C anche se fuori la temperatura è intorno alla zero).
Di notte, però, tutte le parti del corpo che lasciamo fuori dalle coperte si gelano in pochi minuti. Perché? Eppure il termometro segna ben 18 °C, le imposte sono chiuse e non ci sono spifferi. Che cosa abbiamo dimenticato?
Proviamo a toccare le pareti: sono gelide! Quindi? Quindi, in accordo con le leggi della termodinamica, quello che avviene è un passaggio di calore dal corpo più caldo (noi) a quello più freddo (le pareti della casa). I muri interni si comportano come «una stufa al contrario»: anziché cedere calore, lo assorbono. In questo caso, infatti, si parla di emissione di frigorie. La vera stufa, il corpo che per mantenersi a una temperatura costante di 36 gradi deve produrre di continuo il calore ceduto alle pareti fredde, siamo noi. Questo scambio diretto di calore tra corpi separati si chiama irraggiamento.
Possiamo osservare un altro esempio di perdita di calore per irraggiamento durante certe limpide notti invernali, quando le pozzanghere nelle strade sono tutte gelate benché la temperatura sia al di sopra dello zero. In questo caso è il cielo notturno a comportarsi come un enorme corpo freddo che assorbe energia termica dal suolo. Perciò, anche se il termometro della nostra auto segna una temperatura esterna di 4 o 5 gradi sopra lo zero, di notte conviene guidare con grande prudenza, perché la strada potrebbe essere comunque ghiacciata. È questo il motivo per cui le automobili di ultima generazione sono dotate di un dispositivo che avvisa del pericolo di ghiaccio che scatta a 4 gradi.
Riassumendo, l’irraggiamento è un processo mediante il quale il calore fluisce da un corpo a temperatura maggiore a uno a temperatura minore quando i corpi non sono a contatto (anche se tra essi c’è il vuoto dello spazio, come nel caso del Sole e della Terra). Questa trasmissione di calore a distanza avviene tramite l’emissione di onde elettromagnetiche, perlopiù nella regione dell’infrarosso (vedi il capitolo 6).
Esempi di corpi che irradiano costantemente calore sono il Sole, le stufe elettriche e qualsiasi piastra radiante. Anche noi, come abbiamo visto, irradiamo calore, e ciò significa che emettiamo raggi infrarossi. James Bond sfrutta questo fatto per intercettare le spie nemiche che di notte si nascondono in un bosco. Il suo speciale binocolo che consente una visione notturna, infatti, altro non è che un rivelatore di calore, uno strumento ottico che gli consente di vedere quella luce invisibile all’occhio nudo che è la radiazione infrarossa. Nel binocolo di Bond, la silhouette delle sfortunate spie nemiche risalta rispetto a quelle degli alberi e del terreno perché i loro corpi irradiano una quantità di calore molto maggiore.
Poiché l’irraggiamento è un’emissione di calore, un corpo irradiante tende sempre a raffreddarsi, a meno che non possegga una fonte d’energia interna in grado di compensare le perdite. Il nostro corpo, ad esempio, compensa il calore che cede alle pareti fredde della casa in montagna grazie all’energia prodotta dal metabolismo e in tal modo riesce a mantenere una temperatura costante. L’asfalto della strada, al contrario, non ha fonti di energia interna e perciò, quando di notte irradia il calore solare che ha accumulato durante il giorno, può raffreddarsi fino a ghiacciare.
Esiste però un metodo semplice ed efficace per ridurre in maniera drastica il raffreddamento provocato dall’irraggiamento senza dover spendere energia. Su questo principio si basa la coltivazione in serra. Ecco come.
La radiazione solare scalda l’aria e il terreno racchiusi dentro la serra (una struttura di ferro e vetro) fino a che la temperatura al suo interno non diviene maggiore di quella all’esterno. Ma, come sappiamo, il calore fluisce sempre da un corpo a temperatura maggiore a uno a temperatura inferiore. I corpi dentro la serra, dunque, dovrebbero restituire il calore che hanno accumulato verso l’esterno, e la serra dovrebbe raffreddarsi rapidamente.
Ed è proprio quello che succederebbe se il vetro non fosse opaco all’infrarosso. Non potendo sfuggire dalla serra sotto forma di radiazione infrarossa, il calore accumulato resta intrappolato al suo interno.
Ovviamente, se il sistema fosse ideale si potrebbero piantare ananas e mango anche in Groenlandia. In realtà, benché la maggior parte della radiazione « calda » rimbalzi sul vetro e resti intrappolata all’interno della serra, una certa quantità riesce a passare all’esterno. Bisogna poi considerare le perdite dovute alle altre forme di trasmissione del calore e quelle causate dalla necessità che ci sia un ricambio d’aria all’interno della serra (altrimenti le piante da dove prenderebbero ossigeno e anidride carbonica?). Per questo anche le serre, seppur lentamente, alla fine si raffreddano.
Ogni secondo il Sole invia sulla Terra un’energia pari a circa cento milioni di miliardi di joule, qualche miliardo di volte superiore a quella prodotta dalla più grande centrale che l’uomo abbia ideato. Nel capitolo 7, dedicato all’astronomia, parleremo più a lungo dei meccanismi che rendono il Sole una fonte di energia praticamente inesauribile.
Tutta questa energia che colpisce la Terra può essere sfruttata per costruire molte cose interessanti, come un forno (abbastanza intuitivo, direte) oppure un frigorifero (questo non ve lo aspettavate, eh?).
Ma se sulla Terra arriva tutta questa radiazione solare, allora perché in montagna fa più freddo che al mare? Viene da pensare che semmai dovrebbe fare più caldo, dato che in montagna siamo più vicini al Sole.
Questo è un classico esempio di come una domanda basata su considerazioni apparentemente logiche possa portare a conclusioni assurde. Facciamo un po’ di conti e qualche deduzione. Iniziamo elencando i motivi per cui è naturale che faccia caldo al mare:
Adesso analizziamo l’argomento che ci sembrava più convincente: in montagna siamo più vicini al Sole. Vediamo di quanto. La nostra montagna è alta, diciamo, 3000 metri. D’altra parte il Sole dista dalla Terra circa 150 milioni di chilometri. Perciò il rapporto è, grossomodo, 1/50 milioni! È come se fossimo a 5 metri da una stufa e ci spostassimo in avanti di un decimillesimo di millimetro. Certamente troppo poco per sperare di ricevere una quantità molto maggiore di calore.
E ora veniamo, come promesso, al frigorifero solare. Occorrente: una bella giornata estiva calda e ventosa, una spiaggia assolata, un asciugamano da mare, un po’ di nozioni di fisica e un’anguria succosa. Procedimento: si inzuppa l’asciugamano di acqua di mare, ci si avvolge l’anguria e… si mette il tutto al sole. Se avremo la precauzione di tenere sempre ben bagnato l’asciugamano, dopo un paio d’ore la temperatura dell’anguria si sarà abbassata notevolmente. Come è possibile?
Il calore del Sole e della spiaggia fa evaporare l’acqua. Evaporando, l’acqua sottrae calore al sistema asciugamano-anguria, che così si raffredda. Analizziamo quello che succede a livello microscopico. Le molecole dell’acqua più calda si muovono più velocemente, e questa maggior velocità permette loro di vincere le forze di coesione che le tengono unite alle altre (in una parola, evaporano). Ma se le molecole più veloci dell’acqua di cui è imbevuto l’asciugamano se ne vanno, a restare sono le molecole più lente, e ciò significa che l’energia interna del sistema acquaasciugamano-anguria diminuisce. Di conseguenza, diminuisce la sua temperatura.
Un fenomeno analogo si verifica quando sudiamo: il sudore che evapora sottrae calore alla pelle producendo una piacevole sensazione di fresco. E se acceleriamo il processo d’evaporazione facendoci aria con un ventaglio, la sensazione di fresco aumenta.
E il forno solare? È la serra, naturalmente. Se poi vi riesce difficile associare a un forno il tepore delle strutture in vetro in cui si coltivano frutta e ortaggi, pensate a un’automobile lasciata al sole d’estate. L’insopportabile calore che si accumula al suo interno è prodotto esattamente dallo stesso fenomeno. Non potete negare che in questi casi la vostra auto si riveli un forno piuttosto efficiente.
Esiste però un’altra serra, molto più grande e importante, che rischia di trasformarsi in un forno, con conseguenze catastrofiche per tutti noi: il pianeta in cui viviamo.
La comprensione dei meccanismi di propagazione del calore e delle trasformazioni che avvengono in un sistema a seguito degli scambi termici tra le parti che lo compongono ci aiuta a capire un fenomeno con cui, volenti o nolenti, siamo costretti a fare i conti: l’effetto serra dell’atmosfera.
Una parte dell’energia radiante proveniente dal Sole (un po’ meno del 50 per cento) viene assorbita dalla Terra, che diventa a sua volta una sorgente di calore: emette sotto forma di radiazione infrarossa il calore solare che ha assorbito. Se di sera avvicinate la mano a una roccia che sia stata illuminata dal sole fino al tramonto, avvertirete una sensazione di calore, come se la roccia fosse una stufa a bassa temperatura. È l’effetto della radiazione infrarossa emessa dal suolo terrestre.
Il calore di cui la Terra vuole liberarsi trova però un ostacolo: l’atmosfera. Questa, che avvolge il nostro pianeta come un mantello protettivo, agisce infatti in modo simile ai vetri di una serra. Lascia penetrare l’energia proveniente dal Sole ma impedisce a una parte del calore assorbito dalla Terra di disperdersi all’esterno, nello spazio. Responsabili di questo effetto sono alcuni dei gas che la compongono. Le molecole dell’anidride carbonica, del vapore acqueo e di altri gas atmosferici, infatti, si mettono a vibrare quando sono colpite da radiazioni termiche e, in tal modo, trattengono il calore.
In tutto questo non c’è niente di intrinsecamente dannoso. Al contrario, è proprio grazie a un moderato effetto serra atmosferico che la temperatura globale del pianeta si mantiene sufficientemente elevata e costante per permettere alla vita di prosperare. Pensate ai terrificanti sbalzi di temperatura tra il giorno e la notte che avvengono sulla Luna che, come noto, è priva di atmosfera. Oltretutto, il principale responsabile dell’effetto serra, l’anidride carbonica, è fondamentale per i cicli della vita. È il gas che emettiamo con la respirazione e che le piante assorbono e utilizzano per svilupparsi, emettendo a loro volta gran parte dell’ossigeno che noi respiriamo. Il carbonio e l’ossigeno, gli atomi che costituiscono la molecola di anidride carbonica (la cui formula chimica è CO2), sono entrambi elementi indispensabili alla vita. Tutte le molecole organiche contengono carbonio, e la combustione dovuta all’ossigeno fornisce l’energia necessaria ai processi metabolici.
Ma allora dov’è il problema? Perché gli scienziati lanciano grida d’allarme sempre più assordanti sul riscaldamento globale del pianeta causato dall’effetto serra? Ormai perfino i più scettici tra loro si stanno convincendo che nei prossimi cento anni la Terra subirà un incremento della propria temperatura globale, un incremento che si stima compreso tra 2 e 5 gradi centigradi.
Il fatto è che esiste un delicato equilibrio tra le concentrazioni relative dei gas che compongono l’atmosfera, un equilibrio che si è stabilito nel corso di miliardi di anni di evoluzione geologica e biologica del nostro pianeta. E ora sembra che questo equilibrio si stia spezzando: negli ultimi due secoli la quantità di anidride carbonica presente nell’atmosfera è aumentata in maniera costante, ed è proprio a questo aumento che la maggioranza degli scienziati imputa il riscaldamento globale del nostro pianeta. Più anidride carbonica significa infatti un maggior effetto serra e dunque una minore capacità della Terra di disperdere il calore assorbito. Su questo non ci sono più dubbi (semmai gli scienziati discutono su quanto questo fenomeno incida effettivamente sull’aumento della temperatura globale). Ma da dove viene questo surplus di anidride carbonica nell’atmosfera?
Ebbene, da un paio di secoli noi uomini usiamo macchine che – sfruttando i principi della termodinamica (trasformando cioè il calore in lavoro) – permettono di azionare veicoli, di produrre energia elettrica e di fare tante altre cose che ci affrancano dalla fatica muscolare e rendono la nostra vita molto più confortevole. Il guaio è che per far funzionare quasi tutte queste macchine bruciamo carbone, petrolio e idrocarburi gassosi come il metano, materiali costituiti da molecole organiche che non partecipano ai cicli della vita. Bruciando, questi combustibili fossili producono anidride carbonica che va ad aggiungersi a quella già presente nell’atmosfera. In sostanza, stiamo rimettendo in circolo grandi quantità di carbonio che era rimasto sepolto nel suolo per centinaia di milioni di anni e, in questo modo, stiamo spezzando il naturale equilibrio atmosferico, dotando così la Terra di una coperta troppo pesante.
Se non avessimo solo il nostro pianeta da sfruttare, non ci sarebbero problemi. Esaurito il petrolio, inquinati il mare, il suolo e l’aria, alcuni milioni di umani, gli eletti, sciamerebbero come cavallette spaziali verso altri mondi puri e intatti per ricominciare il cammino dello sviluppo e del progresso. Ma la Terra è destinata a rimanere la nostra casa per molto tempo ancora.
La Terra è un sistema chiuso, anche se molto grande, e noi che ne facciamo parte abbiamo l’obbligo di preoccuparci del suo stato di salute, di misurarle la febbre di tanto in tanto. Sembra ormai assodato che da circa duecento anni il nostro pianeta si stia riscaldando più di quanto i fenomeni naturali non possano spiegare. E purtroppo questo aumento della temperatura avrà effetti ben poco piacevoli.
Se il pianeta continuerà a riscaldarsi, gli oceani seguiranno la stessa sorte, ed è prevedibile che i cicloni aumenteranno di numero e di violenza. I modelli climatici prevedono tra l’altro un riscaldamento accentuato ai poli, il che provocherà probabilmente un progressivo scioglimento delle calotte polari e il conseguente innalzamento del livello dei mari. Nel secolo scorso il loro livello si è alzato in media di 20 centimetri. In questo potrebbe salire di altri 40 centimetri.
Catastrofismo? Forse. In fondo, non tutto il male viene per nuocere: in futuro potremmo vedere i vecchietti danesi che, seduti in canottiera fuori della porta, sorseggiano un buon vinello locale suonando il mandolino. Certo è che gli effetti globali sul clima a cui cominciamo ad assistere sono molto meno rassicuranti.
Soluzioni? Se non ne troveremo, dobbiamo sperare che siano loro a trovare noi.
Ritorniamo all’esempio della casa in montagna e proviamo a fare qualche facile conto per capire un po’ meglio i processi termodinamici del riscaldamento domestico.
Abbiamo detto che, dopo aver fatto funzionare l’impianto di riscaldamento per un giorno, la temperatura dell’aria all’interno della casa si era stabilizzata a 18 °C (per dare un senso a questi valori di temperatura, diciamo che in un ambiente a 18 °C si sta bene con un maglione leggero). Siccome siamo in contatto con quest’aria a 18 °C, le cediamo una parte del nostro calore corporeo per conduzione. Ma abbiamo anche notato, con un brivido di freddo, che tra noi e le pareti avviene uno scambio di calore a distanza per irraggiamento.
Riassumiamo. L’aria della stanza è relativamente calda e scambia calore con noi per conduzione; le pareti sono decisamente più fredde (diciamo che hanno una temperatura di 5 gradi) e scambiano calore con noi per irraggiamento. Se il calore che perdiamo è proporzionale alla differenza di temperatura tra il nostro corpo e ciò che ci circonda, è evidente che l’aria ci sottrae meno calore di quanto non facciano le pareti. Considerando che la nostra temperatura è di circa 36 gradi, risulta infatti 36 – 18 = 18 nel primo caso e 36 – 5 = 31 nel secondo: irraggiamento batte conduzione 31 a 18. Ma questo basta per spiegare il naso e le orecchie letteralmente gelate che ci ritroviamo svegliandoci al mattino? No che non basta! Il fatto è che mentre la perdita di calore dovuta a conduzione è effettivamente proporzionale alla differenza di temperatura, quella dovuta a irraggiamento è proporzionale alla quarta potenza della differenza di temperatura. Ciò significa che se nel primo caso la perdita è proporzionale a 18, nel secondo è proporzionale a circa 900.000 (ovvero 314). Ecco perché sentivamo freddo! La soluzione? Se non ci entusiasma l’idea di dormire con un berretto di lana in testa come facevano i nostri nonni, non ci resta che portare all’equilibrio termico tutta la casa, comprese le pareti. (Di solito bastano tre giorni con il riscaldamento sempre acceso per far raggiungere anche alle pareti una temperatura di 18 gradi).
A differenza dell’irraggiamento, la conduzione trasmette calore da un corpo all’altro solo se i due corpi sono a contatto e avviene anche all’interno di un unico corpo solido. Se, ad esempio, riscaldiamo l’estremità di una sbarra di ferro, il calore si propagherà in tutto il suo volume fino a quando la temperatura non sarà la stessa ovunque. Il caso di conduzione che stiamo per analizzare, tuttavia, ci servirà a illustrare uno di quei processi termodinamici in cui un corpo, pur ricevendo calore, rimane a temperatura costante.
Rischiamo di sembrare monotoni, ce ne rendiamo conto, ma anche questa volta ricorreremo alla solita pentola piena d’acqua.
Se appoggiamo la pentola a una piastra elettrica accesa, il calore passerà per conduzione dalla piastra alle pareti d’acciaio della pentola e da questa all’acqua che le è più vicina, per poi diffondersi all’intera massa d’acqua.
Immaginiamo che la piastra si mantenga a una temperatura costante di 300 °C e vediamo nel dettaglio che cosa succede.
Dato che la pentola riceve un flusso costante di calore, e considerando che oltretutto il metallo di cui è fatta è un ottimo conduttore, potremmo pensare che essa arriverà rapidamente all’equilibrio termico con la piastra raggiungendo una temperatura di 300 °C. Ma non abbiamo fatto i conti con l’acqua.
Innanzitutto la pentola dovrà cederle una parte del calore che riceve dalla piastra. Poi, quando l’acqua comincerà a bollire, la temperatura del sistema smetterà di aumentare: rimarrà a 100 °C fino a quando tutta l’acqua non sarà evaporata. Solo allora la pentola potrà diventare rovente e bruciare in santa pace (vi sarà successo almeno una volta, non dite di no!).
Per quale motivo la temperatura dell’acqua che bolle (e dunque anche della pentola che la contiene) non sale oltre i 100 °C? Perché tutta l’energia che il sistema riceve dalla piastra è spesa per far bollire l’acqua, cioè per spezzare i legami che ne tengono insieme le molecole e produrre così la transizione dallo stato liquido a quello aeriforme.
Questa pausa nell’incremento della temperatura si verifica quando una qualsiasi sostanza passa dallo stato liquido a quello aeriforme (o da solido a liquido, o da solido ad aeriforme, come avviene nel caso del ghiaccio secco). Per compiere la transizione di fase, l’acqua che bolle (o il ghiaccio che si scioglie, o il freon del frigorifero che da liquido diventa gas) deve assorbire calore dall’ambiente circostante. Ma questo calore, invece di tradursi in un aumento della temperatura, serve a produrre la transizione di fase.
Chi distilla grappa conosce bene il fenomeno. La temperatura all’interno dell’alambicco sale e poi si ferma, risale e si riferma e così via. «Buttare la testa e la coda» della grappa significa lasciar evaporare tutte le sostanze che bollono a una temperatura inferiore a quella a cui bolle l’alcol etilico (cioè gli alcoli inferiori come il metanolo) per poi prendere il « cuore » della grappa (l’etanolo) e infine buttare tutto ciò che bolle a temperature ancora più elevate (gli alcoli superiori). Questo è possibile perché, fintanto che nel composto è presente, ad esempio, l’alcol metilico (il metanolo tossico), questa sostanza si prenderà tutto il calore per evaporare, e la temperatura all’interno dell’alambicco rimarrà costante.
Per inciso, al livello del mare l’alcol metilico bolle a 65 °C e l’alcol etilico a 78 °C.
La convezione, il terzo tipo di propagazione del calore, riguarda solo i fluidi ed è sostanzialmente un trasporto d’energia per mezzo di movimenti di materia. Per comprendere questo fenomeno bisogna tener presente che una massa fluida, quando si riscalda, diventa meno densa e quindi più leggera e, di conseguenza, tende a salire. Una massa fluida che si raffredda, al contrario, si appesantisce e tende a precipitare verso il basso.
Un esempio di convezione che abbiamo continuamente sotto gli occhi è offerto dalla solita pentola d’acqua riscaldata sul fuoco. L’acqua che si trova più in basso riceve direttamente il calore dal fondo rovente della pendola, si scalda e sale verso la superficie. Ma salendo si mescola con l’acqua meno calda che incontra, si raffredda, si appesantisce e ridiscende verso il fondo. Questa circolazione contribuisce a distribuire il calore in tutto il volume dell’acqua, più velocemente di quanto non avverrebbe attraverso la sola conduzione.
Un modo semplice per osservare l’effetto della convezione in un liquido è bersi un buon tè al latte. Se versiamo qualche goccia di latte freddo in una tazza di tè bollente, vedremo il latte precipitare verso il fondo, poi risalire, precipitare di nuovo e continuare a muoversi su e giù finché non si sarà mescolato completamente all’infuso di acqua e tè.
Chissà quante volte vi sarà successo. Mentre aspettate con impazienza che l’acqua bolla per buttare gli spaghetti, qualcuno, fissando la pentola con aria scettica, pronuncia la storica frase:
« Ma ce l’avete messo il sale? »
E chissà quante volte vi siete fermati con il coperchio in una mano e il sale nell’altra a pensare ad alta voce: « È meglio mettere il sale nell’acqua quando bolle o prima, quando è ancora fredda? »
«Be’, se lo metti prima ci vuole un po’ più di tempo per farla bollire per via dell’innalzamento ebullioscopico» potrebbe rispondere il sapientone di turno.
«Vero» aggiungerebbe forse qualcun altro, «ma come mai questo fenomeno non si nota quando l’acqua è calda? Anzi, guardate che succede se metto il sale ora ». E buttando una manciata di sale nella pentola, si provoca immediatamente un’ebollizione furiosa. Roba da far passare l’appetito!
Tuttavia, non c’è bisogno che trascorriate il resto della serata a gettare manciate di sale nell’acqua prendendo appunti e misurando temperature per intuire quello che succede. Alla base di tutto ci sono le leggi della termodinamica, è vero, ma si può arrivare a delle conclusioni ragionevoli anche usando il buon senso, che è più pratico e soprattutto non vi costringe a rinunciare a un bel piatto di spaghetti salati al punto giusto.
È evidente che quando aggiungiamo del sale all’acqua la temperatura di ebollizione aumenterà in ogni caso, dato che ci vorrà del calore in più per farlo sciogliere. Non c’è alcuna differenza se questo calore aggiuntivo lo consideriamo prima o dopo (mettendo il sale nell’acqua fredda oppure in quella che sta per bollire). Perché, allora, se buttiamo il sale nell’acqua molto calda questa entra immediatamente in ebollizione? Perché abbiamo rotto un equilibrio! L’acqua era ormai sul punto di bollire, ma indugiava in uno stato di precario equilibrio. Sarebbe stato sufficiente perturbare questo equilibrio in un qualsiasi altro modo – dando un colpo alla pentola o immergerci una paletta di legno, ad esempio – per dare comunque inizio all’ebollizione.
La situazione è simile a quella di un bicchiere colmo d’acqua che sta per traboccare, ma non si decide a farlo perché lo strato superficiale del liquido è tenuto insieme da delicatissimi equilibri molecolari; perciò l’acqua non trabocca finché non interviene un fattore esterno, anche piccolissimo.
Quando si parla di convezione e si devono fare degli esempi, in tutti i testi di fisica – tanto nei complicati manuali universitari quanto nei libri divulgativi – compaiono immancabilmente pentole sul fuoco o bacinelle piene d’acqua. E siccome delle pentole sul fuoco non ne possiamo proprio più, il prossimo esempio ha per protagonista una tinozza d’acqua fredda.
Una sera, a cena, un amico fisico ci raccontò la storia seguente.
Come sapete ho una casa in montagna, in un paesino sperduto tra Lazio e Abruzzo, di quelli dove sono più le mucche che i cristiani e dove spesso fa un gran freddo. Vi sto parlando di un episodio che risale alle vacanze natalizie di una quarantina d’anni fa. Ricordo che era una serata freddissima, con un cielo terso che non nascondeva neanche una stella. Fausto, un nostro vicino, si era da poco comprato una Fiat Seicento e, come ogni sera, l’aveva posteggiata nella stalla. Prima di chiudere la porta con il pesante lucchetto, però, era andato alla fonte e aveva riempito un’enorme tinozza d’acqua.
« Che fa? » chiesi a mio padre. Ma lui per risposta scrollò le spalle: ne sapeva quanto me. Rifeci la domanda a Fausto che stava sistemando la tinozza vicino alla sua auto nuova: « Che fai con quell’acqua? »
Lui non aveva studiato fisica, ma utilizzava la natura come se fosse un laboratorio, e i suoi testi scientifici erano i racconti degli anziani.
« Questa sera gela: hai visto il cielo? » mi rispose facendo un cenno col capo verso l’alto. «Così impedisco alla macchina di gelarsi, se no si rompe il radiatore». Guardai mio padre e lui guardò me sporgendo il labbro inferiore. Perciò non chiesi altro.
Fu solo molti anni dopo che capii il senso del comportamento di Fausto: per evitare che il gelo rovinasse la sua Seicento nuova di zecca, sfruttava in modo inconsapevole il «calore latente di solidificazione» dell’acqua nella tinozza.
Il calore latente è il calore che si libera o viene assorbito durante le transizioni di fase di una sostanza. Abbiamo già visto, ad esempio, che quando l’acqua evapora assorbe calore. Quando si solidifica, al contrario, l’acqua cede una parte della propria energia termica all’ambiente circostante. Ed è proprio questo che succede se d’inverno mettiamo una tinozza d’acqua in una stalla fredda. Gelando, l’acqua cede calore all’aria che si trova vicino alla sua superficie. Dopodiché questo calore si diffonde in tutta la stalla per convezione. E come dire che, ghiacciando, la massa d’acqua contenuta nella tinozza sottrae freddo alla stalla. Entro certi limiti, la tinozza si comporta come una piccola stufa.
Forse qualcuno di voi ricorderà di aver visto, quand’era piccolo, la nonna mettere delle tinozze d’acqua nella cantina in cui si riponeva la verdura quando non c’erano ancora i frigoriferi. Lo scopo era lo stesso: far gelare l’acqua per impedire che si gelassero le verdure.
Adesso che sappiamo un po’ meglio cos’è il calore e come si propaga, possiamo capire perché i beduini indossano dei caffettani di lana bianca quando viaggiano sotto il sole cocente del deserto; o perché nei paesi con climi rigidi si usa mettere i doppi vetri alle finestre.
Durante il giorno, nel deserto, la temperatura può salire oltre i 50 gradi. L’aria è bollente e il sole picchia duro. Perfino i dromedari danno segni d’insofferenza. Che cosa può fare un povero beduino per ripararsi un po’ dal caldo? È chiaro: coprirsi da capo a piedi con un bel caffettano bianco di lana pesante! Idea da brivido, vero? Pensiamoci un attimo. Che tipo di vestito indosseremmo per una transahariana? Apriremmo l’armadio e cercheremmo un vestito bianco, poiché sappiamo bene che, al contrario del nero, il bianco non assorbe la radiazione ma tende anzi a rifletterla. A questo punto saremmo indecisi tra un fresco completo di lino con panama e… una tunica di lana pesante. Senza esitazione dovremo scegliere quest’ultima, dato che i 36 gradi del nostro corpo sono certamente meglio dei 50 gradi del deserto. La lana è infatti un ottimo isolante termico, che impedisce al caldo esterno di raggiungere il nostro corpo e lo mantiene a temperatura costante.
Parlando di serre abbiamo detto che il vetro è sì opaco all’infrarosso, ma non del tutto. Ecco perché, per preservare il calore di un ambiente, due vetri sono meglio di uno. Una parte della radiazione che riesce a oltrepassare la prima barriera di vetro viene fermata dal secondo. Facendo dei calcoli rapidi e grossolani possiamo dire che, se il primo vetro lascia passare il 30% della radiazione termica totale, il secondo bloccherà un ulteriore 70% della radiazione residua. Il vantaggio è evidente. La figura 2.3 illustra schematicamente questo fenomeno nel caso in cui esista una differenza di temperatura tra esterno e interno e la radiazione che vuole lasciare la stanza sia pari a 100.
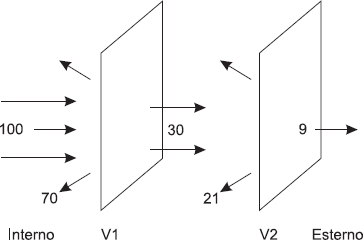
Fig. 2.3 La fisica dei doppi vetri
I materiali come il vetro, la lana e il polistirolo sono detti isolanti termici proprio perché hanno la proprietà di non lasciar fluire il calore.
Un processo termodinamico che ha luogo senza che ci siano scambi di calore con l’ambiente viene detto adiabatico. Per realizzare processi di questo tipo si utilizzano dei recipienti isolanti che, con poca fantasia, vengono chiamati a loro volta adiabatici. Un ben noto recipiente adiabatico è il thermos.
Un thermos è costituito da due pareti di vetro argentato all’interno delle quali è stato realizzato il vuoto. L’idea, semplicemente geniale, è quella di mettere in pratica tutto quello che abbiamo visto finora sulla trasmissione del calore: poiché il calore si propaga per conduzione, convezione e irraggiamento, per realizzare un recipiente adiabatico perfetto è sufficiente costruire un oggetto che inibisca tutte e tre le modalità di trasmissione.
Perciò il thermos è fatto di vetro, che è un pessimo conduttore di calore. Inoltre, la mancanza di aria nell’intercapedine tra le due pareti del thermos impedisce al calore di propagarsi per conduzione e convezione. Infine, le sue pareti sono argentate per riflettere la radiazione ed evitare che il calore si propaghi per irraggiamento. Fisica e buonsenso!
In questo capitolo abbiamo imparato che esiste una corrispondenza tra calore, lavoro ed energia. In effetti questa correlazione non compare solo nei testi di fisica. Se siamo stanchi, ad esempio, diciamo che non abbiamo energia per fare un certo lavoro. E sappiamo bene che quando compiamo un’attività fisica il nostro corpo produce calore.
Naturalmente il combustibile che bruciamo per procurarci l’energia necessaria a vivere ci viene dal cibo. Ecco perché sulla scatola dei nostri biscotti preferiti c’è scritto che a uno solo di questi corrisponde un valore energetico di 55 kilocalorie (1 kilocaloria significa 1000 calorie), pari a 230 kilojoule. Duecentotrentamila joule d’energia in un biscotto! Detto così, sembrerebbe che ingurgitiamo con il cibo una quantità spropositata di energia. L’esempio che segue mostra che il nostro organismo è una macchina a basso consumo. Semmai è il prezzo del combustibile a essere davvero molto alto.
Un uomo di costituzione media che non svolga attività fisica pesante ha bisogno di circa 2300 kilocalorie al giorno. Supponiamo che il nostro uomo medio sia un po’ sovrappeso e che per questioni di linea decida di limitare la propria alimentazione giornaliera a una normale colazione al mattino, un panino a pranzo e un pasto completo a cena. Possiamo allora riportare in una tabella l’apporto calorico della sua ipotetica dieta (da non seguire assolutamente!).
Tiriamo le somme: abbiamo un apporto energetico totale di poco superiore a 1500 kcal per una spesa complessiva di circa 7 euro. E un prezzo equo? Proviamo a confrontarlo con quello che paghiamo per l’energia elettrica.
Sulla bolletta della luce, la quantità di energia elettrica che abbiamo consumato in due mesi è segnata in kilowattora (kWh). Quest’unità di misura corrisponde all’energia consumata in un’ora da un elettrodomestico che assorbe un kilowatt di potenza. (In fisica, potenza significa energia spesa o prodotta nell’unità di tempo; un watt di potenza corrisponde a un joule di energia al secondo e un kilowatt, ovvero 1000 watt, equivale quindi a mille joule al secondo). Per farci un’idea, in un’ora una lampadina da 100 watt di potenza consuma un decimo di kilowattora, mentre un ferro da stiro da 2000 watt consuma 2 kilowattora.
Tabella 2.1
| Alimento | kcal | Costo in euro |
| Colazione: latte e biscotti | 300 | 0.5 |
| Pranzo: panino al prosciutto | 350 | 1.5 |
| Cena: 100g di pasta col pomodoro | 230 | 0.3 |
| 200g di bistecca | 270 | 2.5 |
| 1 bicchiere di vino rosso | 110 | 0.5 |
| 1 panino | 150 | 0.3 |
| 1 piatto di insalata | 150 | 0.3 |
| 1 mela | 15 | 0.5 |
| caffè con un cucchiaino di zucchero | 20 | 0.5 |
Ma poiché 1 kWh = 860 kcal (è un calcolo che potete fare voi stessi ricordando che una caloria equivale a 4,18 joule e che in un’ora ci sono 3600 secondi), ne segue che al nostro uomo medio leggermente sovrappeso bastano 1,6 kWh d’energia al giorno per vivere.
Insomma, se non ci piacesse tanto mangiare la pasta seduti a tavola e fossimo dei robot, infilando due dita nella presa di corrente e stando attaccati meno di due ore risolveremmo la giornata spendendo meno di mezzo euro. Roba da far impallidire più di un ristoratore!
Il fisico tedesco Rudolf Clausius (1822-1888), uno dei fondatori della termodinamica, scoprì l’esistenza di una grandezza S direttamente proporzionale alla variazione di calore di un sistema e inversamente proporzionale alla sua temperatura:

Questa grandezza, che Clausius battezzò entropia, misura quanto un sistema si trovi vicino all’equilibrio termodinamico, cioè a una distribuzione uniforme della temperatura al suo interno.
Dalla definizione di entropia discende un fatto molto interessante, che ha conseguenze importantissime: in un sistema termicamente isolato (che cioè non ha scambi di calore con l’ambiente circostante) l’entropia non può mai diminuire. O aumenta oppure rimane invariata. Ciò significa che, una volta raggiunto l’equilibrio termico, un sistema isolato non può più subire altre trasformazioni. Senza un intervento esterno, senza un apporto di energia, il sistema rimarrà inerte.
Il concetto di entropia fu introdotto, soprattutto per ragioni pratiche, come strumento per calcolare il rendimento delle macchine termiche. Ma i tentativi di interpretare quale fosse il suo significato fisico, reale, hanno portato scienziati e filosofi ben oltre il ristretto ambito del rendimento di motori a scoppio e caldaie a vapore. Purtroppo, le difficoltà concettuali di questi argomenti (e quello di entropia è forse uno dei concetti più complessi di tutta la fisica classica) non ci permettono di approfondirli in questa sede. Tuttavia, se teniamo presente il fatto fondamentale che un qualsiasi sistema fisico che non riceva energia dall’esterno tende spontaneamente a portarsi all’equilibrio termodinamico, possiamo capire come l’entropia serva a spiegare molte cose. In particolare:
Secondo quella che è forse la più significativa delle interpretazioni, l’entropia misura il grado di disordine di un sistema. In base a questa interpretazione, dire che in un sistema isolato l’entropia tende sempre ad aumentare equivale a dire che le trasformazioni termodinamiche spontanee avvengono in una direzione privilegiata tale per cui, al trascorrere del tempo, i sistemi coinvolti passano da uno stato organizzato a uno stato di disordine. E questa direzione privilegiata che definisce la freccia del tempo.
Se, ad esempio, lasciamo aperta un’ampolla di profumo, dopo qualche tempo noteremo che il profumo è tutto evaporato. Troveremo molecole profumate sparse ovunque nella stanza: il sistema ha raggiunto lo stato di massimo disordine, la sua entropia è aumentata spontaneamente. Che cosa dovrebbe succedere, invece, affinché il disordine diminuisca senza interventi esterni? Le molecole di profumo dovrebbero ritornare nell’ampolla di loro spontanea volontà: l’entropia del sistema dovrebbe diminuire. L’esperienza ci conferma che un evento di questo genere non si verifica praticamente mai.
Un altro esempio che permette di apprezzare lo stretto legame che esiste tra disordine ed entropia è quello di una biblioteca. Una biblioteca in cui i volumi siano perfettamente classificati e disposti in scaffali opportunamente identificati è un sistema ordinato e pertanto fruibile senza fatica. A questo sistema si associa dunque uno stato di bassa entropia. Ora immaginiamo che la cavalleria di Gengis Khan irrompa nella biblioteca senza tanta voglia di leggere ma con l’intento di passare una nottata di riposo prima della grande battaglia. È probabile che quando le moltitudini urlanti lasceranno il tempio del sapere ci troveremo di fronte a un sistema molto disordinato, ad altissima entropia. E per riportarlo al precedente stato d’ordine non c’è dubbio che dovremo spendere una gran quantità d’energia.
Anche una casa che rimane disabitata per un certo periodo è un buono strumento per valutare gli effetti dell’aumento spontaneo dell’entropia. L’opera del tempo è inequivocabile: lasciati a se stessi, con il passare degli anni gli oggetti e le cose tendono a degradarsi e a rompersi, non certo ad aggiustarsi. Quando si metterà di nuovo piede nella casa, trovare un rubinetto che si è guastato sarà molto più probabile che trovare un rubinetto guasto che si è aggiustato da solo.
In poche parole, viviamo all’interno di un flusso temporale in cui, prima o poi, si manifestano gli effetti di uno spontaneo aumento dell’entropia, ovvero del disordine. La freccia del tempo punta inesorabilmente in un’unica direzione, quella che dall’ordine conduce al caos.