16.Kapitel
Eine medizinische Revolution:
Die Vermessung des biologischen Lebensalters
Ein Traum, ein Traum ist unser Leben
Auf Erden hier.
Wie Schatten auf den Wogen schweben
Und schwinden wir,
Und messen unsre trägen Tritte
Nach Raum und Zeit:
Und sind (und wissen’s nicht) in Mitte
Der Ewigkeit.
Johann Gottfried von Herder (1744 - 1803), deutscher Kulturphilosoph,
Theologe, Ästhetiker, Dichter und Übersetzer [150]
Die Epigenetik ist ein relativ junges Fachgebiet der medizinischen Forschung, obwohl der Begriff bereits 1942 vom britischen Entwicklungsbiologen Conrad Hal Weddington [151] erstmals verwendet wurde.
Während sich die Genetik mit der Vererbung der Struktur der Erbinformationen in Organismen beschäftigt, die vor allem in der DNA gespeichert sind, liegt der Schwerpunkt der Epigenetik darin, die Ausprägung dieser Erbinformation und deren Anwendung (man spricht hier von „Expression“) zu untersuchen und zu verstehen.
Um es in einem Vergleich zu beschreiben: Ein Buch wie dieses hier könnte man mit der DNA vergleichen, denn darin sind alle Informationen enthalten, die dieses Buch ausmachen und den Titel „Verjüngung!“ begründen, so wie eine DNA einem Organismus den Titel „Mensch“ geben kann. (Genau deshalb können Wissenschaftler ja auch inzwischen ermitteln, mit welchem Organismus sie es zu tun haben, wenn sie eine zunächst unbekannte DNA analysiert haben.)
Die Epigenetik legt nun fest, welches Kapitel des Buches gerade gelesen wird, und in welcher Situation dies geschieht, also welche Information des Buches gerade relevant ist. In der DNA legt die Epigenetik somit fest, welche Bereiche der DNA gerade „ausgelesen“ werden und somit Anwendung finden, also welches „Programm“ in der Zelle gerade abgerufen und damit aktiviert wird.
Hier sind die Grenzen des Vergleichs allerdings erreicht, denn im Körper laufen Millionen und Milliarden von genetischen Auslesevorgängen gleichzeitig ab, an jeweils unterschiedlichen Stellen und zu jeweils unterschiedlichen Einsatzzwecken.
Das ist auch deshalb möglich (und nötig), weil die einzelne DNA einer menschlichen Zelle ein Informationsvolumen hat, das einer Datei mit einer Größe von rund 750MB entspricht [152]. Ein Buch mit 300 Seiten hat dagegen ein Informationsgehalt von ca. 600KB (ca. 2KB pro Seite).
Eine menschliche DNA könnte also 1.250 Bücher speichern – wir tragen in jeder unserer 75 Billionen Zellen eine Bibliothek an Informationen in uns herum, die jeweils 1.250 Büchern entspricht – insgesamt also eine Informationsmenge, die unvorstellbaren rund 100 Billiarden (!) Büchern entspräche.
Obwohl das unvorstellbar viel ist, finde ich es erstaunlich, dass es der Natur gelungen ist, so etwas Komplexes wie den menschlichen Körper mit all seinen individuellen Besonderheiten in einer Informationsmenge von „nur“ 750MB unterzubringen. Das ist weniger als das Datenvolumen eines durchschnittlichen Spielfilms, wenn er gestreamt wird. Eine unglaubliche Effizienz der Evolution!
Apropos Evolution: Das ist es, was man der DNA und der Genetik zuschreibt, nämlich durch Mutation und Selektion die Entwicklung der Arten zu ermöglichen (Charles Darwin sei Dank – ich erspare mir hier ein Quellenzitat, das sollte hinlänglich bekannt sein).
Daher war es lange Zeit schwer verständlich und erklärbar, warum eineiige Zwillinge sich so unterschiedlich entwickeln können. Nach der Geburt und Kindheit sind sie sich sehr ähnlich, doch im Laufe des Lebens können sie sich sehr unterschiedlich verändern. Der eine Zwilling wird vielleicht übergewichtig, der andere nicht. Der eine bekommt Diabetes, der andere Zwilling nicht.
Erst zu Beginn unseres Jahrtausends haben die Forscher erkannt, dass dies auf die Epigenetik zurückzuführen ist. Je nach Lebensweise werden unterschiedliche Programme bzw. DNA-Stellen aktiviert, und dies kann – und das ist ein spannender Punkt – ebenfalls vererbt werden!
Denn im Gegensatz zur traditionellen Annahme, dass Übergewicht halt durch zu viel Nahrungsaufnahme und Bewegungsmangel ausgelöst wird, gibt es epigenetische Faktoren, die dies bewirken oder verstärken können.
Diese Faktoren sind zum Beispiel sogenannte „Methylierungen“. Da dieser Begriff wichtig ist und häufig vorkommt, wenn es um die Epigenetik und das Verständnis geht, wie die epigenetische Altersbestimmung funktioniert, möchte ich den Begriff hier trotz „Fachchinesisch“ erklären. Und ich verspreche Ihnen: Es ist halb so wild.
Also: Eine „Methylgruppe“ nennt man ein Molekül aus einem Kohlenstoffatom (C) in der Mitte, an das passend 3 Wasserstoffatome (H) angedockt haben. Die Summenformel ist CH3. Es gibt noch eine vierte Andockstelle, aber mit der dockt diese Methylgruppe eben gerade an der DNA an.
Wie dann eine Methylgruppe in der Strukturformel aussieht zeigt die folgende Abbildung.
Methylierungen sind also Anlagerungen von Methylgruppen an der DNA. Sie bestimmen mit, ob und welche Information in der DNA von einem Enzym (es heißt „RNA-Polymerase“) gelesen und angewendet (der Vorgang heißt „transkribiert“) wird. Das bedeutet: Durch diese Veränderungen kann dieselbe DNA unterschiedliche körperliche Prozesse bewirken.
Im Ergebnis entwickelt der betreffende Mensch andere Eigenschaften aus als sein genetischer Zwilling, der andere Methylierungen hat.
Dieser kleine Exkurs war notwendig, um zu verstehen, warum diese Veränderungen bzw. epigenetischen Faktoren nun vererbt werden können:
Erst im Jahre 2003 wurde in einer Studie von Robert A. Waterland and Randy L. Jirtle in der Duke University (USA) festgestellt, dass Mäuse ihre epigenetischen Veränderungen teilweise an ihre Nachkommen weitergeben [153].
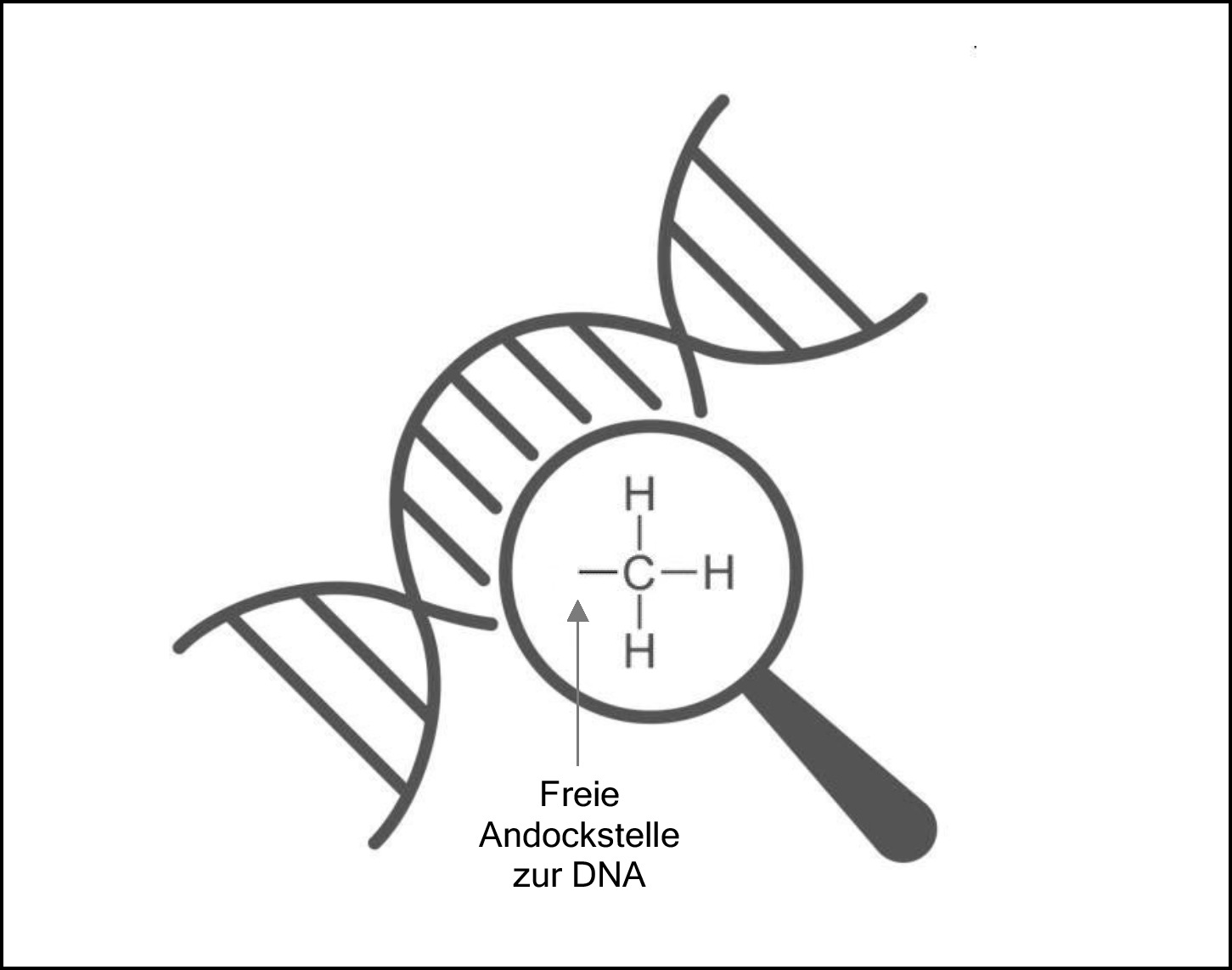
Abbildung 26: Eine Methylgruppe in der Strukturformel (innerhalb der Lupe). Wenn sie an der DNA „andockt“ (außerhalb der Lupe symbolisiert), wird die betreffende Stelle „methyliert“. Das beeinflusst dann die Art und Weise, wie die DNA an dieser Stelle abgelesen werden kann.
Dazu wurden 2 Gruppen von Mäusen gebildet, die unterschiedliche Nahrung bekommen hatten mit dem Ziel, epigenetische Veränderungen auszulösen. Die Nachkommen dieser beiden Gruppen haben sich dann systematisch unterschieden.
Damit war bewiesen: Auch epigenetische und eben nicht nur genetische Veränderungen sind (teilweise) erblich!
Das bedeutet im Folgeschluss eine ziemlich drastische Konsequenz auch für uns Menschen. Es heißt nämlich: Unsere epigenetischen Veränderungen als Eltern können sich auf unsere Kinder auswirken.
Oder – wie es die Studie formuliert [153]: „These findings suggest that dietary supplementation, long presumed tobe purely beneficial, may have unintended deleterious influences on the establishment of epigenetic gene regulation in humans.” (dt. „Diese Erkenntnisse suggerieren, dass Nahrungsergänzungsmittel, die lange Zeit als ausschließlich förderlich für die Gesundheit angesehen wurden, auch unerwünschte, schädliche Einflüsse auf die Schaffung epigenetischer Regulation beim Menschen haben kann. ”) Damit ist klar: Es gilt, epigenetische Schäden genauso wie genetische Schäden zu vermeiden.
Nicht nur vermeiden wir damit Krankheiten, die durch Genmutationen entstehen können (wie viele Krebsarten), sondern auch solche, die auf unerwünschte epigenetische Veränderungen zurückgehen, z.B. eine stark erhöhte Methylierung.
Einerseits sind diese Methylierungen zwar individuell, doch sie sind andererseits auch nicht völlig beliebig. Natürlich bedeuten die Aminosäuresequenzen in der DNA-Doppelhelix etwas, und danach richtet sich auch, was wann und wie methyliert wird. Außerdem haben Wissenschaftler herausgefunden – und darunter führend Prof. Dr. Steve Horvath von der Stanford University in Kalifornien/USA – dass die Methylierungen insgesamt mit dem Alter zunehmen [154].
Ich finde den Vergleich mit einer Baumrinde sehr gut: Bei jungen Bäumen ist sie flach und dünn, und bei alten Bäumen ist sie zerfurcht, bemoost und gezeichnet vom langen Leben des Baums. An manchen Stellen gibt es sogar Einkerbungen, die an bestimmte Ereignisse erinnern, z.B. einen Sturm oder einen verliebten Studenten, der mit seiner Angebeteten hier ein Liebesdenkmal schnitzen wollte.
Die Furchen und Kerben auf der Rinde des Baums kann man gut sehen, und man könnte sie auch messen: Wie viele Kerben gibt es, wie tief sind die Furchen, und wo gibt es größere Bereiche ohne Kerben und tiefe Furchen (das sind die bereits erwähnten CpG-Inseln)? (Siehe dazu auch die folgende Abbildung.)
Nach diesem Prinzip funktioniert auch die epigenetische Altersbestimmung. Denn es ist inzwischen bekannt, dass das Alter einen starken Einfluss auf diese Methylierungen hat. Je älter man ist, desto mehr Methylierungen hat die DNA. Da man diese Methylierungen messen und nachzählen kann, eignen sie sich für eine epigenetische Altersbestimmung. Gemessen wird aber nicht jede einzelne Methylierung. Das würde viel zu lange dauern – es gäbe Millionen in jeder DNA – und wäre vermutlich auch mit den besten Analysegeräten unmöglich.

Abbildung 27: Kupferstich eines alten und jungen Baums, geschaffen von der KI „DALL-E2“ (oberes Bild). Die Rinden der beiden Bäume unterscheiden sich stark, und man könnte mit einem kleinen Ausschnitt der Rinden (unteres Bild) leicht auf das Alter der Bäume schließen – eine Metapher auf das Verfahren der epigenetischen Altersbestimmung, das auf Basis der Methylierung der DNA basiert. Die DNA entspricht dabei der Baumrinde, die Methylierung entspricht den Furchen oder der Bemoosung der Rinde. Grafik der KI „DALL-E“ von OpenAI, © Ingmar P. Brunken 2024.
Allerdings haben die Wissenschaftler herausgefunden, dass es größere Bereiche auf jeder DNA gibt, die besonders wenige dieser Methylierungen enthalten, und die auch eine besondere Bedeutung für das Ablesen haben. Diese Inseln sind die bereits genannten „ CpG-Inseln“.
Diese CpG-Inseln kann man nun zählen. Sie sind alterstypisch, und man muss natürlich immer passende Abschnitte der DNA miteinander vergleichen, zwischen….ja zwischen was eigentlich?
Genau: Zwischen anderen Menschen.
Es muss also eine Vergleichsgruppe geben!
Das ist wichtig und interessant, weil die Qualität der Ergebnisse davon abhängt, wie gut diese Vergleichsgruppe statistisch gesehen ist: Sind die Menschen darin typisch repräsentativ? Und müssen sie überhaupt repräsentativ sein, oder ist ein Vergleich mit möglichst ähnlichen Gleichaltrigen besser, also gleiches Geschlecht, ähnliches Gewicht etc.?
Wie viele Probanden sind es denn überhaupt?
Mehrere hundert müssten es schon sein, besser mehrere tausend.
Es ist also gar nicht so einfach, eine passende Vergleichsgruppe mit ausreichend vielen Probanden zu finden. Und bei allen müssen die CpG-Inseln bekannt sein, um sie vergleichen zu können!
Während die Vergleichsgruppe, mit der Prof. Horvath arbeitete, 2‘536 Probanden [154] umfasste, sind es bei einem deutschen Anbieter, der Firma MoleQlar, 753 Probanden. Man sieht also an diesen Zahlen, dass die Altersmessung nach Prof. Horvath deutlich zuverlässiger sein dürfte.
Ich hoffe, ich konnte verständlich machen, warum es nicht nur auf den Test selbst ankommt, sondern auch auf die Daten, mit denen das Ergebnis verglichen wird. Nur wenn beides sehr gut ist, wird das Ergebnis brauchbar sein.
Wenn ich jetzt meine Messung mit denen anderer Menschen aus der Vergleichsgruppe vergleiche, kann ich sagen: Meine CpG-Inseln entsprechen den im Durchschnitt z.B. 54 Jahre alten Männern, obwohl ich chronologisch 57 Jahre alt bin. Dann wäre ich also epigenetisch (oder biologisch) 3 Jahre jünger als mein chronologisches Alter.
Und wenn ich bei einer Messung 54 biologische Jahre alt bin und bei einer weiteren Messung nach 12 Monaten 52 biologische Jahre alt bin, dann bin ich chronologisch 1 Jahr älter geworden, aber biologisch um 2 Jahre jünger geworden.
So wird die Verjüngung gemessen.
Und das Tollste ist: Genau das gibt es!
Und zum Schluss dieses Kapitels kommen wir noch einmal kurz auf die CpG-Inseln zurück. (Sie haben sich bestimmt schon gefragt, warum ich das vorne so ausführlich erläutert habe. Hier kommt die Antwort!)
Das Genom hat nämlich auch sehr, sehr viele CpG-Inseln – beim Menschen ungefähr 20‘000 [155]. Dies sind mehr, als aktuelle Verfahren vergleichen können. Der Analyst ist also darauf angewiesen, aus einer begrenzten Anzahl gemessener CpG-Inseln und deren Vergleich auf das epigenetische Alter zu schließen. Und es nützt auch nichts, einfach mehr Geld zu investieren und mehr CpG-Inseln zu messen, wenn man dieselben Messungen nicht auch bei der gesamten Vergleichsgruppe durchgeführt hat.
Das ist in etwa so, als wenn man das Alter eines Baumes messen oder angeben müsste, aber nur einen kleinen Ausschnitt der Rinde sehen würde (siehe noch einmal Abbildung 27). Das ist bis zu einem gewissen Grad möglich – aber viel hilft viel. Je mehr CpG-Inseln ich messen und vergleichen kann, desto besser und genauer wird das Ergebnis sein.
Mein Selbsttest wird zeigen, ob die vergleichsweise einfachen, kommerziellen Tests dem Anspruch einer recht genauen Altersmessung entsprechen werden.
Aber Sie wissen nun, wie sie funktionieren und wo die Schwachpunkte liegen können.
