10.1 Einleitung
„Also, ich habe den gesamten Bahnbegriff ja eigentlich weggelegt in Sachen Atomphysik. Diese Funktion, die man da hat, ist lediglich die Aufenthaltswahrscheinlichkeit für ein Elektron. Aber man kann nicht sagen, dass es sich auf einer Bahn bewegt. Es lässt sich eigentlich – die Bewegung lässt sich überhaupt kaum irgendwie erklären. Eine Bahn ist das halt nicht mehr.
Das wird ja verrückt, das Ganze. Verdammt, dann könnte es sich theoretisch auch bewegen dazwischen. Nur dass es sich im seltsamen Zickzack bewegt, aber das wäre ja im Grunde genommen wieder irgendsowas wie eine Bahn. Und das ist ja auch wieder verrückt. Also da muss ich passen irgendwie.“1
Diese Schüleräußerung bringt viele der beim Lernen der Quantenphysik auftretenden Schwierigkeiten auf den Punkt. Haben Elektronen einen Ort? Bewegen sie sich auf einer Bahn? Wenn das nicht der Fall ist: Wie lässt sich darüber sprechen, wie sie von einem Ort zum anderen kommen? Das Lernen der Quantenphysik besteht zu großen Teilen im Erlernen von Sprechweisen, die auf die Phänomene und Modelle der Quantenphysik „passen“ (wie z. B. das statistische Ensemble als Basis der Wahrscheinlichkeitsinterpretation oder die damit verknüpften Begriffe Präparation und Messung). Ähnlich wie man sich in der Mechanik (Kap. 4) von irreführenden Sprach- und Denkmustern bewusst lösen muss (z. B. „Trägheit muss überwunden werden.“), ist es in der Quantenphysik erforderlich, sich mit den klassischen Präkonzepten auseinanderzusetzen, um Sprach- und Denkmuster zu entwickeln, die den quantenmechanischen Phänomenen angemessen sind.
Damit hängt zusammen, dass in der Quantenphysik ein reflektierter Umgang mit Modellen unumgänglich ist (Abschn. 13.4). Man spricht nicht über die Realität selbst, sondern man spricht über Modelle der Realität. Die ersten beiden Sätze des Zitats zeigen, dass der Schüler gelernt hat, auf metakognitiver Ebene (Abschn. 2.5) über seine Vorstellungen zu reflektieren. Im zweiten Absatz versucht er, diese abstrakten Vorstellungen auf seine Alltagserfahrungen mit klassischen Objekten rückzubeziehen und scheitert daran, beides in Einklang zu bringen. Er erfährt die Diskrepanz als kognitive Zumutung. Das ist eine allgemeine Erfahrung: Jeder Lernende gerät in der Auseinandersetzung mit der Quantenphysik zwangsläufig an einen Punkt, wo die bisherigen Denkmodelle nicht mehr tauglich sind. Niels Bohr bringt dies in dem prägnanten Satz zum Ausdruck: „Denn wenn man nicht zunächst über die Quantentheorie entsetzt ist, kann man sie doch unmöglich verstanden haben.“2
10.2 Vorstellungen zum Aufbau von Atomen
10.2.1 Planetenmodell des Atoms
„Das sind Kreise … um den Atomkern. Und die Elektronen sind dann auf verschiedenen Elektronenbahnen drauf. Die laufen und können auch von einer Bahn auf die andere springen, wenn sie mehr Energie erhalten.“ 3
Das Bohr’sche Atommodell bzw. das Planetenmodell des Atomkerns ist die eindeutig dominante Schülervorstellung zu Atomen (Abschn. 7.2). Wenn sie aufgefordert werden, ein Atom zu beschreiben, nennen Schülerinnen und Schüler die Vorstellung von auf bestimmten Bahnen um den Atomkern kreisenden Elektronen mit Abstand am häufigsten. Physikalisch führt das Bohr’sche Modell in mancherlei Hinsicht in die Irre (Kasten 10.1). Zwar beschreibt das Modell die Quantisierung der Energie in Atomen, aber das Bild von Kreisbahnen um den Atomkern gibt zentrale Aussagen der Quantenmechanik nicht adäquat wieder. Beispielsweise besitzen die Elektronen im Bohr’schen Modell – im Gegensatz zur quantenmechanisch angemessenen Vorstellung – jederzeit einen bestimmten Ort und sie bewegen sich auf bestimmten Bahnen, zwischen denen sie unter Aufnahme oder Abgabe von Energie „springen“ können. Diese Vorstellung zeigt sich auch im Schülerzitat am Beginn dieses Abschnitts. Der für den Übergang zum quantenmechanischen Modell zentrale Kritikpunkt, dass Elektronen auf Kreisbahnen wegen der ständigen Beschleunigung Energie abstrahlen müssten, spielt in den Überlegungen von Schülerinnen und Schülern keine Rolle.
Die Atomvorstellungen, die Schülerinnen und Schüler über das Planetenmodell hinausgehend entwickeln, sind sehr individuell und entstehen aus dem Versuch heraus, die verschiedenen im Physik- und auch Chemieunterricht behandelten Modelle in eine kohärente Vorstellung zu integrieren. Das gelingt im Allgemeinen nicht. Die Untersuchungen zeigen, dass häufig verschiedene (auch untereinander unverträgliche) Vorstellungen koexistieren und je nach Bedarf aktiviert werden.
Selbst wenn sich Schülerinnen und Schüler bewusst auf ein quantenmechanisches Modell vom Atom beziehen, geschieht dies in der Regel in Abgrenzung zum immer präsenten Bohr’schen Atommodell. Diese ständige Präsenz zeigt sich in einem Interview mit einem Oberstufenschüler: „Dieses Bild habe ich eigentlich schon noch, wenn ich an ein Atom denke, also es wird einem schon gesagt, dass es nicht so ist, aber man steckt da schon so drin, und es wird dann auch immer wieder benutzt.“
Kasten 10.1: Quantenmechanisches Atommodell
Das quantenmechanische Atommodell beruht auf der Wahrscheinlichkeitsinterpretation der Quantenmechanik. Im Formalismus der Quantenmechanik ergeben sich die Zustände von Elektronen in Atomen als stationäre Lösungen der Schrödingergleichung – so etwas wie stehende Wellen im Atom. Diese Beschreibung bezieht sich jedoch nicht auf eine materielle Substanz, etwa in der Art einer Flüssigkeit. Nur das Quadrat der Wellenfunktion  besitzt eine Interpretation, es wird als Wahrscheinlichkeitsdichte interpretiert, bei einer Ortsmessung ein Elektron am Ort x zu finden. Eine angemessene bildliche Darstellung dafür wäre eine Punktwolke, die das Ergebnis sehr vieler Ortsmessungen visualisiert.
besitzt eine Interpretation, es wird als Wahrscheinlichkeitsdichte interpretiert, bei einer Ortsmessung ein Elektron am Ort x zu finden. Eine angemessene bildliche Darstellung dafür wäre eine Punktwolke, die das Ergebnis sehr vieler Ortsmessungen visualisiert.
Ebenso wenig wie ein Flüssigkeitsmodell spiegelt ein Planetenmodell des Atoms, bei dem die Elektronen auf Bahnen um den Atomkern laufen, die quantenmechanische Beschreibung wider. In der stehenden Elektronenwelle ist ein Elektron über das ganze Atom delokalisiert – wie das übrigens auch für Photonen in den kilometerlangen Armen der Gravitationswelleninterferometer gilt, die dort keineswegs „hin und her“ laufen. Sprachlich bringt man dies zum Ausdruck, indem man sagt, dass Elektronen in einem Atom keine klassischen Eigenschaften wie „Ort“ oder „Bahn“ zugeordnet werden können. Den Unterschied zwischen stehenden und laufenden Elektronenwellen zeigen Experimente, in denen mit Laserpulsen hochangeregte Elektronenzustände präpariert werden (Rydbergatome), in denen Elektronenwellenpakete wie im Planetenmodell quasi-lokalisiert um den Atomkern laufen. Solche Elektronenzustände sind physikalisch möglich, treten aber in der Natur nur in sehr speziellen Situationen auf.
10.2.2 Ladungswolken, Schalen, Orbitale
- a.
konkrete Vorstellungen von Wolken oder verschmierten Ladungswolken: „dass es das Elektron auch nicht als Kugel, sondern irgendwie … um den Atomkern so umkreist als … ja, als Verteilung“,
- b.
das Schalenmodell (zum Teil mit Schalen als festen, real existierenden Hüllen oder als Schale mit endlicher Dicke: „Innerhalb dieser Dicke kann man es nicht genau definieren, wo sich das Elektron aufhält, halt nur aufgrund der Wahrscheinlichkeit“,
- c.
Darstellungen, die an chemische Strukturformeln von Molekülen erinnern (‚Hanteln‘),
- d.
das Orbitalmodell: „Da gibt es die Orbitaltheorie, da kann man diese Orbitale räumlich darstellen, dann weiß man, wo sich die Elektronen ungefähr aufhalten“.
Sehr häufig findet man Mischvorstellungen aus verschiedenen Modellen und ad hoc generierte Annahmen über die Struktur von Atomen, insbesondere im Zusammenhang mit der Wahrscheinlichkeitsdeutung: „Die Elektronen kreisen innerhalb der Schalen um den Atomkern, wobei sie immer verschiedene Positionen einnehmen können, die man halt nicht bestimmen kann.“
In einer Längsschnittstudie untersuchte Petri (1996) die Entwicklung der Vorstellung eines einzelnen Schülers im Verlauf einer mehrwöchigen Unterrichtseinheit über Atomphysik. Petri konnte mehrere koexistierende Modelle identifizieren, die unterschiedlich stark ausgeprägt waren und eine unterschiedliche Wertigkeit für den Schüler besaßen: das Planetenmodell, das Aufenthaltswahrscheinlichkeitsmodell und das Ladungswolkenmodell. Das Aufenthaltswahrscheinlichkeitsmodell war bei diesem Schüler dadurch charakterisiert, dass die Elektronen sich in durch die  -Funktion definierten ‚Aufenthaltsräumen‘ befinden, wo sie sich nicht bewegen. Im Ladungswolkenmodell besteht ein Atom aus dem Atomkern und einer statischen Elektronenladungswolke. Die Elektronen werden als ‚verschmiertes Etwas‘ aufgefasst.
-Funktion definierten ‚Aufenthaltsräumen‘ befinden, wo sie sich nicht bewegen. Im Ladungswolkenmodell besteht ein Atom aus dem Atomkern und einer statischen Elektronenladungswolke. Die Elektronen werden als ‚verschmiertes Etwas‘ aufgefasst.
10.2.3 Bahnen und Ortseigenschaft
In der klassischen Mechanik lässt sich ein Körper zu jedem Zeitpunkt lokalisieren. Wenn man ihn zeitlich verfolgt, kann man eine Bahn angeben. Schülerinnen und Schüler mit einer Teilchenvorstellung von Elektronen übertragen dies auf die mikroskopische Physik: „Und da können sie ja eine noch so große Geschwindigkeit haben, zu einem bestimmten Zeitpunkt müssen sie ja irgendwo sein!“ Die Wahrscheinlichkeitsaussagen der Quantenmechanik und die Tatsache, dass man Elektronen im Allgemeinen keinen festen Ort zuschreiben kann, werden auf Unkenntnis des wahren Ortes und praktische Schwierigkeiten zurückgeführt: „In Wirklichkeit hat das Elektron einen bestimmten Ort, man kennt ihn nur nicht.“ Eine typische Vorstellung führt die Unkenntnis des Ortes auf die schnelle Bewegung der Elektronen im Atom zurück, die es praktisch schwierig macht, den ‚wahren Ort‘ des Elektrons zu bestimmen: „Die bewegen sich schnell, und da ist es sicherlich schwierig festzustellen, wo die gerade sind“.
Zur Stabilität der Vorstellungen zur Ortseigenschaft von Quantenobjekten stellt Wiesner (1996, S. 136) fest: „Die Mehrzahl der Schüler äußert spontan indifferente Bedenken gegen die Lokalisierung, geht aber sehr leicht davon ab und stimmt der permanenten Lokalisierung zu. […] Das hier beschriebene Endverhalten erscheint in dem Sinne ‚negativ‘, was vielen Schülern zwar bewusst ist, dass bei Elektronen einiges anders ist, sie haben aber keine klaren, stabilen Vorstellungen darüber, was anders ist“.
In der Elektronenbeugungsröhre lässt sich die Interferenz von Elektronen in einem realen Experiment beobachten. Obwohl auf dem Leuchtschirm helle und dunkle Ringe zu beobachten sind, die in der Quantenphysik als Interferenzmuster gedeutet werden, halten viele Schülerinnen und Schüler an strikt teilchenhaften Vorstellungen fest (Bormann, 1987). Die auf dem Leuchtschirm beobachtete Intensitätsverteilung wird durch Störungen der Bahn erklärt, z. B. durch Stöße: „dass also die Elektronen durch den Kristall, der wahrscheinlich eine regelmäßige Form hat, auch auf bestimmte Bahnen gelenkt werden, dass also das Bild dann auch regelmäßig ist.“
10.3 Vorstellungen zur Quantenmechanik
10.3.1 Determinismus und Wahrscheinlichkeitsdeutung
In der Quantenmechanik sind im Allgemeinen nur Wahrscheinlichkeitsaussagen möglich. Ihre Gesetze sind statistischer Natur (Kasten 10.2). Einzelereignisse lassen sich im Allgemeinen nicht vorhersagen (z. B. der Ort, an dem ein einzelnes Elektron im Doppelspaltexperiment auf dem Schirm gefunden wird). Erst die statistische Verteilung von Messergebnissen, die sich bei vielen Wiederholungen des Versuchs ergibt, wird von den Gesetzen der Quantenmechanik beschrieben. Das einfachste Beispiel sind Photonen, die auf einen halbdurchlässigen Spiegel treffen. Die Hälfte von ihnen wird reflektiert, die andere Hälfte durchgelassen. Es lässt sich aber nicht vorhersagen, ob das nächste Photon reflektiert oder durchgelassen wird.
Für Schülerinnen und Schüler hat diese Vorstellung zunächst nichts Ungewöhnliches an sich. Schließlich ist es beim Wurf eines Würfels auch nicht anders: Das Ergebnis des nächsten Wurfes kann man nicht vorhersagen, die statistische Verteilung, die sich bei häufigem Würfeln ergibt, dagegen schon. Der Unterschied zur Quantenmechanik liegt darin, dass die Newton’sche Mechanik im Grundsatz deterministisch ist. Das bedeutet: Würde man die Anfangsbedingungen beim Wurf eines Würfels nur genau genug kennen, könnte man das Ergebnis prinzipiell vorhersagen. Für Lernende ist es schwer nachzuvollziehen, dass es in der Quantenmechanik prinzipiell anders sein soll. Vor diesem Hintergrund ist die folgende Schüleraussage zu verstehen: „Und es ist jetzt halt schwer anzugeben, wo sich jetzt das Elektron genau befindet, und der Ausweg ist eben der, dass man dann auch Wahrscheinlichkeiten angeben kann: also das Elektron befindet sich mit einer gewissen Wahrscheinlichkeit eben an einem gewissen Ort.“
Der objektive Zufall ist ein Grundprinzip der Quantenphysik. Es gibt in der Quantenmechanik keine „verborgenen Parameter“, durch die schon im Voraus festgelegt wird, ob ein Photon am halbdurchlässigen Spiegel durchgelassen oder reflektiert wird. Es gibt auch keine Möglichkeit, die Anfangsbedingungen so zu wählen, dass der Ausgang des Experiments im Voraus festgelegt wird. Das bedeutet: Der Determinismus der klassischen Mechanik muss in der Quantenmechanik aufgegeben werden – der Ausgang eines Einzelexperiments wird nicht vollständig durch die Anfangsbedingungen festgelegt. Der Zufall, der die Einzelereignisse bestimmt, ist objektiver Natur und hat seine Ursache nicht in subjektiver Unkenntnis der Anfangsbedingungen.
Für Schülerinnen und Schüler ist es nicht leicht, diesen Unterschied zu akzeptieren: „Also man kann eigentlich nicht unbedingt sagen, dass man … es überhaupt nicht vorhersehen kann, es ist nicht total rein zufällig, was das Elektron macht. Aber es ist auch nicht direkt vorhersehbar. So zwischen, also in der klassischen Mechanik kann man ja genau sagen, was eine Masse, also Massenpunkt im nächsten Moment macht. Und in der Statistik kann man es überhaupt nicht mehr sagen, nur mit Wahrscheinlichkeit und dazwischen liegt irgendwo die Quantenmechanik.“
- a.
Wahrscheinlichkeit als Interpretations- oder Übersetzungskalkül: Der Begriff der Wahrscheinlichkeit wird von den Schülerinnen und Schülern lediglich als Instrument verwendet, um damit physikalische Fragestellungen und Probleme für sie befriedigend bearbeiten zu können. Der Zusammenhang zwischen Wahrscheinlichkeiten und relativen Häufigkeiten schafft eine für die Schülerinnen und Schüler vorstellbare Situation.
- b.
Unzufriedenheit mit der akausalen Beschreibung durch Wahrscheinlichkeiten: Einige Schüler fordern zum Verständnis von vorgegebenen Wahrscheinlichkeitsverteilungen eine kausale Erklärung für die Entstehung dieser Verteilungen auf der Grundlage von Einzelereignissen ein: „Wieso weiß das Quant denn, dass es da nicht hindarf? … Was für einen Grund haben die Quanten, sich so zu verteilen?“
- c.
Wahrscheinlichkeit als Ungenauigkeit: Einige Schüler verbinden mit dem Begriff Wahrscheinlichkeit die umgangssprachliche Auffassung von Ungenauigkeit und Zufälligkeit. Wahrscheinlichkeitsaussagen haftet generell der Charakter des Ungenauen und Uneindeutigen an (Abschn. 11.3).
Insgesamt wird die Wahrscheinlichkeitsinterpretation von den meisten Schülerinnen und Schülern als Kalkül und Hilfsmittel akzeptiert. Es bleibt jedoch oft eine Unzufriedenheit mit der im Unterricht angebotenen Deutung. Teilweise wird die Wahrscheinlichkeitsinterpretation fraglos akzeptiert, teilweise wird jedoch eine – in der Quantenmechanik nur leider nicht mögliche – Begründung über anschauliche Vorstellungen gewünscht. Die mit dem Wahrscheinlichkeitsbegriff verbundene Vorstellung von Ungenauigkeit spiegelt in den Augen mancher Schülerinnen und Schüler die nach ihrer Ansicht unzureichenden Möglichkeiten zur Beschreibung von quantenphysikalischen Phänomenen wider.
Kasten 10.2: Objektiver Zufall in der Quantenphysik
Die Gesetze der Quantenmechanik sind statistischer Natur. Es liegt nahe, diese Tatsache auf einen Mangel der Theorie zurückzuführen. Auch beim Würfeln oder Roulette sind nur statistische Aussagen möglich, was sich dort jedoch auf Unkenntnis der genauen Versuchsbedingungen zurückzuführen lässt. Auch hinter der Quantenmechanik hat man immer wieder „verborgene Parameter“ vermutet. Erst relativ spät hat das Bell’sche Theorem hier Klarheit geschaffen. Es besagt: Wenn es Theorien mit verborgenen Parametern gibt, dann müssen diese notwendig nichtlokal sein. Nichtlokalität bedeutet: Ereignisse an einem Ort haben Auswirkungen nicht nur unmittelbar in ihrer direkten räumlichen Umgebung, sondern es treten „Fernwirkungen“ auf.
Es gibt alternative Formulierungen zur Quantenmechanik, z. B. die Bohm’sche Mechanik, die explizit nichtlokal, dafür aber deterministisch sind. Die große Mehrzahl der Physiker steht ihnen allerdings skeptisch gegenüber, insbesondere weil sie nur schwer mit der Relativitätstheorie vereinbar sind.
In der Standardinterpretation der Quantenmechanik (die historisch auf die „Kopenhagener Deutung“ von Bohr und Heisenberg zurückgeht) gibt es keine expliziten Fernwirkungen. Selbst in Experimenten mit verschränkten Photonenpaaren, mit denen z. B. die Bell’sche Ungleichung überprüft wird, gibt es höchstens Korrelationen über große Entfernungen, aber keine Möglichkeit, diese im Sinne einer Fernwirkung zu beeinflussen. In dieser Sichtweise handelt es sich bei der Quantenmechanik um eine lokale Theorie.
Die Aussage des Bell’schen Theorems ist: Möchte man an lokalen Theorien festhalten, kann es keine verborgenen Parameter geben. Damit gibt es objektiven Zufall; der Determinismus der klassischen Physik muss aufgegeben werden. Die Notwendigkeit statistischer Aussagen ist nicht auf Unkenntnis eines „wahren Wertes“ zurückzuführen – diesen gibt es nicht. Zum Beispiel ist der Ort, an dem ein Elektron bei einer Ortsmessung gefunden wird, in der Quantenmechanik nicht vorherbestimmt. Erst bei einer Messung wird das Ergebnis auf statistische Weise realisiert.
10.3.2 Wellen und Teilchen
In einer Studie wurde Physikstudierenden (5. bis 11. Semester) ein Gedankenexperiment zum Doppelspaltversuch vorgelegt.5 Knapp die Hälfte der Studierenden konnte keinen physikalisch adäquaten Erklärungsansatz vorlegen. Ebenfalls knapp die Hälfte der Antworten ließen sich in die Kategorie „unreflektierter Welle-Teilchen-Dualismus“ einordnen, in der das Wellenverhalten und das Teilchenverhalten von Quantenobjekten unverbunden nebeneinanderstehen („Mal-so-mal-so-Dualismus“) und bei Bedarf zu Ad-hoc-Erklärungsansätzen herangezogen werden. Zu Doppelspaltexperimenten mit Elektronen heißt es dann z. B.: „Das kann man sich nur erklären, wenn man das als Welle sieht. Weil wenn ich das Teilchen sehe, dann kann ich nicht verstehen, dass das Teilchen, das hier durchgeht, etwas von dem da drüben weiß.“ Ein reflektierter Umgang mit den beiden Erklärungsmustern (etwa im Sinne der im Kasten 10.3 dargestellten Argumentationsmuster) wurde nur vereinzelt gefunden.
In Untersuchungen zu Schülervorstellungen über die Natur des Lichts6 zeigte sich, dass Schülerinnen und Schüler die Teilchenvorstellung des Lichts bereitwillig akzeptieren. Die Wellenvorstellung wird nur bei intensivem Nachfragen reaktiviert.7 Die Teilchenvorstellung wird beim Fotoeffekt schnell akzeptiert und dann unreflektiert mit der Wellenvorstellung kombiniert. Lichtfeldt (1992b, S. 210) schreibt: „Schüler kommen mit einer hohen Bereitschaft in den Physikunterricht, Modelle so zu benutzen, wie es gerade in ihre jeweilige Vorstellungswelt passt. Dazu kommt die noch bei vielen Schülern vorhandene diffuse Kenntnis von Lichtteilchen, sodass dann der […] Photoeffekt die Vorstellungen der Schüler im Sinne eines mechanistischen Teilchens mit Wellencharakter stabilisiert.“
Der Versuch, Teilchen- und Welleneigenschaften von Elektronen in eine Atomvorstellung zu integrieren, führt bei einigen Schülerinnen und Schülern zur Vorstellung eines Elektrons, das auf einer Welle sitzt und mit ihr auf- und abschwingt. Diese Schülervorstellung kann verfestigt werden, wenn man De-Broglie-Wellen als stehende Wellen in ganzzahligen Vielfachen der Wellenlänge auf eine Bohr’sche Kreisbahn um den Wasserstoffkern zeichnet, um die Stabilität des Wasserstoffatoms zu begründen.8
Kasten 10.3: Wellen und Teilchen
Häufig wird der „Welle-Teilchen-Dualismus“ als eines der großen Rätsel der Quantenmechanik dargestellt, insbesondere in der populärwissenschaftlichen Literatur. Aus wissenschaftlicher Perspektive ist diese Darstellung nicht haltbar; es gibt nichts Unverstandenes am Welle-Teilchen-Verhalten von Quantenobjekten. Die Grundgleichung der Quantenmechanik, die Schrödingergleichung, ist eine Gleichung für die Wellenfunktion  . Sie sagt das Auftreten von Interferenzphänomenen, also Wellenverhalten, vorher. Das Teilchenverhalten tritt erst in der Born’schen Wahrscheinlichkeitsinterpretation zutage: Führt man an einem Elektron eine Ortsmessung durch, erhält man einen eindeutigen Messwert für den Ort – man findet Teilchenverhalten. Die räumliche Verteilung der Messwerte bei sehr vielen Messungen wird durch das Betragsquadrat der Wellenfunktion gegeben. Auf diese Weise sind sowohl Wellen- als auch Teilchenaspekte erforderlich, um das Verhalten beispielsweise von Elektronen mithilfe der Wahrscheinlichkeitsinterpretation zu beschreiben und auch vorherzusagen. Ein Quantenobjekt „ist“ weder Teilchen noch Welle, sondern etwas Drittes, wie Richard Feynman es einmal beschrieb: „It is like neither.“
. Sie sagt das Auftreten von Interferenzphänomenen, also Wellenverhalten, vorher. Das Teilchenverhalten tritt erst in der Born’schen Wahrscheinlichkeitsinterpretation zutage: Führt man an einem Elektron eine Ortsmessung durch, erhält man einen eindeutigen Messwert für den Ort – man findet Teilchenverhalten. Die räumliche Verteilung der Messwerte bei sehr vielen Messungen wird durch das Betragsquadrat der Wellenfunktion gegeben. Auf diese Weise sind sowohl Wellen- als auch Teilchenaspekte erforderlich, um das Verhalten beispielsweise von Elektronen mithilfe der Wahrscheinlichkeitsinterpretation zu beschreiben und auch vorherzusagen. Ein Quantenobjekt „ist“ weder Teilchen noch Welle, sondern etwas Drittes, wie Richard Feynman es einmal beschrieb: „It is like neither.“
10.3.3 Potenzialtopf und Quantisierung der Energie
„Die Elektronen schwappen im Potenzialtopf hin und her wie Wasser in der Badewanne“
Beim unendlich hohen Potenzialtopf ergeben sich stehende Wellen als Lösungen für die Schrödingergleichung. Das Quadrat der Wellenfunktion wird in der Quantenmechanik als Wahrscheinlichkeitsdichte interpretiert, ein Elektron am entsprechenden Ort zu finden. Die Bilder von sinusförmigen stehenden Wellen im Potenzialtopf werden von Schülerinnen und Schülern aber dahingehend interpretiert, dass sich die Elektronen oder die Elektronenwellen im Potenzialtopf zwischen den Wänden hin- und herbewegen9. Die Wahrscheinlichkeitsvorstellung scheint sich hier gut mit dem klassischen Bahnbegriff verbinden zu lassen, während die stehende Welle in den Hintergrund tritt.
In Bezug auf die Quantisierung der Energie bei gebundenen Systemen wird nicht über lernhinderliche Schülervorstellungen berichtet. Die Energiequantisierung wird von den Schülerinnen und Schülern fraglos akzeptiert und auch in eigenständigen Erklärungsansätzen herangezogen. Aus dieser bereitwilligen Übernahme der Energiequantisierung folgt allerdings auch, dass sie im Unterricht kein besonderes Erstaunen (d. h. keinen kognitiven Konflikt, Abschn. 3.2.1) bei den Schülerinnen und Schüler auslöst, an dem man den Sachverhalt als fundamental neu herausarbeiten könnte.
10.3.4 Heisenberg’sche Unbestimmtheitsrelation
„ ist der Abstand zwischen wahrem Ort und gemessenem Ort“
ist der Abstand zwischen wahrem Ort und gemessenem Ort“
- a.
Ort und Impuls sind bei Quantenobjekten nicht gleichzeitig genau messbar bzw. bestimmbar (mit
 die häufigste der gefundenen Vorstellungen).
die häufigste der gefundenen Vorstellungen). - b.
Gegenläufiges Verhalten in den Genauigkeiten von x und p: „Je genauer die Ortsmessung, desto ungenauer die Impulsmessung und umgekehrt“.
- c.
Ort und Impuls sind einem Quantenobjekt nicht gleichzeitig beliebig genau zuzuschreiben: „Wenn ich einmal den Ort genau betrachte, kann ich den Impuls nicht genau bestimmen und umgekehrt. … Ich würde nicht nur so weit gehen, das so zu interpretieren, dass man durch die Messanordnung es nur praktisch verändert, sondern dass es eine physikalische Eigenschaft unserer Welt ist, also eine grundlegende Eigenschaft unserer Welt. Ob man misst oder nicht, diese Unschärfe ist vorhanden. Ich würde es also als eine physikalische Eigenschaft unserer Welt interpretieren.“
- d.
Mehrfach wurde die Ansicht geäußert, der Ort eines Quantenobjekts könne zu einem bestimmten Zeitpunkt nicht beliebig genau gemessen werden.
Alle diese Vorstellungen gehen davon aus, dass sich die Heisenberg’sche Unbestimmtheitsrelation auf einzelne Quantenobjekte bezieht und nicht – wie in Kasten 10.4 ausgeführt – auf ein Ensemble von Quantenobjekten. Da die Darstellung der Heisenberg’schen Unbestimmtheitsrelation in den untersuchten Schulklassen nicht dokumentiert ist, kann nicht ausgeschlossen werden, dass sich in einigen Vorstellungen Formulierungen widerspiegeln, die im Unterricht von der Lehrkraft verwendet wurden. Dann handelt es sich um lehrbedingte Lernhemmnisse (Abschn. 1.2). Zur Fehlinterpretationen trägt auch die Bezeichnung „Heisenberg’sche Unschärferelation“ bei, die man häufig antrifft und die so etwas wie einen „verschmierten Ort“ eines Elektrons nahelegt.
 und
und  gefragt. Er schreibt dazu: „Diese Frage bereitete den meisten Schülern Schwierigkeiten. Nur wenige waren in der Lage, spontan eine einigermaßen klare Antwort zu geben […]. Deutlich dominierend waren Antworten mit dem Vorstellungshintergrund, dass der ‚richtige‘ Wert – obwohl existierend – aus verschiedenen Gründen nicht festzustellen ist.“ Er findet die folgenden Antwortkategorien:
gefragt. Er schreibt dazu: „Diese Frage bereitete den meisten Schülern Schwierigkeiten. Nur wenige waren in der Lage, spontan eine einigermaßen klare Antwort zu geben […]. Deutlich dominierend waren Antworten mit dem Vorstellungshintergrund, dass der ‚richtige‘ Wert – obwohl existierend – aus verschiedenen Gründen nicht festzustellen ist.“ Er findet die folgenden Antwortkategorien:- a.
(Orts-)Änderung, Wegzuwachs: „
 ist ja ’ne Ortsänderung.“
ist ja ’ne Ortsänderung.“ - b.
Abstand des gemessenen Wertes vom eigentlichen, wahren Wert: „Ja, das ist der Abstand vom gemessenen Ort zum Ort, wo es vorher war.“ bzw. „Die Abweichung, wo das Teilchen wirklich war und wo es gemessen wurde.“
- c.
Differenz zweier Ortswerte (Messwerte): „Das Teilchen hat ja immer einen Anfangsort und danach einen zweiten Ort, den Endort.“
- d.
Deutung als kleine Werte: „
 ist – irgendwie klein.“ Oder: „
ist – irgendwie klein.“ Oder: „ ist ein klein gewählter – kleiner Teil vom Impuls.“
ist ein klein gewählter – kleiner Teil vom Impuls.“ - e.
eingeschränkte Definitionsmöglichkeit: „Das sind – das ist so ein Bereich, in dem das verschwimmt. Das
 ist letztlich die Unschärfe des Ortes – letztlich.“
ist letztlich die Unschärfe des Ortes – letztlich.“ - f.
Fehlergrenzen (als Maß für die Messungenauigkeit)
- g.
zulässiger Aufenthaltsbereich: „Also halt – ein bestimmtes, nein, nicht bestimmtes Intervall, wo es sein könnte. Der Bereich, wo es sich aufhalten kann.“
- h.
Unkenntnis über den Ort vor der Messung: Durch die Ortsmessung wird das Quantenobjekt gestört; es befindet sich anschließend nicht mehr an seinem ‚eigentlichen‘ Ort.
Wiesner betont, dass kein einziger Schüler eine Interpretation von  und
und  als Standardabweichungen äußert und diese auf das Ensemble bezieht – also die heute fachlich überwiegend anerkannte statistische Deutung heranzieht.
als Standardabweichungen äußert und diese auf das Ensemble bezieht – also die heute fachlich überwiegend anerkannte statistische Deutung heranzieht.
Kasten 10.4: Heisenberg’sche Unbestimmtheitsrelation
Die Frage, was die Heisenberg’sche Unbestimmtheitsrelation  aussagt, wird auch von Fachleuten nicht einheitlich beantwortet. Bis in die zweite Hälfte des 20. Jahrhunderts herrschte die Störungsvorstellung vor, nach der bei einer Ortsmessung eines einzelnen Quantenobjekts der Impuls dieses Quantenobjekts mindestens so stark gestört wird, dass die angegebene Ungleichung erfüllt ist. Diese Deutung geht auf Heisenberg (1927) selbst zurück, der ein entsprechendes Gedankenexperiment zur Illustration der Relation diskutierte (Heisenbergmikroskop). Problematisch bei dieser Interpretation ist, dass sie die Existenz eines „wahren Ortes“ suggeriert, der in der Quantenmechanik ja gerade nicht angegeben werden kann. Modernere Formulierungen der Störungsvorstellungen beziehen sich daher auf quantenmechanische Zustände und die Breite von statistischen Verteilungen.
aussagt, wird auch von Fachleuten nicht einheitlich beantwortet. Bis in die zweite Hälfte des 20. Jahrhunderts herrschte die Störungsvorstellung vor, nach der bei einer Ortsmessung eines einzelnen Quantenobjekts der Impuls dieses Quantenobjekts mindestens so stark gestört wird, dass die angegebene Ungleichung erfüllt ist. Diese Deutung geht auf Heisenberg (1927) selbst zurück, der ein entsprechendes Gedankenexperiment zur Illustration der Relation diskutierte (Heisenbergmikroskop). Problematisch bei dieser Interpretation ist, dass sie die Existenz eines „wahren Ortes“ suggeriert, der in der Quantenmechanik ja gerade nicht angegeben werden kann. Modernere Formulierungen der Störungsvorstellungen beziehen sich daher auf quantenmechanische Zustände und die Breite von statistischen Verteilungen.
In den letzten Jahrzehnten hat sich weitgehend die statistische Interpretation der Quantenmechanik durchgesetzt. Hier wird die Heisenberg’sche Unbestimmtheitsrelation als eine Grenze für die gleichzeitige Präparierbarkeit von Ort und Impuls an Ensembles von Quantenobjekten angesehen. Bei Messungen von Ort oder Impuls ergibt sich bei jeder Einzelmessung ein bestimmter Wert. Viele Messungen ergeben statistische Verteilungen von Messwerten. Die Standardabweichungen dieser statistischen Verteilungen werden mit  oder
oder  bezeichnet. Die Aussage der Heisenberg’schen Unbestimmtheitsrelation ist dann, dass es nicht möglich ist, ein Ensemble von Quantenobjekten so zu präparieren, dass das Produkt von
bezeichnet. Die Aussage der Heisenberg’schen Unbestimmtheitsrelation ist dann, dass es nicht möglich ist, ein Ensemble von Quantenobjekten so zu präparieren, dass das Produkt von  und
und  den Wert
den Wert  unterschreitet.
unterschreitet.
10.4 Unterrichtskonzeptionen
milq – Das Münchener Unterrichtskonzept zur Quantenphysik
Müller, R. & Wiesner H. (2000). Das Münchener Unterrichtskonzept zur Quantenmechanik. Physik in der Schule, 38, S. 126–134.
Das milq-Konzept basiert auf Forschungen über Schülervorstellungen und orientiert sich inhaltlich stark an den begrifflichen Fragen der Quantenphysik. Mithilfe von Simulationsprogrammen (Doppelspalt, Mach-Zehnder-Interferometer) werden die statistische Natur der Quantenphysik, die Komplementarität oder der quantenmechanische Messprozess untersucht. Strukturierend sind dabei die „Wesenszüge der Quantenphysik“ – kurze Aussagen, die die Kerngedanken der Quantenphysik zusammenfassen (Müller, 2003; Müller und Wiesner, 2002).
milq10 – milq für Jahrgangsstufe 10
Schorn, B. & Wiesner, H. (2008). Die Quantenphysik in der Sekundarstufe. Praxis der Naturwissenschaften – Physik in der Schule, 6(57), 26–33
Ausgehend von dem für die Oberstufe konzipierten Unterrichtskonzept milq wurde ein Unterrichtskonzept für die Jahrgangsstufe 10 erarbeitet und erprobt. Im Vordergrund steht dabei die qualitative Erarbeitung der Unterschiede zwischen klassischer Physik und Quantenphysik und der Merkwürdigkeiten, die sich daraus ergeben.
Visual Quantum Mechanics
Zollman, D. A., Rebello, S. & Hogg, K. (2002). Quantum mechanics for everyone: Hands-on activities integrated with technology. American Journal of Physics, 70(3), 252–259, und
https://web.phys.ksu.edu/vqm (Zugriff am 15. 1. 2018).
Das Visual Quantum Mechanics-Projekt ist zwar kein Unterrichtskonzept, das primär von Schülervorstellungen ausgeht, dennoch zeichnet es sich durch schülerorientierte Hands-on-Aktivitäten aus. Vor allem mithilfe von Simulationsexperimenten werden visuell orientierte Aktivitäten angeboten, mit denen Lernende ihr Wissen aktiv konstruieren können. Das Unterrichtskonzept wurde in den USA in Schulen erprobt und evaluiert.
Quantenphysik ohne Bohr’sches Atommodell
Fischler, H. & Lichtfeldt, M. (1990). Quantenphysik in der Schule II: Eine neue Konzeption und ihre Evaluation. physica didactica, 17(1), 33–50.
Fischler, H. (1992a). Die Berliner Konzeption einer „Einführung in die Quantenphysik“: Didaktische Grundsätze und inhaltliche Details. In H. Fischler (Hrsg.), Quantenphysik in der Schule (S. 245–252). Kiel: Institut für die Pädagogik der Naturwissenschaften.
Der von Fischler und Lichtfeldt entwickelte Kurs zur Quantenphysik verzichtet auf halbklassische Modelle, insbesondere das Bohr’sche Atommodell. Der Einstieg erfolgt mit Elektronen als Quantenobjekten (Elektronenbeugung) statt mit Photonen (Photoeffekt). Hintergrund sind Studien über Schülervorstellungen und Lernschwierigkeiten. Der Kurs wurde hinsichtlich der bewirkten Vorstellungsänderungen evaluiert (Lichtfeldt, 1992b).
10.5 Testinstrumente
Anders als etwa in der Mechanik gibt es für die Quantenphysik kein international akzeptiertes Standardinstrument zur Untersuchung von Schülervorstellungen oder Lernerfolgen. Das liegt zum großen Teil an der Vielfalt der Curricula. Sowohl im Anspruchsniveau als auch in den verfolgten Lernzielen gibt es hier beträchtliche Unterschiede. In vielen Ländern ist die Quantenphysik zudem kein Inhalt im Schulunterricht, sondern wird erst an der Universität gelehrt. Krijtenburg-Lewerissa, Pol, Brinkman und van Joolingen (2017) geben einen Überblick über die bisher in der internationalen fachdidaktischen Forschung eingesetzten Testinstrumente.
milq-Vorstellungsfragebogen
Ein Vorstellungsfragebogen zur Quantenphysik wurde von Müller (2003, S. 149ff.) zur Evaluation des milq-Konzepts (Abschn. 10.3) entwickelt. Der Test umfasst 29 Items aus den Bereichen Atomvorstellung, Doppelspaltexperiment, Eigenschaftsbegriff/Determinismus und Unbestimmtheitsrelation. Sie wurden auf der Basis von Forschungen zu Schülervorstellungen konstruiert. Das Ziel ist es, quantenmechanisch angemessene Vorstellungen der Probanden von Vorstellungen zu unterscheiden, die eher einem klassisch-deterministischen Weltbild zuzurechnen sind.
QMCS – Quantum Mechanics Conceptual Survey
Dieser Test wurde im Rahmen des PhET-Projekts (Physics Education Technology) an der University of Colorado entwickelt (McKagan, Perkins & Wieman, 2010). Es handelt sich um einen Multiple-Choice-Fragebogen, dessen Themenauswahl auf den Ergebnissen einer Expertenbefragung beruht. Hauptinhalte der Fragen sind Vorstellungen zu Energieniveaus und dem Verlauf von Wellenfunktionen in Potenzialen, d. h. zu Themen, die sich stark am quantenmechanischen Formalismus orientieren und in der deutschsprachigen Forschung als weniger relevant für den Quantenphysikunterricht in der Schule angesehen werden.
10.6 Literatur zur Vertiefung
Müller (2005). Qualitative Quantenphysik – Eine Handreichung für die Sekundarstufe I im Rahmen von piko (Physik im Kontext). Kiel: IPN. Online verfügbar unter: www.tu-braunschweig.de/Medien-DB/ifdn-physik/quantenphysik_piko.pdf (Zugriff am 15. 1. 2018)
Küblbeck & Müller (2002). Die Wesenszüge der Quantenphysik. Modelle, Bilder und Experimente. Köln: Aulis. Online verfügbar unter: www.milq-physik.de (Zugriff am 15. 1. 2018)
Müller (2003). Quantenphysik in der Schule. Berlin: Logos.
Fischler (1992b). Quantenphysik in der Schule. Kiel: IPN.
Lichtfeldt (1992b). Schülervorstellungen in der Quantenphysik und ihre möglichen Veränderungen durch Unterricht. Essen: Westarp.
Petri (1996). Der Lernpfad eines Schülers in der Atomphysik – Eine Fallstudie in der Sekundarstufe II. Aachen: Verlag Mainz.
In der Dissertation von Petri wird die Entwicklung der Vorstellungen eines einzelnen Schülers im Verlauf des Quantenphysikunterrichts detailliert verfolgt und unter lernpsychologischer Perspektive analysiert – die bislang detaillierteste Rekonstruktion des Vorstellungsgefüges eines Schülers.
10.7 Übungen
Übung 10.1 orientiert sich an einer Aufgabe in Bethge (1988). Der Dialog in Übung 10.2 wurde eigens für die Aufgabe konstruiert.
Übung 10.1
„In der linken Abbildung ist die Wellenfunktion (
-Funktion) zu einem Elektron eingezeichnet, das sich in einem Potenzialtopf aufhält. „x“ bezeichnet die Ortskoordinate in einem linearen Potenzialtopf der Breite b mit unendlich hohen Wänden.
In der rechten Abbildung ist eine mögliche Lokalisation des Elektrons zum Zeitpunkt
eingezeichnet. Zeichnen Sie weitere Orte des Elektrons ein, an denen man es zu den folgenden Zeitpunkten
bis
lokalisieren würde!“

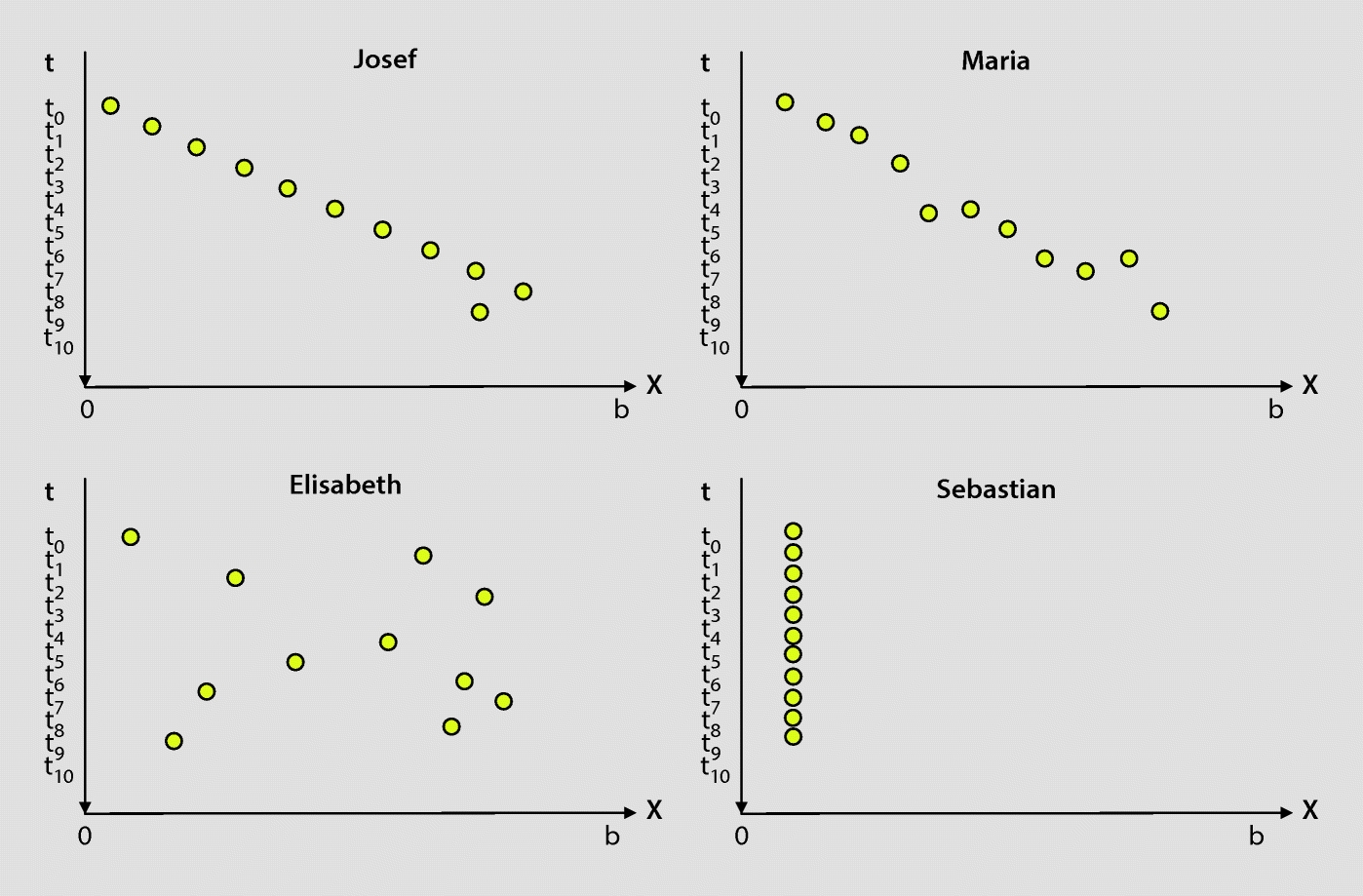
Übungsaufgabe:
- a.
Welche Lösung kommt der physikalisch korrekten Lösung am nächsten? Geben Sie eine kurze Begründung!
- b.
Welche Vorstellungen kann man bei den anderen drei Schülern vermuten? Beschreiben Sie jeweils die Vorstellung und erläutern Sie, woran man sie in den Lösungen erkennen kann!
Übung 10.2
Theo ist Schüler in einem Leistungskurs Physik, in dem Farbstoffmoleküle als Beispiel für einen Potenzialtopf mit unendlich hohen Wänden behandelt wurden, in dem sich Elektronen befinden. Theo ist an Physik sehr interessiert und fragt gerne nach. In der Pause nach dem Unterricht ergibt sich folgendes Gespräch mit der Kurslehrerin:
Theo:
Wir haben gesagt, dass sich in dem Kasten – also dem Molekül – eine stehende Materiewelle ergibt, die gerade so Knoten hat an den Wänden – also den Enden von dem Farbstoff – dem Molekül, meine ich.
Lehrerin:
Ja.
Theo:
Und da, wo die Welle eine große Auslenkung hat, da findet man so Farbstoffelektronen halt häufig.
L:
Man muss den Wert der
-Funktion quadrieren, dann hat man ein Maß für die Antreffwahrscheinlichkeit an diesem Ort.
Theo:
Dann ist das Elektron da also häufiger – richtig?
L:
Das kann man so nicht sagen.
Theo:
Warum nicht? Antreffwahrscheinlichkeit heißt doch, wie wahrscheinlich es sich dort befindet.
L:
Wo es häufiger ist, kann man nicht sagen – nur, wo man es häufiger finden wird.
Theo:
Wenn man es dort häufiger findet, muss es doch auch häufiger dort sein. Sonst ist das doch unlogisch.
L:
Die Quantentheorie macht keine Aussagen über die Orte oder die Messung einzelner Elektronen. Sie sagt die Wahrscheinlichkeit voraus, wo man wie viele Elektronen registrieren wird, wenn man die Messung mit einer bestimmten Versuchsanordnung durchführt – z. B. bei den Bäuchen viele.
Theo:
Das mit den Wahrscheinlichkeiten ist doch nur ein Ersatz dafür, dass man eben nicht exakt sagen kann, wo das Elektron gerade ist. Das kann aber ja kein Zufall sein. Man würde gerne genau sagen, wo es ist – oder meinetwegen auch, wo man es findet – aber das geht eben nicht, oder noch nicht. Und daher greift man dann halt zu den Wahrscheinlichkeiten. Das ist so ähnlich wie bei Heisenberg. Auch da gibt man immer diese Deltas an, weil man den Ort nicht genau angeben kann.
Übungsaufgabe:
Deuten Sie Theos Fragen und Aussagen vor dem Hintergrund der Schülervorstellungen in der Quantenphysik. Nehmen Sie dabei Bezug auf konkrete Aussagen von Theo.