37 Pflege von Männern mit Erkrankungen der Geschlechtsorgane
Anatomie & Physiologie im Fokus
(nach Schwegler u. Lucius 2016)
Männliche Geschlechtsorgane im Überblick
Hoden
Innerhalb des Hodensacks liegen in voneinander getrennten Taschen der rechte und linke Hoden (Testis). In den Hoden selbst erfolgt die Bildung der Samenzellen wie auch die Produktion verschiedener Hormone (u. a. das männliche Geschlechtshormon Testosteron). Die Hormone gelangen über die Blutbahn zu den Zielorganen wie Gehirn, Knochen und Muskulatur. Die männliche Keimdrüse, der Hoden (Testis, Orchis), entsteht aus derselben Anlage wie der Eierstock der Frau. Er entwickelt sich daher zunächst intraperitoneal und wandert erst kurz vor der Geburt aus dem Bauchraum durch den Leistenkanal in den Hodensack (Skrotum) ein. Der Hoden hat in etwa die „Standardmaße“ von 5 × 3 × 2 cm und wiegt 25 g. Unter der derben Kapsel befinden sich aufgeknäuelte Samenkanälchen, in denen sich die Spermien entwickeln. Zwischen den Samenkanälchen produzieren Leydig-Zellen das männliche Sexualhormon Testosteron.
Nebenhoden
Der Nebenhoden (Epididymis) bedeckt wie eine Kappe die hintere äußere Seite des Hodens. Hoden und Nebenhoden sind gut tastbar und klar gegeneinander abgegrenzt ( ▶ Abb. 37.1). Im Nebenhodenkopf verlaufen 10 – 20 geknäuelte Ductuli efferentes, die das Hodensekret aus dem Hodennetz aufnehmen und in den eigentlichen Nebenhodengang ableiten. Die Gesamtlänge des Nebenhodenganges (Ductus epididymidis) beträgt ca. 5 m (!). Vielfache Verschlingungen ermöglichen es, diese Länge in Körper und Schwanz des Nebenhodens (ca. 6 – 7 cm) unterzubringen. Der Nebenhodengang macht die Spermien während der etwa 12 Tage dauernden Passage befruchtungsfähig, da sein Sekret die Bindung der Spermien an die Eizelle begünstigt.
Samenleiter
Im Gegensatz zum Nebenhodengang, der als Reservoir für Spermien dient, hat der anschließende Samenleiter die Aufgabe, während der Ejakulation den Inhalt des Nebenhodenschwanzes möglichst schnell weiterzubefördern. Er führt durch den Leistenkanal in die seitliche Leistengrube, biegt dort spitzwinklig nach innen und hinten ab und verläuft vor dem Harnleiter zur Rückseite des Blasendreiecks.
Samenblase
In den Samenleiter mündet beidseits eine Samenblase. Sie produzieren mehr als zwei Drittel des Volumens einer Ejakulation. Das Sekret ist schleimig zäh und reich an Fruchtzucker (Fruktose). Durch seinen relativ alkalischen pH-Wert von 7,2 erlangen die Spermien ihre Eigenbeweglichkeit; die hohe Fruktosekonzentration liefert die notwendige Energie. Ohne diese Aktivierung bleiben die Spermien im sauren Vaginalmilieu unbeweglich und könnten nicht in Uterus und Eileiter vordringen.
Hoden und Nebenhoden.
Abb. 37.1 Sie enthalten vielfach geknäuelte Samen- bzw. Hodenkanälchen. In den Samenkanälchen des Hodens entstehen und reifen die Spermien. Erst im Nebenhodengang werden sie befruchtungsfähig.

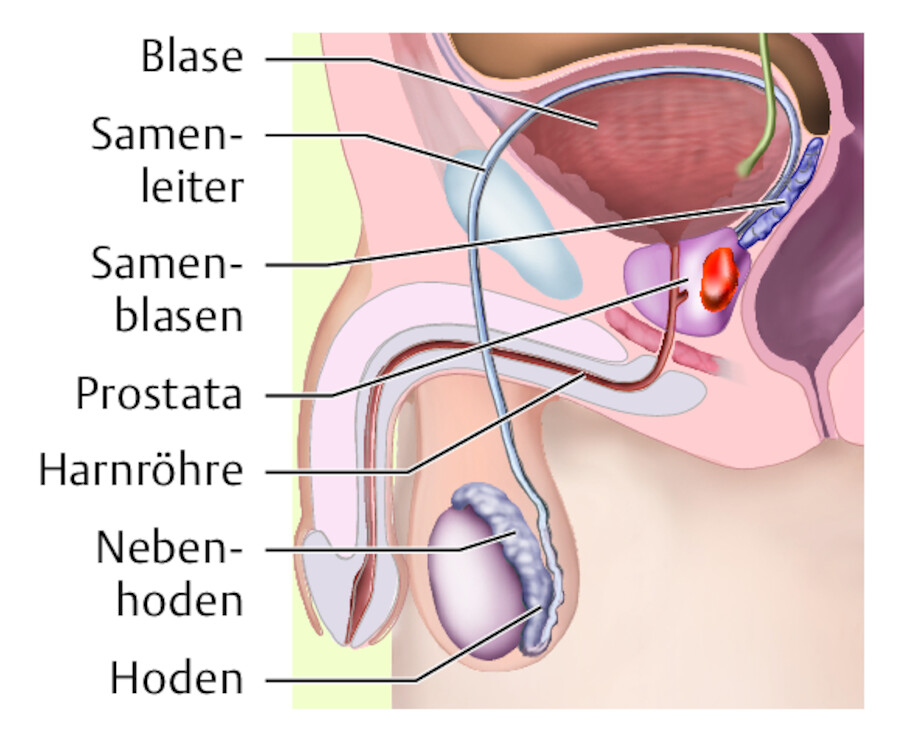
Übersicht über die männlichen Geschlechtsorgane.
Abb. 37.2 Der Samenleiter ist mit einer Länge von 50 – 70 cm nach dem Darm das längste Hohlorgan des Mannes.
Prostata
Die Prostata (Vorsteherdrüse) wird meistens als „kastaniengroßes" Organ beschrieben. Sie ähnelt einem oben und unten eingedellten Tischtennisball (ca. 4 × 4 × 2 cm). Funktionell ist die Drüse ein Dreiwegehahn zur Umschaltung zwischen Urin- und Spermafluss: Das Endstück der beiden Spritzkanälchen wird von starken glatten Muskelfasern verschlossen, sodass beim Wasserlassen kein Urin in Samenblasen und Samenleiter eindringen kann. Umgekehrt verschließt der innere Schließmuskel am Harnblasenausgang während der Ejakulation den blasennahen Anteil der Harnröhre. Er blockiert auf diese Weise einen nutzlosen rückwärtsgerichteten Spermafluss in die Harnblase (retrograde Ejakulation).
Harnröhre
Durch ihre Einbettung in den Penis ist die Länge der männlichen Harnröhre (Urethra) mit 20 – 40 cm sehr variabel. Im ersten Harnröhrenabschnitt münden die beiden Samenleiter und die Ausführungsgänge der Prostata. Der zweite Abschnitt liegt innerhalb der Peniswurzel. Hier münden die beiden Cowper-Drüsen. Außerdem besitzt die Harnröhre in ihrem weiteren Verlauf zahlreiche kleine Harnröhrendrüsen. Beide Drüsengruppen geben gleich zu Beginn der sexuellen Erregung ein zähflüssiges Sekret ab, das die Gleitfähigkeit des Penis erhöhen soll. Der dritte Abschnitt der Harnröhre liegt in der Mitte des Penis.
Penis
Seine markante Veränderlichkeit in Form und Konsistenz verdankt der Penis 2 unterschiedlichen Schwellkörpersystemen,
-
dem paarigen Penisschwellkörper und
-
dem unpaarigen Harnröhrenschwellkörper.
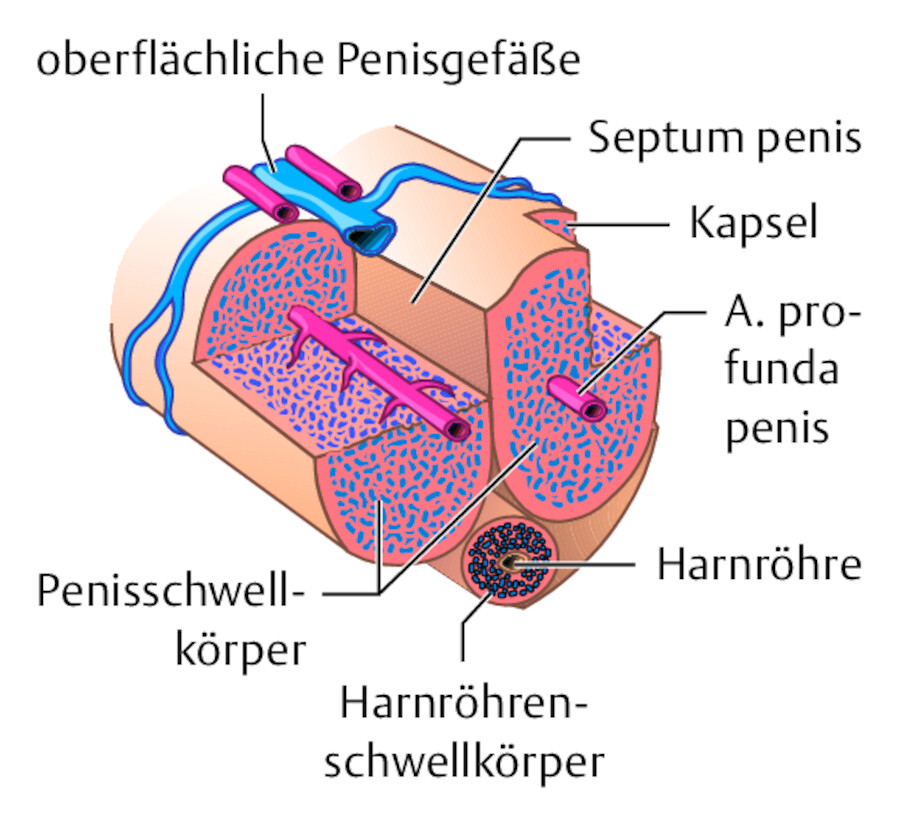
Der Penisschwellkörper ist beidseits am unteren Schambeinast fixiert und bildet dort zusammen mit dem ihn bedeckenden M. ischiocavernosus die Peniswurzel. Im weiteren Verlauf vereinigen sich die beiden Penisschwellkörper zum eigentlichen Penisschaft, sind jedoch immer noch unvollständig durch eine lückenhafte, längsgestellte Membran (Septum penis) getrennt. Der Harnröhrenschwellkörper kann willkürlich angespannt werden, um nach dem Wasserlassen den verbleibenden Urin aus der Harnröhre zu entleeren. Der Harnröhrenschwellkörper verläuft an der Unterseite des Penis und bildet an dessen Spitze die Eichel (Glans penis). In seinem Innern verläuft die Harnröhre.
37.1 Pflege von Männern mit Prostataerkrankungen
Die Prostata (Vorsteherdrüse) in der Größe einer Edelkastanie (etwa 20 ml) liegt im kleinen Becken unterhalb der Harnblase (s. ▶ Abb. 37.2). Sie produziert ein alkalisches Sekret (pH 7,8), welches einen Anteil von etwa 30 % der Samenmenge beim Samenerguss ausmacht. Es aktiviert die Beweglichkeit der Spermien und schützt die Spermien vor dem sauren Milieu der Vagina. Ferner sezerniert die Prostata das Prostata-spezifische Antigen (PSA), ein Eiweiß, das sich im Blut bestimmen lässt und als sog. Tumormarker dient.
37.1.1 Medizinischer Überblick
Folgende Erkrankungen der Prostata sind häufig:
-
gutartige Prostatavergrößerung (benigne Prostatahyperplasie, BPH) (> 30 ml)
-
Prostatakarzinom
-
entzündliche Veränderung der Prostata (akute und chronische Prostatitis)
37.1.1.1 Ursachen
Gutartige Prostatavergrößerung Diese ist am ehesten hormonell bedingt.
Prostatakarzinom Die Ursache ist unklar, beobachtet wird eine familiäre Häufigkeit.
Entzündliche Veränderung Entzündungen der Prostata werden meist durch Keimverschleppung über die Harnwege, selten lymphogen oder hämatogen verursacht.
37.1.1.2 Häufigkeit
Gutartige Prostatavergrößerung Im Alter nimmt die Häufigkeit zu (60 % der Männer > 50 Jahre, 90 % der Männer > 80 Jahre).
Prostatakarzinom Das Prostatakarzinom ist der häufigste Tumor (26%) des „alternden“ Mannes (Alter meist > 60 Jahre, 63 000 Neuerkrankungen in Deutschland pro Jahr). Mit 10 000 Todesfällen pro Jahr stellt das Prostatakarzinom die dritthäufigste Todesursache nach dem Lungen- und Darmkarzinom dar (Deutsche Krebsgesellschaft 2016).
Entzündliche Veränderung Die Wahrscheinlichkeit, im Laufe des Lebens an einer Prostatitis zu erkranken, beträgt 15 %.
Gutartige Prostatavergrößerung
Bis zu 60 % der über 50-jährigen Männer leiden unter meist zunehmenden Symptomen der gutartigen Vergrößerung der Prostata. Es resultiert eine Einengung/Kompression der Harnröhre mit erhöhtem Auslasswiderstand der Harnblase. Typische Miktionsbeschwerden sind Startschwierigkeiten, eine Abschwächung des Harnstrahls mit verlängerter Miktionszeit, häufige Miktion (auch nachts) bei fehlender kompletter Harnblasenentleerung (Restharnbildung) sowie Nachträufeln. Häufig findet sich auch eine irritative Symptomatik, wie häufiger Harndrang. Diese Symptomatik wird als LUTS (Lower Urinary Tract Symptoms) bezeichnet. Bei Dekompensation kann es sogar zu einem Miktionsunvermögen (Harnverhaltung) kommen. Die Symptome werden nach Schweregrad in 3 Stadien eingeteilt (nach Alken 1996).
Stadium I: Reizstadium In diesem Stadium wird die Abflussstörung durch die Blase kompensiert, sodass kein Restharn in der Blase verbleibt. Die Beschwerden beschränken sich lediglich auf eine Abschwächung des Harnstrahls, verzögerten Beginn der Blasenentleerung, erhöhter Miktionsfrequenz (Pollakisurie) und nächtlicher Miktion (Nykturie).
Stadium II: Restharnstadium Die Blase kann die Abflussbehinderung nicht mehr kompensieren. Nach der Blasenentleerung bleibt immer noch eine Restharnmenge von bis zu 100 ml in der Blase. Alle Beschwerden des Reizstadiums treten auf. Zusätzlich kommen häufig Harnwegsinfekte, mögliche Blasensteinbildung und Dranginkontinenz hinzu.
Stadium III: Dekompensationsstadium Im dritten Stadium kommt es zur Problematik der sogenannten Überlaufblase. Harnstauungsnieren, mit fortschreitendem Verlust des Nierengewebes und mit nachfolgender Niereninsuffizienz bis hin zur Harnvergiftung (Urämie) sind möglich.
Prostatakarzinom
In Abhängigkeit vom Tumorstadium ist der Patient im Frühstadium i. d. R. symptomlos, bei Tumorwachstum sind die Symptome mit denen der gutartigen Vergrößerung zu vergleichen. Die Aufgabe des Urologen ist, die bösartige Vergrößerung der Prostata von der gutartigen zu unterscheiden. Im fortgeschrittenen Stadium bzw. Spätstadium kann der Patient oft neben lokalen Beschwerden auch unter Knochenschmerzen aufgrund ossärer Metastasen (ossär = den Knochen betreffend) leiden.
Entzündliche Veränderung
Bei akuter Prostatitis bestehen meist Dammschmerzen, Prostataschmerzen besonders bei Defäkation sowie Symptome wie Dysurie, schmerzhafte Miktion (Algurie) und Pollakisurie (Miktionsstörung). Der Patient befindet sich oftmals in einem schlechten Allgemeinzustand mit z. T. hohem Fieber und Schüttelfrost. Unbehandelt besteht die Gefahr einer Urosepsis (Blutvergiftung).
Bei chronischer Prostatitis ist das Beschwerdebild deutlich milder. Es besteht kein Fieber. Meist berichten die Patienten über Druckgefühl im Bereich des Dammes, unspezifische Unterbauchbeschwerden sowie Algurie oder Ejakulationsbeschwerden, die schon über einen langen Zeitraum, sogar über Jahre, bestehen können.
37.1.1.3 Symptome
Die Erkrankungen der Prostata haben folgende mögliche Begleitsymptome: Ejakulationsstörungen, Hämaturie, Hämatospermie.
37.1.1.4 Diagnostik
Zu den diagnostischen Maßnahmen gehören:
-
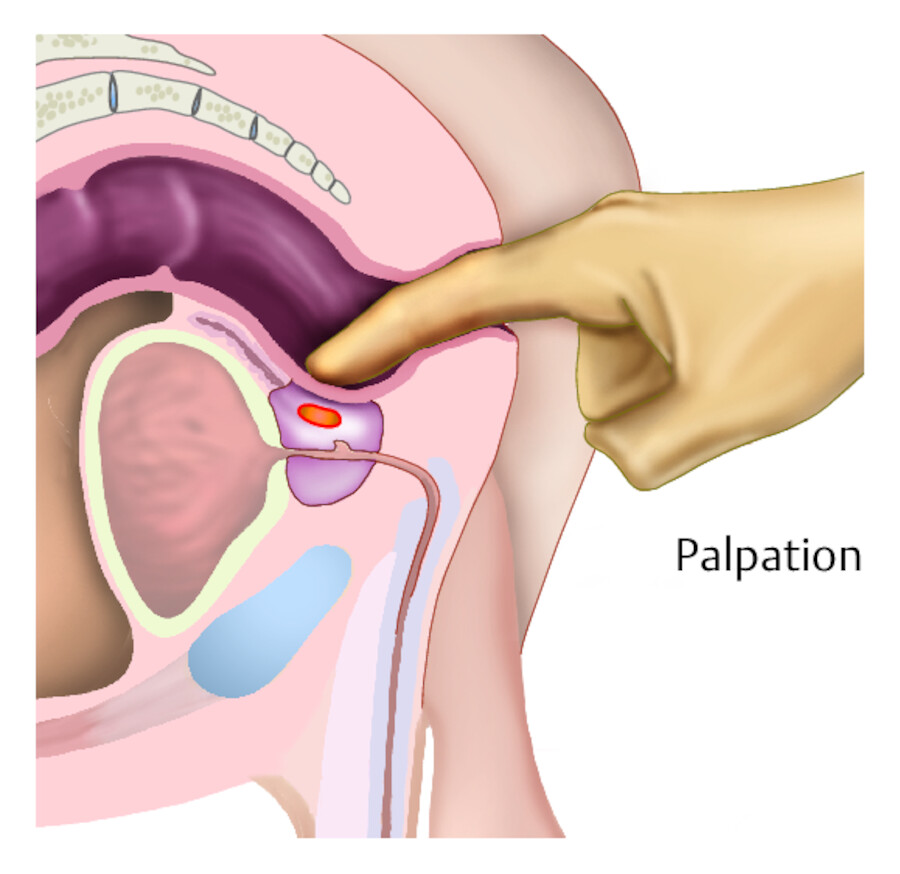
digital rektale Untersuchung der Prostata ( ▶ Abb. 37.3)
Prostatapalpation.
Abb. 37.3 Bei der rektalen Palpation wird die Prostata ertastet.
-
bildgebende Verfahren:
-
Sonografie der Prostata
-
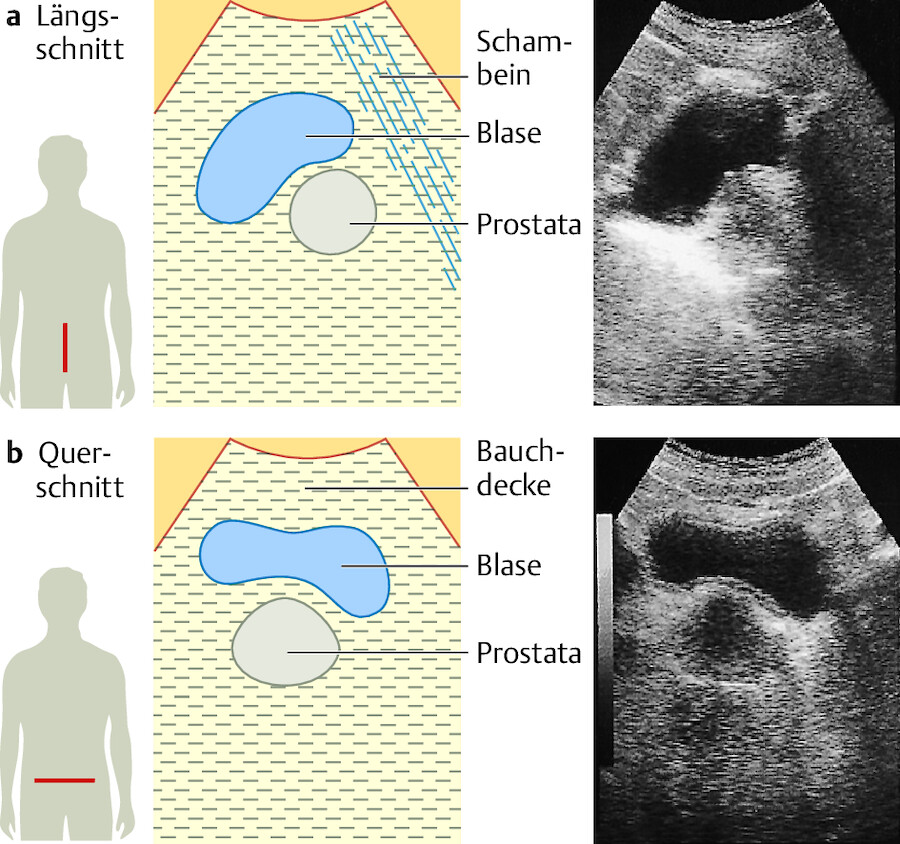
Sonografie der Blase und Restharnbestimmung ( ▶ Abb. 37.4)
-
Restharnbestimmung.
Abb. 37.4 Sonografische Darstellung von Blase und Prostata.
-
Sonografie der oberen Harnwege
-
Fakultativ: Ausscheidungsurogramm mit Röntgenkontrastmittel
-
invasive diagnostische Verfahren:
-
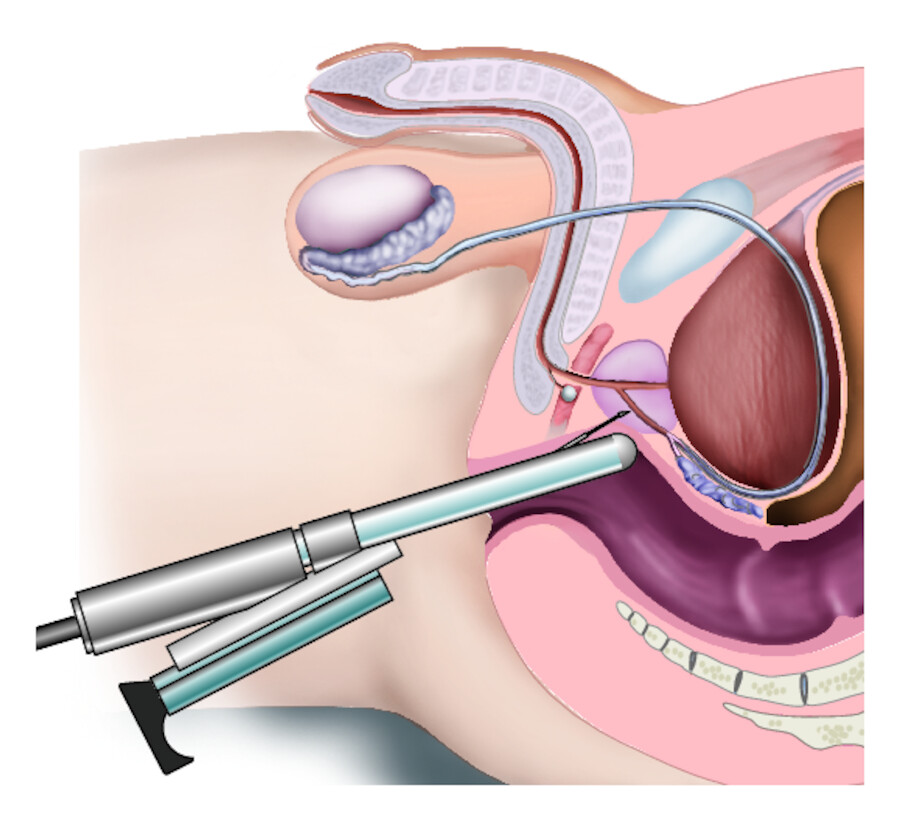
sonografisch gesteuerte Prostatastanzbiopsie ( ▶ Abb. 37.5): Bei klinischem Verdacht ist die Prostatastanzbiopsie zum Nachweis/Ausschluss eines Prostatakarzinoms indiziert. Dieser kann bei erhöhtem bzw. inadäquatem (zur Prostatagröße nicht korrelierenden) PSA-Wert, deutlichem PSA-Anstieg und/oder auffälligem Prostatatastbefund bestehen.
Prostatastanzbiopsie.
Abb. 37.5 Die Prostatastanzbiopsie erfolgt zum Nachweis/Ausschluss eines Prostatakarzinoms.
-
-
fakultativ: diagnostische Spiegelung der Harnröhre und der Harnblase (Urethrozystoskopie)
-
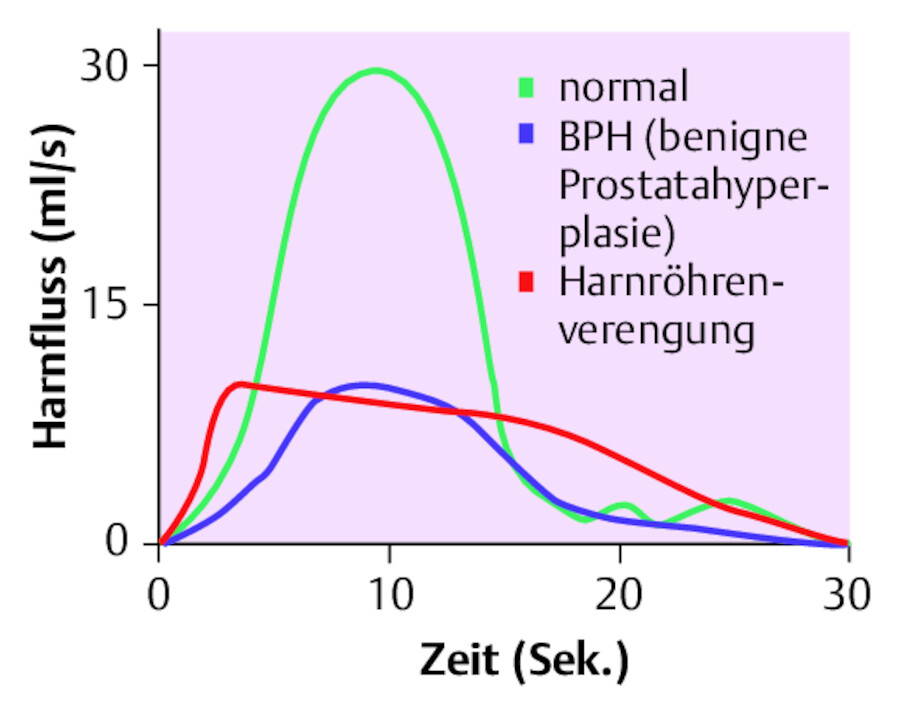
Harnflussstrahlmessung (Uroflowmetrie, ▶ Abb. 37.6)
Uroflowmetrie.
Abb. 37.6 Bei dieser Untersuchung wird die Geschwindigkeit des Harnflusses gemessen.
PSA-Wert Der PSA-Wert (Prostata-spezifisches Antigen) wird im Serum festgestellt (orientierender Richtwert: ≤ 4 ng/ml). Es ist ein Eiweiß, welches ausschließlich von gesunden Prostatazellen, aber auch von Prostatakarzinomzellen gebildet wird:
-
bei Prostatakarzinom meist erhöht (> 4 ng/ml, Quotient freies/Gesamt-PSA < 10–14 %)
-
bei benigner Prostatahyperplasie aber oftmals auch erhöht (Korrelation zur Größe), allerdings Quotient freies/Gesamt-PSA meist > 14–20 %)
-
bei akuter Prostatitis meist deutlich erhöhte Werte
-
Aber auch PSA-Werte < 4ng/ml schließen ein Prostatakarzinom keineswegs aus.
-
Ein PSA-Anstieg kann auch hinweisend für ein Prostatakarzinom sein.
Insgesamt bestimmt die Prostatagröße (TRUS der Prostata!) den für den Patienten individuell zulässigen „gesunden“ PSA-Wert. Vereinfacht heißt das, dass eine kleine gesunde Prostata deutlich weniger „gesundes“ PSA produziert als eine große Prostata.
Tumorstaging Bei Prostatakarzinom wird ggf. ein Tumorstaging (Umfelddiagnostik) mittels Skelettszintigrafie durchgeführt, bei fortgeschrittenen Tumorleiden darüber hinaus eine Computertomografie des Abdomens.
Bakteriologie Bei Prostatitis werden Urin, Prostatasekret, Ejakulat, ggf. Serum auf Bakterien untersucht.
37.1.1.5 Therapie
Die Therapieform ist abhängig von der Art der Erkrankung.
Gutartige Prostatavergrößerung
Medikamentös Zu den Medikamenten zur Behandlung einer gutartigen Prostatavergrößerung gehören:
-
pflanzliche Präparate (Phytotherapeutika)
-
selektive α-Blocker zur Senkung des Blasenauslasswiderstandes
-
5α-Reduktase-Hemmer zur Verkleinerung des Prostatavolumens
Nebenwirkungen:
-
durch die Einnahme von α-Blockern kommt es möglicherweise zur retrograden Ejakulation (Samenerguss erfolgt in die Blase), ggf. auch zum Blutdruckabfall, insbesondere bei gleichzeitiger Einnahme von blutdrucksenkenden Medikamenten
-
durch die Einnahme von 5α-Reduktase-Hemmern sinkt der PSA-Wert etwa um die Hälfte, d. h. unter Einnahme muss der im Blut gemessene PSA-Wert verdoppelt werden
Operativ Der Zugangsweg hängt von der Größe der Prostata ab ( ▶ Abb. 37.7):
Zugangswege zur operativen Therapie der Prostata.
Abb. 37.7

-
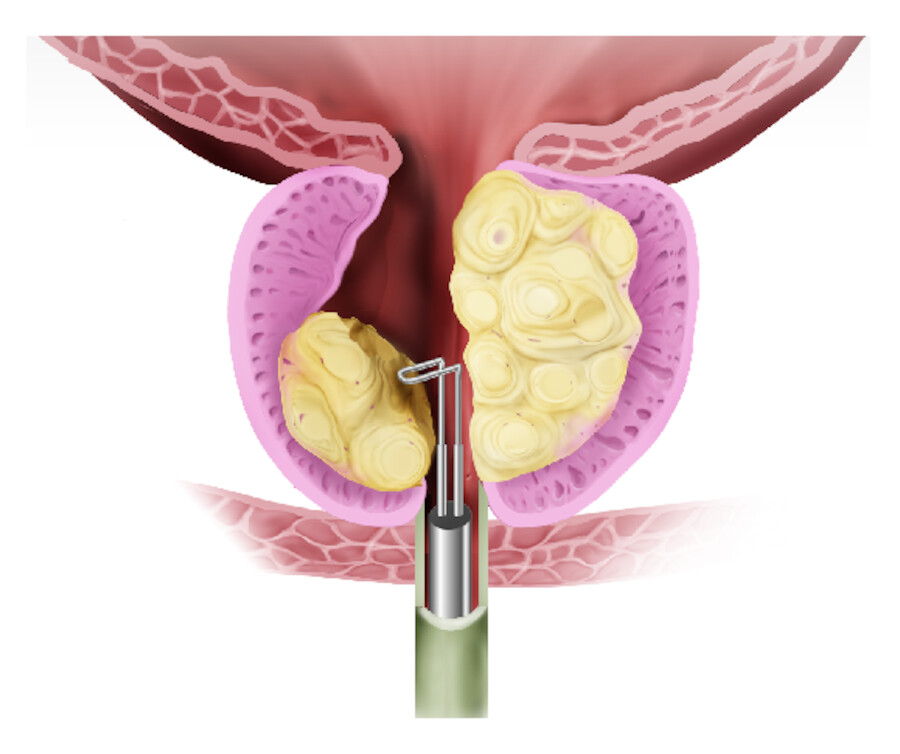
Prostatavolumen ca. < 80 ml: endoskopische transurethrale Prostataadenomresektion (TUR-P) mittels elektrischer Schlinge ( ▶ Abb. 37.8)
TUR-P.
Abb. 37.8 Die endoskopische transurethrale Prostataadenomresektion mittels elektrischer Schlinge zur Verkleinerung der Prostata.
-
Prostatavolumen > 80 ml: offene transvesikale Prostataadenomektomie (Sectio alta oben, ▶ Abb. 37.9)
-
Deutlich zunehmende Anwendung: moderne Prostataadenom-Enukleationsverfahren mittels Lasersonde (z.B. Thulium-Laser-Enukleation der Prostata (ThuLEP)
-
weitere Verfahren: Laservaporisation (Verdampfung von Prostatagewebe)
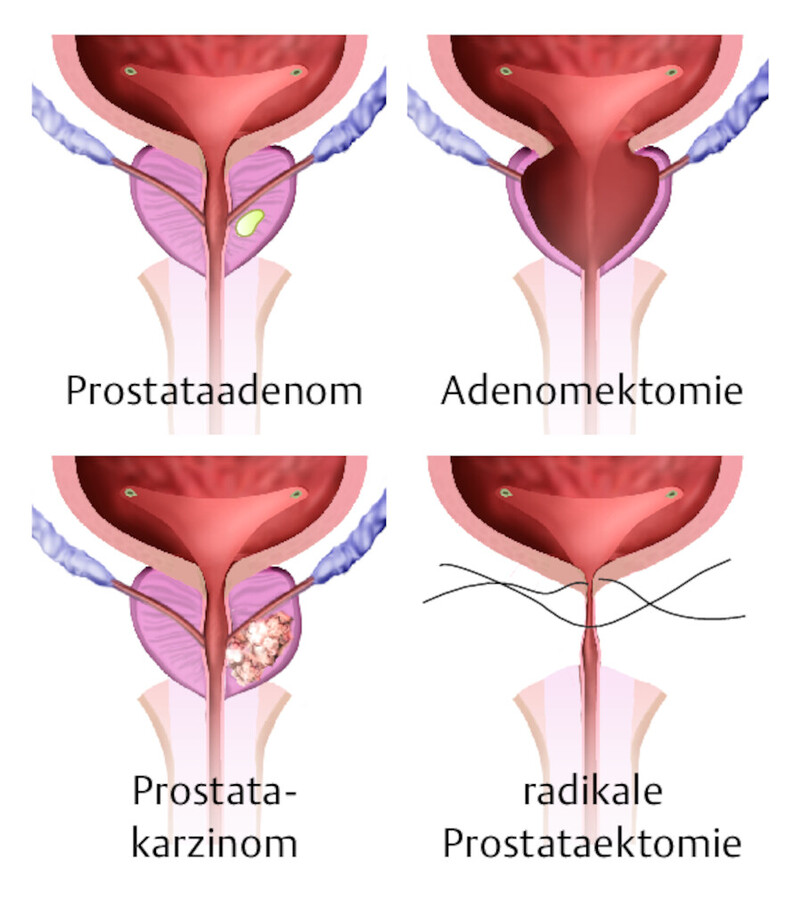
Operationen an der Prostata im Vergleich.
Abb. 37.9 oben: offene transvesikale Prostataadenomektomie, unten: offene radikale Prostatektomie
Nebenwirkungen der Verfahren (TUR-P, offene Adenomektomie, ThuLEP) sind:
-
Bei allen OP-Verfahren resultiert ggf. die retrograde Ejakulation.
-
Bei allen OP-Verfahren besteht die Gefahr der Blutung und Koagelbildung in der Harnblase (Tamponade). Beim modernen ThuLEP-Verfahren ist das Blutungsrisiko deutlich geringer. Selbst bei gleichzeitiger, unabdingbarer Einnahme von blutverdünnenden Medikamenten kann eine OP mit diesem Verfahren sicher durchgeführt werden.
-
Bei der TUR-P / ThuLEP besteht das Risiko der Inkontinenz durch Verletzung des Blasenschließmuskels.
-
Bei der TUR-P / ThuLEP (seltener!) besteht die Gefahr der Ausbildung eines sog. TUR-Syndroms. Hierbei kommt es während der Resektion/Enukleation zur Einschwemmung von elektrolytfreier Spülflüssigkeit in das Gefäßsystem. Insbesondere bei längerer OP-Dauer besteht die Gefahr der Hypervolämie mit Verdünnungshyponatriämie und Entgleisung des Elektrolythaushaltes. Ein Lungenödem oder Schock kann resultieren, sodass ggf. eine intensivmedizinische Überwachung bei TUR-Syndrom notwendig wird.
Prostatakarzinom
Kurativer Therapieansatz Bei lokal begrenzten Tumorleiden ohne Metastasierung wird eine kurative Therapie gewählt:
-
nicht operativ: Bestrahlung der Prostata
Nebenwirkungen: Neben akuten Beschwerden wie einer Strahlenzystitis besteht langfristig die Gefahr des unwillkürlichen Urinverlustes (Inkontinenz) und der fehlenden Gliedsteifigkeit (Impotenz).
-
operativ:
-
offene radikale Prostataektomie ( ▶ Abb. 37.9 unten) (retropubischer/perinealer Zugangsweg, s. ▶ Abb. 37.7)
-
laparoskopische radikale Prostatektomie (sog. Schlüsselloch-Chirurgie)
-
endoskopische, transperitoneale Roboter-assistierte radikale Prostatektomie (RARP)
-
Bei den genannten Operationsverfahren wird die gesamte Prostata einschließlich der Samenblasen entfernt. Nebenwirkungen: Die Patienten sind nach der Operation unfruchtbar. Es besteht die Gefahr der Inkontinenz (< 5 % der Patienten), darüber hinaus droht in etwa 70–80 % der Fälle die Impotenz.
Palliativer Therapieansatz Bei lokal fortgeschrittenen Tumorleiden und/oder bestehenden Metastasen wird ein palliativer (nicht kurativer) Therapieansatz verfolgt.
Hormontherapie Diese beruht auf der Annahme des hormon-(testosteron-)abhängigen Tumorwachstums:
-
Hormonentzugstherapie mit LHRH-Analoga → der Serumtestosteron-Spiegel sinkt ab
-
Blockade der Hormonrezeptoren (Androgenblockade) mit Antiandrogenen → Testosteron wirkt nicht am Androgen-Rezeptororgan
-
chirurgische Kastration (subkapsuläre Orchiektomie) → Testosteron-produzierendes Hodengewebe wird entfernt (heutzutage eher selten)
Mit diesen Therapieformen kommt es durch das Absinken des Serumtestosterons bzw. durch die Rezeptorblockade wegen der Hormonsensibilität des Prostatakarzinoms zum Rückgang der Tumormasse und zur Inaktivität der Tumorzellen. Der Tumor ruht oftmals bis zu einige Jahre in Abhängigkeit von der Aggressivität des Tumors sowie der initialen Tumorlast. Im weiteren Verlauf (oftmals erst nach Jahren) schreitet die Erkrankung aber unweigerlich voran. Dieses Stadium wird kastrationsresistentes Stadium genannt, d. h., die Hormonwirkung auf den Tumor lässt nach.
Nebenwirkungen: Aus der Hormontherapie resultieren Antriebsschwäche, Hitzewallungen, Libidoverlust, Impotenz sowie Osteoporose (LH-RH-Analoga) und eine schmerzhafte Vergrößerung der Brustdrüsen (Gynäkomastie) (Antiandrogene).
Operative Tumormassenreduktion Zunehmend kommt in den letzten Jahren auf der Grundlage neuer wissenschaftlicher Studien ergänzend auch ein radikal operatives Vorgehen (OP-Verfahren, s.o.) zum Einsatz. Der Grundgedanke liegt in der Reduktion der Tumormasse, sodass eine höhere Effektivität der anschließenden medikamentösen Therapie resultiert.
Therapiemöglichkeiten bei Kastrationsresistenz Sogenannte „Neue Substanzen“:
-
Abirateron-Acetat (AA) hemmt selektiv die Androgensynthese in Hoden und Nebennieren und in der Prostata, Darreichungsform: Tabletten (zu Hause einnehmbar).
-
Enzalutamid blockiert den Androgen-Rezeptor mit deutlich höherer Affinität als die o.g. älteren Antiandrogene, Darreichungsform: Tabletten (zu Hause einnehmbar).
-
Radium-223 kommt als Radiopharmazeutikum (radioaktives Medikament) bei mehreren Knochenmetasen zum Einsatz.
-
Immuntherapie (Sipuleucel-T), allerdings in Deutschland nur an speziellen Zentren zulässig
Chemotherapie Die Chemotherapie mit Doxetacel steht schon seit vielen Jahren zur Verfügung.
Radiotherapie Bei solitären Knochenmetastasen, metastatischen Knochenschmerzen oder metastatischer Knocheninstabilität wird die Strahlentherapie eingesetzt.
Prävention von Komplikationen bei knöchern (ossär) metastasiertem Prostatakarzinom
-
Bisphosphonate (Zoledronsäure) als Infusion
-
Denosumab (RANKL-Inhibitor) als subkutane Applikation
Palliative TUR-P / ThuLEP Zur Wiederherstellung der Urinpassage wird eine transurethrale Prostatatumorresektion (TUR-P, ThuLEP, s. o.) durchgeführt.
Prostatitis
Akute Prostatitis Die akute Form der Prostatitis kann entweder konservativ oder invasiv behandelt werden:
-
konservativ (Bettruhe, Antibiose, Analgetika)
-
invasiv (ggf. suprapubische Blasenpunktion (SPK-Anlage), bei Prostataabszess ggf. TUR-P zur Abszesseröffnung)
Chronische Prostatitis Die chronische Form wird ausschließlich konservativ behandelt:
-
Phytotherapeutika (bei abakterieller chronischer Prostatitis)
-
Langzeitantibiose (bei Keimnachweis)
-
Analgetika
37.1.2 Pflege- und Behandlungsplan
Die Pflegekraft hat i. d. R. den Erstkontakt mit dem Patienten. Der Patient sucht meist rasch das Vertrauensverhältnis zum Pflegepersonal, welches im weiteren Behandlungsverlauf aufrechterhalten bleibt. Der überwiegende Kontakt des Patienten findet mit der Pflegekraft statt. Hierdurch wird der Pflegekraft eine wichtige Schlüsselfunktion bezüglich des Wohlbefindens des Patienten zuteil. Insbesondere bei der stationären, perioperativen sowie ambulanten Pflege von Patienten mit Erkrankungen im Genitalbereich ist es zur Wahrung der Intimsphäre des Patienten von entscheidender Bedeutung diskret, einfühlsam, besonnen sowie kompetent vorzugehen.
Gerade im Rahmen urologischer Eingriffe sind oftmals Katheterversorgungen (transurethral/perkutan) zur Urinableitung notwendig. Daraus resultiert eine Beeinträchtigung der ungestörten Urinausscheidung, die den gesamten Pflegeverlauf begleiten kann. Auch die meist vielen Schläuche und Urinbeutel beunruhigen den Patienten. Daher ist es schon präoperativ notwendig, Ängste zu nehmen und beruhigend zu wirken.
Pflegeschwerpunkte sind präoperative Betreuung, postoperative Überwachung (Katheter- und Wundpflege), Entfernung von Wunddrainagen, Hautnahtmaterial und Katheter sowie Abschlussuntersuchung und -gespräch zur Förderung der häuslichen Genesung.
37.1.2.1 Betreuung in der präoperativen Phase
Nach oft unangenehmen Körpererfahrungen und Aufklärungsgesprächen beim Urologen erhofft der Patient, durch die stationäre Behandlung von seinem urologischen Problem befreit zu werden. Gleichzeitig hat er aber auch meist Angst vor der Operation und deren möglichen Folgen wie Inkontinenz und sexuellen Störungen. Dem Patienten sollte daher die Möglichkeit zum Gespräch geboten werden, aber auch zum persönlichen Rückzug. Stellen Sie sich individuell auf jeden Patienten ein.
Der Patient muss für die Operation alle notwendigen Informationen erhalten sowie über die weiteren notwendigen pflegerischen präoperativen Maßnahmen (z. B. Katheteranlage und/oder Intimrasur) aufgeklärt werden.
Blasenverweilkatheter Nicht selten ist präoperativ ein Harnblasenkatheter notwendig. Für viele Patienten wirkt ein Harnblasenkatheter bedrohlich, die Anlage wird oft als unangenehm, z. T. sogar als schmerzhaft empfunden. Besonders ältere Menschen können irritiert sein, weil sie nach der Anlage eines Dauerkatheters keinen gewohnten Harndrang mehr verspüren.
37.1.2.2 Betreuung in der postoperativen Phase
Je nach klinikspezifischer Vorgabe und bestehenden bzw. zu erwartenden Komplikationen erfolgt postoperativ ein Aufenthalt des Patienten in einer entsprechenden stationären Überwachungseinheit. Dies gilt meist sowohl bei chirurgisch größeren Eingriffen (z. B. radikale Prostatektomie), Gefahr der Hb-wirksamen Nachblutung und TUR-Syndrom nach TUR-P als auch bei kardial-respiratorisch eingeschränkten oder älteren Patienten.
Der Zeitpunkt der Verlegung auf eine periphere Station ohne engmaschige und apparative Überwachung wird klinikspezifisch und je nach klinischem Zustand des Patienten festgelegt.
TUR-Syndrom nach TUR-P/ThuLEP Während der transurethralen Prostataadenomresektion kommt es zur Einschwemmung elektrolytfreier Spülflüssigkeit nach intravasal. Je nach Dauer des Einschwemmens (in Abhängigkeit von der Resektionsdauer des Eingriffs) kann eine Hypervolämie mit Verdünnungsnatriämie, Lungenödem und Schock resultieren. Diese Patienten müssen zur Stabilisierung und zum Ausgleich des Elektrolythaushaltes ggf. intensivmedizinisch behandelt werden.
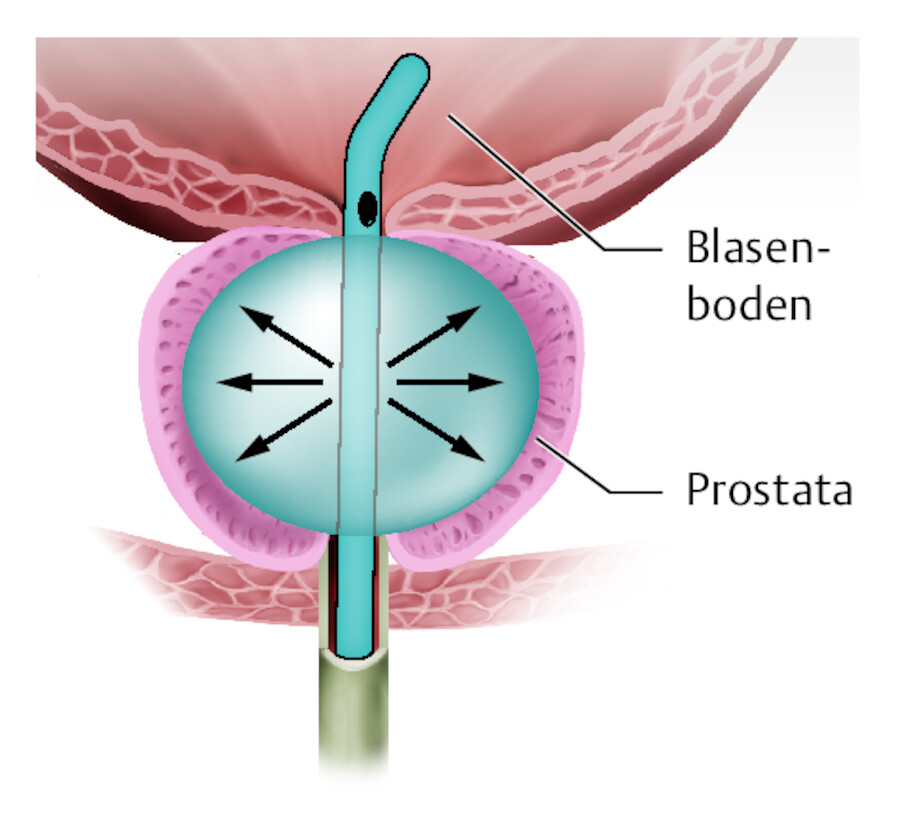
Nachblutung und Koagelbildung nach TUR-P/ThuLEP oder offener Adenomresektion Durch die offene oder transurethrale Entfernung des gutartigen Prostataadenoms entsteht eine innere Wundhöhle (Prostataloge; die Kapsel der Prostata bleibt intakt). Um eine möglichst frühzeitige und effektive Blutstillung zu erzielen, wird diese Wundhöhle durch Aufblocken des Blockungsballons (bis zu 80 ml) des Spülkatheters komprimiert ( ▶ Abb. 37.10). Da es trotz dieser Komprimierung nachbluten kann, erfolgt gleichzeitig eine kontinuierliche Spülung über den Spülkatheter mittels Schwerkraftinfusion, um eine Koagelbildung oder gar eine Harnblasentamponierung durch Blut zu vermeiden. Die meist blutige Spülung findet über den Spülkatheter (großlumiger, zentraler Abflusskanal) den Weg nach extrakorporal.
Blockungsballon.
Abb. 37.10 Nach der Prostataresektion wird die Prostataloge (Bereich, in der die Vorsteherdrüse liegt bwz. gelegen hat) mit dem Blockungsballon eines Tamponadenkatheters komprimiert.
(Abb. nach: Sökeland J, Rübben H. Taschenlehrbuch Urologie; Thieme 2000)
Bilden sich jedoch bei verstärkter Blutung oder nicht ausreichender Spülgeschwindigkeit Koagel, kann daraus eine Harnblasentamponade resultieren. Die zunehmende Blasenfüllung aus Blutkoageln und Spülung mit Überdehnung der Blase ist meist sehr schmerzhaft für den Patienten.
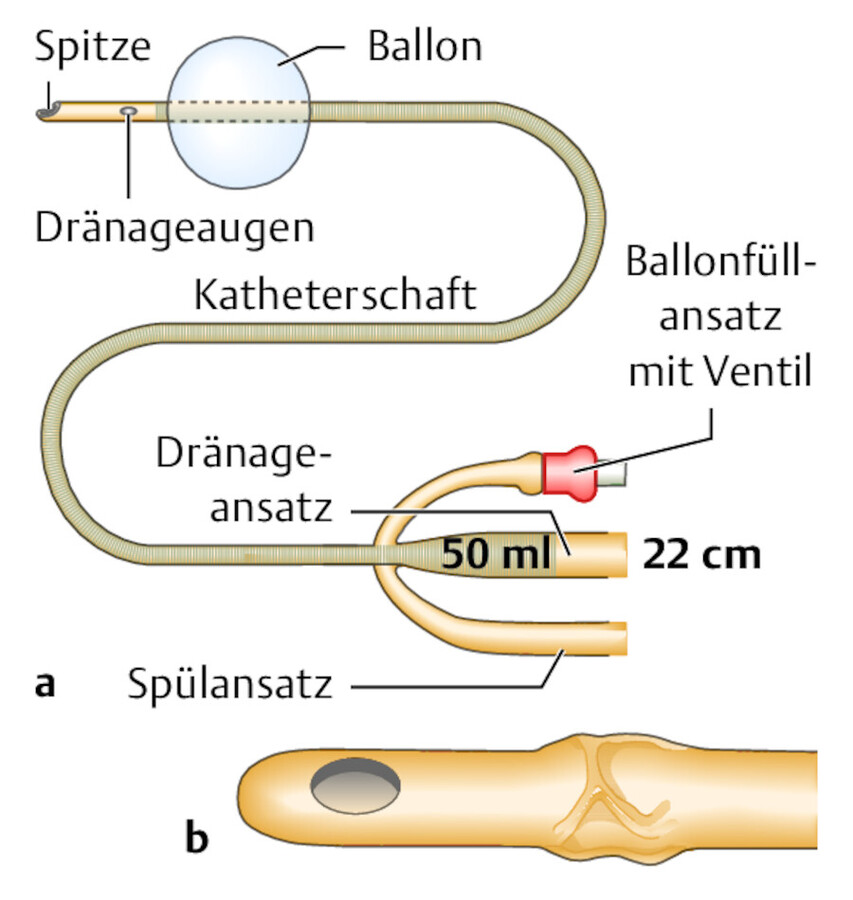
Falls bei verstärkter Koagelbildung die Tamponade droht, sollte der Arzt die Koagel manuell ausräumen. Hierzu wird zunächst mit einer mit 50 – 100 ml NaCL gefüllten Blasenspritze durch zügige Instillation versucht, die Koagel aus dem Katheter in die Blase zurückzutransportieren, um diese dann durch kräftige Aspiration aus der Blase durch den Katheter in die Spritze zu befördern. Dieser Vorgang wird bis zur Koagelfreiheit wiederholt. Für die zügige Aspiration ist ein fester Spülkatheter mit zentral mündender Öffnung notwendig ( ▶ Abb. 37.11 a); bei weichen Kathetern kommt es sonst zum Kollabieren des Lumens bei Aspiration. Um eine Aspiration von Blasenschleimhaut zu vermeiden, sollte immer eine kleine Restmenge an Spülflüssigkeit in der Blase verbleiben. Bei Versagen dieser Maßnahmen wird eine Ausräumung der Tamponade über einen Zystoskop-Schaft notwendig. Erfolgt dieser Eingriff in Narkose, können mögliche Blutungsquellen gezielt elektrisch verschorft werden.
Spülkatheter.
Abb. 37.11 a 3-Weg-Tamponadenkatheter, b wird der Spülkatheter komplett entblockt, kann es zur Wulstbildung an der Ballonmembran kommen und so zu Verletzungen führen.
(Abb. nach: Sökeland J, Rübben H. Taschenlehrbuch Urologie; Thieme 2000)
Spül- und Urinableitungssystem Der Spülbeutel hängt i. d. R. an einem Infusionsständer. Die Spülflüssigkeit gelangt der Schwerkraft folgend via Schlauchsystem durch den Spülkanal des Spülkatheters in die Blase. Über den zentralen Ablaufkanal des Katheters entleert sich die Spülflüssigkeit in einen geschlossenen Auffangbeutel, dessen Volumen dem Volumen des Spülbeutels entspricht. Das gesamte System ist geschlossen.
Nierenfunktion (Urinausscheidung) Neben der Blutungsintensität muss die Nierenfunktion überwacht werden. Blutungsmenge und Tropfengeschwindigkeit der Spüllösung bestimmen, wie oft Urin und Spüllösung, die aus der Blase wieder herauslaufen, kontrolliert werden. Falls die Auffangbehälter der Spüllösung Markierungen aufweisen, die nur grobe Schätzungen zulassen, muss die Flüssigkeit gewogen werden. Die tatsächliche Urinausfuhr ergibt sich aus der Differenz zwischen der gesamten Flüssigkeit und der Spülmenge. Sollte die abgeleitete Flüssigkeit geringer sein als die Spülmenge, muss ein Abströmen der Flüssigkeit nach abdominell z. B. durch Verletzung der Harnblasenwand ausgeschlossen werden. In diesem Fall muss umgehend ein Arzt informiert werden.
37.1.2.3 Entfernung von Wunddrainagen und Kathetern
Katheterentfernung Auf ärztliche Anordnung werden die Harnblasenkatheter durch das Pflegepersonal entfernt. Nach TUR-P/ThuLEP verbleibt der Katheter je nach Dauer der Blutung i. d. R. 2 – 4 Tage.
Nach offener Adenomektomie muss aufgrund des transvesikalen OP-Zuganges der Katheter etwa 6 – 10 Tage verbleiben. Nach Abklingen der Blutung erfolgt vor Entfernung des Katheters eine Dichtigkeitsprüfung der Blase durch eine Röntgen-Kontrastmittelfüllung der Blase (Zystogramm).
Nach radikaler Prostatektomie dient der transurethrale Katheter nicht nur zur Urinableitung, sondern auch zur Schienung der Wundnaht zwischen Urethra und Blasenhals (Anastomose). 10 – 12 Tage nach der Operation vor Entfernung des Katheters wird die Anastomose auf Dichtigkeit durch ein Röntgen-Zystogramm überprüft.
Praxistipp
Nach dem Entblocken des Ballons des Katheters verbleiben Wulstbildungen und Falten an der zuvor maximal gedehnten Ballonmembran ( ▶ Abb. 37.11 b). Daher ist es sinnvoll, eine Restfüllung von etwa 0,5 ml zu belassen, damit die Falten etwas flacher sind. So können Verletzungen vermieden und dem Patienten zusätzliche Schmerzen erspart bleiben.
Entfernung von Wunddrainagen und Hautnahtmaterial Die Wunddrainagen werden je nach Sekretionsmenge 3 – 5 Tage und das Hautnahtmaterial 10 – 11 Tage nach der Operation auf ärztliche Anordnung entfernt.
37.1.2.4 Abschlussuntersuchung und -gespräch
Abschlussuntersuchung Nach Entfernung des Katheters nach TUR-P/ThuLEP oder offener Adenomektomie ist es sinnvoll, die Miktionsleistung des Patienten zu überprüfen. Durch die Harnflussstrahlmessung und Bestimmung des Restharns findet eine Erfolgskontrolle statt. Der Harnstrahl sollte sich im Vergleich zur präoperativen Untersuchung möglichst verbessert und die Restharnmenge sich auf < 50 ml reduziert haben.
Nach radikaler Prostatektomie und Katheterentfernung steht die Kontinenz für den Patienten im Vordergrund. In den ersten Tagen und Wochen ist oftmals die Verwendung von Inkontinenzvorlagen notwendig. Der postoperativ erlernte bewusste Einsatz der Beckenbodenmuskulatur (gezieltes Beckenbodentraining; Schulung durch Physiotherapeuten) zur Erlangung der Kontinenz ist entscheidend.
Entlassungsgespräch Im Entlassungsgespräch wird der Patient auf notwendige Verhaltensweisen zur Optimierung der weiteren Genese und mögliche Risiken hingewiesen:
-
allgemein:
-
Risiko der Nachblutung
-
körperliche Schonung
-
Hinweis auf die Dauer der Wundheilungsvorgänge (6 – 8 Wochen)
-
Verlaufskontrollen/Nachsorge beim niedergelassenen Urologen
-
-
nach radikaler Prostatektomie:
-
Inkontinenz (Training der Beckenbodenmuskulatur)
-
Impotenz (Hilfestellung durch niedergelassenen Urologen)
-
-
nach TUR-P/ThuLEP/ offener Adenomektomie:
-
retrograde Ejakulation
-
37.2 Pflege von Männern mit Erkrankungen an Hoden oder Hodensack
Anatomie und Physiologie im Fokus
(nach Schwegler u. Lucius 2016)
Die Entwicklung von Hoden (Testis), Nebenhoden und Samenleiter beginnt beim Ungeborenen früh innerhalb der Schwangerschaft. Hoden und Nebenhoden entstehen direkt neben der Niere innerhalb des Beckens. Bis zum 7. Schwangerschaftsmonat wandern die Hoden in Richtung der Leiste. Bis zur Geburt und manchmal auch erst im ersten Lebensjahr gelangen die Hoden dann in den Hodensack (Skrotum). Während dieser Wanderschaft schieben sie förmlich das Bauchfell (Peritoneum) vor sich her, sodass nach Abschluss der Hodenwanderung (Descensus testis) Hoden und Nebenhoden von einer bindegewebigen Haut (Tunica vaginalis testis) umspannt sind.
37.2.1 Medizinischer Überblick
Die Erkrankungen an Hoden und Hodensack lassen sich einteilen in
-
Fehlbildungen,
-
Brucherkrankungen,
-
Skrotalödem,
-
Hodenverdrehung,
-
Entzündungen und
-
Hodentumor.
37.2.1.1 Fehlbildungen
Hodenhochstand (Maldescensus testis) Bei 3 – 6 % der neugeborenen Jungen haben die Hoden ihre „Wanderung“ noch nicht abgeschlossen und befinden sich noch im Becken, innerhalb der Leiste oder aber hoch oben im Hodensack. Das Risiko, einen Hodentumor zu entwickeln, ist bei diesen Jungen etwa 30-mal höher. Zudem ist oftmals die Spermienbildung der hochstehenden Hoden eingeschränkt. Die Therapiemöglichkeiten des Hodenhochstands sind medikamentös (Hormone) und auch operativ. Bei einer Operation werden die Hoden aufgesucht, freigelegt und in den Hodensack verlegt (Orchidolyse und Orchidopexie). Unabhängig von der Art der Therapie sollte diese mit dem 1. Lebensjahr abgeschlossen sein!
Pendelhoden Von einem Hodenhochstand ist ein Pendelhoden zu unterscheiden. Ein Pendelhoden befindet sich die meiste Zeit im Hodensack und zieht sich, z. B. bei sexueller Erregung, in den Leistenkanal zurück und verlagert sich anschließend selbstständig wieder ins Skrotum. Dies ist i. A. nicht behandlungsbedürftig und stellt normalerweise für sich alleine keine Bedrohung für die Fruchtbarkeit dar.
37.2.1.2 Brucherkrankungen
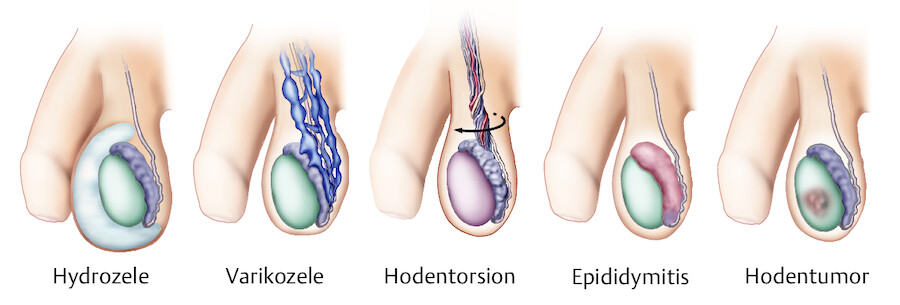
Wasserbruch (Hydrozele) Beim Wasserbruch sammelt sich Flüssigkeit (von wenigen Millilitern bis 500 ml und mehr) zwischen der Tunica albuginea und der T. vaginalis testis ( ▶ Abb. 37.12 a). Es lässt sich ein meist schmerzloser, vergrößerter prall-elastischer Hodensack tasten. Die Ursache ist nicht immer zu identifizieren. Es gibt angeborene Wasserbrüche oder auch Wasserbrüche nach Verletzungen, operativen Eingriffen oder Entzündungen von Hoden und Nebenhoden. Die Therapie besteht in der operativen Eröffnung und Vernähung der Haut um den Hoden und Nebenhoden (Hydrozelenresektion). Bei Beschwerdelosigkeit ist eine Therapie nicht zwingend erforderlich.
Erkrankungen an Hoden und Hodensack.
Abb. 37.12 a Hydrozele, b Varikozele, c Hodentorsion, d Epididymitis, e Hodentumor.
Leistenbruch (Hernia inguinalis) Beim Leistenbruch kann Darm und anderer Bauchinhalt in das Skrotum gelangen. Auch hier ist der Hodensack vergrößert. Mit dem Stethoskop lassen sich dann oft Darmgeräusche innerhalb des Hodensacks hören (auskultieren). Es besteht die Gefahr einer Darmeinklemmung (Inkarzeration). Die Therapie liegt in der operativen Rückverlagerung des Darms in den Bauchraum und dem Verschluss der „offenen Leiste“ entweder mit Nähten oder der Einlage eines Kunststoffnetzes. Achtung: Netze können zu entzündlichen Mitreaktionen des Samenstranges (Ductus deferens) und u. U. zu Störungen der Fruchtbarkeit führen. Die Operation kann offen chirurgisch und auch laparoskopisch (Schlüssellochchirurgie) durchgeführt werden.
Krampfaderbruch (Varikozele) Als Varikozele bezeichnet man eine krampfaderartige Erweiterung der venösen Gefäße am Hoden ( ▶ Abb. 37.12 b). Sie tritt meistens links auf, da der venöse Abstrom hier ungünstiger ist als rechts. Selten können auch Raumforderungen im hinteren Bauchraum (Retroperitoneum), wie z.B. Nierentumoren, Ursache eines verschlechterten venösen Blutabflusses und somit Ursache einer Varikozele sein. Durch den vermehrten Blutstrom um den Hoden ist die Temperatur innerhalb des Hodens erhöht, was die Spermienbildung negativ beeinflussen kann. Bei unerfülltem Kinderwunsch oder Beschwerden seitens des Patienten kann die Therapie über eine operative Unterbindung der erweiterten Gefäße erfolgen, wie sie im Kapitel ▶ „Pflege von Männern mit Veränderung der Fertilität“ beschrieben ist.
37.2.1.3 Skrotalödem
Nach operativen Eingriffen, bei Herz- oder Niereninsuffizienz wie auch bei Lymphabflussstörungen der Beine (z. B. nach pelviner Lymphadenektomie im Rahmen einer radikalen Prostatektomie) kann sich Flüssigkeit innerhalb der Skrotalhaut ansammeln und meistens auch auf den Penis übergreifen. Durch manuelle Kompression lässt sich temporär Flüssigkeit aus der Haut „herausdrücken“, sodass eine „Delle“ entsteht, die sich nach kurzer Zeit wieder zurückbildet. Die Therapie besteht in der Behandlung der zugrundeliegenden Erkrankung (z. B. Herz- oder Niereninsuffizienz) und in der Hochlagerung des Skrotums mithilfe eines Hodenbänkchens (s. u.). Eine intermittierende Kühlung ist ebenfalls hilfreich.
37.2.1.4 Hodenverdrehung
Die Hodenverdrehung (Hodentorsion, ▶ Abb. 37.12 c) ist ein urologischer Notfall! Hierbei drehen sich Hoden und Samenstrang um die eigene Achse, was zu einer Unterbrechung von Blutzufuhr oder -abfluss führt. Ist die Blutversorgung zu lange (über 4 Std.) gestört, ist der Hoden u. U. irreversibel geschädigt. Betroffen sind meistens Neugeborene, Säuglinge oder Schulkinder. Die Patienten verspüren plötzlich heftigste Schmerzen, manchmal verbunden mit Übelkeit und Erbrechen. Die Therapie besteht in der raschen operativen Freilegung des Hodens und der Entdrehung (Detorquierung) von Hoden und Samenstrang.
37.2.1.5 Entzündungen
Entzündungen betreffen meistens den Nebenhoden (Epididymitis, ▶ Abb. 37.12 d) und seltener den Hoden (Orchitis). Sind beide Organe betroffen, spricht man von einer Epididym-Orchitis. Die Entzündung beim Erwachsenen ist meist durch Bakterien hervorgerufen, die über die Harnröhre entlang des Samenleiters in den Nebenhoden und Hoden gelangen. Im Gegensatz dazu können im Kindes- und Jugendalter auch Viren ursächlich sein (Mumps, Pfeiffer’sches Drüsenfieber). Die Beschwerden (Schmerzen) setzen meist nicht plötzlich ein, sondern nehmen langsam zu. Die Behandlung besteht aus einer antibiotischen Therapie und der Vermeidung infektionsfördernder Faktoren (z. B. transurethraler Dauerkatheter). Im Falle eines eitrigen Abszesses muss dieser operativ entlastet werden. Eine Entzündung des Nebenhodens kann zu einem Verschluss des Nebenhodenganges führen, was mit einer Einschränkung der Fertilität einhergehen kann. Mehr zu dieser Problematik finden Sie im Kapitel ▶ „Pflege von Männern mit Veränderung der Fertilität“.
37.2.1.6 Hodentumoren
Hodentumoren fallen meist durch eine schmerzlose Vergrößerung eines Hodens auf ( ▶ Abb. 37.12 e). Die Tastuntersuchung zeigt dann eine Verhärtung, je nach Größe entweder eines Teils des Hodens oder des ganzen Hodens. Hodentumoren sind meist bösartig (maligne). Der tumortragende Hoden muss über einen Hautschnitt in der Leiste entfernt werden (inguinale Ablatio testis). Da das Entartungsrisiko für den anderen Hoden ebenfalls erhöht ist, sollte eine Gewebeprobe vom „gesunden“ Hoden entnommen werden, um auf Tumorvorstufen therapeutisch reagieren zu können (kontralaterale Hodenbiopsie). Anstelle des erkrankten Hodens kann entweder direkt oder aber auch verzögert eine Hodenprothese aus Silikon eingebracht werden. Nach der Operation (auch als Primärtherapie bezeichnet) erfolgt die Ausbreitungsdiagnostik (Metastasensuche) mittels Computertomografien der Lunge und des Bauches sowie in fortgeschrittenen Fällen einer Computertomografie des Schädels wie auch einer Knochenszintigrafie. Vor und nach Entfernung des Hodens werden Tumormarker im Blut (AFP, ßHCG und LDH) bestimmt.
Je nach feingeweblichem (histopathologischem) Bild und Ausbreitung des Tumors besteht die Therapie in
-
einer alleinigen operativen Entfernung des Hodens und weiteren Kontrolluntersuchungen,
-
einer sich anschließenden Bestrahlung (nur bei Seminom) oder
-
einer sich anschließenden Chemotherapie, wobei die Art und Anzahl der Chemotherapiezyklen wiederum vom feingeweblichen Bild und der Ausbreitung des Tumors abhängt.
Abschließend ist in einigen Fällen eine operative Entfernung der nach Chemotherapie übriggebliebenen Tumorreste notwendig. Optimaler Weise vor einer Operation, spätestens jedoch vor einer Bestrahlung oder Chemotherapie sollte mit dem Patienten die Möglichkeit der Aufbewahrung von Spermien in flüssigem Stickstoff (Kryokonservierung) besprochen werden, da die Therapieformen oft eine Einschränkung der Zeugungsfähigkeit bewirken können.
Im Gegensatz zu anderen bösartigen Tumoren ist die Hodentumorerkrankung auch im metastasierten Stadium in über 85 % der Fälle heilbar. Da die Altersgruppe der Betroffenen meistens zwischen dem 20. und 40. Lebensjahr liegt, fällt die Auseinandersetzung mit einer malignen Erkrankung in eine Lebensphase, in der Schulabschluss, Berufsausbildung und Familienplanung im Vordergrund stehen. Die Hodentumorerkrankung, der Verlust eines Hodens und die Angst vor einer Zeugungsunfähigkeit können eine schwere psychische Belastung und Minderwertigkeitskomplexe bei den betroffenen Patienten auslösen. Eine intensive psychoonkologische Betreuung dieser Patienten ist daher obligat.
37.2.2 Pflege- und Behandlungsplan
Krankhafte Veränderungen im Bereich des Hodens sind vielen, v. a. jungen Männern peinlich. Viele der Erkrankungen in diesem Bereich sind jedoch mit einer so ausgeprägten Symptomatik verbunden (Schmerz), dass der Weg zum Arzt unumgänglich ist. Da die Erkrankungen unterschiedliche Altersgruppen betreffen, bestehen ganz individuelle Versorgungswünsche. Bei jungen Männern steht oft die Angst vor einer Zeugungsunfähigkeit oder die meist unbegründete Angst vor einer erektilen Dysfunktion im Vordergrund. Bei Patienten mit der Diagnose eines Hodentumors beeinträchtigt die Krebsdiagnose die weitere Lebensplanung. Die pflegerische und ärztliche Betreuung beinhaltet einen sorgsamen Umgang mit den Schamgefühlen des Patienten und Verständnis für die Sorgen und Nöte bezüglich der Erkrankung.
37.2.2.1 Ruhigstellung, Hochlagerung und Kühlung des Hodens
Im Rahmen krankhafter Veränderungen ist das Skrotum oftmals sehr schmerzempfindlich. Der Hoden ist bei jeder pflegerischen Tätigkeit vor dem Körpereigendruck zu schützen (z. B. die Hoden bei der Seitlagerung nicht zwischen die Oberschenkel einklemmen). Auch leichter Druck, z. B. durch die Bettdecke, kann für den Patienten bereits sehr unangenehm sein. Ein Bettbogen kann hier leicht Abhilfe schaffen.
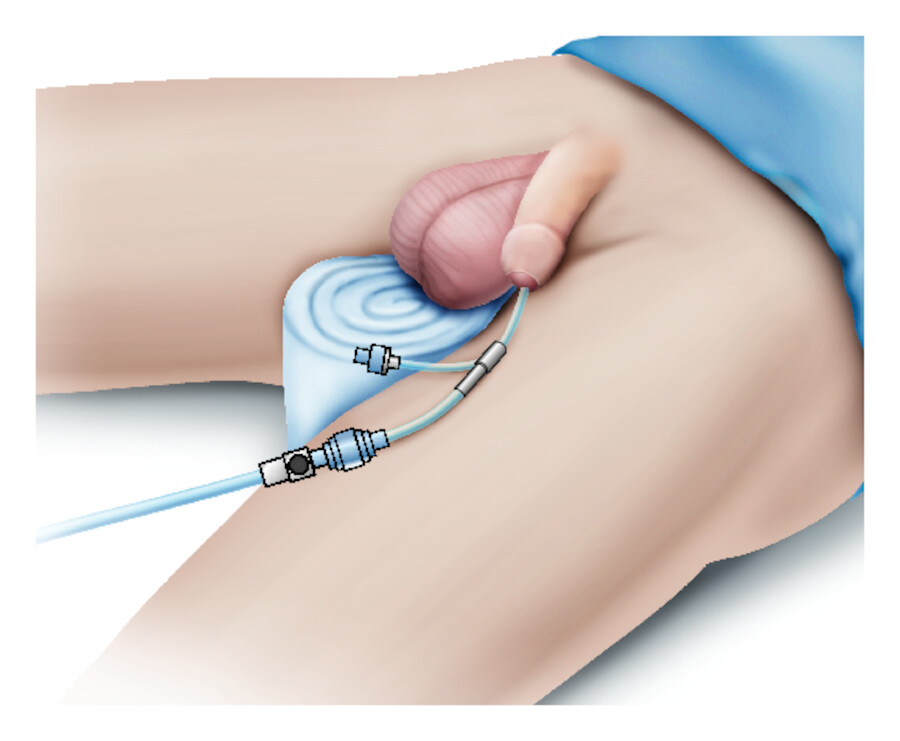
Hodenbänkchen Eine Ruhigstellung und Hodenhochlagerung kann durch ein Hodenbänkchen erreicht werden ( ▶ Abb. 37.13). Es dient der Hochlagerung des geschwollenen oder entzündlich veränderten Hodens. Der Hoden wird oberhalb des Bauchniveaus gelagert, um einen optimalen Abfluss der Flüssigkeit zu gewährleisten. Am besten bewerkstelligt man dies durch ein aufgerolltes Handtuch, das längs zwischen die Beine Richtung Damm (Perineum) gezogen wird. So liegt der Hoden auf dem Bauch und wird durch das Handtuch gehindert, zwischen die Beine und damit unter das Bauchniveau zu rutschen. Nachteile des Hodenbänkchens sind ein leichtes Verrutschen und die notwendige Rückenlagerung sowie eine unphysiologische Hüftgelenksabduktion (Spreizung der Beine). Bei leichteren Schwellungen kann bereits eine eng anliegende Unterhose für eine Linderung der Beschwerden sorgen.
Hodenbänkchen.
Abb. 37.13 Durch die Hochlagerung und Ruhigstellung kommt es häufig zur unphysiologischen Hüftgelenksabduktion.
Kühlung Eine Überwärmung verzögert die Wundheilung und kann die Spermienbildung (Spermatogenese) negativ beeinflussen. Das Verbandsmaterial sollte auf das Nötigste reduziert werden. Eine zwischenzeitliche Kühlung (Kühlelement, Eis) ist unterstützend wirksam. Bei der Verwendung von Kühlelementen oder Eispackungen sind die Gefahren einer ungewollten Minderperfusion mit folgender verzögerter Wundheilung und sogar Erfrierungen zu beachten. Kühlelemente sollten daher immer mit einem Handtuch umwickelt und niemals direkt auf die Haut gelegt werden. Auf feuchtigkeitsisolierendes Material wie Einlagen mit Plastikfolien als Auslauf- und Nässeschutz sollte zur Vermeidung einer feuchtwarmen Kammer verzichtet werden.
37.3 Pflege von Männern mit Veränderungen der Fertilität
37.3.1 Medizinischer Überblick
Veränderungen der Fertilität (Zeugungsfähigkeit) können in einer ausbleibenden Spermienbildung (Spermatogenese) oder einem defekten „Transportweg“ der Spermien begründet sein und werden unter dem Begriff „Infertilität“ (Störungen der Zeugungsfähigkeit) zusammengefasst.
37.3.1.1 Ursachen
Ursachen von Störungen der Spermatogenese sind u. a.:
-
gestörter hormoneller Regelkreis zwischen Hypothalamus, Hypophyse und Hoden
-
Einfluss verschiedener Medikamente (z. B. Chemotherapeutika) und Genussgifte (z. B. Nikotinabusus, Drogen- und Anabolikamissbrauch) sowie exogener Noxen
-
Überwärmung des Hodens z. B. durch ▶ Varikozele
-
genetische Störungen (z. B. Klinefelter-Syndrom)
Ursachen von Störungen des Samentransports sind u. a.:
-
Entzündungen des Nebenhodens (Epididymitis) → können zu einem Verschluss der Samenwege führen
-
transurethrale Resektion von Prostatagewebe oder Operationen im Bereich des vegetativen Nervensystems (z. B. retroperitoneale Lymphadenektomie im Rahmen der Tumorchirurgie bei metastasiertem Hodentumor) → Samenerguss kann rückwärts in die Blase erfolgen (retrograde Ejakulation) oder ganz ausbleiben (Anejakulation)
-
angeborene Fehlbildungen, z. B. ein angeborenes Fehlen beider Samenleiter (kongenitale bilaterale Aplasie des Vas deferens; CBAVD)
-
gewollte Fertilitätsstörung durch Störung des Samentransports, z. B. nach Durchtrennung beider Samenleiter (Ductus deferentes) zur Empfängnisverhütung (Kontrazeption durch Vasektomie bds.)
37.3.1.2 Diagnostik
Die Diagnostik der Fertilitätsstörungen beinhaltet im Wesentlichen eine Anamnese, eine klinische Untersuchung, die Bestimmung von Hormonspiegeln im Blut, eine Sonografie der Hoden und die Anfertigung einer Samenuntersuchung (Spermiogramm).
Zeigt das Spermiogramm keine, zu wenige, defekte oder unbewegliche Spermien, kann eine operative Gewinnung von Hodengewebe sinnvoll sein. Mikroskopisch kann dann anhand der feingeweblichen Untersuchung (Histologie) die Art der Störung der Spermatogenese diagnostiziert werden. Während dieser Operation werden gleichzeitig Hodengewebsproben entnommen (testikuläre Spermienextraktion; TESE), um evtl. im Hoden vorhandene Spermien zu gewinnen und einzufrieren (Kryokonservierung). Mit speziellen Verfahren kann dann aus den eingefrorenen Spermien und von der Frau entnommenen Eizellen eine künstliche Befruchtung erfolgen (sog. intrazytoplasmatische Spermieninjektion; ICSI).
Intrazytoplasmatische Spermieninjektion (ICSI) Wie bei der In-vitro-Fertilisation werden der Frau Eizellen entnommen. Anschließend wird eine Eizelle durch Sog an einer Spezialvorrichtung fixiert. Mithilfe einer feinsten Nadel wird dann ein Spermium in die Eizelle injiziert. Der Vorgang der Befruchtung (Durchdringen der Eizellenwand durch das Spermium) findet hier also tatsächlich künstlich statt. Die so entstandenen Vorstufen von Embryonen werden dann, nach einer Inkubationszeit, in die Gebärmutterhöhle übertragen (Embryotransfer).
37.3.1.3 Therapie
Mikrochirurgische Vasovasostomie Nach erfolgter operativer Durchtrennung der Samenleiter zur Empfängnisverhütung kann es durch neue Lebensumstände (neue Partnerin, Tod des Kindes, religiöse und psychologische Gründe) zu einem erneuten Kinderwunsch kommen. In solchen Fällen ist es möglich, mikrochirurgisch die Enden der durchtrennten Samenleiter unter dem Mikroskop mit feinsten Fäden wieder zusammenzunähen. Eine Durchgängigkeit der Samenleiter kann bei 80 – 90 % der Patienten, eine Schwangerschaft in Abhängigkeit vom Alter der Frau bei 30 – 50 % der Paare erreicht werden.
Nach einer schweren Nebenhodenentzündung mit Verschluss des Nebenhodenganges besteht die Möglichkeit einer Vasotubulostomie (Erfolgsrate ca. 50 %). Die bei beiden Verfahren verwendeten Nahtmaterialien haben einen Durchmesser von 0,02 mm (10 – 0 USP [Fadenstärke]) und 0,03 mm (9 – 0 USP).
Varikozelenligatur Als ▶ Varikozele bezeichnet man eine krampfaderartige Erweiterung der venösen Gefäße am Hoden. Die operative Korrektur erfolgt über eine Unterbindung der erweiterten Gefäße. Es gibt auch die Möglichkeit einer Gefäßverödung (Sklerosierung/Embolisation). Hier wird eine Chemikalie in die erweiterten Venen gespritzt, die dann zum Gefäßverschluss führt.
Zirkumzision Eine Verengung der Penisvorhaut (Phimose) kann zu einer Beeinträchtigung des Wasserlassens (Miktion), der Gliedversteifung (Erektion) und auch des Samenergusses (Ejakulation) führen. Das Risiko einer Übertragung von Geschlechtskrankheiten sowie das Risiko der Ausbildung eines Peniskarzinoms sind bei Patienten mit einer Phimose erhöht. Die Therapie besteht in einer teilweisen (plastischen) oder vollständigen (radikalen) Entfernung der Vorhaut. Im Kindesalter liegen die Erfolgsquoten einer lokalen Kortisontherapie (zur Vermeidung einer Zirkumzision) bei etwa 75 – 90 %.
37.3.2 Pflege- und Behandlungsplan
Die Pflege nach oben genannten Operationen wird in den Kapiteln ▶ „Pflege von Männern mit Erkrankungen an Hoden oder Hodensack“ und ▶ „Pflege von Patienten mit urologischen Operationen“ beschrieben.
37.4 Pflege von Männern mit erektiler Dysfunktion
37.4.1 Medizinischer Überblick
37.4.1.1 Definition
Erektile Dysfunktion (ED) bezeichnet die Unfähigkeit des Mannes, trotz sexueller Stimulation eine für den Geschlechtsverkehr ausreichende Erektion zu erlangen.
Anatomie und Physiologie im Fokus
(nach Schwegler u. Lucius 2016)
Bei einer Erektion schwillt durch einen erhöhten arteriellen Einstrom in die Schwellkörper und einen verminderten venösen Abfluss der Penis an und wird steif ( ▶ Abb. 37.14).
Schwellkörper am Penis.
Abb. 37.14
37.4.1.2 Ursachen und Risikofaktoren
Die Ursachen für eine erektile Dysfunktion sind vielfältig:
-
allgemeine Ursachen: Über- oder Untergewicht, Herz- und Gefäßerkrankungen, Lungenerkrankungen
-
psychische Ursachen: Depression, Versagensängste, Angst vor Schwangerschaft
-
toxische Ursachen: viele Medikamente (z. B. Betablocker zur Behandlung der arteriellen Hypertonie, Antiepileptika, Psychopharmaka usw.), Alkohol, Nikotin und Drogen
-
gefäßbedingte Ursachen:
-
arterielle Genese: z. B. generalisierte Arteriosklerose, Trauma (z. B. Autounfall mit Beckenfraktur)
-
venöse Genese: z. B. atypisch verlaufende Penisvene mit dadurch bedingtem zu schnellem Blutabfluss (sehr selten)
-
-
endokrine (hormonelle) Ursachen: Störungen des Hormonhaushalts, z. B. Testosteronmangel
-
neurologische Ursachen: Querschnittverletzungen, Nervenschädigung durch Diabetes mellitus, Multiple Sklerose
-
organische Ursachen: Penisveränderungen, z. B. Induratio penis plastica (fibrosebedingte Verkrümmung des Penis), Peniskarzinom, kongenitale (angeborene) Penisdeviation, Zustand nach beckenchirurgischen Eingriffen (radikale Prostatektomie, radikale Zystektomie, Rektumexstirpation bei Rektumkarzinom, Y-Prothesenimplantation z. B. bei Bauchaortenaneurysma)
37.4.1.3 Diagnostik
Diagnostische Maßnahmen bei erektiler Dysfunktion sind:
-
ausführliche Allgemeinanamnese bezüglich der Risikofaktoren
-
Sexualanamnese (seit wann besteht die Störung? partnerabhängig? Selbstbefriedigung möglich?)
-
körperliche Untersuchung (Gesundheitsstatus? Geschlechtsorgane normal entwickelt?)
-
neurologische Untersuchung bei Verdacht auf neurogene Ursache der ED
-
apparative Diagnostik (Ultraschalluntersuchung der Hoden und des Penis, Gefäßdarstellung des Gliedes mit Farbduplex unter Pharmakostimulation)
-
Laboruntersuchung (Hormonmangel? Diabetes mellitus? Hyperprolaktinämie?)
-
Stimulationsversuch: Injektion von vasoaktiven Substanzen (z. B. Prostaglandin E1) in den Penis zur Auslösung einer Erektion (SKIT-Test: Schwellkörperinjektionstechnik)
37.4.1.4 Therapie
Die richtige Therapie der erektilen Dysfunktion bedarf einer genauen Ursachenklärung. Häufig ist das Gesamtbild der Erkrankung auf mehrere der o. g. Ursachen zurückzuführen. Die therapeutischen Maßnahmen umfassen:
-
kausale Therapie: Ausschalten möglicher Einflüsse, Medikamentenumstellung, Nichtrauchen
-
medikamentöse Unterstützung der Gliedsteifigkeit:
-
Phosphodiesterase-5-Hemmer (PDE-5-Hemmer) mit Wirkung auf den Signalweg der Erektion → er hemmt das Enzym Phosphodiesterase und sorgt damit für eine verlängerte Wirksamkeit des cGMP, eines Produkts des NO-Stoffwechsels, und damit für eine Entspannung der glatten Muskulatur der Schwellkörper. Drei Präparate sind aktuell verfügbar: Sildenafil (Viagra), Vardenafil (Levitra) und Tadalafil (Cialis).
-
SKAT-Therapie (Schwellkörperautoinjektionstechnik): Injektion von vasoaktiven Substanzen (z. B. Prostaglandine) in den Penis kurz vor dem Geschlechtsverkehr
-
MUSE-Therapie: Prostaglandin-Pellets werden direkt in die Harnröhre appliziert.
-
Dauertherapie mit Alpha-Rezeptoren-Blocker: Yohimbin (Indikation bei milder erektiler Dysfunktion)
-
Praxistipp
Die Kosten für diese Medikamente müssen vom Patienten selbst getragen werden. Die Nebenwirkungen der Präparate und Wechselwirkungen mit anderen Medikamenten sind zu beachten (z. B. keine Kombination von PDE-5-Inhibitoren mit Nitraten!).
-
Hormonsubstitution bei nachgewiesenem Androgenmangel (Testosteron)
-
Anwendung technischer Hilfsmittel: Vakuumpumpe mit Penisring
-
operative Therapie: mikrochirurgische Korrektur von Gefäßanomalien, Penisprothese (Schwellkörperimplantate), Begradigung einer Penisverkrümmung mittels operativer Korrektur
-
psychiatrische bzw. psychologische/psychosomatische Behandlung bei psychogen bedingter ED
Die Ultima Ratio der Therapie der ED stellt zweifelsohne die Penisprothetik dar. Grundsätzlich unterteilt man die verschiedenen Prothesen in semirigide (biegsame) und hydraulische („aufpumpbare“) Implantate. Bei beiden Modellen ist die Protheseninfektion die gefährlichste Komplikation der Behandlung.
37.4.1.5 Priapismus
Eine weitere Erkrankung aus dem Bereich der erektilen Dysfunktion ist der Priapismus (schmerzhaft verlängerte Erektion unterschiedlicher Genese). Hierbei werden 2 Hauptgruppen unterschieden: der Low-flow- und der High-flow Priapismus. Eine klinische Unterscheidung ist jedoch, wenn überhaupt, nur mit großer Erfahrung möglich. Daher ist jeder Priapismus zunächst als Notfall zu betrachten und es sollte unmittelbar ein Urologe konsultiert werden.
Low-flow-Priapismus Er ist gekennzeichnet durch eine drastische Verlangsamung der Penisdurchblutung (Blutstase). Es sammeln sich saure Stoffwechselmetaboliten an und schädigen mit einer Latenz von wenigen Stunden das Schwellkörpergewebe irreversibel! Deshalb handelt es sich bei dieser Priapismusform um einen urologischen Notfall. In vielen Fällen lässt sich keine Ursache für die schmerzhafte Dauererektion finden. Als bekannte Auslöser seien hier die SKAT-Therapie der ED, hämatologische Erkrankungen (Leukämie, Sichelzellanämie) und Drogenkonsum (Kokain) genannt.
Therapeutisch stehen neben Medikamenten (Effortil intrakavernös) verschiedene operative Maßnahmen (Winter-Shunt, Al-Ghorab-Shunt) zur Verfügung. Bei den verschiedenen Eingriffen besteht das therapeutische Prinzip in der Verbesserung des Blutabflusses aus den Schwellkörpern.
High-flow-Priapismus Dabei handelt es sich um eine meist verletzungsbedingte Kurzschlussverbindung zwischen arteriellem und venösem Gefäßsystem. Es resultiert eine durch die vermehrte Durchblutung bedingte Erektion. Die Therapie dieser Priapismusform besteht in dem Verschluss der pathologischen Gefäßverbindung. Der High-flow-Priapismus stellt keine Notfallsituation dar.
37.4.2 Pflege- und Behandlungsplan
In vielen Kulturen gilt ein erigiertes männliches Genitale als Symbol von Macht und Kraft. Impotenz hingegen wird als Versagen und Verlust der Männlichkeit empfunden. Das Thema ist tabuisiert, und viele Betroffene schämen sich, Hilfe zu suchen. Die ärztliche und pflegerische Behandlung sollte stets das Schamgefühl des Patienten berücksichtigen. Pflegerische Aufgaben sind u. a. die Aufklärung und Beratung des Patienten.
37.4.2.1 Patientenaufklärung
Bei einer Vielzahl von operativen Eingriffen kann es zu Störungen der Erektion kommen (radikale Entfernung der Prostata oder der Harnblase bei Prostata- bzw. Blasenkrebs, selten bei Operationen von gutartigen Prostataveränderungen, Rektumresektion, Eingriffen an den großen Bauchgefäßen usw.). Eine detaillierte Aufklärung über die zu erwartenden Nebenwirkungen ist unerlässlich. Nur wenige Patienten lehnen Eingriffe aufgrund einer drohenden Impotenz ab. Der Gesprächsbedarf der betroffenen Männer muss erkannt werden, um ihnen die Möglichkeit der Klärung wichtiger Fragen zu geben.
37.4.2.2 Patientenberatung
Der Verlust der Gliedsteife ist für viele Männer gleichzeitig ein Verlust an Lebensqualität und eine schwere psychische Belastung. Daher kommt der Gesprächsführung durch die Behandelnden eine große Bedeutung zu. Wie spricht man über dieses Thema? Welche Fragen sind erlaubt oder müssen sogar gestellt werden? Wie kann man helfen?
Das Wissen über die Handhabung der verschiedenen Erektionshilfen (mechanisch/medikamentös) gehört zur Beraterleistung. Weitere Informationsquellen, wie Aufklärungsbroschüren, Internetadressen und Selbsthilfegruppen, sollten dem Patienten zugänglich gemacht werden.
37.4.2.3 Spezielle Pflegeanforderungen
Bei der Beratung von Patienten bezüglich der Therapie mit Medikamenten ist die Aufklärung über die möglichen Nebenwirkungen und Langzeiteffekte wichtig. Bei der Pflege nach Operationen kommt es auf die jeweilige operative Maßnahme an, die durchgeführt wurde.
Penisdeviationskorrektur Bei der Pflege von Patienten nach operativer Penisdeviationskorrektur (Induratio penis plastica, kongenitale Deviation) ist eine ausreichende analgetische Therapie zwingend notwendig. Infolge der physiologischen nächtlichen Erektionen kann es zu einem erhöhten Bedarf an Schmerzmitteln kommen.
Korrektureingriffe Im Rahmen der Korrektureingriffe wird das Glied zirkulär verbunden. Postoperativ kann es zur Mangeldurchblutung mit Nekrosen, besonders im Bereich der Vorhaut oder der Glans penis, kommen. Regelmäßige Verbandkontrollen lassen eine drohende Nekrose oder auch Nachblutung frühzeitig erkennen.
Penisprothetik Dem Pflegepersonal obliegt die Aufgabe, prä- und postoperativ wichtige prophylaktische Maßnahmen durchzuführen. Die Rasur des OP-Gebiets erfolgt unmittelbar präoperativ im OP. Zudem badet der Patient in einer keimreduzierenden Lösung (z. B. Betaisodonnabad). Im OP-Saal erfolgt dann die ausführliche Desinfektion. Prä- und perioperativ erhält der Patient eine suffiziente Antibiotikaprophylaxe (Kombinationsantibiose) sowie, falls möglich, postoperativ ein Einzelzimmer. Eine Zusammenlegung mit Patienten, bei denen eine Wundinfektion vorliegt, darf nicht erfolgen!
Priapismus Aufgrund der Gefahr einer dauerhaften Impotenz oder gar schwerer Infektionen des Gliedes muss jeder Priapismus erkannt und rechtzeitig behandelt werden. Der Verbandspflege und Wundkontrolle nach Shuntanlage kommt hierbei größte Wichtigkeit zu.
37.5 Pflege von Männern mit Erkrankungen am Penis
37.5.1 Medizinischer Überblick
Krankhafte Veränderungen am männlichen Glied lassen sich grob in Entzündungen, Verletzungen, angeborene Fehlbildungen und erworbene Veränderungen sowie Tumoren unterteilen ( ▶ Tab. 37.1 ).
|
Art der Veränderung |
Ursache |
Symptome |
|
Entzündungen |
||
|
Eichelentzündung (Balanitis), betroffen sind Eichel und Vorhaut |
|
|
|
Harnröhrenentzündung (Urethritis) |
|
|
|
Schwellkörperentzündung (Kavernitis) |
|
|
|
Tumoren gutartige Penistumoren (Lipome, Hämangiome, Fibrome usw.) sind selten |
||
|
Peniskarzinom |
|
|
|
Verletzungen |
||
|
Penis- und Harnröhrenverletzungen |
|
|
|
Penisfrakturen |
|
|
|
Ein- oder Abriss des Vorhautbändchens (Frenulum) |
|
|
|
Angeborene Fehlbildungen und erworbene Veränderungen |
||
|
Phimose (Vorhautverengung) |
|
|
|
Paraphimose |
|
|
|
Vorhautbändchenverkürzung (Frenulum breve) |
|
|
|
Harnröhrenfehlmündungen (Epispadie und Hypospadie) |
|
|
|
▶ schmerzhafte Dauererektion (Priapismus) von Stunden bis Tagen |
|
|
|
Penisödem (Wasseransammlung im Bindegewebe des gesamten Penis) |
|
|
|
Veränderungen und Verletzungen der Harnröhre (Urethra) |
||
|
Urethrastrikturen |
|
|
|
Urethraabriss |
|
|
|
Urethraeinriss |
|
|
|
Urethrareizungen |
|
|
37.5.1.1 Diagnostik
Die Diagnostik dieser Erkrankungen umfasst neben der körperlichen Untersuchung verschiedene Untersuchungsmethoden:
-
mikrobiologische Untersuchungen von Abstrichen, Sekreten und Urin zum Nachweis von Krankheitserregern
-
bildgebende Verfahren wie Röntgen, CT/MRT (speziell zur Metastasensuche bei bösartigen Prozessen), Sonografie und die diagnostische Urethrozystoskopie
37.5.1.2 Therapie
Ziel der Therapie der genannten Erkrankungen ist die Sicherung/Wiederherstellung des Urinabflusses und der Erektionsfähigkeit bzw. deren Erhalt. Verzögerte oder unterlassene Behandlung kann zu schwerwiegenden Folgen wie der Störung der Erektionsfähigkeit, Miktionsbeschwerden, Harnröhrenstrikturen und Nekrosen bis hin zum Verlust des Gliedes führen. Die Therapie unterteilt sich in:
-
konservative Therapie (Ruhigstellung, Hochlagerung, Kühlung)
-
medikamentöse Therapie (Antibiotika, Analgetika, Antiphlogistika, Chemotherapie)
-
chirurgische Therapie (Zirkumzision, Harnröhrenschlitzung, Penisamputation, Shuntoperation)
-
manuelle Techniken (Reposition der Vorhaut, Harnröhrenbougierung)
-
Radiotherapie
37.5.2 Pflege- und Behandlungsplan
Ein gesundes Genitale und die Potenz werden in unserer Gesellschaft als der Inbegriff der Männlichkeit angesehen. Stellen sich in diesem Bereich Störungen ein, so hat dies für die Patienten neben den unmittelbaren Beschwerden Auswirkungen auf das psychische Gleichgewicht. Man ist nicht mehr Mann. In dieser Situation ist neben dem kompetenten fachlichen Umgang mit der Erkrankung immer auch eine psychologische Betreuung gefragt.
37.5.2.1 Umgang mit Schamgefühlen
Bei Erkrankungen des Penis ist das Schamgefühl bei vielen der betroffenen Männer stark ausgeprägt. Häufig verzögert sich hierdurch die Einleitung einer notwendigen Therapie oder bleibt sogar ganz aus. Beim Peniskarzinom kann dieses Verhalten lebensbedrohliche Folgen mit Fortschreiten der Erkrankung und Metastasenbildung haben. Der Pflege kommt daher besondere Bedeutung im Umgang mit dem Schamgefühl des Patienten und der Unterstützung der Therapie zu.
Vorwurfsvolle Bemerkungen („Warum sind sie damit denn nicht eher zum Arzt gegangen?“) müssen unbedingt vermieden werden. Hat der Patient kein Vertrauen, wird er wichtige Informationen verschweigen, Schmerzen und Probleme im Behandlungsprozess nicht äußern. Dies kann schwerwiegende physische, aber auch psychische Probleme mit sich bringen. Eine offene Gesprächsführung ermöglicht dem Patienten, Probleme zu äußern, ohne sich unter Druck gesetzt zu fühlen.
37.5.2.2 Mitwirkung bei der Therapie
Bei allen plastischen Korrekturen der Harnröhre ( ▶ Abb. 37.15) dient der transurethrale Blasenverweilkatheter nicht nur zur Harnableitung, sondern auch als Wundschiene. Wichtig ist es, auf die korrekte Lage des Katheters und die Urinfördermenge zu achten. Bei Dislokation oder Verstopfung muss der Arzt hinzugezogen werden. Beim Umgang mit dem Katheter ist auf steriles Arbeiten zu achten.
Bei Manipulationen am Penis (Genitalhygiene, Katheteranlage und -kontrolle) ist unbedingt darauf zu achten, dass die Vorhaut nach Beendigung der Maßnahme wieder vollständig reponiert wird, da es sonst zur Ausbildung einer Paraphimose kommen kann. Paraphimosen sind nicht selten nach pflegerischen Manipulationen v. a. bei Patienten mit vorbestehenden Phimosen und Schnürringen zu beobachten!
Bei vielen Eingriffen im Genitalbereich kommt es postoperativ zur Ausbildung eines Ödems oder aber auch eines Hämatoms. In diesen Fällen erfolgt die Hochlagerung und ggf. indirekte Kühlung! Der Penis kann hierzu auf die Bauchdecke gelegt werden und druckfrei durch eine Netzhose mit Vorlage fixiert werden. Bei der Wundbehandlung ist auf die Schmerzempfindlichkeit insbesondere der Glans penis zu achten.
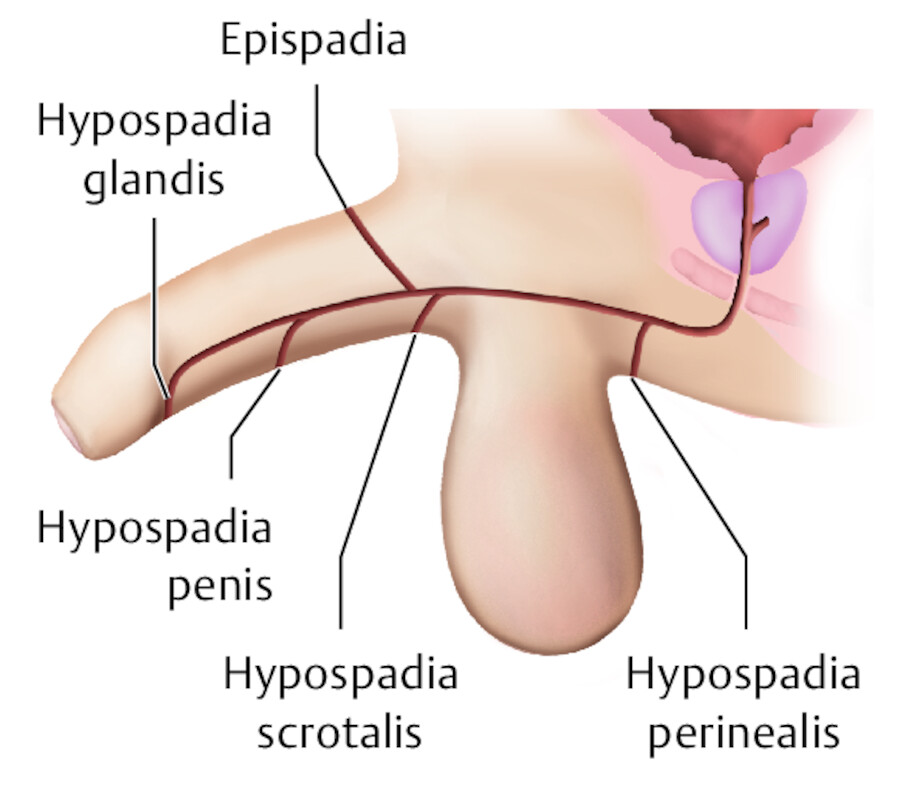
Mögliche Austrittspforten der Harnröhre bei Hypo- und Epispadie.
Abb. 37.15
(Abb. nach: Sökeland J, Rübben H. Taschenlehrbuch Urologie; Thieme 2000)
Beheben einer Paraphimose
Die Verschwellung der zurückgezogenen Vorhaut mit konsekutivem Anschwellen der Eichel bis hin zum Absterben der Glans stellt eine Notfallsituation dar. Bei Katheterträgern ist das Risiko für die Entwicklung einer Paraphimose hoch. Kontrollen sind daher unerlässlich.
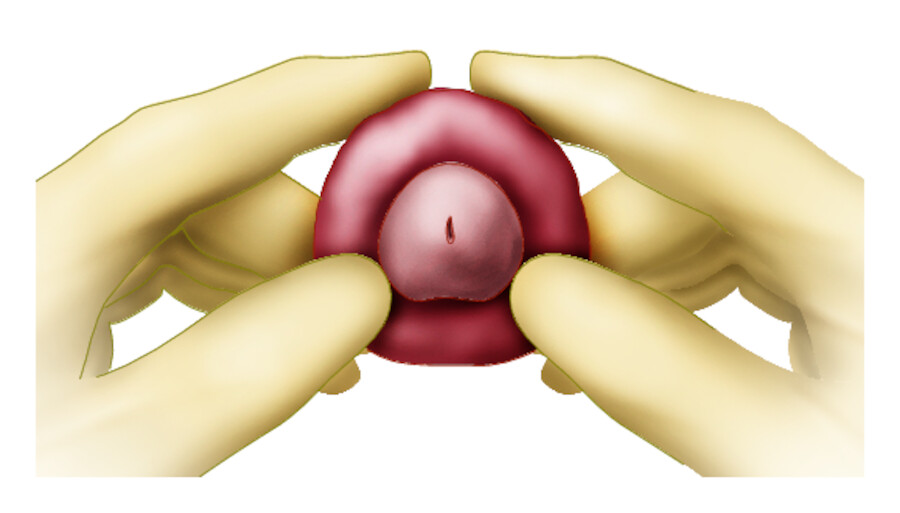
Eine ausgeprägte Paraphimose sollte immer durch den Arzt korrigiert werden. Hierbei wird die Eichel mit einem lokalanästhetischem Gel benetzt. Zeige- und Mittelfinger beider Hände fassen den Penis. Die beiden Daumen drücken dann bei gleichzeitiger Vorziehung der Vorhaut stempelartig nach unten ( ▶ Abb. 37.16).
Reposition einer Paraphimose durch Ausdrücken des Ödems und Zurückstreifen der Vorhaut.
Abb. 37.16
(Abb. nach: Sökeland J, Rübben H. Taschenlehrbuch Urologie; Thieme 2000)
37.5.3 Lern- und Leseservice
37.5.3.1 Literatur
[1910] Albers P, Heidenreich A. Standardoperationen in der Urologie. 2. Aufl. Stuttgart: Thieme; 2014
[1911] Schwegler J, Lucius R. Der Mensch. Anatomie und Physiologie. 6. Aufl. Stuttgart: Thieme; 2016
[1912] Sökeland J, Rübben H. Urologie. 14. Aufl. Stuttgart: Thieme; 2007
[1913] Sökeland J, Krieger M. Urologie. In: Oestreicher E, Burk A, Burk R et al. Hrsg. HNO, Augenheilkunde, Dermatologie und Urologie für Pflegeberufe. Stuttgart: Thieme; 2003: 260–343