33.3.2 Pflege- und Behandlungsplan
Ein Patient mit Glomerulonephritis muss sich mit der Bedrohung durch ein schwerwiegendes chronisches Leiden auseinandersetzen. Für die Pflegenden stehen begleitende und beratende Maßnahmen im Vordergrund.
Merke
Ein großer Teil der Patienten mit Glomerulonephritis wird im Laufe der Jahre die terminale Niereninsuffizienz erreichen und dialysepflichtig werden. Um den Zeitpunkt des Eintritts der Dialysepflicht möglichst weit hinauszuschieben, müssen die Umgebungsbedingungen für die Nieren optimiert werden (z. B. Blutdruck in den unteren Normalbereich senken, Proteinurie reduzieren).
33.3.2.1 Krankheitszeichen beobachten
Hier stehen Vitalzeichenkontrolle, Gewichtskontrolle und Bilanzierung im Vordergrund. Da sich Verschiebungen im Flüssigkeitshaushalt ergeben können, muss der Patient auf mögliche ▶ periphere Ödeme, ▶ hypertone Krisen sowie ein ▶ Lungenödem beobachtet werden.
Oft bemerkt der Patient körperliche Veränderungen selbst:
-
zunehmende Lidödeme
-
wachsender Bauchumfang
-
kleinere und dunklere (konzentriertere) Urinportionen
-
häufigere Blutdruckspitzen
-
Schlafen oft nur mit erhöhtem Kopfteil möglich
33.3.2.2 Mit Zukunftsängsten umgehen
Hier geht es vor allem um das veränderte Körpergefühl des Patienten sowie seinen Umgang mit der Prognose.
Körperliche Veränderungen lassen den Patienten fürchten, dass die Entzündung nicht ausheilt und chronisch wird. Die Information über Laborergebnisse kann für Patienten sehr wichtig werden. Die Patienten fürchten Dialysepflicht und ihre potenziellen Folgen:
-
veränderte Tagesstruktur
-
häufiges Durstgefühl
-
begrenzte Trinkmenge
-
Ernährungsbeschränkungen (kalium- und phosphatarme Kost)
-
Kreislaufveränderungen
-
Warten auf eine Spenderniere
-
vorzeitige Alterung
-
Veränderung sozialer Kontakte
-
Abhängigkeit von Professionellen des Medizinsystems
Praxistipp
Gesprächsbereitschaft, Information über medizinische und medizintechnische Möglichkeiten, das Angebot psychologischer Beratung sowie Kontakte zu Selbsthilfegruppen helfen, mit der Zukunftsangst umzugehen.
33.3.2.3 Gesundheitsberatung
Im Beratungsgespräch ist zunächst zu ermitteln, was der Patient über seine Erkrankung weiß und wie er damit umgeht:
-
An welchen Prinzipien orientiert der Patient sein Leben? Was ist ihm wichtig?
-
Weiß der Patient, dass Änderungen seiner Lebensgewohnheiten wesentlich zur Hemmung des Fortschreitens der Erkrankung beitragen können?
-
Wie schwer wird ihm eine Lebensumstellung fallen?
Praxistipp
Wird der Patient dazu beraten, seine bisherigen Gewohnheiten zu verändern, braucht er Wissen und Zeit, um sich mit der neuen Lebensweise vertraut zu machen. Ermutigen Sie den Patienten, sich vorzustellen, wie die Empfehlungen seinen Alltag beeinflussen werden.
Neben den Grundlagen der Gesundheitsberatung ( ▶ Abb. 33.10) sind vor allem Empfehlungen zur Diät wichtig:
Informationsblatt zur Gesundheitsberatung bei akuter Glomerulonephritis.
Abb. 33.10

-
Proteine: aufgenommene Eiweißmenge auf normales Maß (1 g/kg Körpergewicht) reduzieren (bei sich weiter verschlechternder Nierenfunktion 0,8 g biologisch hochwertiges Protein pro kg Körpergewicht)
-
Phosphatzufuhr: aufgenommene Phosphatmenge aus Fleisch und Milchprodukten vermindern
-
Azidose: Bikarbonat zum Ausgleich einer metabolischen Azidose scheint die Nierenfunktion zu schützen.
Praxistipp
Nutzen Sie die Konsiliarbesuche einer Diätassistentin, um einen Einblick in dieses wichtige therapeutische Angebot zu erhalten. Probieren Sie salzarme Nahrungsmittel.
Prävention und Gesundheitsförderung
Eine exzellente Einstellung des Blutdrucks verlangsamt das Fortschreiten der Nierenerkrankung. Geht die Erkrankung in eine chronische Form über, kann der Betroffene evtl. über Arbeitsversuche oder eine Umschulung im Arbeitsprozess bleiben. Gelegentlich ist eine Erwerbsunfähigkeit mit Frühberentung unvermeidlich. Regen Sie eine Beratung zu sozialrechtlichen Fragen an.
33.4 Pflege von Patienten mit urologischen Operationen
33.4.1 Medizinischer Überblick
33.4.1.1 Operationsformen
Niere Die häufigsten Indikationen für eine Teilentfernung (partielle Nephrektomie) bzw. eine komplette Entfernung (Nephrektomie) der Niere sind Nierentumore/-zysten, Eiternieren (Pyonephrose) aufgrund einer Infektion und Verletzungen des Nierengewebes wie Nierenrisse (Ruptur) bzw. Verletzungen der Nierenarterie oder -vene durch Traumen.
Harnleiter Der Harnleiter wird häufig zusammen mit anderen Organen (Niere, Harnblase) operiert. Allerdings können Steine bzw. Tumoren im Harnleiter endoskopisch mit einer Harnleiterspiegelung (Ureteroskopie) gesehen und auch behandelt werden.
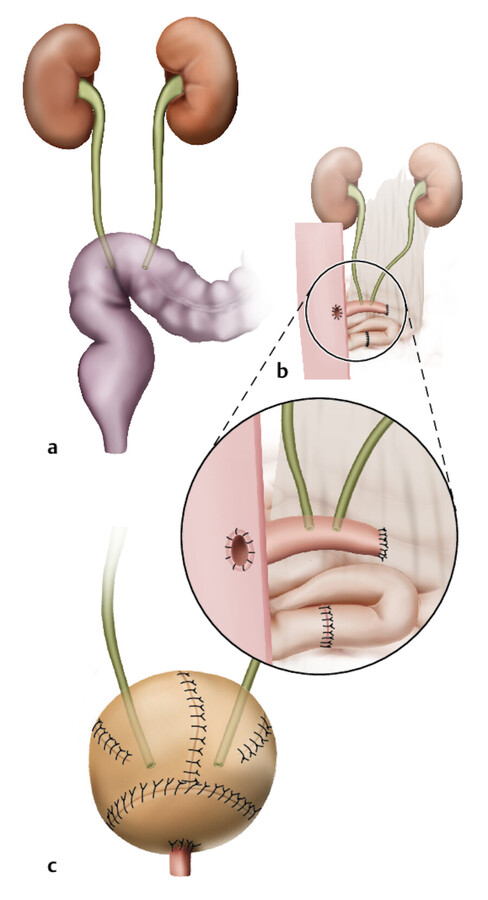
Harnblase Oberflächliche Harnblasentumore bzw. Blasensteine können endoskopisch entfernt werden. Fortgeschrittene Tumoren bzw. Harnblasendivertikel bedürfen einer Operation mit Bauchschnitt. Wenn die Harnblase aufgrund eines Tumors komplett entfernt werden muss, kann der Patient nicht mehr auf natürlichem Weg miktionieren. Es stehen mehrere Verfahren zur alternativen Urinableitung zur Verfügung ( ▶ Abb. 33.11):
Möglichkeiten der Harnumleitung.
Abb. 33.11 a Ureterosigmoidostomie, b Ileum-Conduit, c Ileum-Neoblase (nach Sökeland).
-
Ureterosigmoidostomie: Bei der Einpflanzung der Harnleiter in das Colon sigmoideum (Sigma) scheidet der Patient den Urin willkürlich über den Enddarm mit dem Stuhlgang aus (kontinente Harnableitung).
-
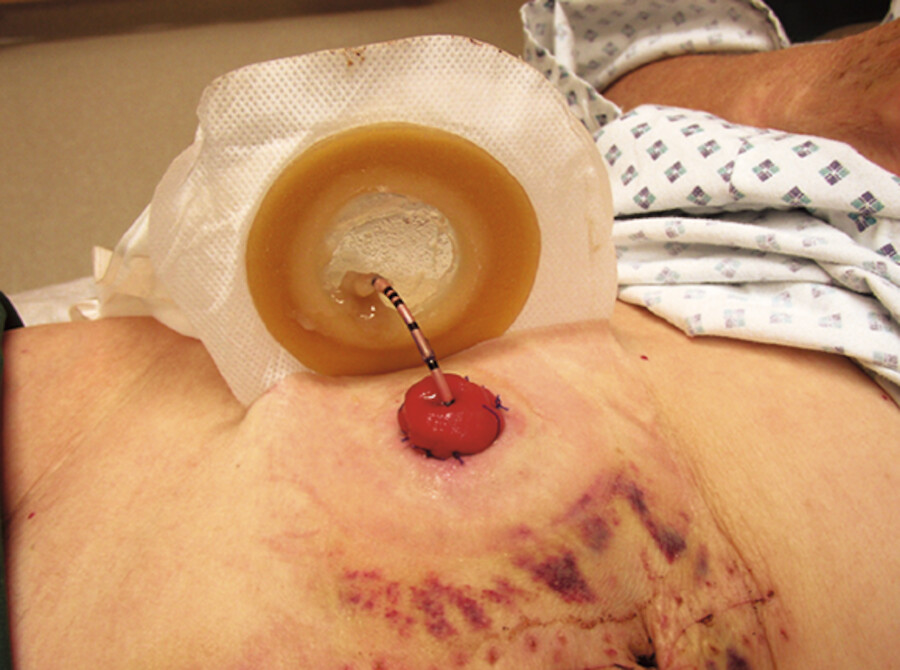
leum-Conduit: Bei der Einpflanzung der Harnleiter in ein ausgeschaltetes Dünndarmsegment wird der Urin über die Haut abgeleitet (Urostoma, ▶ Abb. 33.12). Der Patient benötigt als Urinreservoir einen Stomabeutel (inkontinente Harnableitung).
Urostoma nach Anlage eines Ileum-Conduits am 10. postoperativen Tag.
Abb. 33.12 Noch leitet ein sog. Splint den Urin in den Stomabeutel.
(Foto: M. Hoffmann, Thieme)
-
Ileum-Neoblase: Wird die Ersatzblase aus Dünndarm mit der Harnröhre verbunden, bleibt eine Miktion auf natürlichem Weg möglich. Bei einer Ersatzblase mit einem Ventilnippel über dem Bauchnabel (Nabelpouch) führt der Patient darüber postoperativ einen Selbstkatheterismus durch.
Harnröhre Eine Harnröhrenverengung (Striktur) wird endoskopisch behandelt. Bei Kindern können angeborene Harnröhrenklappen, selten auch Harnröhrendivertikel vorliegen. Die Harnröhre wird manchmal begleitend bei Verkehrsunfällen mit Beckenbrüchen oder im Rahmen einer Kathetereinlage verletzt.
33.4.1.2 Komplikationen
Sowohl in der Operation (intraoperativ) als auch nach der Operation (postoperativ) kann es zu Komplikationen kommen. Die häufigsten sind:
-
Blutung
-
Verletzung benachbarter Organe
-
Infektion
-
Verschlechterung/Verlust der Nierenfunktion
-
Anastomoseninsuffizienz (Stuhl-/Urinleckage)
33.4.2 Pflege- und Behandlungsplan
33.4.2.1 Präoperative Pflege
Präoperativ muss der Patient OP-gerecht rasiert werden („eher ein bisschen mehr als zu wenig“). Bei Anlage eines Ileum-Conduits wird die ideale Lokalisation für das Stoma auf der Haut markiert. Vor einer Operation mit Darmbeteiligung wird eine Darmreinigung empfohlen, insbesondere bei Operationen mit Dickdarmbeteiligung. Hierzu gibt es in den meisten urologischen Kliniken Standards und operationsspezifische Anordnungen zu Darmentleerung und Kostabbau. Der gesamte Darm sollte intraoperativ frei von Verdauungsresten sein, um das Infektionsrisiko zu senken.
33.4.2.2 Postoperative Pflege
Hier stehen Information (z. B. Häufigkeit von Kontrollen, Mobilisationsplan, Kostaufbau), Schmerztherapie sowie Maßnahmen zur Kontrolle und Unterstützung der Urinausscheidung im Vordergrund.
Schmerztherapie
Die Lage des Schnittes beeinträchtigt den Patienten in unterschiedlicher Weise. Trotz Schmerzmittelgabe kann ein Restschmerz verbleiben, der bei Bewegung spürbar wird. Er kann die Atmung beeinträchtigen, Positionswechsel im Bett verhindern und die Nachtruhe stören. Grundkenntnisse in der postoperativen Schmerztherapie sind für jede Pflegende unbedingt notwendig, z. B.:
-
Kombination von sog ▶ . zentralen und peripheren Analgetika
Urinausscheidung unterstützen
Flüssigkeitszufuhr und Urinausscheidung sollten bilanziert werden (Einfuhr/Ausfuhr). Letztere wird von folgenden Faktoren beeinflusst:
-
Lebensalter
-
Begleiterkrankungen
-
Infusionsmenge
Indirekt kann die Nierenfunktion durch Laborkontrollen (Kreatinin, Elektrolyte) und sonografische Kontrollen (Nierenstau) beurteilt werden. Unterschenkelödeme können ein Hinweis für eine verminderte Nierenfunktion sein.
Urinableitungen
Die Urinableitung über einen Dauerkatheter erfolgt entweder über die Niere (Nierenfistelkatheter) oder über die Harn-/Neoblase. Sie erfüllt folgende Funktionen:
-
Ableitung des Urins
-
Überwachung der Nierenfunktion
-
Schienung des Wundgebietes/der Anastomose (z. B. nach radikaler Prostatektomie)
-
Zufuhr von Spülflüssigkeit über ▶ einen Spülkatheter zur Verhinderung von Blutkoageln, z. B. nach einer Prostata-Operation
Komplikationen
Paravasation Ein Urinabgang am Katheter vorbei ist häufig. Bei größerem Urinverlust fühlt sich der Patient in seiner Lebensqualität beeinflusst. Häufig hilft es, den geblockten transurethralen oder suprapubischen Katheter etwas anzuziehen, damit sich der Katheterballon vor die Eintrittsstelle des Katheters legt. Auch kleine „Schleifchen“ – aus Mullkompressen am Katheter angebracht – können Urin aufnehmen. Sie müssen regelmäßig gewechselt werden.
Verstopfter Katheter Manchmal ist die Paravasation aber ein Hinweis dafür, dass kein Urin mehr durch den Katheter fließen kann; z.B. durch eine Verstopfung. Hier handelt es sich um eine Akutsituation, bei der der Patient Schmerzen und das Gefühl hat, dringend miktionieren zu müssen, aber nicht zu können. Ursachen für eine schlechte Durchgängigkeit können sein:
-
technische Handhabungsfehler (abgeklemmte oder abgeknickte Schläuche),
-
Blutkoagel, Harngries oder Schleim im Katheter,
-
Katheterspitze liegt an der Harnblasenwand an.
Zunächst sollte die Lage der Urinableitungen überprüft werden. Die Veränderung der Position des Katheters durch vorsichtige Manipulation kann die Beschwerdesymptomatik des Patienten bereits deutlich lindern. Zum Anspülen wird eine Blasenspritze und eine Schale mit Kochsalz gerichtet und der Urologe kontaktiert.
Merke
Ausgeschaltete Darmsegmente bei Harnumleitungsoperationen bilden weiter Schleim, der den Katheter verstopfen kann. Informieren Sie den Urologen, wenn Sie eine Verstopfung feststellen. Es muss geklärt werden, wo der gestaute Urin verbleibt.
Entfernen der Ableitungen Harnleiterschienen und Katheter sind Fremdmaterialien, die die Infektionsgefahr für den Patienten erhöhen, wenn sie zu lange liegen. Für das Ziehen der Schienen bzw. Katheter muss oftmals nur ein Haltefaden gelöst werden und/oder ein Blockungsballon entleert werden.
Merke
Überprüfen Sie nach der Entfernung des Katheters die Fähigkeit zur Miktion. Beobachten Sie den Urin auf mögliche Nachblutungen durch Schleimhautverletzungen, die durch das Ziehen entstanden sind.
Urostoma versorgen
Die äußere Versorgung des Urostomas wird mit speziellen Materialien durchgeführt. Eine optimale Stomaversorgung ist nur in Zusammenarbeit mit einem Stomatherapeuten zu erreichen.
Fallbeispiel
Vor 5 Tagen wurde Herrn Schneider aufgrund eines Tumors die Blase entfernt und eine Neoblase angelegt. Am ersten Tag nach der Operation ging es ihm gut, doch schon am zweiten Tag klagte er über Unwohlsein, Blähungen und Atemnot. Die Magensonde förderte galliges Sekret, an eine Nahrungsaufnahme mag Herr Schneider gar nicht denken. Abgeführt hat er auch noch nicht und seit heute Morgen ist sein Bauch richtig hart und schmerzt, wenn man ihn berührt.
Beim Auskultieren mit dem Stethoskop hört Stationsarzt Dr. Magerwall keine Darmgeräusche. Er schaut sich den Verlauf der Entzündungswerte des Patienten an: steigend in den letzten 3 Tagen! Eine Röntgenübersichtsaufnahme zeigt Luft im Bauchraum. Die Operation, die sehr bald durchgeführt wird, bestätigt die Verdachtsdiagnose: akutes Abdomen durch eine Nahtinsuffizienz mit Stuhlleckage. Zum Glück kann der Patient erfolgreich operiert werden.
33.4.2.3 Gesundheitsberatung
Die Verfassung der Patienten bei der Entlassung kann sehr unterschiedlich sein. Einerseits sind viele Patienten nahezu frei von Beschwerden, andererseits bestehen bei Tumorpatienten häufig über die Entlassung hinaus sowohl physische als auch psychische Probleme. Bei der Entlassung sollte der Patient so weit beraten sein, dass er
-
auf seine Urinableitung eingestellt (z. B. sein Urostoma selbst versorgen kann),
-
über Ernährung und körperliche Schonung aufgeklärt sowie
-
über Selbsthilfegruppen informiert ist.
Körperbildveränderungen Der operative Ersatz für die Blasenfunktion verändert die Lebensgewohnheiten des Patienten. Der Patient kann den Urinfluss nicht mehr mithilfe der Blase kontrollieren und muss bei der Trinkmenge auf die Füllungsgrenzen der Ersatz-Urinsammelsysteme achten. Wie erlebt ein Patient seinen Körper, wenn er zukünftig mit Stomabeuteln oder „Schläuchen“ leben muss?
Praxistipp
Berücksichtigen Sie verbale und nonverbale Signale des Patienten oder der Angehörigen bei der Versorgung des Urostomas. Hält der Patient Abstand, spreizt er die Finger ab, zeigt sich Abscheu im Gesicht? Bieten Sie dem Patienten Informationsmaterial zu Selbsthilfegruppen an.
Sexualität „Auch wenn ein Mensch durch seine Erkrankung oder deren Behandlung in seiner Fähigkeit eingeschränkt ist, einen Koitus zu vollziehen, heißt es nicht, dass er über keine Sexualität mehr verfügt“ (Zettl u. Hartlapp 1996).
Ein zärtlicher, intimer Körperkontakt und Geschlechtsverkehr ist mit einer instrumentellen Harnableitung je nach Katheterlokalisation in unterschiedlichem Maße möglich. Selbstbefriedigung mit liegendem Katheter in der Harnröhre ist bei der Frau möglich. Beim Mann ist sie dagegen wegen der Verletzungs- und Blutungsgefahr aus urologischer Sicht zu vermeiden.
Praxistipp
Gespräche über Sinnlichkeit und sexuelle Erlebnisfreude sind im Krankenhaus nur unter erschwerten Bedingungen zu führen. Greifen Sie dennoch die Ängste der Patienten auf und ermöglichen Sie ein Gespräch mit einer gleichgeschlechtlichen Pflegeperson.
33.5 Pflege dialysepflichtiger Patienten
33.5.1 Medizinischer Überblick
33.5.1.1 Definition
Definition
Als Dialyse (griech.: Auflösung) bzw. als Dialysebehandlung im physikalischen Sinn wird ein Vorgang bezeichnet, durch den Urämietoxine, wasserlösliche Substanzen und/oder Wasser über extra- oder intrakorporale Membranen mittels Diffusion, Ultrafiltration und Konvektion aus dem Körper entfernt werden. Gleichzeitig erfolgt die Regulation des Säure-Basen- und Elektrolyt-Haushaltes.
Physikalische Wirkprinzipien
Die Dialyse fußt auf physikalischen Wirkungsprinzipien ( ▶ Abb. 33.13). Je nach Spezifikation der unterschiedlichen Nierenersatzverfahren kommen diese Prinzipien zum Einsatz.
Diffusion Dieses Hauptprinzip der Dialyse ist auf den Konzentrationsausgleich von gelösten Stoffen zwischen Orten unterschiedlicher Konzentration zurückzuführen. Der Ausgleich geschieht durch eine semipermeable Membran – welche für Substanzen unterschiedlicher Größe durchlässig ist. Dabei wandern die Substanzen vom Ort der höheren zum Ort der niedrigeren Konzentration.
Dialyse.
Abb. 33.13 a Nur niedermolekulare Substanzen können durch die semipermeable Membran übertreten. Treibende Kraft ist das Konzentrationsgefälle. b Über die Dialysemembran können dem Körper sowohl harnpflichtige Substanzen als auch Flüssigkeit entzogen werden.
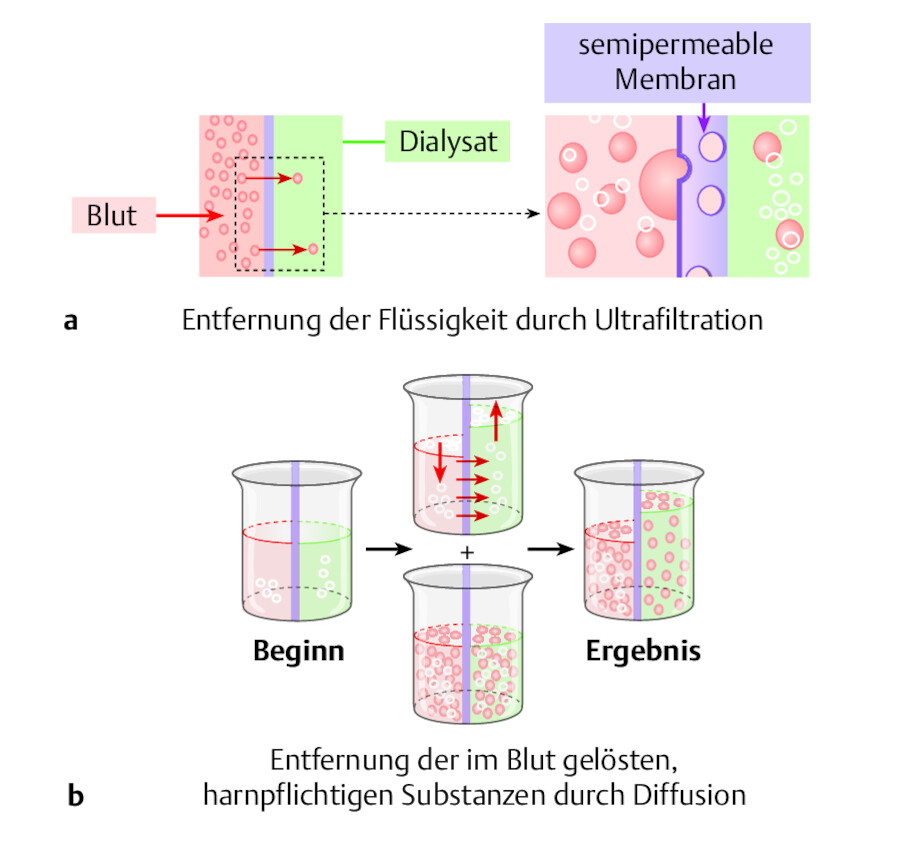
Osmose Befindet sich zwischen 2 Lösungen mit unterschiedlicher Konzentration gelöster Stoffe eine Membran, die vom Lösungsmittel, nicht aber von den gelösten Teilchen passiert werden kann, so entsteht eine Druckdifferenz. Diese führt zum Übertritt des Lösungsmittels vom Ort der niedrigeren zum Ort der höheren Konzentration
Ultrafiltration Dies bezeichnet den Transport von Flüssigkeit durch eine semipermeable Membran infolge einer Druckdifferenz. Vergleichen lässt sich dies mit dem Abpressen von Primärharn im Glomerulum. Die Flüssigkeit wird vom Ort des höheren Drucks zum Ort des niedrigeren Drucks transportiert.
Konvektion Werden bei der Ultrafiltration gelöste Teilchen durch die Membran mit hindurchtransportiert, spricht man von konvektivem Transport.
33.5.1.2 Nierenersatzverfahren
Für die Therapie von Patienten mit akutem und chronischem Nierenversagen stehen verschiedene Nierenersatzverfahren zur Verfügung:
-
Hämodialyse (HD)
-
Hämofiltration (HF)
-
Hämodiafiltration (HDF) als Kombination von Hämofiltration und Hämodialyse
-
Peritonealdialyse (PD)
Hämodialyse (HD)
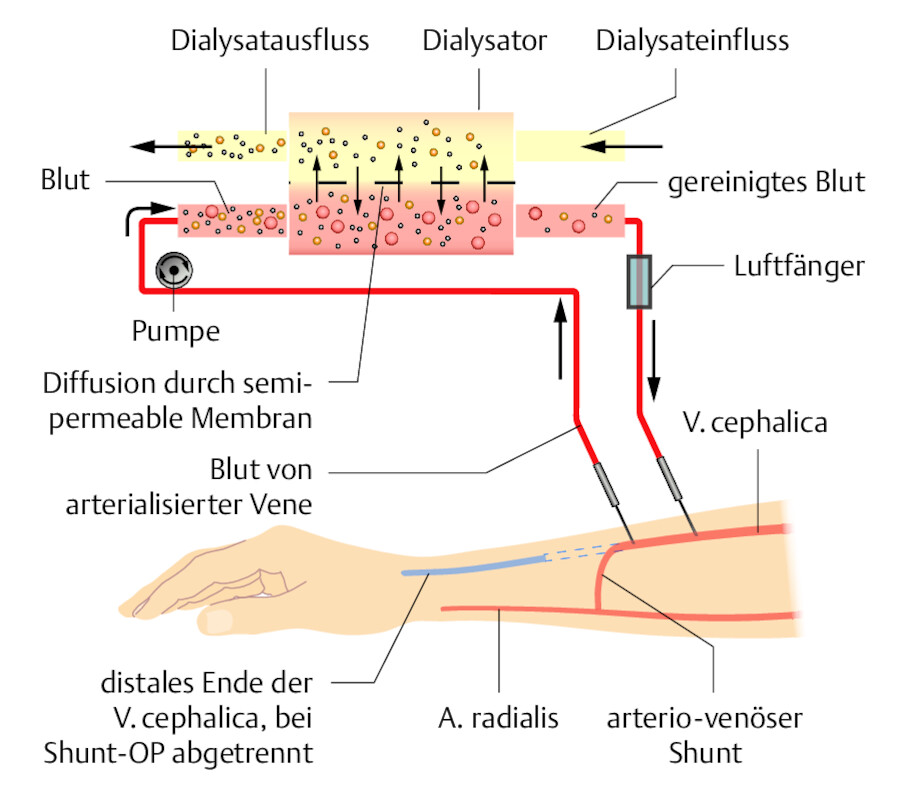
Bei der Hämodialyse wird der Stoffaustausch im Wesentlichen durch Diffusion bestimmt und hängt von der Durchlässigkeit der Membran (Permeabilität) für die jeweilige Substanz und dem Konzentrationsgefälle zwischen Blut und Dialysierflüssigkeit ab. Die Permeabilität der Membran für die jeweilige Substanz resultiert aus der Molekülgröße, der Größenverteilung der Membranporen und der Wandstärke der Membran. Harnpflichtige Substanzen wie Kreatinin, Harnstoff und Elektrolyte können aus dem Blut des Patienten durch diese Membran in die Dialyseflüssigkeit übertreten. Das Wasser tritt nur über, wenn Druck ausgeübt wird oder osmotische Kräfte wirken ( ▶ Abb. 33.14).
Schema des extrakorporalen Blutkreislaufs.
Abb. 33.14
Hämofiltration (HF)
Definition
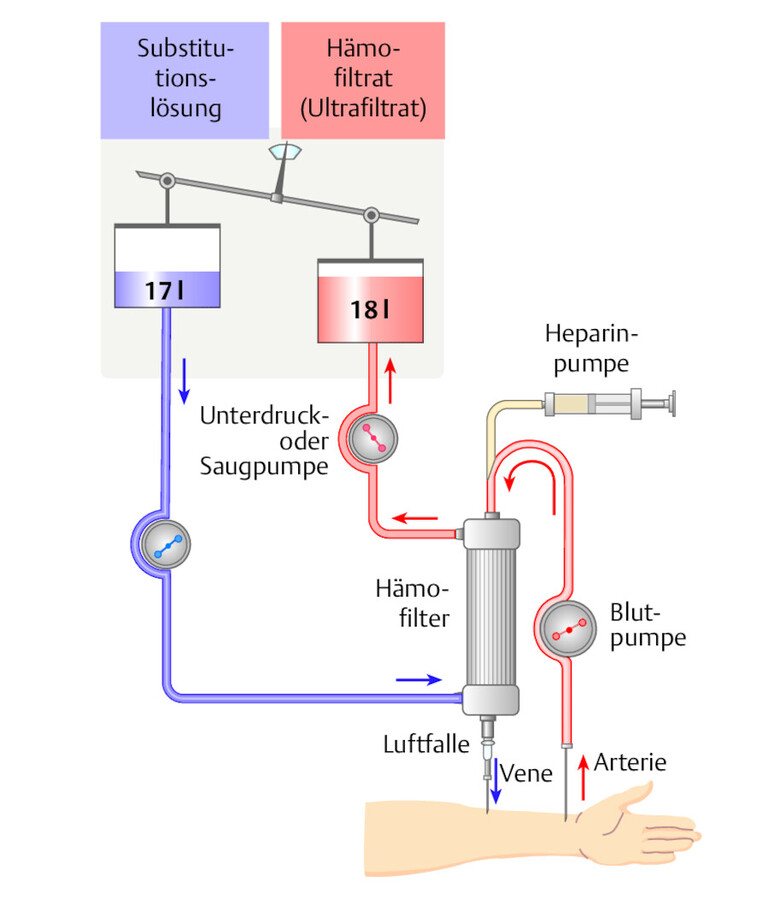
Mit der Hämofiltration wird dem Blut Flüssigkeit entzogen. Die Clearance (Klärung, Reinigung) von gelösten Teilchen erfolgt konvektiv aufgrund eines über eine Pumpe angelegten Druckgradienten an der Filtermembran (Ultrafiltration). Durch diesen transmembranen Fluss werden auch alle filtergängigen Teilchen mitentfernt. Das abgepresste Ultrafiltrat wird durch sterile Elektolytlösung (Substituat) ersetzt ( ▶ Abb. 33.15).
Der Stoffaustausch bei der Hämofiltration erfolgt ausschließlich durch Konvektion: Wasser und die darin gelösten Substanzen werden mit Hilfe eines hydraulischen Druckgradienten durch die Membranporen gepresst. Mit zunehmender Molekülgröße entsteht ein Siebungseffekt, d.h., die Konzentration im Filtrat wird kleiner als die im Plasma. Für die Hämofiltration geeignete Membranen sollen einen hohen Ultrafiltrationskoeffizienten (> 20 ml/mmHg pro Std.) aufweisen.
Hämofiltration.
Abb. 33.15 Werden 18 l Blut filtriert und nur 17 l durch die Infusion substituiert, entspricht dies einem Flüssigkeitsentzug von 1 l.
Hämodiafiltration (HDF)
Durch die Kombination von Hämodialyse und Hämofiltration werden die Vorteile der Diffusion bei der Elimination kleinmolekularer Substanzen und der Konvektion bei der Elimination höhermolekularer Substanzen gleichzeitig genutzt.
Peritonealdialyse (PD)
Bei diesem Verfahren erfolgt der Stoffaustausch über das Peritoneum, das dabei als natürliche, semipermeable Membran dient ( ▶ Abb. 33.16). Zu diesem Zweck wird eine sterile und pyrogenfreie Dialysierflüssigkeit über einen Katheter in die Bauchhöhle instilliert. Der Flüssigkeit sind osmotisch wirksame Substanzen beigemischt, durch deren Wirkung dem Patienten das überschüssige Körperwasser entzogen wird. Für Patienten mit hochgradiger Herzinsuffizienz und Niereninsuffizienz hat sich die PD in den letzten Jahren als ein erfolgreiches Verfahren etabliert, das der konservativen Therapie und der Hämodialyse in Abhängigkeit von der Indikation und klinischen Gegebenheiten überlegen sein kann. Man unterscheidet die PD-Verfahren danach, ob sie ohne oder mit Hilfe einer Maschine durchgeführt werden.
Definition
Bei der Peritonealdialyse (PD) dient das Bauchfell als Dialysemembran. Das sterile Dialysat wird mit einem Katheter in die Bauchhöhle eingebracht. Man unterscheidet zwischen der kontinuierlichen ambulanten (CAPD) und der automatischen Peritonealdialyse (APD).
Abb. 33.16 Funktionsprinzip der kontinuierlichen ambulanten Peritonealdialyse (CAPD).
33.5.1.3 Dialysezugänge
Definition
Ein Shunt ist eine subkutane, gefäßchirurgisch angelegte Kurzschlussverbindung zwischen einer Armarterie und einer Vene. Er dient dem Anschluss des Patienten an das Dialysegerät sowie als Zugang zum Blutkreislauf. Über einen Shunt werden dem Patienten pro Minute 200–300 ml Blut entnommen und gereinigt wieder retransfundiert.
Nativer Hämodialyseshunt Der primär anzustrebende Gefäßzugang für die chronische Hämodialyse ist die (arteriovenöse) AV-Fistel, typischerweise in Form einer Anastomose zwischen Arteria radialis und Vena cephalica, auch als Cimino-Shunt bezeichnet ( ▶ Abb. 33.17). Der Dialyseshunt sollte nach vorangegangener Venenschonung und gemeinsamer Planung mit dem Shuntoperateur so frühzeitig angelegt werden, dass die erste Dialyse über diesen Shunt erfolgen kann.
Prothesenshunt Sind die körpereigenen Gefäße zur Shuntanlage nicht geeignet, wird als zweitbeste Möglichkeit die Anlage eines Prothesenshunts unter Verwendung von synthetischem Material wie Polytetrafluorethylen (PTFE) möglich. Nachteile solcher Shunts sind die höheren Infektionsraten und die größere Stenose- und Verschlusswahrscheinlichkeit.
Merke
Am Shuntarm sollte kein Blutdruck gemessen oder eine Venenpunktion zur Injektion oder Blutentnahme vorgenommen werden. Die Funktion eines intakten Shunts ist nicht hoch genug einzuschätzen.
Zentralvenöser Dialysekatheter Besteht keine Möglichkeit, eine AV-Fistel oder einen Prothesenshunt anzulegen, so muss als Dialysezugang ein zentralvenöser Katheter implantiert werden. Nicht getunnelte Katheter werden zur Verwendung über wenige Wochen, getunnelte Katheter mit subkutaner Muffe zur längeren Nutzung gewählt. Letzteres ist insbesondere bei schwerer Herzinsuffizienz, Steal-Syndrom und bei dauerhafter motorischer Unruhe bei verwirrten Patienten der Fall.
Zentralvenöse Katheter haben gegenüber AV-Fisteln und Prothesenshunts entschiedene Nachteile. Trotz Einführung spezieller Blocklösungen ist die Rate der Bakteriämien mit schweren Komplikationen deutlich höher. In jedem Fall ist bei Verwendung zentralvenöser Katheter auf strikte Hygienemaßnahmen im Rahmen der Konnektion und Diskonnektion zu achten.
Hämodialyseshunt.
Abb. 33.17 a Cimino-Shunt mit liegenden arteriellen und venösen Kanülen. Die Pfeile deuten die Flussrichtung an. b Venöse und arterielle Kanülen sind genau gekennzeichnet.
(Foto: M. Hoffmann, Thieme)

Praxistipp
Grundsätzlich sollten Blutentnahmen bei Dialysepatienten nur aus Handrückenvenen vorgenommen werden, um die wertvollen Venen des Unterarms und der Ellenbeuge für operative Shunts zu schonen.
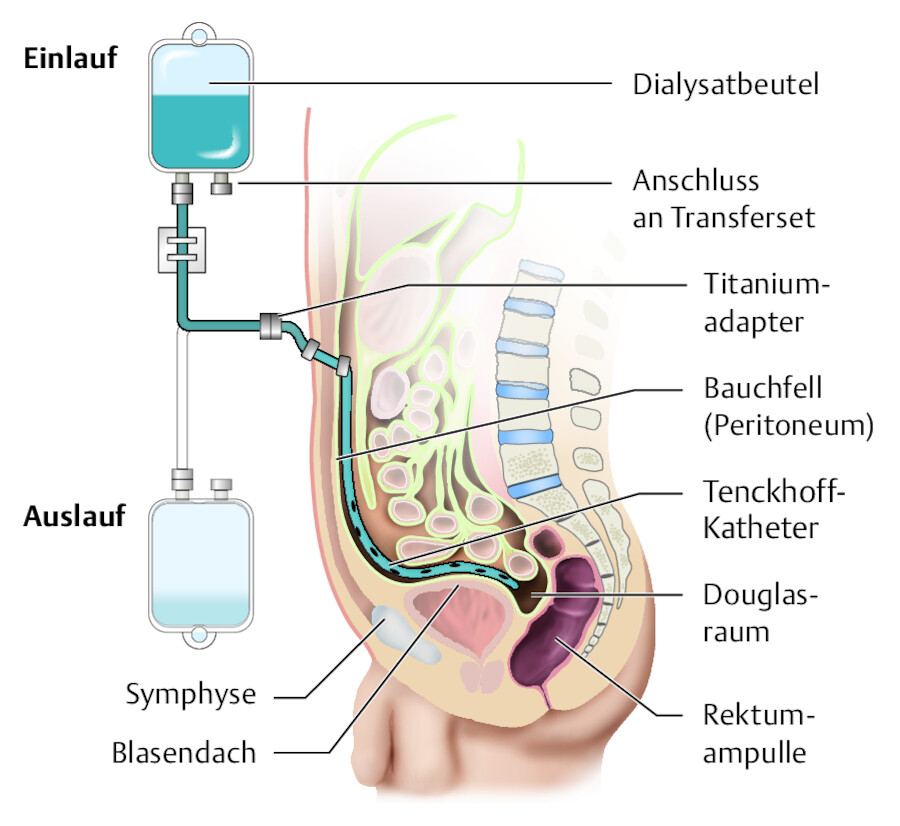
Zugang bei der Peritonealdialyse Bei diesem Verfahren erfolgt der Stoffaustausch wie bereits erwähnt über das Peritoneum (Bauchfell). Der Katheter wird chirurgisch oder endoskopisch in die Bauchhöhle implantiert ( ▶ Abb. 33.18). Die Spitze des Katheters liegt dabei im tiefsten Punkt des Beckens, im Douglas-Raum. An den Durchtrittsstellen besitzt der Katheter 1 oder 2 Dacron-Filzmuffen (cuffs), die ins Bindegewebe einwachsen. So entsteht eine Haltefunktion und Barriere, die Keimen das Eindringen erschwert und die Katheteraustrittsstelle (KAST) wasserdicht verschließt.
Abb. 33.18 Peritonealdialysezugang.
a Lage eines Peritonealdialysekatheters in der Bauchdecke in schematischer Darstellung. b Blick auf die Bauchdecke.

33.5.1.4 Indikationen für eine Dialysebehandlung
Die Indikation für die Aufnahme einer Dialysebehandlung wird unter Berücksichtigung des Lebensalters, des Allgemeinzustandes, klinischer Zeichen der Urämie, der Co-Morbidität und der Laborwerte getroffen. Die Entscheidung, eine solche Nierenersatztherapie zu beginnen, ist immer eine Individualentscheidung für den einzelnen Patienten. Maßgebend ist hier das Absinken der Nierenfunktion in das dialysepflichtige Stadium (Funktion < 15% einer gesunden Niere) und/oder das Auftreten klinischer Zeichen einer Urämie wie:
-
diätetisch und medikamentös nicht beeinflussbare Hyperkaliämie
-
medikamentös nicht korrigierbare metabolische Azidose
-
therapieresistente Hypertonie
-
Verschlechterung des Allgemeinzustandes unter urämischer Symptomatik (z.B. Appetitmangel, gastrointestinale Symptomatik mit epigastrischen Schmerzen, Übelkeit, Erbrechen, Diarrhö, urämische Perikarditis, Perikarderguss, Pruritus)
-
Mangelernährung, Katabolismus
-
schwere urämische Neuropathie
-
kardiorenales Syndrom mit nicht beherrschbarer Überwässerung
Fallbeispiel
Der 50-jährige Eduardo Ferrara klagt beim Hausarzt: „Ich fühle mich schlapp und müde und habe ständig Kopfschmerzen. Meiner Frau fiel in unserem Urlaub auf, dass ich immer blass blieb.“ Die körperliche Untersuchung ergibt ein „normales" Urinzeitvolumen, eine Urinkonzentration um 300 mosmol/kg, eine deutliche Erhöhung der Kreatininkonzentration im Plasma auf den 10-fachen Wert der Norm, eine Hypertonie mit diastolischer Blutdruckerhöhung und eine ausgeprägte Blutarmut (Anämie). Im Ultraschall werden kleine Nieren (Schrumpfnieren) festgestellt. Herr Ferrara gibt an, mehrmals an eitrigen Anginen (Infektion der Gaumenmandeln) erkrankt gewesen zu sein. Da mit den eingeleiteten konservativen Maßnahmen wie Diät und harntreibenden Mitteln die Symptome der Harnvergiftung nicht mehr zu kontrollieren sind, wird schließlich die Therapie mit der künstlichen Niere eingeleitet.
Praxistipp
Verschlechtert sich die Nierenfunktion trotz Therapie weiter und ist daher eine Dialysebehandlung abzusehen, sollte frühzeitig ein Shunt angelegt werden.
33.5.1.5 Diagnostik
Laborchemische (Serum-Kreatinin-Werte, Harnstoff, Kalium) und klinische Untersuchungen (EKG) weisen auf eine eventuell notwendige Dialyse hin. Je nach Befund und glomulärer Filtrationsrate wird die chronische Nierenerkrankung in 5 Stadien eingeteilt ( ▶ Tab. 33.4 ).
|
Stadium |
GFR |
Nierenfunktion |
|
G1 |
> 90 |
normal oder hoch |
|
G2 |
60–89 |
leicht erniedrigt |
|
G3a |
45–59 |
leicht bis moderat erniedrigt |
|
G3b |
30–44 |
moderat bis stark erniedrigt |
|
G4 |
15–29 |
stark erniedrigt |
|
G5 |
< 15 |
Nierenversagen |
33.5.1.6 Komplikationen
Gefürchtete Komplikationen bei der Dialyse sind:
-
Hyper- und hypotensive Kreislaufprobleme, z.B. Flüssigkeitsentzug
-
Muskelkrämpfe
-
Herzrhythmusstörungen bei Hypo- oder Hyperkaliämie
-
Dysäquilibrium
-
Shuntinfektionen
-
allergische Reaktionen
-
Infektionen der Katheteraustrittsstelle
-
blutübertragene Infektionen
-
Notfälle während der Dialyse (z. B. Blutungen an der Punktionsstelle, Herzstillstand)
-
Störungen des Dialysegerätes
33.5.2 Patienten während der Dialyse betreuen
Eine Hämodialyse/Hämofiltration/Hämodiafiltration findet in der Regel 3-mal wöchentlich für 4–5 Stunden (z.B. Di/Do/Sa) statt.
33.5.2.1 Vorbereitung
Vor Beginn der Dialyse muss das Gewicht des Patienten kontrolliert werden, möglichst immer auf derselben Waage und mit gleichartiger Kleidung. Ebenso müssen Blutdruck und Puls gemessen und die aktuelle physische und psychische Situation des Patienten beurteilt werden.
Funktionsprüfung des Shunts Um die Strömungsaktivität in dem künstlich angelegten Gefäß festzustellen und einen evtl. Shuntverschluss zu erkennen, muss die Funktion des Shunts täglich geprüft werden. Die Kontrolle der Füllung, des Shuntverlaufs und der Platzierung der letzten Punktionsstelle erfolgt u.a. durch:
-
Inspektion
-
Palpation (leichtes Auflegen der Fingerspitzen)
-
Auskultation mit einem Stethoskop („Rauschen“ und „Schwirren“)
-
Ultraschall durch speziell geschultes Personal (Fisteldiagnostik)
33.5.2.2 Durchführung
Punktion Vor der Punktion des Shunts wird eine Hautdesinfektion mit einem alkoholischen Desinfektionsmittel und sterilen Tupfern durchgeführt (Einwirkzeit beachten).
Merke
Eine Rasur der Körperbehaarung im Bereich des Shunts ist kontraindiziert, da sie die ▶ Infektionsgefahr durch Mikroläsionen erhöht.
Anschließend wird der Zugang zum extrakorporalen Kreislauf hergestellt durch die Punktion des arteriovenösen Shunts oder des zentralvenösen Hämodialysekatheters. Anschließend wird er an das extrakorporale System angelegt. Um das Gerinnen im Filtersystem zu vermeiden, wird der Patient antikoaguliert.
Kreislaufkontrollen während der Dialyse Blutdruck und Herzfrequenz werden stündlich – bei Bedarf auch häufiger – kontrolliert und im Dialyseprotokoll dokumentiert. Während der Hämodialyse können akute medizinische Notfälle auftreten. Hierzu gehören:
-
hypotensive oder hypertensive Krisen (akuter Blutdruckabfall oder -anstieg)
-
Brady- oder Tachykardien, Rhythmusstörungen (Hinweis auf einen nicht physiologischen Kaliumgehalt des Blutes)
-
akuter Schmerz
-
akute Atemnot
-
zerebraler Krampfanfall
Daher muss eine regelmäßige Kontrolle der dialysespezifischen Parameter mit Dokumentation gewährleistet sein.
Merke
Das Beheben apparativer Störungen während der Hämodialyse bleibt Pflegepersonen mit einer Fachweiterbildung vorbehalten.
Dialyse beenden Zum Ende der Dialyse wird dem Patienten sein Blut retransfundiert. Die Kanülen werden vorsichtig entfernt und korrekt entsorgt. Die Punktionsstellen werden wegen der Blutungsgefahr bis zu 20 Min. lang mit sterilen Tupfern komprimiert und steril verbunden. Bei zentralvenösen Dialysekathetern wird der Katheter nach Abschluss der Dialyse mit einer Blocklösung unter aseptischen Bedingungen verschlossen.
Kontinuierliche Verfahren in der Intensivpflege
Bei Patienten mit Akutem Nierenversagen (ANV) wird in der Intensivtherapie das Nierenersatzverfahren kontinuierlich über längerem Zeitraum durchgeführt. Diese Behandlungsart ist kreislaufschonender, da sich der Flüssigkeitsentzug und der Elektrolytausgleich auf einen längeren Zeitraum erstreckt. Dabei stehen alle beschriebenen Verfahren zur Auswahl.
33.5.2.3 Heimdialyse
Insbesondere für berufstätige Patienten kann ein Heimverfahren vorteilhaft sein, da es i.d.R. eine größere Unabhängigkeit ermöglicht. Die Heimdialyse wird unter kontinuierlicher medizinischer und pflegerischer Betreuung durch einen erfahrenen Nephrologen und speziell weitergebildete Fachpflegekräfte mit 24-stündiger Rufbereitschaft als Hämodialyse oder als Peritonealdialyse durchgeführt. Für beide Heimdialyseverfahren ist ein intensives Dialysetraining erforderlich, um den Ablauf der Behandlung zu verstehen, die Durchführung zu üben und beherrschen zu lernen. Erfahrungen zeigen, dass aufgrund der intensiven Eigenverantwortung des Dialysepatienten typische Behandlungskomplikationen wesentlich seltener auftreten.
Praxistipp
Bei der Heimhämodialyse ist im Unterschied zur Peritonealdialyse ein unterstützender Partner notwendig. Dieser muss mit der Bedienung des Geräts und dem Ablauf der Dialyse vertraut sein und in kritischen Situationen zuverlässig handeln können.
Fallbeispiel
Die Dialyse im Zentrum lief von Anfang an ohne größere Probleme. Ein paar Mal stieg der Venendruck etwas an, aber die Probleme waren in den Griff zu kriegen. Für mich und meine Frau stand fest, dass – wenn keine Probleme mehr auftreten – wir Heimdialyse machen. So kann ich mir eine gewisse Unabhängigkeit erhalten. Meine Frau war von Anfang an im Dialysezentrum dabei und hat den Umgang mit der Maschine und das Punktieren des Shunts gelernt.
Seit dieser Zeit wird immer zuhause dialysiert und wir haben es bisher nicht bereut. Ich gehe seit diesem Zeitpunkt auch wieder ganz normal zur Arbeit. Da ich auch immer Samstag oder Sonntag dialysiere (intensivierte tägliche Dialysebehandlung) findet unser Fernsehabend eben im „Dialysezimmer“ statt, an dem sich auch unser 10-jähriger Sohn beteiligt. Natürlich muss meine Ehefrau die Zeit aufbringen und die Verantwortung übernehmen (Groß 2007).
33.5.2.4 Peritonealdialyse (PD)
CAPD Bei der kontinuierlichen ambulanten Peritonealdialyse (engl.: CAPD) diffundieren 24 Stunden täglich harnpflichtige Substanzen, Urämietoxine sowie Elektrolyte und Flüssigkeit über das Bauchfell vom Blut des Patienten ins Dialysat. Durch ca. 4–5-maliges Wechseln der Peritonealdialyseflüssigkeit am Tag kann ein hohes Konzentrationsgefälle zwischen Blut und Dialysat aufrechterhalten werden. Es findet eine kontinuierliche Entgiftung statt. Ein notwendiger Wasserentzug wird durch die Zugabe von osmotisch wirksamen Substanzen gesteuert.
APD Bei der automatischen Peritonealdialyse wird der Patient mit einem sog. Cycler behandelt. Dieses Gerät führt den Ein- und Auslauf mit einer programmierten Spüllösungsmenge durch. Die Verweilzeiten betragen 30–240 Minuten. Die Behandlungsdauer beträgt 6–12 Stunden. Das Dialyseregime wird individuell auf den Patienten abgestimmt. Viele Berufstätige und aktive Patienten ziehen diese Behandlung der CAPD vor.
Besondere pflegerische Schwerpunkte bei der PD
Zur Prophylaxe von Infektionen bei der Peritonealdialyse ist ein standardisiertes Vorgehen beim Wechsel der Dialyseflüssigkeit und bei der Pflege der Katheteraustrittsstelle erforderlich. Peritonealdialysepatienten müssen ausführlich zur hygienischen Handhabung des Verfahrens und des Peritonealkatheters geschult werden. Sie müssen darüber informiert sein, sich bei Trübungen des Dialysats und/oder abdominellen Schmerzen unverzüglich mit ihrem behandelnden Arzt in Verbindung zu setzen.
Merke
Besonders bei der Peritonealdialyse ist Handhabung der Händehygiene mit die wichtigste Maßnahme zur Infektionsprophylaxe.
Nicht vollständig epithelialisierte Katheteraustrittsstellen werden mit einem sterilen Verband abgedeckt. Zudem müssen die Katheteraustrittsstelle und der sog. Tunnel regelmäßig kontrolliert werden, um Infektionen rechtzeitig erkennen zu können.
33.5.3 Infektionsprophylaktische Maßnahmen
Infektionen sind die häufigsten Komplikationen bei der Hämo- und Peritonealdialyse. Um ihnen vorzubeugen, sind folgende Maßnahmen wichtig:
-
hygienischer Umgang mit der Dialysierflüssigkeit
-
hygienischer Umgang mit dem Shunt bzw. der Katheteraustrittsstelle
-
Vorbeugung blutübertragbarer Infektionen
33.5.3.1 Hygiene der Dialyseflüssigkeit
Zur Produktion der Dialysierflüssigkeit ist keimarmes, pyrogenfreies und entionisiertes Wasser erforderlich (= Permeat), als Aufbereitungsverfahren gilt die Umkehrosmose. Zur Herstellung der fertigen Dialysierflüssigkeit werden dem Permeat im Dialysegerät eine spezielle konzentrierte Elektrolytlösung und Puffersubstanzen zugeführt.
Der Herstellungsprozess der Dialysierflüssigkeit wird regelmäßig nach einem festgelegten Hygieneplan in einem validierten Verfahren auf Verkeimung und Endotoxine hin überprüft. Die Überprüfung erfolgt durch speziell geschultes Hygienefachpersonal.
Merke
Auf das mit Endotoxin kontaminierte Dialysat reagieren die Patienten mit Fieber, Schüttelfrost, Blutdruckabfall und evtl. Kopfschmerzen und Übelkeit. Diese können 1–5 Std. nach Beginn der Behandlung auftreten.
Die PD-Lösung wird industriell gefertigt und wird nicht gesondert aufbereitet. Sie liegt als sterile und pyrogenfreie Lösung in verschiedenen Glukose- und Elektrolykonzentrationen zur Verwendung vor. Dabei sind spezielle Lagerungshinweise zu beachten.
33.5.3.2 Shuntpflege
Shunts funktionieren über Jahre hinweg störungsfrei, wenn sie sorgfältig gepflegt und punktiert werden. Bakterielle Infektionen des Shunts sind eher selten und entstehen durch Keimeintrag beim Punktieren, z.B. durch:
-
ungenügende Desinfektion des Shuntarms vor der Punktion
-
unsachgemäße Manipulation der Punktionskanülen
-
fehlende sterile Abdeckung der Punktionsstellen während sowie nach der Behandlung
-
offene Kratzer in Shuntnähe
-
vorzeitiges Entfernen des sterilen Verbandes nach der Dialyse (dieser sollte idealerweise 12–24 Stunden verbleiben)
Dialysepatienten sind aufgrund ihrer Erkrankung immungeschwächt, benötigen häufiger Klinikaufenthalte und sind deswegen einem höheren Infektionsrisiko ausgesetzt. Daher müssen spezielle Hygienevorsorgemaßnahmen beachtet und Screenings nach Hygieneplan durchgeführt werden.
Pflege der Katheteraustrittsstelle
Wenn die Patienten (oder ihre Angehörigen oder Pflegedienste) bei der CAPD selbst den Wechsel des Dialysebeutels vornehmen und die Katheteraustrittsstelle versorgen, sollten sie zu folgenden Aspekten der Asepsis geschult sein:
-
Desinfektion der Arbeitsfläche
-
hygienische Händedesinfektion
-
Zum Duschen kann eine wasserdichte Folie zum Abdichten der Katheteraustrittsstelle benutzt werden.
-
Nach dem Duschen ist ein Verbandwechsel erforderlich. Hierfür die Katheteraustrittsstelle mit einem trockenen Verband abdecken. Eine reizlose Katheteraustrittsstelle muss nicht täglich verbunden werden. Ist er aber durchfeuchtet, muss der Verband sofort gewechselt werden.
Infektion der Katheteraustrittsstelle Eine Infektion der Austrittsstelle des getunnelt laufenden Peritonealdialysekatheters ist eine schwere Komplikation dieser Dialyseform. Symptome der Infektion sind:
-
Rötung der umgebenden Haut und Schwellung
-
Schmerzen, Druckempfindlichkeit
-
Fieber
-
anhaltende Exsudation der Katheteraustrittsstelle
Zuerst wird ein Abstrich durchgeführt. Tägliche Verbandwechsel mit lokaler Wundantiseptik sind obligat. Gegebenenfalls wird auch eine antibiotische Therapie nach Anordnung des Arztes notwendig.
33.5.3.3 Vorbeugung gegen blutübertragbare Infektionen
Das Infektionsrisiko in Dialysestationen ist größer als in üblichen Klinikbereichen. Als eine Dialysekomplikation gilt die vermehrte Hepatitisgefährdung. Die Infektionen können sowohl von Patient zu Patient als auch von Patienten auf Mitarbeiter und von Mitarbeitern auf Patienten verbreitet werden. Es handelt sich meist um Virusinfektionen: Hepatitis B, Hepatitis C, Infektionen mit Epstein-Barr-Viren und Zytomegalieviren sowie um HIV-Infektionen.
Maßnahmen Oft werden Patienten mit Hepatitis B und Hepatitis C getrennt von den übrigen Patienten durch eigene Mitarbeiter betreut; bestimmte Dialysegeräte werden nur bei infizierten Patienten verwendet. Hämodialysegeräte müssen nach jedem Patienten vorzugsweise thermisch desinfiziert werden.
Besonders zu beachten ist der Umgang mit Sterilmaterial, die regelmäßige Durchführung von desinfizierenden Flächenreinigungen, das Tragen von Schutzkleidung, insbesondere der gezielte Handschuhgebrauch und die Instrumentendesinfektion.
Merke
Um eine Infektion von Patienten und Mitarbeitern frühzeitig zu erkennen, sollten bei Neuaufnahme bzw. Einstellung regelmäßig Screening-Untersuchungen durchgeführt werden. Jeder Patient mit einer stark eingeschränkten Nierenfunktion sollte eine Hepatitisschutzimpfung erhalten.
33.5.3.4 Gesundheitsberatung
Die Konzentration der harnpflichtigen Substanzen bleibt trotz Dialyse viel höher als bei Gesunden. Daraus ergeben sich für den Patienten folgende Konsequenzen:
-
Gefährdungen durch Infektionen
-
begrenzte Flüssigkeitsaufnahme
-
einschränkende Diätprinzipien
-
spezielle Hautpflege
-
bei Langzeit-Dialyse Langzeitmedikation
Informationen und Empfehlungen für Patienten sind in ▶ Abb. 33.19 zusammengefasst.
Informationsblatt zur Gesundheitsberatung bei Dialysebehandlung.
Abb. 33.19

Prävention und Gesundheitsförderung
Körperliche Aktivität kann einen erhöhten Blutdruck positiv beeinflussen, das Körpergewicht (ab einem BMI > 25 kg/m2) sowie die periphere Insulinresistenz reduzieren und zudem eine Gefäßsteifigkeit vermindern.
33.5.3.5 Patienten psychosozial unterstützen
Dialysepatienten sind chronisch krank und bleiben dies auch mit geglückter ▶ Transplantation. Die permanente Abhängigkeit von klinischen Einrichtungen, Pflegenden, lebenserhaltenden Gerätschaften und Medikamenten beeinflusst viele Lebensaktivitäten sowie das psychosoziale Wohlbefinden ( ▶ Abb. 33.20).
Belastung.
Abb. 33.20 Von der Technik abhängig zu sein, kann für viele Dialysepatienten eine große Belastung darstellen.
(Foto: K. Oborny, Thieme)
Im Vordergrund stehen:
-
institutionelle Abhängigkeit
-
Abhängigkeit von der Technik
-
Hoffnung und wiederkehrende Enttäuschungen im Warten auf eine Spenderniere
-
eine evtl. Beschränkung der Berufstätigkeit
-
familiäre Probleme durch das dauernde Kranksein des einen Partners und das Angebundensein des anderen
-
eingeschränkte Freizeitaktivitäten, denn der Dialysepatient
-
darf niemals unkontrolliert essen und trinken,
-
kann kräftemäßig nicht mehr jede Festlichkeit durchhalten und
-
muss seinen Urlaub auf Orte mit Feriendialysezentren beschränken.
-
Prävention und Gesundheitsförderung
Die weltweit wachsende Zahl von qualifizierten Behandlungseinrichtungen bietet inzwischen aber immer weniger Einschränkungen bei der Wahl ihres Urlaubszieles. Ob Kreuzfahrt, Städtereise, Urlaub am Meer oder in den Bergen, die Dialysebehandlung ist heute dafür kein Hinderungsgrund mehr.
Fallbeispiel
Zeitungen titelten im Jahr 2007: „Ivan Klasnić kehrt zurück in die Bundesliga.“
Dem 27-jährigen Fußballer von Werder Bremen war im März eine Niere seines Vaters eingepflanzt worden, nachdem sein Körper die zuvor transplantierte Niere seiner Mutter abgestoßen hatte. Er ist damit der erste Bundesliga-Profi, der mit einer Spenderniere seinem Beruf nachgeht.
Compliance und Adhärenz
Die oben genannten Einschränkungen können ein Grund sein, dass im Dialysealltag immer wieder Patienten auffallen,
-
die nicht nur einmal am Wochenende ihre diätetischen Anweisungen nicht befolgen und nach dem Wochenende ein zu hohes Gewicht haben,
-
deren Kalium aus diätetischen Gründen entgleist oder
-
die durch aggressives Verhalten in der Dialyse auffallen.
Sie halten sich nicht an den Behandlungsplan; sie zeigen Non-Compliance-Verhalten ( ▶ Tab. 33.5 ).
|
Ausdrucksformen |
erhöhtes Sterberisiko |
|
Überspringen/Auslassen einer Dialyse pro Monat |
25 – 30 % |
|
jede ausgelassene Dialyse |
10 % |
|
3 oder mehr Sitzungen verkürzen |
14 – 20 % |
|
Gewichtszunahme |
14 – 35 % |
|
Erhöhung des Serumphospatspiegels über 7,5 g/dl |
13 – 19 % |
Prävention und Gesundheitsförderung
Aufgabe ist es, die Compliance in Mitwirkung und Mitarbeit des Patienten an der Einhaltung medizinischer Empfehlungen und therapeutischer Maßnahmen zu erreichen. Mitwirkung setzt das Interesse des Patienten an den für seine Gesundheit relevanten Fragen voraus.
Mit Suizidabsichten umgehen
Bei der Langzeit-Dialyse – über Jahre oft 3-mal pro Woche – haben Patient, Pflegende und Ärzte sehr engen Kontakt miteinander. Dabei werden die Mitarbeiter mit den häufig schnellen körperlichen und psychischen Veränderungen des Patienten konfrontiert. Patienten, die plötzlich eine Dialyse ablehnen, um in Ruhe sterben zu können, rufen im Team ambivalente Haltungen hervor. Einerseits wird der Patient wegen des bewussten Umgehens mit seiner Krankheit respektiert, andererseits kommt Unruhe wegen der Verantwortlichkeit auf: „... darf man das wollen?“ Non-Compliance kann ein verdeckter Suizidversuch des Patienten sein (s. ▶ Tab. 33.5 ). Oft übersehen Mitarbeiter dieses Verhalten, werten es als Disziplinlosigkeit oder werden wütend, wenn der Patient „unsere Arbeit kaputtmacht“. Die Mitarbeiter stehen in der Spannung zwischen Wegsehen und Intervention. Ziel ist hier nicht die pflegerische Therapie einer Krankheit, sondern der Persönlichkeit des Kranken.
33.6 Pflege von Patienten mit Nierentransplantation
33.6.1 Medizinischer Überblick
33.6.1.1 Definition
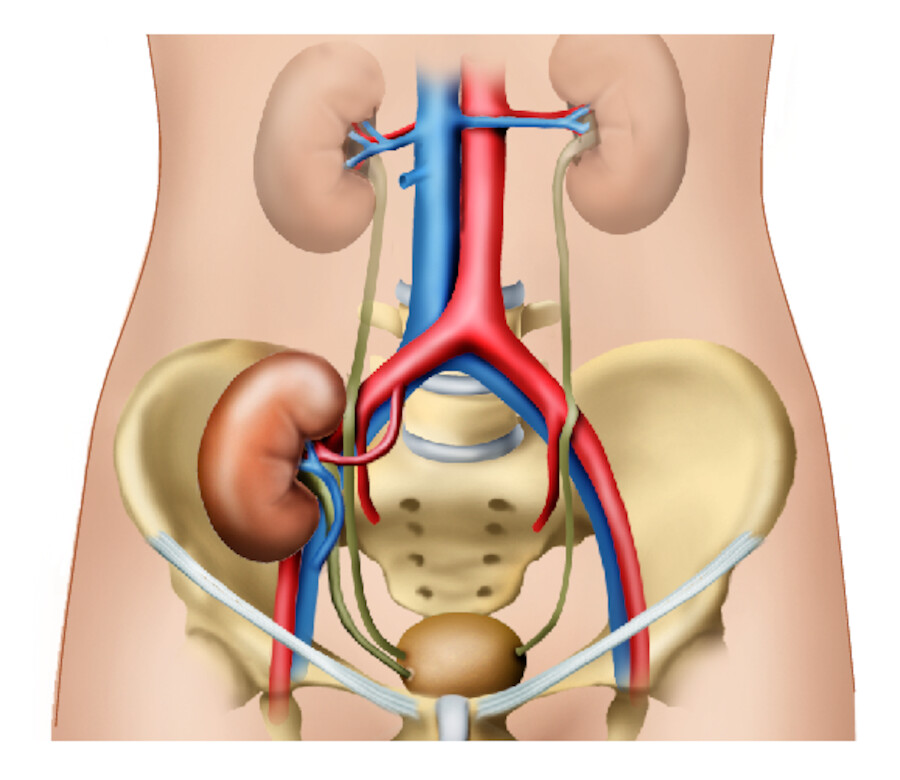
Unter einer Nierentransplantation (lat. transplantare = verpflanzen) versteht man die Übertragung einer funktionstüchtigen Spenderniere auf einen kranken Menschen mit dem Ziel, die verlorengegangene Funktion der eigenen Niere zu ersetzen ( ▶ Abb. 33.21).
Nierentransplantation.
Abb. 33.21 Das Transplantat liegt im kleinen Becken und wird über Beckengefäße mit Blut versorgt. Der Urin wird über neu eingepflanzte Harnleiter in die Blase geleitet. Die funktionslosen Nieren müssen je nach Grunderkrankung entfernt werden (z. B. große Zystennieren) oder können im Körper verbleiben (z B. diabetische Nephropathie).
Neben der Dialyse stellt die Nierentransplantation (NTPL oder NTx) eine wichtige Therapie der terminalen Niereninsuffizienz dar. Nur eine NTPL kann eine annähernd vollständige Normalisierung der exokrinen, endokrinen und stoffwechselbezogenen Nierenfunktionen bewirken. Eine erfolgreiche NTPL kann entscheidend zur Verbesserung der Lebensqualität, der körperlichen Leistungsfähigkeit und der sozialen Integration des Betroffenen beitragen.
Merke
Bevor sich ein Patient für eine NTPL entscheidet, muss er umfassend über die Transplantation und die daraus resultierenden Veränderungen seiner Lebensaktivitäten aufgeklärt werden.
33.6.1.2 Formen der Nierentransplantation
Hinsichtlich der Übereinstimmung von Spender und Empfänger unterscheidet man mehrere Formen.
Allotransplantation Diese Organübertragung ist bei genetisch fremden, aber artgleichen Individuen (Mensch zu Mensch) möglich und in der Praxis der Regelfall (allogene, homogene oder homologe Transplantation), Blutgruppen-kompatibel oder Blutgruppen-inkompatibel.
Xenotransplantation Dies ist die Übertragung von Gewebe oder Organen tierischen Ursprungs auf den Menschen (xenogene, heterogene oder heterologe Transplantation). Zurzeit scheitert diese Methode noch an der Abstoßungsreaktion von Seiten des menschlichen Empfängers.
Fallbeispiel
Herr Maier ist 46 Jahre alt. Er leidet an einer terminalen Niereninsuffizienz aufgrund einer chronischen Glomerulonephritis. Seit 3 Jahren muss er dreimal die Woche für jeweils 5 Stunden an die Dialyse. Hinterher ist er meist müde und erschöpft. Er muss sich an eine strenge Beschränkung seiner täglichen Trinkmenge halten und darf nur Dialysekost zu sich nehmen. Mit Einschränkungen ist er weiterhin berufstätig. Früher ist er immer gerne verreist. Jetzt wählt er ausschließlich Reiseziele, an denen es eine ambulante Dialyseeinrichtung gibt. Kurz nach Beginn seiner Dialysepflichtigkeit entschied er sich nach reiflichem Überlegen und vielen Gesprächen mit seiner Ehefrau und seinem behandelnden Nephrologen, sich auf die Warteliste für eine Nierentransplantation setzen zu lassen.
33.6.1.3 Nierenspende
Transplantiert werden Organe von hirntoten Organspendern, sog. postmortale Nierenspende, oder von Lebendspendern, entsprechend als Lebendnierenspende bezeichnet. Zahlenmäßig überwiegt die postmortale Nierenspende.
Laut dem Jahresbericht „Organspende und Transplantation“ der „Deutschen Stiftung Organtransplantation“ (DSO 2015) wurden im Jahr 2015 in Deutschland 645 (29,4%) Lebendnierenspenden und 1550 (70,6%) postmortale Nierenspenden durchgeführt.
Lebendnierenspende
Das Transplantationsgesetz (von 1997, letzte Änderung 2013) und die Richtlinie der Wartelistenführung und die Organvermittlung (Bundesärztekammer 2013) bilden die Grundlage für die Spende, Entnahme und Übertragung lebenswichtiger Organe wie Herz, Niere, Leber, Lunge, Bauchspeicheldrüse und Dünndarm. Um dem Missbrauch von Spenderorganen und dem Organhandel vorzubeugen, kommen für eine Lebendnierenspende nur Verwandte 1. und 2. Grades und – in besonders zu prüfenden Einzelfällen – andere Personen infrage, die dem Spender persönlich verbunden sind.
Voraussetzungen Neben dem Einverständnis des Nierenspenders zur Organentnahme gibt es weitere Voraussetzungen für eine Lebendspende:
-
Der Nierenspender muss durch ▶ 2 unabhängige Ärzte eingehend über operative Risiken (Wahleingriff!) und den möglichen Funktionsverlust oder eine mögliche Erkrankung seiner verbleibenden Einzelniere aufgeklärt sein.
-
Es darf keine finanziellen, sozialen oder familiären Zwänge geben. Dazu wird eine unabhängige Gutachterkommission eingesetzt, die überprüft, ob wirklich eine freiwillige Entscheidung des Spenders vorliegt.
Mit dem Organspendeausweis ( ▶ Abb. 33.22) besteht die Möglichkeit, schriftlich eine Erklärung zur Organentnahme für den Todesfall zu dokumentieren.
Vorder- und Rückansicht des Organspendeausweis.
Abb. 33.22
(Abb. von: Bundeszentrale für gesundheitliche Aufklärung (BZgA), Köln)

Postmortale Nierenspende
Als Organspender kommt ein Patient mit irreversiblem Hirnfunktionsausfall infrage (Deutsche Ärztekammer 2015). Zwei voneinander unabhängige Ärzte, die mit einer evtl. nachfolgenden Organentnahme nichts zu tun haben, müssen den Hirntod bestätigen. Hierzu sind genaue Kriterien festgelegt. Im günstigsten Fall besitzt der Verstorbene einen Organspendeausweis und hat zu Lebzeiten selbst schriftlich einer Organentnahme zugestimmt. Ist dies nicht der Fall, müssen die nächsten Angehörigen in seinem mutmaßlichen Sinne entscheiden (DSO 2016).
Die gemeinnützige Stiftung Eurotransplant in Leiden/Holland koordiniert die Vergabe von Spenderorganen in Europa. Dialysepatienten können sich dort über ein Transplantationszentrum nach eingehender Untersuchung für eine NTPL registrieren lassen. Alle Ergebnisse der Voruntersuchungen werden zentral gespeichert. Ein Nierenangebot wird über Eurotransplant nach bestimmten Vergabekriterien (z. B. Gewebeübereinstimmung zwischen Spender und Empfänger, Wartezeit, Entfernung zwischen Spender und Transplantationszentrum) vermittelt (Eurotransplant 2016).
Merke
Die Zahl der Patienten, die auf eine Niere warten, steigt von Jahr zu Jahr. So warteten im Jahr 2014 rund 10.000 Patienten im Einzugsgebiet von Eurotransplant auf eine Spenderniere. Da nicht ausreichend Spenden zur Verfügung stehen, beträgt die Wartezeit zurzeit bis zu 5 Jahre und länger (Jahresbericht Eurotransplant 2014).
33.6.1.4 Diagnostik und Kontraindikation
Vor einer Nierentransplantation sind verschiedene Untersuchungen notwendig. Zu den wichtigsten gehört die Gewebetypisierung. Im sog. Crossmatch wird direkt vor der Transplantation die Gewebeübereinstimmung von Spender und Empfänger untersucht. Nicht jeder Dialysepatient kommt für eine Nierentransplantation infrage. Bei folgenden Kontraindikationen ist die Transplantation im Regelfall nicht möglich:
-
Beim Empfänger sind Malignome oder chronische Infektionskrankheiten wie Tbc oder HIV bekannt.
-
Beim Empfänger besteht eine weit fortgeschrittene Arteriosklerose.
33.6.2 Pflege- und Behandlungsplan
33.6.2.1 Präoperative Pflege
Steht ein geeignetes Organ zur Verfügung, wird der Patient von dem betreuenden Transplantationszentrum angerufen und zur sofortigen stationären Aufnahme einbestellt. In vielen Kliniken erfolgt die Aufnahme direkt auf der Intensivstation, auf der die Patienten postoperativ für die nächsten 2–3 Tage betreut werden. Anders verhält es sich bei Patienten, die ein Organ von einem Lebendspender erhalten. Nach Absprache mit allen an der Transplantation beteiligten Fachabteilungen wird der Operationstermin festgelegt. Der Patient wird in der Regel 1 Tag vor der Transplantation stationär aufgenommen und zur Operation vorbereitet, bei Blutgruppen inkompatibler Lebendspende früher. Zu den wichtigsten Vorbereitungen gehört nach Überprüfen des aktuellen Gesundheitszustandes das Verabreichen der Immunsuppression. Neben den üblichen pflegerischen Tätigkeiten bei der Patientenaufnahme sind in Bezug auf die bevorstehende Transplantation die Situation des Patienten und die präoperativen Vorbereitungen zu berücksichtigen.
Situation des Patienten
Die Patienten werden vor der Operation von unterschiedlichen Gedanken und Fragen begleitet, z. B.:
-
Wird die Operation gut gehen?
-
Wird die Niere anwachsen und funktionieren?
-
Wie werde ich die Immunsuppression vertragen?
-
Wie wird es mir mit einem fremden Organ im Körper ergehen?
Patienten mit einer Lebendspende sorgen sich zusätzlich um den Angehörigen, der die Niere spendet. Für den Patienten ist dann ein fester Ansprechpartner wichtig. Wichtige Informationen für den Patienten und seine Angehörigen sind:
-
Ablauf der Aufnahme
-
Ablauf der Operationsvorbereitungen
-
postoperative Besonderheiten, wie beispielsweise hygienische Richtlinien für Angehörige
Merke
Durch den plötzlichen und gleichzeitig lang ersehnten Anruf, dass ein Spenderorgan zur Verfügung steht, und die sofort notwendige stationäre Aufnahme zur Transplantation sind die Patienten meist sehr aufgeregt, wenn sie auf der Station eintreffen. Gehen Sie ernsthaft mit den Gefühlen und Fragen des Patienten und dessen Angehörigen um.
Präoperative Vorbereitungen
Damit die Vorbereitungen zur Operation korrekt und vollständig durchgeführt werden, bietet sich eine Checkliste als Hilfsmittel an. Um den Patienten nicht zusätzlich zu belasten, sollte die Aufnahme ruhig und koordiniert ablaufen. Den momentanen Aufnahmestatus erheben:
-
Vitalzeichen kontrollieren (EKG, Blutdruck, Temperatur)
-
Gewicht bestimmen
-
aktuelles Sollgewicht und Restausscheidung erfragen
-
Blut abnehmen lassen
Definition
Das Sollgewicht ist das vom Arzt festgelegte Gewicht, das der Patient durch die Dialyse erreichen soll. Als Restausscheidung wird die Urinmenge bezeichnet, die ein Dialysepatient trotz einer eingeschränkten Nierenfunktion ausscheiden kann.
Die Patienten müssen vor der Operation mindestens 6 Std. nüchtern sein. Bereits präoperativ erhalten sie die erste Dosis Immunsuppressiva. Der Arzt entscheidet, ob und wie lange der Patient vor der Transplantation dialysiert wird. Die Entscheidung ist abhängig vom:
-
letzten Kalium-Wert
-
Zeitpunkt der letzten Dialysebehandlung
-
Aufnahmebefund des Patienten
Patienten mit CAPD – Kontinuierliche ambulante ▶ Peritonealdialyse – müssen vor der Operation den Peritonealraum entleeren. Der Katheter wird mit einer Kochsalzlösung gespült, gut verschlossen und i. d. R. intraoperativ entfernt.
33.6.2.2 Pflegemaßnahmen bei postoperativer Übernahme
Der Patient wird nach der Operation sofort extubiert und spontan atmend auf die Intensivpflegestation gebracht. Die Vitalparameter (Blutdruck, Sauerstoffsättigung und EKG) werden während des Transportes kontinuierlich überwacht. Zur Sicherung der Oxygenierung erhält der Patient Sauerstoff über eine Nasensonde.
Aufnahmestatus Dieser wird auf der Station erhoben, um die Patientensituation zu erfassen:
-
Herzfrequenz und Herzrhythmus kontinuierlich über den Monitor überwachen, Blutdruck messen
-
Dialyseshunt (palpatorisch und auskultatorisch) und periphere Durchblutung prüfen
-
Ansprechbarkeit und Befindlichkeit erfassen (gezielt nach Schmerzen fragen)
-
Atmung überwachen und Sauerstoffsättigung kontinuierlich erfassen (Sauerstoffgabe 2 – 3 l/Min. über Nasensonde)
-
Wundverband kontrollieren, Aussehen und Fördermenge der Wunddrainagen beobachten (Wunddrainage zugfrei absichern)
-
Urinmenge und -farbe kontrollieren (Urinbeutel leeren und Urinmenge ab diesem Zeitpunkt stündlich erfassen)
Zentralvenöser Zugang Zur postoperativen Flüssigkeitstherapie wird intraoperativ ein ZVK meist über die V. jugularis interna angelegt. Ein 2-lumiger Katheter eignet sich hier besonders:
-
1. Lumen: angeordnete Infusionslösung, Schmerzmittel, ▶ PCA-Pumpe = patient-controlled analgesia
-
2. Lumen: für angeordnete Medikamente wie Antihypertonika, Heparin u. a.
Weitere Maßnahmen sind:
-
angeordnete Medikamente und Infusionen verabreichen
-
Körpertemperatur messen (vor Auskühlung schützen)
-
Oberkörperhochlagerung
-
Bauchdecke durch Knierolle entlasten
33.6.2.3 Postoperative Pflege
In vielen Kliniken werden transplantierte Patienten die ersten 1–2 Tage auf der Überwachungsstation betreut. Hat sich der Patient stabilisiert, wird er auf eine nephrologische Pflegestation verlegt. Pflegeschwerpunkte der postoperativen Pflege sind:
-
Vitalfunktionen kontrollieren und stabilisieren
-
Flüssigkeit kontrolliert zuführen
-
Urinausscheidung kontrollieren
-
immunsuppressive Therapie unterstützen
-
Patienten auf Schmerzen hin beobachten und ggf. Schmerzmittel verabreichen
-
Verband kontrollieren und Wundversorgung gewährleisten
-
frühzeitig mobilisieren
-
Gesundheitsberatung durchführen
-
psychosoziale Unterstützung geben
-
Patienten vor Infektionen schützen
-
Entlassung vorbereiten
Aufrechterhaltung der Vitalfunktionen
Herz-Kreislauf-Funktion überwachen Als Folge der Operation kann es zu folgenden Störungen kommen:
-
Hypertonie mit systolischen Werten ≥ 180 mmHg (durch medikamentöse Therapie, bestehende Hypertonie oder die Operation an sich)
-
Lungenstauungen und Ödembildung (durch gestörte Ausscheidung)
Um die Vitalwerte zu erfassen und evtl. Störungen schnell zu erkennen, ist eine engmaschige Kontrolle in der 1. postoperativen Phase erforderlich. Stabilisieren sich die Werte, werden die Messintervalle gelockert:
-
Blutdruck in den ersten 1 – 2 Stunden nach der OP 1/4-stdl. kontrollieren
-
Herzfrequenz und Herzrhythmus kontinuierlich über den Monitor erfassen
-
Sonographie der Vena cava 4–6 stündlich durch den Arzt. Damit werden der Flüssigkeitshaushalt und die Durchblutung der Nierengefäße engmaschig kontrolliert.
-
Gewicht täglich erfassen, beginnend am 1. p.o. Tag
-
Allgemeinbefinden beobachten (Patienten gezielt befragen)
Dialyseshunt kontrollieren Der Dialyseshunt wird bei Volumenmangel und hypotonen Phasen nicht mehr ausreichend durchblutet und kann sich verschließen. Um mögliche Durchblutungsveränderungen schnell zu erkennen, wird der Dialyseshunt direkt postoperativ und dann 1-mal pro Schicht kontrolliert. Bei starken Blutungen entsprechend häufiger. Die Kontrolle der Shuntdurchblutung erfolgt durch Palpation und Auskultation. Nach Stabilisierung der Vitalwerte kann die Kontrolle entsprechend gelockert werden.
Merke
Der Erhalt des Dialyseshunts ist sehr wichtig, um den Patienten bei unzureichender Ausscheidungsfunktion der Niere schnell dialysieren zu können. Um Beeinträchtigungen zu vermeiden, darf am Shuntarm keine Blutdruckmessung und keine Blutentnahme erfolgen!
Atmung überwachen Durch Volumenüberlastung und Schmerzen kann die Atmung und die damit verbundene Sauerstoffversorgung des Organismus erheblich gestört werden. Als Folge der Immunsuppression sind die Patienten verstärkt pneumoniegefährdet. Die Atmung muss daher engmaschig überwacht werden. Überwachungsparameter sind:
-
Sauerstoffsättigung und Hautfarbe
-
Atemfrequenz und -rhythmus
-
Atemtiefe und -geräusche
Um die Atmung zu sichern und die Sauerstoffversorgung zu gewährleisten, sind folgende Pflegemaßnahmen durchzuführen:
-
Sauerstoff (2 – 3 l/Min.) verabreichen, bis der Patient ausreichend erwärmt ist
-
Analgetika in ausreichender Dosierung verabreichen
-
Oberkörper hochlagern
-
Atemgymnastik mit Atemtrainer (z. B. Triflo), Physiotherapie ab dem 1. postoperativen Tag
-
ab dem 1. postoperativen Tag mit steigender Anforderung mobilisieren.
Körpertemperatur überwachen Durch Infektionen und Reaktionen auf Medikamente kann die Körpertemperatur rasch ansteigen. Die Temperatur wird deshalb 2–3-mal täglich gemessen (bei Fieber entsprechend öfter).
Bewusstsein kontrollieren Durch Anstieg der harnpflichtigen Substanzen, Entgleisungen des Blutzuckers oder Nebenwirkungen der Medikamente können sich Ansprechbarkeit und Orientierung plötzlich verändern. Um mögliche Veränderungen frühzeitig wahrzunehmen, sind folgende Maßnahmen durchzuführen:
-
Bewusstsein regelmäßig prüfen
-
Patienten bezüglich seines Befindens befragen
-
beobachten, ob ein Zusammenhang zwischen dem Auftreten von Bewusstseinsveränderungen und der Gabe von Immunsuppressiva besteht
-
Blutzucker kontrollieren (wegen der Gabe von Kortikoiden und der Immunsuppression)
Flüssigkeit zuführen
Flüssigkeit wird primär parenteral zugeführt. Störungen im Wasser- und Elektrolythaushalt können durch überhöhte oder verminderte Flüssigkeitszufuhr, verminderte (Oligo- oder Anurie) oder überhöhte (Polyurie) Urinausscheidungen entstehen. Zur Stabilisierung des Wasser- und Elektrolythaushalts sind folgende Maßnahmen erforderlich:
Flüssigkeit substitutieren Die intravenöse Flüssigkeitszufuhr wird mittels Infusionspumpe über den ZVK verabreicht. Hierbei werden meist kaliumfreie Infusionslösungen verwendet. Das stündliche Infusionsvolumen orientiert sich am Stundenurin und an der Arztvorgabe. Die Flüssigkeitssubstitution wird 1– 2 Tage stündlich bilanziert. Nach 24 Std. wird eine komplette Flüssigkeitsbilanz erstellt.
Gewichtskontrolle Die Patienten werden mindestens einmal täglich gewogen. Die Gewichtskontrolle ist eine Ergänzung zur 24-Stunden-Bilanz.
Kostaufbau Die orale Zufuhr beginnt ab dem 1. postoperativen Tag. Der Patient kann zunächst schluckweise Tee zu sich nehmen. Ab dem 2. postoperativen Tag kann bei vorhandenen Darmgeräuschen mit Tee, Zwieback und Suppe begonnen werden. Nachdem der Patient abgeführt hat, erfolgt evtl. schon am 2. postoperativen Tag bei normaler Darmtätigkeit der weitere Kostaufbau. Eine spezielle Diät ist bei ausreichender Nierenfunktion nicht mehr erforderlich.
Urinausscheidung kontrollieren
Die Kontrolle der Urinausscheidung besteht in der Überwachung der Urinproduktion und der Kontrolle der ableitenden Katheter.
Urinproduktion überwachen Der Urin wird über einen ▶ transurethralen Blasenkatheter und eine suprapubische Blasenfistel abgeleitet. Je nach stündlicher Urinproduktion wird für 1–2 Tage nach der Transplantation die Flüssigkeit substituiert. Störungen der Urinproduktion können durch Verschluss der Harnableitungen und/oder verminderter Harnproduktion auftreten. Eine anfänglich engmaschig Kontrolle der Urinmenge, Urinfarbe und -beimengung ist deshalb sehr wichtig:
-
1.– 2. Post-OP-Tag: 1-stdl. Erfassung der Urinmenge
-
ab dem 3. Post-OP-Tag wird 2 x täglich eine Bilanz erhoben
-
Kaliumkontrollen werden nach Arztanordnung regelmäßig durchgeführt und bei Bedarf kaliumsenkende Maßnahmen wie beispielsweise eine Dialyse durchgeführt.
Bei verminderter Urinproduktion wird zunächst die Ursache abgeklärt (Sonografie der Niere und der ableitenden Harnwege). Danach erfolgt eventuell die Stimulation der Urinausscheidung mittels Diuretikum (z. B. Lasix). Kommt auch dann die Urinproduktion nicht in Gang, muss der Patient dialysiert werden.
Merke
Ursache für einen Rückgang der Urinausscheidung kann ein akutes Nierenversagen, Flüssigkeitsmangel, eine Abstoßungsreaktion oder ein Abflusshindernis sein.
Ableitende Katheter kontrollieren Der Abfluss von Urinableitungen ist sehr wichtig, da ein Harnstau zum Funktionsverlust der transplantierten Niere führen kann. Die Katheter dürfen deshalb in den ersten Tagen nach der Transplantation nicht abgeklemmt werden. Der transurethrale Blasenkatheter wird am 2.oder 3. Post-OP-Tag entfernt. Die suprapubische Blasenfistel bleibt erhalten bis die Spontanmiktion ohne wesentliche Restharnmengen erfolgt. Sie darf erst ab dem 7. Post-OP-Tag abgeklemmt werden.
Wundversorgung
Die Gefahr einer Wundinfektion ist infolge der unterdrückten Immunabwehr hoch. Deshalb muss auf eine strikte Einhaltung der hygienischen Richtlinien geachtet werden. Der Verbandwechsel erfolgt mindestens einmal täglich, bei Bedarf öfter. Der Zustand der Wunde wird dabei genau erfasst und dokumentiert.
Wunddrainagen überwachen In das Nieren- und Blasenlager wird zur Ableitung von Wundsekret eine ▶ Robinsondrainage (Schwerkraftdrainage) eingelegt. Diese wird am 2. oder 3. postoperativen Tag entfernt. Der Abfluss von Wundsekret ist wichtig, um eine Hämatombildung im Nierenlager zu vermeiden. Überwachungsparameter sind:
-
Zustand des Verbandes (Nachblutung, Durchfeuchtung)
-
Durchgängigkeit und Sicherung der Wunddrainage
-
Sekretmenge und -farbe
-
Bauchdeckenspannung
Mobilisation
Der Patient ist durch Schmerzen und die Zu- und Ableitungen (z. B. Drainagen, Katheter) in seiner Beweglichkeit eingeschränkt. Die Beweglichkeit muss zur Vermeidung von Komplikationen wie Thrombosen und Pneumonien entsprechend gefördert werden. Folgende Maßnahmen sind zu empfehlen:
-
Patienten zur Pneumonie- und Thromboseprophylaxe anleiten.
-
Nach Bedarf Schmerzmittel geben. Wichtig ist es, den Patienten im Umgang mit der ▶ PCA-Pumpe (patientengesteuerte Analgesie) zu unterweisen. Schmerzmittel sollen anfänglich eher großzügig verabreicht werden, damit der Patient gut mobilisiert werden kann.
-
Patienten ab dem 1. Post-OP-Tag nach kinästhetischen Prinzipien mobilisieren (Bettkante, Stuhl, Zimmer, Flur). Physiotherapeuten und Pflegefachkräfte zeigen dem Patienten geeignete Bewegungsübungen, die er selbstständig durchführen kann.
-
Zu- und Ableitungen sichern (evtl. verlängern), um eine Dislokation oder Zug durch Bewegungen zu vermeiden.
Gesundheitsberatung
Die Information des Patienten über seine Situation und seine Möglichkeit zur Mitarbeit sind Schwerpunkte bei der postoperativen Betreuung. Eine besondere Aufgabe ist die gezielte und an den Patienten angepasste Anleitung zur Einnahme der Immunsuppressiva und zur Eigenbeobachtung (z. B. Urinausscheidung, Befindlichkeit, Zustand der Mundschleimhaut).
Mit Schmerzen umgehen
Schmerzen werden von Patienten völlig unterschiedlich erlebt und beeinflussen die Genesung. Aus diesem Grund benötigen die Patienten eine individuelle Unterstützung. Bewährt hat sich das Konzept der patientengesteuerten Analgesie. Weitere Maßnahmen sind z. B. eine kleine Rolle unter den Knien, um die Bauchdecke zu entlasten. Gibt der Patient plötzlich Schmerzen an, so sind diese sehr ernst zu nehmen (Ursache kann eine Abstoßungsreaktion, ein Abflusshindernis oder eine Nachblutung sein).
Patienten psychosozial unterstützen
Die Nierentransplantation an sich, die Immunsuppression und die hohe Erwartung an das neue Organ führen häufig zu einer hohen psychischen Anspannung. Kleinste Veränderungen, beispielsweise ein kurzzeitiger Rückgang der Urinproduktion, beunruhigen den Patienten. Um den Patienten in dieser Situation begleiten zu können, sind einfühlsame Gespräche notwendig. Für den Patienten stehen hierbei Gespräche mit Ärzten und Pflegenden an erster Stelle. Durch Gespräche mit dem Klinikseelsorger oder dem Klinikpsychologen kann der Patient zusätzlich unterstützt werden. Ebenso hilfreich ist die Einbeziehung der Angehörigen in den gesamten Prozess.
Immunsuppressive Therapie unterstützen
Definition
Unter einer immunsuppressiven Therapie versteht man die Gabe von Medikamenten, welche die Immunreaktion des Körpers herabsetzen oder nahezu ganz ausschalten. Von einer Abstoßung spricht man, wenn der Körper das Organ als fremd erkennt und eine spezifische Immunreaktion ausgelöst wird (Herold 2016).
Nach einer Nierentransplantation soll die immunsuppressive Therapie eine Abstoßung des Transplantats verhindern. Gleichzeitig erhöht die Immunsuppression die Infektgefährdung, z.B. durch Bakterien, Viren und Pilze. Ziel der Therapie ist es, die Medikamentendosis in optimaler Weise anzupassen und Nebenwirkungen sofort zu erkennen. Folgende Laborparameter müssen beachtet werden: Medikamentenspiegel, Elektrolyte, harnpflichtige Substanzen, Blutbild, Gerinnungs- und Leberwerte.
Arzneimittel im Fokus
Die Basis der Immunsuppression bei der Nierentransplantation ist in der Regel eine leitliniengerechte Kombinationstherapie aus verschiedenen Immunsuppressiva. Das hat für den Patienten entscheidende Vorteile. Die Reaktion des Immunsystems wird an verschiedenen Stellen beeinflusst, was eine geringere Dosierung der einzelnen Medikamente mit weniger Nebenwirkungen ermöglicht.
Die momentan übliche Kombination besteht aus:
-
Induktionstherapie, z.B. IL2-Antagonisten (z.B. Basiliximab, Thymoglobulin)
-
Dauertherapie mit einer 3er-Kombination, z.B. Tacrolimus (Prograf) + Mycophenolatmofetil (CellCept) + Cortison,
jeweils in patientenadaptierter Form (Herold 2016).
Compliance. Aufgabe der Pflegenden ist es, auf eine korrekte und regelmäßige Einnahme der Medikamente zu achten und den Patienten bereits in der Klinik dahingehend anzuleiten. Immunsuppressiva müssen 1–2-mal täglich eingenommen werden. Um einen möglichst konstanten Medikamentenspiegel im Blut zu erzielen, ist auf eine zeitlich sehr gewissenhafte und pünktliche Einnahme zu achten. Das bedeutet bei zweimal täglicher Einnahme einen Abstand von 12 Std. (+/–0,5 Std.).
Merke
Ein Transplantierter muss seine immunsuppressiven Medikamente während der gesamten Funktionsdauer des transplantierten Organs regelmäßig einnehmen!
Wechsel- und Nebenwirkungen Bestimmte Getränke, insbesondere Grapefruitsaft, haben einen Einfluss auf die Resorption der Wirkstoffe und sind deshalb nicht erlaubt. Die Pflegekraft muss mögliche Nebenwirkungen der Medikamente kennen und ihr Auftreten rechtzeitig erkennen.
Schutz vor Infektionen
Vor allem in den ersten Tagen nach der Transplantation führt die Immunsuppression zu einer deutlich erhöhten Infektionsgefahr. Diese wird später geringer, weil eine anfänglich höhere Dosierung der Immunsuppressiva auf eine niedrigere Dauerbehandlungsdosis reduziert werden kann. Neben harmloseren Infekten wie Husten oder Schnupfen können Infektionen, die bereits vor der Transplantation bestanden haben, neu aufflammen oder sich verschlechtern (z. B. Reaktivierung von Infektionen mit Herpes-, Zytomegalie- oder Epstein-Barr-Viren und Pilzen). Außerdem können Wund- oder Katheterinfektionen auftreten, die in direktem Zusammenhang mit dem chirurgischen Eingriff stehen. Zu den wichtigsten Maßnahmen zum Infektionsschutz gehört die gründliche Händedesinfektion.
Merke
Um Infektionen möglichst zu vermeiden oder aber möglichst frühzeitig zu erkennen, sind alle hygienischen Richtlinien streng einzuhalten.
Praxistipp
Blumen oder Topfpflanzen sind nicht erlaubt, da sie eine potenzielle Infektionsquelle darstellen. Andere Gegenstände können unsteril, aber möglichst desinfiziert und sauber in das Patientenzimmer gebracht werden.
Weitere Maßnahmen Um das Infektionsrisiko so gering wie möglich zu halten, sind weitere Maßnahmen notwendig:
-
Körpertemperatur kontrollieren (3-mal täglich in den ersten Tagen)
-
Operationswunde und Einstichstellen aller liegenden Katheter und Drainagen inspizieren und unter sterilen Bedingungen neu verbinden (täglich)
-
alle nicht benötigten Katheter und Drainagen entfernen
-
medikamentöse Infektionsprophylaxe verabreichen
-
Mundschleimhaut und Zunge auf bakterielle oder virale Infekte oder Mykosen hin inspizieren (täglich)
-
Soorprophylaxe durchführen (täglich, z. B. mit Amphomoronal)
-
Patienten seine eigenen Körperpflegeartikel benutzen lassen (insbesondere die Zahnbürste soll neu sein und regelmäßig gewechselt werden)
Entlassungsvorbereitung
Der Patient wird bereits während des Krankenhausaufenthalts durch gezielte Beratung und Anleitung auf seine Entlassung vorbereitet. Anleitungsschwerpunkte sind:
-
Selbstbeobachtung der Flüssigkeitszufuhr und Urinausscheidung
-
selbstständige Medikamenteneinnahme
-
selbstständige Ermittlung von Blutdruck, Puls, Körpertemperatur und Körpergewicht
Nach seiner Entlassung wird der transplantierte Patient vom behandelnden Nephrologen engmaschig überwacht (Kontrolle alle 6 – 8 Wochen). Durch das Transplantat erbringt die Niere normale exokrine und endokrine Funktionsleistungen. Der Patient gewinnt die bisher teilweise stark eingeschränkten Lebensaktivitäten größtenteils zurück.
33.7 Lern- und Leseservice
33.7.1 Literatur
33.7.1.1 Harnsystem
[1749] Grabensee B. Nephrologie. Stuttgart: Thieme; 2002
[1750] Sökeland J. Urologie für Pflegeberufe. 7. Aufl. Stuttgart: Thieme; 2000
[1751] Thomas C. Ein ganz besonderer Saft – Urin. 33. Aufl. Köln: Vgs; 1996
[1752] Zettl S, Hartlapp J. Krebs und Sexualität. St. Augustin: Weingärtner; 1996
33.7.1.2 Harnwegsinfekte
[1753] Beetz R, Mannhardt-Laakmann B, Schulte-Wissermann H. Harnwegsinfektionen. In: Stein R, Beetz R, Thüroff JW, Hrsg. Kinderurologie in Klinik und Praxis. 2. Aufl. Stuttgart: Thieme; 2012: 149–173
[1754] Schmelz HU, Sparwasser C, Weidner B, (Hrsg). Facharztwissen Urologie. Heidelberg: Springer; 2006
[1755] Vahlensieck W, Lenk S, Ludwig M. Infektionen der Nieren und Harnleiter, Uro-Tuberkuose. In: Michel MS, Thüroff JW, Janetschek G, Wirth M, Hrsg. Die Urologie. Berlin: Springer; 2016: 293–314
[1756] Wagenlehner FME, Hoyne U, Kaase M, et al. Unkomplizierte Harnwegsinfektionen. Dtsch Ärztebl 2011; 108 (24): 415–423
33.7.1.3 Dialyse
[1757] Akbari A et al. Canadian Society of Nephrology Commentary on the KDIGO Clinical Practice Guideline for CKD Evaluation and Management. Am J Kidney 2015; 177–205
[1758] DGfN e. V., DGfN. Das Nierenportal: Dialysestandard. Im Internet: http://www.dgfn.eu/fileadmin/download/2016–03–23_Dialysestandard.pdf; Stand: 18.12.2016
[1759] DGAHD e.V. Leitlinie für angewandte Hygiene in der Dialyse. 3. Aufl. Münster: DGAHD; 2013
[1760] Balck F. Die Compliance nephrologischer Patienten. Dialyse aktuell 2007; 6: 32–38
[1761] Breuch G, Müller E. Fachpflege Nephrologie und Dialyse. München: Elsevier, Urban & Fischer; 2014
[1762] Fernsebner T, Heekenjann C, Nann M, Reichardt M. Geplante Pflege in der Nephrologie. Raunheim; 2016
[1763] Kappstein I. Nosokomiale Infektionen. 4. Aufl. Stuttgart: Thieme; 2009
[1764] Krüger B, Krämer BK. Nierenersatztherapie in der Intensivmedizin. DMW 136 2011; 14: 697–699
[1765] Landthaler I. Ernährungstherapie bei Mangelernährung. Dialyse aktuell 2009; 5: 254–262
[1766] Trachsler J, Ambühl PM. Chronische Niereninsuffizienz. Aktueller Stand der Dialyseverfahren. Schweiz Med Forum 9 2009; 3: 40–44
[1767] William C, John S. Akutes Nierenversagen – aktuelle Diagnostik und Therapie. Kardiologie up2date 5 2009; 2: 157–178
33.7.2 Patientenberatung
[1768] Auf die Dialyse bezogene Ernährungsbroschüren (industriegefördert). Im Internet: www.roche.de/pharma/indikation/nephrologie/pages/service/informationsmaterial.html?sid=2ead470875872148762c76062870cc51; Stand: 18.12.2016
[1769] Sperschneider H. Der Dialyseratgeber. 4. Aufl. Stuttgart: Trias; 2008
33.7.2.1 Nierentransplantation
[1770] Bundesärztekammer: Hirnfunktionsausfall. Vierte Fortschreibung. Deutsches Ärzteblatt, 30. März 2015. Im Internet: http://www.bundesaerztekammer.de/fileadmin/user_upload/downloads/irrev.Hirnfunktionsausfall.pdf; Stand: 18.12.2016
[1771] Bundeszentrale für gesundheitliche Aufklärung: Organspendeausweis. Im Internet: http://www.bzga.de/infomaterialien/organspende/; Stand: 18.12.2016
[1772] DSO. Deutsche Stiftung Organspende. Im Internet: http://www.dso.de; Stand: 18.12.2016
[1773] Eismann R. et al. Nierentransplantation. 3. Aufl. Stuttgart: Trias; 2000
[1774] Eurotransplant Leiden, NL. Im Internet: https://www.eurotransplant.org/cms/; Stand: 18.12.2016
[1775] Gesetz über die Spende, Entnahme und Übertragung von Organen und Geweben (Transplantationsgesetz-TPG). Im Internet: https://www.gesetze-im-internet.de/bundesrecht/tpg/gesamt.pdf; Stand: 18.12.2016
[1776] Herold G. Innere Medizin 2016. Köln: Gerd Herold Verlag; 2016
[1777] Jahresbericht Eurotransplant (2014). Im Internet: https://www.eurotransplant.org/cms/mediaobject.php?file=ar_2014.pdf; Stand: 18.12.2016
[1778] Jahresbericht Organspende und Transplantation in Deutschland (2015). Im Internet: http://www.dso.de/servicecenter/downloads/jahresberichte-und-grafiken.html; Stand: 10.03.2017
[1779] Leitlinien zur Nierentransplantation der Station A 4 – nicht veröffentlichte hausinterne Unterlagen. Klinikum Stuttgart
[1780] Richtlinie für die Wartelistenführung und die Organvermittlung, zuletzt geändert 2013: http://www.bundesaerztekammer.de; Stand: 18.12.2016
33.7.3 Weiterführende Literatur
33.7.3.1 Dialyse/Transplantation
[1781] Börsteken B. Diabetes & Dialyse mit Austauschtabelle für Kohlenhydrate, Kalium und Phosphor. Stuttgart: Thieme; 2000
[1782] Gartmann H, Dettenkofer M. Dialyse. In Daschner F et al., Hrsg. Praktische Krankenhaushygiene und Umweltschutz. 3. Aufl. Berlin: Springer; 2006
[1783] Rotondo R. Organspende … in Frage gestellt. 2. Aufl. Essen: BioSkop – Forum zur Beobachtung der Biowissenschaften; 2001
[1784] Schmidt D. Hämodialyse. Anlage, Komplikationen und Pflege des Shunt. Die Schwester/Der Pfleger 2000; 39; 482
33.7.4 Kontakt- und Internetadressen
[1785] Dialysepatienten Deutschlands e. V., Weberstr. 2, 55130 Mainz, Tel.: 0 61 31/8 51 52, Fax: 0 61 31/83 51 98
[1786] Verband Organtransplantierter Deutschlands (VOD) e. V., Wielandstr. 28a, 32545 Bad Oeynhausen, Tel.: 0 57 31/79 21 81
[1787] http://www.bauchfelldialyse.de; Stand: 18.12.2016
[1788] http://www.bzga.de; Stand: 18.12.2016
[1789] http://www.eurotransplant.org; Stand: 18.12.2016
[1790] http://www.fuerth.de/Home/Tourismus/Museen/Dialysemuseum-Fuerth.aspx; Stand: 18.12.2016
[1791] http://www.dso.de; Stand: 18.12.2016
[1792] http://www.dialyse-online.de; Stand: 18.12.2016
[1793] http://www.fmc-ag.de/31.htm; Stand: 18.12.2016
[1794] http://www.kfh.de; Stand: 18.12.2016
[1795] http://www.klinikum-stuttgart.de; Stand: 18.12.2016
[1796] http://www.Lebendspende.de; Stand: 18.12.2016