23 Wundmanagement
23.1 Grundlagen aus Pflege- und Bezugswissenschaften
23.1.1 Wundentstehung
Definition
Jeder Gewebedefekt mit mehr oder weniger klaffender Gewebedurchtrennung der Haut oder Schleimhaut wird als Wunde bezeichnet.
Wunden lassen sich nach folgenden Kriterien klassifizieren:
-
nach der Art ihrer Entstehung
-
nach dem Kontaminationsgrad
-
nach Tiefe und Ausdehnung des Defekts
-
nach Erscheinungsbild und Verletzungshergang
23.1.1.1 Art der Wundentstehung
Wunden können nach der Art ihrer Entstehung unterteilt werden in
-
traumatische Wunden,
-
iatrogene Wunden und
-
chronische Wunden ( ▶ Tab. 23.1 ).
Tab. 23.1 Klassifikation der Wundarten nach ihrer Entstehungsursache mit Beispielen. traumatische Wunden
iatrogene Wunden
chronische Wunden
-
mechanische Verletzung
-
thermische Verletzung
-
chemische Verletzung (Säuren, Laugen)
-
strahlenbedingte Verletzung
-
operative Eingriffe
-
Inzision
-
Punktion
-
Strahlentherapie
-
Laserbehandlung
-
venöse Ulzeration
-
arterielle Ulzeration
-
diabetische Ulzeration
-
Dekubitus
-
Traumatische Wunden Die häufigsten Wundarten sind
-
Schnitt- und Stichverletzungen,
-
Schürfwunden sowie
-
Quetsch-, Platz- und Risswunden.
Thermische (durch Hitze, Strom oder Kälte entstandene Verbrennungen oder Erfrierungen) und strahlenbedingte Wunden können dieser Kategorie zugeordnet werden. Hierzu gehören auch chemische Verletzungen (Verätzungen); bei Säuren entstehen Koagulationsnekrosen (Gewebeuntergang infolge Eiweißdenaturierung), bei Laugen Kolliquationsnekrosen (Aufquellungsnekrosen).
Iatrogene Wunden Neben der traumatischen Gewebezerstörung gibt es die vom Arzt verursachte, sog. iatrogene Wunde. Zu dieser Sonderform gehört die durch Schnitt geplant gesetzte (elektive) Operationswunde. Da sie unter aseptischen Bedingungen entsteht, hat sie die geringste Infektionsgefahr und die beste Heilungstendenz. Postoperative Wundinfektionen lassen sich jedoch niemals ausschließen. Strahlenbedingte Wunden ähneln Brandwunden und heilen deshalb eher problematisch.
Chronische Wunden Die z. B. als Dekubitus, Gangrän, diabetisches Fußulkus, Ulcus cruris venosum oder ulzerierter Tumor auftretenden Wunden unterscheiden sich von den zugrunde liegenden Ursachen (Primärerkrankungen) wesentlich. Dies ist bei der therapeutischen Pflege sowie der Umsetzung des Prinzips der idealfeuchten Wundbehandlung nach Wundbettsanierung und Wunddokumentation grundlegend zu beachten (Kern 2010).
23.1.1.2 Kontaminationsgrad
Eine wichtige Rolle beim Risiko des Auftretens einer Wundinfektion spielt die Kontamination. Je nach Ausmaß und Grad der Kontamination werden Wunden in unterschiedliche Kontaminationsklassen eingeteilt ( ▶ Tab. 23.2 ):
|
Kontaminationsklassen |
Erläuterungen |
|
1. klinisch saubere Operationswunde |
|
|
2. klinisch saubere, aber kontaminierte Wunde |
|
|
3. kontaminierte Wunde |
|
|
4. massiv kontaminierte oder infizierte Wunde |
|
-
klinisch saubere Operationswunden
-
klinisch saubere, aber kontaminierte Wunden
-
kontaminierte Wunden und
-
massiv kontaminierte oder infizierte Wunden
23.1.1.3 Tiefe und Ausdehnung des Defekts
Eine andere Art der Einteilung orientiert sich an der Tiefe und Ausdehnung des Defekts. Unterschieden werden:
-
offene Wunden
-
geschlossene Wunden
Offene Wunden Darunter versteht man Wunden, bei denen die Haut- oder Schleimhautoberfläche zerstört ist. Je nach Tiefe und Ausmaß unterscheidet man:
-
oberflächliche Wunden (Wunden, die die Epidermis nicht durchtrennen; Erosion, Schürfung)
-
perforierende Wunden (alle Hautschichten sind betroffen)
-
komplizierte Wunden (auch die tieferen Schichten sind betroffen, womöglich unter Einbeziehung innerer Organe oder anderer Strukturen wie Gefäße und Nerven)
Geschlossene Wunden Dies sind tiefe, unter intakter Haut entstandene Wunden. Häufigste Ursachen sind Distorsion (Verstauchung), Luxation (Verrenkung), geschlossene Frakturen sowie Muskel- und Sehnenrisse. Hämatome oder Schwellungen weisen auf tiefer liegende Schäden hin.
23.1.1.4 Erscheinungsbild und Verletzungshergang
Im klinischen Alltag müssen unterschiedliche Weichteilschäden verschiedener Ursachen aus pflegerischer und ärztlicher Sicht wahrgenommen und dokumentiert werden, denn die Behandlung und pflegerische Betreuung orientieren sich daran. Aus praktischen Gründen werden daher Wunden meist nach ihrem Erscheinungsbild, der einwirkenden Kraft und dem Hergang der Verletzung unterschieden. ▶ Tab. 23.3 zeigt die verschiedenen Wundarten und ihre möglichen Komplikationen auf. Dazu bestehen weitere Wundarten, wie aktinische Wunden, die durch ionisierende Strahlung entstehen, thermische (Verbrennungen) oder chemische Wunden (Verätzungen).
|
Wundart |
Erscheinungsbild |
einwirkende Kraft |
mögliche Komplikationen |
|
Schnittwunden
|
glatte Wundränder, anfangs heftig blutend |
Schnitt in die Haut |
Verletzung tieferer Gewebeschichten → beste Heilungstendenz, wenn sie nicht durch stark kontaminiertes Werkzeug (z. B. Metzgermesser) entstanden sind |
|
Schürfwunden
|
flächenhafte Wunden mit starker Wundsekretion bei geringem Blutaustritt |
Reibungskräfte |
neigen zur Infektion (schmieriger Wundbelag), Pigmentstörung nach Abheilung (bei Verschmutzung) |
|
Platz-, Quetschwunden
|
unregelmäßig begrenzte und gequetschte Wundränder, Blutung |
stumpfe Gewalteinwirkung |
Infektionsgefahr wegen schlechter Durchblutung der Wundränder, Nekrosen |
|
Risswunden
|
unregelmäßige, zerrissene Wundränder mit Taschenbildung, Blutung |
Dehnung oder Zerrung |
erhöhte Infektionsgefahr |
|
Bisswunden
|
Kombinationsverletzung von Riss- und Quetschwunde, häufig ausgedehnte Taschenbildung |
Tier- und Menschenbiss |
extrem hohe Infektionsgefährdung durch Bakterien und Viren |
|
Schusswunden
|
Kombination aus Riss- und Quetschwunde Einschusswunde meist klein mit Verbrennungen und Pulverschmauch, Ausschusswunde meist größer und stark zerfetzt |
ausgedehnte Gewebezerstörung mit Defektbildung durch hohe Energieübertragung |
hohe Infektionsgefahr durch anaerobe Bakterien Verletzung tiefer Gewebebezirke Verletzung mehrerer Körperhöhlen |
|
Ablederung/Décollement |
(Teil-)Abtrennung der Kopfschwarte (Skalpierung) flächenhafte Ablederung von Haut u. a. Gewebe |
seitlich einwirkende Scherkräfte |
Infektionsgefahr durch Taschen- und Hämatombildung |
|
Pfählungsverletzung
|
Eindringen pfahlförmiger, stumpfer oder spitzer Gegenstände in den Körper |
äußerlich der Stichwunde ähnlich |
Gefahr schwerwiegender Komplikationen (Infektionen, Perforation von Organen) |
23.1.2 Begleiterscheinungen von Wunden
Je nach Ausmaß der Wunde unterscheiden sich die Beschwerden des Betroffenen (Schmerzen, Blutung, Angst).
23.1.2.1 Schmerzen
Etwa ein Drittel aller Frischverletzten hat zunächst keine Schmerzen. Diese Analgesie kann Minuten bis Stunden anhalten. Prinzipiell bedeutet diese Schmerzausschaltung, dass der Organismus versucht, seine Unversehrtheit zu erhalten bzw. wiederherzustellen. Die schädigenden Reize aktivieren Nozizeptoren (freie Nervenendigungen in der Haut), deren Signale häufig zu motorischen Reaktionen wie Abwehr und Flucht führen, die den Schaden begrenzen sollen. Die Signale werden aber auch als Schmerz wahrgenommen. Dieser hat die Aufgabe, die Aktivität des Organismus zu dämpfen und so die Heilungsvorgänge zu fördern.
Merke
Schmerz hat eine Warn- und Rehabilitationsfunktion!
23.1.2.2 Blutung
Die Blutung ist abhängig vom Ort und von der Tiefe der Verletzung, also davon, ob Arterien, Venen oder Kapillaren betroffen sind. Das Ausmaß der Blutung hängt auch von der Wundentstehung ab. So bluten Schnittwunden stärker als Quetschwunden, bei denen die Gefäße zusammengedrückt werden, wodurch sich rasch ein Thrombus bildet.
Arterielle Blutungen Blutverlust nach außen zeigt sich spritzend und pulsierend. Innere arterielle Blutungen zeigen verzögerte Symptome. Starker Blutverlust kann lebensbedrohlich sein, es stellt sich ein Schockzustand durch Volumenmangel ein.
Venöse Blutungen Sie sind weniger bedrohlich, können aber, wenn größere Venen betroffen sind, auch ein beträchtliches Ausmaß annehmen (z. B. bei Blutungen aus Krampfadern).
Kapilläre Blutungen Blutungen aus den Kapillaren werden auch als punktförmige oder Sickerblutungen (parenchymatös) bezeichnet.
Bei Gerinnungsstörungen kann es zu gefährlichen Blutungen, auch unter der Haut, kommen. Sie treten auf bei akuter ▶ lymphatischer Leukämie, Bluter-Krankheit oder als Komplikation bei Antikoagulanzientherapie (z. B. mit Marcumar).
23.1.3 Wundheilung
Jede Wunde löst im Organismus physiologische Vorgänge aus mit dem Ziel,
-
die offene, ungeschützte Wunde rasch zu schließen,
-
den Verlust von Blut, Lymphe und Wärme zu vermeiden,
-
das Austrocknen der Wundflächen zu verhindern,
-
die Wunde vor äußeren Einflüssen (Infektionen, mechanischen Reizen) zu schützen.
Definition
Unter Wundheilung versteht man den in Phasen verlaufenden Prozess des Defektverschlusses. Der Wundverschluss kann als Regeneration (gewebespezifischer Ersatz, z. B. Epithelien) oder Reparation (unspezifischer Ersatz durch vernarbendes Stützgewebe) erfolgen. Gewöhnlich weist das entstehende Ersatzgewebe geringere Qualitäten auf, v.a. hinsichtlich Stabilität und Funktion.
23.1.3.1 Wundheilungsphasen
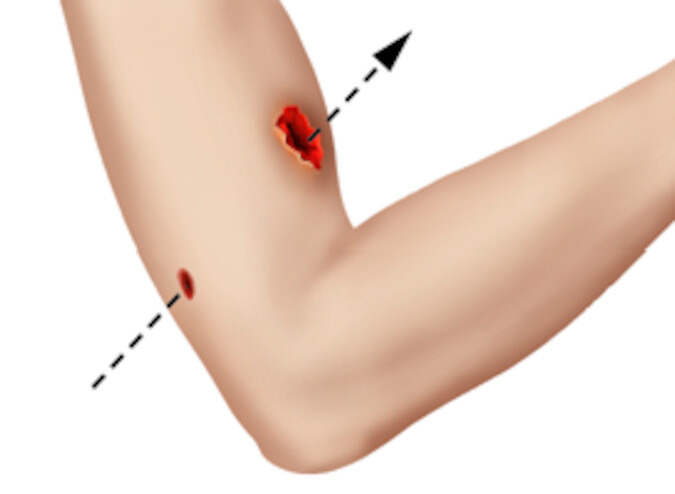
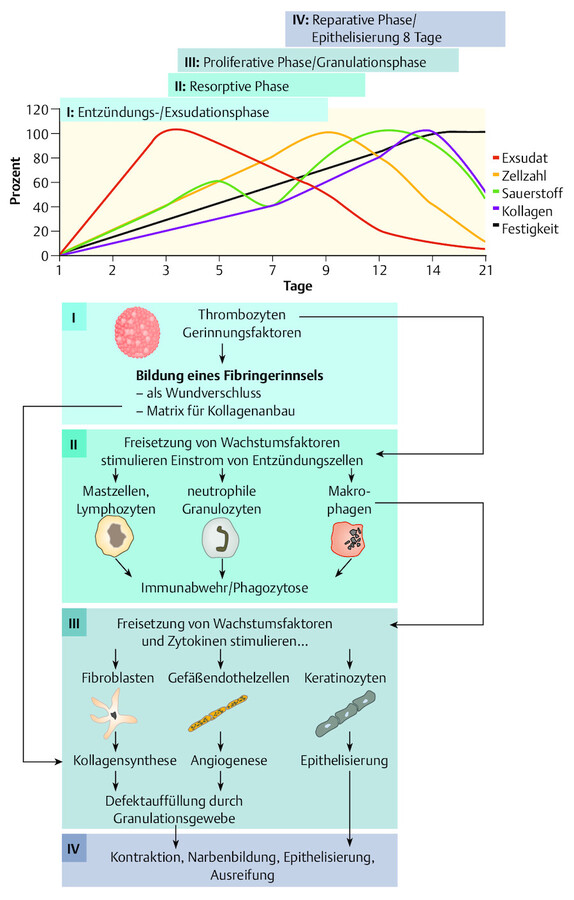
Bei Verletzungen der Haut vermitteln Nozizeptoren nicht nur Schmerzen, sondern fördern direkt lokale Abwehr- und Heilungsprozesse. Obwohl die Wundheilung ein dynamisches Geschehen ist, kann man verschiedene Phasen unterscheiden ( ▶ Abb. 23.1). Je nach Literatur lassen sich 3–4 zeitlich aufeinanderfolgende Prozesse unterscheiden:
Phasen der Wundheilung.
Abb. 23.1
(Abb. nach: Wilpsbäumer S et al. 2015)
-
Entzündungs-/Exsudationsphase (erste Stunden)
-
resorptive Phase (1. – 4. Tag)
-
proliferative Phase/Granulationsphase (3. – 10. Tag)
-
reparative Phase/Epithelisierung (7. Tag bis Monate)
Die Phasen überlappen sich und können nur willkürlich voneinander getrennt werden. Der physiologische Ablauf dauert i. d. R. 2 – 3 Wochen. Die Reißfestigkeit der Hautnarbe beträgt dann erst 20 % des Endzustandes. Aus der ursprünglich sehr gefäßreichen „roten Narbe“ entsteht ein kapillar- und zellarmes Bindegewebe (weiße Narbe), die Anpassung (Remodellierung) verläuft über Jahre.
1. Entzündungs-/Exsudationsphase Die initiale Blutung und die Blutgerinnung leiten die Heilung ein. Thrombozyten heften sich an verletzte Blutgefäße und bilden einen Pfropf zur Blutstillung; anschließend setzt die Blutgerinnung ein. Die aus dem verletzten Gewebe austretenden Blutbestandteile und Plasma führen zum schnellen Wundabschluss. Es kommt zur
-
Gefäßreaktion mit Blutung, Vasokonstriktion, Gerinnselbildung, Wundödem,
-
Blutgerinnung mit Gerinnungskaskade, Fibrinbildung, Verschorfung und
-
Entzündung.
Die exsudative Phase der Entzündung ist Voraussetzung für den Abbau von nekrotischem Gewebe (Wundreinigung) und für die Steigerung der Zellvermehrung und des Zellwachstums.
2. Resorptive Phase In dieser Phase übernehmen Makrophagen (Fresszellen) die wichtigste Funktion: Mit ihrer Fähigkeit zu Einwanderung (Migration) und Aufnahme fester Partikel, z. B. Gewebetrümmer (Phagozytose), beteiligen sie sich an der Infektabwehr und lösen mit Enzymen, wie Hydrolasen und Proteasen, abgestorbenes Gewebe und Mikroorganismen auf. So wird die Wunde gereinigt und der Infekt bekämpft.
3. Proliferative Phase/Granulationsphase In der nun eingeleiteten Granulationsphase wird die Bildung von Granulationsgewebe gefördert (stimuliert). Es kommt zur
-
Vaskularisation: Gefäßneubildung,
-
Fibrinolyse: Abbau des Fibringerüstes,
-
Zellproliferation: Bindegewebsneubildung (Kollagenbildung) und
-
Granulation mit Bildung von rötlich, glänzendem gefäß-, zell- und kollagenreichem Granulationsgewebe.
4. Reparative Phase (Epithelisierungs- und Umbauphase) In dieser Phase reifen die Kollagenfasern aus und Bindegewebe wird hergestellt. Das Gewebewasser nimmt ab, sodass sich die Wunde zusammenzieht (Wundkontraktur). Epithelgewebe sprießt von den Wundrändern her ein und leitet die Epithelisierung ein. Mit Rückgang der Zellproliferationen und dem einsetzenden Gefäßabbau entwickelt sich bei der primären Wundheilung (s. u.) eine dichte, gefäßarme Narbe auf Hautniveau. Die sauber granulierende Wunde verkleinert sich im Durchmesser täglich um 1 – 2 mm.
Merke
Wenn Ihnen die Stadieneinteilung der Wundheilung für die Wundtherapie zunächst nicht von Bedeutung erscheint, wird es beim Einsatz phasengerechter moderner Wundtherapeutika immer wichtiger, die Wunde einer Phase zuzuordnen und einzelne Prozesse gezielt zu stimulieren.
23.1.3.2 Primäre und sekundäre Wundheilung
Die Wundheilung kann primär oder sekundär erfolgen. Je nach Entstehungsart und Kennzeichen der Wunde sind Heilung und Heilungsdauer sehr unterschiedlich ( ▶ Tab. 23.4 ):
|
Entstehung |
Kennzeichen |
Heilung/Resultat |
Heilungsdauer |
|
Primäre Wundheilung (Heilung per primam intentionem, oder p.-p.-Heilung) |
|||
|
operativ gesetzte oder scharfrandige Gelegenheitswunde, die innerhalb von 6 – 8 Stunden unter aseptischen Bedingungen (Naht, Fibrinkleber, Metallklammern oder Klammerpflaster) verschlossen wird |
Für eine primäre Wundheilung
|
Heilt ohne Entzündungsreaktion ab, evtl. wurde sie vorher ausgeschnitten (glatte Wundränder): Die eng aneinanderliegenden Wundränder verkleben durch Fibrinausscheidung und schützenden Wundschorf. Daraus entsteht eine strichförmige, fast unsichtbare Narbe (minimale Neubildung von Granulations- und Narbengewebe). |
24 Stunden nach Operation gilt die Wunde als verschlossen (Oldhafer 2007). |
|
Sekundäre Wundheilung (Heilung per secundam intentionem, oder p.-s. -Heilung) |
|||
|
|
|
Lange Wundheilungsphase (Tage bis Monate) |
-
primäre Wundheilung (Heilung per primam intentionem)
-
sekundäre Wundheilung (Heilung per secundam intentionem)
Primäre Wundheilung Während der primären Wundheilung verschließt sich die Wunde durch direktes Aneinanderlagern, Verwachsen und Vernarben der glatten Wundränder. Sie verschmelzen mit minimalem Aufwand an Neubildung von Gewebe. Die Heilung wird nicht durch Entzündung oder Wundsekretion verzögert.
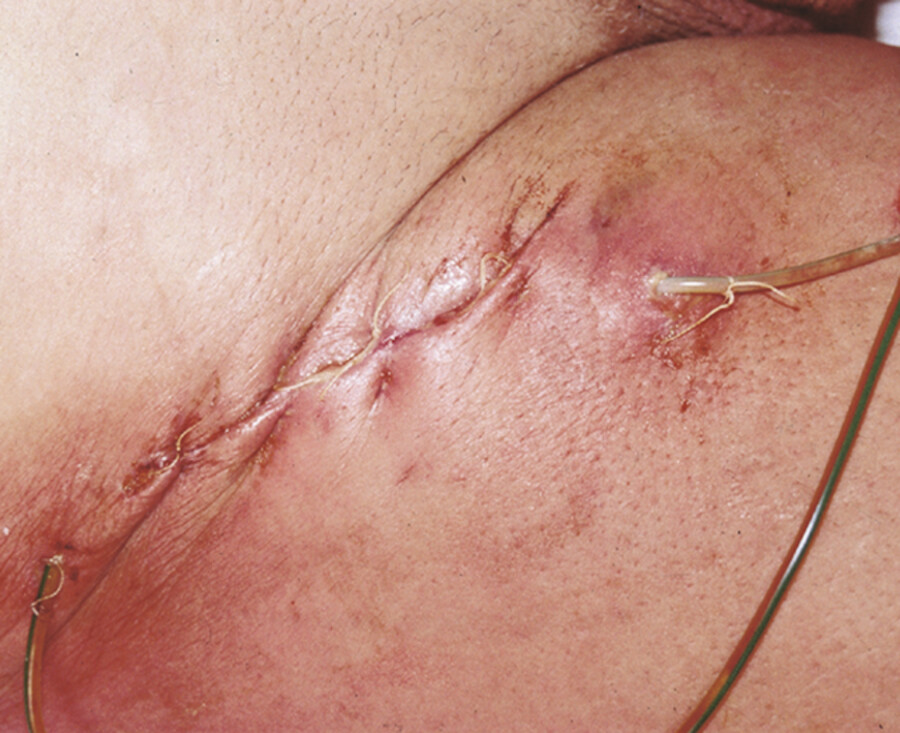
Sekundäre Wundheilung Sekundär heilt eine Wunde, wenn sich eine meist infizierte Wunde aufgrund einer Wundheilungsstörung nur zeitlich verzögert und schrittweise verschließt ( ▶ Abb. 23.2). Nach Bildung von Granulationsgewebe im Wundgrund und Epithelisierung vom Wundrand her neigt die Wunde zur starken Narbenbildung (Kontraktion). Patienten mit derartigen Wunden sind psychisch stark gefordert (u. a. Angst, Geduld) und die Behandlung kann sie nachhaltig sozial (Dauer der Erkrankung, Beruf, Kosten) und physisch (z. B. durch Schmerzen, Geruch) belasten. Die Anforderungen an die Pflegenden (Zeit und Kompetenz) sind entsprechend hoch.
Analnahe Wunden Eine Besonderheit stellen analnahe Wunden (proktologische Chirurgie) dar. Trotz ihrer oft wochenlangen Heilungsdauer zählen sie nicht als chronische Wunden, da die sekundäre Wundheilung geplant und die Wunde gut durchblutet ist. Es handelt sich meist um Wunden, wo ständig Haut auf Haut (intertriginös) liegt. Bei der meist hohen Sekretionsleistung der Wunde besteht zudem keine Indikation für eine feuchtwarme Okklusivbehandlung. Vielmehr muss die proktologische Wundumgebung vor einer Überfeuchtungsdermatitis geschützt werden (Stoll 2016).
Postoperative Wundinfektion.
Abb. 23.2
(Abb. aus: Tautenhahn J et al. Allgemein- und Viszeralchirurgie up2date. Thieme; 2007)
23.1.3.3 Chronische Heilungsverläufe
Die lokalen und systemischen Störfaktoren verzögern oder hemmen je nach Ausprägung die Wundheilung. Dies führt zu einer Mangelversorgung der Haut und des subkutanen Gewebes. Bei Wunden mit einer schlechten Heilungstendenz handelt es sich prinzipiell um sekundär heilende Wunden. Eine dauerhafte Heilung ist nur möglich, wenn die ursächlichen Störfaktoren erkannt und ihre hemmenden Einflüsse beseitigt werden ( ▶ Tab. 23.7 ).
Definition
Eine Wunde wird als chronisch bezeichnet, wenn sie nach einer definierten Zeit von 4–12 Wochen unter fachgerechter Therapie keine Heilungstendenzen zeigt (DNQP 2015).
23.1.3.4 Mikrobiologischer Befund einer Wunde
Die Wechselbeziehung zwischen Mikroorganismen und der Wunde kann von einer Kontamination bis hin zu einer ausgeprägten Infektion reichen ( ▶ Tab. 23.5 ).
|
Begriff |
Erläuterung |
|
Kontamination |
Mikroorganismen befinden sich in der Wunde, vermehren sich jedoch (evtl. noch) nicht. |
|
Kolonisation |
Mikroorganismen vermehren sich in der Wunde, es erfolgt aber keine immunologische und klinische Reaktion des Menschen. |
|
Infektion |
Ablagerung und Vermehrung von Mikroorganismen im Gewebe mit entsprechender immunologischer und klinischer Reaktion des Menschen |
Ursache einer Infektion ist nie das Eindringen eines Keimes allein. Ob es zu einer Infektion kommt, hängt meist von der Anzahl der Erreger und der Stärke der körpereigenen Abwehr, des Immunsystems, ab.
Mikrobiologie der Wunde – eine empfindliche Balance
Eine Besiedlung der Wunde mit verschiedenen Bakterienarten muss, insbesondere in chronischen Wunden, keineswegs ungünstig sein. Eine Besiedlungsvielfalt erschwert möglicherweise gefährlicheren Mikroorganismen die Ansiedelung. So sind chronische Wunden niemals steril!
Bei der Therapie ist immer das Zusammenspiel dieses mikrobiellen Ökosystems zu bedenken. Durch die Besiedelungskeime, die sich mit ihrem Stoffwechsel sowohl unterstützen als auch gegenseitig im Wachstum hemmen können, kann es zu einem Gleichgewicht der körpereigenen Bakterienflora (residente Bakterien) und solchen, die erst im Nachhinein in die Wunde gelangen, kommen. Ein weiterer Faktor in diesem Balanceverhältnis ist die körpereigene Abwehr, die mit Fresszellen Keime und abgestorbene Zellen abräumt ( ▶ Abb. 23.3). Daher sollte eine routinemäßige vorbeugende Antiseptik auf chronischen Wunden aus Furcht vor Infektionen nicht praktiziert werden.
Mikrobiologie der Wunde – eine empfindliche Balance (nach Schwarzkopf 2007).
Abb. 23.3
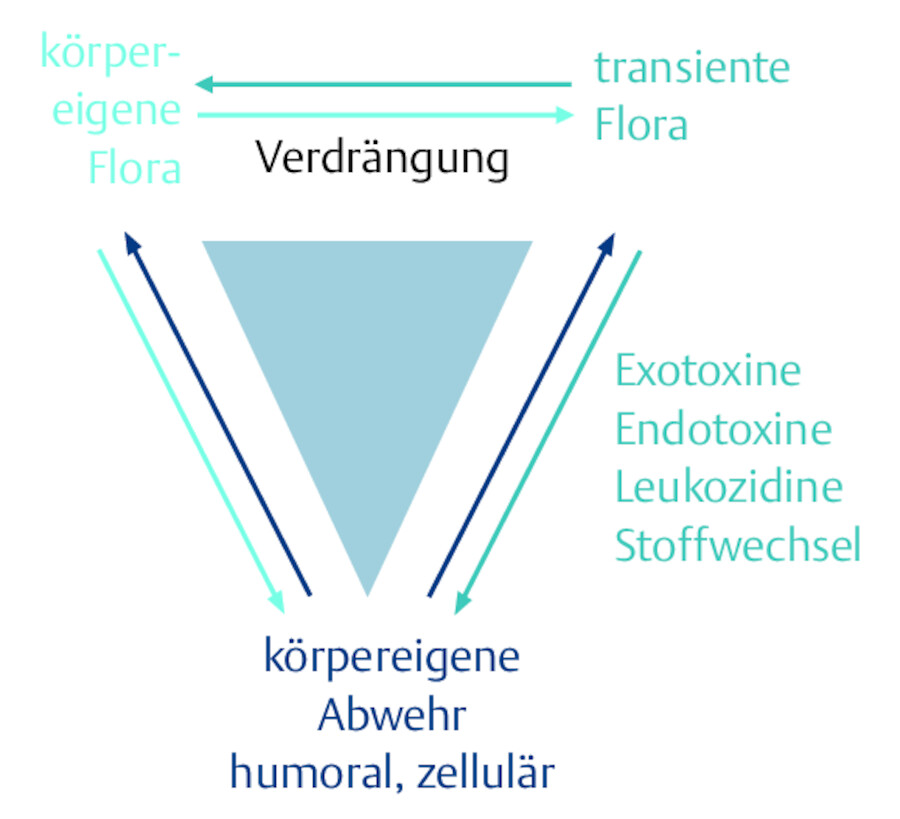
Erst bei einer Infektion reduziert sich die Vielzahl der Keimarten auf 1 oder 2, die die Vorherrschaft gewinnen und die dann typische Infektionszeichen aufzeigen. Das Aussehen und manchmal der Geruch der Infektion geben Aufschluss über die wahrscheinlichsten Mikroorganismen ( ▶ Tab. 23.6 ).
|
Farbe des Wundbelags |
Geruch |
wahrscheinlichste Mikrobentypen |
Wundinfektion |
|
gelblich-braun bis orange |
– |
grampositive Kokken, z. B. Staphylokokken, Streptokokken |
pyogen (eiterbildend) |
|
bläulich-grün |
süßlich |
gramnegative Pseudomonas aeruginosa |
pyogen (eiterbildend) |
|
– |
nach Darminhalt |
gramnegative Escherichia coli |
|
|
schwarz (Gangrän) |
faulig riechend |
gramnegativ Proteus vulgaris (Gangränbildner) |
putrid (Fäulnis erregend) |
|
weißlich, schwach gelb |
neutral |
Wenn keine weiteren Entzündungszeichen (Rötung, Schmerz, Wärme) vorhanden sind, besteht der Belag aus Fibringerüsten und weißen Blutkörperchen (Leukozyten), die während des Heilungsprozesses abgebaut wurden. Die Wunde ist nicht infiziert. |
|
|
unspezifisch |
nicht zuzuordnen |
Verdacht auf Infektion mit Methicillin-resistenten Staphylococcus aureus (MRSA) oder Vancomycin-resistenten Enterokokken (VRE) |
|
Prinzipiell handelt es sich bei sekundär heilenden Wunden um Wunden mit einem verzögerten Heilungsverlauf. Eine chronische Wunde kann sein:
-
eine „saubere“ Wunde, d. h. Wundkeime haben nicht die Oberhand, das Wundsekret sieht gelblich-rahmig aus, die Wunde riecht nicht übel, oder
-
eine septische Wunde mit massiver Sekretion und eitrigem Wundsekret
Septische Wunden riechen meist übel und die Wundränder sind oft gerötet und überwärmt. Eventuell reagiert der gesamte Organismus des Menschen (systemische Reaktion mit Fieber, Leukozytose u. a.).
23.1.3.5 Individuelle Betrachtung des Patienten
Die Situation eines Patienten während der Wundbehandlung kann nie isoliert betrachtet werden. Es gibt nicht „die Wunde“ oder „den Verbandwechsel“, sondern immer den Patienten als Menschen, der eine individuelle Behandlung und pflegerische Unterstützung benötigt.
Den Nöten und Ängsten der Patienten muss mit Fachkompetenz und einfühlender Unterstützung begegnet werden. Holen Sie bei Bedarf nähere Informationen beim Patienten selbst oder seinen Angehörigen ein. Die dazugewonnenen Erkenntnisse können ggf. für die Wundbehandlung hilfreich sein:
-
Wer ist der Patient (Alter, Biografie, Persönlichkeit)? Verschiedene Wunden sowie nachfolgende Komplikationen wirken sich auf die Aktivität und Sicherheit eines Menschen sehr unterschiedlich aus. Studien belegen, dass Patienten je nach Wundart unter Schmerzen, eingeschränkter Mobilität, Wundnässe, Wundgeruch, schmerzbedingter Schlaflosigkeit, Körperbildstörungen, Scham, Schwierigkeiten bei der Hygiene, der Kleider- und Schuhwahl, sozialer Isolation, Macht- und Hoffnungslosigkeit und Abhängigkeit von anderen leiden.
-
Wie reagiert er auf Probleme (z. B. verzögerte Heilung, plötzlich aufgetretene Entzündungszeichen)?
Merke
Der „Wound-QoL“ (engl.: Questionnaire on quality of life with chronic wounds) ist ein Assessmentinstrument zur Erfassung der Lebensqualität von Patienten mit chronischen Wunden. Die Datenerhebung erfolgt per Selbsteinschätzung des Patienten.
23.1.4 Wundheilungsstörungen
Jede Wunde, auch eine durch Naht verschlossene postoperative Wunde, ist Gefahren ausgesetzt. Durch Einflüsse auf die physiologische Wundheilung kommt es zu Wundheilungsstörungen. Man unterscheidet:
-
lokale Faktoren
-
systemische Einflussfaktoren
23.1.4.1 Lokale Wundheilungsstörungen
Lokal begrenzte Störfaktoren können die Heilung der Wunde beeinträchtigen. ▶ Tab. 23.7 fasst einige Einflussfaktoren, die zu lokalen Wundheilungsstörungen führen können, zusammen.
|
Lokale Faktoren |
Pflege- und Behandlungsprinzip |
|
Vorschädigung des Gewebes durch Bestrahlung |
Behandlung wie Verbrennungen |
|
Vorschädigung des Gewebes durch heilungsstörende „Therapeutika“ |
strenge Indikationsstellung und Auswahl an Antiseptika und Wundtherapeutika |
|
verbliebene Fremdkörper (Infektionsgefahr) |
penibles Entfernen von Fremdkörpern |
|
schlecht durchblutete oder nekrotische Wunde |
Hinweis: Dadurch werden avitales und minder durchblutetes Gewebe entfernt, eine optimale Gewebsdurchblutung erreicht und eingedrungene Bakterien reduziert; verbliebenen Keimen wird der Nährboden genommen. |
|
Hämatom |
Hämatombildung vermeiden (Nahttechnik, chirurgisches Ausräumen) |
|
zu hohe Nahtspannung (gefährdet die Wundheilung) |
Verschluss der Wunde ohne Spannung |
|
Austrocknung und Unterkühlung der Wunde |
|
|
Bewegung im Wundgebiet (lokale Instabilität wirkt infektionsfördernd) |
sorgfältige Wundversorgung |
Zu den lokalen Wundheilungsstörungen zählen:
-
Hyperästhesien
-
Serome
-
Wundhämatome
-
Infektionen
-
Wundrandnekrosen
-
Dehiszenzen und
-
Keloide
Hyperästhesie
Nach einer Verletzung wird die Haut um die Verletzungsstelle zunehmend empfindlich (Hyperästhesie) und beginnt sich zu röten. Die sich rasch ausbreitende Entzündung entsteht z. T. durch die Nozizeptoren selbst (neurogene Entzündung). Die Rötung und die Hyperästhesie können weit über das ursprüngliche Verletzungsgebiet hinaus verstärkt werden durch
-
Weitstellung der Gefäße,
-
Austritt von Plasma aus den Kapillaren und
-
Freisetzung von Histamin.
Bei der Wundbehandlung soll die Selbstregulation der Wunde nicht gestört, sondern unterstützt werden.
Serome
Bei Seromen handelt es sich um eine Ansammlung von Exsudat (Lymphe, Serum) in Wundhohlräumen. Meist entstehen sie durch offene Lymphbahnen oder angeschnittene Lymphknoten, Reizzustände im Wundgebiet (verursacht z. B. durch Fremdkörper) oder operationstechnisch bedingte Nekrosen (u. a. verursacht durch Unterbindung, d. h. Ligaturen von Gefäßen zur Blutstillung und durch evtl. Spannungszustände beim Verschluss großer Gewebsdefekte). Weitere Ursachen können u. a. Transsudate bei Eiweißmangel oder behindertem Lymphabfluss sein. Größere Serome müssen durch eine Wundrevision behandelt werden, kleinere Serome können steril abpunktiert werden mit Anlage eines leichten Kompressionsverbandes.
Wundhämatome
Nach jeder lokal geschlossenen Traumatisierung und nach jedem aseptischen operativen Eingriff kann ein Bluterguss durch Nachblutung aus kleineren Gefäßen entstehen. Ein postoperatives Wundhämatom kann entstehen durch
-
mangelhafte Blutstillung im Wundgebiet,
-
abgerutschte Ligaturen (Gefäßunterbindungen),
-
Hemmung der Blutgerinnung infolge Antikoagulanzientherapie und
-
pathologische Veränderung der Gerinnung.
Am häufigsten befinden sich Wundhämatome im Subkutangewebe. Die Wunde schwillt an und schmerzt. Weitere Symptome der Nachblutung können Tachykardie und Hypotonie sein. Meistens kommt die Blutung spontan zum Stillstand, unterstützend kann bei kleineren Hämatomen die Auflage von Kühlelementen (Coolpacks) sein. Das Hämatom wird im Laufe einiger Wochen resorbiert, d. h. vom Körper aufgelöst. Die Blaufärbung der darüberliegenden Haut ist durch eingelagerte Abbauprodukte des Hämoglobins bedingt. Ein postoperatives Wundhämatom muss vom Arzt unmittelbar nach seiner Diagnosestellung chirurgisch entfernt werden, da es einen potenziellen Infektionsherd darstellt.
Praxistipp
Das Öffnen einzelner Fäden am Patientenbett und ein Ausdrücken des Hämatoms gehen mit hohen Infektionsrisiken einher.
Infektionen
Jede Wunde ist ein Zugang ins Körperinnere und birgt die Gefahr der Keimeinschleppung. Bei einem Unfall und bei kontaminierten Wunden befürchtet man das Eindringen von anaeroben Keimen, v. a. von Tetanus- und Gasbranderregern. Als Mikroben von Wundinfektionen kommen Bakterien erst dann in Betracht, wenn sie über ein spezifisches, für den Menschen pathogenes Potenzial verfügen. Die Mehrzahl der Keime ist aber avirulent, weshalb die Wunde direkt durch eine Naht geschlossen werden kann. Virulent werden die Keime in einer nicht versorgten Wunde erst nach Stunden.
Definition
Virulenz bezeichnet die schädliche Aktivität von Krankheitserregern im Organismus bzw. die Gesamtheit ihrer krank machenden Eigenschaften.
Ausnahme sind Wunden, die schon durch die Art ihrer Entstehung eine Primärinfektion mit virulenten Keimen einschließen. Dazu gehören Biss-, Stich-, Quetsch-, Schuss- und Pfählungsverletzungen ( ▶ Tab. 23.3 ). Solche Wunden sind generell als infiziert einzustufen.
Sind die Keime schon beim Eintritt in eine Wunde als virulent anzusehen (z. B. Keime, die von der Haut des Patienten in eine Operationswunde gelangen), hat der Organismus keine Zeit mehr zur Abschirmung ( ▶ Abb. 23.2). Solche Infektionen gelten als sehr gefährlich, v. a. wenn der Patient durch sein Alter oder seine Grunderkrankung zusätzlich in seiner Abwehr geschwächt ist.
Je nach Ort und Ausmaß werden chirurgische Wundinfektionen in 3 Gruppen eingeteilt:
-
oberflächlich
-
tief
-
organbezogen (NRZ 2012).
Merke
Der Grad der Wundinfektion hängt von Keimart, Keimzahl, Keimvirulenz (Vermehrung von Toxinprodukten), Wundbeschaffenheit und der Abwehrlage des Patienten ab.
Wundrandnekrosen
Wundrandnekrosen entstehen als Folge nicht oder mangelhaft durchbluteter Wundränder. Eine Traumatisierung während der OP, schlechte Nahttechnik oder eine primäre Minderdurchblutung (Ischämie) können Ursache sein. Bei geringfügigen trockenen Nekrosen kann evtl. eine Abgrenzung (Demarkation) abgewartet werden. Feuchte Nekrosen müssen wegen ihrer Infektionsgefährdung ausgeschnitten werden.
Dehiszenz
Definition
Dehiszenz bedeutet das Auseinanderklaffen von Binde- oder Stützgewebe, von Teilen der Bauchwand oder von Wundflächen.
Man spricht von Frühdehiszenz einer Wunde nach primärem Nahtverschluss, wenn nach wenigen Tagen bei noch liegenden Fäden die Wunde aufplatzt. Dazu führen z. B. Ischämien durch Nähte, zu früh gezogene Fäden, Adipositas oder postoperativer Husten. Eine Dehiszenz kann jedoch auch erst nach 2 – 3 Wochen entstehen. Ursache ist dann meist eine generelle Abwehrschwäche oder ein schlechter Allgemeinzustand des Patienten. Auch eine lokale Infektion kann zur Dehiszenz führen. Von einem Platzbauch spricht man, wenn sich der Bauchdeckenverschluss komplett (alle Schichten betreffend) nach einer Laparotomie öffnet, sodass der ▶ Darm sichtbar wird. Hier bedarf es sofortiger chirurgischer Intervention, ggf. der Implantation eines Kunststoffnetzes. Oberflächliche Hautdehiszenzen brauchen hingegen keine spezielle Behandlung.
Hypertrophe Narbenbildung und Keloide
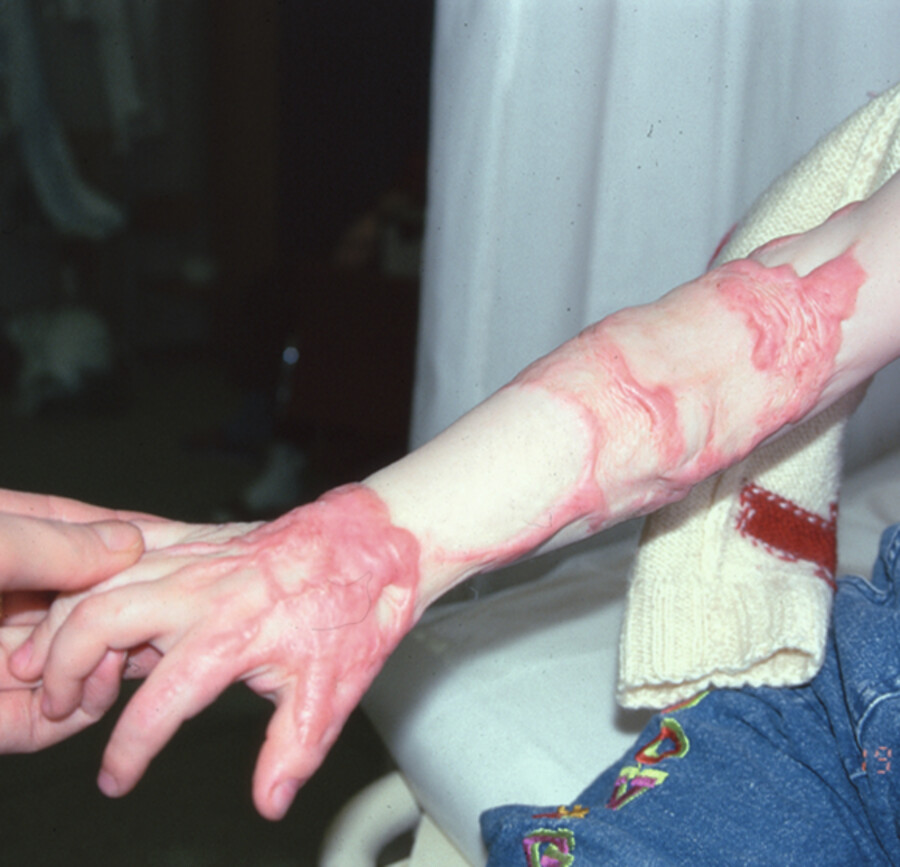
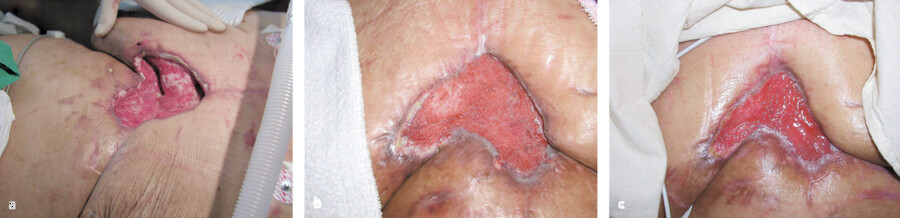
Manche Menschen neigen zu überschießender Narbenbildung. Dabei entwickeln sich scharf umschriebene sowie erhabene Narben (hypertrophe Narben) kurze Zeit nach der Operation. Sie bleiben i. d. R. auf das Wundgebiet begrenzt. Keloide hingegen überschreiten die Wundgrenzen und zeigen keine Tendenz zur Rückbildung ( ▶ Abb. 23.4).
Keloid.
Abb. 23.4 Das Keloid wölbt sich über das Niveau der angrenzenden Haut und dehnt sich über den Wundbereich hinaus aus.
(Foto: PAUL HARTMANN AG)
23.1.4.2 Systemische Wundheilungsstörungen
Neben den lokalen Faktoren, die eine Wundheilung beeinflussen, gibt es auch systemische Einflüsse, die eine Wundheilung z. T. massiv behindern können. Die Ursachen für diese Störfaktoren müssen erkannt und entsprechend im Pflege- und Behandlungsplan mit berücksichtigt werden. ▶ Tab. 23.8 zeigt zusammengefasst die wichtigsten Maßnahmen bei systemischen Störungen auf.
|
Systemische Einflussfaktoren |
Behandlungs- und Pflegeprinzipien |
|
präoperative Verweildauer im Krankenhaus (Wandlung des patienteneigenen Keimspektrums durch den Krankenhausaufenthalt) |
|
|
schlechter Allgemeinzustand (z. B. fortgeschrittenes Alter, Immobilität, Inkontinenz) |
|
|
herabgesetzter Immunstatus |
|
|
Fehl- oder Mangelernährung wie:
|
|
|
Rauchen und Alkohol (beides hemmt die Wundheilung durch Vitaminmangel) |
|
|
Arzneimittel wie: |
|
|
|
|
|
|
|
|
Fieber, Exsikkose |
|
|
Multimorbidität |
|
|
Diabetes mellitus |
|
|
Durchblutungsstörungen |
|
|
Venenklappeninsuffizienz |
|
|
Dekubitus |
|
23.1.5 Beratungsangebote und Patientenschulungen
23.1.5.1 Wissensstand des Patienten
Fehlen dem Patienten Informationen? Um die Maßnahmen zur Linderung von Beschwerden, Förderung der Wundheilung und zur Verhinderung von Rezidiven zu unterstützen, müssen Betroffene die Bedeutung der Maßnahmen und damit die Wundursache kennen. Viele Studien beschreiben hier typische Wissensdefizite von Patienten. Patienten kennen oft die Ursache ihrer Wunde nicht und deuten bestimmte Begriffe anders, z. B.
-
wird wohl „venös“ mit Venen in Verbindung gebracht, der pathophysiologische Zusammenhang mit der Wundentstehung wird dagegen nicht verstanden,
-
wird die Bedeutung eines „Ulkus“ mit einem Magengeschwür und nicht mit der Beinwunde in Verbindung gebracht,
-
wird „traumatisch“ als psychisches Trauma verstanden und nicht als körperliches.
Jeder zweite Befragte wusste nach einer Studie von Edwards (2002) nicht, welche eigenen Anteile und Aktivitäten er zur Behandlung beitragen konnte. Zum Teil waren die Patienten gegenteiliger Ansicht, gaben an, „mehr ausruhen“ bzw. „mehr aktiv sein“ sei wichtiger.
Merke
Pflegende müssen Wünsche, die sie berücksichtigen können, oder Einschränkungen (z. B. bezüglich Mobilität), die der Patient verstehen müsste bzw. nicht verstehen kann oder will, kommunikativ im Informations-, Beratungs-, Anleitungs- oder Schulungsgespräch bearbeiten. Die Voraussetzungen dazu beschränken sich nicht auf Fähigkeiten der Alltagskommunikation.
23.1.5.2 Reaktionen und Gefühle
Weitere Fragen zum Befinden des Patienten sind:
-
Wie reagiert der Patient auf Probleme (z. B. verzögerte Heilung, plötzlich aufgetretene Entzündungszeichen)?
-
Ekelt er sich evtl. vor dem Geruch bzw. Anblick der Wunde?
-
In welchem Umfeld lebt der Patient? Fördert und unterstützt es seine Mobilität oder isoliert es ihn?
-
Empfindet er Scham?
-
Wie sind seine Bedürfnisse bezüglich Intimsphäre, Wohlbefinden?
Vielfach fühlen Patienten sich nicht wahrgenommen und verstanden. Ebbeskog und Emami (2005) befragten ältere Menschen mit Ulcus cruris venosum, wie sie den Verbandwechsel erleben. Die Patienten zwischen 74 und 89 Jahren beschrieben 2 Formen der Pflege:
-
Die Patienten fühlten sich ängstlich, wenn der Verbandwechsel routinemäßig stattfand. Sie erlebten das Interesse der Pflegefachkräfte für den Verbandwechsel, nicht jedoch für sie als Person mit bestimmten Gefühlen und Erleben. Einige Patienten kommentierten den Verbandwechsel und die damit verbundenen Gefühle wie Angst oder Schmerzen, die Pflegenden reagierten jedoch nicht darauf. Dies führte zu einem Gefühl der Verletzlichkeit, der Kontrolllosigkeit und Unterdrückung.
-
Patienten fühlten sich in die Behandlung integriert, wenn eine sensible Atmosphäre vorhanden war, ein Gefühl des Verstehens und der Kompetenz.
Praxistipp
Patienten wünschen sich,
-
über das Erleben der Wunde zu reden,
-
sich wahrgenommen und verstanden zu fühlen,
-
dass ihre Schmerzen in der pflegerischen Behandlung berücksichtigt werden.
23.1.5.3 Beratungen und Angebote
Auf dem pflegerisch-therapeutischen Arbeitsgebiet schlecht heilender Wunden kommt es auf die ständige Aktualisierung des Wissens von Patienten und Mitarbeitern sowie auf ein hohes Maß an Bereitschaft zur Mitarbeit des Patienten (Compliance) an. Die nachfolgenden Beispiele für Beratungsangebote und Patientenschulungen richten sich mit ihren Inhalten an den verschiedenen Ursachen chronischer Wunden aus.
Merke
Im Expertenstandard „Pflege von Menschen mit chronischen Wunden“ (DNQP 2015) wird empfohlen, dass Einrichtungen, die Klienten mit chronischen Wunden betreuen, pflegerische Fachexperten sowohl in die Mitarbeiterschulung als auch in die Beratung von Patienten einbeziehen.
Ulcus cruris arteriosum Patienten mit einer arteriellen Verschlusskrankheit werden geschult, auf bestimmte Aspekte im Umgang mit ihrer Erkrankung zu achten. So werden sie darauf hingewiesen, orthopädische Schuhe entsprechend der Druckverteilung zu tragen. Sie werden angeleitet, ihre Füße im Hinblick auf Veränderungen wie Hornhautschwielen, Rhagaden, Pilzinfektion der Nägel u. a. sorgfältig zu inspizieren. Darüber hinaus werden den Patienten Verhaltensregeln für den Alltag vermittelt, z. B.
-
dass die Fußpflege nicht mit schneidenden Instrumenten durchgeführt werden darf,
-
dass Fußbäder nur körperwarm sein dürfen,
-
dass Barfußlaufen und externe Wärmequellen (Wärmflaschen, Heizkissen) vermieden werden sollten (stattdessen sollte die Eigenwärme durch Wollsocken oder Wattestiefel unterstützt werden),
Ulcus cruris venosum Diesen Patienten wird die Bedeutung der Kompressionstherapie erläutert sowie das Anziehen von Kompressionsstrümpfen nahegelegt. Sie sollen zu einer „venengesunden“ Lebensweise mit viel Bewegung angeregt und zur Gewichtsabnahme und einem häufigen Hochlagern der Beine angeleitet werden.
23.2 Pflege- und Behandlungsplan
Ziel jeder Wundbehandlung ist es, so früh wie möglich eine funktionsgerechte Regeneration bzw. Heilung des geschädigten Gewebes herbeizuführen. Unterschieden werden die Behandlungsprinzipien
-
akuter traumatischer Wunden,
-
sekundärer Wundheilung und
-
chronischer Wunden.
23.2.1 Behandlungsprinzipien akuter traumatischer Wunden
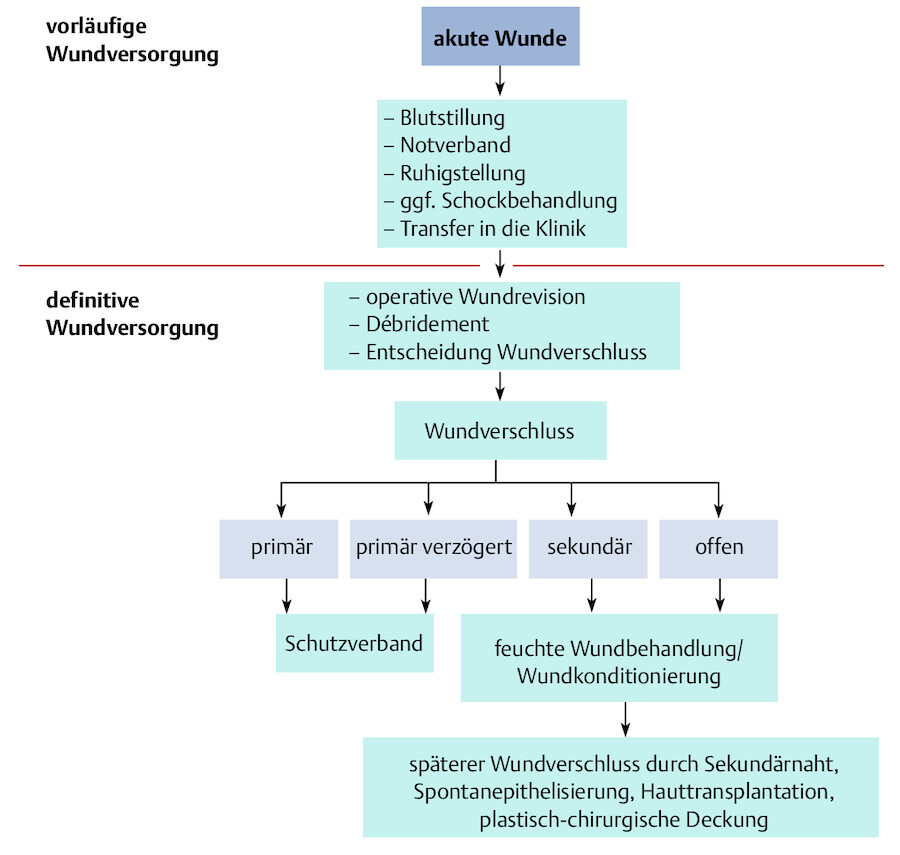
Verletzungen werden generell nach einem festen Schema versorgt:
-
Beurteilung der Wunde nach ihrer Ursache ( ▶ Tab. 23.1 ), Lokalisation, ihrem Alter und Zustand (evtl. auch Begleitverletzungen und Grunderkrankungen)
-
Reinigung bzw. Antiseptik
-
Lokalanästhesie
-
Débridement, um die Keimbesiedlung und Verschmutzung zu reduzieren
-
Wundrandausschneidung (1 – 2 mm im Gesunden)
-
lückenlose Wundrandadaption (Wundverschluss)
-
Wundabdeckung
-
heilungsunterstützende Maßnahmen, falls notwendig ( ▶ Abb. 23.5)
Prinzipien der Behandlung akuter Wunden (nach Tautenhahn et al. 2007).
Abb. 23.5
Einzelne Schritte dieses Konzeptes werden nachfolgend erläutert.
23.2.1.1 Reinigung bzw. Antiseptik
Zur Reinigung von akuten Wunden kann körperwarme Ringer-Spüllösung verwendet werden, ein Gemisch aus Kalzium-, Kalium- und Natriumchlorid in Wasser (z. B. als Finger- oder Handbad in einer sterilen Schüssel). Bei bakterieller Kontamination (z. B. Biss- oder Fleischerverletzungen, Verschmutzungen der Wunde mit Erde) eignet sich angewärmtes Polihexanid in Ringer-Spüllösung sehr gut (Lavanid, Serasept) in der Anwendungskonzentration 0,02 % oder 0,04 %, bezogen auf den Wirkstoff. In Prontosan ist Polihexanid in Wasser gelöst.
Polihexanid hat ein breites mikrobizides Wirkungsspektrum gegen Bakterien und Pilze, gegen das bislang noch keine Resistenzbildung gefunden wurde. Eine Gewebetoxizität wurde bisher nicht festgestellt. Die Lösung verursacht keine Schmerzen.
Merke
Der Impfstatus ist bei Wunden und Verletzungen immer abzuklären, auch wenn die Verletzung, z.B. an einem rostigen Nagel, nur gering erscheint. Ist der Impfstatus unklar oder nicht ausreichend, erfolgt die Tetanusprophylaxe. Zugleich ist bei relevanten Verletzungen an Tollwut, eine HIV- oder Hepatitiskontamination zu denken.
23.2.1.2 Wundrandadaption (Wundverschluss)
Bezüglich des definitiven Wundverschlusses unterscheidet man:
-
Primärnaht
-
verzögerte Primärnaht (in der Proliferationsphase, etwa 2 – 7 Tage nach der Verletzung)
-
Sekundärnaht (in der Reparationsphase, etwa ab 8. Tag nach der Verletzung)
Als Voraussetzungen für den primären Wundverschluss gelten
-
Nichtüberschreiten der 6 – 8-Stunden-Grenze nach dem Trauma,
-
Nichtvorhandensein von Infektionen oder übermäßigen Verschmutzungen und
-
das für Quetsch- und Schürfwunden typische Unterminieren der Haut.
Eine Primärnaht muss unterlassen werden bei Wunden, die als infektionsgefährdet anzusehen sind, wie Biss- und Schussverletzungen, aber auch berufsbedingte Verletzungen von Chirurgen, Tierärzten, Landwirten, Fleischern usw. Im Gesicht ist aufgrund der guten Durchblutung eine primäre Wundversorgung auch zu einem späteren Zeitpunkt noch möglich.
23.2.2 Behandlungsprinzipien bei sekundär heilenden Wunden
Bei verschiedenen Wunden, z. B. in der proktologischen Chirurgie, ist die offene Wundbehandlung mit sekundärer Heilung geplant. Die Heilung kann je nach Wundausdehnung Wochen bis Monate dauern.
In Abgrenzung zu chronischen Wunden liegt bei sekundär heilenden Wunden keine ursächliche Mangeldurchblutung vor. Damit ist die Heilung dieser oft ausgedehnten, trotz ständiger Stuhl- und Keimkontamination offen belassenen Wunden möglich. Zur Unterstützung der Heilung haben sich die folgenden Maßnahmen bewährt:
-
Reinigung der Analregion durch Abduschen mit gefiltertem Trinkwasser nach jedem Toilettengang: Zur Säuberung und Keimreduktion ist das Duschen Sitzbädern vorzuziehen. Sitzbäder weichen die Haut auf und machen sie empfindlicher.
-
Verzicht auf Zusätze von Kamille, Tannolact oder Betaisodona: Sonst besteht die Gefahr von Hautreizungen bis zum Ekzem; lokal angewandte Antiseptika verändern die ortsansässige (residente) Keimflora störend und sollten keinesfalls routinemäßig zur Anwendung kommen.
-
Mehrmals täglicher Wechsel der Gazekompressen: Die sekretaufsaugenden Gazekompressen sollen die Wunde locker ausfüllen, komprimierende Tamponaden sind nicht nötig.
-
Wundumgebung vor Mazeration schützen: Bei hoher Sekretion der Wunde, Neigung zu Diarrhö oder intertriginöser Wundveränderung ist die Wundumgebung durch dünnes Auftragen von z. B. Zinkpaste vor Mazeration (Aufweichung von Gewebe) zu schützen.
-
Anleitung zur selbstständigen Wundversorgung.
-
Postoperative Schmerztherapie: obstipierend wirkende Opiate vermeiden! (Stoll 2016).
23.2.3 Behandlungsprinzipien chronischer Wunden
Die Pathophysiologie chronischer Wunden unterscheidet sich von der akuter Wunden. Die normale Abfolge des Reparationsprozesses wird an einer oder mehreren Stellen der verschiedenen Stadien der Wundheilung unterbrochen ( ▶ Tab. 23.9 ). Als grundlegendes Behandlungsprinzip müssen zunächst die ▶ Ursachen dieser Wundheilungsstörung gefunden und möglichst abgestellt werden.
|
Beispiele |
Hinweise zur Entstehung |
Therapeutische Einflussnahme |
|
Dekubitus 4. Grades |
Druck und die damit einhergehende Perfusionsstörung des Gewebes |
die permanente Druckeinwirkung des direkt dem Knochen aufliegenden Gewebes muss reduziert werden |
|
chronisch venöse Insuffizienz (CVI) |
gestörte Makro- und Mikrozirkulation (die CVI führt in ihrer schwersten Form zum Ulcus cruris varicosum oder venosum) |
kann z. B. durch Kompressionstherapie verbessert werden |
|
exulzerierender Tumor |
Tumor durchbricht Hautgrenze |
palliative Therapie (z. B. Geruchsdämpfung, antiinfektive Behandlung) |
|
arteriosklerotisch oder diabetesbedingte Störung der Mikrozirkulation |
trockene Gangrän: Nekrotisches Gewebe ist eingetrocknet, hart und schwarz verfärbt (Mumifikation) bei feuchter Gangrän wird nekrotisches Gewebe durch Fäulnisbakterien zersetzt und eitrig verflüssigt |
Verbesserung durch Therapie der Grunderkrankung |
|
chronische posttraumatische Wunden |
entstehen meist infolge einer unzureichenden Primärbehandlung des Traumas oder seiner Komplikationen |
Erst dann kommen die nachfolgenden Grundsätze einer modernen Wundtherapie bei chronischen Wunden zur Anwendung.
Lokale Grundsätze einer modernen Wundtherapie sind:
-
Débridement
-
Wundspülung
-
Infektionskontrolle
-
phasengerechte Wundversorgung
Systemische Grundsätze einer modernen Wundtherapie sind:
-
Patientenberatung
-
Ernährungsberatung
-
Revaskularisation (Verbesserung der Gefäßversorgung)
-
medikamentöse Einstellung u. a.
Grundlagen der optimalen Wundbettpräparation (TIME-Prinzip) werden nachfolgend erläutert.
23.2.3.1 TIME-Prinzip
Beim erfolgreichen und evaluierten Behandlungskonzept TIME steht für jeden Buchstaben dieses Anglizismus die zu diagnostizierende und behandelnde Zielstruktur ( ▶ Abb. 23.6):
Prinzipien der Behandlung chronischer Wunden (Tautenhahn 2007).
Abb. 23.6
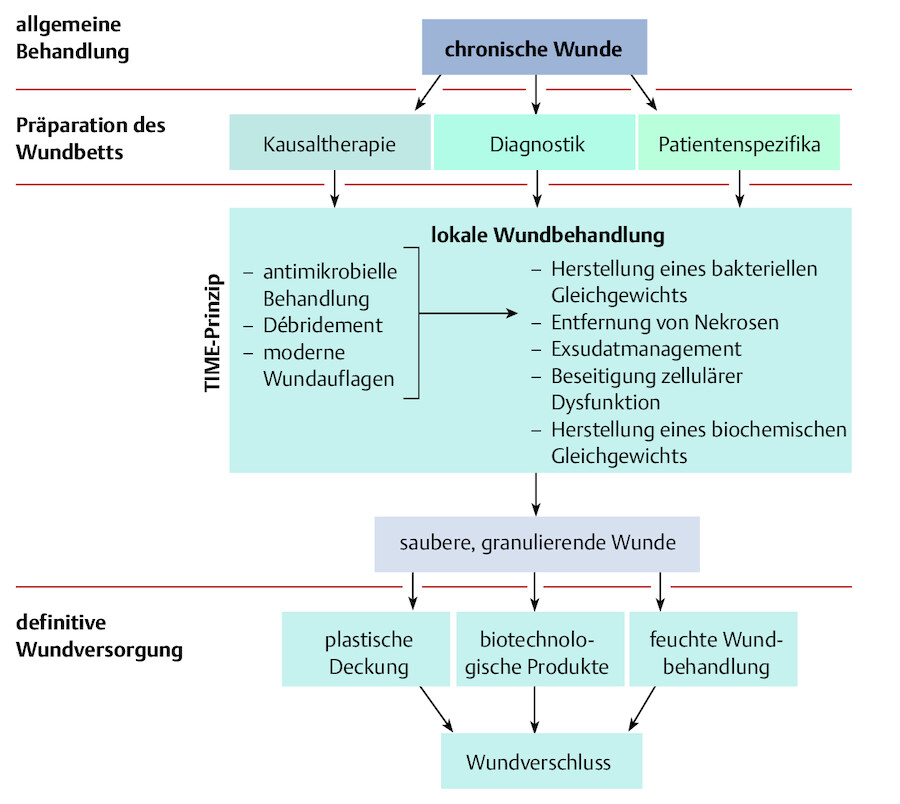
-
T = Tissue (Gewebebehandlung)
-
I = Inflammation/Infection (Entzündungs-/Infektionskontrolle)
-
M = Moisture (Wundexsudatgleichgewicht)
-
E = Edge (Wundrandförderung)
T – Behandlung des Wundgewebes
Chronische Wunden sind mit Nekrosen belastet, die einen Nährboden für Bakterien darstellen. Damit wird die Entzündungsreaktion verlängert und mechanisch eine Kontraktion und Reepithelisierung behindert.
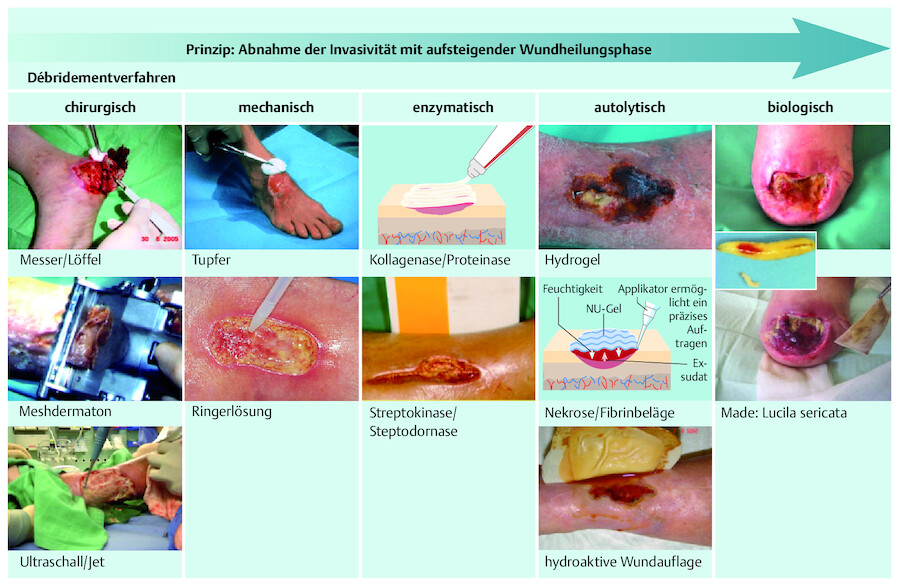
Maßnahmen Die chirurgische Wundreinigung (Débridement) bietet die schnellste und effektivste Möglichkeit, Zelltrümmer und nekrotisches Gewebe zu entfernen ( ▶ Abb. 23.7). Leichte Blutungen nach dem Reinigungsprozess fördern die Ausschüttung von Wachstumsfaktoren. Die lokale Durchblutung wird unterstützt und der Infektionsnährboden entzogen. Im Gegensatz zur akuten Wunde erfolgt jedoch durch die Grunderkrankung eine fortwährende Nachbildung, sodass ein intermittierendes, angemessenes Débridement folgen muss. Abhängig von der Wundart und -ausdehnung muss die ärztliche Entscheidung getroffen werden, ob das Abtragen von Nekrosen durch ein autolytisches (konservativ) oder chirurgisches Débridement erfolgen soll.
Möglichkeiten des Débridements.
Abb. 23.7
(Abb. nach: Lippert H. Wundatlas. Thieme; 2012)
I – Behandlung der Inflammation/Infektion
Jede Störung der Hautbarriere führt zu einer Veränderung der physiologischen Bakterienflora. Die kontaminierenden Keime müssen nicht mit den Mikroorganismen der Infektion identisch sein. Chronische Wunden sind niemals steril. Die Anwesenheit von Keimen führt zudem nicht unbedingt zur Beeinträchtigung der Wundheilung. Mit einer Verzögerung ist allerdings ab einer Keimzahl von 105 – 106 Mikroorganismen/g Gewebe zu rechnen.
Merke
Eine Wundinfektion zeigt sich mit den Entzündungsreaktionen:
-
Rubor (Rötung)
-
Calor (Wärme)
-
Dolor (Schmerzen)
-
Tumor (Schwellung)
-
Functio laesa (eingeschränkte Funktion)
Maßnahmen Da sich meist die oberflächlichen Keime von denen der tieferen Gewebeschichten unterscheiden, ist der herkömmliche Wundabstrich der Biopsie unterlegen. Débridement, Drainage, Wundspülung, z. B. mit körperwarmer Ringer-Spüllösung, und evtl. eine systemische Antibiotikatherapie sind Mittel der Wahl. Der Verband ist unter Verwendung von z. B. Alginat- oder silberionenhaltigen Wundauflagen (s. ▶ Tab. 23.12 ) zu wechseln.
Lässt sich die Infektsanierung durch die beschriebenen Maßnahmen nicht erreichen, kann eine kurzzeitige Behandlung mit Polihexanid-, Polyvidon-Iod-Präparaten oder Octenidin-getränkten Mullkompressen ( ▶ Tab. 23.10 ) und Antiseptikaspülungen durchgeführt werden. Auf die prophylaktische Antiseptik sollte bei chronischen Wunden verzichtet werden. Sie hat bei der modernen Wundbehandlung ihre Bedeutung verloren, denn oft sind Zellschädigungen die Folge.
|
Polihexanid 0,04 %, z. B. Lavanid, Serasept |
Octenidin-2-HCL 0,1 %, Phenoxyethanol 2 %, z. B. Octenisept |
|
|
|
|
|
|
|
|
|
|
|
|
Praxistipp
Insgesamt ist der Effekt von Antiseptika als gering einzuschätzen (Michelsen/Kujath 2014).
M – Exsudatmanagement
Die Korrektur des biochemischen Milieus chronischer Wunden schafft die Voraussetzung eines schnelleren Heilungsprozesses. Dazu wird das „Moist-Wound-Healing“ (feuchtwarmes Wundmilieu) für alle sekundär heilenden Wunden angewandt, bei denen eine Wundkonditionierung erforderlich ist. Bei der Wundkonditionierung wird das Wundgebiet mithilfe geeigneter Wundauflagen zur Bildung von Granulationsgewebe angeregt, was die Voraussetzung für eine spätere Defektdeckung ist.
Maßnahmen Eine phasengerechte Wundversorgung wird angestrebt ( ▶ Abb. 23.8). Sie sollte sich nach einem konkreten Wundversorgungskonzept ( ▶ Tab. 23.11 ) richten (Ravenschlag u. Ullrich 2007).
|
Wundzustand |
Versorgungsmöglichkeiten |
|
Reinigungsphase |
|
|
Nekrose |
|
|
infizierte oder infektionsgefährdete Wunde* |
|
|
Restnekrosen und/oder Fibrinbeläge |
|
|
Granulationsphase |
|
|
Granulation plus Infektionsgefährdung |
|
|
Granulation ohne Infektionsgefährdung |
|
|
Epithelisierungsphase |
|
|
Epithelgewebe vom Wundrand zirkulär schließend |
Schaumverband oder hydrokolloidaler Verband |
|
* Merke: Bei MRSA und VRE immer Hydroalginat mit Silber verwenden; Abdeckung mit Kompressen oder Schaumverband (phasenunabhängig)! |
|
Phasengerechte Wundversorgung chronischer Wunden.
Abb. 23.8
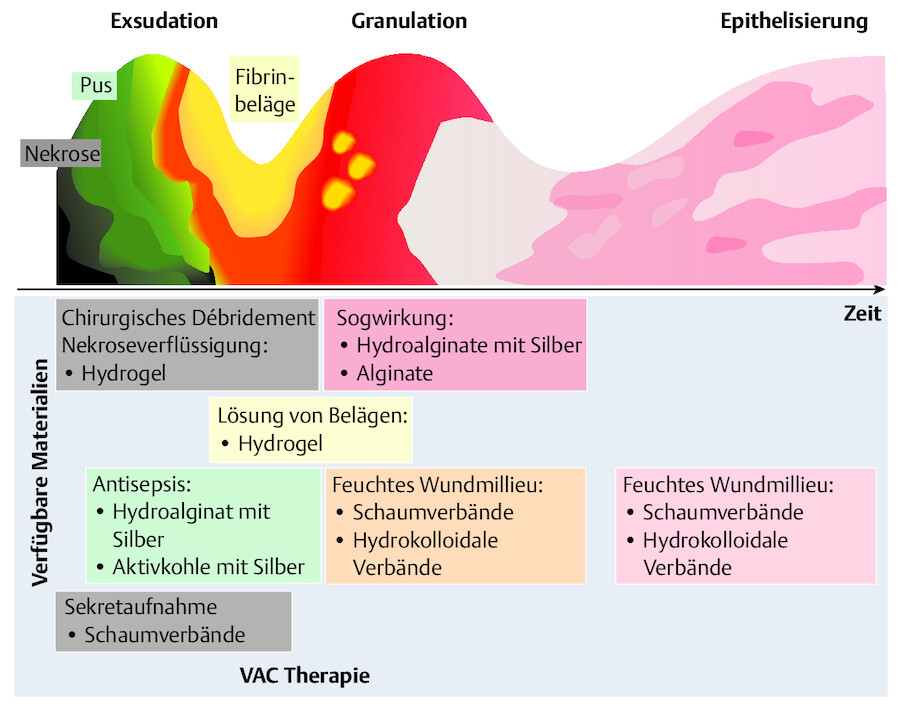
Merke
Chronische Problemwunden heilen im feuchtwarmen Wundmilieu schneller als in einem trockenen, der Luft ausgesetzten Wundmilieu.
E – Wundrand/Wundumgebung
Ausgeprägte Gewebewucherungen (Hyperproliferationen) im Bereich der Wundränder verhindern, dass die Epidermis in chronischen Wunden über das Wundgewebe wandert und so die Wunde schließt. Zugleich finden sich bei stark exsudativen Wunden Veränderungen der Wundumgebung im Sinne von Mazeration, Ödem, Erythem oder Ekzem. Bei diesen Veränderungen ist an potente Kontaktallergene mit Kontaktsensibilisierung durch Wundauflagen zu denken.
Maßnahmen Die Behandlung des Wundrandes ist in das Konzept der Wundbettaufbereitung einzubeziehen:
-
Bei frischen Granulationsrändern: keine Reinigung und Spülung vornehmen, keine Salben zur Granulationsförderung, Wundruhe durch atraumatische Verbände, feucht halten.
-
Bei überschießenden Granulationen: Hier kann man vorsichtig mit dem Ätzstift einwirken.
-
Bei exsudativen Wunden: Geeignete Wundauflagen regulieren die Exsudatmenge; bei ausgeprägten Befunden zeigen sich Vaseline oder Zinkpaste als hilfreich, zudem ist ein Ausweichen auf Stomaschutzsalben möglich.
-
Bei stagnierenden Granulationen: Bei schmierigen, schlaffen und stagnierenden Granulationen müssen die möglichen Ursachen eruiert und behandelt werden (z. B. Blutminderversorgung, Druckbelastung, mangelhafte Wundreinigung).
23.2.3.2 Wundabdeckung
Wundauflagen sind heute mehr als ein Wundschnellverband oder eine Mullkompresse. Zwar soll auch heute noch die Wundabdeckung vor äußeren Einflüssen schützen, aber zusätzlich greift sie aktiv in den Heilungsprozess ein. Moderne Wundverbände schaffen für die nacheinander ablaufenden ▶ Heilungsphasen ein günstiges Mikroklima und unterstützen die physiologischen Heilungsprozesse.
Okklusive Wundbehandlung
Definition
Okklusion bezeichnet in der Wundbehandlung einen luftfreien Verschluss und Abdichtung der Wunde gegenüber der Umgebung.
Bereits Mitte der 80er-Jahre setzte sich bei der Wundbehandlung das Konzept der Okklusion durch. Damals wurde beobachtet, dass Wunden unter Luftabschluss besser heilen als vergleichbare Wunden, die an der Luft trocknen. Diese Abdichtung regt den Körper an, über den Blutweg Sauerstoff in das Wundgebiet zu fördern. Ein feuchtes, körperwarmes Wundmilieu intensiviert zusätzlich die optimale Wirksamkeit körpereigener Zellaktivitäten.
Die ▶ okklusive Wundbehandlung wird im Kapitel zu Verbandtechniken und Verbandwechsel ausführlich beschrieben.
Kontraindikationen Während bakterielle Kontaminationen keine Kontraindikation für Okklusivverbandtechniken darstellen, dürfen chronische Wunden nicht in dieser Art verbunden werden, v.a. nicht bei
-
klinischen Anzeichen einer lokalen oder systemischen Infektion (Zunahme der Schmerzen, Schwellung, Anstieg von Temperatur und Leukozyten),
-
Infektionen mit anaeroben Keimen,
-
ischämisch-gangränösen Läsionen, insbesondere mit Beteiligung tieferer Strukturen (Knochen, Sehnen, Faszien).
Begleittherapie Die okklusive Verbandtechnik kann bei Bedarf mit anderen Therapien kombiniert werden. So ist z. B. bei einem Ulcus cruris venosum eine Kompressionstherapie in Kombination mit dem Okklusionsverband erforderlich.
Funktionen moderner Wundverbände
Dem Erscheinungsbild der Wunde entsprechend (s. ▶ Tab. 23.6 ) haben die Verbände verschiedene Funktionen und Aufgaben:
-
bei trockenen, nekrotischen Wunden: Feuchtigkeitsretention
-
bei schorfbedeckten, feuchten Wunden: Feuchtigkeitsretention, Exsudataufnahme, evtl. Geruchsbindung und antimikrobielle Wirkung
-
bei sauberen, exsudativen Wunden: Exsudataufnahme, Wärmeisolierung, evtl. Geruchsbindung und antimikrobielle Wirkung
-
bei trockenen oder wenig Sekret fördernden Wunden: Feuchtigkeitsretention, Wärmeisolierung, Schutz vor Verkleben mit dem Wundgrund
Moderne Verbände sind in ihrer Anwendung eher spezifisch und müssen deshalb differenziert eingesetzt werden. Die Wahl der Wundauflage richtet sich dabei nach den Anforderungen, die die jeweilige Heilungsphase an die Funktion des Wundverbandes stellt. Geht es eher um eine Wundbettsanierung und Reinigung, eine Wundkonditionierung zum Granulationsaufbau oder um den Wundverschluss?
Auswahl der richtigen Wundauflage
Die richtige Wahl der Wundauflage ist für den Fortgang der Wundheilung von besonderer Bedeutung. Neben den in ▶ Tab. 23.12 aufgeführten Wundauflagen existieren noch (bio-)aktive Verbände, z. B. honighaltige Wundbehandlungsmittel wie Medihoney, autologe Hauttransplantate, lyophilisierte Schweinehaut, autologe Keratinozytenkulturen, Wundverbände auf Kollagenbasis mit Wachstumsfaktoren.
Merke
Eine Wundauflage sollte den Abfluss von Wundflüssigkeit erleichtern, eine bakterielle Kontamination reduzieren bzw. eine Infektion verhindern und ein physiologisches Wundmilieu erzeugen, ohne dabei selbst toxische Effekte zu haben.
Die Liste angebotener Substanzen, die die Granulation und Epithelisierung fördern, ist lang. Meist fehlen klinische Beweise. Andererseits hemmen viele metallhaltige Pasten, die meisten Antiseptika und viele pflanzliche Präparate die Wundheilung. Bei Langzeitanwendung können sie bei offenen Wunden Allergien und Hautirritationen verursachen.
Praxistipp
Ein starker Wundgeruch kann den Patienten selbst und auch sein soziales Umfeld beeinträchtigen. Eine antibakterielle und geruchsbindende Wundauflage mit Aktivkohle kann Abhilfe schaffen.
23.2.4 Heilungsunterstützende Maßnahmen
Einige der folgenden Wundbehandlungsverfahren sind fester Bestandteil der täglichen Wundversorgung, andere noch nicht. Ob ihr Einsatz sinnvoll ist, werden die Erkenntnisse aus Forschung und Praxis zeigen.
23.2.4.1 Madentherapie
Durch das Einbringen steril gezüchteter Fliegenlarven der Schmeißfliegenart Lucilia sericata (Goldfliege) in die chronische Wunde werden Heilungsvorgänge stimuliert. Ein feinmaschiges Netz hindert dabei die Larven am Verlassen der Wunde.
Durchführung Zunächst wird die Wunde gereinigt und die Wundumgebung mit Hydrogelstreifen oder Hydrokolloidverband geschützt abgedeckt (zum Schutz vor möglichem Juckreiz der Larven auf intakter Haut). Anschließend wird eine Gaze auf eine vorbereitete Fläche mit saugfähiger Unterlage ausgebreitet. Im Transportröhrchen werden die Maden mit steriler isotoner Kochsalzlösung aufgeschwemmt und auf die ausgebreitete Gaze geleert. Dann wird die Gaze mit den Maden auf die Wunde aufgebracht. Pro Quadratzentimeter Wundoberfläche werden 5 – 10 Larven gegeben. Darüber wird eine zweite Wundauflage aus Mullkompressen gegeben, die die Wundflüssigkeit aufnehmen soll. Die Behandlungseinheit wird mit einem lockerem Wundverband oder Pflaster fixiert. Eine Alternative ist das Aufbringen der Maden auf die Wunde in einer fest verschweißten Gaze („Biobag“).
|
Wundauflagen |
Wirkprinzipien |
Handelsformen (Beispiele) |
|
1. Inaktive Wundauflagen |
||
|
Baumwoll-Mullkompressen |
Hinweis: verkleben mit der Wunde und traumatisieren diese beim Entfernen des Verbands |
ES-Kompresse (mit eingeschlossener Schnittkante = ES) |
|
Saugkompressen:
|
|
Zetuvit |
|
Salbenkompressen (weitmaschiges Baumwollgewebe oder spezielle Vliesstoffe, mit Salbe getränkt) |
Hinweis: Aufsaugen des Wundsekretes erfolgt mithilfe aufgelegter Mull- und Saugkompressen |
Atrauman, Oleotüll, Adaptic |
|
2. Interaktive Wundauflagen/-substanzen |
||
|
Polyurethan-Schaumverbände |
|
Allevyn Life, Cutinova hydro, Biatain, Mepilex |
|
Hydrokolloide |
|
Askina Biofilms, Varihesive E, Hydrocoll, Comfeel plus, Tegasorb, Combiderm |
|
Hydropolymere |
|
Tielle, Spyrosorb |
|
Hydrogele |
Hinweis: Verlängerte Verbandwechselintervalle sind möglich. Gel wird mit Ringer-Spüllösung ausgespült. |
Intra Site Gel, Nobagel, Varihesive-Hydrogel, Hydrosorb, Nu-Gel, Askina Transorbent, Purilon Gel |
|
Alginate (Kompressen) |
Hinweis: In Wundtaschen (Kavitäten) sollte die Tamponade, ihrem Namen zum Trotz, nur locker eingelegt werden: Sie quillt in der Wunde zu einem strukturbeständigen Gel. |
Nobaalgin, Algosteril Trionic, SeaSorb, Sorbalgon, Algisite M, Kaltostat, Biatain Alginate, Silvercel (mit Silberionen) |
|
Folien |
|
Opsite Flexifix, Cutifilm plus, Tegaderm, Bioclusive, Comfeel Plus Transparent |
|
3. Aktive Wundauflagen |
||
|
|
Carbonet, CarboFlex, Actisorb Silver 220 |
|
4. Aktive Wundauflagen/Antiseptisch wirkende Wundauflagen |
||
|
silberbeschichtete Auflage |
|
Acticoat, Aquacel Ag Foam |
|
Jodgaze |
|
Opraclean Jodoform Tamponade |
|
5. Gewebezüchtungen biologischer Wundauflagen |
||
|
||
Wirkprinzip Die Larven sondern ein Sekret ab, das die Wunde reinigt. Sie „fressen“ sich keineswegs durch die Wunde. Ein deutlicher Indikator für den Behandlungserfolg sind das Erscheinen von rosarotem Granulationsgewebe und das Absterben der Larven, wenn sie nur noch gesundes Gewebe vorfinden (Struller 2015).
23.2.4.2 Vakuumtherapie
Bei der sog. V.A.C.-Therapie (Vacuum Assisted Closure Therapy) wird ein Schaumstoffverband auf die Wundoberfläche gebracht und anschließend mit einer transparenten, bakteriendichten Polyurethanfolie dachziegelartig abgeklebt. Über ein kleines, in die Folie eingebrachtes Loch wird ein Drainageschlauch geklebt, der mit einer Vakuumquelle verbunden wird. In der Regel wird ein Vakuum von 125 mmHg am Gerät eingestellt. Wundsekret und toxische Zerfallsprodukte werden kontinuierlich abgesaugt. Im Verband herrscht ein gleichmäßig temperiertes, feuchtes Wundmilieu. Bei der Weiterentwicklung der Methode (negative pressure wound therapy with instillation = NPWTi) wird neben der Aufrechterhaltung eines Unterdrucks intermittierend Spülflüssigkeit in die Wunde instilliert. Als Spüllösung wird häufig NaCl 0,9% und Polihexanid verwendet (Gathen 2016). Beobachtet werden bei dieser Methode beschleunigte Heilungsverläufe, da die Bildung von Granulationsgewebe angeregt wird. Plastische Sekundärmaßnahmen sind anschließend häufig erforderlich.
Indikationen/Kontraindikationen Durch die V.A.C.-Therapie werden die Gewebeperfusion und Granulationsneubildung verbessert. Daher ist sie nur bei Wunden indiziert ( ▶ Abb. 23.9), bei denen der Wachstumsprozess angeregt werden soll. Sie stellt keinen Ersatz für ein chirurgisches Débridement dar. Nicht angewendet werden soll die V.A.C.-Therapie bei
Indikationen für V.A.C.-Therapie.
Abb. 23.9
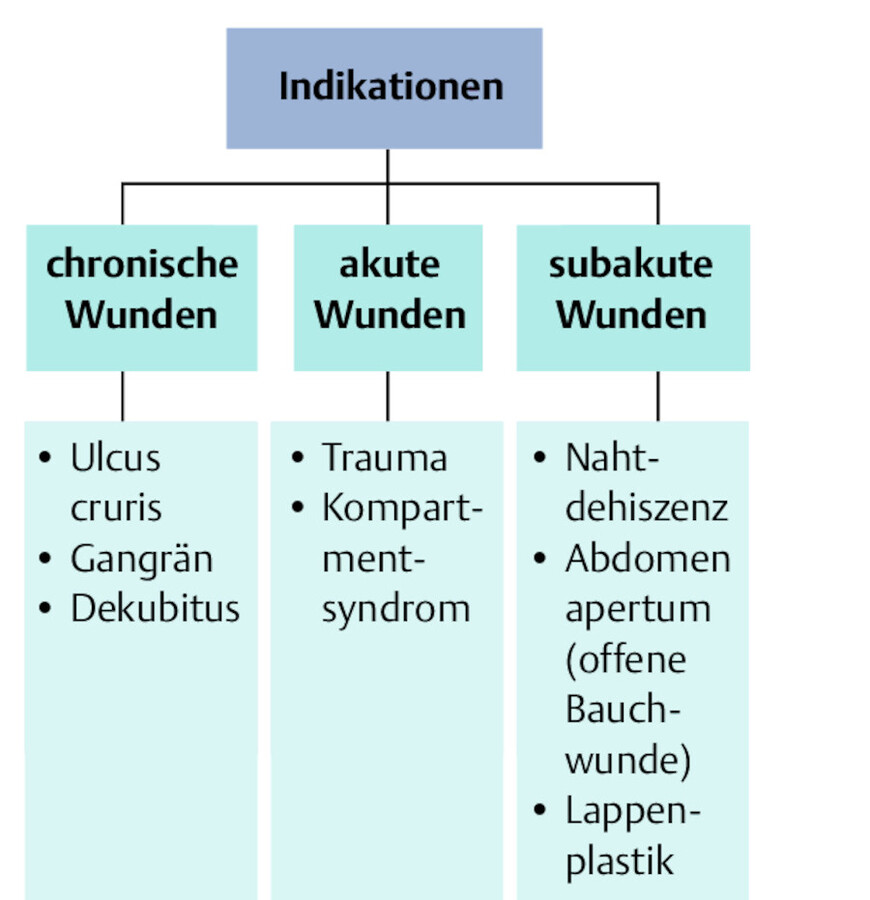
-
freiliegenden Gefäßen/Gefäßanastomosen (bedingt) → es käme zur Kompression auf Gefäße/ Anastomosen durch Druck des Schwammes,
-
Gerinnungsstörungen und akuten Blutungen → unter kontinuierlichem Vakuum kann kaum eine Blutstillung erreicht werden,
-
unbehandelter Osteomyelitis,
-
malignen Tumoren,
-
Gewebenekrosen mit Verkrustungen.
Merke
In inoperablen Einzelfällen, z. B. bei infauster Situation einer zerfallenden Tumorhöhle, kann es unter dem rein palliativen Gedanken sinnvoll sein, mittels V.A.C.-Therapie eine hygienische und für den Patienten tolerierbare Wundabdeckung zu schaffen (Sitzmann 2009a).
Voraussetzungen zur V.A.C.-Therapie Nekrosen müssen vor der Anlage entweder chirurgisch oder autolytisch entfernt werden. Damit der Schwamm die gesamte Wundoberfläche bedecken kann, muss die Wunde ausreichend geöffnet sein. Zwingend erforderlich ist eine luftdichte Abdeckung der Wunde.
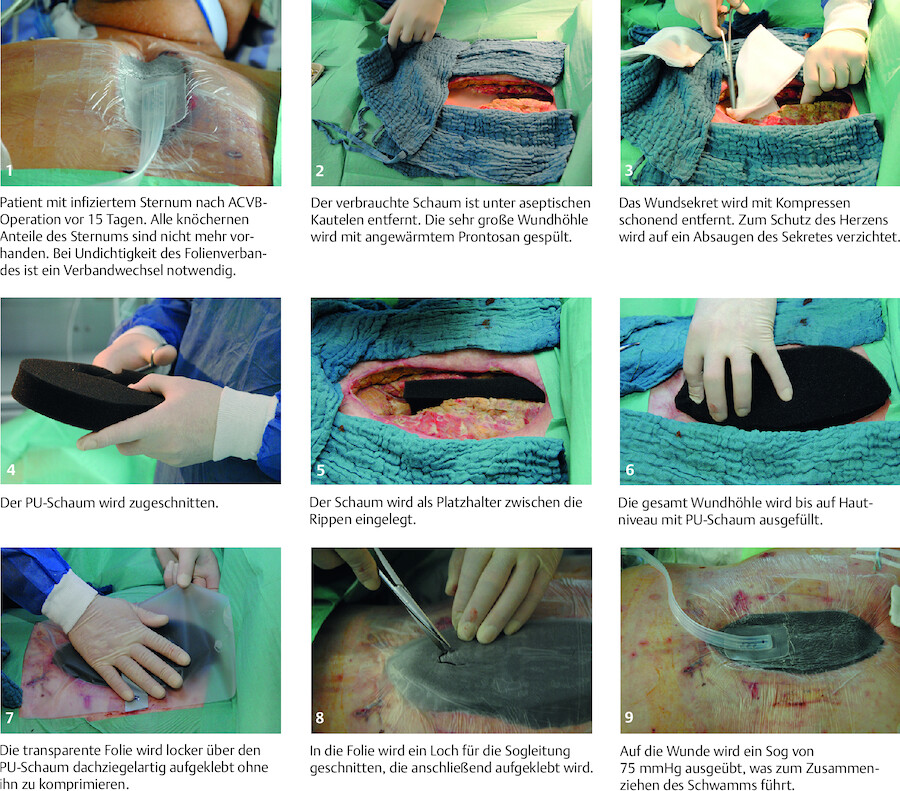
Anlage einer V.A.C.-Therapie Die Anlage einer V.A.C.-Therapie wird in ▶ Abb. 23.10 dargestellt.
Unterdruck-Wundtherapie bei einem infizierten Sternum (Foto: D. Mört.).
Abb. 23.10
(Abb. aus: Ullrich L, Stolecki D. Intensivpflege und Anästhesie. Thieme; 2015)
Praxistipp
Bei empfindlicher Umgebungshaut wird diese durch einen transparenten Folienverband geschützt.
Wundheilung unter V.A.C.-Therapie Eine Wundheilung unter V.A.C.-Therapie ist in ▶ Abb. 23.11 dargestellt. Die Therapie kann 4 – 8 Wochen dauern.
Wundheilungsverlauf unter V.A.C.-Therapie.
Abb. 23.11 a Ausgangssituation, b Wunde nach 6 Wochen, c Wunde nach 8 Wochen V.A.C.-Therapie (die Wunde ist so weit granuliert, dass sie mit Mesh-Graft gedeckt werden kann) (Foto: D. Mört).
(Abb. aus: Ullrich L, Stolecki D. Intensivpflege und Anästhesie. Thieme; 2015)
Verbandwechsel bei V.A.C.-Therapie Die Information und Vorbereitung des Patienten, des Materials und der Ablauforganisation unterliegen den allgemeinen Anforderungen an einen Verbandwechsel. Der Verbandwechsel erfolgt alle 48–72 h, bei infizierten Wunden auch häufiger (KCI 2016):
-
Schutzkleidung, Handschuhe und ggf. Mundschutz und Schutzbrille anlegen
-
Verband entfernen
-
Wunde spülen
-
Wundumgebung entfetten
-
geeignete Schaumverbände an Wundfläche, Wundtiefe und Wundhöhlen anpassen
-
Abdeckfolie zuschneiden (sollte ca. 3,5 cm über den Wundrand reichen)
-
Wunde sorgfältig mit Schaum bedecken/ausfüllen
-
Schaum mit der Folie abdecken (ohne ihn zu komprimieren!)
-
evtl. Leckagen mit restlicher Folie abdichten
-
ein ca. 1 cm großes Loch in die Folie über dem Schaum schneiden und die Saugleitung aufkleben
-
Anschlüsse an das Therapiesystem anbringen
-
auf Dichtigkeit und Einstellungen kontrollieren
Praxistipp
Werden mehrere Schaumstoffstücke verwendet, müssen sie alle untereinander Kontakt haben, damit die Sogentwicklung gewährleistet wird.
Entfernen der V.A.C.-Therapie Eine V.A.C.-Therapie wird wie folgt entfernt:
-
Vakuum 1 Std. vor geplantem Verbandwechsel beenden, da es einen schmerzfreien Verbandwechsel erleichtert.
-
Optional können zum Lösen des Schaums 10 – 30 ml NaCl 0,9 % in den zum Verband führenden Schlauch gegeben werden, der dann für 15 – 30 min abgeklemmt wird.
-
Restliches Sekret in den Sammelbehälter laufen lassen und Schlauchverbindungen lösen.
-
Folie sanft auseinanderziehen (nicht abziehen!).
-
Schaum vorsichtig entfernen, evtl. mit NaCl 0,9 % befeuchten.
Merke
Hat ein Gewebewachstum in den Schaum stattgefunden, kann es zu Adhäsionen (Verwachsungen, Verklebungen) kommen. In einem solchen Fall muss die Frequenz der Verbandwechsel erhöht werden. Zusätzlich kann die Wunde mit einem nichtinvasiven, porösen Material (z. B. Mepitel) bedeckt werden.
23.2.4.3 Hyperbare Oxygenation
In einer Druckkammer atmet der Patient bei hohem Druck reinen Sauerstoff. Dadurch werden bei chronischen Wundheilungsstörungen
-
Leukozyten und Makrophagen aktiviert,
-
durch Vasokonstriktion die Ödembildung vermindert,
-
die bakterizide Wirkung auf anaerobe Erreger verstärkt,
-
Toxine inaktiviert.
23.2.4.4 Thrombozytäre Wachstumsfaktoren
Wachstumsfaktoren spielen bei der natürlichen Wundheilung eine entscheidende Rolle. Im Wundmilieu lassen sich nahezu alle Wachstumsfaktoren nachweisen (als Polypeptide, z. B. PDWHF). PDWHF (platelet-derived wound healing factors) ist ein thrombozytäres Wachstumskonzentrat, das aus Thrombozyten gewonnen wird. Inzwischen werden klinische Erfahrungen mit autolog aus dem Eigenblut des zu behandelnden Patienten isoliertem Material gemacht. Diese unterstützen
-
die Bildung von Granulationsgewebe,
-
die Vaskularisation,
-
die Epithelisierung und
-
die Remodellierung der Wunde.
Die Anwendung von Wachstumsfaktoren ist eine sehr teure Therapie, sodass sie eher speziellen Einsatzgebieten vorbehalten bleibt. Ihre Wirkung ist bisher nicht gesichert.
Durchführung Nach dem Prinzip der sog. semiokklusiven feuchten Wundbehandlung wird zunächst eine Baumwollkompresse in die PDWHF-Lösung getränkt, dann ausschließlich auf den Wundbereich aufgebracht und mit einer Fettgaze großräumig abgedeckt. Über den täglich zu wechselnden Verband wird eine Bandage gewickelt. Die gleichzeitige Anwendung zelltoxischer Therapeutika (z. B. Lokalantibiotika oder Antiseptika) sollte vermieden werden.
23.2.4.5 Gepulste Stimulation
Bei dieser Therapiemethode wird die Wunde mit niederfrequentem Strom stimuliert. Der Strom fließt über eine sterile Behandlungselektrode. Durch die negative Polarität einer elektrischen Ladung soll das Débridement beschleunigt werden, mit der positiven Ladung sollen die Granulation sowie die Gewebsneubildung stimuliert werden. Beobachtet wird eine Zunahme der Kapillardichte sowohl im Bereich des Wundrandes als auch in der Wunde.
23.2.5 Durchführung von Wundverbänden
Die Durchführung des Wundverbandes ist ärztliche Tätigkeit. Meist wird der erste postoperative Verband durch den behandelnden Arzt entfernt oder gewechselt. Aus hygienischer Sicht ist der erste Verbandwechsel einer primär verschlossenen Wunde frühestens nach 24–48 h sinnvoll. Kürzere Zeitspannen erhöhen das Risiko der Verletzung des Fibrinnetzes. Selbstverständlich werden durchgeblutete oder feucht gewordene Wundabdeckungen sofort gewechselt.
Die weiteren aseptischen Verbandwechsel bzw. die Betreuung der Patienten mit chronischen Wunden führen dann Pflegende aus.
Recht im Fokus
Da auch hier Grundsätze verantwortlicher Delegation ärztlicher Tätigkeiten an Pflegende gelten, wird nachfolgend ein Beispiel für eine Dienstanweisung gegeben. Sie ist im Einvernehmen mit der Pflegedienstleitung abzufassen (Auszüge):
Aus Verantwortung gegenüber dem Sicherheitsbedürfnis der Patienten und den Pflegenden gegenüber, die für ihre Tätigkeiten die Durchführungs- und Handlungsverantwortung tragen (strafrechtliche und zivilrechtliche Verantwortung), muss gewährleistet sein, dass
-
die ausschließlich dem Arzt vorbehaltene Anordnung von Verbandwechseln schriftlich zu dokumentieren ist (mit Anordnungsverantwortung),
-
der Arzt nur speziell für die zu übernehmende Aufgabe qualifizierte Pflegende beauftragen darf (Auswahlpflicht),
-
der Patient aufgeklärt ist.
Die Pflege- und Behandlungskonzepte können nur aufgrund einer umfassenden Anamnese (Wundbeurteilung) erstellt werden. Wenn Wunden längere Zeit bestehen, liegt es oft an mangelnder Ursachenabklärung. Ein qualitäts- und kostenorientiertes Wundmanagement bedeutet zuerst, althergebrachte und eingespielte pflegerische Maßnahmen und Therapien („das haben wir immer so gemacht“) auf ihren Nutzen und ihre Wirksamkeit zu überprüfen.
Darüber hinaus erfordern der Verlauf der Wundheilung und die Beurteilung der Wundversorgung sowie die Koordination bei einem häufig wechselnden Arzt- und Pflegeteam eine sorgfältige schriftliche Aufzeichnung und kontinuierliche Dokumentation. Bei Veränderung der Wundverhältnisse muss der Arzt informiert werden.
Günstig hat sich die grundsätzliche (Material-)Absprache im Qualitätszirkel zwischen Krankenhaus, niedergelassenen Praxen, ambulanten Pflegediensten sowie Altenpflegeeinrichtungen gezeigt.
Aufgaben der Pflege Bei der Wundbehandlung stehen für die Pflegenden folgende Aufgaben im Vordergrund:
-
Stationsmanagement
-
Versorgung der Wunde in Zusammenarbeit mit dem behandelnden Arzt
-
Wundbeurteilung, evtl. mikrobiologische Diagnostik und Dokumentation
-
Wundreinigung
-
Durchführung der Verbandwechsel und -techniken
-
Anleitung und Schulung des Patienten (Patientenedukation und Förderung der Adherence)
23.2.5.1 Stationsmanagement
Die stationäre Betreuung von aseptischen und septischen Patienten auf einer gemeinsamen Station bedarf besonderer hygienischer Maßnahmen, um Kreuzkontaminationen zu vermeiden. Es ist möglich, septische und aseptische Patienten auf einer Station zu betreuen, es bedarf keiner eigenen septischen Station.
Die Patienten sollten aber nach den Wundkategorien getrennt in verschiedenen Zimmern untergebracht werden. Die Weiterverbreitung von Infektionen geschieht im Wesentlichen über die Hände der Mitarbeiter. Dieser Übertragungsweg ist nur durch eine Maßnahme sicher zu verhindern: die korrekt durchgeführte Händedesinfektion.
Merke
Bei Patienten mit septischen Wunden muss täglich die gezielte Desinfektion von patientennahen Flächen (Nachttisch, Bettplatz, Waschbecken, WC usw.) und Fußboden gewährleistet sein. Nur so kann das Risiko von Kreuzkontaminationen minimiert werden.
23.2.5.2 Versorgung der Wunde
Eine konsequente Versorgung der Wunde beinhaltet
-
Beurteilung der Wunde mit aussagefähiger Dokumentation,
-
Entfernung abgestorbenen Gewebes,
-
regelmäßige Wundreinigung,
-
Anlegen eines physiologischen Wundverbandes,
-
Maßnahmen zu Prävention und Behandlung einer Infektion und
-
systemische Maßnahmen zur Unterstützung der Wundheilung.
Während primär heilende, durch Naht verschlossene Wunden verhältnismäßig einfach zu versorgen sind, sind die fachlichen Anforderungen an den Ausführenden bei sekundär heilenden, akuten und chronischen Wunden ungleich höher. Hier handelt es sich um eine bedeutsame therapeutische Maßnahme, mit der alle Wundheilungsphasen beeinflusst werden können.
Um eine umfassende Wundversorgung gewährleisten zu können und die Situation in Bezug auf die Wunde bzw. die Wundbehandlung sicher einschätzen zu können, müssen folgende Fragen im Vorfeld der Behandlung berücksichtigt werden:
-
Welche Arztanordnungen liegen vor?
-
Wie war der Heilungsverlauf bis jetzt?
-
Worauf ist beim Verbandwechsel zu achten?
-
Was muss dokumentiert werden?
-
Welches Material brauche ich?
-
Wie organisiere ich den Ablauf?
-
Wer hilft mir?
-
Welche hygienischen Schutzmaßnahmen sind zu treffen?
-
Worauf muss in der Umgebung geachtet werden?
-
Wie muss der Patient vorbereitet werden?
Welche Arztanordnungen liegen vor? Je nach Wunde, Wundbeschaffenheit und Heilungsverlauf können die Arztanordnungen sehr unterschiedlich sein, z. B. zweimal tägliche Wundspülung mit Ringer-Spüllösung, Wundabstrich, rechtzeitige orale Schmerzmittelgabe vor Verbandwechsel usw.
Wie war der Heilungsverlauf bis jetzt? Was sagt die Pflegedokumentation? Hat sich die Wunde verändert? Benötige ich evtl. zusätzliche Informationen? Fragen wie diese sind im Vorfeld des Verbandwechsels zu klären, da sie entscheidenden Aufschluss über Wundstatus, Heilungsverlauf und nicht zuletzt über die Situation des Patienten geben können. Eventuell ist eine mikrobiologische Diagnostik vorzubereiten.
Worauf ist beim Verbandwechsel zu achten? Hier sind die ▶ Beobachtungskriterien, die Hygienerichtlinien und die Pflegestandards usw. zu berücksichtigen.
Was muss dokumentiert werden? In der schriftlichen und evtl. fotografischen Wunddokumentation müssen der Verlauf der Wundheilung, die Wundinspektion, die Beurteilung der ▶ Wundversorgung und die Verbandwechsel kontinuierlich nachvollziehbar sein.
Welches Material brauche ich? Aus dem Schrank oder Verbandwagen wird das notwendige Material bereitgelegt ( ▶ Abb. 23.12). Es variiert je nach praktizierter fachgerechter Vorgehensweise:
Material für einen Verbandwechsel.
Abb. 23.12
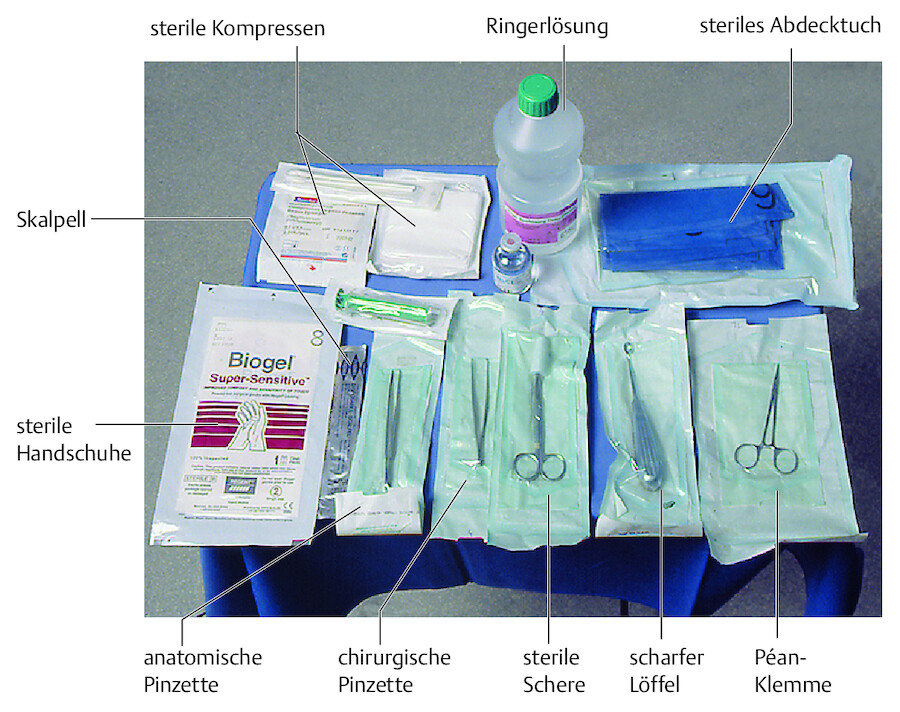
Sterile Materialien:
-
evtl. Einmalhandschuhe
-
evtl. Abdecktuch
-
anatomische und chirurgische Pinzetten zur Verbandabnahme, zum Débridement und zur Wundreinigung
-
evtl. scharfer Löffel oder Skalpell zum Débridement und zur Wundrandauffrischung
-
evtl. Wundantiseptika (Indikation beachten!)
-
Spritzen und Ringer-Spüllösung
-
evtl. Knopfkanüle und Sonden zum Sondieren der Wundtiefe und zum Spülen
-
Tupfer, Kompressen, evtl. salbenhaltige Gaze
-
Schere
-
Klemme (einzeln verpackt)
-
evtl. Material zu Faden- oder Klammerentfernung
Unsterile Materialien:
-
Schutzschürze
-
Händedesinfektionsmittel
-
Einmalhandschuhe
-
Abwurfbeutel
-
desinfiziertes Tablett zum Transport der Materialien
-
Mund-, Nasen- und Haarschutz bei großflächigen Wunden bzw. besonderer Infektiosität
-
Fixiermaterial wie Pflaster, Vliese, Binden, Netz- oder Schlauchverbände
-
Verbandschere
Praxistipp
Es ist darauf zu achten, dass sterile Materialien auch auf einer sterilen Unterlage gerichtet werden. Man sollte sie nicht zu früh vorbereiten, da sie sonst durch längeres Offenstehen kontaminieren. Lässt sich die frühzeitige Vorbereitung nicht vermeiden, sind die Materialien steril abzudecken.
Wie organisiere ich den Ablauf? Die Termine für den Verbandwechsel sind im therapeutischen Team festzulegen. Ihre Reihenfolge ist im Stationsbetrieb bei mehreren Verbandwechseln und verschiedenen Patienten unwesentlich. Strikt ist jedoch darauf zu achten, dass zuerst aseptische Wunden versorgt werden. Die jeweilige Ausführung muss auch so erfolgen, dass keine Keimübertragung stattfindet. Dabei sind das Tablettsystem und eine sorgfältige Händehygiene hilfreich. Das Tablett oder einzelne Materialien dürfen nicht auf dem Bett des Patienten abgelegt werden, ggf. kann der Nachttischauszug benutzt werden. Um die Gegenstände zweckmäßig zu platzieren, sollte Folgendes beachtet werden:
-
Arbeitsfläche (Tablett, ausgepacktes Set, Nachttischauszug) so vorbereiten, dass die Materialien beim Verbandwechsel neben und nicht hinter einem stehen (Arbeitserleichterung/Arbeitsorganisation).
-
Entsorgungssack patientennah, evtl. am Nachttischauszug, festkleben.
-
Nichtsterilisiertes Material patientennah vorbereiten (Flaschen, Tuben, geschlossene Sets, Heftpflaster usw.).
-
Sterilisiertes Material patientenfern anordnen → damit lässt sich das „Übergreifen“ über sterile Materialien (z. B. beim Abwerfen gebrauchter Verbandstoffe) vermeiden.
-
Benutzte Instrumente in Container für die Trockenentsorgung (zur maschinellen desinfizierenden Aufbereitung) oder in Desinfektionslösung ablegen.
Wer hilft mir? Kann ich die Wunde allein verbinden oder brauche ich die Mithilfe einer zweiten Person? Großflächige Wunden (z. B. Größe von ca. 2 Handflächen) und tiefe Wunden (Dekubitus 3. und 4. Grades, sekundäre Wundheilungen, entzündliche Prozesse, offene Frakturen und Fisteln) werden zur Wahrung der Asepsis immer durch 2 Personen verbunden. Das Vorgehen muss entsprechend koordiniert werden.
Welche hygienischen Schutzmaßnahmen sind zu treffen? Alle mit dem Patienten beim Verbandwechsel direkt in Kontakt kommenden Mitarbeiter müssen darauf achten, dass sie
-
vor und nach dem Verbandwechsel eine hygienische Händedesinfektion durchführen,
-
eine Schutzschürze und kurzärmelige Kleidung tragen (auch Ärzte!),
-
die Arbeitsfläche wischdesinfizieren (z. B. 70 % Alkohol und Einmaltuch),
-
sterile oder unsterile (zur Verbandabnahme) Schutzhandschuhe wählen,
-
größere Verbände außerhalb der Routinevisite mit eigenem Schutzkittel oder Schutzschürze durchführen,
-
bei eigener Erkältungskrankheit einen Mund-Nasen-Schutz tragen und
-
Sterilität der Materialien und bei der Durchführung der Verbandwechsel gewährleisten.
Worauf muss in der Umgebung geachtet werden? Während eines Verbandwechsels sollten im Zimmer
-
keine Reinigungs- oder Bettenarbeiten durchgeführt werden, da sonst Staub und Keime aufgewirbelt werden,
-
keine unbefugten Besucher im Patientenzimmer sein, denn der persönliche Schutz und die Intimität des Patienten müssen gewahrt bleiben (Bettvorhang oder Stellwand),
-
alle Fenster und Türen geschlossen bleiben und
-
genügend Platz und eine gute Beleuchtung gewährleistet sein.
Wie muss der Patient vorbereitet werden? Vor dem Verbandwechsel sollte der Patient ausführlich informiert werden über Zweck und Vorgehen. Erklärungen helfen, dass er seine Hände nicht in den Handlungsbereich der Wunde bringt (z. B. bei schmerzhaften Tätigkeiten). Falls notwendig, erhält er ca. 20 Minuten vor dem Verbandwechsel ein Schmerzmittel nach ärztlicher Anordnung (z. B. beim Ziehen eines T-Drains oder einer Tamponade). Für den Verbandwechsel muss er bequem und zweckmäßig positioniert werden. Darüber hinaus sollte ausreichend Zeit sein für evtl. Fragen des Patienten. Nach Abnahme des Verbandes sollte er nicht mehr über der Wunde sprechen, damit keine Keime in die Wunde gelangen.
23.2.5.3 Wundbeurteilung, mikrobiologische Diagnostik und Dokumentation
Voraussetzung einer adäquaten Wundbehandlung ist, das vorherrschende Wundstadium festzustellen. Selbst erfahrene Pflegende und Ärzte haben damit z.T. Schwierigkeiten.
Die Kriterien zur Wundbeurteilung werden in ( ▶ Tab. 23.13 ) dargestellt.
|
Hauptmerkmal der Wundoberfläche |
zusätzliche Kriterien |
|
Beläge und Nekrosen (Ausmaß und Beschaffenheit) |
|
|
schwarz (nekrotisch, ledrig) |
|
|
schwarz/gelb (Mischphase von Nekrose und Fibrin) |
|
|
schwarz/gelb/rot (Mischphase von Nekrose + Fibrin + Granulation) |
|
|
gelb (Fibrinbelag) |
|
|
Granulation (Vorhandensein, Beschaffenheit) |
|
|
gelb/rot (Fibrin + Granulation) |
|
|
rot (feste Konsistenz, feinkörnig, gut durchblutet) |
|
|
Epithelisation (Umfang) |
|
|
rot/rosa (Granulation + beginnende Epithelisation) |
|
|
rosarot (epithelisiert) Neubildung der Epidermis von den Wundrändern aus |
|
Zur korrekten Beurteilung und Dokumentation des Wundzustandes ( ▶ Abb. 23.13) sind folgende Wundmerkmale schriftlich festzuhalten:
Trockene Nekrose (großer Zeh), feuchte Nekrose (zweiter Zeh).
Abb. 23.13
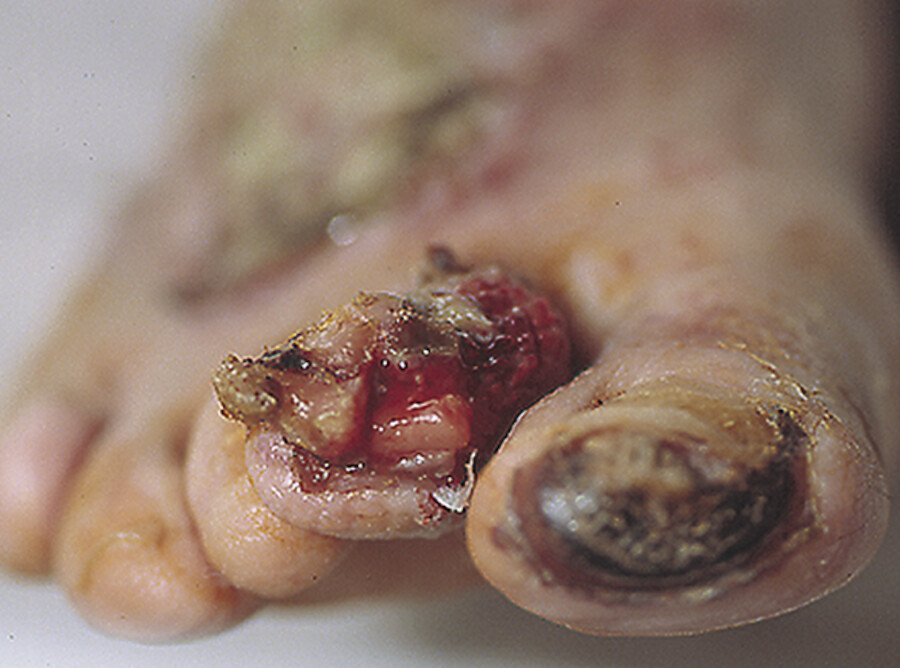
-
Beschaffenheit des Exsudats (serös, blutig)
-
Ausmaß der Sekretion (stark sezernierend, Wunde am Austrocknen usw.)
-
Grad der Blutungsneigung
-
Schmerzhaftigkeit der Wunde
-
evtl. Infektionsanzeichen (Schwellung, Rötung, gelbliche oder grünliche, schmierige Beläge, Geruch)
Regelhaft sind chronische Wunden von Mikroorganismen kolonisiert. Daher ist eine routinemäßige Bestimmung von Krankheitserregern unnötig. Wenn jedoch Hinweise auf eine erregerbedingte systemische Infektion, ausgehend vom Wundbereich, bestehen, müssen ▶ mikrobiologische Proben entnommen werden.
Die Wunddokumentation erfolgt grundsätzlich immer schriftlich, evtl. zusätzlich fotografisch. Sie sollte zeitnah erfolgen, aber erst nach Beendigung des Verbandwechsels, damit während der Wundversorgung keine Unterbrechung entsteht. Die Dokumentation beinhaltet Informationen über
-
Wundzustand,
-
Wundversorgung und
-
Verbandwechsel.
Praxistipp
Zur Beurteilung der Wundheilung muss die Wunde immer im selben Abstand, bei gleicher Beleuchtung (weil sonst die Farben unterschiedlich sind) und in derselben Lagerungsposition begutachtet werden.
Die schriftliche Fixierung der Wunddokumentation ist wichtig
-
zur Wundanalyse,
-
zur Informationsweitergabe und
-
aus rechtlichen Gründen.
Wundanalyse Bei der Wundanalyse werden
-
Wundgröße,
-
Wundtiefe,
-
Unterminierungen im Bereich von Wundtaschen (d. h., der Wunde liegt lediglich Gewebe locker auf, das aber keine Verbindung zum Wundgrund hat),
-
Wundstadium,
-
Wundumgebung begutachtet.
Zudem sollte man sich folgende Fragen stellen:
-
Hat sich die Wunde seit dem letzten Verbandwechsel vergrößert/verkleinert?
-
Gibt es Fortschritte, Stagnation oder Rückschläge in der Behandlung?
-
Muss die Behandlung geändert werden?
Zur Größenbestimmung ist zunächst der Durchmesser zu bestimmen. Bei tiefen Geschwüren (z. B. Dekubitus) ist eine Tiefenbestimmung mit ihren Höhlen- und Taschenbildungen sowie Unterminierungen wichtig. Dieses Vorgehen dient u.a. auch der Qualitätssicherung.
Informationsweitergabe Um Beobachtungsergebnisse an die weiter- oder mitbehandelnden Ärzte und Pflegenden ohne Verlust an Fakten weitergeben zu können, ist eine korrekte Dokumentation erforderlich.
Rechtliche Gründe Um Beweise für die regelmäßig durchgeführten prophylaktischen und therapeutischen Maßnahmen der Wundbehandlung sichern zu können, ist die schriftliche Dokumentation von Wundzustand, Wundversorgung und Verbandwechsel unerlässlich; sie kann nicht durch ein Foto ersetzt werden. Die ▶ Dokumentationspflicht Pflegender ist im Krankenpflegegesetz (2015) in § 3 Abs. 2 fixiert. Hilfreich ist dafür ein vorgegebener Dokumentationsbogen.
Bezüglich der fotografischen Dokumentation muss beachtet werden, dass der Patient der Aufnahme zustimmt und das Foto immer mit Datum, Größenangaben und Patientendaten zu versehen ist. Sie ist Bestandteil der Patientenakte.
Merke
Eine konsequente Fotodokumentation kann eine gute Ergänzung zur Verlaufsdokumentation darstellen.
23.2.5.4 Wundreinigung
Indikation Grundsätzlich ist zwischen der prophylaktischen Antiseptik und der Anwendung aus therapeutischer Indikation zu unterscheiden. Typische prophylaktische Indikationen sind
-
Primärversorgung verschmutzter, kontaminierter Wunden und
-
Versorgung traumatogener Wunden.
Die Wundantiseptik erfolgt hier immer mit chirurgischer Wundrevision bzw. Débridement. Dazu muss die Lösung auf Körpertemperatur angewärmt werden.
Merke
Die Wundheilung wird durch Auskühlung der Wunden um Stunden verzögert.
Kontraindikation Keine Indikation zur Antiseptik besteht bei folgenden Wunden:
-
abgetrocknete Operationswunde ab dem 2. Tag
-
heilende Gelegenheitswunde
-
heilendes Hauttransplantat
-
chronische Wunde
Bei chronischen Wunden dürfen Zellschädigungen nicht in Kauf genommen werden. Ausnahme ist eine bestehende Infektion.
Auswahl von Wundantiseptika Bei der Auswahl lokal anzuwendender Wundantiseptika sind in erster Linie folgende Kriterien zu berücksichtigen:
-
Wirkung gegen Mikroorganismen (antimikrobielle Wirkung)
-
Geschwindigkeit der Wirkungsentfaltung
-
Beeinflussung der Wirkung durch Eiweiß, Blut und pH-Veränderungen
-
Zytotoxizität
-
Wundverträglichkeit
Es gibt nur eine kleine Auswahl zellverträglicher Mittel ohne Selektionsdruck.
Für oberflächliche, lokal begrenzte und tiefe Wunden sind PVP-Jod-Lösungen geeignet (1:10 mit Ringer-Spüllösung verdünnt). Polihexanid (z. B. Lavanid) und PVP-Jod-Präparate (z. B. Braunol) dürfen nicht zusammen angewendet werden: Sie haben Wechselwirkungen!
Nicht oder nicht ausreichend wirksam sind lokale Antiseptika auf der Basis von Farbstoffen (z. B. Gentianaviolett) und Wasserstoffperoxid 3 %. Auch antibiotikahaltige Salben stören, über längere Zeit angewandt, die Wundheilung: Sie schädigen die Granulozytose und Lymphozytose mehr als die Mikroben. Weiterhin stören sie die Durchblutung und behindern die Bildung von Granulationsgewebe. Dadurch verzögern sie signifikant die Heilung, abgesehen davon, dass sie Kontaktallergien und Resistenzen Vorschub leisten.
23.2.5.5 Verbandtechniken und Verbandwechsel
Voraussetzungen eines Verbandwechsels
Beim Umgang mit verletzten und verwundeten Patienten müssen die ▶ allgemeinen Maßnahmen der Hygiene gewährleistet sein. Darüber hinaus sind beim Wechsel von Wundverbänden noch folgende hygienische Richtlinien zu beachten:
-
Kreuzkontaminationen vermeiden
-
Tablettsystem nutzen
-
Schutzkleidung tragen
-
Non-Touch-Technik praktizieren
Kreuzkontaminationen vermeiden Da die Weiterverbreitung von Infektionen im Wesentlichen über die Hände der Mitarbeiter geschieht, ist die hygienische Händedesinfektion vor und, wegen möglicher Handschuhdefekte, nach jedem Verbandwechsel unbedingte Voraussetzung. Zudem müssen die Arbeitsfläche und der evtl. verwendete Verbandwagen nach jedem Gebrauch desinfiziert werden. Das Tragen einer Schutzschürze entspricht der Standard-(Basis-)Hygiene.
Tablettsystem nutzen Das benötigte Material wird im Verbandwagen ( ▶ Abb. 23.14) oder in einem Schrank der Station gelagert. Es hat sich in der Praxis bewährt, einen Verbandwagen nicht mit ins Patientenzimmer zu nehmen. Stattdessen wird ein jeweils frisch desinfiziertes (z. B. mit 70 %igem Alkohol) Tablett für das Verbandmaterial benutzt, um die Gefahr von Kreuzkontaminationen zu vermeiden. Bei materialaufwendigen Verbandwechseln kann auch ein fahrbarer Mehrzweckwagen eingesetzt werden. Die für den Verbandwechsel erforderlichen Gegenstände sollten ▶ hygienisch zweckmäßig platziert werden.
Verbandwagen zur Lagerung des Materials.
Abb. 23.14
(Foto: K. Oborny, Thieme)

Praxistipp
Möglichst zu zweit arbeiten, insbesondere bei aufwendigen Verbandwechseln, z. B. bei großen Druckgeschwüren und ▶ Dehiszenz der Bauchwandschichten.
Schutzkleidung tragen Bei ausgedehnten infizierten Wunden ist das Tragen von Schutzkitteln bzw. Einmalschürzen sinnvoll. Vor dem Anziehen und nach dem Ausziehen der Handschuhe sollte eine hygienische Händedesinfektion durchgeführt werden.
Non-Touch-Technik praktizieren Empfehlenswert ist beim Verbandwechsel die Non-Touch-Technik, d. h., zum Abnehmen des Verbandes werden (unsterile) Einmalhandschuhe und zur Versorgung der Wunde sowie zum Auflegen der ersten Verbandlage sterile Handschuhe bzw. Instrumente verwendet (keine Berührung von Haut, Wunde oder sterilen Gegenständen mit bloßen Händen oder unsterilen Instrumenten). Auch sollte unbedingt vermieden werden, mit kontaminierten Handschuhen Gegenstände wie Flaschen, Tuben, Arbeitsflächen, Verbandwagen usw. zu berühren.
Abdeckung trockener, geschlossener Wunden
Die geringsten Schwierigkeiten machen primär heilende, durch Naht verschlossene Wunden. Ziel des Wundverbandes ist es, eventuelle Sickerblutungen aufzunehmen und die Wunde vor Sekundärinfektionen bzw. vor mechanischen Irritationen zu schützen. Als Verbandmaterial ist eine trockene Wundabdeckung empfehlenswert, z. B. mit sterilem Pflaster (selbsthaftender Wundverband) oder sterilen Kompressen, die mit Fixierpflaster/-vlies befestigt werden. Nach 24 Stunden ist diese Wunde geschlossen (Oldhafer 2007); ein weiterer Verbandwechsel erfolgt nur auf Wunsch des Patienten (Schutz vor Reiben der Kleidung).
Durchführung Die trockene Wundabdeckung wird folgendermaßen durchgeführt:
-
Hände desinfizieren und unsterile Einmalhandschuhe anziehen
-
alten Verband lösen
-
direkte Wundauflage/Kompresse vorsichtig entfernen
-
Zustand der Wunde einschätzen, beurteilen und Verband auf Sekretabsonderungen inspizieren
-
Material in Abwurfbeutel abwerfen
-
unsterile Handschuhe ausziehen und abwerfen
-
Händedesinfektion
-
Überlegung, ob Folgeverband erforderlich/gewünscht
-
mit steriler Pinzette oder sterilen Handschuhen weiter vorgehen
-
evtl. die Wunde von innen nach außen mit einem sterilen Tupfer oder einem Watteträger mit Ringer-Spüllösung reinigen (eine routinemäßige Wundantiseptik ist hier nicht angebracht!)
-
sterile Wundauflage aufbringen
-
Verband mit Pflaster, Fixiervlies oder Mullbinde fixieren
-
benutzte Materialien in den Abwurfbeutel abwerfen
-
Patienten wieder in die gewünschte Lagerungsposition bringen und zudecken
Prävention und Gesundheitsförderung
Eine frühzeitige Pflege der Narbe, d. h. der verschlossenen Wunde, und ihrer Umgebung hält die Haut geschmeidig. Das Einreiben kommt zudem einer leichten Gewebemassage gleich und wirkt wohltuend. Es eignen sich Öle, z. B. Johanniskrautöl, Mandelöl sowie Ringelblumen- (Calendula-) und Sonnenhutsalbe (Echinacea). Der Patient wird vor der Entlassung zur Selbstpflege angeleitet.
Abdeckung offener, nicht infizierter Wunden
Sehr viel höher sind die Anforderungen an die korrekte Materialauswahl und Verbandtechnik bei sekundär heilenden, akuten und chronischen Wunden. Ziel ist es, beim Verbandwechsel das Granulationsgewebe nicht zu verletzen. Geeignet sind nicht verklebende Gelkompressen (z. B. Comprigel) oder wundfreundliche, wirkstofffreie Salbenvliese (z. B. Atrauman). Sie werden mit einer weiteren Wundauflage (sterile Mullkompresse) kombiniert und mit Fixierpflaster, Fixiervlies oder Mullbinde befestigt. Der Verbandwechsel erfolgt je nach Wundsekretion 1- bis 2-täglich.
Durchführung Vorgehen wie oben beschrieben. Vorsichtig die Wundauflage entfernen. Lässt sie sich nicht abnehmen, weil sie mit der Wunde verklebt ist, darf sie auf keinen Fall abgerissen werden. Befeuchten Sie die Auflage mit Ringer-Spüllösung, bis sich die Verklebung gelöst hat.
Okklusive Wundbehandlung
Damit der bestehende Hautdefekt einer chronischen Wunde abheilen kann, müssen die ▶ lokalen Stör- und systemischen Einflussfaktoren beim Pflege- und Behandlungsplan mitberücksichtigt werden.
Als Verbandmaterial sind moderne Verbände geeignet, die auf dem ▶ Okklusionsprinzip beruhen. Sie halten die Wunde nach dem Modell einer Hautblase feucht, warm und sauber. Darüber hinaus schützen sie den Wundrand vor Mazeration (Aufweichen, Gewebeauflösung) und saugen überschüssige Feuchtigkeit auf.
Wechselintervalle Von den Herstellern werden lange Intervalle von mehreren Tagen, gar bis zu einer Woche angegeben. Besonders in der Reinigungsphase beobachtet man jedoch oft eine derart starke Exsudation, dass die Auflagen in wesentlich kürzeren Abständen, teilweise sogar täglich gewechselt werden müssen. Ist die Sekretion sehr stark, sollten saugfähige Alginatverbände, Schaumverbände oder eine kontinuierliche ▶ V.A.C.-Therapie eingesetzt werden, um häufige Verbandwechsel zu vermeiden.
Bei Sättigung der Hydrokolloide zeigt sich über der Wunde eine Quellungsblase. Wenn sie den Wundrand erreicht hat, muss der Verband gewechselt werden ( ▶ Abb. 23.15). Eine Mazeration der Wundränder kann sonst nicht ausgeschlossen werden.
Wechsel eines Hydrokolloidverbandes einschließlich Spülung.
Abb. 23.15
(Foto: Thieme Verlagsgruppe)
Markierung der Wundränder Beim frisch aufgeklebten Verband erkennt man die Wundränder am besten; daher empfiehlt es sich, sie mit einem Stift vorsichtig auf dem Verband zu markieren. Einige Produkte weisen eine zum Archivieren geeignete bedruckte Rasterfolie auf, auf der die Wundgröße nach der Applikation mit einem Markerstift dokumentiert werden kann ( ▶ Abb. 23.16). Zu häufige und zeitlich ausgedehnte Verbandwechsel sollten vermieden werden, da jeder Verbandwechsel eine Störung der Wundruhe bedeutet und der Temperaturabfall in der Wunde den Heilungsverlauf bremst.
Bestimmung der Wundgröße.
Abb. 23.16 Mit einer dem Wundverband beiliegenden Rasterfolie kann die Größe der Wunde bestimmt und dokumentiert werden.
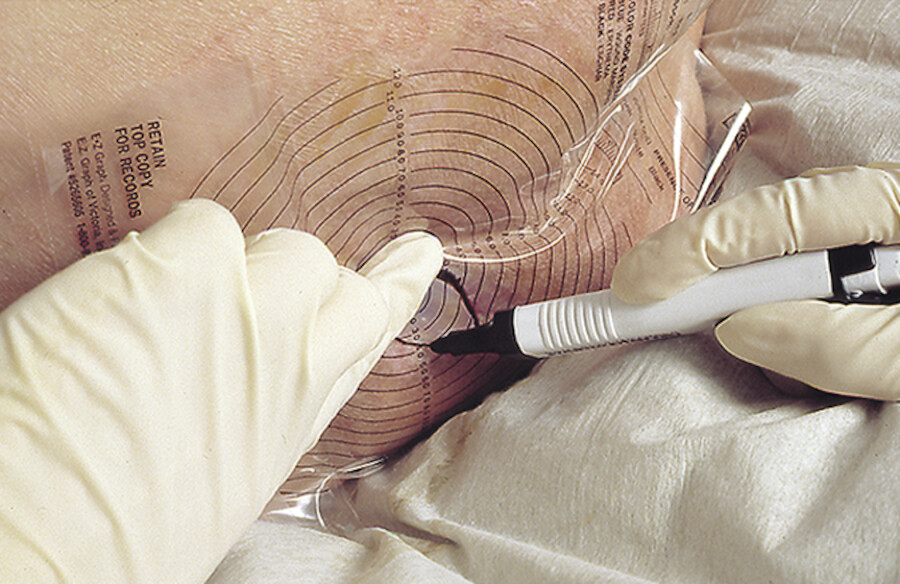
Entfernen des Verbandes
Der Verband wird folgendermaßen entfernt:
-
Händedesinfektion
-
unsterile Handschuhe anziehen
-
Fixierung des Verbandes entfernen (Verbände zur feuchten Wundbehandlung verkleben nicht mit der Wunde, daher wird bei diesem Verbandwechsel eine Verletzung des jungen, äußerst empfindlichen Epithels vermieden)
-
Wundauflage vorsichtig mit Pinzette entfernen
-
Zustand der Wunde (Wundinspektion und Beobachten des Verbandes auf Sekretabsonderung) einschätzen
-
unsauberes Material sofort in Abwurfbeutel abwerfen und diesen entsorgen
-
Schutzhandschuhe achtsam ausziehen („schnalzen lassen“ verbreitet Keime), Händedesinfektion, sterile Handschuhe anziehen
Wundgeruch Riecht die Wunde stark, kann dies sehr unangenehm für den Patienten und seine Angehörigen sein. Hydrokolloidverbände sind zwar geruchsdicht, entfernt man diese jedoch, riecht es besonders intensiv. Das Problem ist leider nicht völlig zu lösen, einige mildernde Hilfen gibt es jedoch:
-
Zimmer regelmäßig gründlich lüften
-
Aktivkohleverbände nutzen
-
Schälchen mit ätherischen Ölen aufstellen
-
Kräuterkissen im Raum aufhängen
-
alte Verbände direkt nach dem Verbandwechsel aus dem Patientenzimmer entfernen
Merke
Eine starke Vermehrung des Wundsekrets, oft von fauligem Geruch, ist charakteristisch für eine hydrokolloide Okklusionsbehandlung. Oft wird dies fälschlicherweise als Wundinfektion angesehen. Keinesfalls ist ein Therapieabbruch angebracht!
Reinigung der Wunde und Wundumgebung
Septische Wunden werden von außen nach innen gereinigt (um die Keimverschleppung auf gesundes Gewebe zu verhindern), evtl. mit einem geeigneten Wundantiseptikum. Beläge und devitalisiertes Gewebe müssen vom Arzt mechanisch mit Skalpell oder einem scharfen Löffel entfernt werden.
Eine effektive Wundreinigung ist durch die Spülung mit Ringer-Spüllösung oder NaCl 0,9 % möglich. Für tiefe, zerklüftete Wunden muss die Spritze mit einer Knopfkanüle oder einem kurzen Katheter verbunden werden. Auffangen kann man die Flüssigkeit mit sterilen Kompressen oder Nierenschale; anschließend den Wundrand sorgfältig mit Tupfern trocknen. Das erhöht die Haftung und verhindert eine Hautmazeration durch das Wundsekret. Kein Wundbenzin anwenden, da durch Feuchtigkeitsentzug der Haut die Haftkraft des Verbandes beeinträchtigt wird.
Beim Duschen darf Leitungswasser nicht in die Nähe der Eintrittsstellen von intravasalen Kathetern, Wunden oder Drainagen gelangen. Hier kann eine Folienabdeckung schützen.
Aufbringen der neuen Wundauflage
Nach der Wundreinigung wird die neue Wundauflage steril appliziert. Bei tiefen serösen Wunden (mehr als 1 cm) wird mit geeigneter Tamponade (z. B. Alginat) aufgefüllt, um auch in der Tiefe der Wunde das Aufsaugen keimbelasteten Sekrets sicherzustellen ( ▶ Abb. 23.17). Wichtig ist, dass nicht zu fest tamponiert wird, da sonst die Mikrozirkulation der Wundfläche beeinträchtigt wird.
Verbandwechsel.
Abb. 23.17 Fachgerechter Verbandwechsel mit Alginat-Tamponade und abschließendem Hydrokolloidverband.
(Foto: Thieme Verlagsgruppe)
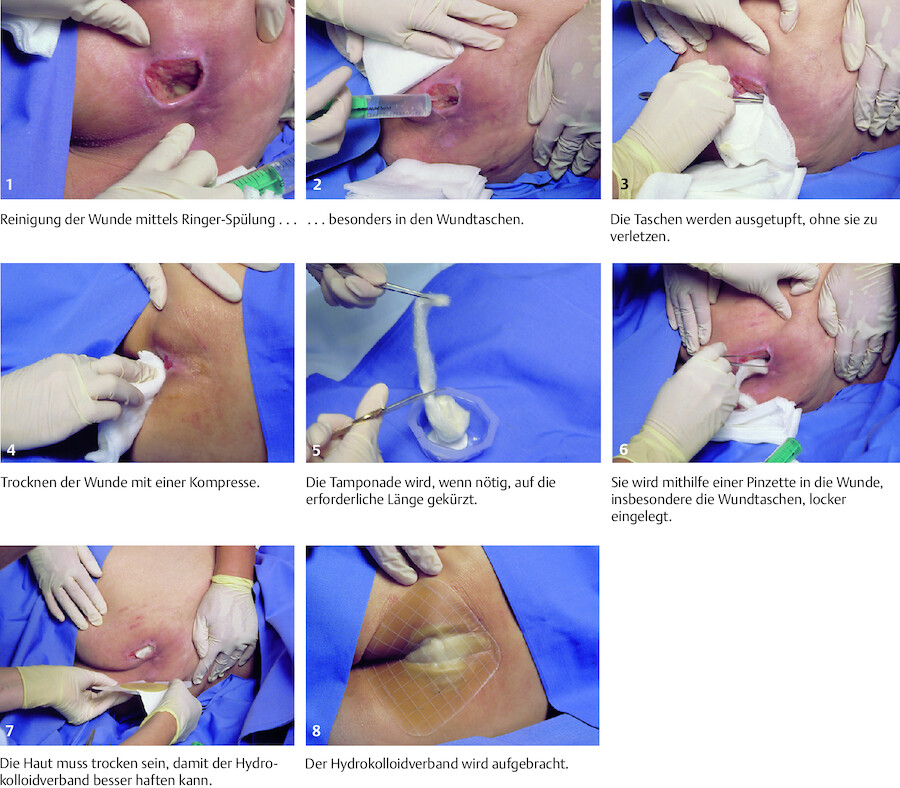
Größenbestimmung der Wundauflage Die Wunde muss 2 cm über den Rand abgedeckt sein. Wenn mehrere hydroaktive Verbände erforderlich sind, sollen sie sich überlappen.
Durchführung Der Wundverband wird ohne Berühren der sterilen Oberfläche von der Folie abgezogen und auf die Wunde geklebt. Dank ihrer Elastizität und selbstklebenden Eigenschaften lassen sich hydroaktive Verbände gut anmodellieren. Anschließend wird der Verband für ca. 1 Minute angedrückt, insbesondere an den Rändern. Das Haftvermögen nimmt durch das Erwärmen mit den Händen zu. Bei Bedarf kann man die Auflage zusätzlich mit einem lose angelegten Verband oder mit einer semipermeablen Klebefolie (Tegaderm, Opsite) sichern.
Praxistipp
Achten Sie auf eine zirkuläre Okklusion. Der hydrokolloide Verband muss daher mehrere Zentimeter über die Wundränder hinausgehen. Andernfalls kommt es zu einem frühzeitigen Wundsekretaustritt bzw. zu einem „Abschwimmen“ der Hydrokolloidauflage.
23.2.6 Wunddrainagen
Definition
Mit Drainagen, flexiblen, oft perforierten Schläuchen, werden aus Operationswunden sowie Körper- oder Abszesshöhlen Flüssigkeitsansammlungen wie (Wund-)Sekret, Blut, Galle, Verdauungssaft oder Eiter abgeleitet (Sitzmann 2014).
23.2.6.1 Funktionen von Wunddrainagen
Wie aktuelle Cochrane-Reviews bilanzieren, gibt es für den Einsatz von Wunddrainagen nach „aseptischen“ Operationen keinen Beleg für ihren Nutzen. Ganz im Gegenteil, Drainagen z.B. nach Kaiserschnitt oder Gallenblasenoperation verzögern die zeitnahe Mobilisation des Patienten und verlängern die Verweildauer. Weiter konnte kein positiver Effekt auf die Reduktion der Infektionsneigung festgestellt werden (Anonym 2010).
Bei bestimmten Krankheitsbildern und Operationen kann jedoch die Anlage einer Drainage sinnvoll sein. Es können zwei grundlegende Funktionen von Drainagen unterschieden werden:
-
prophylaktische Funktion (präventiv)
-
therapeutische Funktion (kurativ)
Prophylaktische Funktion Drainagen werden mit präventiver Absicht eingelegt, z.B. als
-
Sekretdrainage in der Bauchhöhle
-
Redon-Drainage im Weichteilgewebe.
Die prophylaktische Wunddrainage soll die postoperative Wund- und Heilungskontrolle unterstützen, Wundinfektionen vermindern sowie Nachblutung, Ergussbildung (Hämatome und Serome bei unsicherer Blutstillung) und Anastomoseninsuffizienz, d. h. Nahtundichtigkeit des Magen-Darm-Trakts (insbesondere bei Ösophagusresektion und Colonanastomosen) reduzieren.
▶ Abb. 23.18 zeigt die häufigsten Lokalisationen von Drainagen in der Bauchhöhle.
Häufige Lokalisationen von Drainagen in der Bauchhöhle.
Abb. 23.18
Eine weitere vorbeugende Funktion wird in präoperativen Drains gesehen bei Abszessen einer Sigma-Divertikulitis.
Merke
Durch prophylaktische Wunddrainagen soll eine Ansammlung von Körpersekreten (Wundsekret, Blut und Lymphe) verhindert werden. Darüber hinaus werden eine Fixierung der inneren Wundflächen sowie eine frühwarnende Indikatorfunktion bei Komplikationen (z. B. Anastomoseninsuffizienz, Blutungen) erwartet (Welsch u. Büchler 2011).
Therapeutische Funktion Unter den Drainagen gibt es auch solche, die eine therapeutische Funktion haben. Zu diesen zählen z.B. Ableitungsdrainagen, die der Wiederausdehnung der Lunge nach Thorakotomie helfen oder den Blutabfluss nach Hämo-/Pneumothorax unterstützen.
Zunehmend werden therapeutische Eingriffe zur Drainagebehandlung mit endoskopischen und perkutanen interventionellen Verfahren unter Bildsteuerung (Ultraschall, CT oder MRT) durchgeführt.
23.2.6.2 Wert in der septischen Chirurgie
Drainagen ihren therapeutischen Wert bei
-
kontaminierten/infizierten Schnitt- und Quetschverletzungen,
-
Tier- und Menschenbissverletzungen und
-
bei eröffneten Abszessen, z. B. in der proktologischen Chirurgie.
Bei Gelenkinfektionen sind nach radikalem Débridement jeweils Spülung und Drainage indiziert.
23.2.6.3 Wirkprinzipien von Wunddrainagen
Bei den meisten Drainagen sind eine oder mehrere Gummilaschen oder ein Schlauch aus Gummi oder Kunststoff (Drain) oder selbstsaugende Materialien wie Gaze oder Schaumstoff erforderlich. Zum anderen ist eine Druckdifferenz (Sog) zwischen der Drainspitze und dem Auffangbehältnis nötig. Diese wird zur Sekretförderung durch unterschiedliche physikalische Prinzipien erzeugt:
-
Schwerkraft (mit 0 mmHg Sogstärke)
-
Kapillarwirkung
-
Heberprinzip
-
Saugprinzip (Vakuum)
Schwerkraft (mit 0 mmHg Sogstärke) Bei der Schwerkraftdrainage wird das angesammelte Sekret durch den Drain vom tiefsten Punkt z. B. der Körperhöhle in einen tiefer gehängten Ablaufbeutel abgeleitet.
Kapillarwirkung Bei Drainagen durch Kapillarwirkung wird die Adhäsion (Kapillarkraft) genutzt, um das Sekret bzw. Exkret sogar aufwärts in einen Verband abzuleiten. Dieses Prinzip kann bewirkt werden durch Verbandmull als „Docht“ in einer Wunde, wie beim Penrose-Drain (Mulldocht in einem dünnwandigen Gummirohr [ ▶ Abb. 23.19 c]) oder beim Easy-Flow-Drain (einem weichen Kunststoffrohr mit längs geripptem oder waschbrettartig geformtem engem Innenlumen [ ▶ Abb. 23.19 e]).
Wunddrainagearten.
Abb. 23.19 a Tamponade, b Gazedocht (wird bis zur Stelle der Sekretion in den Wundkanal hineingeschoben), c Penrose-Drain, d Gewellter Plattendrain (angenäht und mit einer Sicherheitsnadel gesichert), e Silikonkapillardrain („easy flow“), f T-Drain, g Robinson-Drainage (Reflux von Wundsekret aus dem Reservoir in die Wundhöhle wird durch ein Einweglippenventil verhindert), h Spül-Saug-Drainage-Katheter.
Heberprinzip Drainagen nach dem Heberprinzip nutzen das Prinzip „verbundener Röhren“, um die Flüssigkeit zunächst zwar aufwärts, aber schließlich in tiefer gelegene Auffangbeutel oder -flaschen abzuleiten. Sie dienen hauptsächlich der Ableitung von Magen-, Darm- und Gallensekreten. Unbedingte Voraussetzung für eine einwandfreie Funktion ist das Aufrechterhalten der Höhendifferenz zwischen dem Flüssigkeitsspiegel im Reservoir und im Auffanggefäß. Es besteht nur eine geringe, schonende Sogwirkung.
Saugprinzip (Vakuum) Bei dieser Drainagenform wird ein extern erzeugtes Vakuum genutzt. So wird freie Flüssigkeit oder Luft drainiert.
Angewendet werden
-
Vakuumflaschen (Unterdruckflaschen), z. B. ▶ Tab. 23.14 ,
-
sich selbst expandierende Faltenbälge oder Plastikbälle, ▶ Tab. 23.14 , oder
-
Saugpumpen ( ▶ Tab. 23.14 ).
Bei der Thoraxsaugdrainage, die bei Pneumothorax nach Verletzung oder Operation im Brustkorb angewendet wird, wird ein definierter Sog (meist 15 – 30 cm Wassersäule) genutzt.
Aktive und passive Drainagen
Als aktive Drainagen werden z. B. Saug- und Schlürf-Drainagen bezeichnet, bei denen das mittels einer Pumpe oder vorevakuierter Flasche erzeugte Vakuum genutzt wird. Davon sind zu unterscheiden passive Drainagen, die von der Druckdifferenz zwischen Drainspitze und Auffangbehältnis abhängig sind, z. B. Schwerkraft-, Überlauf-, Penrose- und Easy-Flow-Drainagen.
23.2.6.4 Einteilung von Drainagesystemen
Prinzipiell unterscheidet man:
-
innere Drainagen
-
nach außen abgeleitete Drainagen
Innere Drainagen Sie stellen eine Verbindung zwischen 2 Organen her (z. B. verbindet die Liquordrainage beim Hydrozephalus die Hirnventrikel mit dem Peritonealraum) oder schienen ein verengtes Gangsystem im Körperinnern (z. B. eine verengte Koronararterie, die durch einen Tumor verengte Speiseröhre oder den Gallengang). Innere Drainagen, z. B. Stents (gewirkte Drahtgeflecht- oder Plastikröhrchen), wirken als selbstexpandierende Endoprothesen und werden als „verlorene Drainagen“ bezeichnet. Diese Drainagen können operativ, minimalinvasiv oder endoskopisch eingeführt werden und bleiben dauerhaft im Körper. Die Funktion innerer Drainagen wird dem jeweiligen Kapitel des Krankheitsbildes zugeordnet behandelt.
Äußere Drainagen Die nach außen abgeleiteten Drainagesysteme werden eingelegt, um Eiter, Blut, Körpersekrete oder Flüssigkeitsansammlungen, die sich später bilden können, nach außen zu entleeren. Sie lassen sich unterteilen in
-
offene Ableitungen (leiten das Sekret über einen Schlauch, eine Mull- oder Gummieinlage in den Verband ab),
-
halboffene Ableitungen (das Sekret wird in Beuteln oder Flaschen gesammelt, evtl. leitet die Austrittsstelle der Drainage in einen auf die Haut geklebten Beutel),
-
geschlossene Ableitungen (das distale Ende der eingebrachten Drainage führt direkt in ein Reservoir in Form einer Flasche oder eines Beutels).
Wegen den schwerwiegenden Konsequenzen einer Wundinfektion gelten heute die geschlossenen Drainagen als Bestandteil der Standardtherapie. Weitere spezielle Katheter in der Bauchhöhle werden zur ▶ Peritonealdialyse und zur Aszitesdrainage angewendet.
23.2.6.5 Drainagesysteme
▶ Tab. 23.14 gibt eine Übersicht über die verschiedenen Wunddrainagesysteme. Es wird zwischen offenen, halboffenen und geschlossenen Systemen differenziert.
|
Bezeichnung |
Art |
Einsatz |
Indikation und Lokalisation |
Pflege |
|
Kurzrohrdrainage (Lasche, Drainagestreifen) |
offenes System |
kurz über der Haut abgeschnittene und mit Naht und/oder Sicherheitsnadel fixierte Drainage |
nach operativer Abszesseröffnung Einlage in Wundhöhle, um Granulation zu sichern |
|
|
Langrohrdrainage (Schwerkraftdrainage mit Auffangbeutel) |
halboffenes System |
Drainage mit abgerundeter Spitze, einigen versetzten Perforationen (runde oder flache Ausführung) und Auffangbeutel, der entweder an der Austrittsstelle der Drainage direkt auf der Haut klebt oder mit einer Ableitung zu einem Beutel führt |
postoperative abdominelle Ziel- bzw. Sicherheitsdrainage bei intestinalen Anastomosen, Milzloge, subphrenisch (li.), subhepatisch (re.), Douglas-Raum (li. und/oder re.), retroperitoneal |
|
|
T-Drainage mit Sekretauffangbeutel |
passive halbgeschlossene/-offene Schwerkraftdrainage |
T-förmige kleinlumige (Langrohr-)Drainage, die intraluminal in den Gallengang eingelegt wird |
|
|
|
Robinsondrainage |
Langrohrdrainage als geschlossenes System mit Auffangbeutel |
Silikondrainage (100 bis 130 cm lang und diverse Lumen) mit abgerundeter weicher Spitze und seitlich versetzten trichterförmigen Perforationen |
|
|
|
Easy-Flow-Drainage |
passive halbgeschlossene (nur Drainagerohr) oder offene Kapillardrainage |
durch Kapillarwirkung steigt das Sekret aus der Wunde in den Verband oder sterilen Beutel, der auf die Haut geklebt wird |
|
Hautzustand an der Austrittstelle der Drainage beobachten (Hautschutz) |
|
Penrose-Drain (Drainagerohr, Lasche) |
passive, meist offene Docht- oder Kapillardrainage |
kapillare Saugkraft der Dochtwirkung zieht Sekret aus der Wunde |
Abszess- und/oder Wundhöhlen |
Hautzustand an der Austrittstelle der Drainage beobachten (Hautschutz) |
|
Redon-Drainage |
halboffenes System |
|
|
bei Bedarf Flaschenwechsel unter sterilen Bedingungen |
|
Jackson-Pratt-Drainage |
Drainage mit Unterdruckbehälter verbunden |
|
ohne Sog in Bauchchirurgie eingesetzt |
|
|
Spül- bzw. Spül-Saug-Drainage (kontrollierter Sog) |
|
|
Beobachtung und Bilanzierung der einlaufenden Spülflüssigkeit und des ablaufenden Sekrets sowie Dokumentation |
23.2.6.6 Mögliche Komplikationen der Drainagesysteme
Der Einsatz von Drainagen wird in Fachkreisen vielfach diskutiert und ist durchaus strittig (Pichl 2005). Befürworter argumentieren mit der Signalfunktion des Drains bei Blutungen und Anastomoseninsuffizienzen und der Vermeidung von Komplikationen oder Infektionen.
Gegner hingegen zweifeln die Zuverlässigkeit der Signalfunktion an, da Fibrinablagerungen oder Blutkoagel vielfach die Drains innerhalb weniger Stunden verstopfen, wodurch sie ihre ableitende Funktion und damit auch ihre Signalfunktion verlieren.
Hinzu kommt, dass viel der ausfließenden Flüssigkeit durch die Reaktion des Gewebes auf den eingebrachten Fremdkörper entsteht.
Die Indikationen für Drainagen werden daher aufgrund ihrer Nebenwirkungen immer kritischer gestellt (Treutner 2003), insbesondere im Bereich der Elektivchirurgie (geplante Eingriffe) und im ▶ Fast-Track-Konzept. Auch für die Pflegenden ist es daher wichtig, die Gefahren der Drainagen zu kennen und bei der Pflege zu beachten. Zu den häufigsten Komplikationen gehören
-
aufsteigende Infektionen über den Drainageschlauch,
-
Arrosionsblutungen und Verwachsungen.
Sie wirken zudem negativ auf das Krankheitsgefühl des Patienten.
Aufsteigende Infektionen Alle Drainagen und Kathetersysteme, die durch die äußere Haut in den Körper geführt werden, stellen eine Eintrittsmöglichkeit für Mikroorganismen dar, können eine bakterielle Kontamination fördern und zur Infektion führen. Entweder steigen die Mikroben durch das Lumen oder entlang der Außenwand des Schlauches auf. Entscheidend ist die Liegedauer.
Zudem soll ein Infektionsrisiko durch ein möglichst geschlossenes System und aseptische Manipulationen an der Drainageaustrittsstelle vermieden werden.
Merke
Da jede Drainage einen Fremdkörper darstellt, führt sie zur Reizsekretion der Wunde. Wegen der Gefahren durch aufsteigende Infektionen gilt: Drainagen sind so lange wie nötig anzuwenden und so kurz wie möglich.
Arrosionsblutungen und Verwachsungen Das starre Ende des Schlauches kann das umgebende Weichteilgewebe mechanisch schädigen (arrodieren). Werden dabei Blutgefäße verletzt, kann es zu gefährlichen Blutungen kommen. Verwachsungen können als lokale Komplikation postoperativ entstehen z. B. durch eingebrachtes Fremdkörpermaterial (Nahtmaterial, Drainagen) oder durch die angewandte Operationstechnik (u. a. Anwenden elektrischer Blutstillung = Kauter). Bei Verwachsungen handelt es sich um fibrinöse Verklebungen bauchfellüberzogener Eingeweide, die zum (Briden-)Ileus (Darmverschluss) führen können.
Krankheitssituation des Patienten Drainagen, die aus dem Körper führen, können das Krankheitsgefühl des Patienten verstärken. Dauernd austretende Sekrete erinnern ihn an sein Kranksein. Die Angst kann zunehmen, wenn er unzureichend über Saugsysteme informiert ist. Die Geräusche der Saugsysteme beeinträchtigen seine Nachtruhe und er hat das Gefühl, die Funktion der Geräte überwachen zu müssen. Zudem schränken die Drainagen die Beweglichkeit des Patienten ein und viele fürchten sich vor unkontrollierten Bewegungen.
23.2.7 Pflegeschwerpunkte im Umgang mit Drainagen
Berücksichtigt man die möglichen Komplikationen von Drainagesystemen, wird deutlich, dass ihr Einsatz nur mit eindeutigen ärztlichen Anordnungen im Rahmen der speziellen Pflege sicher gewährleistet werden kann. Nach der Einlage der Drainage müssen Pflegende klare Informationen über die Lage und Aufgabe des Systems erfragen und Überwachungskriterien (z.B. Sog, Ableitung, Systemwechsel, Liegedauer) schriftlich fixiert erhalten. Diese richten sich nach der Indikationsstellung der Drainage (z. B. prophylaktische Blutungsdrainage oder aktive therapeutische Drainage im Rahmen der Thoraxchirurgie oder Spül-Saug-Drainage). Entsprechend diesen Vorgaben müssen der Überwachungsplan (z. B. gesonderte Pflegeverlaufs- und Bilanzbögen) und die Planung der lokalen Pflegemaßnahmen (u. a. Beobachtung der Ein- und Austrittsstelle der Drainagekatheter, des Verbandes, der Sogstärke, Kontrolle auf Durchgängigkeit) erstellt werden.
Aufgaben der Pflege Bei der Pflege von Patienten mit angeschlossenen Drainagesystemen stehen folgende Aufgaben im Vordergrund:
-
Durchführung der Verbandwechsel
-
Kontrolle und Dokumentation des ablaufenden Sekrets
-
Kontrolle des Drainagesystems
-
Wechsel der Sekretbeutel oder Sekretflaschen und Leeren des Sekretsammelsystems
-
Assistenz beim Entfernen der Drainagen
23.2.7.1 Verbandwechsel bei Drainagen
Der Verbandwechsel ( ▶ Abb. 23.20) und die Inspektion der Drainageaustrittsstelle sollten nach Absprache mit dem Arzt geplant werden. Um mögliche Komplikationen zu vermeiden, sind folgende Richtlinien einzuhalten.
Fixieren einer Wunddrainage und Verbandwechsel.
Abb. 23.20
(Foto: Thieme Verlagsgruppe)
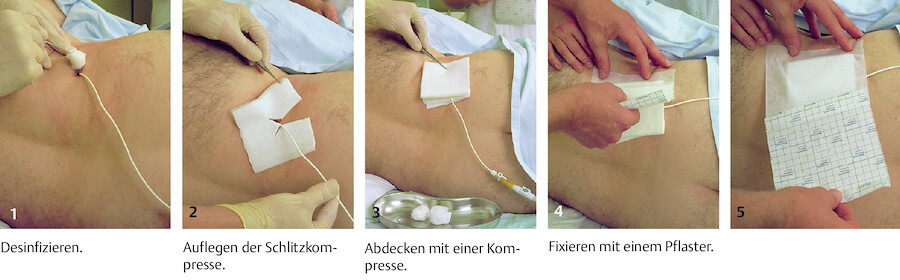
Silikonkapillar- („easy flow“) oder Latexrohrdrain Empfehlenswert sind Stomabasisplatten mit möglichst kleinem Durchmesser zum Schutz der Haut vor den aggressiven Sekreten (Schutz vor Hautmazerationen) und hautfreundliche Ausstreif- oder Auffangbeutel. Diese sollten unter sterilen Kautelen mindestens 2-mal wöchentlich gewechselt werden. Die Durchtrittsstelle der Drainage wird mit sterilen Kompressen und NaCl 0,9 % gereinigt. Den ausführenden Drainageschlauch reinigt man mit sterilen Kompressen und NaCl 0,9 %.
Robinson- und T-Drain Die Austrittsstelle wird mit NaCl 0,9 % gereinigt und mit Octenidin desinfiziert. Dabei muss auf Hautmazerationen geachtet und eine Schlitzkompresse um die Austrittsstelle gelegt werden. Bei stark sezernierenden Drainagen ist ein zusätzlicher Hautschutz der umgebenden Hautregion, z. B. mit Hydrokolloidplatten, erforderlich. Insbesondere bei Spül- und Saugdrainagen besteht die Mazerationsgefahr der Haut, weil Sekret und Spülflüssigkeit häufig nicht nur über die Drainage ablaufen. In jedem Fall ist eine Unterwanderung der Folie durch Sekrete zu vermeiden.
Vakuumtherapie Als effektive Drainagetherapie bietet die Vakuumtherapie bei Anastomoseninsuffizienzen und septischen Prozessen in der Bauchhöhle Vorteile. Auch hier steht pflegerisch der Schutz der Haut vor Mazerationen im Vordergrund ( ▶ Abb. 23.21).
Versorgung einer klaffenden Bauchwunde mit Vakuumtherapie.
Abb. 23.21
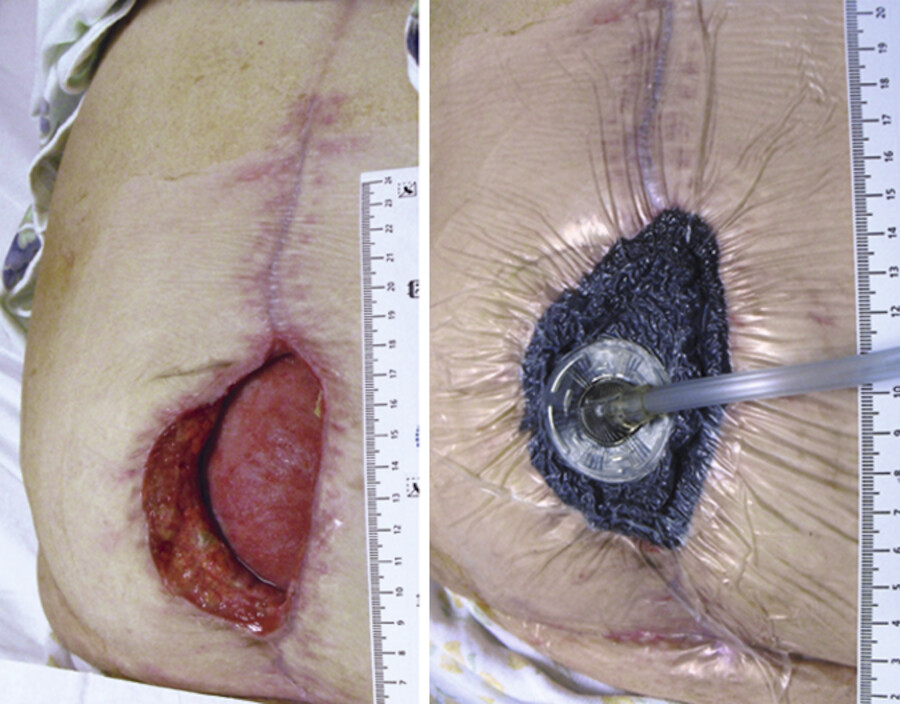
23.2.7.2 Sekretkontrolle und Dokumentation
Drainagen können hilfreich sein, um Nahtinsuffizienzen oder sich entwickelnde Nachblutungen frühzeitig zu erkennen.
Bei der postoperativen Übernahme eines Patienten muss der Flüssigkeitsstand der Drainage mit Datum und Uhrzeit markiert und schriftlich festgehalten werden. Danach folgen je nach hausinterner Absprache (z. B. Zeitpunkt der Bilanzerstellung) die kontinuierliche Verlaufskontrolle und Markierung der Sekretmenge. Bei mehreren Drainagen werden diese nummeriert und getrennt dokumentiert.
Für die diagnostische Abklärung postoperativer Wundinfektionen, insbesondere tief gelegener Infektionsprozesse, ist die mikrobiologische Untersuchung von Drains bzw. der aus ihnen gewonnenen Sekrete bedeutsam. Der Gefahr der exogenen Kontamination muss jedoch durch aseptische Entnahme der Probe vorgebeugt werden.
Praxistipp
Kontrollieren Sie das Sekret auf Menge, Aussehen (Farbe, Beimengungen) und bei offener Ableitung auf Geruch. Beobachten Sie das gesamte Ableitungssystem von der Austrittsstelle (Haut, Verband) bis in das Sekretauffanggefäß und achten Sie auf Veränderungen. Praktizieren Sie Infektionsschutz durch das konsequente Tragen von Schutzhandschuhen, Schutzschürze und wechseln Sie die Patientenunterlage bei Verschmutzung.
23.2.7.3 Kontrolle des Drainagesystems
Die Funktion der Drainagesysteme (Sog und Durchgängigkeit) muss aufmerksam beobachtet werden. Das ist v. a. bei Drainagen mit kontrolliertem Sog, z. B. der Thoraxdrainage, dringend erforderlich. Hier muss Folgendes kontrolliert werden:
-
Sekretabfluss
-
Sogstärke
-
Soggeräusche
Das im Schlauch stehende Sekret kann regelmäßig im nicht eröffneten Schlauchsystem mit einer Schlauchrollerklemme Richtung Auffanggefäß „ausgemolken“ werden. Auch der freie Abfluss von Drainagen mit unkontrolliertem Sog, z. B. der Redon-Drainage, ist sicherzustellen, insbesondere nach Umlagerungen.
Bei der Mobilisation und Umlagerung der Patienten sollte auch darauf geachtet werden, einen Rückfluss des abgeleiteten Sekrets und ein Abtrennen der Drains zu vermeiden. So wird z. B. der Ausstreifbeutel vor dem Umlagern geleert, um Zug am Drain zu vermeiden.
Merke
Jede Öffnung eines in sich geschlossenen Schlauchsystems stellt eine potenzielle Infektionsgefahr dar.
Schwerkraftdrainagen müssen immer unter Patientenniveau aufgehängt werden. Zum gefahrlosen Umlagern des Patienten kann man diese Drainageart kurzfristig mit einer Péanklemme, die an den Klemmblättern geschützt ist, abklemmen.
Praxistipp
Nehmen Sie Schmerzen ernst! Berücksichtigen Sie die vom Patienten geäußerten Schmerzen im Bereich der Drainagen und geben Sie seine Äußerungen mit entsprechender Nachhaltigkeit an den zuständigen Arzt weiter.
23.2.7.4 Umgang mit Sekretbeutel oder Sekretflaschen
Wechsel der Sekretbeutel oder -flaschen Bei der Auswahl eines Wunddrainagesystems ist es wichtig, dass das Handling beim Wechsel der Flaschen ohne Verspritzen von Sekret möglich ist. Desinfizieren Sie Konnektionsstellen mit einem alkoholischen Hautantiseptikum. Um Kontaminationen zu vermeiden, sollte das System mit Schraubkonnektoren ausgestattet sein.
Praxistipp
Zum Wechsel einer neuen Vakuumflasche informieren Sie den Patienten, dass trotz langsamen Öffnens der Klemme durch das Einwirken des vollen Sogs auf das Wundgebiet Schmerzen auftreten können.
Leeren des Sekretsammelsystems Werden Sekrete oder andere Körperflüssigkeiten aus Drainagen mit Einwegbeuteln gesammelt, z. B. zur Liquordrainage, in Stuhlkollektoren, in Wundsekretbeuteln, müssen die mehr oder weniger gefüllten Beutel von Pflegenden geleert werden. Sie dürfen meist nicht ungeleert zum Abfall gegeben werden. Ihre Entleerung kann mit Einmalhandschuhen in den Randspüler der Steckbeckenspüle oder direkt in die Steckbeckenspüle erfolgen. Dabei besteht immer eine Kontaminationsgefahr, die durch vorsichtiges Hantieren gebannt werden kann.
23.2.7.5 Entfernen der Drainage
Die Drainagen werden je nach Art und hausinternen Vorgaben durch den Arzt oder eine erfahrene Pflegekraft (nach Anordnung) entfernt. Bei der Vorbereitung ist zu achten auf:
-
sorgfältige Patienteninformation (gibt Sicherheit und verringert Angst)
-
Schmerzempfinden des Patienten (evtl. Schmerzmittelgabe vorab)
Nach Gewährleistung der hygienischen Sicherheit (z. B. aseptisches Vorgehen, Händedesinfektion, Schutzschürze, Vermeiden einer Umgebungskontamination) erfordert das Ziehen einer Drainage ein sicheres und zügiges Arbeiten:
-
Hände desinfizieren
-
Verband mit unsterilen Handschuhen entfernen
-
Handschuhe wechseln, Hände desinfizieren
-
Naht (zur Fixierung und Sicherung des Drains) mit steriler Schere lösen und mit Pinzette ziehen
-
(evtl. Redon-)Drainage belüften (wird von Experten unterschiedlich bewertet)
-
anschließend Drainage zügig, aber nicht ruckartig entfernen
-
sterile Kompresse bereithalten, um das Wundsekret während des Ziehens aufzufangen
-
Drainageschlauch auf Vollständigkeit prüfen
-
Wunde reinigen (evtl. Wundantiseptik)
-
sterilen Verband mit hoher Absorptionsfähigkeit anlegen
Blutungsdrainagen Sie werden entfernt, wenn nur noch geringe blutige Sekretmengen gefördert werden, i. d. R. nach 1 – 3 bzw. 4 Tagen. Meist werden sie vollständig gezogen und nicht schrittweise gekürzt.
Abszessdrainagen Diese entfernt man, sobald die Abszesshöhle verschwunden ist. In der Regel werden die Drains schrittweise gekürzt (je nach Fördermenge), damit sich der Drainagekanal schließt. Auf die zusätzliche Fixierung mit steriler Sicherheitsnadel ist zu achten, um zu verhindern, dass der Drain in das Wundgebiet zurückgleitet.
Drainagen in der Unfallchirurgie In der Unfallchirurgie und Orthopädie wurden nach max. 24 Stunden Verweildauer die geringsten Infektionsraten gefunden. Nach Rücksprache mit dem Operateur werden Redon-Drainagen gezogen, wenn die Fördermenge bei 50 ml/24 Stunden liegt.
Abdominelle Drainagen Beispielsweise ist für die Entfernung der T-Drainage die Abflussrate der Galle ins Duodenum (300 ml/24 Stunden nach außen) ausschlaggebend. Bei hindernisfreiem Abfluss der Galle ins Duodenum wird z. B. das T-Drain am 5. postoperativen Tag abgeklemmt und erst nach Röntgenkontrastuntersuchung der Gallenwege entfernt.
23.3 Lern- und Leseservice
23.3.1 Literatur
[1363] Akil A, Schnorr P, Wiebe K. Behandlungsstrategien bei postoperativen Sternuminfektionen. Zentralbl Chir 2016; 93–101, DOI: http://dx.doi.org/10.1055/s-0035–1558097
[1364] Anonym 2010. Wunddrainagen – Im Zweifel bitte nicht! Z Orthop Unfall 2010; 148(6): 624–626; DOI: 10.1055/s-0030-1270268
[1365] AWMF – Leitlinie 029–022. PerioperativeAntibiotikaprophylaxe. (1/2012). Im Internet: http://www.awmf.org/uploads/tx_szleitlinien/029–022l_S1_Perioperative_Antibiotikaprophylaxe_2012–02.pdf; Stand: 16.12.2016
[1366] AWMF – S3-Leitlinie 091–001. Lokaltherapie chronischer Wunden bei Patienten mit den Risiken periphere arterielle Verschlusskrankheit, Diabetes mellitus, chronische venöse Insufizienz. Deutsche Gesellschaft für Wundheilung und Wundbehandlung e.V. (DGfW). Stand: 16.01.2014, gültig bis 30.04.2016. Im Internet: http://www.awmf.org/leitlinien/detail/ll/091–001.html; Stand: 16.12.2016
[1367] Diefenbeck M et al. Vakuumtherapie bei Haut- und Weichgewebsinfektionen der Extremitäten. Z Orthop Unfall 2011; 149: 324–329
[1368] DNQP – Deutsche Netzwerk für Qualitätsentwicklung in der Pflege. Expertenstandard. Schmerzmanagement in der Pflege bei chronischen Schmerzen (4/2015). Im Internet: Im Internet: https://www.dnqp.de/de/; Stand: 16.12.2016
[1369] DNQP – Deutsches Netzwerk für Qualitätsentwicklung in der Pflege. Expertenstandard, Schmerzmanagement in der Pflege bei akuten Schmerzen (12/2011). Im Internet: Im Internet: https://www.dnqp.de/de/; Stand: 16.12.2016
[1370] DNQP – Deutsche Netzwerk Qualitätsentwicklung in der Pflege. Expertenstandard „Pflege von Menschen mit chronischen Wunden“ (30.9.2015). Im Internet: https://www.dnqp.de/de/; Stand: 16.12.2016
[1371] Ebbeskog B, Emami A. Older patients' experience of dressing changes on venous leg ulcers: more than just a docile patient. Journal of Clinical Nursing 14 2005; 1223–1231
[1372] Edwards L et al. An exploration of patients' understanding of leg ulceration. Journal of Wound Care 11 2002; 1: 35–39
[1373] Gathen M, Petri M, Krettek C, Omar M. Die Anwendung der kombinierten Unterdrucktherapie mit Instillation von Spülflüssigkeiten bei Komplikationswunden. ZOrthop Unfall 2016: 1–6, DOI: http://dx.doi.org/10.1055/s-0041–109328; Stand: 09.03.2017
[1374] Greve J et al. Penetrierende Verletzungen der Kopf-Hals-Region. Laryngo-Rhino-Otol 2014; 671–676,DOI: 10.1055/s-0034–1376974
[1375] Hansis M et al. Empfehlungen: Anforderungen der Hygiene bei Operationen und anderen invasiven Eingriffen. Mitteilung der Kommission für Krankenhaushygiene und Infektionsprävention am Robert Koch-Institut. Bundesgesundheitsbl 2000; 43: 644
[1376] Karl T. Komplikationen nach inguinalen Eingriffen in der Gefäßchirurgie. Gefäßmedizin Scan 2016: 59–76, DOI: 10.1055/s-0042–100229
[1377] Kern M. Palliative Wundbehandlung (ex)ulzerierender Wunden. Frauenheilkunde up2date 2010; 2–5, DOI: 10.1055/s-0030–1247251
[1378] KrPflG (Gesetz über die Berufe in der Krankenpflege – Krankenpflegegesetz) vom 16.7.2003, zuletzt geändert 16.7.2015. Im Internet: https://www.gesetze-im-internet.de/bundesrecht/krpflg_2004/gesamt.pdf; Stand: 16.12.2016
[1379] Kruppa C et al. AirEntrapment durch einen Ventilmechanismus bei chronischen Wunden, ein harmloses Phänomen? ZOrthop Unfall 2015: 648–651, DOI: http://dx.doi.org/10.1055/s-0041–106787
[1380] Lawall H, Huppert P, Rümenapf G. S3-Leitlinie zur Diagnostik, Therapie und Nachsorge der peripheren arteriellen Verschlusskrankheit. Stand: 30.11.2015, gültig bis 31.10.2018. Im Internet: http://www.dga-gefaessmedizin.de/aerzte/leitlinien.html; Stand: 16.12.2016
[1381] Lippert H. Wundatlas – Kompendium der komplexen Wundbehandlung. Stuttgart: Thieme; 2012
[1382] Michelsen A, Kujath P. Grundlagen der Wundversorgung in Klinik und Praxis. Krankenhaushygiene up2date 2014; 265–280, DOI: http://dx.doi.org/10.1055/s-0034–1391324
[1383] NRZ (Nationales Referenzzentrum für Surveillance von nosokomialen Infektionen). Surveillance postoperativer Wundinfektionen 2012. Im Internet: http://www.nrz-hygiene.de; Stand: 16.12.2016
[1384] Oldhafer K et al. Empfehlungen: Prävention postoperativer Infektionen im Operationsgebiet. Mitteilung der Kommission für Krankenhaushygiene und Infektionsprävention am Robert Koch-Institut. Bundesgesundheitsbl – Gesundheitsforsch – Gesundheitsschutz 2007; 377–393, DOI: 10.1007/s00103–007–0167–0
[1385] Paetz B, Benzinger-König B. Chirurgie für Pflegeberufe. 22. Aufl. Stuttgart: Thieme; 2013
[1386] Panfil EM, Schröder G, Hrsg. Pflege von Menschen mit chronischen Wunden. 3. Aufl. Bern: Huber; 2015
[1387] Pichl JJ et al. Perioperative Infektionsprophylaxe in Unfallchirurgie und Orthopädie. OP-Journal 21 2005; 3: 220–223
[1388] Ravenschlag C, Ullrich L. Handbuch zur Versorgung von Wunden. 2. Aufl. Universitätsklinikum Münster; 2007
[1389] Sauer S, Rothgang H, Glaeske G. BARMER GEK Heil- und Hilfsmittelreport (September 2014) Berlin. Im Internet: https://www.bvmed.de/de/technologien/haut/moderne-wundversorgung/informationen-fuer-kassen/informationen-fuer-krankenkassen; Stand: 16.12.2016
[1390] Schwarzkopf A. Mikrobiologie der Wunde – ein fragiles Gleichgewicht. Aseptica 2007; 3: 3–10
[1391] Sitzmann F. Wunden nie ohne Sterilfilter ausduschen! Die Schwester/Der Pfleger 2005; 7: 570
[1392] Sitzmann F. Wundspülung nie ohne Sterilfilter. In: Georg J. Pflegekalender 2007. Bern: Huber; 2006
[1393] Sitzmann F. Wenn die Socken in die Haut wachsen – Professionelles Umgehen mit Ekel. NovaCura 40 2009a; 4: 37–39
[1394] Sitzmann F. Spülen chronischer Wunden. NovaCura 40 2009b; 4: 40–41
[1395] Sitzmann F. Hygiene Kompakt. Bern: Huber; 2012
[1396] Sitzmann F. Hygienische und menschliche Aspekte der Selbstvernachlässigung im Alter. In: Gogl A. Hrsg. Selbstvernachlässigung bei alten Menschen. Bern: Hans Huber; 2014: 175–196
[1397] Sitzmann F. Im Fokus: Wunddrainagen. CNE.fortbildung (Januar 2014). DOI: 10.1055/s-0033–1364153
[1398] Stoll M. Proktologische Wundbehandlung. Akt Dermatol 2016; 42: 198–202, DOI: http://dx.doi.org/10.1055/s-0042–102265
[1399] Struller F et al. Das diabetische Fußsyndrom. Allgemein- und Viszeralchirurgie up2date 2015; 249–264, DOI: 10.1055/s-0041–102092
[1400] Tabori E, Strittmatter B, Furtwängler A et al. Leitfaden und Empfehlungen für die Hygiene in der Koloproktologie. coloproctology 2010: 356 –364, DOI: 10.10 07/s 0 0 053–010–0146–z
[1401] Tautenhahn J, Jannasch O, Lippert H. Wunde, Wundheilung, Wundbehandlung. Allgemein- und Viszeralchirurgie up2date 2007; 201–215, DOI: 10.1055/s-2007–965637
[1402] Treutner KH et al. Material und Struktur von Drainagen. Chirurg 2003; 74: 85
[1403] Ullrich L, Mört D. Wundversorgung. In: Ullrich L, Stolecki D, Hrsg. Intensivpflege und Anästhesie. 3. Aufl. Stuttgart: Thieme; 2015
[1404] V.A.C.® Therapy. Richtlinien für die Behandlung mit V.A.C.® Therapy. Im Internet: http://help2heal.eu/de/vlu/vactherapytreatmentguidelines.html; Stand: 19.12.2016
[1405] Welch T, Büchler MW. Anastomoseinsuffizienz im Gastrointestinaltrakt. Intensivmed.up2date 2011; 221–233, DOI: 10.1055/s-0030–1256483
[1406] Wilpsbäumer S, Mört D, Ullrich L, Bone H-G. Wundmanagement auf der Intensivstation. Intensivmedizin up2date 11/ 2015: 11: 1m–18
23.3.2 Weiterführende Literatur
[1407] Assadian O, Kramer A. Antiseptik. In: Kramer A, Assadian O, Hrsg. Wallhäußers Praxis der Sterilisation, Desinfektion, Antiseptik und Konservierung. Stuttgart: Thieme; 2008
[1408] National Institute for Health and Care Excellence (NICE). Pressure ulcers: prevention and management of pressure ulcers. NICE clinical guideline 179. 2014. Im Internet: www.nice.org.uk/guidance/cg179; Stand: 16.12.2016
[1409] Protz K. Moderne Wundversorgung, 7. Aufl. München: Elsevier; 2014
[1410] Zastrow KD, Popp W. Verbände aus Sicht der Hygiene – Verbandwechsel. Hygiene-Tipp der Deutschen Gesellschaft für Krankenhaushygiene 2011. Im Internet: http://www.krankenhaushygiene.de/informationen/hygiene-tipp/hygienetipp2011/357; Stand: 16.12.2016
23.3.3 Kontakt- und Internetadressen
[1411] Deutsche Gesellschaft für Wundheilung und Wundbehandlung e.V., Glaubrechtstraße 7, 35392 Gießen, Tel.: 0641 6868518, E-Mail: dgfw@dgfw.de
[1412] Initiative Chronische Wunden e.V. (ICW), Pölle 27/28, 06484 Quedlinburg, Tel.: 06455 75 93 96 5, E-Mail: organisation@icwunden.de
[1413] www.dgfw.de/index_1_gesellschaft.html; Stand: 16.12.2016
[1414] www.gesundheit.nrw.de/content/e19/e2803; Stand: 16.12.2016
[1415] www.ic-wunden.de/; Stand: 16.12.2016
[1416] www.jalomed.de/pd5/index.php; Stand: 16.12.2016
[1417] http://www.kci-medical.de/DE-GER/vactherapy; Stand: 15.04.2017