24 Mikrobiologische Probenahme und Diagnostik
Im Verlauf eines Jahres kann man ein Auf und Ab der Infektionskrankheiten erkennen. Schwächt sich im März, April die Influenza (Grippe) ab, nehmen im Sommer Durchfallerkrankungen zu. Die Top 6 der häufigsten Infektionen machen zumeist gastrointestinale Infektionen aus, wie Norovirus-Gastroenteritis, Campylobacter-Enteritis, Rotavirus-Gastroenteritis, Salmonellose gefolgt von Influenza und Windpocken (RKI 2016). Sie sind entweder ambulant oder bei einem Klinikaufenthalt (nosokomial) erworben.
Zudem überwinden in Zeiten zunehmender Globalisierung, Migration und Reisen auch infektiöse Krankheitserreger aus exotischen, fernen Ländern leichter Grenzen, Meere und Kontinente.
Dabei wird oft von „neuen“ Seuchen geredet, aber was hat es damit auf sich? Festzustellen ist, dass sich Viren und andere Mikroorganismen durch genetische Mechanismen wie Mutationen und Genaustausch verändern und dadurch an Pathogenität zu- oder abnehmen. Es sind keine neuen Mikroben, es gibt aber wohl alte und neue Formen von Infektionen, die sich z.B. durch unangemessenen Antibiotikaeinsatz verändern. Sie begründen die mikrobiologische Infektionsdiagnostik.
Infektionskrankheiten sind ein allgegenwärtiges Thema, das Angst auslöst (Sitzmann 1999). Wissen kann helfen.
24.1 Grundlagen aus Pflege- und Bezugswissenschaften
24.1.1 Einleitung
Mikrobiologische Untersuchungen gewinnen zunehmend an Bedeutung bei
-
verkürzten klinischen Aufenthalten, da hier z.B. ein wesentlicher Teil der postoperativen Wundinfektionen erst nach der Patientenentlassung auftreten,
-
zunehmend ambulant durchgeführten Eingriffen, da hier die notwendige Nachsorgeverpflichtung in den ambulanten Bereich übergeht,
-
Infektionen, die in das Krankenhaus importiert werden,
-
großem öffentlichem Interesse an Infektionszahlen (Gastmeier 2016).
Definition
Mikrobiologische Probenahmen dienen der systematischen Bestätigung oder dem Ausschluss einer Infektionserkrankung. Sie sind Mittel einer gezielten Diagnosestellung.
MRE-Screening bedeutet die aktive Suche nach MRE-besiedelten Personen (MRE = multiresistente Erreger) ohne klinische Symptome, die auf eine Infektion hindeuten würden.
Unter mikrobiologischem Monitoring hingegen versteht man Routinekontrollen, insbesondere bei Intensivpatienten, oder Umgebungsuntersuchungen zur Prüfung eines Kontaminationsverdachts (Quint u. Benen 2016).
Je nach Fragestellung und Verdachtsdiagnose werden gezielt Blutkulturen, Urin, Stuhl, Liquor, Haare, Rachenabstrich, Wundabstrich, Sputum usw. zur mikrobiologischen Untersuchung gegeben.
Die mikrobiologische Infektionsdiagnostik stellt hohe Anforderungen an das medizinische Team. Sie umfasst die Maßnahmen:
-
▶ Präanalytik (Vorbereitung der Proben), was mit hoher Verantwortung der Pflegenden für das Ergebnis verbunden ist.
-
Analytik im Labor, um Infektionen zu erkennen. Sie schließt evtl. Resistenztestungen (Antibiotikaresistenz) mit ein.
-
Postanalytik mit Interpretation des Befundes, gezielter Therapie sowie infektionspräventive Maßnahmen so früh wie möglich.
Im Rahmen des Monitorings verordnete Überwachungsuntersuchungen verursachen erheblichen Kosten- und Zeitaufwand und müssen nüchtern hinsichtlich ihres tatsächlichen Werts analysiert werden. Patientenbezogen muss geprüft werden, ob die routinemäßige Untersuchung von Urin, Blutkulturen, das Abnehmen von Abstrichen sinnvoll sind. So empfiehlt die KRINKO z.B. keine routinemäßigen mikrobiologischen Kulturen des Trachealsekrets ohne Infektions- oder Ausbruchsverdacht (Suger-Wiedeck 2013).
Bewährt haben sich Screeninguntersuchungen bei Patienten mit konkreten MRE-Risikofaktoren sofort nach Eintritt in das Krankenhaus sowie die generelle Intensivierung der ▶ Basishygiene bei allen Patienten.
24.1.2 Kontamination – Kolonisation – Infektion
Mikrobiologische Untersuchungen sind erheblich aufwendiger als ▶ klinisch-chemische Verfahren. Denn Mikroorganismen sind Lebewesen und sie reagieren z. T. sehr empfindlich auf die Einflüsse bei der Probeentnahme, einer evtl. Vorbehandlung mit Antibiotika, der Zwischenlagerung oder dem Transport.
Definition
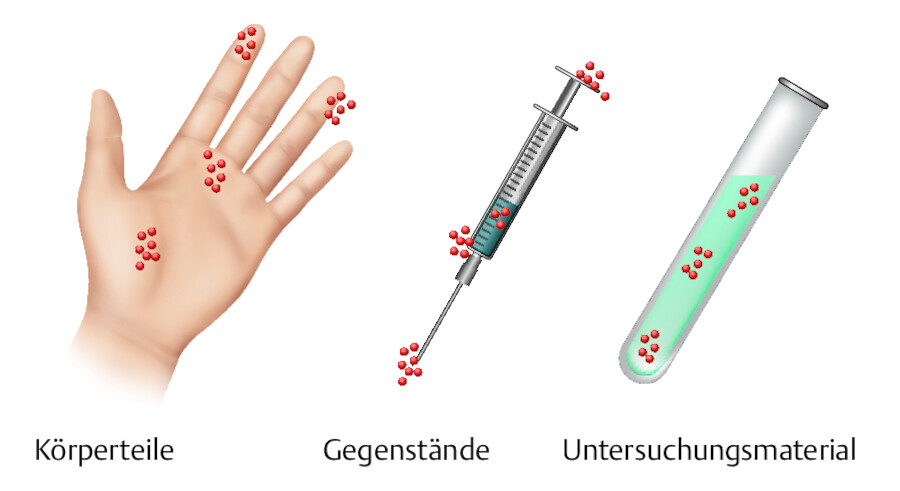
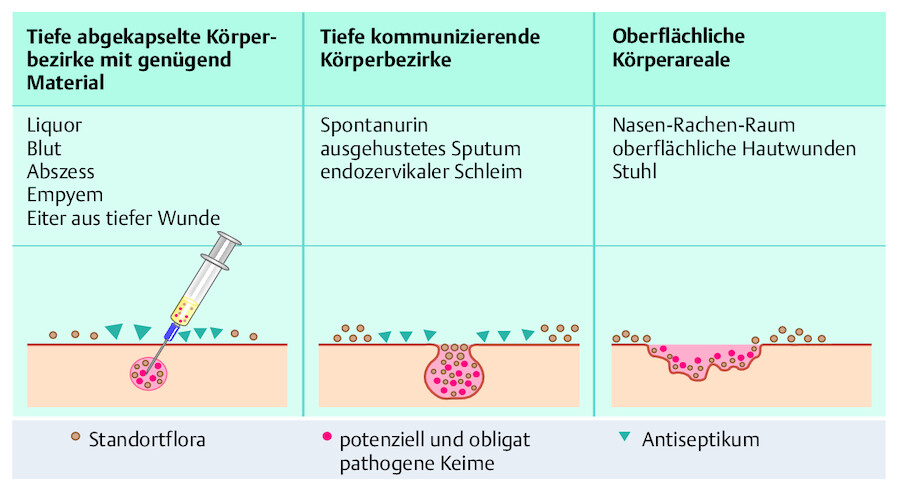
Kontamination: Unter Kontamination versteht man die unerwünschte Verunreinigung von Gegenständen oder Körperteilen, z.B. mit Mikroorganismen ( ▶ Abb. 24.1).
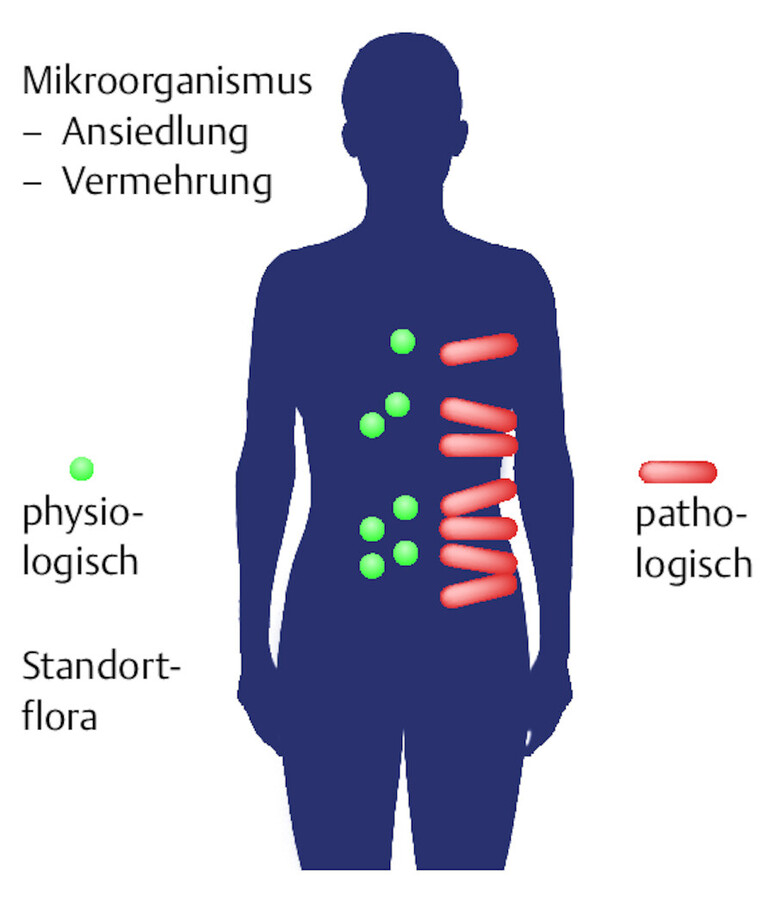
Kolonisation: Die physiologische Kolonisationsflora stellt die normale Besiedlung des Menschen mit Mikroorganismen dar. Sie findet sich auf Haut und Schleimhäuten und ist je nach Körperregion unterschiedlich zusammengesetzt ( ▶ Abb. 24.2). Eine pathologische Kolonisationsflora zeigt sich dagegen nur unter besonderen Bedingungen. So können Klinikmitarbeiter und Patienten mit multiresistenten Bakterien wie Pseudomonas aeruginosa oder MRSA besiedelt sein, zeigen aber keine Krankheitssymptome.
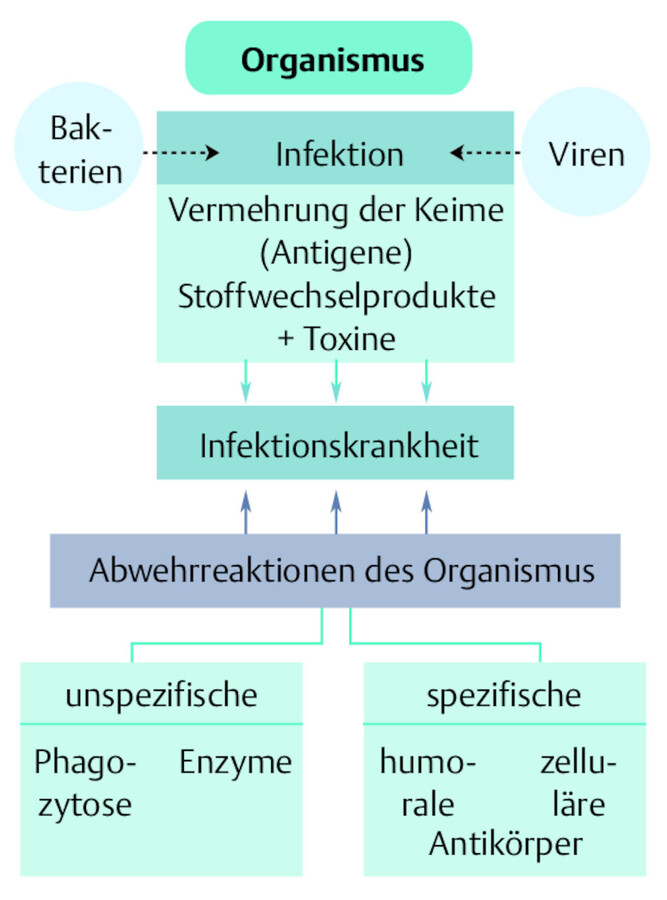
Infektion: Um von einer Infektion zu sprechen, müssen bei der Ansiedlung, dem Wachstum und der Vermehrung von Mikroorganismen im Körper Abwehrreaktionen und/oder Schädigungen auftreten ( ▶ Abb. 24.3).
Kontamination.
Abb. 24.1
Kolonisation.
Abb. 24.2
Infektion.
Abb. 24.3
Symptome Die klassischen Anzeichen einer Infektion sind:
-
Calor (Überwärmung)
-
Rubor (Rötung)
-
Dolor (Schmerz)
-
Tumor (Schwellung)
-
Functio laesa (eingeschränkte Funktion)
Merke
Eine Infektion ist nicht gleich eine Krankheit! Erst wenn Symptome vorliegen und Funktionsänderungen von Organen Beschwerden verursachen, liegt eine Krankheit vor.
24.1.3 Untersuchungsarten
Zunächst können bei Infektionen aus Blutproben Entzündungsparameter erfasst werden, z.B. die Bestimmung der Leukozytenzahl, das C-reaktive Protein sowie Neopterin und Procalcitonin.
Mikroorganismen können mit folgenden Untersuchungen nachgewiesen werden:
-
Direkter Erregernachweis
-
Mikroskopie
-
Nativpräparate
-
gefärbte Präparate
-
Immunfluoreszenz
-
-
Isolierung und kulturelle Anzucht
-
-
Nachweis von Erregerbestandteilen
-
Antigennachweis
-
Agglutination
-
Enzymimmunoassay
-
Nukleinsäurenachweis
-
-
Spezifische Antikörpernachweise
24.1.3.1 Direkter Erregernachweis
Mikroskopie
Nativpräparate Die einfachste Darstellung von Mikroben in ihrer Form (Morphologie) sind sog. Nativpräparate, bei der Untersuchungsmaterial ohne weitere Aufarbeitung mikroskopiert wird. So wird in sehr dringenden Fällen (z. B. Liquor bei Meningitisverdacht) das gewonnene Material sofort auf einem Objektträger ausgestrichen und unter dem Mikroskop untersucht.
Gefärbte Präparate Zur besseren Darstellung ihrer Größe, Form und Beweglichkeit können Bakterien und Pilze gezielt angefärbt werden. Bereits im gramgefärbten Präparat eines Tropfens frisch gelassenen Urins sind Keime mikroskopisch nachweisbar und grob zuzuordnen. Bei der Gramfärbung wird ein Präparat eingefärbt; grampositive Bakterien behalten dabei mikroskopisch sichtbar eine dunkelblaue Färbung, gramnegative Bakterien erscheinen nach der Gramfärbung rot.
Immunfluoreszenz Damit werden Erreger nachgewiesen, indem Antikörper auf das Gewebe gegeben und die Strukturen unter einem Mikroskop sichtbar gemacht werden.
Isolierung und kulturelle Anzucht
Für Bakterien oder Pilze wurden künstliche Nährböden, z.B. RODAC-Platten (Replicate Organism Detection and Counting) entwickelt, auf denen sie wachsen und untersucht werden können. Viren können in Zellkulturen vermehrt werden. Der Keimnachweis ermöglicht die
-
Quantifizierung (Anzahl pro Milliliter, z. B. im normalerweise sterilen Urin),
-
Typisierung (Bestimmung von Stämmen gleicher Spezies),
-
Resistenzprüfung (Empfindlichkeit) der Keime gegen verschiedene antimikrobiell wirksame Substanzen im Antibiogramm ( ▶ Abb. 24.4).
Mit der antimikrobiellen Chemotherapie wird eine selektive Beeinträchtigung der Mikroorganismen angestrebt, sodass z. B. der Makroorganismus Mensch diese unschädlich machen oder sogar eliminieren kann. Gegen die schädigende Wirkung antimikrobieller Substanzen setzen sich die Mikroben durch Resistenzentwicklung zur Wehr, z. B. Staphylococcus aureus gegen Methicillin, d. h. MRSA.
Resistenz. Wächst ein Bakterium trotz der Gegenwart eines Antibiotikums, spricht man von Resistenz.
Definition
Mikroorganismen sind resistent gegen eine mikrobielle Substanz, wenn sie bei therapeutisch erreichbaren Konzentrationen weiterhin vermehrungsfähig sind.
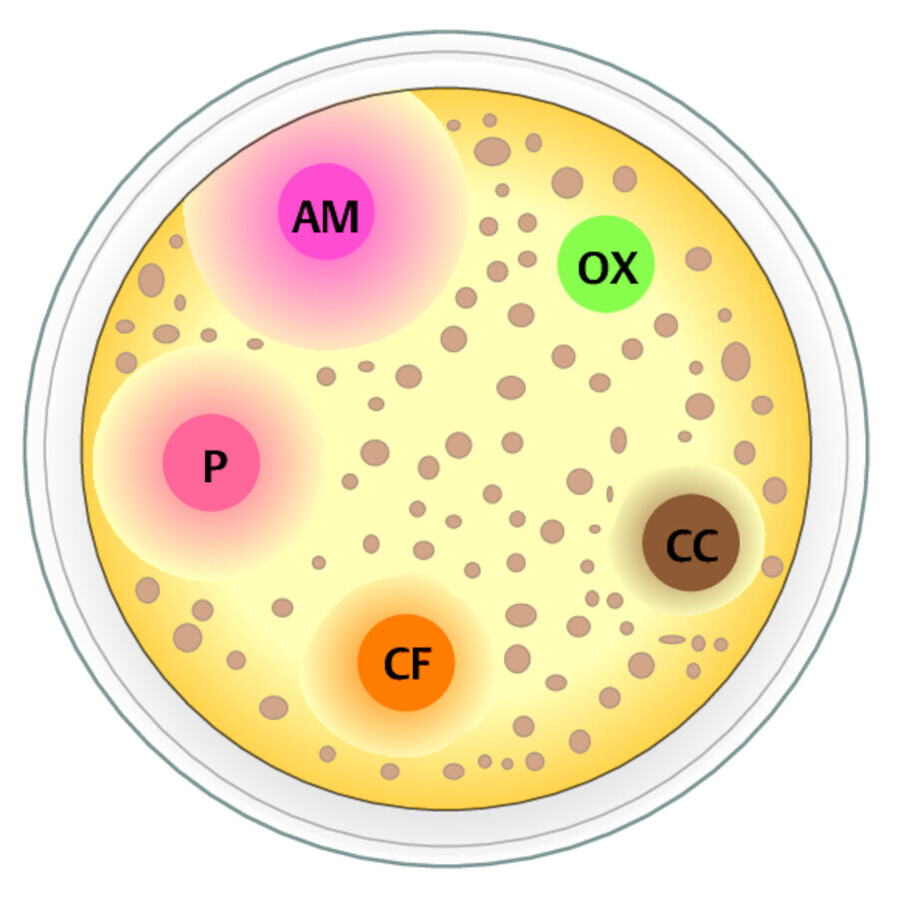
Agar-Diffusionstest Im Agar-Diffusionstest wird festgestellt, wie ein isolierter und kultivierter pathogener Keim auf verschiedene Antibiotika reagiert. Dazu wird der zu prüfende Bakterienstamm auf einem Nährboden als homogener Rasen ausgeimpft. Die infrage kommenden Antibiotika sind in definierter Konzentration auf Filterpapierblättchen aufgebracht. In ▶ Abb. 24.4 handelt sich z.B. um:
-
P = Penicillin G
-
AM = Ampicillin
-
OX = Oxacillin
-
CF = Cephalotin
-
CC = Clindamycin
Werden diese auf die Oberfläche des Nährbodens aufgelegt, diffundiert der Wirkstoff ins Medium. Je intensiver die Wirkung des Medikaments auf die Mikroben ist, umso größer wird die Hemmzone um das Blättchen herum ( ▶ Abb. 24.4).
24.1.3.2 Nachweis von Erregerbestandteilen
Antigennachweis
Dieses immunologische Verfahren wird zum Nachweis von Antigenen, z. B. der Meningokokken, angewendet, wozu Antikörper genutzt werden.
Agglutination
Bei diesem Test kommt es zur Reaktion zwischen Erreger und Antikörper, wobei die Zellen verklumpen (z. B. Syphilis-Diagnostik).
Enzymimmunoassay
Bei dieser Methode, auch ELISA (= Enzyme-Linked Immunoadsorbent Assay) genannt, werden spezifische Antikörper oder Antigene eingesetzt. Es können z. B. Proteine (wie Antikörper) und Viren nachgewiesen werden.
Nukleinsäurenachweis
Mithilfe molekulargenetischer Testsysteme kann das genetische Material – also DNA oder RNA – von Mikroorganismen, die sonst nur sehr schwer oder mit längerem Zeitaufwand zu züchten sind (z. B. Mycobacterium tuberculosis), bestimmt werden.
24.1.3.3 Spezifische Antikörpernachweise
Als mögliche Antwort des Organismus auf eine Infektion bilden sich nach bestimmter Zeit Antikörper, die im Serum nachgewiesen werden können. Bestimmt werden die Produktion und der Anstieg des Antikörpertiters u. a. im Serum (z. B. bei Windpocken) und im Liquor (z. B. auf Treponema pallidum).
Merke
Sogenannte Schnelltests ersetzen keineswegs die Routinediagnostik. Sie sind nur ein zusätzliches, sinnvolles Hilfsmittel.
Resistenzverhalten von Enterokokken im Agar-Diffusionstest.
Abb. 24.4
24.1.4 Qualitätssicherung bei Probenahmen (Präanalytik)
Die Aussagekraft mikrobiologischer Befunde und der Erfolg einer differenzierten Infektionsdiagnostik hängen entscheidend von der Qualität des Untersuchungsmaterials ab. Alle Personen, die an der Infektionsdiagnostik beteiligt sind, müssen informiert sein, um das Ziel – die korrekte Bestimmung des an der Infektion beteiligten Keims – zu erreichen. Diese wichtige Phase des Untersuchungsprozesses vor der eigentlichen Erhebung des Befundes wird als Präanalytik bezeichnet und umfasst folgende Schritte:
-
Transportmedium auswählen
-
Eignung des Materials prüfen
-
korrekten Zeitpunkt bestimmen
-
Entnahmeort auswählen
-
Entnahmetechniken optimieren
-
Probenverwechslungen vermeiden
-
sachgemäß zwischenlagern
-
Proben versenden
Praxistipp
Damit der Mikrobiologe fündig wird, dürfen aussagekräftige Informationen im Untersuchungsauftrag nicht fehlen.
24.1.4.1 Transportmedium auswählen
Es empfiehlt sich, die Transportmedien des jeweiligen Laborpartners zu nutzen und bei Unklarheiten nachzufragen ( ▶ Tab. 24.1 ). Kommunikation ist alles! Darüber hinaus gilt:
-
Punktate und Flüssigkeiten sind ohne Zusatz in einem sterilen Gefäß zu transportieren. Für kleine Volumina können abgestöpselte Spritzen (ohne Kanüle!) verwendet werden. Zum Nachweis anaerober (unter Luftabschluss wachsender) Bakterien sollte das Material mit speziellen Transportmedien (Blutkulturflasche) eingesandt werden.
-
Bei Biopsien aus nicht kontaminiertem Gebiet ist die Beigabe von 1 ml steriler 0,9 %iger NaCl-Lösung angebracht, um ein Austrocknen der Probe zu verhindern.
24.1.4.2 Eignung des Materials prüfen
Je nach Fragestellung und angeforderten Laboruntersuchungen muss auch das geeignete Probenmaterial entnommen werden. ▶ Biopsat, z. B. aus einer Wunde, ist ergiebiger als Punktat oder lediglich ein Abstrich (s. ▶ Tab. 24.1 ).
|
Infektionen/Verdacht |
Entnahmeart und -material zur mikrobiologischen Diagnostik |
Bemerkungen |
|
eitrige Angina |
Rachenabstrich; Schnelltest auf A-Streptokokken (Scharlach) mit trockenem Tupfer (Schottdorf 2016) |
unverzüglich ins Labor, sonst im Kühlschrank lagern |
|
Meningitis |
diagnostische Lumbalpunktion, steriles Röhrchen |
Liquor unverzüglich ins Labor geben; niemals kühl lagern, danach ist keine Anzucht von Neisseria meningitidis mehr möglich (Vonberg 2016) |
|
Fieber unklarer Genese, insbesondere bei Neugeborenen, Immunsupprimierten |
Blutkultur-Kit mit sterilen Handschuhen (Simon 2017) |
2–3 Blutkulturpaare (aerob/anaerob) unabhängig voneinander gewinnen (Köck 2015) |
|
faulig riechende Infektionen (Verdacht auf Anaerobier-Infektion) |
Sputum, Eiter, Aszites (spezielle Transportmedien erforderlich) möglichst Eiter, keine Abstriche einsenden |
geschlossene Spritzenbehälter |
|
eitrige Wundinfektion |
möglichst Eiter, mind. aber Material aus der Tiefe |
keine Abstriche von Wundoberfläche nehmen (AWMF 2014) |
|
Gefäßkatheterinfektion |
Gefäßkatheterspitze, quantitative Blutkultur aus Katheter und zusätzlich aus peripherer Vene |
nicht routinemäßig untersuchen, nur bei Verdacht auf eine ZVK-Infektion (Simon 2017) |
|
nosokomiale Diarrhö (häufig nach Antibiotikatherapie) |
Glutamatdehydrogenase-Test (GDH) und Stuhlkultur in Ausbruchsituation mit Genotypisierung auf Clostridium difficile |
Diagnose nur aus ungeformtem Stuhl möglich (Durchfall); keinen Rektalabstrich einsenden |
|
Peritonitis mit Aszites |
Eiter durch Punktion entnommen, in speziellem Transportmedium (Anaerobier!) |
wesentlich besser als Abstriche! Ist sofortiger Versand nicht möglich, Punktionsmaterial bei 4 °C lagern |
|
ambulant erworbene Pneumonie |
mittels direkter Immunfluoreszenz und Antigennachweis, z.B. im Urin auf Legionella pneumophila |
steriles Gefäß |
|
Tuberkulose |
Probe von
|
steriles Gefäß |
|
atypische Pneumonie bei abwehrgeschwächten Patienten |
Serologie auf Legionellen |
Antikörpernachweis im Urin |
|
Osteomyelitis |
Eiter, intraoperatives Material (Aspirat) |
wesentlich besser als Abstriche! |
|
postoperative Infektionen |
Sekret oder Eiter aus Drainagen in Transportmedium |
keine Drainageabstriche (häufig Sekundärkontamination) |
|
genitale Mykosen |
Vaginalsekret, Vulvaabstrich, Urethralsekret |
Abstrich in Transportmedium |
|
Harnwegsinfekt |
Tauchnährboden vollständig in frischen Mittelstrahlurin eintauchen bzw. beim Urinieren mit dem Mittelstrahlurin berieseln (Urin abtropfen lassen) |
24.1.4.3 Korrekten Zeitpunkt bestimmen
Für die optimale Gewinnung von mikrobiologischem Probenmaterial ist auch der richtige Zeitpunkt der Entnahme mitentscheidend. So sollte z.B. möglichst früh, v. a. noch vor Beginn einer Antibiotikatherapie, Material zur Keimisolierung entnommen werden. Denn durch die Gabe des Antibiotikums werden neben der normalen Körperflora auch pathogen wirkende Mikroorganismen verändert. Eine gezielte Diagnostik wird damit erschwert.
Daher wird ein schnelles Ergebnis zur baldigen Therapieentscheidung angestrebt. Zur mikrobiologischen Diagnostik am Krankenbett oder in Satellitenlaboren vor Ort (Point-of-Care-Testing = POCT) kann z.B. der MRSA-Direktnachweis mittels PCR (Polymerase-Kettenreaktion) erfolgen. Die Untersuchungsdauer von ca. 2,5 Std. liegt deutlich unter der einer konventionellen Kultur von ca. 3 Tagen (Vonberg 2016).
Erfolgt bei einer klinisch vorliegenden Infektion die antibiotische Therapie ohne Erregeridentifikation und Resistenzprüfung, spricht man von einer empirischen oder kalkulierten antimikrobiellen Therapie. Sie sollte entsprechend den klinischen Symptomen, dem lokalen Resistenzmuster und den Leitlinien erfolgen.
24.1.4.4 Entnahmeort auswählen
Der Keimnachweis ist am sichersten, wenn das Untersuchungsmaterial möglichst vom Ort des krankhaften Prozesses stammt. So soll Wundsekret aus der Tiefe der Wunde entnommen werden, um in dem gewonnenen Material auch Keime nachweisen zu können ( ▶ Abb. 24.5).
Bei Verdacht einer Sinusitis ist ein Nasenabstrich nicht sehr hilfreich. Hier ist das einzig sinnvolle Material ein Aspirat durch eine gezielte Punktion.
Gewinnung von Untersuchungsmaterial von verschiedenen Körperarealen (nach Sitzmann 1999).
Abb. 24.5
24.1.4.5 Entnahmetechniken optimieren
Die Anzuchtergebnisse sind durch Kontaminationen aus der Umgebung, d.h. durch Begleitflora, gefährdet. Vor Entnahme von Blut, Liquor und Blasenpunktionsurin muss daher eine adäquate Hautantiseptik durchgeführt werden.
Merke
Proben zur Keimanzucht dürfen keinesfalls mit histologischen Fixativen, z.B. mit Alkohol oder Formalin in Kontakt kommen. Eventuell vorhandene Mikroben würden sofort vernichtet werden.
24.1.4.6 Probenverwechslungen vermeiden
Probenmaterial muss sorgfältig beschriftet und möglichst eindeutig, elektronisch lesbar kodiert werden, um Fehler zu vermeiden. Da Pflegende und Ärzte unter zunehmendem zeitlichem Druck arbeiten, nimmt die Gefahr von Fehlern zu. Im Labor werden Verwechslungen durch Informationstechnik weitgehend vermieden.
Gedruckte Etiketten reduzieren Verwechslung. Stehen sie nicht zur Verfügung, sind die Proben mit folgenden Angaben zu versehen:
-
Name und Geburtsdatum des Patienten
-
Entnahmedatum, -uhrzeit
-
entnehmende Person
-
Name der Station
24.1.4.7 Sachgerecht zwischenlagern
Optimal ist die sofortige Untersuchung des Probenmaterials; ist dies nicht möglich, muss eine korrekte Zwischenlagerung erfolgen. Als optimale Wachstumstemperatur der meisten menschlichen Infektionserreger gilt die Körpertemperatur. Eine Absenkung der Temperatur führt – mit wenigen Ausnahmen – zu einer deutlichen Abnahme des Stoffwechsels und verminderter Vermehrung. Daher ist natives Probenmaterial generell kühl und Material im Transportmedium bei Raumtemperatur bis zum Transport aufzubewahren (Geiss 2011). Prinzipiell bestehen 3 Möglichkeiten zur Zwischenlagerung ( ▶ Tab. 24.2 ).
|
Art der Zwischenlagerung |
Funktion |
Untersuchungsmaterial |
|
Kühlschrank (4 °C) |
|
|
|
Brutschrank (36 – 37 °C) |
für Material in Nährlösung sinnvoll, damit sich evtl. vorhandene Mikroorganismen vermehren (Vorbrütung vermerken!) |
|
|
Raumtemperatur |
kommen Proben noch am selben Tag zur Bearbeitung, sind Lagerung und Transport bei Raumtemperatur immer ausreichend |
|
Merke
Klären Sie Details zu Entnahme, Lagerung und Transport immer mit dem zuständigen Labor. Es besteht gegenseitige Informationspflicht!
24.1.4.8 Proben versenden
Entscheidend für die Qualität und Aussagekraft der mikrobiologischen Laboruntersuchungen ist neben der richtigen Lagerung auch der korrekte Probenversand.
Die meisten humanpathogenen Bakterien wie Darmbakterien, z.B. Enterobacteriaceae oder Staphylokokken (u.a. Pathogen eitriger Hauterkrankungen und Wundinfektionen), teilen sich alle 20 Min.; nach 3,5 Stunden hat sich ihre Zahl vertausendfacht. Damit wird der Wert einer korrekten Zwischenlagerung und des Transport mikrobieller Proben deutlich.
Bei Transporten außer Haus oder zwischen weit voneinanderliegenden Teilen einer Klinik müssen Beförderungsbestimmungen, z.B. das Gesetz über die Beförderung gefährlicher Güter (GGBefG 2016), eingehalten werden (Rückfrage im Labor).
24.2 Situation des (Risiko-)Patienten bei Klinikaufnahme und Informationspflicht
Infektionen in Kliniken, auch durch multiresistente Erreger (MRE), rücken immer mehr in den Fokus der Öffentlichkeit. Und für Menschen mit Risikofaktoren und reduzierter Immunabwehr können MRE, wie MRSA (Methicillin-resistente Staphylococcus aureus) oder MRGN-Bakterien (Multiresistente gramnegative Bakterien) zu einer vitalen Bedrohung werden. Mit diesen Bedenken und Befürchtungen kommen Menschen in die Klinik. Sie sorgen sich vor der Gefahr eines Reservoirs erkannter und unerkannter, mit Mikroben besiedelter oder infizierter Patienten. Dazu kommen solche MRE-Träger, die noch von früheren Aufenthalten kolonisiert oder infiziert geblieben sind und unerkannt wiederaufgenommen werden.
Daher führen immer mehr Krankenhäuser bei Risikopatienten sofort bei Aufnahme ein Screening auf MRE-besiedelte Personen durch.
Merke
Aufnahmescreening bei Risikopatienten heißt Abstrichuntersuchung
-
mit einem Tupfer (mit NaCl 0,9 % befeuchtet) in Rachen und beiden Nasenlöchern sowie
-
jeweils einem Abstrich von chronischen Wunden oder anderen Wundöffnungen auf MRSA und
-
je nach Risikopotenzial einem Rektalabstrich auf MRGN.
Die Patientenbetreuung erfolgt mit konsequenter Basis-(Standard-)Hygiene möglichst im Einzelzimmer oder als Kontaktisolierung, bis das MRE-negative Ergebnis vom Labor kommt.
Doch kann auch diese Praxis zu Unsicherheit bei Angehörigen und Patienten führen, da in den meisten Diskussionen und Gesprächen wichtige Informationen fehlen wie:
-
Viele dieser Infektionen sind Folge schwerer Grunderkrankungen oder größerer operativer Eingriffe.
-
Nosokomiale Infektionen können ▶ nur teilweise vermieden werden.
Daher ist sorgfältige Aufklärung notwendig und hilfreich, um die unterschiedlichen Erfordernisse in der Pflege zwischen Klinik und Alten- und Pflegeheim oder ambulanter Pflege zu erläutern.
Gleichgültig, ob es sich um eine Probeentnahme ohne oder mit Eingriff in den Körper handelt, der Patient wird stets besser mitarbeiten, wenn er ausreichend über die Vorgehensweise und den Zweck der Untersuchung informiert wurde. Seine Angst und Ungewissheit bezüglich des Laborergebnisses dürfen dabei nicht vergessen werden.
Bei diagnostischen Eingriffen ist der Patient darüber aufzuklären, wozu dieser Eingriff dient, wie dabei verfahren wird und wann mit dem Ergebnis zu rechnen ist. Das nimmt ihm ein wenig die Unsicherheit darüber, was mit ihm geschieht, und reduziert das Gefühl des Ausgeliefertseins.
24.3 Pflege- und Behandlungsplan
Je nach benötigtem Material kann die Gewinnung dem Patienten selbst übertragen werden (z. B. Stuhl, Urin). Hier ist eine dem Patienten angepasste Information wichtig, um so die Vorbereitung qualitativ zu verbessern.
Die Probenbeschaffung wird zudem an qualifizierte Mitarbeiter der Pflege oder des Labors delegiert, z. B. kapilläre und venöse Blutentnahmen. Auch einzelne komplikationsträchtige Eingriffe in den Körper des Menschen werden vom Arzt an kompetente Pflegende delegiert, so eine Sekretentnahme aus der Wundtiefe. Andere Eingriffe wie ▶ Biopsien und Punktionen werden vom Arzt mit Unterstützung speziell dafür ausgebildeter Mitarbeiter vorgenommen.
Je nach Fragestellung werden unterschiedliche Laboruntersuchungen angeordnet. Für den Keimnachweis ist es wichtig, ob
-
das Material aus einer normalerweise sterilen Körperregion stammt oder
-
es Kolonisationsflora enthalten kann.
Bei normalerweise sterilem Untersuchungsmaterial kann mithilfe eines mikroskopischen Präparates eine erste, schnelle Verdachtsdiagnose bezüglich des Mikroorganismus gestellt werden.
24.3.1 Blutkulturen
Blutkulturen sind z. B. bei Verdacht auf eine Blutstrominfektion (Sepsis) indiziert. Sepsis ist die Beschreibung eines klinischen Bildes mit z. B. Fieber, Blutdruckabfall, Oligurie. Andere Indikationen sind Peritonitis, Meningitis, Pneumonie und Fieber unbekannter Ursache. Bei unsachgemäßer Abnahme der Blutkulturen (z. B. unzureichende Desinfektion einer Punktionsstelle, Entnahme aus dem liegenden Katheter über einen kontaminierten Dreiwegehahn) können Keime der residenten Flora (Standortflora, die physiologisch vorhanden ist) in die Kulturflasche gelangen (Köck 2015).
Material
-
sterile Handschuhe
-
Hautantiseptikum (alkohol. PVP-Jod oder 70 %iger Alkohol)
-
sterile Tupfer
-
2–3 Blutkulturpaare (aerob/anaerob)
-
Blutentnahmekanülen oder geschlossenes System (z.B. Butterfly und Bactec-Holder)
Durchführung
-
Hände desinfizieren.
-
Plastikkappe von beschrifteter Blutkulturflasche entfernen, ohne Verschlussgummi zu berühren.
-
Verschlusskappe desinfizieren.
-
Punktionsfläche mit sterilen Tupfern und Hautantiseptikum desinfizieren (Probe niemals einem länger liegenden Gefäßkatheter entnehmen).
-
Einwirkzeit von 1–2 Min. beachten, danach zweite Desinfektion durchführen.
-
Punktionsstelle danach nicht mehr palpieren.
-
Möglichst nicht sprechen oder husten, um Kontaminationsgefahr zu reduzieren.
-
Nach Fehlpunktion Kanüle wechseln.
-
Bei Erwachsenen pro Flasche 8–10 ml Blut entnehmen (Maximum jedoch nicht überschreiten, Herstellerangaben beachten); pro Milliliter zu wenig abgenommenen Blutes steigt die Anzahl falsch negativer Befunde um 3–5 %. Bei Säuglingen und Kleinkindern 0,5 – 5 ml (abhängig vom Patientengewicht) in pädiatrische Kulturflasche mit geringerer Menge an Kulturmedium geben.
Wenn Blut mittels Blutentnahmekanülen entnommen wird:
-
Kanüle zwischen Blutabnahme und Inokulation in die Blutkulturflasche wechseln.
-
Menge in eine aerobe und anaerobe oder 2 aerobe Flaschen aufteilen.
Nach dem Beimpfen die Flaschen leicht schwenken, um gute Durchmischung von Blut und Kulturmedium zu gewährleisten.
Die Blutentnahme für eine Blutkultur kann auch mittels Adaptersystem erfolgen.
Transport/Lagerung
-
Vorrat an Flaschen bei Raumtemperatur lagern, niemals im Kühlschrank.
-
Bei V.a. Sepsis gilt: je schneller die Blutkulturprobe im Labor, desto besser die Überlebenschancen für den Patienten.
-
Nach der Blutentnahme müssen die Flaschen ebenfalls bei Raumtemperatur gelagert werden.
Tipps und Tricks
-
Ein Fieberanstieg muss nicht abgewartet werden.
-
Probe möglichst früh nach Auftreten von klinischen Symptomen, die auf eine Sepsis hindeuten, abnehmen.
-
Meist lohnt es sich, eine dritte Blutkultur nach 24 Std. zu entnehmen.
-
Die Abnahme soll möglichst vor Beginn der Antibiotikatherapie oder -pause sein.
-
Auch bei liegendem ZVK Blut peripherer Vene entnehmen.
-
Bei Verdacht auf Katheterinfektion Blut aus ZVK und peripherer Vene entnehmen.
24.3.2 Intravaskuläre Katheterspitzen (Regionalanästhesie- oder Venenkatheter)
Besteht der Verdacht auf eine katheterbedingte Infektion, muss zur Sicherung der Diagnose neben der Blutkultur auch die Venenkatheterspitze untersucht werden.
Material
-
Schutzhandschuhe
-
Hautantiseptikum (PVP-Iod oder 70 %iger Alkohol)
-
sterile Schere
-
steriles Probenröhrchen ohne flüssiges Transportmedium, da sonst keine semiquantitative Bestimmung (Beurteilung von: leicht, mäßig, deutlich bis stark erhöht) möglich ist.
Durchführung
-
Schutzhandschuhe anziehen.
-
An Einstichstelle um den Katheter ggf. Wundschorf entfernen und mit Hautantiseptikum desinfizieren (zum Schutz vor Kontamination des Katheters durch Hautflora beim Herausziehen).
-
Verdunstung des Präparates abwarten (Kontakt mit Desinfektionsmittelresten verfälscht Ergebnis!).
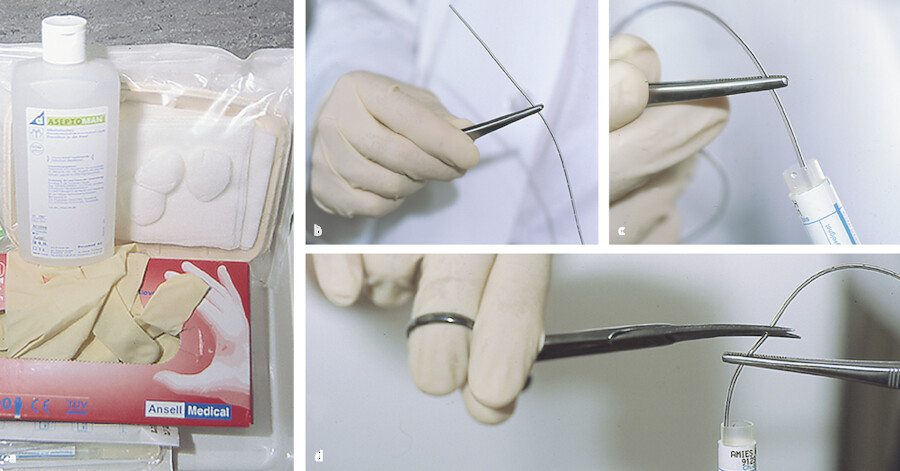
-
Katheter aseptisch ziehen, Spitze mit steriler Schere abschneiden (5 cm des Katheters) und in steriles Probenröhrchen geben ( ▶ Abb. 24.6).
Katheterspitze.
Abb. 24.6 a Tablett mit benötigtem Material b Ziehen des Katheters c Einführen der Katheterspitze in ein steriles Proberöhrchen d Abschneiden der Spitze in 5 cm Länge.
Transport/Lagerung Die Katheterspitze wird in einem sterilem Probenröhrchen entweder ungekühlt sofort ins Labor transportiert oder bei 4 °C bis zu 24 Std. gelagert (Simon 2017).
Tipps und Tricks Katheterspitzen mangels Aussagekraft nicht routinemäßig einsenden (Kerwat 2011).
24.3.3 Liquor
Infektionen des zentralen Nervensystems wie z. B. Enzephalitis, ▶ Meningitis verlaufen oft sehr rasch und nicht selten mit tödlichem Ausgang. Daher sind die Geschwindigkeit des Transports und die schnelle Bearbeitung des Untersuchungsmaterials hier oft entscheidend.
Material Sterile Probenröhrchen vorbereiten.
Durchführung
-
Die Liquorpunktion erfolgt durch den Arzt nach korrekter Desinfektion der Haut bzw. nach sorgfältiger Desinfektion unter sterilen Bedingungen aus externer Ventrikeldrainage.
-
1 – 2 ml Liquor aufteilen in mind. 3 sterile Probenröhrchen, größere Volumina bei Untersuchung u.a. auf Pilze, TB-Bakterien.
-
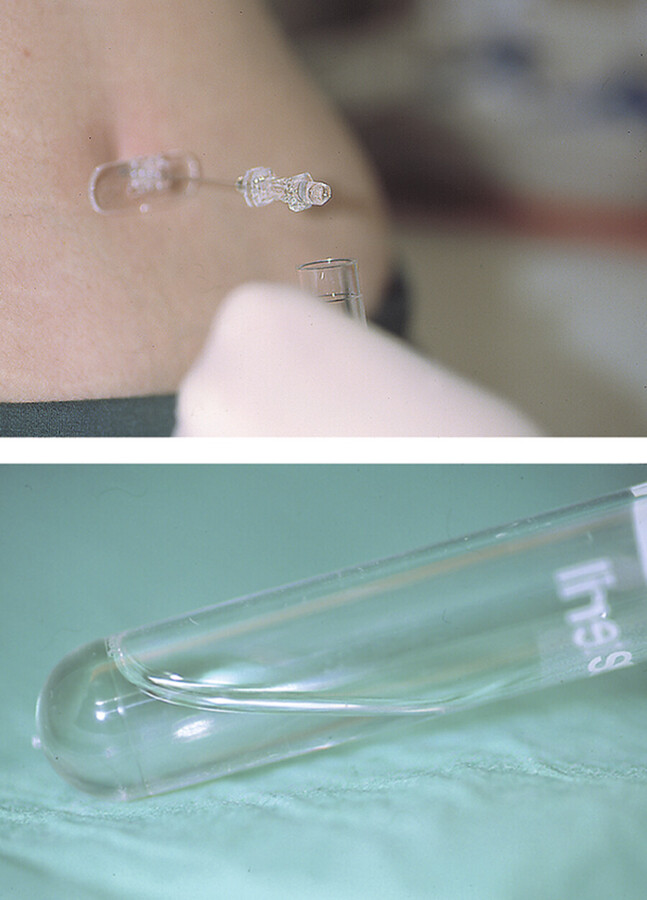
Das Probenröhrchen nach Lumbalpunktion und Eintropfenlassen des Liquors ( ▶ Abb. 24.7) sofort mit Schraubkappe dicht verschließen.
Liquorentnahme.
Abb. 24.7 Nach der Lumbalpunktion mit sehr sorgfältiger Desinfektion der Punktionsstelle, um Keimeinschleppungen und Kontaminationen der Probe zu vermeiden, lässt der Durchführende den Liquor in das Proberöhrchen eintropfen.
Transport/Lagerung
-
so schnell wie möglich Transport ins mikrobiologische Labor
-
nicht kühlen, sondern bei Raumtemperatur stehen lassen
-
falls längere Lagerung notwendig, Teil des Liquors in Blutkulturflasche und in Brutschrank geben
Tipps und Tricks Damit empfindliche bakterielle Mikroben (Meningokokken, Pneumokokken) nicht absterben, soll der Liquor möglichst sofort körperwarm ins Labor gebracht werden (ggf. telefonisch ankündigen). Je nach Entfernung ist ein Thermobehälter sinnvoll.
24.3.4 Pleura-, Perikard-, Synovial-, Peritonealflüssigkeit
Material Zur mikrobiologischen Diagnostik von Pleura-, Perikard-, Synovial- oder Peritonealflüssigkeit werden sterile Probenröhrchen vorbereitet.
Durchführung
-
Punktion erfolgt nach sorgfältiger Hautdesinfektion.
-
Gewonnenes Material in steriles Probenröhrchen füllen (2 – 5 ml ausreichend; größere Volumina bei Untersuchung auf TB-Bakterien).
Transport/Lagerung
-
Materialien nicht kühlen
-
sehr geringe Mengen beimpfen in vorgewärmte Blutkulturflasche
-
falls längere Lagerung notwendig: Teil des Materials in Blutkulturflasche und (je nach Laborangabe) in Brutschrank geben
Tipps und Tricks Die Abnahme von Sekret ist einem Abstrich vorzuziehen.
24.3.5 Respirationstrakt
24.3.5.1 Nasenabstrich
Abstriche der Nase/des Rachens zum Screening auf MRSA u. a. MRE sind bei Patienten mit Risikofaktoren bei Klinikaufnahme angebracht. Die bevorzugt in der vorderen Nasenhöhle siedelnden Staphylococcus aureus gelangen durch unbedachten Hand-Gesichts-Haar-Kontakt auf die Hände und werden bei mangelnder Händehygiene verbreitet.
Material
-
Abstrichtupfer
-
steriles NaCl 0,9 %
Durchführung Die Durchführung eines Nasenabstrichs ist in ▶ Abb. 24.8 dargestellt.
Abstrich.
Abb. 24.8 Zum Nachweis von Keimträgertum (Staphylococcus aureus oder Methicillin-resistente S. aureus u. a. MRE) wird ein Nasenabstrich durchgeführt. Ein Abstrichtupfer reicht für Rachen und beide Nasenhöhlen aus.
(Foto: P. Blåfield, Thieme)
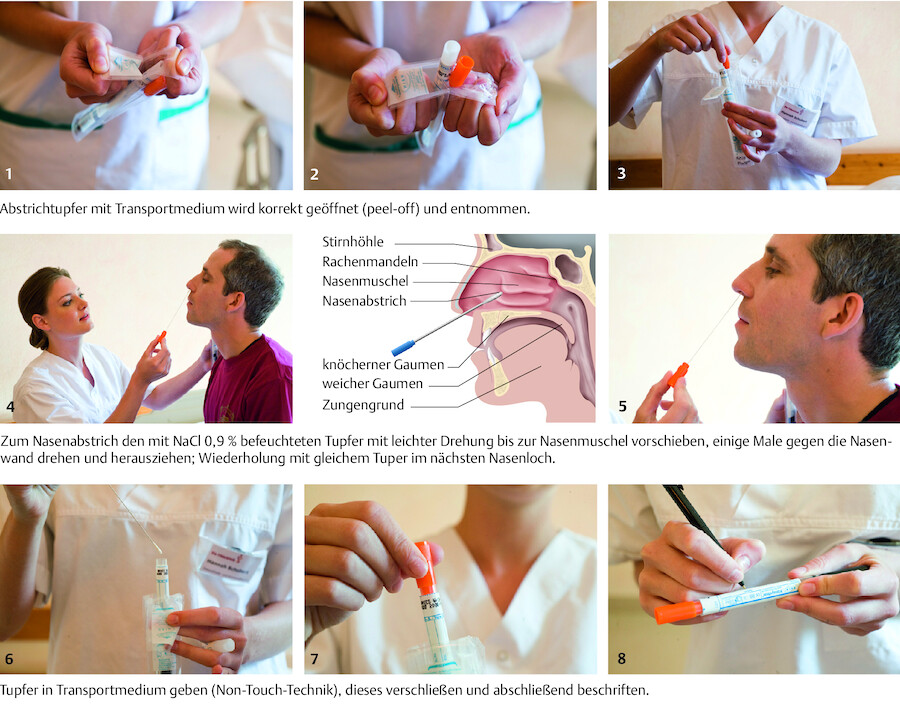
Transport/Lagerung
-
Röhrchen mit Transportmedium
-
Lagerung im Kühlschrank bis zum schnellstmöglichen Transport ins Labor
Tipps und Tricks
-
Abstrich möglichst lange nach letzter Säuberung
-
mit NaCl 0,9 % angefeuchteten Tupfer nicht tief (1 – 2 cm) in die Nase einführen, da z. B. der Erreger S. aureus bevorzugt in vorderer Nasenhöhle siedelt
24.3.5.2 Nasennebenhöhlen
Material
-
steriles Probenröhrchen
Durchführung Der Durchführende punktiert die Nebenhöhlen und aspiriert so viel Sekret wie möglich, evtl. wird anschließend mit Ringer-Lösung gespült.
Transport/Lagerung Probenröhrchen umgehend ins Labor bringen oder Sekret in Transportmedium geben.
24.3.5.3 Rachenabstrich
Die Entnahme ist z.B. zum MRSA-Screening oder Nachweis von A-Streptokokken (Scharlach) indiziert.
Material
-
Abstrichtupfer
-
Mundspatel
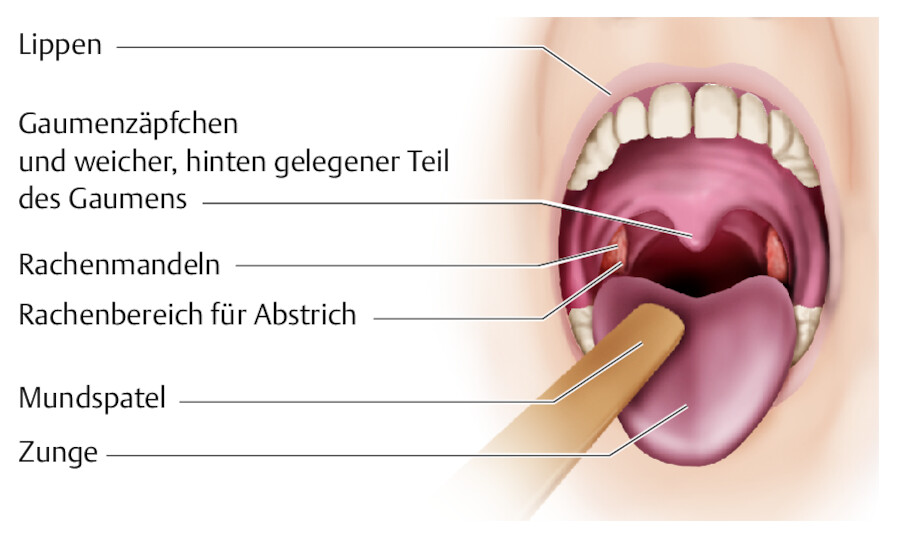
Durchführung Das Material von entzündeten bzw. sekretbedeckten Regionen der hinteren Rachenwand, des Gaumens und der Tonsillen, z.B. bei eitriger Angina zum Nachweis von A-Streptokokken, mit drehender oder kräftig streichender Bewegung des Tupfers entnehmen. Mit Abstrichtupfer entzündete Region oder Rachenring abstreichen ( ▶ Abb. 24.9), evtl. 2. Abstrichtupfer für normalen Schleimhautabstrich verwenden. Aus Tonsillenkrypten Probe vorsichtig unter Drehen des Tupfers entnehmen. Dabei Berührung mit gesund erscheinender Zungen- und Wangenschleimhaut und Speichel vermeiden (physiologische Keimbesiedlung).
Rachenabstrich.
Abb. 24.9 Rachen (Rachenmandeln = Tonsillen und Rachenhinterwand) unter drehenden Bewegungen und Aufwendung von Druck abstreichen.
Transport/Lagerung Probe bis zum schnellstmöglichen Transport ins Labor im Kühlschrank lagern.
Tipps und Tricks
-
6 Std. vor der Materialentnahme nicht mehr gurgeln oder Mund spülen (Abnahme am besten morgens).
-
Kein Sprühanästhetikum verwenden, da die Trägersubstanz (Alkohol) das Ergebnis der mikrobiologischen Kultur verfälschen kann.
24.3.5.4 Sputum
Material
-
steriles Probengefäß
-
Zellstoff
Durchführung
-
Wenn möglich, vorher mehrfach Mund mit Leitungswasser spülen lassen.
-
Respiratorisches Sekret (bei kooperativen Patienten möglichst mit eitrigem Auswurf) aus Bronchialsystem hochhusten und in steriles Behältnis expektorieren lassen (> 1 ml).
-
Für TB-Umgebungsuntersuchungen lassen sich mit dem genetischen Fingerabdruck („DNA-Fingerprinting“) Ausbruchsketten leichter aufklären. Es handelt sich um ein molekularbiologisches Verfahren zum Nachweis von Teilen der Erbsubstanz (DNA) des Erregers. Teure Überdiagnostik und evtl. unnötige Therapien können so vermieden werden (Loddenkemper 2007).
Transport/Lagerung
-
Aufarbeitung innerhalb von 4 Std. ist dringend anzustreben (Lorenz 2015)
-
im Kühlschrank (4 °C) Zwischenlagerung, bei längerer Transportzeit Kühllagerung
Tipps und Tricks
-
Abgabe sinnvoll unter Aufsicht
-
am besten ist Nüchternsputum geeignet
-
Auswurf kann durch Inhalation von NaCI (3 – 10 %) provoziert werden
Merke
Speichel ist für mikrobiologisch-diagnostische Zwecke unbrauchbar!
24.3.5.5 Trachealsekret
Trachealsekret kann auf 3 Arten gewonnen werden:
-
nasotracheale bzw. pharyngotracheale Absaugung ( ▶ Abb. 24.10)
-
bronchoskopische Absaugung und bronchoalveoläre Lavage (BAL) (d.h. ein alveolärer Auswaschvorgang) oder geschützte Bürste
-
transtracheale Aspiration
Dabei wird jeweils so viel Sekret wie möglich abgesaugt bzw. aspiriert (Menge der Lavageflüssigkeit ist abhängig von der zurückgewonnenen Menge, z.B. 4 Portionen mit je 30 ml NaCl 0,9%).
Gefäß für BAL/endotracheal abgesaugtes Material.
Abb. 24.10
(Foto: P. Blåfield, Thieme)
Transport/Lagerung Siehe Sputum.
24.3.6 Uringewinnung zur bakteriellen Diagnostik
Bei Harnwegsinfektionen wird der Urin auf bakterielle Mikroorganismen untersucht, s. ▶ Urindiagnostik. Am besten eignet sich der erste Morgenurin als sog. Mittelstrahlurin. Da bei einem Einmalkatheterismus jedoch das Risiko einer iatrogenen Infektion besteht, sollte eine Katheterisierung nur unter strenger Indikation (z.B. bei einer bestehenden Kontraindikation für eine Blasenpunktion) und sterilen Kautelen durchgeführt werden.
Eine suprapubische Blasenpunktion durch den Arzt sollte immer dann durchgeführt werden, wenn das bakteriologische Ergebnis des Mittelstrahlurins nicht zweifelsfrei ist. Kontraindikationen für diese Punktion sind:
-
Blutungsneigung
-
eitrige Harnwegsinfektion
-
Voroperation im Unterbauch
-
Verdacht auf Tumor
Darüber hinaus ist die Methode problemlos durchzuführen.
Bei Säuglingen werden nach gründlicher Reinigung des Perineums zur Uringewinnung Einmalplastikklebebeutel verwendet. Der Morgenurin ist am besten geeignet, die letzte Miktion sollte mehr als 3 Stunden zurückliegen.
Lebensphase alter Mensch
Riecht bei Patienten mit liegendem Dauerkatheter der Urin nach Ammoniak, ohne dass sie Symptome eines Harnwegsinfektes zeigen, ist oft nur der Katheter bakteriell besiedelt. Solchen Patienten sollte keine Antibiose verabreicht werden, sondern der DK gewechselt werden. Die Abnahme einer Urinkultur ist nicht nötig (Wald 2016). Eine asymptomatische Bakteriurie wird nicht behandelt. Einzige Ausnahme ist eine vorliegende Schwangerschaft.
24.3.6.1 Mittelstrahlurin
Mittelstrahlurin ist einfach zu gewinnen, er ist jedoch auch sehr anfällig für Kontaminationen. Je nach klinikinternem Standard zur sachgerechten Gewinnung von Mittelstrahlurin wird die Umgebung der Harnröhrenöffnung (periurethrales Gebiet) speziell gereinigt oder nicht, jedoch die Entnahmetechnik streng beachtet.
Materialien
-
Urinaufnahmegefäß (sauberes Steckbecken)
-
Schutzhandschuhe
-
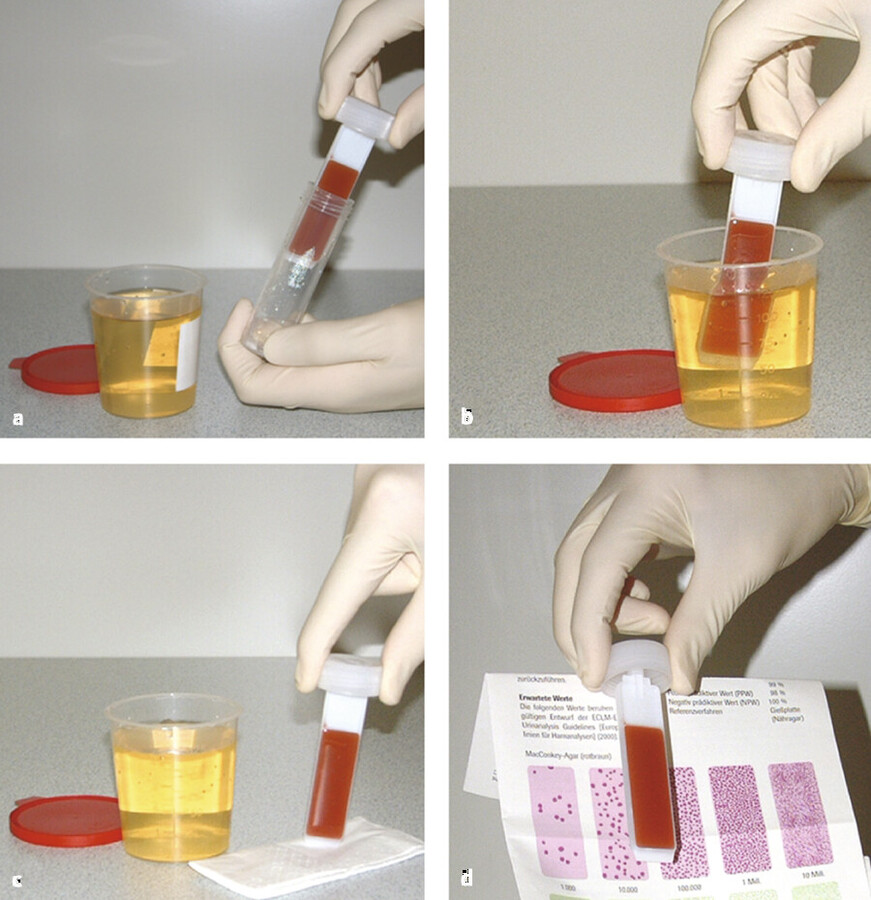
steriler Urinbecher oder Tauchnährboden ( ▶ Abb. 24.11)
Durchführung des Uricult-Tests.
Abb. 24.11 a Deckel mit Eintauchnährboden unter aseptischen Bedingungen von sterilem Untersuchungsröhrchen abschrauben b Uricult-Nährmediumträger in die frisch gelassene Urinprobe eintauchen, bis die Agaroberflächen vollständig bedeckt sind c überflüssigen Urin abtropfen lassen; anschließend Uricult-Nährmedium für 16–24 Std. bei 36°C± 2°C bebrüten lassen d Uricult-Nährmedium mit den Musterbildern vergleichen, um die Kolonienzahl zu ermitteln.
Durchführung
-
Harnröhre zum Urinlassen steril darstellen.
-
Erste Milliliter verwerfen, ohne Unterbrechung steriles Gefäß füllen (5 – 10 ml).
Tipps und Tricks Eine spezielle Reinigung der Umgebung der Harnröhrenöffnung scheint das Ergebnis nicht zu verbessern. Wesentlich ist, die vom jeweiligen Labor geforderte Entnahmetechnik dem Patienten genau zu erklären.
Anleitung für die kooperationsfähige, selbstständige Frau
Die Gewinnung von Mittelstrahlurin erfolgt nach dem Duschen, nach einer Genitalspülung oder mechanischen Reinigung des äußeren weiblichen Genitals mit Einmalwaschlappen und Spreizen der Labien (kein Desinfektionsmittel verwenden). Dabei ist auf eine ausführliche und sensible Information und Erläuterung der medizinischen Notwendigkeit dieser Reinigung zu achten, da es sich um einen Eingriff in die Intimsphäre der Patientin handelt.
Zu Reinigung und Urinabgabe soll sich die Frau mit gespreizten Beinen über die Toilette stellen. Äußere Genitalien immer von vorn oben nach unten hinten reinigen! Der Urin wird stehend entleert. Die erste Urinportion abfließen lassen und die mittlere Portion aus dem freien Urinstrahl in das sterile Gefäß auffangen lassen. Dabei sollte der Urin kontaminierte Schamhaare nicht berühren.
Merke
Keine Schleimhautantiseptik bei der Reinigung des äußeren Genitals oder der Harnröhrenmündung anwenden, der bakteriologischer Befund könnte durch Desinfektionsmittel verfälscht werden!
Anleitung für die eher immobile Frau
Nach dem Duschen der Patientin, einer Genitalspülung oder Reinigung mit Spreizen der Labien kann die Uringewinnung auf dem gynäkologischen Untersuchungsstuhl oder mithilfe der Bettpfanne und pflegerischer Unterstützung im Patientenbett erfolgen. Bei Misslingen muss in aseptischer Technik katheterisiert oder die Blasenpunktion durchgeführt werden.
Merke
Beim Trocknen der Schleimhaut nicht reiben, sondern tupfen. Es besteht die Gefahr falsch positiver Erythrozytenbeimengungen durch Mikroblutungen.
Anleitung für den Mann
Zunächst wird das Präputium (Vorhaut) zurückgezogen und mit Tupfer oder Kompressen die Eichel und die Harnröhrenmündung mit reinem Wasser gründlich gereinigt. Beim Urinlassen werden 10 – 50 ml Urin steril aufgefangen, jedoch nicht die erste Portion, da sie mit Keimen aus der Harnröhre belastet sein kann. Das gilt auch für die Untersuchung mit Eintauchnährboden (z. B. Uricult, ▶ Abb. 24.11). In das sterile Gefäß darf erst die 2. Portion des Urins aufgefangen und der Nährboden darin kurz eingetaucht werden.
Durchführung des Urin-Tests
Im Urin vorhandene Bakterien bleiben auf dem Objektträger, der gleichzeitig als Nährbodenträger auf beiden Seiten mit einer Agarschicht überzogen ist, haften. Sie wachsen während der Inkubation zu makroskopisch sichtbaren Kolonien aus. Die Koloniendichte ist demnach proportional zur Bakterienkonzentration im Urin. Das Vorgehen zeigt ▶ Abb. 24.11.
Die so vorbereitete Trägereinheit wird ohne Verzug zu Inkubation, Auswertung, Kultur und Resistenzbestimmung an das Labor weitergeleitet. Falls dies nicht möglich ist, muss der Nährboden in einem Brutschrank bei 37 °C aufbewahrt werden. Nach 24 Stunden kann ggf. durch Auszählen der makroskopisch sichtbaren Kolonien die Keimzahl bestimmt und die Kultur anschließend im Kühlschrank zwischengelagert werden.
Infektionsrelevante Keimzahlen
Urin in der Blase ist physiologisch steril. Auch Blasenpunktionsurin ist, wenn keine Infektion vorliegt, steril. Nicht jeder Keimnachweis im Urin entspricht jedoch einer Harnwegsinfektion, häufig handelt es sich auch um Verunreinigungen des Urins. Daher ist eine kontaminationsfreie Harnprobe für ein relevantes bakteriologisches Resultat ausschlaggebend. Folgende Keimzahlen sprechen für eine Harnwegsinfektion:
-
103/ml bei Katheterurin
-
> 105/ml bei Mittelstrahlurin (signifikante Bakteriurie)
-
10 000 – 100 000/ml gelten als kontrollbedürftig
-
unter 10 000/ml sind Hinweis für eine Verunreinigung
Merke
Der alleinige Nachweis von Bakterien ohne Leukozyturie ist häufig auf eine Verunreinigung zurückzuführen.
24.3.6.2 Katheterurin (transurethral oder suprapubisch)
Material
-
Hautantiseptikum (70 %iger Alkohol)
-
10 -ml-Spritze
-
Kanüle
-
steriles Probenröhrchen
Durchführung
-
Punktionsstelle am Drainagesystem desinfizieren und Urin aseptisch mit Spritze und evtl. Kanüle entnehmen (5 – 10 ml). Es existieren Urinbeutel mit nadelfreier Probeentnahmestelle.
-
Wirkstoff abtrocknen lassen.
-
Keine Diskonnektion vornehmen.
Transport/Lagerung Die Urinprobe sollte möglichst sofort untersucht oder sofort nach Abnahme in den Kühlschrank gestellt werden.
Tipps und Tricks Nur zur mikrobiologischen Diagnostik darf keine Katheterisierung erfolgen (auch nicht bei der Frau), da die Gefahr der Keimeinschleppung besteht (Kochanek 2014)!
Merke
Niemals Urin aus dem Sammelbeutel entnehmen! Wenn nötig, Urin stauen; Ableitungsschlauch ca. 3 – 5 cm distal von der Punktionsstelle abklemmen. Keine Diskonnektion der Verbindung Katheter-Ableitungsschlauch vornehmen!
Einmalkatheterurin
Zu Vorbereitung und Durchführung des Einmalkatheterismus s. Kapitel zur ▶ Katheterisierung der Harnblase. Da alle üblichen Gleitmittel (Endosgel oder Instillagel) den antimikrobiell wirksamen Konservierungsstoff Chlorhexidin enthalten, muss bei einer Urinabnahme für diagnostische Zwecke die erste Urinprobe verworfen werden. Erst die zweite Portion Urin wird in eine sterile Schale gegeben und damit der Nährboden beimpft. Sonst besteht die Gefahr falsch negativer bakteriologischer Ergebnisse.
24.3.6.3 Blasenpunktionsurin
Blasenpunktionsurin ist indiziert zur Abklärung fraglicher Befunde. Zur Punktion sollte die Blase gefüllt sein.
Materialien
-
Hautantiseptikum
-
10 -ml-Spritze
-
Kanüle
-
steriles Probenröhrchen oder Tauchnährboden
Durchführung Nach der Hautdesinfektion führt der Arzt die suprapubische Punktion der Blase durch. Für die Urinprobe werden 5 – 10 ml benötigt. Der gewonnene Urin aus der Spritze wird in ein steriles Uringefäß gespritzt oder sofort tropfenweise über beide Seiten des Nährbodens (z. B. Uricult) verteilt.
Transport/Lagerung Die Urinprobe sollte möglichst sofort untersucht werden oder sofort nach Abnahme in den Kühlschrank gestellt werden.
24.3.7 Urethralabstrich/Vaginalabstrich
24.3.7.1 Urethralabstrich
Materialien
-
frische Waschlappen oder einige Mullkompressen
-
steriles Abstrichröhrchen
Durchführung
-
Harnröhrenöffnung (Orificium urethrae externa) mit Wasser reinigen und mit sterilen Tupfern vorsichtig tupfend abtrocknen.
-
Mit 0,9 % NaCl angefeuchtete Abstrichtupfer ca. 1 (– 3) cm tief einbringen und durch Drehen zellhaltiges Material gewinnen. Auf Objektträger auftragen.
-
Anschließend in Transportmedium einbringen.
Transport/Lagerung Abstrichtupfer umgehend zur Untersuchung bringen.
Tipps und Tricks Vor der Materialentnahme nicht urinieren.
24.3.7.2 Vaginalabstrich
In der Gynäkologie und Geburtshilfe kann mithilfe des Vaginalabstrichs die momentane Zyklusphase bzw. die hormonelle Aktivität festgestellt werden, zudem unterstützt er die Diagnostik bei Scheidenentzündungen, Vaginalsoor oder Krebserkrankungen.
Materialien
-
frische Waschlappen oder einige Mullkompressen
-
sterile Tupfer
-
steriles Abstrichröhrchen
Durchführung
-
Vulva mit Wasser reinigen und mit sterilem Tupfer abtrocknen.
-
Möglichst unter Spekulumeinstellung Scheidenwand abstreichen.
Transport/Lagerung Material umgehend zur Untersuchung bringen oder bei 4 °C lagern (Kühlschrank).
24.3.8 Gastrointestinaltrakt
24.3.8.1 Helicobacter-pylori-Diagnostik
Helicobacter pylori ist ein spiralförmig gewundenes Bakterium, das sich in der Magenschleimhaut ansiedeln und vermehren kann. Wird es auf fäkal-oralem Weg übertragen, kann es zur Kolonisation und Infektion der Magenschleimhaut kommen. Das Bakterium kann aus Erbrochenem, Stuhl und Speichel kultiviert werden. Im Rahmen der invasiven Gastroskopie werden zur Diagnostik u.a. auch die Kultur und der Urease-Schnelltest durchgeführt.
Nicht invasiv werden i.d.R. in der Endoskopie folgende Untersuchungen durchgeführt: Harnstoff-Atemtest, Antigen-Nachweis im Stuhl (ELISA) sowie IgG-Antikörper im Serum. Deutlich ist, dass der direkte ärztliche oder pflegerische Patientenkontakt keinen relevanten Risikofaktor für eine H.-pylori-Infektion darstellt (Fischbach 2016).
24.3.8.2 Duodenalsaft/Galle
Mikroorganismen, die den oberen Dünndarm befallen, lassen sich auch in Erbrochenem oder in Duodenalsekret nachweisen.
Materialien
-
sterile Probenröhrchen
Durchführung Nach Duodenalsondierung wird so viel Galle wie möglich aspiriert.
Transport/Lagerung
-
Proben in sterilen Probenröhrchen zur sofortigen Untersuchung bringen.
-
Zum Nachweis von Lamblien (Parasit) sofort nach Entnahme in der Klinik ein (ungefärbtes) Objektträgerpräparat mikroskopieren oder innerhalb von 20 Min. ins mikrobiologische Labor bringen.
24.3.8.3 Stuhluntersuchungen
Stuhluntersuchungen werden zum Nachweis darmpathogener Mikroben, z.B. bei Verdacht auf Enteritis (Darminfektion) durch Salmonellen, Shigellen und Rotaviren angeordnet. Außer bei einer Untersuchung auf eine parasitäre Erkrankung ist eine einzige Stuhlprobe ausreichend (Manthey 2016).
Stuhlprobe
Materialien
-
steriles Transportgefäß, mit im Verschluss integriertem Löffelchen
Durchführung
-
Stuhl in sauberes Gefäß geben, z.B. in eine Bettpfanne (ohne Urinbeimengung).
-
Frische Probe mittels Spatel in ein Stuhlröhrchen übertragen (möglichst pathologische Stuhlanteile, wie Schleim, Blut, Eiter).
Transport/Lagerung
-
Die Probe sollte am besten sofort untersucht werden, ansonsten bei 4 °C (Kühlschrank) lagern.
-
Bei V. a. Amöben oder Lamblien körperwarmen Stuhl unverzüglich einsenden (muss innerhalb von 20 Min. mikroskopiert werden).
Rektalabstrich
Ein Rektalabstrich ist indiziert zum Nachweis von MRGN.
Materialien
-
Tupfer mit durchsichtigem oder schwarzem Gel (Amies-Transportmedium)
Durchführung Der Abstrichtupfer wird vorsichtig 3 – 5 cm hinter den Analsphinkter eingeführt und die Darmwand abgestrichen. Der Tupfer muss anschließend braun sein.
Transport/Lagerung
-
Abstrichtupfer ins Transportmedium einbringen.
-
Die Lagerung erfolgt im Kühlschrank bis zum möglichst schnellen Transport ins Labor.
Nachweis von Oxyuren-(Madenwurm-)Eiern
Material
-
mehrere Tesa-Film-Streifen
-
Objektträger
Durchführung Vor dem Waschen morgens und vor dem ersten Stuhlgang mehrmals hintereinander 5 cm lange Tesa-Streifen auf die Perianalregion (rund um die Afteröffnung) kleben und wieder abziehen. Danach die Klebestreifen mit der Klebeseite nach unten auf einen Objektträger kleben und einsenden.
Der Nachweis von Oxyuren-Eiern bzw. -Würmern erfolgt mikroskopisch.
24.3.9 Wundsekrete, Punktate und Biopsiematerial
24.3.9.1 Eiter, Abszesspunktat, Wundsekret
Materialien
-
Hautantiseptikum
-
10 -ml-Spritze
-
(Knopf-)Kanüle
Durchführung Nach der Desinfektion der Haut wird der Eiterherd punktiert und in sterile Spritze aspiriert. Es gilt so viel wie möglich zu aspirieren, denn durch Punktion gewonnenes Material ist besser geeignet als Abstriche!
Transport/Lagerung Das Material wird in ein steriles Röhrchen gespritzt und unverzüglich ins Labor gebracht.
Tipps und Tricks
-
Möglichst vor der chirurgischen Eröffnung punktieren.
-
Bei V. a. Tetanus oder Gasbrand Gewebebiopsie entnehmen (keine Abstriche!).
Praxistipp
Tupferabstriche enthalten oft zu wenig Material und sollten, insbesondere bei Abszessen oder tiefen Wundinfektionen, nach Möglichkeit durch Alternativverfahren wie Gewebsbiopsien ersetzt werden. Abstriche enthalten eher Umgebungskeime, Eiter hingegen enthält neben Leukozyten und eingeschmolzenem Gewebe v. a. die verursachenden Mikroorganismen.
24.3.9.2 Offene Ulzera
Materialien
-
sterile Abstrichtupfer
-
steriler scharfer Löffel
-
Skalpell oder 10 -ml-Spritze mit (Knopf-)Kanüle
-
steriles Röhrchen
Durchführung
-
Wenn möglich Eiter aspirieren mit Spritze (so viel wie möglich).
-
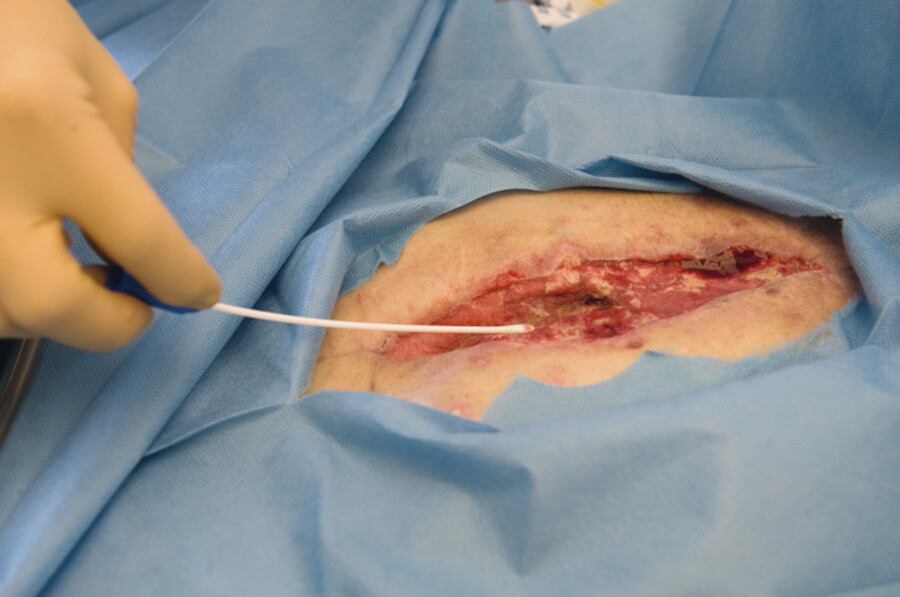
Bei wenig Sekret Material nach Entfernen von Belägen (ohne Hautdesinfektion) aus der Tiefe der Wunde entnehmen ( ▶ Abb. 24.12).
-
Gewebe vom Wundrand exzidieren oder mit sterilem Tupfer Abstrich vom Wundrand entnehmen.
Entnahme von Wundmaterial mit einem Abstrichtupfer.
Abb. 24.12
(Foto: P. Blåfield, Thieme)
Transport/Lagerung
-
Bis zum Transport ins Labor Probe im Kühlschrank lagern.
-
Abstrichtupfer im Transportmedium bei Zimmertemperatur lagern.
Tipps und Tricks Zu exzidiertem Gewebe siehe Biopsiematerial.
24.3.9.3 Biopsiematerial
Häufig ist eine Biopsie die einzige Möglichkeit, um eine tiefe Mykose nachzuweisen (AIDS-Patienten).
Materialien
-
Hautantiseptikum
-
Skalpell
-
Verbandset mit Pinzette
-
steriles Probenröhrchen
-
NaCl 0,9 %
Durchführung
-
Aseptisch entnommene Gewebeprobe in Röhrchen ohne Transportmedium geben (wenn möglich 1 cm3).
-
Nicht in Formalin fixieren!
Transport/Lagerung Möglichst sofort ins Labor transportieren (Autolyse), ansonsten bei 4 °C im Kühlschrank lagern.
Merke
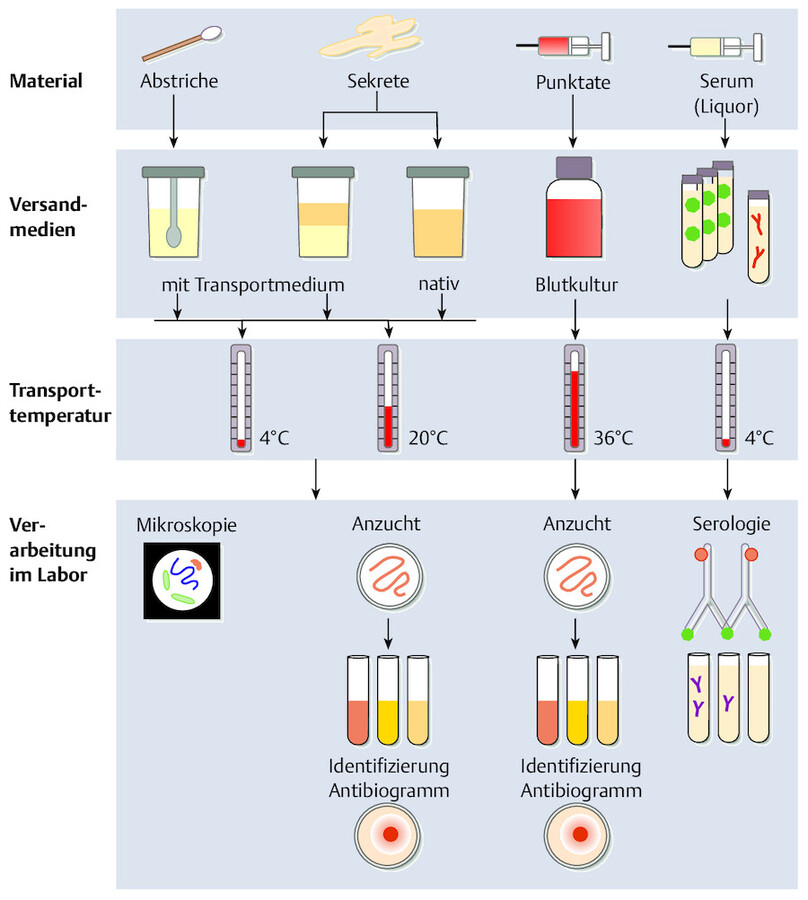
Besonders zu beachten sind die einzuhaltenden Transportzeiten, Transporttemperaturen und Versandmaterialien, da sonst das Material schnell wertlos werden kann und bei Verarbeitung nicht aussagefähige Befunde liefert ( ▶ Abb. 24.13).
Überblick über mikrobiologische Untersuchungsmaterialien und ihre Verarbeitung im Labor (Miksitis u. Hahn 2004).
Abb. 24.13
24.4 Lern- und Leseservice
24.4.1 Literatur
[1418] AWMF 2014. Gewinnung, Lagerung und Transport von Proben zur mikrobiologischen Infektionsdiagnostik. AWMF-Leitlinien-Register Nr. 029/018. Im Internet: http://www.awmf.org/uploads/tx_szleitlinien/029–018l_S1_Gewinnung_Lagerung_Transport_von_Proben.pdf; Stand: 16.12.2016
[1419] Fischbach W et al. S2k-Leitlinie Helicobacter pylori und gastroduodenale Ulkuskrankheit. Z Gastroenterol 2016; 54: 327–363
[1420] Gastmeier P et al. Nosokomiale Infektionen und Infektionen mit multiresistenten Erregern – Häufigkeit und Sterblichkeit. Dtsch Med Wochenschr 2016; 141: 421–426
[1421] Geiss HK. Mikrobiologische Infektionsdiagnostik. CNE.fortbildung 2011: 5
[1422] GGBefG 2016. Gesetz über die Beförderung gefährlicher Güter (GGBefG) vom 6. 8.1975, zuletzt geändert am 26.07.2016. Im Internet: http://www.gesetze-im-internet.de/bundesrecht/gefahrgutg/gesamt.pdf; Stand: 15.04.2017
[1423] Gröschel K, Gröschel S. Diagnostische Lumbalpunktion. Dtsch Med Wochenschr 2015; 140: 738–740
[1424] Just HM. Mikrobiologische Untersuchungen zur Diagnostik nosokomialer Infektionen. Krankenh.hyg. up2date 2006; 1: 133–149
[1425] Kerwat K. et al. Abnahme und Transport von mikrobiologischen Proben. Anästhesiol Intensivmed Notfallmed Schmerzther 2011; 46: 330–331
[1426] Kochanek M, Michels G, Seifert H. Mikrobiologische Infektionsdiagnostik auf der Intensivstation. Intensivmed.up2date 2014; 10: 233–248
[1427] Köck R, Kipp F, Ellger B. Sepsis und Multiorganversagen Blutkulturdiagnostik: Herausforderung oder Routine? Anästhesiol Intensivmed Notfallmed Schmerzther 2015; 50: 124–130
[1428] Loddenkemper R. Was man über die Tuberkulose wissen soll – Informationsschrift für Patienten und ihre Angehörigen.Onlineversion 2007. Im Internet: http://dzk-tuberkulose.de/patienteninfo-tuberkulose.htm; Stand: 10.03.2017
[1429] Lorenz J, Bals R. Checkliste Pneumologie. 4. Aufl. Stuttgart: Thieme; 2015
[1430] Manthey C, Stallmach A, Lohse AW. Gastrointestinale Infektionen. Gastroenterologie up2date 2016; 12: 39–49
[1431] Miksitis K, Hahn H. Basiswissen Medizinische Mikrobiologie und Infektiologie. 3. Aufl. Berlin: Springer; 2004
[1432] Quint U, Benen T. Mögliche Instrumentenkontamination im Operationssaal während der Implantation von Hüft- und Kniegelenkendoprothesen. Z Orthop Unfall 2016; 154: 157–162
[1433] RKI 2016. Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2015. Robert Koch-Institut: Berlin; 2016
[1434] Rüttermann M et al. Clinical Practice Guideline: Local treatment of chronic wounds in patients with peripheral vascular disease, chronic venous insufficiency and diabetes. Dtsch Arztebl Int 2013; 110: 25–31
[1435] Sander M, Gerlach K. Akuter Durchfall. AWMF-Register-Nr. 053/030. Im Internet: http://www.awmf.org/uploads/tx_szleitlinien/053–030l_S1_Akuter_Durchfall_2014–06.pdf; Stand: 16.12.2016
[1436] Scholze K et al. The reduction in antibiotic use in hospitals. Dtsch Arztebl Int 2015; 112: 714–721
[1437] Schottdorf B. Handbuch der Präanalytik, Stand: 3/2016. Augsburg: Labor Schottdorf MVZ GmbH. Im Internet: http://www.schottdorf.de/leistungen/pdf-praeanlytik/praeanalytik_hb.pdf; Stand: 16.12.2016
[1438] Simon A et al. Empfehlung zur Prävention von Infektionen, die von Gefäßkathetern ausgehen. Informativer Anhang 1 – Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut. Bundesgesundheitsbl 2017; 60: 216–230
[1439] Sitzmann F. Hygiene. Berlin: Springer; 1999
[1440] Sitzmann F. Hygiene kompakt. Bern: Huber; 2012
[1441] Suger-Wiedeck H et al. Prävention der nosokomialen beatmungsassoziierten Pneumonie. Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut. Bundesgesundheitsbl 2013; 56: 1578–1590
[1442] Vonberg RP. Höher, schneller, weiter – Neue Methoden der Infektionsdiagnostik. Intensivmedizin up2date 2016; 12: 41–57
[1443] Wald HL. Challenging the “Culture of Culturing”: The Case for Less Testing and More Clinical Assessment. JAMA Intern Med 2016; 176: 587–588
[1444] Zeit online. Tödliche Keime. Im Internet: http://www.zeit.de/thema/multiresistente-erreger; Stand: 17.04.2017