41 Pflege von Patienten mit Infektionskrankheiten
41.1 Übertragung von Infektionen
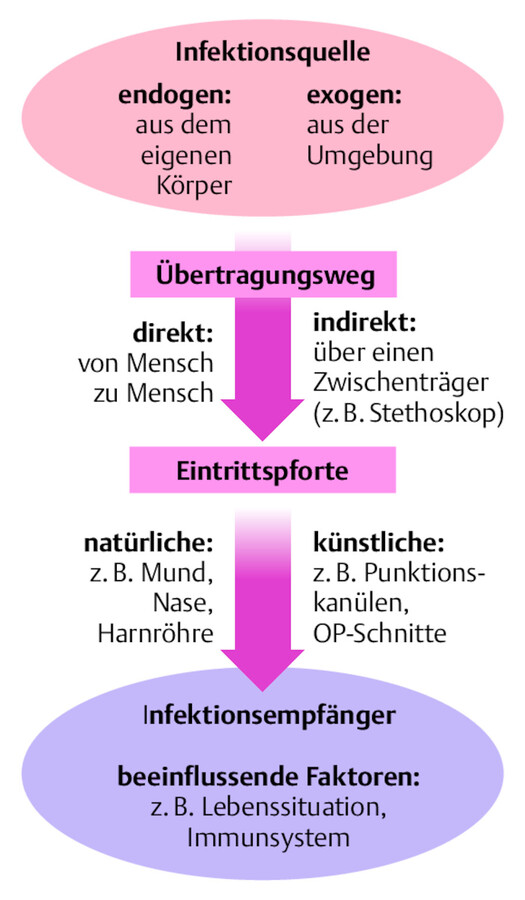
Um die Ausbreitung von Infektionen, z.B. auf Patienten und Mitarbeiter, nachzuvollziehen und präventiv tätig werden zu können, ist es sinnvoll, sich den Weg der Keime, die Infektionskette, vorzustellen ( ▶ Abb. 41.1). Man betrachtet dazu
-
die Infektionsquelle, den Übertragungsweg sowie
-
die Eintrittspforte und den Infektionsempfänger, der wiederum zur Infektionsquelle werden kann.
Infektionskette.
Abb. 41.1 Die Ausbreitung von Infektionen erfolgt über die Infektionskette.
41.1.1 Infektionsquelle und Übertragungswege
Mikroorganismen einer Infektion können aus 2 Quellen stammen: dem Patienten selbst oder aus seiner Umgebung ( ▶ Tab. 41.1 )
|
Infektionsquelle |
Erläuterung |
|
kranker Mensch |
|
|
Inkubationsausscheider |
|
|
Rekonvaleszenzausscheider |
|
|
Dauerausscheider |
|
|
Keimträger, asymptomatisch |
|
|
Tiere |
|
|
Umwelt |
|
Unterschieden werden:
-
endogene Infektionen, wenn Erreger aus der körpereigenen mikrobiellen Flora stammen, z.B. Darmkeime, die bei Beatmung zu einer Pneumonie oder Hautkeime, die zu einer postoperativen Wundinfektion führen. Aus heutiger Sicht sind sie die häufigste Form nosokomialer Infektionen.
-
exogene Infektion, wenn Mikroben aus der Umwelt des Patienten zu einer nosokomialen Infektion führen, z.B. Keime von den Händen der Mitarbeiter oder Aspergillus-Konidien (Pilzsporen) sich mit der Luft bei Immunsupprimierten verbreiten.
Für die Übertragung von Mikroorganismen kommen z.B. in Betracht:
-
besiedelte oder infizierte Mitmenschen (Mitarbeiter, Mitpatienten, Besucher)
-
Kontaminationen (mikrobielle Verunreinigungen) oder Keimreservoire der Umwelt ( ▶ Tab. 41.2 ).
Merke
Keineswegs ist der gesamte Mensch „infektiös“, sondern Mikroben sind in bestimmten Organgebieten und Körpermaterialien enthalten, die von Mensch zu Mensch oder über Gegenstände, d.h. auf realen Übertragungswegen, weitergegeben werden.
|
Krankenhausinfektion |
Infektionsquelle und Übertragungsweg |
|
Harnwegsinfekt |
|
|
Pneumonie |
|
|
postoperative Infektion im Operationsgebiet |
|
|
Bakteriämie, Sepsis |
|
Übertragungswege Prinzipiell werden verschiedene Transmissionswege unterschieden ( ▶ Tab. 41.3 ). So werden Infektionen übertragen durch (Wendt 2015):
-
Kontakt (direkt oder indirekt)
-
große Tröpfchen
-
Aerosole (aerogen)
-
parenterale Exposition (Einwirkung)
|
Übertragung durch Kontakt |
Übertragung durch Aerosole (aerogen) |
parenterale Übertragung |
|||
|
direkter Kontakt |
indirekter Kontakt |
große Tröpfchen (> 5 µm) |
Tröpfchenkerne (< 5 µm) |
||
|
⊗ |
⊗ |
||||
|
Hepatitis A |
⊗ |
⊗ |
|||
|
⊗ |
⊗ |
⊗ |
|||
|
⊗ |
⊗ |
||||
|
⊗ |
⊗ |
||||
|
⊗ |
⊗ |
||||
|
⊗ |
|||||
|
⊗ |
⊗ |
⊗ |
|||
|
⊗ |
|||||
|
⊗ |
⊗ |
⊗ |
|||
|
⊗ |
|||||
|
⊗ |
|||||
|
nicht von Mensch zu Mensch |
|||||
|
⊗ |
⊗ |
||||
|
⊗ |
|||||
|
⊗ |
⊗ |
||||
|
⊗ |
|||||
|
⊗ |
⊗ |
||||
|
⊗ |
⊗ |
⊗ |
|||
|
⊗ |
|||||
41.1.1.1 Kontaktübertragung
Direkter Kontakt Der Erreger wird von infizierten oder kolonisierten Menschen direkt auf einen „Empfänger“ übertragen (Berührung). Die direkte Kontaktübertragung ist für Mikroben sehr viel effektiver als die indirekte Kontaktübertragung. Beispiele in der Patientenbetreuung:
-
Übertragung von Hautpilzen (Dermatophyten) in kleine Hautläsionen der Hände und Unterarme bei pflegerischer Arbeit
-
Übertragung von Scabies (Krätze) auf die Haut von Pflegenden während der Körperpflege eines Patienten
Sonderform: Tröpfchenübertragung Bei dieser Sonderform der Kontaktübertragung (Wendt 2015) werden die Mikroben direkt aus dem Respirationstrakt einer Person durch die Luft auf empfindliche Schleimhautareale einer anderen Person geschleudert. Sie müssen direkt eingeatmet werden oder eine Schleimhaut erreichen. Dies erfolgt meist beim Sprechen, Niesen, Husten oder Erbrechen. Solche sog. „Face-to-face-Kontakte“ sind in der Pflege häufig, aber auch bei therapeutischen Maßnahmen wie einer Bronchoskopie, endotrachealem Absaugen oder einer Atemtherapie werden Tröpfchen respiratorischen Sekrets ausgestoßen. Sie überwinden nur kurze Strecken (max. 2 m), da die Tröpfchen aufgrund ihrer Größe (> 5 μm) rasch sedimentieren. Beispiele für Tröpfchenübertragungen sind:
-
▶ Respiratory-syncytial-Virus-(Atemwegs)-Infektion des Säuglings sowie immunsupprimierter Erwachsener
-
Influenzaviren (Grippeerkrankung)
Indirekter Kontakt Bei dem häufigsten Übertragungsweg nosokomialer Infektionen, der indirekten Übertragung, werden Keime über kontaminierte Gegenstände übertragen. So wurden entweder die Gegenstände nach Benutzung bei einem Patienten nicht oder unzureichend aufbereitet, z.B. das Bronchoskop oder das Stethoskop. Möglich ist aber auch die Weitergabe der Keime durch indirekten Kontakt des kontaminierten Gegenstandes oder der Oberfläche mit einer empfänglichen Person. Durch die Hände oder durch ständig getragene, kontaminierte Schutzhandschuhe der Mitarbeiter werden am ehesten Mikroorganismen durch indirekte Kontaktübertragung weitergegeben.
Merke
Die häufigste Übertragung von Mikroben erfolgt durch Kontakt mit (nicht desinfizierten) Händen und Schutzhandschuhen. Die Händehygiene gehört daher zu den wichtigsten Maßnahmen zur Verhütung von Infektionen. Sie dient sowohl dem Schutz der Patienten als auch dem Schutz der Mitarbeiter (Basishygiene).
Weitere Beispiele für die indirekte Kontaktübertragung:
-
Der Mitarbeiter überträgt seine passagere MRSA-Kontamination der Nase durch ständige, unbewusste ▶ Hand-Gesichts-Haar-Kontakte in die Wunde eines Patienten.
-
Die Kaffee- und Tee-Bar der Abteilung steht im Verdacht, nach Kontamination der Thermosbehälter und Tassen durch verschiedene Patienten Noro-Viren auf der Station zu verbreiten.
41.1.1.2 Übertragung durch Aerosole (aerogen)
Infektionen können auch über kleinste Tröpfchenkerne übertragen werden, vorausgesetzt die Mikroben können über längere Zeit infektiös bleiben. Als sehr kleine (< 5 μm), sehr leichte und in relativ stabiler Dispersion (Verteilung) befindliche infektiöse Mikropartikel (Tröpfchenkerne) umgehen sie wichtige physiologische und immunologische Barrieren, z.B. Bakterien der ▶ Lungen-Tuberkulose sowie Viren der ▶ Windpocken.
41.1.1.3 Parenterale Übertragung
Der Erreger gelangt über die nicht intakte Haut oder Schleimhaut bzw. durch Injektion oder Punktion in den Körper. Beispiele:
-
Hepatitis-B-haltiges Blut eines Patienten spritzt in das ungeschützte Auge eines Mitarbeiters.
-
OP-Mitarbeiter verletzt sich an Skalpell.
41.1.1.4 Mikroben aus der Umwelt
Die Übertragung von Mikroorganismen, die in der Umwelt außerhalb des menschlichen Körpers ihr natürliches Reservoir haben, ist seltener als die Infektionsübertragung durch Kontakt oder Tröpfchen. Beispiel ist die ▶ Legionellenpneumonie. Die Infektion erfolgt durch Einatmen bakterienhaltigen Wassers (Bioaerosol), entweder als
-
Inhalation (z.B. durch eine kontaminierte Warmwasserleitung beim Duschen, durch Luftbefeuchter, Kühltürme, Klimaanlagen oder Whirlpool) oder als
-
Aspiration legionellenhaltigen Wassers in die Lungen.
So führte z.B. 2013 die erhebliche Belastung der Rückkühlanlage einer Brauerei in Warstein und eines Abwasservorbehandlungsbeckens mit Legionellen zum bisher größten Legionellenausbruch mit mehr als 160 Pneumonien in Deutschland (Siegmund-Schultze 2013; Ewig 2016).
Tierische Träger können aktive Krankheitsüberträger sein, z.B. Zecken (Frühsommer-Meningoenzephalitis (FSME), Mücken (Malaria).
41.1.2 Eintrittspforte, Mikrobiom und Infektionsempfänger
Natürliche Eintrittspforten sind z.B. Mund, Nase und Harnröhre. Durch Aspiration, Verschlucken oder Einatmen gelangt das Pathogen in den Körper. Künstliche Eintrittspforten, die erst im Krankenhaus entstehen, sind z.B. Einstichstellen von Injektionen, OP-Schnitte usw.
Als „Mikrobiom“ wird die Gesamtheit aller den Menschen besiedelnden Mikroorganismen bezeichnet. Normalerweise lebt der Mensch mit ihnen in Symbiose (in einer für beide vorteilhaften Wechselbeziehung). Nahezu die gesamte Oberfläche des menschlichen Körpers ist mikrobiell besiedelt („Hautflora“). Sie stimuliert die Immunabwehr und dient als „Platzhalter“ gegen aggressive Fremdkeime. Auch beeinflusst das mikrobielle Ökosystem des Darms unseren Stoffwechsel und das Immunsystem. Bei der Therapieform einer fäkalen Mikrobiota-Transplantation (Stuhltransplantation) wird bei Clostridium-difficile-Infektionen mit antibiotikaassoziierter Diarrhö die Wiederherstellung des physiologischen Mikrobioms angestrebt (Ehlermann 2016).
Als „Infektionsempfänger“ bezeichnet man den Wirt, in dem Mikroben die Entstehung einer Infektion unterstützen. Die Empfänglichkeit für Infektionen und ihre Intensität wird u.a. von der Lebenssituation des Empfängers beeinflusst.
Arzneimittel im Fokus
Antiinfektiva
Antiinfektiva umfassen eine Gruppe von Arzneistoffen, zu der Antibiotika, Chemotherapeutika, Antimykotika, Antiparasitika und Virostatika gehören. Sie werden zur Behandlung von Infektionen eingesetzt.
Durch den in der Medizin weltweit verbreiteten und oft unreflektierten Einsatz der Antiinfektiva (trotz gesetzlicher Verbote auch in der industriellen Tiermast) entwickeln sich resistente Mikroben, d.h., diese Medikamente werden gegen sie unwirksam. Seit dem Auftreten dieser multiresistenten Keime im Krankenhaus sind Patienten, unabhängig von ihrer Primärerkrankung, der zusätzlichen Gefahr einer ▶ nosokomialen Infektion mit diesen Mikroben ausgesetzt.
41.1.3 Schutzmaßnahmen (Prävention)
Um Übertragungswege zu unterbrechen, müssen rationale, d.h. sinnvolle Hygienemaßnahmen angewandt werden. Hierzu gehören:
-
Maßnahmen der Basishygiene siehe ▶ Tab. 41.4 ; sowie
-
Prävention gegen die
-
aerogene Übertragung
-
Tröpfchenübertragung
-
Kontaktübertragung
-
parenteralen Übertragung
-
|
Welche Maßnahme? |
Wann wird die Maßnahme ergriffen? |
|
Händedesinfektion |
vor jeder möglichen Übertragung von Infektionserregern auf Patienten durch die Hände eines Mitarbeiters und nach jeder potenziellen Kontamination der Hände (mit oder ohne Handschuhe) |
|
Schutzhandschuhe |
kurzfristig und gezielt getragen vor Kontakt mit Körperflüssigkeiten, Schleimhäuten, defekter Haut |
|
Mund-Nasen-Schutz, Augenschutz |
|
|
Vorbindeschürze |
bei zu erwartender Kontamination der Kleidung |
|
Desinfektion (Flächen, Gegenstände) |
vor aseptischen Tätigkeiten, nach Kontamination der patientennahen Umgebung (durch aktiven Mitarbeiter selbst) |
|
Schutz vor Schnitt- und Stichverletzungen |
beim Umgang mit spitzen oder scharfen Gegenständen |
Um unsinnige Maßnahmen zu vermeiden, werden individuell für betroffene Patienten Absprachen mit den Hygieneexperten getroffen.
Merke
Eine solide hygienische Grundversorgung aller Patienten von Anfang der stationären/ambulanten Behandlung an reduziert erheblich die mögliche Keimübertragung von Infektionserkrankungen.
Patientenindividuelle, krankheitsspezifische Isolierung Bei einer Isolierung werden sinnvolle Hygienemaßnahmen kombiniert, die orientiert sind an detaillierten Informationen über die Krankheit und ihre Übertragungswege sowie die Kooperationsfähigkeit und den Grad der individuellen Hygiene des Patienten.
Unabhängig von der Isolierung sind routinemäßig bei allen Patienten Maßnahmen der Basishygiene anzuwenden.
▶ Tab. 41.5 fasst die zusätzlichen Maßnahmen der patientenindividuellen, krankheitsspezifischen Isolierung zusammen.
|
Welcher Übertragungsweg? |
Welche Maßnahme wird ergriffen? |
|
Luft (aerogen), z.B.
|
|
|
Tröpfchen, z.B.
|
|
|
Kontakt, z.B.
|
|
|
Parenteral, z.B.
|
|
41.2 Infektionserkrankungen bei Kindern
41.2.1 Einleitung
In keinem anderen Lebensalter treten Infektionserkrankungen in einer solchen Vielfalt, Häufigkeit und mit solch akuten Verläufen auf wie im frühen Kindesalter bis zur Einschulung. Während noch bis ins beginnende 19. Jahrhundert hinein Infektionskrankheiten die häufigste Ursache für das frühe Versterben von Kindern waren, sind an deren Stelle bei insgesamt dramatisch gesunkener Mortalität (Sterblichkeit) im Kindesalter heute plötzlicher Kindstod, Verkehrsunfälle und Krebserkrankungen getreten.
Weit mehr als die Hälfte aller ungeplanten Arztbesuche von Kindern erfolgen wegen Infektionserkrankungen. Sie sind nahezu immer begleitet von mehr oder weniger stark ausgeprägtem Fieber. Letztlich ist es wiederum häufig die gemessene Höhe des Fiebers, die den Eltern Angst macht und zur ärztlichen Konsultation führt, und weniger die zwar vorhandene, aber meist nicht besorgniserregende subjektive Beeinträchtigung des Kindes.
Diese Angst vor Fieber ist jedoch bei ansonsten gesunden Kindern mit normalen Infekten vollkommen unbegründet. Vielmehr ist aus vielen Studien und Beobachtungen bekannt, dass das Senken von Fieber bei Infektionserkrankungen deren Verlauf in aller Regel eher negativ beeinflusst, s. Kapitel „ ▶ ATL Körpertemperatur regulieren“. Neben typischen, je nach Lokalisation der Infektion organspezifischen Symptomen (z.B. Husten, Schluckbeschwerden, Schnupfen) sind die fieberhaften Infektionserkrankungen im Kindesalter oft von Allgemeinsymptomen wie Abgeschlagenheit, Inappetenz, ggf. organbezogenen Schmerzen (z.B. Ohrenschmerzen) und nicht selten auch von einem je nach Erreger typischen Hautausschlag gekennzeichnet.
Sinn und Zweck aller therapeutischer und pflegerischer Maßnahmen bei der Behandlung von Infektionskrankheiten im Kindesalter ist daher in erster Linie die individuelle kind- und menschengemäße Begleitung in der aktuellen Situation – und dies vor allem auch unter dem Gesichtspunkt der kindlichen Entwicklung und der Entfaltung seiner Biografie.
41.3 So genannte „Kinderkrankheiten“
41.3.1 Einführung
Kinderkrankheiten unterscheiden sich grundsätzlich von den anderen, oft sogar schwerwiegenderen Erkrankungen im Kindesalter wie Bronchitis, Pneumonie, Otitis, Tonsillitis, Gastroenteritis usw. Sie werden durch einen bestimmten Erreger verursacht, haben i. d. R. einen zeitlich exakt definierten Verlauf, gehen meist mit einem sehr typischen Hautausschlag einher und hinterlassen, nachdem sie überwunden oder „durchgemacht“ sind, eine lebenslange Immunität, d.h., sie treten im Leben eines Menschen (mit wenigen Ausnahmen) nur ein einziges Mal auf.
Natürlich erworbene Immunität Konkret bedeutet dies, dass das Kind sich durch das Überwinden einzelner Kinderkrankheiten etwas erwirbt, es hat etwas davon: eine Immunität gegen diese Erkrankung. So wird es als Jugendlicher oder Erwachsener bei nochmaligem Kontakt z.B. mit dem Maservirus nicht erneut erkranken und ist somit vor möglicherweise schwerwiegenden Komplikationen einer zur falschen Zeit auftretenden Erkrankung geschützt. Es sei die These gewagt, dass das Durchmachen der typischen Kinderkrankheiten letztlich der kindlichen Entwicklung nutzt, indem es langfristige Gesundheit erst ermöglicht. So wird aus dem vermeintlichen „Opfer“ („die Krankheit XY hat mich erwischt“) ein „Täter“, der Gesundheit und Krankheit aktiv gestaltet.
Die hier beschriebene Immunität lässt sich für eine definierte Anzahl von Infektionserkrankungen auch durch Impfungen herstellen. Jedoch ist diese oft zeitlich begrenzt und muss regelmäßig „aufgefrischt“ werden und sie ist nicht immer so sicher wie die natürlich erworbene Immunität.
41.3.2 Masern
41.3.2.1 Medizinischer Überblick
Masern-Erkrankungen sind in ihrer absoluten Häufigkeit in der Bundesrepublik Deutschland in den vergangenen 20 Jahren nahezu bedeutungslos geworden. Die letzte große Epidemie mit geschätzten 30.000 bis 100.000 Erkrankten (dabei 10 Todesfälle) in Deutschland war im Jahr 1996. Die absolute Zahl der an das Robert Koch-Institut gemeldeten Masernfälle der letzten 15 Jahre zeigt ▶ Tab. 41.6 (RKI 2015).
|
Jahr |
Anzahl der Masern-Fälle |
Inzidenz pro 1 Mill. Einwohner |
|
2001 |
6139 |
75,0 |
|
2002 |
4564 |
55,8 |
|
2003 |
766 |
9,4 |
|
2004 |
123 |
1,5 |
|
2005 |
781 |
9,5 |
|
2006 |
2308 |
28,2 |
|
2007 |
570 |
7,0 |
|
2008 |
914 |
11,2 |
|
2009 |
568 |
6,9 |
|
2010 |
780 |
9,5 |
|
2011 |
1608 |
19,7 |
|
2012 |
165 |
2,0 |
|
2013 |
1769 |
21,6 |
|
2014 |
444 |
5,4 |
|
2015 |
586 (bis 15.2.2015) |
7,2 (bis 15.2.2015) |
|
Quelle: Robert Koch-Institut, Epidemiologisches Bulletin Nr. 10 vom 9. März 2015 |
||
Betrachtet man die betroffenen Altersgruppen, so zeigt sich, dass in Deutschland aus der ursprünglich typischen Kinderkrankheit, die im Kleinkindalter „durchgemacht“ wurde, eine Erkrankung geworden ist, die deutlich häufiger jenseits des Kleinkindalters bis hinein ins Erwachsenenalter mit dann auch höherer Komplikationsrate auftritt ( ▶ Abb. 41.2):
Masern.
Abb. 41.2 Anzahl der übermittelten Masern-Fällen pro Jahr in Deutschland von 2001 bis 2015 (Stand: 15.02.2015).
(Abb. nach: RKI 2015)
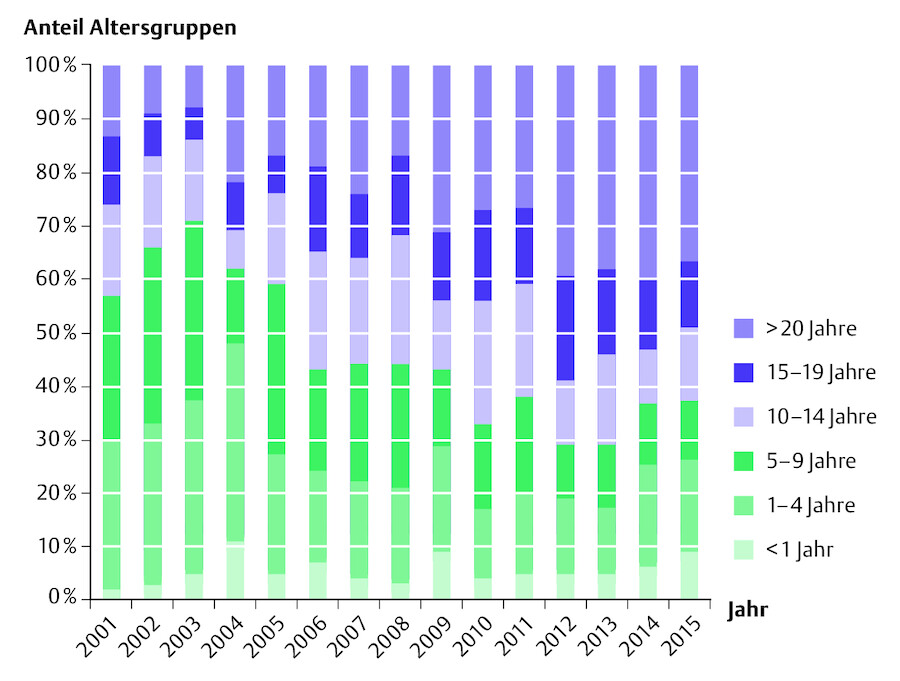
Obwohl die Sterblichkeit bei Masern in Deutschland extrem gering ist (verlässliche Zahlen existieren nicht; für 2014 wird von einem Todesfall in Deutschland berichtet) wird das Auftreten einzelner Masernfälle oder gar das lokal/regional gehäufte Auftreten von Masernfällen medial sehr schnell aufgegriffen.
Definition
Das Masernvirus gehört zur Gruppe der Paramyxoviren. Es gibt derzeit mehr als 20 bekannte Genotypen, die sich in ihrer Virulenz aber nicht unterscheiden.
Der klinische Verdacht auf Masern, der Erregernachweis, die Erkrankung und Tod durch Masern sind laut Infektionsschutzgesetz (IfSG) in Deutschland meldepflichtig.
Übertragungsweg
Masernviren werden bei hoher Kontagiosität (Ansteckungsfähigkeit) mit einem Manifestationsindex (gibt anhand einer Maßzahl für die Wahrscheinlichkeit an, mit welcher eine mit einem Erreger infizierte Person manifest, also erkennbar erkrankt) von nahezu 100% durch Kontakt sowie aerogen über ▶ Tröpfchenkerne von Mensch zu Mensch übertragen. Der Mensch ist das einzige Erregerreservoir. Die höchste Ansteckungsfähigkeit besteht im sog. Prodromalstadium (3–5 Tage vor Ausbruch des typischen Hautausschlages). Etwa 4 Tage nach Ausbruch des Hautausschlages endet die Ansteckungsfähigkeit. Die Inkubationszeit beträgt 10–11 Tage.
Symptome
Der Krankheitsverlauf bei Masern ist sehr charakteristisch mit einem meist 2-gipfligen Verlauf. Im Prodromalstadium (2–3 Tage) bestehen grippeähnliche Symptome wie Schnupfen, Husten, mäßiges Fieber und oft schon Konjunktivitis. In einer kurzen Erholungsphase kann das Fieber verschwinden, die Symptome sich bessern und an der Wangenschleimhaut treten die typischen, aber oft nur wenige Stunden sichtbaren kalkspritzerartigen Koplik-Flecken auf.
Am 4. bis 5. Krankheitstag tritt dann erneut hohes Fieber und ein schweres Krankheitsgefühl auf. Es entwickelt sich ein feinfleckig-konfluierender Hautausschlag, der hinter den Ohren beginnt, sich dann von oben nach unten über den ganzen Körper ausbreitet und nach 3–5 Tagen in der gleichen Reihenfolge wieder verschwindet.
Begleiterkrankungen Typische Begleiterkrankungen von Masern sind eine Mittelohrentzündung, seltener eine Lungenentzündung. Meningitis und Enzephalitis treten deutlich seltener auf (im Jahr 2014 in Deutschland bei 2 (Erwachsenen!) von gemeldeten 444 Masernfällen). Eine sehr seltene, aber immer tödlich verlaufende Spätkomplikation von Masern ist die Jahre nach der Masernerkrankung auftretende subakut sklerosierende Panenzephalitis (SSPE). Sie tritt mit einer Häufigkeit von 1–10 Fällen pro 100.000 Masernerkrankungen auf (Bellini et al. 2005, RKI 2006).
Diagnostik
Aufgrund des charakteristischen Krankheitsverlaufes und des spezifischen Exanthems kann die Diagnose i. d. R. klinisch gestellt werden, vor allem, wenn die Erkrankung epidemisch auftritt. In unklaren Fällen und unter infektionsepidemiologischen Gesichtspunkten ist eine serologische Diagnostik durch den Nachweis von Masern-spezifischem IgM mittels Enzym-Immunoassay (ELISA) wünschenswert. Bei Geimpften wird ein 4-facher Titeranstieg im IgG-ELISA als diagnosesichernd angesehen. In fraglichen Fällen kann auch der direkte Virusnachweis mittels PCR aus Körperflüssigkeiten oder -gewebe angestrebt werden.
Therapie
Eine spezifische Therapie des Maservirus gibt es nicht. Antibiotika sind nur bei Nachweis einer bakteriellen komplizierenden Infektion indiziert, keinesfalls „prophylaktisch“ zur Vermeidung von Komplikationen!
41.3.2.2 Pflege- und Behandlungsplan
Isolierungsmaßnahmen
An Masern Erkrankte sowie nachweislich mit Masern Inkubierte sind mit Diagnosestellung bzw. 7 Tage nach Beginn der Inkubation bis zum 5. Tag nach Ausbruch des Exanthems zu isolieren, d.h., Kontakt mit Menschen ohne ausreichenden Antikörperschutz (durch zuvor durchgemachte Erkrankung oder ausreichende Impfung) muss vermieden werden. Im Haushalt und in der Klinik sind die Maßnahmen der Basishygiene in besonderem Maße zu beachten (Wendt et al. 2015).
Pflegerische Maßnahmen
Die therapeutischen Maßnahmen sind symptomorientiert und richten sich nach den subjektiven Beschwerden des kranken Kindes. Im Vordergrund steht beim meist fiebernden und abgeschlagenen Kind die Gabe von ausreichend oraler Flüssigkeitszufuhr, um eine infusionspflichtige Exsikkose zu vermeiden. Darüber hinaus können
-
schmerzlindernde Maßnahmen bei Otitis (Analgetika, lokale äußere Anwendungen wie z.B. Zwiebelsäckchen auf die Ohren),
-
den Hustenreiz mildernde Maßnahmen wie z.B. die Einreibung von Brust und Thorax mit entkrampfenden ätherischen Ölen, wie z.B. Lavendelöl 3%, sowie
-
Brustwickel mit Senf- oder Ingwermehl den Krankheitsverlauf positiv beeinflussen und die Komplikationsrate senken. Siehe hierzu auch Kapitel „ ▶ ATL Körpertemperatur regulieren“ und Kapitel ▶ Pflege von Patienten mit Bronchiektasen.
Wichtig ist eine reizarme, ruhige Umgebung, in der das Kind sich erholen kann. Insbesondere digitale Medien sollten in dieser Zeit gemieden werden. Hingegen genießen es viele Kinder, wenn ihnen in einer solchen Krankheitsphase z.B. vorgelesen wird.
41.3.3 Mumps
41.3.3.1 Medizinischer Überblick
Definition
Das Mumpsvirus gehört zur Gruppe der Paramyxoviren. Es gibt nur einen Serotyp, aber 20 bekannte Genotypen, die sich in ihren biologischen Eigenschaften unterscheiden.
Der klinische Verdacht auf Mumps, der Erregernachweis, die Erkrankung und Tod durch Mumps sind laut Infektionsschutzgesetz (IfSG) in Deutschland meldepflichtig.
Übertragungsweg
Die Übertragung des Mumpsvirus erfolgt von Mensch zu Mensch über Tröpfcheninfektion. Der Mensch ist das einzige Erregerreservoir. Die Inkubationszeit beträgt 16–18 (bis 25) Tage. 2 Tage vor bis 3 Tage nach Beginn der Krankheitssymptome besteht Ansteckungsfähigkeit. Auch an Mumps Erkrankte ohne Krankheitszeichen können ansteckend sein.
Auch die Mumpserkrankung ist in Deutschland insgesamt selten geworden. Ähnlich wie bei den Masern findet auch hier eine deutliche Verschiebung der Erkrankungsfälle ins Jugendlichen- und Erwachsenenalter statt. Die Anzahl der Erkrankten in Deutschland liegt aktuell bei unter 1000 Erkrankten pro Jahr, von denen nur ein Drittel unter 20 Jahre alt sind (RKI 2013a).
Symptome
Während etwa ein Drittel aller Infizierten keine Krankheitssymptome entwickelt, erkranken die anderen beiden Drittel mit sehr variabel ausgeprägten klinischen Erkrankungszeichen. Die typische Mumpserkrankung beginnt mit hohem Fieber und starkem Krankheitsgefühl. Die Ohrspeicheldrüsen sind entzündet (Parotitis), verdickt und schmerzhaft, was vor allem das Kauen/Schlucken schmerzhaft macht. Bei bis zu 40% der Erkrankten ist auch die Bauchspeicheldrüse entzündet, was zu (kolikartigen) Bauchschmerzen führen kann. Eine Begleitmeningitis (oft schon vor der Parotitis!) ist nicht selten, aber nahezu immer folgenlos und flüchtig, während die sehr seltene Mumps-Enzephalitis in mehr als der Hälfte der Fälle mit bleibenden Schädigungen einhergeht. Gefürchtet ist die Hodenentzündung (Orchitis) bei Jungen jenseits der Pubertät, die nicht selten zu verminderter Zeugungsfähigkeit führt.
Diagnostik
Die Diagnose kann bei typischen Symptomen meist klinisch gestellt werden. In Zweifelsfällen und vor allem bei Geimpften mit Mumps-Symptomen empfiehlt sich eine serologische Diagnostik mittels ELISA zum Nachweis Mumps-spezifischer IgM-Antikörper ( ▶ Abb. 41.11), welche nach wenigen Tagen nachweisbar sind und über Wochen nachweisbar bleiben.
Geimpfte entwickeln trotz Mumps-Erkrankung oft keine IgM-Antikörper. Bei dieser Personengruppe empfiehlt sich neben einer repetitiven Serologie (IgG-Titer-Anstieg) eine RT-PCR (eine Methode der Polymerase-Ketten-Reaktion, die die Quantifizierung der gewonnenen DNA ermöglicht) aus Urin, Rachenabstrich oder Zahntaschenflüssigkeit.
Therapie
Eine spezifische antivirale Therapie gegen Mumps ist nicht verfügbar. Die Therapie der Mumpserkrankung ist ausschließlich symptomatisch. Bei starken Schmerzen können Analgetika (bei Kindern bevorzugt Ibuprofen) und – sofern eine Fiebersenkung klinisch notwendig ist – Antipyretika (auch hier bei Kindern bevorzugt Ibuprofen) gegeben werden.
41.3.3.2 Pflege- und Behandlungsplan
Isolierungsmaßnahmen
An Mumps Erkrankte bzw. Patienten mit Verdacht auf Mumps-Erkrankung müssen von den übrigen Patienten getrennt untergebracht werden. Eine gemeinsame Unterbringung mit anderen an Mumps Erkrankten ist möglich. Im Haushalt und in der Klinik sind die Maßnahmen der ▶ Basishygiene in besonderem Maße zu beachten.
Pflegerische Maßnahmen
Neben der Gabe von Analgetika bei schmerzhafter Parotitis oder Pankreatitis ist vor allem bei Kindern mit deutlichem Krankheitsgefühl Bettruhe und eine reizarme Umgebung hilfreich. Die traditionelle Hausmedizin kennt verschiedene äußere Anwendungen bei schmerzhafter Parotitis wie z.B. ▶ Quarkwickel oder Umschläge mit Archangelika-Salbe. Bei Bauchschmerzen im Rahmen einer Begleitpankreatitis können Bauchwickel z.B. mit Oxalis (Sauerklee) hilfreich sein. Eine Orchitis wird mit Hochlagerung und Kühlung des Hodens behandelt. Unterstützend können hier Umschläge mit Retterspitz-Flüssigkeit gemacht werden.
41.3.4 Röteln
41.3.4.1 Medizinischer Überblick
Definition
Das Rötelnvirus gehört zur Gruppe der Togaviren. Es gibt nur einen Serotyp. Der Mensch ist der einzige natürliche Wirt für das Virus.
Der klinische Verdacht auf Röteln, der Erregernachweis, die Erkrankung und Tod durch Röteln sind laut Infektionsschutzgesetz (IfSG) in Deutschland meldepflichtig.
Übertragungsweg
Die Übertragung des gering kontagiösen (ansteckungsfähigen) Rötelnvirus erfolgt von Mensch zu Mensch über Tröpfcheninfektion. Das Virus vermehrt sich vorwiegend im lymphatischen Gewebe und führt zu einer hohen Virämie (Vorhandensein von Viren im Blut). Darüber hinaus wird es bei Schwangeren auch diaplazentar auf das Kind übertragen. Der Mensch ist das einzige Erregerreservoir. Die Inkubationszeit beträgt 14–21 Tage. Ansteckungsfähigkeit besteht bereits eine Woche vor Ausbruch des Hautausschlags und hält bis zu eine Woche nach Beginn des Hautausschlags an (RKI 2013b).
Symptome
Die häufigsten Krankheitssymptome bei Röteln sind der am Gesicht (inklusive der Mundpartie!), am Rumpf und an den Extremitäten auftretende mittelfleckige, leicht papulöse und meist nicht konfluierende (nicht konfluierend = einzeln stehende Pöckchen), oft nur wenige Tage andauernde Hautausschlag sowie typische beidseitige Lymphknotenschwellungen am Hals, am Nacken und hinter den Ohren („Röteln diagnostiziert man im Dunkeln“). Fieber kann mit auftreten. Der Allgemeinzustand ist meist wenig beeinträchtigt, Komplikationen treten ausgesprochen selten auf.
Konnatale Röteln Erkrankt eine Schwangere in den ersten 3 Schwangerschaftsmonaten an Röteln, besteht das Risiko der Infektion des Fetus (je früher die Schwangerschaft desto höher das Risiko), welche in wenigen Fällen zum Abort und in der Mehrzahl der konnatalen Infektionen zu Fehlbildungen des ZNS, Dystrophie, Katarakt, Retinopathie u.a. führt.
Merke
Röteln sind für Schwangere gefährlich, besonders gefürchtet ist die Embryofetopathie.
Diagnostik
Da das klinische Bild eher flüchtig und oft nicht sehr eindeutig ist, empfiehlt sich bei Unklarheiten eine serologische Diagnostik mit Nachweis von spezifischen IgM-Antikörpern im ELISA.
Konnatale Röteln werden (sofern nicht bereits pränatal geschehen) mittels Erregernachweis mit PCR diagnostiziert.
Therapie
Eine kausale (antivirale) Therapie ist nicht möglich. Symptomatische Maßnahmen können im Einzelfall hilfreich sein, sind aber bei oft geringem subjektivem Krankheitsgefühl meist entbehrlich.
Kinder mit konnatalen Röteln hingegen benötigen eine intensive und langfristige Betreuung.
41.3.4.2 Pflege- und Behandlungsplan
Isolierungsmaßnahmen
Eine Isolierung von an Röteln erkrankten Patienten im Krankenhaus ist nicht zwingend erforderlich. Neben den Basishygienemaßnahmen empfiehlt sich das Tragen von Einmalhandschuhen bei engem Schleimhautkontakt sowie das Tragen eines Mund-Nasen-Schutzes bei engem Kontakt.
Pflegerische Maßnahmen
Bei Fieber helfen unterstützende Maßnahmen wie sie im Kapitel. ▶ „Masern“ beschrieben sind. Selten sind analgetische Maßnahmen bei Komplikationen erforderlich.
41.3.5 Windpocken
41.3.5.1 Medizinischer Überblick
Definition
Das Varizella-Zoster-Virus (VZV) gehört zur Familie der humanpathogenen Herpesviren. Die Erstinfektion mit dem VZV führt zu einem schubweise auftretenden vesikulären generalisierten Exanthem an Haut und Schleimhäuten, den sog. Windpocken (Varizellen).
Das VZV persistiert nach Abklingen der akuten Windpockenerkrankung in den Spinal- und Hirnnervenganglien und kann durch Reaktivierung im späteren Leben zur Gürtelrose (Zoster) führen. Das Erregerreservoir für das VZV ist ausschließlich der Mensch.
Von den gewöhnlichen Windpocken abzugrenzen ist das fetale Varizellensyndrom, welches bei ca. 2% der Kinder von Schwangeren, welche in den ersten 20 Schwangerschaftswochen an Windpocken erkranken, auftritt. Diese ist charakterisiert durch diverse Fehlbildungen an Haut, ZNS, Augen, Skelett- und Muskelsystem.
Windpocken in den ersten 10–12 Lebenstagen werden als neonatale Varizellen klassifiziert und können von leichten Hauteffloreszenzen (typische Wasserbläschen) bis hin zu lebensbedrohlichen Organmanifestationen (z.B. Pneumonie) unterschiedliche Krankheitssymptome hervorrufen. Sie können bei etwa einem Drittel der Kinder von Müttern, die 5 Tage vor bis 2 Tage nach der Geburt erstmals an Varizellen erkranken, auftreten und sind bei Reifgeborenen i.d.R. mit einer guten Prognose assoziiert (Borte 2013).
Der klinische Verdacht auf Windpocken, der Erregernachweis, die Erkrankung an und der Tod durch Windpocken sind laut Infektionsschutzgesetz (IfSG) in Deutschland meldepflichtig.
Übertragungsweg
Die Übertragung des hochkontagiösen VZV erfolgt aerogen durch virushaltige Tröpfchenkerne oder durch direkten, bei gesunden Menschen über mehrere Minuten dauernden Kontakt mit infizierter Haut, (Gesicht-zu-Gesicht-Kontakt). Infektiösität besteht bereits 1–2 Tage vor Ausbruch der Effloreszenzen. In Haushalten geht man von einer über 90%igen Übertragungsrate aus. Ein direkter Kontakt mit Zoster-Effloreszenzen kann ebenfalls zu einer Windpockenerkrankung führen. Immunsupprimierte haben ein deutlich höheres Übertragungsrisiko!
Symptome
Windpocken treten am häufigsten im Kleinkindalter auf (Seroprävalenz bei den 6–7-Jährigen in Deutschland aktuell 88%, RKI 2016b). Nach einer Inkubationszeit von 14–16 Tagen (mit Schwankungen von 10–21 Tagen!) treten meist ohne klinische Vorzeichen innerhalb weniger Stunden oft juckende, zunächst rote Effloreszenzen auf, die sich rasch in Papeln, Bläschen und Pusteln verwandeln. Schließlich verkrusten die Pusteln. Häufigste Lokalisation der Effloreszenzen sind der behaarte Kopf, Rumpf und Schleimhäute. Da meist verschiedene Stadien der Effloreszenzen nebeneinander bestehen, spricht man vom Bild des „Sternenhimmels“. Gelegentlich kann mehr oder weniger ausgeprägtes Fieber begleitend auftreten. Der Allgemeinzustand der Kinder ist selten relevant beeinträchtigt. Gelegentlich tritt eine flüchtige und bei ansonsten Gesunden nahezu immer folgenlose Entzündung des Kleinhirns (Zerebellitis) auf. Selten kommt es bei immunkompromitierten Patienten zu Komplikationen wie Enzephalitis, zerebraler Vaskulitis, Pneumonie, Hepatitis und Arthritis.
Diagnostik
Die Diagnose wird i.d.R. anhand der typischen Hautveränderungen klinisch gestellt. In begründeten Einzelfällen kann ein Erregernachweis mittels PCR oder ein Virusantigen-Direktnachweis aus Effloreszenzenflüssigkeit geführt werden. Mit dem ELISA können spezifische Antikörper (IgM und IgG) nachgewiesen werden.
Therapie
Die Therapie beschränkt sich i.d.R. auf eine ggf. notwendige symptomatische Therapie des manchmal sehr quälenden Juckreiz mit lokal aufgetragenen Gerbstoffen (z.B. Tannosynt). Bei klinischen Zeichen einer bakteriellen Superinfektion der Hauteffloreszenzen kann eine topische Behandlung mit Thymiantee-Bädern hilfreich sein. Lediglich bei Risikopatienten und ungewöhnlich schweren VZV-Verläufen ist eine intravenöse virostatische Therapie mit Aciclovir erforderlich.
Bei gegebener Indikation („Risikopatienten“) kann eine innerhalb von 96 Stunden nach Exposition durchgeführte passive Immunisierung mit VZV-Immunglobulin die Wahrscheinlichkeit des Auftretens einer Windpockenerkrankung deutlich reduzieren bzw. den Verlauf abschwächen.
Eine aktive Impfung mit Lebendimpfstoff steht zur Verfügung und wird von der Ständigen Impfkommission (StIKo) für Kinder ab dem 11. Lebensmonat mit 2 Grundimmunisierungen empfohlen.
41.3.5.2 Pflege- und Behandlungsplan
Isolierungsmaßnahmen
Im häuslichen Umfeld sind i.d.R. keine speziellen Maßnahmen für Patienten und Kontaktpersonen erforderlich. Unter stationären Bedingungen müssen jedoch alle Patienten vom 8. bis 21. Tag nach der Exposition sowie Patienten mit Windpocken in einem Einzelzimmer mit Vorraum untergebracht werden. Beim Betreten des Patientenzimmers müssen Einmalkittel, Einmalhandschuhe und eine Atemschutzmaske FFP2 getragen werden (RKI 2016c). Infektiösität besteht, solange frische Bläschen vorhanden sind.
Neugeborene von Müttern mit Varizellen müssen unabhängig davon, ob sie Krankheitssymptome zeigen, in der Klinik bis 28 Tage nach Geburt isoliert werden. Mutter und Kind sollen nicht getrennt werden. Stillen wird empfohlen. Kinder mit einem neonatalen Varizellensyndrom hingegen müssen nicht isoliert werden.
Pflegerische Maßnahmen
Hilfreich ist in der Phase der Erkrankung eine reizarme Umgebung. Spezifische Maßnahmen sind meist nicht erforderlich. Im Einzelfall können bei hoch fiebernden, abgeschlagenen Kindern äußere Anwendungen wie ▶ Wadenwickel oder selten auch mal fiebersenkende Mittel erforderlich werden.
41.3.6 Keuchhusten
41.3.6.1 Medizinischer Überblick
Definition
Keuchhusten wird durch eine Infektion mit Bordetella pertussis, einem bekapselten, aeroben gramnegativen Stäbchenbakterium verursacht. B. pertussis weist eine Vielzahl von Virulenzfaktoren wie z.B. die Bildung von verschiedenen Toxinen und Adhäsinen auf. Allerdings können auch andere Erreger wie B. parapertussis, B. bronchiseptica, Mycoplasma pneumoniae, Chlamydia pneumoniae, ▶ RSV und Adenoviren ein pertussiformes Krankheitsbild hervorrufen. Der Mensch ist das einzige Reservoir für B. pertussis.
Die Erkrankung tritt in Deutschland inzwischen vor allem bei geimpften Erwachsenen (nachlassender Impfschutz) und ungeschützten jungen Säuglingen ohne ausreichenden Nestschutz auf. So waren im Jahr 2015 von ca. 9000 gemeldeten Keuchhusten-Erkrankten 186 Kinder unter 1 Jahr und ca. 7000 Erkrankte älter als 15 Jahre (RKI 2016d).
Der klinische Verdacht auf Pertussis, der Erregernachweis, die Erkrankung und Tod durch Pertussis sind laut Infektionsschutzgesetz (IfSG) in Deutschland meldepflichtig.
Übertragungsweg
Die Übertragung des hoch kontagiösen Pertussis-Virus erfolgt durch Tröpfcheninfektion bei engem Kontakt (< 1m) mit einer infektiösen Person. Die Ansteckungsfähigkeit beginnt am Ende der Inkubationszeit, erreicht ihren Höhepunkt während der ersten beiden Wochen der Erkrankung und kann bis zu 3 Wochen nach Beginn des Stadium convulsivum (s.u.) andauern. Wird eine antibiotische Therapie durchgeführt (s.u.), verkürzt sich die Dauer der Ansteckungsfähigkeit auf etwa 5 Tage nach Beginn der Therapie. Die Inkubationszeit beträgt 9–10 Tage.
Symptome
Der Verlauf der typischen Keuchhustenerkrankung wird in 3 Stadien unterteilt.
-
Das Stadium catarrhale ist durch leichte Symptome eines oberen Luftweginfektes mit Schnupfen und Husten charakterisiert und dauert 1–2 Wochen.
-
Typisch für den Keuchhusten ist das daran anschließende 4–6 Wochen dauernde Stadium convulsivum mit anfallsartig auftretendem stakkatoartigem Husten, dem dann inspiratorisches Ziehen („Keuchen“) folgt. Die Hustenattacken treten gehäuft nachts auf und werden nicht selten von Würgen/Erbrechen von glasigem Schleim begleitet.
-
Die Hustenanfälle klingen dann schließlich im Stadium decrementi (3–4 Wochen) ab.
In der Regel haben keuchhustenerkrankte Kinder kein Fieber. Tritt dennoch Fieber auf, kann dies ein Hinweis auf eine eingetretene Komplikation (Pneumonie, Otitis) sein.
Abweichend vom typischen stadienhaften Verlauf bewirkt eine B.-pertussis-Infektion bei Neugeborenen und jungen Säuglingen (< 6 Monate) i.d.R. keine typischen Hustenanfälle, sondern teils lebensbedrohliche Apnoen.
Diagnostik
Bei begründetem Verdacht (Anamnese, klinisches Bild, fehlender Impfschutz) erfolgt die Diagnostik aus Nasen-/Rachensekret. Die direkte Erregeranzucht ist sehr störanfällig, weshalb sich im klinischen Alltag die PCR-Diagnostik durchgesetzt hat. Eine serologische Diagnostik ist nicht sinnvoll und dient lediglich in begründeten Einzelfällen der Kontrolle des Impferfolgs.
Therapie
Je früher eine antibiotische Behandlung mit Makroliden eingeleitet wird (am besten im Stadium catarrhale), desto eher verkürzt diese den Krankheitsverlauf. Ein späterer Beginn einer Antibiotika-Therapie hat auf den klinischen Verlauf häufig keinen relevanten Einfluss mehr. Lediglich die Ansteckungsfähigkeit wird rasch beseitigt. Der Beginn einer antibiotischen Therapie > 3 Wochen nach Krankheitsbeginn ist i.d.R. nicht sinnvoll.
Säuglinge unter 6 Monaten müssen bei begründetem Pertussis-Verdacht meist stationär aufgenommen und überwacht werden.
41.3.6.2 Pflege- und Behandlungsplan
Isolierungsmaßnahmen
Stationär behandelte Patienten mit Pertussis(verdacht) müssen bis zu 5 Tage nach Beginn einer antibiotischen Therapie isoliert werden, ggf. auch in Gruppenisolierung (z.B. mehrere symptomatische Familienmitglieder). Mitarbeiter sollen als persönliche Schutzmaßnahmen einen Mund-/Nasenschutz, Einmalkittel und Einmalhandschuhe tragen.
Pflegerische Maßnahmen
Wie oben bereits erwähnt, kann eine frühzeitig begonnene Antibiotika-Therapie den Krankheitsverlauf verkürzen. Akute Hustenanfälle können erleichtert werden, wenn das Kind in einer sitzenden, leicht nach vorne gebeugten Haltung im Bett ist. Im Anschluss an den Hustenanfall kann man dem Kind Essen und Trinken anbieten, da der nächste Anfall sicher erst frühestens in einer halben Stunde auftritt. Brustumschläge oder Einreibungen mit Lavendelöl 10% wirken entkrampfend.
Säuglinge mit Keuchhusten(verdacht) müssen monitorüberwacht werden.
41.3.7 Scharlach
41.3.7.1 Medizinischer Überblick
Definition
Die Diagnose „Scharlach“ ist eine klinische Diagnose, sie wird bei Auftreten eines typischen klinischen Bildes gestellt. Ursache ist eine Infektion mit β-hämolysierenden Streptokokken der Gruppe A (Streptococcus pyogenes), welche typischerweise im Rachenabstrich nachgewiesen werden können.
Der alleinige Nachweis von β-hämolysierenden Streptokokken der Gruppe A mit oder ohne Tonsillopharyngitis allein berechtigt noch nicht zur Diagnosestellung „Scharlach“.
Racheninfektionen durch Streptokokken treten vorwiegend im Winterhalbjahr und gehäuft bei 6–12-Jährigen auf. Man geht (bei fehlender Meldepflicht) von 1–1,5 Mill. Erkrankungen/Jahr in Deutschland aus. Bei bis zu 20% der Bevölkerung ist eine asymptomatische Besiedlung des Rachenraumes mit S. pyogenes nachweisbar.
In Deutschland besteht bei V.a. oder Nachweis von β-hämolysierenden Streptokokken der Gruppe A keine gesetzliche Meldepflicht. Dies gilt auch für Scharlach.
Übertragungsweg
Die Übertragung der Streptokokken-Infektion erfolgt durch Tröpfcheninfektion, die i.d.R. einen engen Kontakt von Mensch zu Mensch voraussetzt. Die Inkubationszeit beträgt 1–3 Tage.
Ansteckungsfähigkeit bei akuten Streptokokken-Infektionen (nicht bei asymptomatischer Besiedlung, s.o.!) besteht bis zu 3 Wochen. Nach Beginn einer wirksamen antibiotischen Therapie hält die Ansteckungsfähigkeit noch ca. 24 Stunden an.
Symptome
Klinisch stehen zunächst die Symptome der akuten Tonsillopharyngitis (Fieber, Halsschmerzen, Schluckbeschwerden) im Vordergrund. Durch Streptokokken-Exotoxine entsteht das spezifische kleinfleckig nicht-konfluierende, gering papulöse, oft in den Leisten beginnende und „wie hingehaucht“ wirkende Exanthem, welches oft schon am 1. oder 2. Krankheitstag auftritt und 6–9 Tage anhalten kann. Das Exanthem spart die Mund-Region aus und führt zum typischen blassen Mund-Nasen-Dreieck. Inspektorisch imponieren das Rachenenanthem und die sogenannte Himbeerzunge.
In der 2. Krankheitswoche kommt es zu einer Desquamation (Hautschuppung) der Haut mit einer kleieartigen Schuppung, die an Händen und Füßen oft großschuppig sein kann.
Relevante Folgeerkrankungen nach S.-pyogenes-Infektionen sind das akute rheumatische Fieber, die Chorea minor und die akute ▶ Glomerulonephritis (Scholz 2013).
Diagnostik
Der Streptokokken-Nachweis erfolgt mittels kultureller Anzucht aus dem Rachenabstrich. Verfügbare Streptokokken-Schnelltests haben eine unbefriedigende Sensitivität von nur 80–90%. Die Diagnose „Scharlach“ wird klinisch gestellt.
Therapie
Eine akute Scharlacherkrankung wird häufig mit einem oralen Penicillin behandelt. Vorteil einer solchen antibiotischen Therapie ist ggf. die verkürzte Ansteckungsfähigkeit (s.o.). In Westeuropa konnte aber bisher kein relevanter Einfluss der Antibiotikatherapie nachgewiesen werden, weder was die Dauer der Krankheitssymptome (Fieber, Halsschmerzen) noch was das Auftreten von möglichen Folgeerkrankungen betrifft (Chiappini et al. 2011).
41.3.7.2 Pflege- und Behandlungsplan
Isolierungsmaßnahmen
Patienten mit Streptokokken-Erkrankungen müssen im Krankenhaus nicht isoliert werden. Im Haushalt und in der Klinik sind aber alle Maßnahmen der Basishygiene in besonderem Maße zu beachten.
Symptomlose Keimträger werden nicht behandelt. Eine Schutzimpfung existiert nicht.
Pflegerische Maßnahmen
Hilfreich bei Halsschmerzen und Schluckbeschwerden sind Halswickel z.B. mit Zitrone. Gurgeln mit Ringelblumen-Tee (Calendula) oder das Trinken von (z.B. mit Honig gesüßtem) Salbeitee werden von Patienten ebenfalls oft als symptomlindernd beschrieben. Zur symptomatischen unterstützenden Therapie bei Fieber siehe ▶ Masern.
41.4 Pflege von Kindern mit Atemwegsinfektionen
41.4.1 Pneumonie
41.4.1.1 Medizinischer Überblick
Definition
Als Pneumonie/Lungenentzündung werden entzündliche Veränderungen der Lunge inklusive der Gefäße, Bindegewebe, Atemwege, Alveolen und viszeraler Pleura bezeichnet.
Grundsätzlich ist die ambulant erworbene Pneumonie von einer nosokomial (d.h. im Krankenhaus) erworbenen Pneumonie sowohl hinsichtlich Risikofaktoren, Erregerspektrum als auch Therapie zu unterscheiden. Alle folgenden Ausführungen beziehen sich – sofern nicht ausdrücklich erwähnt – auf die ambulant erworbene Pneumonie.
Schätzungen der Weltgesundheitsorganisation (WHO) zu Folge erkranken jährlich weltweit ca. 156 Mill. Kinder < 5 Jahre an einer Pneumonie; davon müssen ca. 20 Mill. stationär behandelt werden. Über 2 Mill. Kinder sterben jährlich weltweit an einer Pneumonie (Rudan et al. 2008). In Industrieländern beträgt die Inzidenz für Pneumonien bei Kindern < 16 Jahren 14,5/10000/Jahr. Die höchste Inzidenz (33/10000/Jahr) besteht bei den < 5-Jährigen (Liese et al. 2013). Das Risiko, an einer ambulant erworbenen Pneumonie zu erkranken, steigt, wenn bestimmte Lebensstilfaktoren/Umgebungsbedingungen vorherrschen wie:
-
beengte Wohnverhältnisse
-
hohe Geschwisterzahl
-
Passivrauchen
-
niedriges Geburtsgewicht
-
Tagesunterbringung in Gemeinschaftseinrichtungen
Erregerspektrum
Es wird vermutet, dass bei ambulant erworbenen Pneumonien bei Kindern jenseits des ersten Lebenshalbjahres die Mehrzahl der Pneumonien durch Viren verursacht ist. Die häufigsten viralen Erreger sind ▶ RSV, Influenza, Parainfluenza, Rhino- und Adenoviren. Die häufigsten bakteriellen Erreger sind Streptococcus pneumoniae, Haemophilus influenzae und Mycoplasma pneumoniae (Rudan et al. 2008).
Klinische Symptome
Leitsymptome der akuten Pneumonie im Kindesalter sind:
-
akut einsetzendes hohes Fieber
-
reduzierter Allgemeinzustand
-
bei Säuglingen auch Trinkschwäche!
-
Blässe
-
Tachypnoe, ggf. Dyspnoe
-
Husten
-
Bauch- und/oder Brustschmerzen
Definition
Von einer Tachypnoe, also einer beschleunigten Atemfrequenz, spricht man bei Kindern, abhängig vom Alter, wenn die Atemfrequenz folgende Werte übersteigt:
-
< 2 Monate: > 60/Min.
-
2 Monate bis 1 Jahr > 50/Min.
-
1 bis 5 Jahre > 40/Min.
-
> 5 Jahre > 20/Min.
Der typische, für eine Pneumonie quasi beweisende Auskultationsbefund, der aber bei Weitem nicht bei allen Kindern mit Pneumonie zu hören ist, sind feinblasige inspiratorische Rasselgeräusche. Die klassische Lobärpneumonie (eine meist durch Pneumokokken bedingte Lungenentzündung, die auf einen oder mehrere Lungenlappen begrenzt ist) ist charakterisiert durch ein abgeschwächtes Atemgeräusch, eine perkutorische Dämpfung und Bronchialatmen. Exspiratorisches Giemen, das ansonsten typisch für die spastische Bronchitis ist, ist häufiger auch bei viralen Pneumonien bei Kleinkindern zu hören.
Diagnostik
Diagnostisch sind die Anamnese und der klinische Befund wegweisend! Ergänzend kann die Labordiagnostik (Blutbild mit Differenzialblutbild, C-reaktives Protein, ggf. Blutsenkungsgeschwindigkeit [BSG]) helfen, zwischen viraler oder bakterieller Ursache zu unterscheiden.
Allerdings kann nur der Erregernachweis eine definitive Aussage zur Art des Erregers machen. Dieser ist aber nur sinnvoll, wenn auch eine stationäre Therapie notwendig ist. Grundsätzlich ist anzumerken, dass der bakterielle Erregernachweis bei Kindern mit Pneumonie schwierig ist. Geeignete Körperflüssigkeiten sind (bei älteren Kindern) Sputum, ggf. Pleuraergussflüssigkeit, bronchoalveoläre Lavage bei beatmeten Kindern. Der kulturelle Erregernachweis aus dem Rachenabstrich hingegen hat nur einen sehr geringen positiven Vorhersagewert.
Bildgebende Diagnostik mittels Röntgen ist routinemäßig nicht erforderlich und dient lediglich bei schwerer Erkrankung und/oder kompliziertem Verlauf dem Ausschluss von Komplikationen wie Atelektase, Pleuraempyem, Lungenödem oder anderen Differentialdiagnosen sowie Tuberkulose. Eine hochauflösende CT- oder MRT-Untersuchung der Lunge bleibt Spezialfragestellungen vorbehalten. Zum Ausschluss eines Pleuraergusses ist der Ultraschall die Untersuchungsmethode der Wahl.
Therapie
Die Therapie der kindlichen Pneumonie erfolgt bei unkomplizierten Verläufen und nach Sicherstellung kurzfristiger Verlaufskontrollen ambulant. Bei komplizierteren Verläufen (drohende Exsikkose, drohender Sauerstoffbedarf, ausbleibende Besserung) hingegen ist eine stationäre Behandlung notwendig.
Zu den Basismaßnahmen gehören eine adäquate (oft zusätzlich parenterale) Flüssigkeitszufuhr sowie weitere sekretmobilisierende Maßnahmen. Besteht der Verdacht auf eine bakterielle Pneumonie (und nur dann!), erfolgt eine empirische, im stationären Setting initial meist intravenöse antibiotische Therapie mit einem Aminopenicillin. Makrolide (z.B. Erythromycin oder Clarithromycin) sollten nur eingesetzt werden bei klinischem Verdacht auf atypische Erreger (Mykoplasmen, Chlamydien) oder ausbleibender Besserung unter Therapie mit Aminopenicillinen (Lassi et al. 2014). Eine antipyretische Therapie ist nur dann bedarfsweise erforderlich, wenn das fiebernde Kind trotz unterstützender Maßnahmen sehr unter dem Fieber an sich (und nicht unter den Symptomen der Pneumonie) leidet.
Eine virostatische Therapie bei einer vermuteten oder nachgewiesenen viralen Pneumonie ist nur wenigen speziellen Indikationen vorbehalten.
Merke
Wichtig ist, dass die Kinder auch nach der Entfieberung eine ausreichend lange Zeit der Rekonvaleszenz einhalten können. Pathologisch-anatomisch benötigt eine Pneumonie ca. 3 Wochen bis zur vollständigen Ausheilung.
Prophylaxe
In den von der ständigen Impfkommission (STIKO) empfohlenen Standardimpfungen (RKI 2016e) ist die Immunisierung gegen Haemophilus influenzae und Pneumokokken enthalten. Dies bedeutet aber keinen sicheren Schutz vor einer Pneumonie, da eine Vielzahl anderer Erreger (vor allem Viren) auch eine Pneumonie verursachen können.
Grundsätzlich gilt aber, dass die Wahrscheinlichkeit, an einer Pneumonie zu erkranken, bei Kindern, die eine gute Immunitätslage haben (durch einen entsprechend gesunden Lebensstil), deutlich geringer sein dürfte. Wissenschaftlich valide Daten hierzu fehlen. Grundsätzlich hilfreich in der Vorbeugung gegen eine Pneumonie ist – sofern möglich – die Vermeidung der o.g. Risikofaktoren wie z.B. Passivrauchen.
41.4.1.2 Pflege- und Behandlungsplan
Isolierungsmaßnahmen
Patienten mit einer Pneumonie müssen nicht gesondert isoliert werden und können auch gemeinsam mit anderen Patienten in einem Zimmer behandelt werden. Immunsupprimierte Patienten sollten aber ferngehalten werden. Auch hier sind die Regeln der Basishygiene zu beachten.
Pflegerische Maßnahmen
Kinder mit Pneumonie bedürfen einer besonderen pflegerischen Zuwendung. Zum einen müssen Pflegende den Umgang mit Fieber unterstützen (leichte Kleidung, angenehm temperiertes/belüftetes Zimmer, ggf. Wadenwickel), zum anderen steht aber auch die Linderung des oft quälenden Hustens im Vordergrund der pflegerischen Maßnahmen. Hier können neben Kochsalzinhalationen (ggf. mit ärztlich angeordneten medikamentösen Zusätzen), vor allem auch äußere Anwendungen in Form von Wickeln, Kompressen und Einreibungen (z.B. mit Lavendelöl, Senfmehl, Ingwermehl usw.) hilfreich sein.
Zum Umgang mit dem fiebernden kranken Kind siehe Kapitel ▶ „Masern“ und „Fieber“.
41.4.2 RSV-Infektion
41.4.2.1 Medizinischer Überblick
Definition
Infektionen durch das Respiratory-syncytial-Virus (RSV) betreffen vorwiegend die oberen und unteren Luftwege. Manifestationsart und -ort sind je nach Alter und Vor- bzw. Begleiterkrankung des Erkrankten sehr unterschiedlich. Im klinischen Alltag sind vor allem wegen der (saisonalen) Häufung RSV-Infektionen bei Kindern in den ersten 12 Lebensmonaten mit teilweise schwerwiegenden Verläufen bedeutsam. Besonders komplikationsgefährdet sind ehemalige Frühgeborene mit vorgeschädigter Lunge (wie z.B. bronchopulmonale Dysplasie), Säuglinge mit angeborenen Herzfehlern sowie Säuglinge mit angeborenen Immundefekten.
Das RS-Virus gehört als RNA-Virus zur Familie der Paramyxoviren.
Übertragungsweg
Die Übertragung der RS-Viren erfolgt vorwiegend über Tröpfcheninfektion von infektiösen, nicht immer Krankheitssymptome zeigenden Personen. Es ist auch eine Übertragung durch kontaminierte Hände, Gegenstände und Oberflächen möglich (indirekter Kontakt). Bei lückenhaften Schutz- und Hygienemaßnahmen in Krankenhäusern und Pflegeeinrichtungen kann es somit unter Risikopopulationen (z.B. Frühgeborenenstation) rasch zu nosokomialen Ausbrüchen kommen (RKI 2016f.).
Die Inkubationszeit beträgt 3–6 Tage. Die Dauer der Virusausscheidung reicht von 3–8 Tagen bei gesunden Kindern und Erwachsenen bis hin zu mehreren Monaten bei Frühgeborenen und Immundefizienten. Die Ansteckungsfähigkeit beginnt oft schon vor Beginn der Symptome.
Symptome
Die in den Wintermonaten gehäuft auftretenden klinischen Symptome einer RSV-Infektion reichen vom Bild eines banalen oberen Luftwegsinfektes bis hin zur schwersten beatmungspflichtigen respiratorischen Insuffizienz mit Kreislaufinsuffizienz. Eine Primärinfektion mit RSV äußert sich in der Regel als Bronchiolitis, Pneumonie oder Tracheobronchitis (Mazur et al. 2015). Fast immer geht sie mit mehr oder weniger ausgeprägtem Fieber einher.
Die Schwere der Erkrankung wird bestimmt durch das Ausmaß der Tachy- und/oder Dyspnoe. Der Husten ist oft quälend, manchmal pertussiform (ca. 5% der Fälle) und nicht selten von Zyanoseattacken begleitet. Glasiger zäher Schleim kann kaum abgehustet werden und führt zur pulmonalen Obstruktion. Der Allgemeinzustand der betroffenen Säuglinge ist meist (stark) reduziert, die Nahrungs- und Flüssigkeitsaufnahme stark eingeschränkt. Bei Frühgeborenen können ähnlich wie beim ▶ Keuchhusten Apnoen ein klinisch bedeutsames Begleitsymptom darstellen. Der Krankheitsverlauf ist oft rasant. Vom milden Symptombeginn bis zur klinisch bedeutsamen Hypoxie/Hyperkapnie dauert es vor allem bei Risikopatienten oft nur wenige Stunden.
Eine häufige Begleiterkrankung ist eine Mittelohrentzündung. In bis zu 75% der Fälle von akuter Otitis media bei Kindern unter 3 Jahren findet man RSV entweder alleine oder mit anderen viralen oder bakteriellen Erregern.
Reinfektionen sind häufig, verlaufen aber i.d.R. deutlich milder.
Diagnostik
Neben den klinischen Symptomen sichert der direkte Erregernachweis mittels EIA oder PCR aus dem Nasopharyngealsekret oder Nasenrachenspülwasser die Diagnose. Danach richtet sich anschließend das therapeutische Vorgehen. Zudem ist die sichere Diagnose wesentlich für infektionsepidemiologische Maßnahmen.
Therapie
Die Therapie der RSV-Infektion orientiert sich im Wesentlichen an den Symptomen. Hierbei kommen Bronchodilatatoren, Kortikosteroide, Leukotrienantagonisten und – falls erforderlich – eine Intensivbehandlung inklusive nicht invasiver und invasiver Beatmung zur Anwendung. Für keine der genannten medikamentösen Therapieoptionen konnte bislang in klinischen Studien eine signifikante Wirksamkeit nachgewiesen werden (Mazur et al. 2015). Auch für die inhalative antivirale Therapie mit Ribavarin konnte in klinischen Studien kein signifikanter Behandlungserfolg nachgewiesen werden.
Zur Prophylaxe der RSV-Infektion bei Hochrisikopatienten (Definition siehe AWMF-Leitlinie Reg.-Nr. 048–012) ≤ 24 Lebensmonaten steht ein monoklonaler Antikörper (Palivizumab) zur Verfügung.
41.4.2.2 Pflege- und Behandlungsplan
Isolierungsmaßnahmen
RSV-positive Säuglinge und Kleinkinder sollen im Krankenhaus in Gruppen zusammengefasst werden und – soweit möglich – nur von für diese Patientengruppe zuständigem Pflegepersonal gepflegt werden. Eine sorgfältige Händedesinfektion vor und nach jedem Patientenkontakt und das Tragen von Einmalhandschuhen, Schutzkittel und Atemschutz sind ebenfalls sinnvoll und wirksam.
Pflegerische Maßnahmen
Hospitalisierte Säuglinge und Kleinkinder mit RSV-Infektion sind meist in einem deutlich reduzierten Allgemeinzustand und durch die Krankheitssymptome stark beeinträchtigt. Da pharmakologische Interventionen (s.o.) wenn überhaupt nur von fraglichem Nutzen sind, kommt der pflegerischen Unterstützung eine ganz besondere Bedeutung zu. Therapeutisches Ziel dieser Maßnahmen ist eine Milderung der Tachydyspnoe, u.a. durch
-
O2-Gabe bei Hyoxämie,
-
Inhalation mit 3%iger NaCl-Lösung zur Sekretmobilisierung,
-
Anwendung von Brust-/Thoraxeinreibungen mit verdünnten ätherischen Ölen (Thymian, Lavendel) zur Entkrampfung.
Zudem erleichtert eine Oberkörperhochlagerung etwas das Abhusten.
41.5 Pflege von Neugeborenen mit bakteriellen neonatalen Infektionen
41.5.1 Allgemeines
Infektionen bei Früh- und Neugeborenen können für die betroffenen Kinder oft und rasch zu einer lebensbedrohlichen Situation werden, weshalb ihnen hier ein gesondertes, grundsätzlich in die Thematik einführendes Kapitel gewidmet werden soll.
Grundsätzlich kommen auch in diesem Alter die 3 großen Erregergruppen Viren, Bakterien und Pilze als Auslöser von Krankheitssymptomen in Betracht. Da allerdings Viren und Pilze im klinisch-neonatologischen Alltag seltener sind und u.U. sehr spezielle Handlungsstrategien nach sich ziehen, wird im Folgenden nur auf die bakteriellen Infektionen eingegangen.
41.5.1.1 Formen
Je nach klinischer Symptomatik und in Abhängigkeit vom kulturellen Erregernachweis können 4 verschiedene Formen einer bakteriellen Infektion des Neugeborenen unterschieden werden:
-
Systemische Entzündungsreaktion (SIRS): Diese ist gekennzeichnet durch die in ▶ Tab. 41.7 zusammengefassten klinischen Hinweise einer (bakteriellen) Infektion. Ein Erreger kann in der Blutkultur nicht gefunden werden.
-
Sepsis: wie SIRS, allerdings mit Erregernachweis in einer Blutkultur.
-
Septischer Schock: Zusätzlich zu den in ▶ Tab. 41.8 zusammengefassten Symptomen tritt ein Blutdruckabfall, ein blassgraues Aussehen und eine metabolische Azidose auf.
-
Lokale oder Organinfektionen wie z.B. Meningitis, Harnwegsinfektion, Omphalitis.
|
Organ |
klinischer Befund |
|
Allgemeinzustand |
„Das Kind sieht nicht gut aus.“ |
|
Herz, Kreislauf |
Trinkschwäche, Hypothermie oder Fieber, Berührungsempfindlichkeit Tachykardie > 180/Min. |
|
Atmung |
thorkakale Einziehungen, Stöhnen, Apnoe, Dyspnoe, Tachypnoe: erhöhter Sauerstoffbedarf beim Neugeborenen |
|
Haut, Weichteile |
Blässe, Zyanose (Hautfarbe von rosig nach blass bzw. von Rosig-ikterisch nach Grün-ikterisch wechselnd), Petechien, Pusteln, Abszesse, Omphalitis (Entzündung des Bauchnabels) , Paronychie (Nagelbettentzündung), Ikterus, Ödeme |
|
Magen-Darm-Trakt |
geblähtes Abdomen, Trinkschwäche, Erbrechen, verzögerte Magenentleerung, Obstipation, Diarrhö, Nahrungsverweigerung, fehlende Darmgeräusche |
|
ZNS |
Lethargie oder Irritabilität, Muskelhypotonie oder -hypertonie, Krampfanfälle, gespannte Fontanelle |
Merke
Mit 1–3% der Lebendgeborenen ist die bakterielle Infektion des Neugeborenen die häufigste Erkrankung des Neugeborenen.
Grundsätzlich unterscheidet man die Frühsepsis (Early-onset-Sepsis), die bereits am 1.– 3. Lebenstag auftreten kann, von der Spätsepsis (Late-onset Sepsis), die erst Tage nach der Geburt, zwischen dem 4. Lebenstag und der 6. Lebenswoche, auftritt, s. ▶ Tab. 41.8 .
|
Early-onset Sepsis |
Late-onset Sepsis |
|
1.–3. Lebenstag |
4. Lebenstag–6. Lebenswoche |
|
Erreger aus der mütterlichen Rektovaginalflora (u.a. β-hämolysierende Streptokokken Gruppe B, E. coli, Klebsiellen usw.) |
Erreger aus der Umgebungsflora des Kindes (cave nosokomiale Keime wie z.B. Pseudomonas, koagulase-negative Staphylokokken, Candida sp. u.a.) |
|
Risikofaktoren: geburtshilfliche Komplikationen, vorzeitiger Blasensprung, Amnionifektionssyndrom, mütterliche Entzündungszeichen |
Risikofaktoren: Hospitalisierung, Frühgeburtlichkeit, parenterale Ernährung, Fremdkörper (Tubus, Katheter usw.) |
41.5.1.2 Diagnostik
Der Verdacht auf eine Neugeboreneninfektion ergibt sich aus den klinischen Zeichen und der Anamnese (s. ▶ Tab. 41.8 , Santos u. Tristram 2015). Für die Entscheidung für oder gegen eine antiinfektive Therapie ist (außer bei eindeutig und schwer kranken Kindern) vor allem auch die unmittelbar bei klinischem Verdacht einzuleitende Labordiagnostik hilfreich:
-
Blutbild mit Differenzialblutbild (absolute Leukozytenzahl, relative Anzahl der neutrophilen Granulozyten), C-reaktives Protein (steigt erst nach 12–24 Stunden an), Interleukin-6 oder -8 bzw. Procalcitonin.
-
Eine Blutkultur sollte bei klinischem Verdacht immer mit abgenommen werden, spätestens vor Beginn einer antiinfektiven Therapie. Das Ergebnis, das i.d.R. erst nach einigen Tagen vorliegt, hat auf den Beginn einer antiinfektiven Therapie keinen Einfluss, allerdings auf die Dauer und bei positivem Keimnachweis auf die Auswahl der eingesetzten Antibiotika.
Bei Meningitisverdacht ist zusätzlich zu den genannten diagnostischen Maßnahmen immer eine Lumbalpunktion zur Liquorgewinnung erforderlich. Neben einer Liquorkultur (hier gilt das zur Blutkultur Gesagte analog!) werden im Liquor die Zellzahl, -differenzierung, Eiweiß- und Glukosegehalt sowie Laktat bestimmt.
Weitere mikrobiologische Diagnostik aus Ohrabstrichen, Magensaft und/oder Trachealsekret sind, wenn überhaupt, nur unmittelbar postpartal sinnvoll.
41.5.1.3 Therapie
Ziel der initialen Therapie ist es, weitere klinische Komplikationen zu vermeiden, insbesondere den septischen Schock mit allen Folgeproblemen. Bei einem begründeten klinischen Verdacht sollte daher frühzeitig eine empirische antibiotische Therapie eingeleitet werden – abhängig vom zu erwartenden Erregerspektrum und unter Berücksichtigung des klinikspezifischen Keim- und Resistenzspektrums. Darüber hinaus werden je nach Bedarf auch therapeutische Maßnahmen zur Stabilisierung der Organfunktionen eingesetzt (Volumengabe, ggf. Katecholamine, Maßnahmen zur Kreislaufunterstützung usw.).
41.5.2 Pflege- und Behandlungsplan
Bei Neugeborenen mit Infektionsverdacht ist immer eine Intensivüberwachung bis zur verlässlichen Stabilisierung der Vitalfunktionen erforderlich. Hierzu gehört ein kontinuierliches Monitoring der Vitalfunktionen sowie initial auch eine Bilanzierung der Flüssigkeitsein- und -ausfuhr. Dies bedeutet aber nicht, dass Mutter und Kind zwangsläufig getrennt werden müssen. Im Gegenteil, gibt es gute Gründe, Mutter und Kind möglichst zusammen zu betreuen: So wird das Gelingen einer guten Mutter-Kind-Bindung dadurch deutlich wahrscheinlicher; und so kann eine gute Stillsituation mit allen (auch infektiologischen!) Vorteilen der Muttermilchernährung gefördert bzw. sichergestellt werden.
Noch mehr als bei sonst „gesunden“ Früh- und Neugeborenen ist bei Neonaten mit Infektionsverdacht und drohendem Organversagen eine den Bedürfnissen des Neugeborenen möglichst nahe kommende, entwicklungsfördernde Pflegebegleitung unabdingbar. Diese Aufgabe muss von allen beteiligten Berufsgruppen gemeinsam angegangen und bewältigt werden!
41.6 Pflege von Patienten mit Clostridium-difficile-assoziierter Diarrhö
41.6.1 Medizinischer Überblick
Durchfälle sind eine sehr häufige unerwünschte Wirkung von Antibiotika. Da Antibiotika nicht zwischen pathogenen Keimen und Teilen des physiologischen Mikrobioms, der gastrointestinalen Flora, unterscheiden können, wird das Gleichgewicht durch die bakterizide Wirkung gestört. Ist die Diarrhö nicht selbstlimitierend, liegt häufig eine Infektion mit Clostridium difficile (CDI) vor, die für schwerkranke und alte Menschen lebensbedrohlich werden kann.
41.6.1.1 Definition
Definition
CDAD ist eine mit Clostridium difficile (CD) verbundene Durchfallerkrankung. CD ist ein anaerobes, d.h. ausschließlich unter Luftabschluss existierendes Stäbchenbakterium, das im Stuhl auch bei Gesunden nachgewiesen werden kann.
Der in Luft oder in fließendem Wasser vorkommende Sauerstoff ist für CD giftig. Um an der Luft zu überleben, verkapselt sich CD zu Sporen, die gegenüber Umweltfaktoren wie Austrocknung, hohen Temperaturen und chemischen Substanzen (z.B. Alkoholen), resistente Dauerformen des Erregers darstellen. Sie werden durch Ingestion, d.h. oral erworben (s. ▶ Tab. 41.3 ).
Anatomie und Physiologie im Fokus
(nach Schwegler u. Lucius 2016)
Die Innenoberfläche des Magen-Darm-Trakts ist durch die warzenförmigen Erhebungen der Darmzotten sehr umfangreich. Die einzelnen Abschnitte ( ▶ Abb. 41.3) unterscheiden sich jedoch in ihrer mikrobiellen Besiedlung. Die größte Anzahl befindet sich im Dickdarm, man schätzt sie auf ca. 10–100 Billionen (Ehlermann 2016). In den oberen Abschnitten des Verdauungstrakts (Magen und Zwölffingerdarm) lassen sich nur geringe Mengen von Mikroorganismen nachweisen.
Physiologische Besiedlung des Magen-Darm-Trakts.
Abb. 41.3

Die physiologische Besiedlung mit Darmflora schützt vor einer Ausbreitung von pathogenen Mikroben. Diese Eigenschaft wird auch als Kolonisationsresistenz bezeichnet.
41.6.1.2 Epidemiologie
Seit einigen Jahren nimmt die Zahl (Inzidenz) nosokomialer Ausbrüche mit CD in den USA und Europa zu. Der entscheidende Faktor ist die Toxinbildung, klinisch schwere Verläufe (rezidivierende Erkrankungen sowie der Tod des Patienten) sind der epidemischen Lage angepasst meldepflichtig (§ 15.1 IfSG, RKI 2016).
41.6.1.3 Ursachen
C. difficile gehört zur Normalbesiedlung des menschlichen Darms, von Tieren und der Umwelt. Es findet sich im Darm von Kleinkindern (bis zu 80%) und Erwachsenen physiologisch und bei Krankenhauspatienten als asymptomatische Kolonisation. Als wesentliche Ursache für CDAD hat sich der zunehmende Einsatz von Antibiotika herauskristallisiert. Eine angemessene Anwendungshäufigkeit ist daher für Kliniken ein Qualitätsindikator. Eine erste nationale Studie wurde hierzu 1994 erstellt, jetzt liegen Zahlen aus 2011/2012 vom European Centre for Disease Prevention and Control (ECDC) vor: Ca. 18% der Patienten in Deutschland erhielten 1994 Antibiotika, im Jahr 2011 waren es schon 26% (Behnke 2013).
Merke
Der Zusammenhang zwischen nosokomial erworbener CDAD und einer vorausgehenden Antibiotika-Therapie ist eindeutig belegt. Durch Antibiose sterben viele der physiologisch im Darm lebenden Mikroben ab, Clostridien füllen schnell die entstandene Lücke aus.
Risikofaktoren Die Infektion ist abhängig von folgenden Risikofaktoren:
-
langfristige und häufig aufeinander folgende Antibiosen
-
Alter (> 65 Jahre)
-
Krankenhausaufenthalte
-
Schwere der Grunderkrankung (Intensivtherapie)
-
Immunsuppression
Sie sind nicht nur ein hohes Erkrankungsrisiko, sondern auch ein hohes Rezidiv-Risiko.
41.6.1.4 Symptome
Clostridium-difficile-assoziierte Erkrankungen zeigen sich in sehr unterschiedlichen Ausprägungsformen. Sie reichen vom Unterbauchschmerz bis hin zur lebensbedrohlichen Kolitis (Dickdarmentzündung):
-
Einige Patienten klagen über akute wässrige Diarrhö (CDAD) mit krampfartigen Unterbauchschmerzen und erhöhter Temperatur.
-
Bei anderen Patienten zeigen sich daneben sehr starke, manchmal blutig-schleimige Durchfälle. Sie können zur Austrocknung (Dehydration) und zum Eiweißverlust (Hypoproteinämie) führen. Hinzu können Appetitlosigkeit und Schwindel kommen.
-
Andere Patienten bilden charakteristische Pseudomembranen aus bis hin zu einer Kolitis, ggf. mit lebensbedrohlichem Ileus (Darmverschluss), toxischem Megakolon (starke Ausdehnung des Kolons) mit Gefahr der Darmwandperforation und anschließender Sepsis.
41.6.1.5 Diagnostik
Untersuchungsmethoden zum Nachweis einer Infektion sind:
-
klinisches Bild (akute wässrige, faulig riechende Durchfälle oder toxisches Megakolon)
-
positiver Labornachweis der C.-difficile-Toxine im Stuhl oder von C. difficile in der Stuhlkultur
-
endoskopischer Nachweis einer pseudomembranösen Kolitis
-
Nachweis typischer Entzündungszeichen in Gewebsproben (histologisch)
41.6.1.6 Therapie
Eine therapeutische Option wird in der allogenen Stuhl-Transplantation oder fäkalen Bakteriotherapie gesehen (Ehlermann 2016). Damit wird beabsichtigt, dass sich wieder ein dem Individuum eigenes System mikrobieller Symbionten entwickelt.
Als Standardbehandlung der CDAD wird nach Absetzen einer anderweitigen antibiotischen Therapie als Erstmaßnahme Metronidazol oder als Reserveantibiotikum Vancomycin oral verabreicht.
Prävention und Gesundheitsförderung
Die Prävention besteht im Wesentlichen im restriktiveren Umgang mit Antibiotika.
41.6.2 Pflege- und Behandlungsplan
41.6.2.1 Pflegerische Maßnahmen zur Infektionsprävention
Bei CDAD scheiden Patienten C.-difficile-Sporen in hoher Zahl aus, die in der Umgebung monatelang überleben können. Sie werden leicht fäkal-oral über mit Stuhl kontaminierte Gegenstände (Bettwäsche, Nachtstuhl sowie Instrumente, z.B. Rektalfieberthermometer) von einem kolonisierten oder infizierten Patienten auf einen anderen übertragen. Die hygienischen Maßnahmen müssen insbesondere bei Ausbrüchen strikter als sonst umgesetzt werden, um die weitere Ausbreitung in der Klinik zu vermeiden.
Daher umfasst das pflegerische Management von CDAD-Fällen in der Klinik aufwendige Hygienemaßnahmen wie
-
Kontaktisolierung der betroffenen Patienten sowie
-
korrekte Basishygiene mit Dekontamination der Patientenumgebung ( ▶ Tab. 41.9 ).
|
Prävention |
Anmerkungen |
|
mitarbeiterbezogene Maßnahmen |
|
|
Schutzkittel/-schürze tragen bei Möglichkeit der Kontamination der Arbeitskleidung (Kontakt mit Körperflüssigkeiten, Sekreten, Ausscheidungen, Betten des Patienten, Kontakt mit kontaminierten Körperarealen) |
bei üblichen Pflegetätigkeiten wegen der starken Kontamination des Patientenumfeldes |
|
Schutzhandschuhe tragen bei jedem Patientenkontakt (Ausscheidungen, Körperflüssigkeiten, Sekrete, Kontakt mit kontaminierten Körperarealen) |
sofort nach Benutzen die schmutzigen Handschuhe ohne Kontamination der Hände ausziehen und sorgfältig entsorgen; Hände desinfizieren |
|
Hände desinfizieren bei allen infektionsgefährdenden Tätigkeiten in der üblichen Weise |
die Verbreitung anderer vegetativer Mikroben muss verhütet werden |
|
Hände waschen nach Patientenkontakt und insbesondere vor dem Umgang mit Nahrungsmitteln (Sondennahrung, Essen verteilen und reichen) |
C. difficile wird fäkal-oral übertragen. Da die Sporenform von CD tolerant gegenüber Alkohol und andere Desinfektionsmittel ist, wird hier ausnahmsweise die Kombination der Waschung mit Wasser und Seife nach der Händedesinfektion empfohlen |
|
patientenbezogene Maßnahmen |
|
|
Patienten im Einzelzimmer unterbringen |
Zimmer kennzeichnen, Besucher müssen sich bei Pflegenden anmelden und eingewiesen werden |
|
eigenes WC bzw. Toilettenstuhl bereitstellen |
während der Dauer des Durchfalls; täglich sorgfältige desinfizierende Reinigung, einschließlich der Sitzflächenunterseite |
|
Patienten in die sorgfältige Händewaschung einweisen |
z.B. nach WC-Benutzung |
|
Pflegematerialien mit direktem Kontakt mit dem Patienten (Steckbecken, Urinflasche, Thermometer, EKG-Elektroden, Stethoskop usw.) patientenbezogen verwenden |
|
|
Flächen (Fußboden, Handkontaktflächen, Bettgestell, Nachtschrank, Türgriffe u.a.) mit sporozid wirksamen Desinfektionsmittel behandeln, z.B. Peressigsäure (wirkt gegen Sporen) |
ferner ist gründliche Reinigung angebracht, da Sporen mit üblichen Desinfektionsmitteln nicht inaktiviert werden |
|
sichtbare Verunreinigungen (Kontaminationen durch Ausscheidungen, Sekrete, Blut) müssen sofort desinfizierend gereinigt werden |
Keinesfalls auf Reinigungsdienst warten! |
|
Müll und Bettwäsche in der üblichen Weise entsorgen |
Bettwäsche vorsichtig abziehen, um Sporenverbreitung zu verhindern |
|
Dauer dieser Vorbeugemaßnahmen |
|
|
Schlussdesinfektion des Patientenzimmers |
|
41.6.2.2 Besonderer Hautschutz
Bei häufigen und heftigen Durchfällen sind ein spezieller Hautschutz und eine sorgfältige Hautpflege bei den Patienten angebracht. Der unsere Haut abschließende dünne Hydrolipidfilm hält die Epidermis glatt und geschmeidig, schützt vor schädigenden Einflüssen und vor dem Eindringen von Mikroorganismen. Häufige und durch ihre Intensität stärker die Haut reizende Körperausscheidungen und die bei Durchfällen erhöhte Wasch- und Reinigungsaktivität an der analen Haut kann zu Mazerationen führen (Auf- und Erweichen der Haut in großen Hautfalten mit lokalen Entzündungen und Blutungen). Zu den pflegerischen Maßnahmen siehe Kapitel „ ▶ Prävention und pflegerische Unterstützung bei Diarrhö“.
41.7 Pflege von Patienten mit Norovirus-Infektion
41.7.1 Medizinischer Überblick
41.7.1.1 Definition
Definition
Noroviren sind die häufigste Ursache nicht bakterieller Gastroenteritiden (Magen-Darm-Infektionen) mit 3 markanten Symptomen: akuter Diarrhö (Durchfall), Übelkeit und schwallartigem, heftigem Erbrechen.
Erkranken können Menschen aller Altersgruppen, an das RKI (2016) gemeldete Infektionszahlen betreffen aber mehr Kleinkinder (0–4 Jahre) und Ältere (> 80 Jahre).
Die besonders hohe Anzahl an Norovirus-Erkrankungen in der Saison 2016/2017 wird im Zusammenhang mit dem Auftreten eines neuen Norovirus-Typs gesehen.
41.7.1.2 Ursachen
Die Infektion wird von einem primär Erkrankten (Indexfall) auf andere übertragen und so verbreitet. Die Ansteckung ist die Folge
-
unzureichender Händehygiene,
-
einer oft intensiven Umgebungskontamination und
-
einer Tröpfchenübertragung beim Erbrechen.
41.7.1.3 Übertragungswege
Die Infektion erfolgt über die orale Aufnahme der Viren (fäkal-oraler Übertragungsweg). Gesichert sind:
-
direkter Kontakt mit einer infizierten Person
-
orale Aufnahme virushaltiger Tröpfchen (Schleimhautkontakt), die im Rahmen des schwallartigen Erbrechens entstehen
-
indirekter Kontakt mit Händen, Oberflächen oder Gegenständen, die mit Noroviren kontaminiert sind
-
orale Aufnahme kontaminierter Lebensmittel (z.B. durch Ausscheider bei mangelhafter persönlicher Hygiene)
Nachfolgende Faktoren begünstigen die Ausbreitung von Norovirus-Infektionen im Krankenhaus:
-
Die Viruskonzentrationen in Stuhl und Erbrochenem sind hoch (> 106/g Stuhl).
-
Das Virus ist sehr umweltresistent: Es überlebt lange in der Umwelt (bei 20 °C 14 – 21 Tage).
-
Eine Infektion ist sehr ansteckend: Eine geringe infektiöse Dosis reicht aus (10–100 Viruspartikel).
-
Das Virus ist relativ unempfindlich gegen Desinfektion.
-
Es gibt keine länger dauernde Immunität, da sich die zirkulierenden Noroviren ständig genetisch verändern (RKI 2016).
-
Das Virus wird bereits 12 Std. vor Symptombeginn und noch 7 – 14 Tage nach akuter Erkrankung ausgeschieden.
41.7.1.4 Symptome
Übelkeit und Bauchschmerzen mit Krämpfen, plötzlich einsetzendes („explosionsartiges“) Erbrechen und wässriger Durchfall sind die führenden Symptome. Mäßiges Fieber tritt in einzelnen Fällen auf.
Praxistipp
Bereits beim ersten Hinweis auf eine norovirusbedingte Gastroenteritis (typische Symptome) müssen in Klinik und Altenheim – ohne die Laborbestätigung abzuwarten – unverzüglich sinnvolle Maßnahmen zur Verhütung weiterer Infektionen eingeleitet werden (Sitzmann 2016).
Dauer und Komplikationen Meist dauert die Erkrankung nur 12–60 Std. und klingt dann spontan wieder ab. Sie verläuft kurz, aber heftig. Kleine Kinder und ältere Menschen können durch den manchmal sehr ausgeprägten Flüssigkeits- und Elektrolytverlust lebensgefährlich bedroht sein (Gefahr von Arrhythmien und akutem Nierenversagen). Auch sind bei diesen Patienten durch die Einleitung des Erbrechens beim Essen schwerwiegende Aspirationspneumonien möglich (Schneider 2013).
Lebensphase Kind & alter Mensch
Norovirus-Infektion
Die Norovirus-Infektion ist wegen des Flüssigkeitsverlusts vor allem für Senioren und Kinder gefährlich (Sitzmann 2012).
41.7.1.5 Diagnostik
Weist die Symptomatik auf eine Norovirus-Infektion hin, kann der Labornachweis geführt werden durch
-
den Nachweis viraler RNA mit Hilfe der RTPCR (Reverse-Transkriptase-Polymerase-Kettenreaktion),
-
durch den Befund viraler Antigene im ELISA (Enzyme Linked Immunosorbent Assay) oder
-
mit Hilfe von immunochromatografischen Testmethoden (Schnelltests).
Bei einem Ausbruch sollte die Diagnose aus dem Stuhl einiger weniger Patienten (Kosten) mittels PCR-Diagnostik bzw. Enzymimmunoassays bestätigt werden. Sonst genügt die Diagnosestellung aus den klinischen Symptomen einer Norovirusinfektion.
41.7.1.6 Therapie
Meist reicht eine symptomatische ambulante Behandlung aus. In der akuten Erkrankungsphase sollen Betroffene nicht erforderliche Personenkontakte meiden und auf sorgfältige Händehygiene achten, besonders nach Erbrechen und Toilettenbesuch. Die Therapie beschränkt sich auf den Ausgleich des Flüssigkeits- und Mineralsalzverlusts durch ausreichend Flüssigkeit (Tee, Wasser).
41.7.2 Pflege- und Behandlungsplan
41.7.2.1 Pflegerische Maßnahmen zur Infektionsprävention
Von grundsätzlicher Bedeutung ist die strenge Einhaltung der ▶ Basishygiene, insbesondere die ▶ Händehygiene. ▶ Tab. 41.10 listet Maßnahmen für Patienten und Kontaktpersonen auf.
|
Prävention |
Anmerkungen/Begründungen |
|
mitarbeiterbezogene Maßnahmen |
|
|
Hände desinfizieren mit Mitteln, die nachgewiesenermaßen eine viruzide Wirkung haben, d.h. solchen mit hohem Ethanolgehalt |
Viren werden über den Stuhl des Menschen noch bis 2 Wochen nach einer Erkrankung ausgeschieden, daher sollte nach Abschluss der Durchfälle die sorgfältige Händehygiene für ca. 2 Wochen fortgeführt werden |
|
Pflege der Patienten mit Schutzhandschuhen, Schutzkittel durchführen |
um Kontamination der Hände und Arbeitskleidung vorzubeugen |
|
Mundnasenschutz tragen, z.B. bei Erbrechen oder Kontaktmöglichkeit mit Erbrochenem |
durch Bildung virushaltiger Tröpfchen kann das Virus während des Erbrechens übertragen werden |
|
Hand-Gesichts-Kontakte vermeiden |
zumindest solange die Hände nicht desinfiziert sind, da sie als Virusüberträger gelten |
|
Hände desinfizieren nach Ablegen der Schutzhandschuhe und vor Verlassen des Isolierzimmers |
Hygieneregeln beachten |
|
auf Arbeitsbefreiung erkrankter Mitarbeiter bis mind. 2 Tage nach Beendigung der Krankheitszeichen achten |
Ansteckungsfähigkeit dauert noch mind. 48 Std. nach Beendigung klinischer Symptome |
|
patientenbezogene Maßnahmen |
|
|
Patienten im Zimmer mit eigenem WC isolieren, auch möglich als Gruppenisolierung |
sehr hohe Infektiosität bei minimaler lnfektionsdosis |
|
(kooperationsfähige) Patienten in korrekte Händehygiene einweisen |
verschmutzte Hände und Erbrochenes gelten als Virusüberträger |
|
(mehrmals) täglich Flächen (alle patientennahen Kontaktflächen einschl. der WC-Brille und der Türgriffe) mit viruzid wirksamem Präparat desinfizieren |
Kontakt mit kontaminierten Gegenständen kann Übertragung ermöglichen |
|
kontaminierte Flächen sofort mit viruzid wirksamem Präparat (z.B. Peressigsäure) desinfizieren |
Kontaktübertragung des Virus vermeiden |
|
Dauer der Isolierung |
mind. 2 Tage nach Beendigung der klinischen Symptomatik |
|
Schlussdesinfektion des Patientenzimmers |
|
Häusliche Pflege im Fokus
Bei der Pflege Angehöriger in einem Privathaushalt kann auf den Einsatz von Desinfektionsmitteln verzichtet werden. Erkrankte und Personen, die Erkrankte betreuen, sollten unbedingt eine korrekte Händehygiene mit sorgfältigem Waschen der Hände praktizieren. Professionell Pflegende sollen geeignete Händedesinfektionsmittel nutzen. Körpernahe Kontakte mit Erkrankten sollten auf das Allernötigste beschränkt werden.
41.8 Pflege von Patienten mit Meningitis
Anatomie und Physiologie im Fokus
(nach Schwegler u. Lucius 2016)
Zwischen dem Gehirn und dem umgebenden Knochen befinden sich Flüssigkeitsräume, welche durch die Hirnhäute begrenzt werden. Die Hirnhäute (griech.: Meningen) gehen in die Rückenmarkshaut über. Nach Festigkeit, Dicke und Aussehen unterscheidet man 3 Hirnhäute ( ▶ Abb. 41.4):
-
harte Hirnhaut (Dura mater)
-
Spinngewebshaut (Arachnoidea mater)
-
weiche Hirnhaut (Pia mater)
Die Hirnhäute und die Zwischenräume von außen (Schädel) nach innen (Gehirn).
Abb. 41.4
Die Dura mater ist die äußerste Hirnhaut mit der Funktion einer Organkapsel. Als feste bindegewebige Haut haftet sie dem Schädelknochen von innen fest an. Als Subduralraum wird der zwischen Dura mater und Arachnoidea gelegene Spaltraum bezeichnet.
Die Arachnoidea mater besteht aus einem dünnen Häutchen, welches von innen der Dura mater anhaftet und von dem aus feine „spinnwebenartige“ Bindegewebszüge zur Gehirn- bzw. Rückenmarksoberfläche ziehen. Unter der Arachnoidea liegt der Subarachnoidalraum, der mit Liquor cerebrospinalis gefüllt ist und damit den äußeren Liquorraum darstellt.
Die Pia mater ist die innerste Schicht, sie bedeckt das Gehirn und Rückenmark komplett. Sie besteht aus weichem, zartem Bindegewebe und zahlreichen Blutgefäßen.
41.8.1 Medizinischer Überblick
Definition
Eine Meningitis ist eine Entzündung der weichen Häute des Gehirns und Rückenmarks. Sie gehört immer noch zu den schwersten akuten Infektionskrankheiten.
41.8.1.1 Ursachen
Meningitiden werden durch Bakterien und Viren (u.a. Masern-Virus, Varizella-Zoster-Virus, FSME), seltener durch Pilze und andere Pathogene hervorgerufen. Virale Meningitiden haben im Vergleich zu den bakteriellen Meningitiden fast immer einen leichteren Verlauf mit vollständiger Genesung.
Die häufigsten Erreger einer ambulant erworbenen, akuten bakteriellen Meningitis sind Streptococcus pneumoniae (Pneumokokken) und Neisseria meningitidis (Meningokokken).
41.8.1.2 Übertragungsweg
Die Übertragung erfolgt über verschiedene Wege:
-
über die Blutgefäße (z.B. bei Pneumonie oder bakterieller Endokarditis)
-
direkt von benachbarten Organen (z.B. Otitis media, Hirnabszess)
-
von außen, z.B. über einen liegenden Shunt, eine peridurale Anästhesie oder ein offenes Schädel-Hirn-Trauma
-
vom Nasen-Rachen-Raum aus sich ausbreitend nach einer Tröpfchen-Infektion (20 % der Bevölkerung gelten als „gesunde“ Meningokokkenträger).
Überwinden die Mikroben die Blut-Liquor-Schranke, kann eine Meningitis entstehen.
41.8.1.3 Symptome
Nach einer kurzen Phase unspezifischer Symptome (Erbrechen, Krankheitsgefühl, Muskelschmerzen und hohem Fieber > 39 °C mit Schüttelfrost) bildet sich das typische Krankheitsbild, das meningeale Syndrom, aus. Es zeichnet sich aus durch:
-
unerträgliche Kopfschmerzen
-
Lichtscheu (Fotophobie)
-
ausgeprägte Reizbarkeit bis hin zur Bettflucht (Berührungsempfindlichkeit)
-
Bewusstseinseintrübung bis zum Koma ( ▶ Tab. 41.11 )
-
Meningismus (Nackensteifigkeit) als schmerzbedingter Widerstand beim Beugen des Kopfes auf die Brust
Fallbeispiel
Die 15-jährige Ilona hat es gestern in der Disco richtig „krachen lassen". Danach fühlt sie sich gar nicht gut. Sie hat Halsschmerzen, Kopfschmerzen und erhöhte Temperatur. Die Mutter vermutet einen grippalen Infekt und verabreicht ihrer Tochter Acetylsalizylsäure und Tee. 2 Stunden später klagt das Mädchen auch über Nackensteifigkeit und immer stärker werdende Kopfschmerzen. Der Mutter fällt auf, dass sie nur noch verlangsamt auf Ansprache reagiert. Sie misst noch einmal das Fieber ihrer Tochter, die Temperatur beträgt nun 39,5 °C. Entsetzt ruft sie den ärztlichen Notdienst an, der eine sofortige Einweisung ins Krankenhaus veranlasst.
|
Somnolenz |
Patient ist leicht erweckbar (öffnet auf Ansprache die Augen, kann einem kurzen Anamnesegespräch folgen, Reaktion verlangsamt) |
|
Sopor |
Patient ist schwer erweckbar (Augen öffnen erst auf laute Ansprache oder Schmerzreize, Reaktionen sind deutlich verlangsamt oder fehlen) |
|
Koma |
Patient öffnet nicht die Augen, reagiert evtl. mit Motorik auf Schmerzreize |
Komplikationen Komplikationen einer Meningitis sind z.B. Septikämien mit punktförmiger Haut- oder Schleimhautblutung (Petechien, ▶ Abb. 41.5), Waterhouse-Friderichsen-Syndrom (Blutungen in Gehirn und Nebennieren, ▶ Abb. 41.6). Die Letalität liegt bei 5 – 30 %, die Rate bleibender Schäden (Epilepsie, Hörverlust, Lähmungen u. a.) bei 20 % der Patienten.
Petechiale Blutungen bei Meningokokkensepsis.
Abb. 41.5

Großflächige Hautblutungen bei Meningokokkensepsis und Waterhouse-Friderichsen-Syndrom.
Abb. 41.6
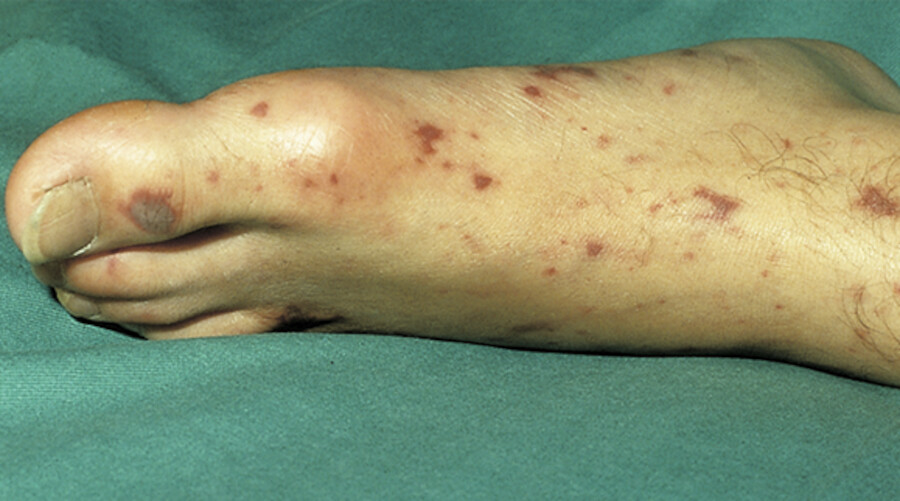
41.8.1.4 Diagnostik
Untersuchungen bei Verdacht auf eine bakterielle Meningitis sind:
-
klinisch-neurologische Befundzeichen
-
Lumbalpunktion zum Keimnachweis im ▶ Liquor
-
Antigennachweis
-
Keimnachweis im Blut
-
Schädel-CT zur Identifizierung einer möglichen Infektionsquelle (z.B. Sinusitis oder Mastoiditis) und Nachweis intrakranieller Komplikationen, z.B. einer Hirnschwellung (Hirnödem)
Merke
Liquor zum kulturellen Erregernachweis darf niemals im Kühlschrank zwischengelagert werden, da danach die Anzucht von Neisseria meningitidis kaum noch gelingt (Vonberg 2016).
41.8.1.5 Therapie
Nachdem das Untersuchungsmaterial (Blut, Liquor) entnommen wurde, werden sofort hoch dosiert Antibiotika verabreicht. Um schwere Verläufe von Meningitiden zu verhindern, wird auch die Gabe von Steroiden empfohlen (Bijlsma 2016).
Prävention und Gesundheitsförderung
Präventive Maßnahmen sind:
-
Impfung von Risikogruppen sowie Reisenden in epidemische Länder, z.B. des „Meningitisgürtels“ (Sahelzone, südlich der Sahara) sowie bei gehäuften Erkrankungen (Cluster).
-
Zur Umgebungsprävention besteht Meldepflicht (§ 6 IfSG) bei Verdacht, Erkrankung und Tod.
41.8.2 Pflege- und Behandlungsplan
Da zerebrale und systemische Komplikationen in der Akutphase der Erkrankung häufiger auftreten, werden diese Patienten intensivmedizinisch betreut.
41.8.2.1 Isolierungsmaßnahmen
Patienten mit Verdacht auf Meningitis werden bis zu 24 Std. nach Therapiebeginn ▶ im Einzelzimmer isoliert. Danach ist keine spezielle Hygiene mehr notwendig, die über die ▶ Basishygiene hinausgeht. Außerhalb des Körpers sterben die Keime rasch ab. Mitarbeiter schützen sich in dieser Zeit vor Tröpfcheninfektion und tragen einen Mund-Nasen-Schutz.
Fallbeispiel
Liegt eine nosokomiale Übertragung von Meningokokken vor?
Nach Aufnahme eines jungen Mannes mit ambulant erworbener Meningitis wird im Liquor Neisseria meningitidis (Kapseltyp B) isoliert. Nach 3 Tagen bessert sich sein Zustand deutlich. 6 Tage später erkrankt auf derselben Station ein 82-jähriger Patient, der bereits 14 Tage dort liegt. Im Liquor werden auch Meningokokken nachgewiesen.
Bei Verdacht auf nosokomiale Übertragung (3–10 Tage Inkubationszeit) wird den Mitarbeitern die einmalige Expositionsprophylaxe angeboten, die „Face-to-face“-Kontakte mit dem Ersterkrankten hatten. 10 Tage später meldet ein Speziallabor Meningokokken vom Kapseltyp C. Es fanden also 2 gleichartige Infektionen statt, aber mit genetisch ungleichen Kapseltypen; somit wurden die Meningokokken nicht nosokomial übertragen (Lemmen 2015).
41.8.2.2 Kontrolle der Symptome
Der Patient wird auf neurologische Symptome hin kontrolliert:
-
Bewusstseinslage (Gefahr der Aspiration)
-
Reaktion auf Ansprache
-
Kopfschmerz
-
Nackensteife
-
erhöhter intrakranieller Druck (Hirndruckzeichen an Pupillenweite)
-
evtl. ▶ epileptischer Anfall
Ebenso kontrolliert werden die durch die Sepsis veränderten Kreislaufverhältnisse:
-
Vitalfunktionen (Blutdruck, Puls, Temperatur)
-
Hautbeobachtung auf ▶ Petechien.
41.8.2.3 Intensivpflegerische Betreuung
Besonders berücksichtigt werden dabei:
-
Licht- und Geräuschempfindlichkeit: Der Patient liegt in einem leicht abgedunkelten Zimmer; die Pflegeatmosphäre sollte ruhig sein.
-
Erhöhter Hirndruck: Evtl. ist als hirndrucksenkende Maßnahme die Oberkörperhochlagerung (30°) angebracht.
-
Fieber: Eine erfrischende Waschung mit entsprechenden Pflegezusätzen ▶ senkt die Temperatur.
-
Berührungsempfindlichkeit: Bei allen Maßnahmen der Dekubitus- und Kontrakturenprophylaxe und beim Positionieren sollte der Körper ruhig und sanft angefasst werden. Das gilt auch bei diagnostischen Maßnahmen, z.B. einer Liquorpunktion.
41.9 Pflege von Patienten mit Atemwegs-Tuberkulose
41.9.1 Medizinischer Überblick
41.9.1.1 Definition
Definition
Tuberkulose (TB) gilt als generalisierte oder auf ein Organ begrenzte Infektionserkrankung, am häufigsten durch Mycobacterium tuberculosis ausgelöst. Unterschieden wird die pulmonale TB von der extrapulmonalen Form, die andere Organsysteme (z.B. Niere, Knochen oder Lymphknoten) betrifft.
Pulmonale TB Es gibt 2 Formen der pulmonalen TB:
-
geschlossene TB (kann nur klinisch oder histologisch gesichert werden)
-
offene TB (der Tuberkuloseherd hat direkten Anschluss an die Bronchien, sodass Mikroben durch Husten übertragen und direkt nachgewiesen werden können)
41.9.1.2 Epidemiologie
Die Tuberkulose gewinnt zunehmend an Bedeutung. Bei ca. 2 Milliarden Menschen weltweit liegt eine latente TB-Infektion vor. Das sind mehr als bei jeder anderen behandelbaren Infektionskrankheit. Jedes Jahr erkranken Millionen Menschen neu an Tuberkulose.
Nachdem die TB-Fallzahlen in Deutschland mehrere Jahre stagniert hatten, stiegen sie in den vergangenen 3 Jahren wieder an: im Jahr 2015 auf 5.865 Fälle, nach 4.533 im Jahr 2014 und 4.325 im Jahr 2013 (RKI 2016).
Definition
Als latente TB-Infektion wird ein Kontakt mit TB-Mikroben mit Infektion bezeichnet. Geht die Immunkontrolle verloren, kann sie in eine aktive TB übergehen ( ▶ Abb. 41.7).
Gleichgewicht zwischen M. tuberculosis und dem Immunsystem (mod. n. Sitzmann 2007).
Abb. 41.7

Das Risiko, nach einer latenten TB-Infektion eine aktive TB zu entwickeln, ist besonders für Kleinkinder und immungeschwächte Personen (HIV-Infizierte) hoch. Auch nimmt die TB in multiresistenter Variante zu, d.h., viele Tuberkulostatika sind dann wirkungslos. Bedrohlich ist die Ausbreitung von 2 Resistenztypen:
-
MDR-TB (engl.: multi-drug-resistant tuberculosis) mit Resistenz gegen Isoniazid und Rifampizin
-
XDR-TB (engl.: extensively drug-resistant tuberculosis) mit weiteren Resistenzen
Die Sterberate ist erheblich erhöht. Ursache für diese Entwicklung sind z.B. globale Mobilität, Armut, Krieg, Flucht und Migration. Bedeutsam ist, dass Gentests der Erreger zeigen, dass sich viele Menschen erst auf der Flucht sowie in der Enge der Flüchtlingslager infizieren. Der Beweis kann mit dem genetischen Fingerabdruck geführt werden (Anonym 2016).
41.9.1.3 Ursachen
In erster Linie sind enge Kontaktpersonen von Erkrankten für eine Ansteckung gefährdet, vor allem bei einem längeren oder wiederholtem Kontakt. Das Ansteckungsrisiko nach einmaligem, kurzem Kontakt ist dagegen sehr gering. Die Ansteckung erfolgt meist unbemerkt durch aerogene Infektion, d.h. infolge einer Inhalation kleinster Tröpfchenkerne mit M. tuberculosis bis in die Alveolen (primäre TB). Bei gesunden Erwachsenen kontrolliert meist das Immunsystem die Bakterien und es kommt zu einer latenten Infektion. Wenige der Infizierten erkranken überwiegend pulmonal an TB, betroffen sind v.a. Menschen mit reduzierter Abwehrlage ( ▶ Abb. 41.7).
41.9.1.4 Symptome
Die Erstinfektion verläuft gewöhnlich symptomlos und wird, wenn überhaupt, meist zufällig entdeckt. Die TB-Mikroben siedeln sich in der Lunge an. Nach Jahren oder Jahrzehnten ist eine Reaktivierung latenter Herde möglich. Diese ist u.a. abhängig von
-
der Virulenz der Keime,
-
der Infektionsdosis,
-
der Abwehrlage und
-
dem Alter des Infizierten.
Dabei sind eher unspezifische Symptome typisch:
-
Husten
-
Fieber (z.T. nur mild)
-
Nachtschweiß
-
Inappetenz, Gewichtsverlust
-
Leistungsschwäche
Meistens kommt es zu einer Zerstörung von Lungengewebe und zur Bildung einer Kaverne (geschlossene TB, ▶ Abb. 41.8). Gewinnt diese Anschluss ans Bronchialsystem, wird der Patient infektiös (offene TB). Der Auswurf beim Husten wird produktiver und blutig.
Rundherde bei pulmonaler TB, hier direkt im Präparat zu sehen.
Abb. 41.8
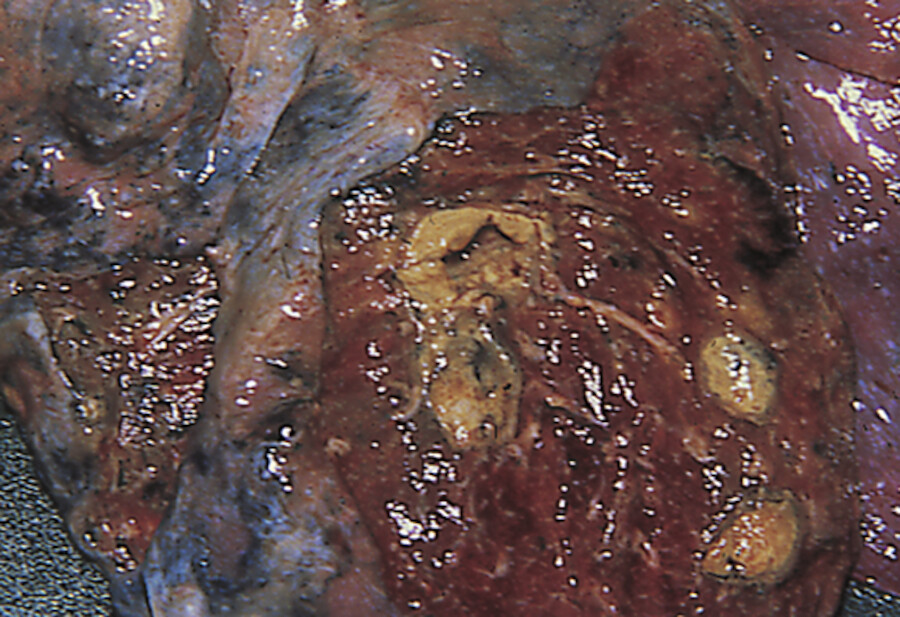
41.9.1.5 Diagnose
Die Diagnose einer TB ist aufgrund der eher unspezifischen Symptome oft schwierig. Die frühe Diagnose ist jedoch wichtig, um TB-Fälle zu reduzieren und Mitarbeiter zu schützen.
Untersuchungsmethoden sind:
-
intrakutaner Tuberkulinhauttest nach Mendel-Mantoux (s.u.)
-
Interferon-γ-Test (IGRA, Bestimmung der Freisetzung von Gamma-Interferon)
-
Röntgendiagnostik (Thoraxübersichtsaufnahme)
Untersuchungsmethoden zur Verlaufsbeurteilung sind bakteriologische Diagnostik (Mikroskopie, Kultur, Nukleinsäurenachweis = PCR ) aus Sputum, Urin, Bronchialsekret, Magensaft u.a.
Mendel-Mantoux-Test Für den Test wird ein Extrakt aus Tuberkelbakterien, d.h. Eiweißbestandteile der Bakterienzelle, ▶ intrakutan injiziert. Es wird die immunologische (Spät-)Reaktion des Körpers auf das Tuberkulin getestet. Als Hinweis, ohne Beweis auf eine Infektion, entsteht ein kutanes Granulom in Form einer geröteten Papel (> 6 mm Durchmesser).
41.9.1.6 Therapie
Üblich ist eine Kombination von verschiedenen Tuberkulostatika. Als Erstrangmedikamente werden Rifampicin, Isoniazid, Pyrazinamid und Ethambutol eingesetzt. Sie haben eine Vielzahl von Nebenwirkungen, z.B. Transaminasenanstieg, Allergien, Gelenkschmerzen, Magen-Darmbeschwerden, Polyneuropathie. Auf dem Beipackzettel sind weitere Beobachtungskriterien ausgeführt. Seit 2014 sind in der EU die Wirkstoffe Bedaquilin und Delamanid zugelassen, die kombiniert mit anderen Substanzen bei multiresistenten TB-Isolaten angewandt werden.
Bei wirkungsvoller Therapie gelten Patienten nach 2–3 Wochen als nicht mehr infektiös (RKI 2013). Die Medikamente müssen aber in wechselnden Kombinationen über mind. 6 Monate eingenommen werden, bei Therapie einer multiresistenten Tuberkulose (MDR-TB) über mind. 120 Wochen (Seybold 2016).
Fallbeispiel
Die junge Frau litt seit April 2008 unter Husten, ohne Besserung auch nach Monaten. Die Hausärztin tippte auf eine verschleppte Erkältung. Eigenständig suchte die Frau im August eine HNO-Ärztin auf, ohne Befund überwies diese sie an einen Lungenfacharzt. Nach Allergie- und Lungenfunktionstest ohne Befund schickte er die Frau im September 2008 zum Röntgen, ohne auffälligen Befund. Der Husten blieb und wurde schlimmer. Sie schwitzte nachts sehr und hatte tagsüber Fieber. Die wieder aufgesuchte Hausärztin riet zu einer Gastroskopie, inzwischen war es Juli 2009. Unter Säurehemmern litt die Frau weiter unter Hustenattacken, die Brechreiz auslösten. Öfter musste sie sich krankmelden, da sie ständig schwächer wurde. Nach einem Umzug (Juli 2009) suchte sie einen neuen Hausarzt auf, der sie ohne Untersuchung mit Kortison auf Asthma behandelte – sie bekam noch weniger Luft.
Der Husten des Freundes wurde innerhalb von 2 Wochen durch Röntgenbild mit „merkwürdigen Kringeln“ im oberen Lungenbereich differenziert. Als Kontaktperson musste sie sofort in die TB-Klinik, wo sie insgesamt 115 Tage hospitalisiert, über 410 Tage mit 2.202 Tabletten behandelt wurde (RKI 2016).
Prävention und Gesundheitsförderung
Das höchste berufliche TB-Risiko besteht für Mitarbeiter bei Tätigkeiten, die an aktiv Tuberkulose-Erkrankten, insbesondere vor der Diagnose, durchgeführt werden, z.B.
-
Sputuminduktion (Inhalation)
-
Bronchoskopie
-
Intubation
-
Beatmung (beim Absaugen).
Meldepflicht besteht nach § 6.1 IfSG bei Erkrankung und Tod, bei Altenheimeinweisung besteht Nachweispflicht auf TB-Freiheit (§ 36.4 IfSG).
41.9.2 Pflege- und Behandlungsplan
41.9.2.1 Maßnahmen zur Infektionsprophylaxe
Infizierte Personen husten eine große Zahl von Mykobakterien ab und schleudern dabei Tröpfchen mit großem Durchmesser in die Umgebung. Die Infektiösität großer, ausgehusteter Tröpfchen ist jedoch gering. Die Tröpfchen sedimentieren und verdunsten. Zurück bleiben kleinste Tröpfchenkerne (Durchmesser <5 μm) mit Infektionskeimen. Dank ihrer wachsartigen Oberfläche können die Mykobakterien das Austrocknen überstehen und in der Luft bis zu 24 Std. schweben. Die Wahrscheinlichkeit, diese Tröpfchenkerne mit TB-Bakterien in die Alveolen zu inhalieren und sich zu infizieren, steigt mit der Dauer des Aufenthalts in Räumen mit bakteriell kontaminierter Luft und/oder der Anzahl der Mikroben in der eingeatmeten Luft (aerogene Infektion).
Daraus lassen sich 2 Pflegeprinzipien ableiten:
Dispositionsprophylaxe
Säuglinge, Kleinkinder, ältere Menschen und Patienten mit reduzierter Immunabwehr haben ein höheres Erkrankungsrisiko. Auch untergewichtige Menschen (durch Armut, Alkoholismus, maligne Tumoren) sind stärker infektionsgefährdet. Durch die Förderung hygienischer und positiver Lebensbedingungen soll das Infektionsrisiko möglichst gering gehalten werden.
Eine Maßnahme zur Umgebungsgestaltung ist z.B. die häufige Raumlufterneuerung, indem das Patientenzimmer bei geschlossener Zimmertür gelüftet wird.
Expositionsprophylaxe
Im Vordergrund steht die Reduktion des direkten und körpernahen Kontaktes mit dem TB-Kranken:
-
Patienten im Einzelzimmer isolieren (nur bei offener Lungentuberkulose!).
-
Als Mund-Nasen-Schutz eine Partikelmaske der Schutzstufe FFP2 tragen (besonders beim Umgang mit mikrobenhaltigen Körpersekreten, ▶ Abb. 41.9).
-
Patienten zu Hustenetikette („cough etiquette“) anhalten, d.h. den Patienten auffordern, beim Husten den Mund mit einem Papiertaschentuch zu bedecken → damit wird die Freisetzung respiratorischer Tröpfchen vermindert.
-
Bezugspflege (begrenzte Zahl von Mitarbeitern, die das Isolierzimmer betreten) leisten.
Ist eine Einzelzimmer-Isolation nicht möglich, müssen Patienten mit identischem Resistenzmuster zusammen betreut werden (Gruppenisolierung).
FFP2 Maske.
Abb. 41.9 Ein höherwertiger Atemschutz (Partikelmaske der Schutzstufe FFP 2) soll bei der Pflege von Patienten mit offener Lungen-TB getragen werden (hier ohne Ausatemventil).
(Foto: A. Fischer, Thieme)

41.9.2.2 Maßnahmen zur Steigerung der Compliance
Eine ambulante medikamentöse Behandlung ist möglich, wenn es der Krankheitsverlauf, die sozialen Verhältnisse und die Patienten-Compliance zulassen. Compliance bedeutet die Bereitschaft eines Patienten zur Mitarbeit an seiner Genesung. Da eine unregelmäßige Medikamenteneinnahme zur Selektion resistenter Keime führt, ist es besonders wichtig, dass die Patienten ihre Medikamente trotz der erheblichen Nebenwirkungen korrekt einnehmen.
Bestehen nur geringe Zweifel daran, sollte die Einnahme überwacht werden („directly observed therapy“, DOT). Insbesondere bei Menschen ohne festen Wohnsitz, Menschen mit Alkoholabusus und älteren Menschen ist jedoch eine kurze stationäre Therapie vorzuziehen.
41.10 Pflege von Patienten mit HIV/AIDS
41.10.1 Medizinischer Überblick
41.10.1.1 Definition
HIV ist die Abkürzung für die englische Bezeichnung „Human Immunodeficiency Virus“ (dt.: menschliches Immunschwäche-Virus). HIV wurde erstmals 1983 in den USA als Verursacher der Immunschwäche AIDS nachgewiesen.
AIDS kürzt die englische Bezeichnung „Acquired Immuno-Deficiency Syndrome“ ab (dt.: erworbenes Immunschwäche-Syndrom). Von AIDS wird gesprochen, wenn ein HIV-seropositiver Mensch ▶ bestimmte Erkrankungen entwickelt, die auf eine HIV-bedingte Immunschwäche zurückzuführen sind.
41.10.1.2 Epidemiologie
Weltweit haben sich in den letzten 35 Jahren mehr als 77 Millionen Menschen mit HIV infiziert und schätzungsweise 37 Millionen sind an AIDS gestorben, sodass Ende 2015 etwa 40 Millionen Menschen mit HIV lebten. 2016 infizierten sich wieder 2 Millionen Menschen neu (UNAIDS 2016). In Deutschland lebten Ende 2014 etwa 83 400 Menschen mit HIV, wobei sich im Jahr 2014 etwa 3200 Menschen neu infiziert hatten (RKI 2014).
41.10.1.3 Übertragungswege
HIV kann übertragen werden durch:
-
ungeschützten Sexualverkehr
-
Gebrauch von infizierten Kanülen
-
Schwangerschaft, Geburt und Stillen
-
Blutkonserven und Nadelstichverletzungen
HIV kann (trotz hartnäckiger Gerüchte!) nicht durch Küssen, Beißen, Speichel, Tränen, Schweiß, Urin, Insekten, Luft oder Wasser, in Restaurants oder auf Toiletten übertragen werden.
Ungeschützter Geschlechtsverkehr HIV kann beim Sexualverkehr durch Sperma, Scheidenflüssigkeit oder Blut übertragen werden. Durch die entstehende mechanische Reibung beim ungeschützten Anal- oder Vaginalverkehr sind die Risiken am größten. Das Ansteckungsrisiko beim Vaginalverkehr ist für Frauen aufgrund der großen Schleimhautoberfläche der Vagina wesentlich höher als für Männer. Beim Oralverkehr besteht ein geringeres Risiko, wenn Viren in Blut oder Genitalflüssigkeit im Mund durch offene Wunden in die Blutbahn gelangen.
Merke
Als wichtigste Präventionsmaßnahme vor sexuell übertragbaren Krankheiten gilt nach wie vor Safer Sex (Kondom, Femidom, Dental dam).
Wenn unter der ▶ antiretroviralen Therapie (ART) die Viruslast unter der Nachweisgrenze liegt, dann senkt dies die Übertragungsrate von HIV um 96 % (Cohen et al. 2011). Damit verhindert eine effektive HIV-Therapie eine sexuelle Übertragung von HIV, auch bei ungeschütztem Verkehr (Nationaler AIDS Beirat 2012). Das Problem ist allerdings, dass hierzu eine hohe Therapietreue erforderlich ist, um die Viruslast dauerhaft unter der Nachweisgrenze zu halten.
Prävention und Gesundheitsförderung
Eine ART bietet keinen Schutz vor anderen sexuell übertragbaren Krankheiten und sollte daher nicht als Ersatz für Safer Sex, sondern als zusätzliche Präventionsmaßnahme betrachtet werden.
Gebrauch infizierter Kanülen Der Übertragungsweg verläuft über gemeinsam benutzte Injektionsbestecke. Wichtigste Prävention ist hier der Gebrauch von sterilen Spritzen und Kanülen.
Schwangerschaft, Geburt und Stillen Eine HIV-Übertragung von der Mutter auf das Kind kann während der Schwangerschaft, unter der Geburt und beim Stillen stattfinden. Mit den Möglichkeiten der ▶ antiretroviralen Therapie, der geplanten Kaiserschnittentbindung (falls unter antiretroviraler Therapie die Viruslast nicht ausreichend unterdrückt wird) und dem Verzicht auf das Stillen lässt sich das Übertragungsrisiko auf 1 – 2 % senken. Bei einer nicht nachweisbaren Viruslast ist eine vaginale Geburt eine risikoarme Option. Ohne Schutzmaßnahmen liegt das Risiko bei 17 – 20 % (European Collaborative Study 2005).
Blutkonserven und Nadelstichverletzungen Beide Übertragungswege sind als extrem gering zu werten. Seit 1985 ist es möglich, Blutkonserven auf HIV-Antikörper zu testen. Blutspendeempfänger gehen seither nur noch ein verschwindend geringes HIV-Infektionsrisiko von 0,5 : 1 Million ein (Flegel et al. 1996). Bei einer Nadelstichverletzung beträgt das HIV-Infektionsrisiko etwa 0,3 % und ist damit deutlich geringer als das Risiko einer Infektion mit Hepatitis C (3 %) oder mit Hepatitis B (über 30 %, bei fehlendem Impfschutz) (Wicker et al. 2007).
41.10.1.4 Prävention
Safer Sex Safer Sex (geschützter Geschlechtsverkehr) ist die wichtigste Maßnahme zur Vorbeugung gegen HIV und andere sexuell übertragbare Krankheiten. Safer Sex beginnt mit der richtigen Anwendung von Kondomen oder Femidomen und reicht bis zur Vermeidung riskanter Sexualpraktiken. Neben Safer Sex wird die männliche Beschneidung propagiert. Mikrobizide (chemische topische Mittel zur Verhinderung der HIV-Infektion) und Schutzimpfungen befinden sich im Stadium der Entwicklung.
HIV-Testung und ggf. sofortige Therapie Die bedeutsamste Präventionsstrategie liegt in der von der WHO seit 2015 propagierten universellen HIV-Testung und der sofortigen medikamentösen Therapie bei positiver Diagnose, unabhängig vom Krankheitsstadium (WHO 2016). Da sowohl HIV-Positive als auch deren Sexualpartner von früher ART profitieren, haben die WHO und UNAIDS das Ziel gesetzt, dass bis 2020 weltweit 90% aller HIV-Positiven ihren Status kennen, davon 90% medizinisch betreut werden und davon 90% eine nicht nachweisbare Viruslast unter ART erreichen.
Prä-Expositionsprophylaxe (PrEP) Die vorbeugende Einnahme von antiretroviralen Therapien, die sog. Prä-Expositionsprophylaxe (PrEP), hat sich in Studien als wirksam gezeigt. Allerdings ist eine PrEP mit Nebenwirkungen behaftet, verschreibungspflichtig und teuer. In Deutschland wird sie bald als Ergänzung – nicht in Konkurrenz – zu den obigen Präventionsmaßnahmen für Menschen mit hohem Infektionsrisiko zugelassen. Trotz intensiver Forschung stehen bisher weder eine wirksame Impfung noch effektive topische Mikrobizide zur Verfügung.
41.10.1.5 Immunsystem und Pathophysiologie
Um sich vor dem Eindringen von Fremdkörpern und Mikroorganismen (z. B. Bakterien, Viren, Pilzen) zu schützen, verfügt der menschliche Körper über ein kompliziertes Immunsystem. Es setzt sich zusammen aus der unspezifischen und der spezifischen Abwehr.
Unspezifische Abwehr
Die unspezifische Abwehr kann Eindringlinge nicht nach ihrer Gefährlichkeit für den Organismus unterscheiden. Granulozyten und Makrophagen als Hauptbeteiligte an der angeborenen Abwehr versuchen körperfremde Teilchen aufzunehmen (= Phagozytose) und abzubauen. Gelingt ihnen das nicht, kommt die spezifische Abwehr mit einer „maßgeschneiderten“ Abwehrreaktion zu Hilfe.
Spezifische Abwehr
Die spezifische Abwehr ist gekennzeichnet durch ihre Fähigkeit, ein immunologisches Gedächtnis aufzubauen. Hauptbeteiligte der spezifischen Abwehr sind die Lymphozyten. Lymphozyten, die im Knochenmark reifen, werden in Anlehnung an das englische Wort „bone“ (= Knochen) B-Lymphozyten genannt. Jene, die sich im Thymus ausdifferenzieren, werden als T-Lymphozyten bezeichnet.
B-Lymphozyten Sie stellen nach dem Schlüssel-Schloss-Prinzip Antikörper her, die genau an bestimmte körperfremde Strukturen (= Antigene) passen. Das Erkennen von Antigenen erfolgt über bestimmte Rezeptoren an der Zelloberfläche, sog. „Cluster of Differentiation“ (abgekürzt „CD“, dt.: Block der Unterscheidung).
T-Lymphozyten Sie lassen sich grob in 3 Klassen unterteilen, die auf verschiedene Aufgabenbereiche spezialisiert sind:
-
T-Helferzellen (auch CD 4-Zellen genannt, weil sie zum Erkennen von Antigenen auf ihrer Oberfläche den CD 4-Rezeptor tragen): Sie erkennen Krebszellen und körperfremdes Material und geben die Information an die B-Lymphozyten weiter, die daraufhin spezifische Antikörper produzieren.
-
T-Suppressorzellen (auch CD 8-Zellen genannt, weil sie auf ihrer Oberfläche den CD 8-Rezeptor tragen): Sie unterdrücken (supprimieren) die Bildung von Antikörpern sowohl bei einem Überschießen der Immunreaktion als auch nach Abklingen der Erkrankung.
-
Natürliche Killerzellen: Sie erkennen und vernichten körpereigene, von Viren befallene Zellen, um die Vermehrung dieser Viren zu verhindern.
Pathophysiologie
HIV gehört zu der Familie der Lentiviren (Viren mit langer Latenzzeit), einer Untergruppe der Retroviren. Bei diesen ist nicht DNA (Desoxyribonukleinsäure), sondern RNA (Ribonukleinsäure) Träger der Erbsubstanz. HIV zerstört langsam das spezifische Immunsystem, denn HIV kann in alle Körperzellen eindringen, die in ihrer Zellwand den CD 4-Rezeptor besitzen, somit auch die T-Helferzellen. Ins Innere der Zelle gelangt, benutzt HIV die DNA der Wirtszelle, um seine eigene RNA zu replizieren und weitere HI-Viren zu produzieren ( ▶ Abb. 41.10).
Pathogenese der HIV-Infektion.
Abb. 41.10 1. Bindung und Fusion. HIV bindet sich an den CD 4 Rezeptor an der Oberfläche der T-Helferzelle an und fusioniert mit der Zelle. 2. Infektion. HIV pentriert die Zelle und setzt seine virale RNA frei. 3. Reverse Transkription. Der einzelne RNA-Strang wird mit Hilfe der reversen Transkriptase zu einem DNA-Strang verdoppelt. 4. Integration. Die HIV-DNA wird mit Hilfe der Integrase in die DNA der T-Helferzelle in den Zellkern eingebaut. 5. Replikation. HIV repliziert sich in großer Anzahl innerhalb der T-Helferzelle. 6. Zusammensetzung und Knospung. Die zunächst unreifen HI-Viren werden aus der T-Helferzelle herausgeschleust und reifen mithilfe der Protease zu infektionsfähigen Viren heran. Verschiedene in der HIV-Therapie eingesetzte Medikamente greifen in den Vermehrungsprozess des Virus ein (in roter Schrift).
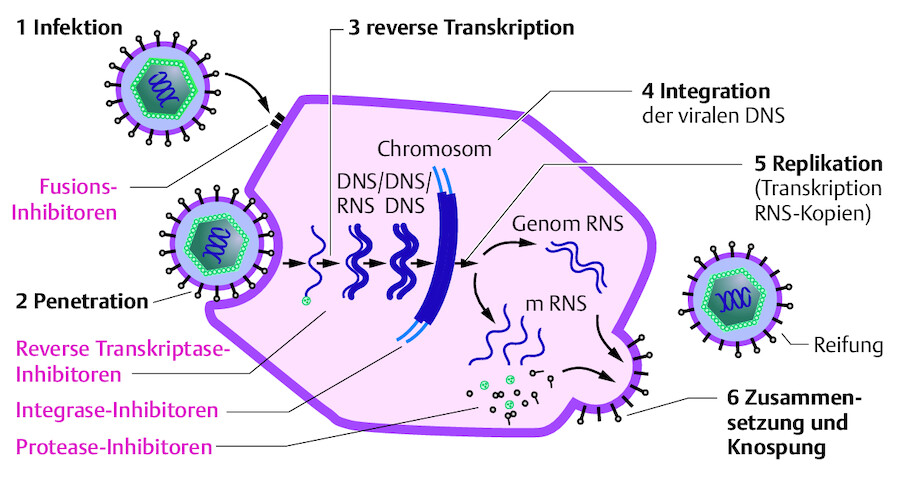
Die langsame Zerstörung der Immunabwehr kommt dadurch zustande, dass HIV die T-Helferzellen für seine Vermehrung benutzt. Die führt zu einem allmählichen Verlust der CD 4-Zellen und einer fortschreitenden Immunschwäche. Das Gleichgewicht zwischen Virenproduktion und -elimination durch das Immunsystem kann sich über Jahre hinweg halten (Latenzzeit). Gewinnt die Virenproduktion die Oberhand, können sich Krankheitserreger ausbreiten und weitere Erkrankungen verursachen.
41.10.1.6 Diagnostik und Verlaufskontrolle
Eine HIV-Infektion wird mit HIV-Antikörper-Tests im Serum nachgewiesen:
-
1. Blutabnahme: Suchtest mit HIV-ELISA (Enzyme-Linked Immunoabsorbent Assay, ▶ Abb. 41.11) oder mit dem HIV-Schnelltest, bei positivem Befund Kontrolle durch Bestätigungstest (Westernblot-Test).
-
2. Blutabnahme: bei positivem Bestätigungstest zum Ausschluss von Verwechslungen. Der ELISA-Suchtest und der Westernblot-Test haben zusammen eine Genauigkeit von über 99 %.
ELISA-Suchtest.
Abb. 41.11 Zum Nachweis von HI-Viren wird der ELISA-Test eingesetzt. Sind Antikörper im Patientenblut enthalten, reagiert der Farbindikator darauf mit einem Farbumschlag. Befinden sich keine Antikörper im Blut, bleibt der Farbindikator farblos. Da der ELISA-Suchtest in 1 – 5 von 100 000 Fällen falsch positiv ausfällt, muss ein positives Ergebnis mit dem Westernblot-Test bestätigt werden.
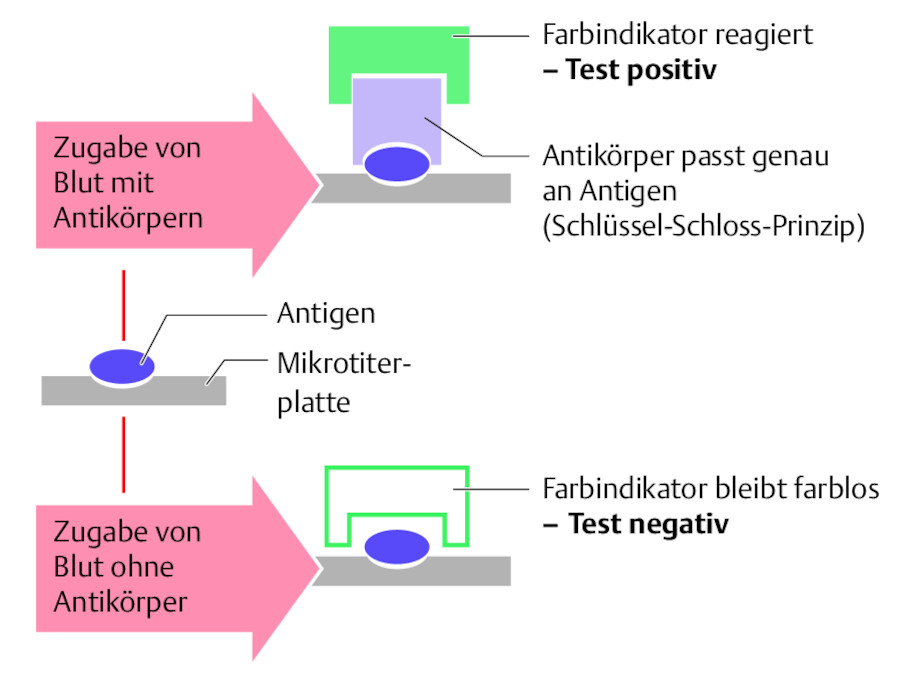
Merke
Jeder Patient muss vorab darüber informiert sein, dass er auf HIV getestet wird. Ergebnisse von HIV-Tests sollten nie allein auf der Basis eines positiven Suchtests und möglichst nur von Ärzten mitgeteilt werden Bei negativem Testergebnis ist immer daran zu denken, dass erst 3 – 12 Wochen nach der Infektion Antikörper im Blutserum nachweisbar sind (Serokonversion).
Zur Verlaufskontrolle der HIV-Infektion werden die CD 4-Zellzahl und die Viruslast regelmäßig bestimmt.
CD 4-Zellzahl Diese sagt etwas darüber aus, wie viele T-Helferzellen dem Körper für die Immunabwehr zur Verfügung stehen, und dient zur Stadieneinteilung der HIV-Infektion ( ▶ Tab. 41.12 ).
|
CD 4-Zellen/μl |
klinische Kategorie A (symptomlos) |
klinische Kategorie B (Symptome, kein AIDS) |
klinische Kategorie C (AIDS) |
|
Kategorie 1: > 500 |
A1 |
B1 |
C 1 |
|
Kategorie 2: 200 – 499 |
A2 |
B2 |
C 2 |
|
Kategorie 3: < 200 |
A3 |
B3 |
C 3 |
Viruslast Diese misst die Anzahl der Viruskopien im Blutplasma. Unter einer effektiven HIV-Therapie sinkt die Viruslast im Blut unter die Nachweisgrenze.
Praxistipp
Obwohl es sich um Laborwerte handelt und dafür der Arzt zuständig ist, werden Patienten häufig das Gespräch mit Pflegenden über dieses Thema suchen. Letztere sollten sich über aktuelle Laborwerte zur Verlaufskontrolle informieren.
41.10.1.7 Therapie
Die Einteilung der HIV-Infektion in Stadien erfolgt nach der US-amerikanischen Gesundheitsbehörde CDC (Center of Disease Control) nach Symptomkategorien und nach CD 4-Zellzahlen ( ▶ Tab. 41.12 ).
Bei Patienten mit einer HIV-Infektion sollte so schnell wie möglich eine antiretrovirale Therapie erfolgen, weil damit ein besserer Krankheitsverlauf, weniger Therapienebenwirkungen und ein Schutz vor einer HIV Übertragung verbunden sind.
Fällt die CD 4-Zellzahl unter 200/μl, ist die Prophylaxe gegen ▶ opportunistische Infektionen von Bedeutung, und zwar auch dann, wenn bereits eine antiretrovirale Therapie durchgeführt wird.
Praxistipp
Die Entscheidung für den Beginn einer antiretroviralen Therapie liegt immer beim Patienten. Der Erfolg der Behandlung ist maßgeblich von der regelmäßigen Medikamenteneinnahme (Adherence) abhängig. Wegen der hohen Mutationsfähigkeit des HIV kann die unregelmäßige Medikamenteneinnahme rasch zu Resistenzen führen. Dadurch werden zukünftige Behandlungsoptionen eingeschränkt. Pflegende können helfen, Nebenwirkungen und Schwierigkeiten bei der Einnahme einer antiretroviralen Therapie zu erkennen und den Patienten bei der Medikamentenverabreichung unterstützen.
Antiretrovirale Therapie (ART)
Der Durchbruch der ART erfolgte 1996 mit der Entdeckung, dass durch die Kombination mehrerer antiretroviraler Medikamente aus verschiedenen Substanzklassen das Fortschreiten einer HIV-Infektion dauerhaft kontrolliert werden kann. Derzeit stehen 4 Substanzklassen zur Verfügung, die viruseigene Enzyme hemmen und unterschiedliche Schritte der HIV-Vermehrung blockieren ( ▶ Abb. 41.10):
-
Fusionsinhibitoren hemmen die Fusion.
-
Entryinhibitoren hemmen den Eintritt.
-
Nukleosidale/Nichtnukleosidale Reverse-Transkriptase-Inhibitoren (NRTI/NNRTI) hemmen die reverse Transkription.
-
Integrase-Inhibitoren hemmen die Integration.
-
Protease-Inhibitoren (PI) hemmen die Maturation (Reifung).
Die heute übliche ART beinhaltet die gleichzeitige Gabe von mindestens 3 Wirkstoffen aus einer oder mehreren Substanzklassen.
Potenzielle Nebenwirkungen Hierzu gehören u.a.:
-
Diarrhö und Übelkeit
-
periphere Polyneuropathie
-
Anämien
-
allergische Reaktionen (manchmal lebensbedrohlich)
-
Leberfunktionsstörungen
-
Nierensteine und Pankreatitis
-
Alpträume und Schlafstörungen
-
Wesensveränderungen
-
Depressionen oder Psychosen
Lipodystrophie-Syndrom Eine besonders gefürchtete Langzeitnebenwirkung von ART ist das Lipodystrophie-Syndrom. Es ist verbunden mit einer Umverteilung des Körperfettgewebes: dünner werdenden Extremitäten, Zunahme des Brust- und Bauchumfangs, Verlust des Wangenfettes, manchmal auch Vollmondgesicht und Büffelnacken. Diese äußerliche Stigmatisierung wird häufig begleitet von Stoffwechselstörungen.
41.10.2 Pflege- und Behandlungsplan
Die Aufgaben der Pflegenden richten sich nach dem jeweiligen Stadium, in dem sich der Betroffene befindet. Sie sind den individuellen Bedürfnissen und dem Allgemeinzustand anzupassen und können schwanken (s. ▶ Tab. 41.12 ).
41.10.2.1 Pflegeschwerpunkte bei asymptomatischer HIV-Infektion (Stadium A)
In der oft langen Zeit der symptomlosen HIV-Infektion steht die psychologische Betreuung im Vordergrund. Besonders in der ersten Zeit nach dem Testergebnis und in weiteren Krisensituationen braucht der Betroffene professionelle und emotionelle Unterstützung. Schon allein der Stress der Diagnose kann sich negativ auf das Immunsystem auswirken.
Prävention und Gesundheitsförderung
Durch einige einfache Regeln kann das Immunsystem positiv beeinflusst werden. Hierzu zählen insbesondere
-
eine regelmäßige Tagesstruktur mit ausgewogenen Mahlzeiten,
-
ausreichend Schlaf und
-
körperliche Bewegung.
Übertriebenes Sonnenbaden, Rauchen oder Alkohol schwächen das Immunsystem.
41.10.2.2 Pflegeschwerpunkte bei symptomatischer HIV-Infektion (Stadium B)
Wenn Symptome auftreten, die auf eine bereits vorhandene Schwächung des Immunsystems hinweisen, jedoch nicht zu AIDS definierenden Erkrankungen gehören, muss in der Pflege einerseits die Beobachtung intensiviert, andererseits der Patient verstärkt zur Selbstbeobachtung angeleitet werden.
Praxistipp
Erfahrungsgemäß müssen Sie den Patienten konkret nach Veränderungen fragen. Oft denken sich die Patienten nichts dabei, wenn Kleinigkeiten auftreten, wie z. B. Hautpilz zwischen den Zehen.
Um Symptome wie Hautveränderungen, Soor, Gewichtsverlust, Fieber oder Durchfall frühzeitig zu erkennen, sind folgende pflegerische Maßnahmen von besonderer Bedeutung:
Hautkontrolle Die Pflegeperson achtet auf Hautveränderungen und Hautläsionen. Besonders häufig treten Hautpilze, Herpes simplex und Feigwarzen auf (auch im Intim- und Analbereich). Herpeserkrankungen werden je nach Anordnung lokal oder systemisch mit Aciclovir behandelt. Die Wundheilung der durch Herpes simplex hervorgerufenen Ulzerationen im Analbereich kann zusätzlich durch ein Eichenrindensitzbad einmal täglich unterstützt werden. Die Gründe für bestehenden Juckreiz bzw. wahrgenommene Kratzspuren sind abzuklären.
Kontrolle der Mundhöhle Auch kleine Veränderungen oder Läsionen der Mundschleimhaut sind zu behandeln. Eine äußerst gründliche Mundpflege und Reinigung der Zahnzwischenräume sollte zur Gewohnheit werden, um die Besiedelung mit Krankheitserregern möglichst zu vermeiden. Der Patient sollte sich über die Mundpflege auch ausführlich beim Zahnarzt beraten lassen.
Gewichtskontrolle Eine regelmäßige Kontrolle des Körpergewichts ist notwendig, um einer plötzlichen Gewichtsveränderung entgegenzuwirken.
Temperaturkontrolle Haben die Pflegende oder der Patient den Verdacht, dass die Körpertemperatur ansteigt, wird sie kontrolliert. Der Patient soll dafür sensibilisiert werden, wie er selbst Temperaturänderungen wahrnehmen kann.
Stuhlkontrolle Das Stuhlverhalten des Patienten wird abgeklärt (Diarrhö, Obstipation), um frühzeitig Medikamentennebenwirkungen oder Verschlechterungen des Allgemeinzustandes wahrzunehmen.
41.10.2.3 Pflegeschwerpunkte bei AIDS (Stadium C)
Das Vollbild AIDS ist durch das Auftreten bestimmter AIDS definierender Erkrankungen gekennzeichnet. Dazu gehören z. B. schwere Infektionserkrankungen (opportunistische Infektionen), bestimmte Malignome (Krebserkrankungen), ausgeprägte ungewollte Gewichtsabnahme (Wasting-Syndrom) und neurologische Erkrankungen, z. B. die HIV-Enzephalopathie.
Opportunistische Infektionen
Opportunistische Infektionen werden durch Erreger hervorgerufen, die dem gesunden Menschen nichts anhaben können, den Immungeschwächten aber krank machen. Zu den wichtigsten opportunistischen Erregern gehören Pneumocystis carinii, Toxoplasma gondii und Zytomegalieviren (CMV). Weitere Erreger sind z. B. Candida albicans mit Befall der Speise- oder Luftröhre, Herpes simplex mit generalisiertem Befall, Papova-Viren, die Erreger der progressiven multifokalen Leukenzephalopathie, Histoplasmose oder Kryptokokken außerhalb der Lunge, tuberkulöse oder atypische Mykobakterien, Mikro- oder Kryptosporidien beim Darmbefall.
Pneumocystis-carinii-Pneumonie (PCP) Die durch Pneumocystis carinii hervorgerufene PCP tritt in akuter und schwerer Form heute nur noch bei Menschen auf, die von ihrer HIV-Infektion nichts wissen oder nicht konsequent vorbeugen. Zeichen für eine PCP sind: Abgeschlagenheit, Belastungsdyspnoe, meist unproduktiver trockener Husten und Fieber. Die PCP verläuft unbehandelt tödlich, muss also frühzeitig erkannt und mit hoch dosierten i. v.-Antibiotikagaben und Pentacarinat-Inhalationen therapiert werden.
Toxoplasmose Toxoplasma gondii, der Erreger der Toxoplasmose, ist ein Parasit, der über rohes oder nicht durchgegartes Fleisch und durch Katzenkot übertragen wird. Er kann sich in allen Zellen des menschlichen Körpers entwickeln, bevorzugt aber die Nervenzellen des Gehirns. Bei Befall des ZNS können Symptome wie Kopfschmerzen, ▶ Meningismus, Bewusstseinsveränderungen, abnehmende Merkfähigkeit, Verwirrtheit, Sehstörungen oder Krampfanfälle auftreten. Die Anzeichen sind unspezifisch und gegen andere Ursachen abzugrenzen (z. B. HIV-Enzephalopathie, Zytomegalie). Möglich sind ebenso Verhaltensänderungen, die meist zuerst von Menschen des sozialen Umfelds bemerkt werden. Wird die Toxoplasmose frühzeitig erkannt und behandelt, bestehen gute Aussichten auf Heilung.
Zytomegalieviren (CMV) CMV kann sich in verschiedenen Organen ansiedeln. Betroffen sind meist die Retina und der Verdauungstrakt, seltener die Lunge und das Gehirn. Symptome sind ungewöhnliche Sinneswahrnehmungen (z. B. leuchtende Punkte oder „Schneetreiben“) und Sehstörungen (z. B. Sehschwäche, verminderte Sehschärfe). Trotz CMV-Therapie (z. B. Gancylovir oder Foscarnet) kommt es häufiger zu Sehverminderungen bis hin zur Erblindung.
Merke
Patienten mit einer CD 4-Zellzahl ≤ 200 μl sollten eine Primärprophylaxe (z. B. Cotrim forte) erhalten, welche gleichzeitig der Toxoplasmose und der PCP vorbeugt. Da eine unbehandelte CMV-Retinitis sehr rasch zur Erblindung führen kann, sind halb- bis vierteljährliche augenärztliche Kontrollen ratsam, bis sich das Immunsystem rekonstituiert hat.
Weitere AIDS-definierende Erkrankungen
Malignome Bestimmte Malignome, die in Verbindung mit einer HIV-Infektion gehäuft vorkommen, sind z. B. das Kaposi-Sarkom ( ▶ Abb. 41.12), maligne ▶ Lymphome oder Zervix-Karzinome. Aufgrund des erhöhten Tumorrisikos sollten HIV-positive Frauen halbjährlich zur gynäkologischen Vorsorgeuntersuchung.
Hauteffloreszenzen von bräunlich livider Farbe.
Abb. 41.12 Das Kaposi-Sarkom als opportunistische Erkrankung bei AIDS.
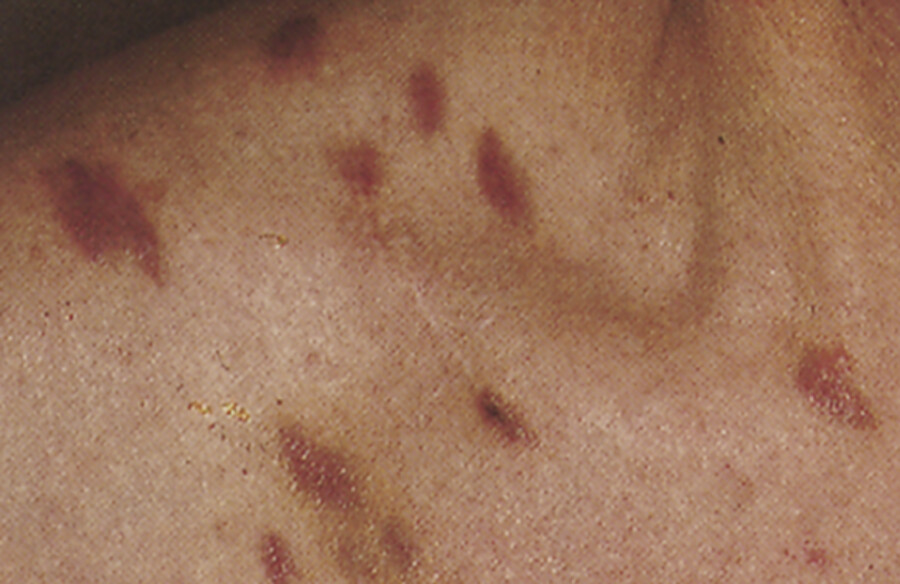
Waisting-Syndrom Beim Waisting-Syndrom verliert der Erkrankte mindestens 10 % des ursprünglichen Körpergewichts. Dabei leidet er unter ▶ Fieber und ▶ Durchfällen.
HIV-Enzephalopathie Der ZNS-Befall von HIV führt langfristig zu einer HIV-Enzephalopathie, die mit einer zunehmenden ▶ Demenz einhergeht. Erste Symptome, wie Vergesslichkeit und Depressionen, werden häufiger von den Angehörigen als von den Betroffenen selbst bemerkt.
Praxistipp
Informieren Sie sich zur speziellen Pflege der Erkrankungen, die bei HIV-Patienten auftreten können, und zu den sich daraus ergebenden Pflegeproblemen im jeweiligen Kapitel dieses Buches.
41.10.2.4 Besondere Anforderungen an die Pflege
Pflegepersonen, die noch nie mit HIV-Patienten zu tun hatten, fühlen sich oft überfordert. Sie glauben, sich mit der Infektionskrankheit HIV nicht auszukennen und stehen nicht selten Patienten gegenüber, die sich zu wahren HIV-Experten entwickelt haben und über viele therapeutische Maßnahmen in besonderem Maße selbstverantwortlich mitentscheiden.
Praxistipp
Profitieren Sie vom Wissensstand der Patienten und stehen Sie dazu, wenn Sie etwas nicht wissen. Nur so können Sie das Vertrauen der Patienten gewinnen bzw. behalten.
Situation des Patienten Bei neu an AIDS erkrankten Patienten kommt neben der Auseinandersetzung mit einer lebensbedrohlichen Erkrankung gleichzeitig oft die Auseinandersetzung mit der Diagnose hinzu. Mehr als die Hälfte der Patienten, die heute noch an AIDS erkranken, wissen nichts von ihrer HIV-Infektion. Die übrigen führten meist aus verschiedenen Gründen nicht rechtzeitig eine ART durch. Hier sind neben Pflegespezialisten auch „Pflegeuniversalisten“ gefragt, die ihre Fähigkeiten zur Beobachtung, ihr Einschätzungsvermögen und ihre Möglichkeiten ausschöpfen, interdisziplinär zu arbeiten.
Sahen sich Menschen mit HIV vor 1996 v. a. mit ihrer Endlichkeit, Sterben und Tod konfrontiert, müssen sie sich im Zeitalter wirksamer ART neue Lebensziele für eine unabsehbar lange und nicht mehr für eine unabsehbar kurze Zeitspanne schaffen.
Interdisziplinäre Zusammenarbeit Die Pflege von Menschen mit HIV und AIDS stellt eine besondere Herausforderung an die interdisziplinäre Zusammenarbeit mit Ärzten, Labor, Diagnostik, Physio-, Sozial-, und Psychotherapie, Seelsorge und Selbsthilfegruppen. Hier haben Pflegende eine vermittelnde Aufgabe. Die Arbeitsplanung muss flexibel an den oft wechselnden Betreuungsbedarf der Patienten angepasst werden. Ein offener, sensibler und vorurteilsfreier Umgang mit den Patienten ist dabei wichtig. Gefordert werden insbesondere eine gut entwickelte Beobachtungsfähigkeit, eine rasche Neueinschätzung der zu ergreifenden Pflegemaßnahmen und das Erkennen von übergeordneten Zusammenhängen, wenn gleichzeitig verschiedene Krankheitsbilder auftreten.
Berufsrisiko einer HIV-Infektion Jede Pflegeperson muss mit einem bestimmten Berufsrisiko in Form von Arbeitsunfällen leben. Statistisch gesehen sind Pflegende keinem größeren Risiko einer HIV-Infektion ausgesetzt als die Gesamtbevölkerung. Das persönliche Risiko einer beruflichen Infektionskrankheit wird minimiert, wenn gezielt die allgemein gültigen ▶ Hygieneschutzmaßnahmen angewandt und der direkte Kontakt mit Körperflüssigkeiten (z. B. durch das Tragen von Handschuhen) vermieden wird.
Merke
Die größten Risiken für beruflich bedingte Infektionskrankheiten sind Hektik bei der Arbeit und Unachtsamkeit.
Sollte sich eine Pflegeperson an infizierten Kanülen stechen oder ungeschützt mit infizierten Körperflüssigkeiten in Kontakt kommen, sollte sie sich an die Empfehlungen der Deutschen und Österreichischen AIDS-Gesellschaft halten ( ▶ Abb. 41.13).
Sofortmaßnahmen bei HIV-Exposition.
Abb. 41.13 Maßnahmen nach Stich- oder Schnittverletzung bzw. nach Kontamination von geschädigter Haut bzw. Schleimhaut mit HIV nach den Deutsch-Österreichische Empfehlungen (DAIG u. OEAIG 2014).
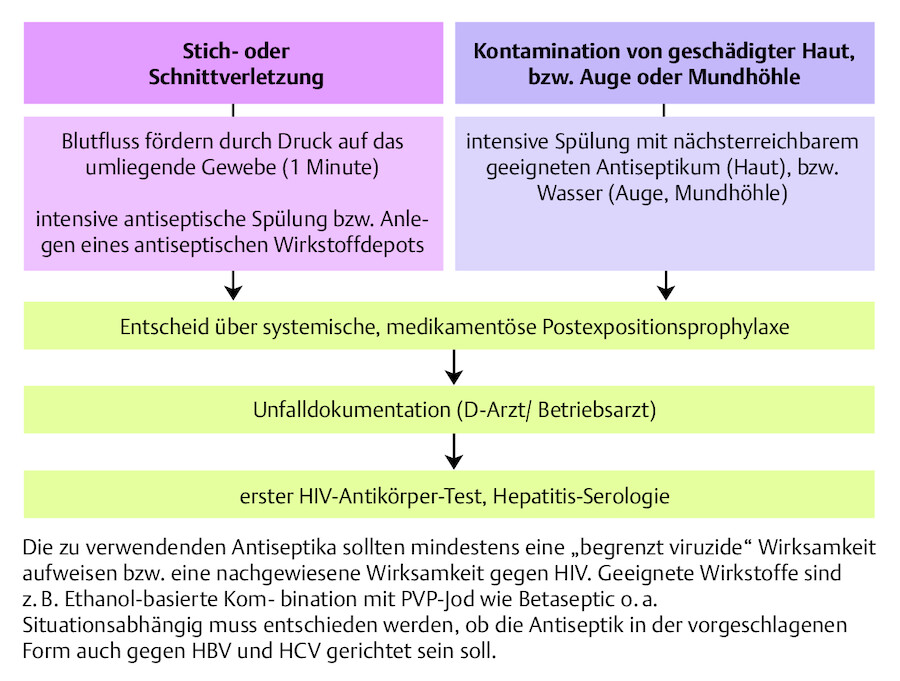
Prävention und Gesundheitsförderung
Falls die HIV-Infektion des Patienten zwar wahrscheinlich, jedoch nicht sicher ist, sollte ein HIV-Schnelltest erfolgen (Aufklärung, Einwilligung erforderlich!), der innerhalb weniger Stunden Klarheit bringen kann, sodass ggf. eine HIV-Postexpositionsprophylaxe durchgeführt werden kann.
Pflegende sollten nicht nur wissen, wie sie sich vor einer Ansteckung schützen können, sondern sie müssen auch ihre alltäglichen pflegerischen Handlungen perfekt beherrschen. Pflegepersonen sollen sich sicher fühlen bei den Verrichtungen im Zusammenhang mit unbehandelten HIV-positiven Patienten, damit die Beziehung nicht von Angst überschattet ist. Patienten spüren, wenn eine von Angst gehemmte Pflegeperson auf sie zukommt.
Es kann notwendig werden, verunsicherten Freunden oder Angehörigen eines HIV-positiven Menschen unbegründete Ängste zu nehmen und somit die Grundlage für eine ungestörte Beziehung zu ermöglichen. In ▶ Abb. 41.14 sind Kontakte dargestellt, die kein Übertragungsrisiko mit sich bringen.
Risikolose Kontakte.
Abb. 41.14 Im täglichen Leben sind viele Kontakte möglich, ohne sich mit HIV zu infizieren.

Isolationsmaßnahmen HIV-positive oder an AIDS erkrankte Patienten müssen nur isoliert werden, wenn sie an infektiösen Sekundärerkrankungen leiden. Dann werden Hygienemaßnahmen notwendig, wie sie bei infektiösen Patienten durchgeführt werden müssen, siehe Kapitel „Infektionsschutz“. Sind keine infektiösen Sekundärerkrankungen aufgetreten, kann der Patient z. B. im Mehrbettzimmer liegen und seine Wäsche wird normal versorgt. An AIDS Verstorbene dürfen dann auch normal aufgebahrt werden.
41.11 Lern- und Leseservice
41.11.1 Literatur
41.11.1.1 Übertragung von Infektionen
[2034] Ehlermann P. Fäkaler Mikrobiomtransfer bei Clostridium-difficile-Infektion. Krankenhaushygiene up2date 2016; 11: 155–165
[2035] Ewig S et al. Behandlung von erwachsenen Patienten mit ambulant erworbener Pneumonie und Prävention – Update 2016. Pneumologie 2016; 70: 151–200
[2036] IfSG 2016. Gesetz zur Verhütung und Bekämpfung von Infektionskrankheiten beim Menschen (Infektionsschutzgesetz – IfSG) vom 20.07.2000, zuletzt geändert am 18.07.2016. Im Internet: http://www.gesetze-im-internet.de/bundesrecht/ifsg/gesamt.pdf; Stand: 24.04.2017
[2037] RKI 2015. RKI-Fachwörterbuch Infektionsschutz und Infektionsepidemiologie. Berlin 2015, Im Internet:http://www.rki.de/DE/Content/Service/Publikationen/Fachwoerterbuch_Infektionsschutz.pdf?__blob=publicationFile, Stand: 20.12.2016
[2038] RKI 2016. Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2015. Datenstand: 01. 03.2016. Im Internet: https://www.rki.de/DE/Content/Infekt/Jahrbuch/Jahrbuch_2015.pdf?__blob=publicationFile; Stand: 20.12.2016
[2039] Schulze-Röbbecke R. Übertragung nosokomialer Infektionen und Prinzipien der Transmissionsprävention. Krankenhaushygiene up2date 2014; 9: 281–300
[2040] Sender R, Fuchs S, Milo R. Are We Really Vastly Outnumbered? Revisiting the Ratio of Bacterial to Host Cells in Humans. Cell 2016; 164: 337–340
[2041] Siegel JD et al. Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings 2007. Im Internet: http://www.cdc.gov/hicpac/pdf/isolation/isolation2007.pdf; Stand: 20.12.2016
[2042] Siegmund-Schultze N. Legionelleninfektionen in Warstein – größter Ausbruch in Deutschland. Dtsch Arztebl 2013, 110: A-1736/B-1532/C-1508
[2043] Sitzmann F. Hygiene kompakt. Bern: Huber; 2012
[2044] Sitzmann F. Standardhygiene „Mit alles, aber ohne scharf“. JuKiP 2016; 5: 66–74
[2045] Wendt C. et al. Infektionsprävention im Rahmen der Pflege und Behandlung von Patienten mit übertragbaren Krankheiten. Bundesgesundheitsbl 2015; 58: 1151–1170
41.11.1.2 Infektionskrankheiten bei Kindern
[2046] AWMF Leitlinien. Registernummer 048–012. Im Internet: http://www.awmf.org/leitlinien/detail/ll/048–012.html; Stand: 20.12.2016
[2047] Bellini WJ, Rota JS, Lowe LE et al. Subacute sclerosing panencephalitis: more cases of this fatal disease are prevented by measles immunization than was previously recognized. J Infect Dis 2005;192:1686–93
[2048] Borte M, Varizellen Zoster; in: DGPI Handbuch, 6. Auflage, Thieme Stuttgart 2013
[2049] Chiappini E, Regoli M, Bonsignori F et al. Analysis of different recommendations from international guidelines for the management of acute pharyngitis in adults and children. Clin Ther 2011; 33:48–58
[2050] Lassi ZS, Das JK, Haider SW et al. Systematic review on antibiotic therapy for pneumonia in children between 2 and 59 months of age. Arch Dis Child 2014; 99: 687–93
[2051] Liese J, Abele-Horn M, Beer M et al. Diagnose und Behandlung der Pneumonie im Kindesalter. Monatsschrift Kinderheilkunde 2013: 161; 703–712
[2052] Mazur NI, Martinón-Torres F, Baraldi E et al. Respiratory Syncytial Virus Network (ReSViNET). Lower respiratory tract infection caused by respiratory syncytial virus: current management and new therapeutics. Lancet Respir Med 2015 3:888–900
[2053] RKI. Epidemiologisches Bulletin Nr. 5 vom 3. Februar 2006
[2054] RKI. Ratgeber Mumps 2013a. Im Internet: http://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Mumps.html;jsessionid=4485937CFC455402093FAF9F7F85A226.2_cid290; Stand: 20.12.2016
[2055] RKI. Ratgeber Röteln 2013b. Im Internet: http://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Roeteln.html; Stand: 20.12.2016
[2056] RKI. Epidemiologisches Bulletin Nr. 10 vom 9. März 2015
[2057] RKI. Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2015. Robert Koch-Institut: Berlin; 2016a
[2058] RKI. Ratgeber Varizellen 2016b. Im Internet: http://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Varizellen.html; Stand: 20.12.2016
[2059] RKI. Ratgeber Varizellen 2016c. Im Internet: https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Varizellen.html; Stand: 20.09.2016
[2060] RKI 2016d. Im Internet: http://www.rki.de/DE/Content/Infekt/SurvStat/survstat_node.html; Stand: 20.12.2016
[2061] RKI 2016e. Im Internet: http://www.rki.de/DE/Content/Kommissionen/STIKO/stiko_node.html; Stand: 20.12.2016
[2062] RKI. Ratgeber RSV2016f. Im Internet: http://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_RSV.html; Stand: 20.12.2016
[2063] Rudan I, Boschi-Pinto C, Zrinka Biloglav Z et al. Epidemiology and etiology of childhood pneumonia. Bulletin of the World Health Organization. 2008; 86: 321–416. Im Internet: http://www.who.int/bulletin/volumes/86/5/07–048769/en/; Stand: 20.12.2016
[2064] Santos RP, Tristram D. A practical guide to the diagnosis, treatment, and prevention of neonatal infections. Pediatr Clin North Am 2015 62: 491–508
[2065] Scholz H. Infektionen durch beta-hämolysierende Streptokokken der Gruppe A. In: DGPI Handbuch. 6. Aufl. Stuttgart: Thieme; 2013
[2066] Sitzmann FC, Bartmann P. Pädiatrie. 3. Aufl. Stuttgart: Thieme; 2006
[2067] Sitzmann FC, Bauer CP, Meyer S et al. Pädiatrie. 4. Aufl. Stuttgart: Thieme; 2012
[2068] Wendt C et al. Infektionsprävention im Rahmen der Pflege und Behandlung von Patienten mit übertragbaren Krankheiten – Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut. Bundesgesundheitsbl 2015; 58: 1151–1170
41.11.1.3 CDAD
[2069] Behnke M et al. Nosocomial infection and antibiotic use – a second national prevalence study in Germany. Dtsch Arztebl Int 2013; 110: 627–633
[2070] Dormann AJ, Weinke T. Clostridium-difficile-Infektionen. klinikarzt 2015; 39: 2–10
[2071] Kolbe-Busch S. Prävention von Clostridium-difficile-Infektionen. Krankenhaushygiene up2date 2016; 11: 63–77
[2072] RKI 2016. Clostridium difficile. RKI-Ratgeber für Ärzte. Im Internet: http://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Clostridium.html; Stand: 20.12.2016
41.11.1.4 Noroviren
[2073] Bonifait L et al. Detection and quantification of airborne norovirus during outbreaks in healthcare facilities. Clinical Infectious Diseases 2015; 61: 299–304
[2074] RKI 2016. Norovirus-Infektionen ein Rückblick auf das Jahr 2015. Epidemiologisches Bulletin 2016, 23: 197–204
[2075] Schneider T. Noroviren: häufigste Ursache infektiöser Gastroenteritiden. Innere Medizin up2date 2013; 1: 81–87
[2076] Sitzmann F. Hygiene kompakt. Bern: Huber; 2012
[2077] Sitzmann F. Gastrointestinale Virusinfektion: Norovirus. In: Köther I, Hrsg. Altenpflege, 4. Aufl. Stuttgart: Thieme 2016
41.11.1.5 Meningitis
[2078] Bijlsma MW et al. Community-acquired bacterial meningitis in adults in the Netherlands, 2006–14: a prospective cohort study. Lancet Infect Dis. 2016; 16: 339–347
[2079] Klein M, Pfister HW. Neues zur akuten bakteriellen Meningitis. Dtsch med Wochenschr 2016; 141: 470–473
[2080] Lange R, Erbguth F. Unklare Bewusstseinsstörung. Lege artis 2016; 6: 108–111
[2081] Lemmen S. Hygiene life – Was in keinem Lehrbuch steht. Krankenhaushygiene up2date 2015; 10: 161–171
[2082] Vonberg RP. Höher, schneller, weiter – Neue Methoden der Infektionsdiagnostik. Intensivmed.up2date 2016; 12: 41–56
41.11.1.6 Lungen-TB
[2083] Anonym 2016. Tuberkulose: Flüchtlinge infizieren sich erst auf der Flucht. Im Internet: http://www.pharmazeutische-zeitung.de/index.php?id=62610; Stand: 20.12.2016
[2084] Bauer CM et al. Bildgebung und Labordiagnostik bei Tuberkulose. Klin Monatsbl Augenheilkd 2016; 233: 587–593
[2085] RKI 2013. Tuberkulose RKI-Ratgeber. Im Internet: http://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Tuberkulose.html;jsessionid=5EE8095643B8BEDB371D0DB320903C74.2_cid290; Stand: 20.12.2016
[2086] RKI 2016. Welttuberkulosetag 2016: Gemeinsam gegen Tuberkulose. Epidemiologisches Bulletin Nr. 10/11/2016 v. 14.03.2016
[2087] Seybold U. Update: Tuberkulose bei Erwachsenen in Deutschland. Dtsch Med Wochenschr 2016; 141: 643–649
[2088] Sitzmann F. Hygiene daheim. Bern: Hans Huber; 2007
[2089] Sitzmann F. Pflegeschwerpunkt Tuberkulose. In: Gerlach U et al, Hrsg. Innere Medizin für Pflegeberufe. 8. Aufl. Stuttgart: Thieme; 2015
[2090] Sitzmann F. Tuberkulose. In: Köther I, Hrsg. Altenpflege, 4. Aufl. Stuttgart: Thieme; 2016
[2091] Ziegler R et al. Infektionsprävention bei Tuberkulose – Empfehlungen des DZK. Pneumologie 2012; 66: 269–282
41.11.1.7 HIV und AIDS
[2092] EKAF. HIV-infizierte Menschen ohne andere STD sind unter wirksamer antiretroviraler Therapie sexuell nicht infektiös. 2008. Im Internet: http://www.saez.ch/docs/saez/archiv/de/2008/2008–05/2008–05–089.pdf; Stand: 20.12.2016
[2093] DAIG, OEAIG. Postexpositionelle Prophylaxe der HIV-Infektion. Deutsch-Österreichische Empfehlungen 2014. Im Internet: http://www.daignet.de; Stand: 20.12.2016
[2094] Cohen MS, Chen YQ, McCauley M, et al. Antiretroviral Therapy for the Prevention of HIV-1 Transmission. N Engl J Med 2016; 375:830–839
[2095] European Collaborative Study. Mother-to-child transmission of HIV infection in the era of highly active antiretroviral therapy. Clin Infect Dis 2005; 40: 458–465
[2096] Flegel A, Koerner K, Wagner F, Kubanek B. Zehn Jahre HIV-Testung in den Blutspendediensten: Maßnahmen zur Vermeidung von Infektionsübertragungen durch Bluttransfusionen. Dtsch Arztebl 1996; 93 (13). Im Internet: http://www.aerzteblatt.de/V4/archiv/artikel.asp?id=942; Stand: 20.12.2016
[2097] Hoffmann H, Rockstroh J, Kamps BS. HIV.NET. Wuppertal: Steinhäuser; 2007
[2098] Nationaler AIDS Beirat beim Bundesministerium für Gesundheit. Der Nationale AIDS-Beirat positioniert sich zur Prävention von HIV mit antiretroviralen Medikamenten (2012). Im Internet: http://www.dagnae.de/wp-content/uploads/2016/06/Nationaler_AIDS_Beirat_Votum__Praevention_120404–1.pdf; Stand: 10.03.2017
[2099] RKI (2014). HIV/AIDS in Deutschland – Eckdaten der Schätzung. Im Internet: http://www.rki.de/DE/Content/InfAZ/H/HIVAIDS/Epidemiologie/Daten_und_Berichte/EckdatenDeutschland.pdf?__blob=publicationFile; Stand: 20.12.2016
[2100] UNAIDS (2016). UNAIDS AIDS by the numbers. Im Internet: http://www.unaids.org/sites/default/files/media_asset/AIDS-by-the-numbers-2016_en.pdf; Stand: 20.12.2016
[2101] Wicker S, Gottschalk R, Rabenau HF. Gefährdungen durch Nadelstichverletzungen: Betrachtung aus arbeitsmedizinischer und virologischer Sicht. Dtsch Ärztebl 2007; 104 (45): A3102–7
41.11.2 Kontakt- und Internetadressen
[2102] http://www.auswaertiges-amt.de; Stand: 20.12.2016
[2103] http://www.rki.de; Stand: 20.12.2016