42.3.1.6 Primäre Giftelimination
Behandlungsziel in der Akutphase ist es, Giftstoffe aus dem Magen-Darm-Trakt zu entfernen. Hierfür steht in Ausnahmefällen die Magenspülung zur Verfügung. Das provozierte Erbrechen spielt nur noch eine untergeordnete Rolle, keinesfalls darf hierfür Kochsalz oder Apomorphin benutzt werden, sondern nur Ipecacuanaha-Sirup (Dauer bis zum Wirkeintritt 20–30 Min.). Liegt die Substanzaufnahme länger als 1h zurück, ist der Erfolg der Magenspülung oder des Erbrechens bereits fraglich. Erbrechen darf u.a. nicht ausgelöst werden bei:
-
eingeschränktem Bewusstseinszustand
-
Krampfanfall
-
Kindern < 9 Monaten
-
Einnahme von ätzenden Substanzen
-
Einnahme von Schaumbildnern
-
Einnahme von Lösungsmitteln
In einigen Fällen ist v.a. nach Einnahme größerer Mengen Tabletten eine Magenspiegelung notwendig, da diese im Magen oft verklumpen, sich nicht direkt auflösen und daher auch noch deutlich später gastroskopisch geborgen werden können.
Magenspülung
Die Magenspülung dient dazu, eine Substanz mithilfe einer Spüllösung aus dem Magen zu entfernen oder wenigstens zu verdünnen. Sie wird nur noch in Ausnahmefällen und bis max. 1h nach Aufnahme des Giftes angewandt. Sie kann auch im Rahmen einer o.g. Gastroskopie erfolgen.
Merke
Vor der Magenspülung müssen zum Schutz des Patienten Materialien für eine evtl. notwendige Intubation bereitgestellt werden. Bei schwachen oder fehlenden Schutzreflexen (Husten, Würgen), eingeschränktem Bewusstsein oder Ateminsuffizienz muss der Patient vor Beginn der Magenspülung zwingend intubiert werden.
Weitere Kontraindikationen sind u.a.
-
bekannte Ösophagus-Divertikel/-Varizen,
-
mangelnde Kooperation des Patienten,
-
eine Blutungsneigung,
-
Schwangerschaft.
Material Für eine Magenspülung werden folgende Materialien benötigt ( ▶ Abb. 42.56 ):
Spülsysteme.
Abb. 42.56 Konventionelles Spülsystem mit Magenschlauch und Trichter (ein Beißring sorgt dafür, dass der Patient den Schlauch nicht mit den Zähnen zudrückt).

-
wasserabweisender Schutzkittel, Handschuhe (ggf. Schutzbrille)
-
2 10-l-Eimer und ein 500-ml Messgefäß
-
Beißring
-
Blasenspritze
-
großlumiger Magenspülschlauch
-
ca. 1 m durchsichtiger Plastikschlauch mit gleichem Durchmesser wie Magenschlauch
-
1 Trichter mit ca. 300 ml und Ansatz passend zum Durchmesser des Schlauchs
-
Verbindungsstück zwischen Magen- und Plastikschlauch
-
2 Laborgefäße zum Aufbewahren der Spüllösung für das Labor
-
Gel oder Spray (um den Magenschlauch gleitfähig zu machen)
Vorbereitung Hat die Giftnotrufzentrale die Magenspülung als notwendig eingestuft, muss sie zur Sicherheit des Patienten durchgeführt werden. Die Wachheit des Patienten ist vor Beginn der Magenspülung sorgfältig zu prüfen.
Durchführung Die Magenspülung wird folgendermaßen durchgeführt:
-
Schutzkittel, Handschuhe und ggf. Schutzbrille anziehen.
-
Einen Eimer mit 10 l lauwarmem Wasser füllen.
-
Patienten in Seitenlage und leichte Kopftieflage (ca. 15°) bringen.
-
Großlumigen Magenschlauch mit Xylocain-Gel bestreichen und oral durch den Beißring einführen.
-
Lage mittels Insufflation von Luft und gleichzeitigem Abhören des Epigastriums kontrollieren.
-
Magenschlauch, Verbindungsschlauch und Trichter miteinander verbinden.
-
Mageninhalt durch Tiefhalten des Trichters in den Eimer entleeren.
-
Eine Probe des Mageninhalts in ein Probengefäß abfüllen.
-
Trichter knapp unter Magenhöhe halten, mit ca. 200 – 300 ml Wasser füllen und durch Anheben des Trichters leicht über Magenhöhe fast leerlaufen lassen.
-
Der Trichter darf nie ganz leer werden, damit keine Luft in den Magen gelangt. Dabei müssen die eingelaufene und die abgeleitete Wassermenge gleich groß sein. Der Vorgang ist so oft zu wiederholen, bis mindestens 15 – 20 l Spülmenge erreicht sind (bei Alkylphosphat- und Paraquat-Intoxikationen mindestens 100 l).
-
Durch erneutes Tiefhalten das Wasser in den Trichter zurücklaufen lassen und in einen Eimer ableiten.
Merke
Die Magenspülung darf nur durchgeführt werden, wenn die Möglichkeit zur Notfallintubation besteht.
Nachsorge Nach Beendigung der Spülung wird der Magenschlauch gezogen und der Beißring entfernt. Der Patient wird auf den Rücken gedreht und in eine leicht sitzende Position gebracht. Die Überwachung des Patienten sollte auf jeden Fall fortgeführt werden.
Kohlegabe
Im Anschluss an die Magenspülung erhält der Patient Aktivkohle (Medizinalkohle, 1 g/kg KG!), um noch im Gastrointestinaltrakt verbliebene Substanz zu binden. Diese Maßnahme ist nur zeitnah (< 60 Min.) sinnvoll und wird daher nur noch eingeschränkt empfohlen. Die Kohle kann dem Patienten zu trinken gegeben werden (auf Brechreiz achten!) oder über eine Magensonde über ca. 10 Minuten in kleinen Portionen (50 ml) verabreicht werden. Aktivkohle kann eine ausgeprägte Obstipation auslösen. Insbesondere bei älteren Menschen ist die Obstipationsprophylaxe direkt in die Pflegeplanung mit einzubeziehen und eine frühzeitige medikamentöse Unterstützung mit dem Arzt abzusprechen.
Merke
Durch die intoxikationsinduzierte Übelkeit und die innerhalb kurzer Zeit verabreichte Aktivkohle besteht die Gefahr des akuten Erbrechens und der Aspiration!
Forcierte Diarrhö
Um die Kohle mit der gebundenen Substanz rasch aus dem Darm zu entfernen, kann dem Patienten auf ärztliche Anordnung hin z.B. Glaubersalz zum Abführen verabreicht werden. Ebenfalls kann ein rektaler Einlauf durchgeführt werden, um die enterale Gift- und Stuhlausscheidung zu forcieren.
Merke
Wegen des hohen Flüssigkeits- und Mineralstoffverlustes bei der forcierten Diarrhö sind eine strenge Bilanzierung mit ausreichender Flüssigkeitszufuhr und eine engmaschige Überwachung des Kreislaufs notwendig.
Maßnahmen bei Kontakt- und Atemgiften
Bei einer Verunreinigung von Haut, Schleimhäuten oder Augen mit einem Kontaktgift (z. B. E 605, Quallen Gift, Säure) ist die Empfehlung der Giftnotrufzentrale zu beachten, die die Behandlung (Dekontamination) vorgibt. Meist sieht das Vorgehen wie folgt aus:
-
bei Kontaktgiften: Auf Eigenschutz achten (Schutzkittel mit langen Ärmeln und Handschuhe)! kontaminierte Kleidungsstücke sofort entfernen, betroffene Areale mit fließendem Wasser abspülen,
-
bei inhalativen Vergiftungen: Auf Eigenschutz achten! Patienten aus dem Gefahrenbereich bergen und Frischluft/Sauerstoff zuführen, Rettungsdienst umgehend informieren. Bei einigen inhalativen Vergiftungen (z.B. durch Kohlenstoffmonoxid, Rauchgas) ist in der Regel eine hoch dosierte Sauerstofftherapie, eventuell eine Intubation oder/und auch eine hyperbare Therapie (Überdruckkammer) notwendig.
Nachsorge
Jeder betroffene Patient benötigt Ruhe, fachlich kompetente Zuwendung und eine genaue Beobachtung durch das Personal. Wegen der anstrengenden Behandlung sollte ihm angeboten werden, sich frisch zu machen und ggf. eine Mundpflege durchzuführen. Nach ausreichender Ruhephase wird dem Patienten in ruhiger Atmosphäre der weitere Ablauf der Behandlung erklärt.
42.3.1.7 Sekundäre Giftelimination
Ist die Substanz bereits in die Blutbahn gelangt, wird sie durch die Nieren und die Leber verstoffwechselt und über Urin, Galle und Stuhl ausgeschieden. Einige Stoffe können auch über Lunge und Haut abgegeben werden. Die Unterstützung dieser Ausscheidungswege wird auch als sekundäre Giftelimination bezeichnet. Diese kann medikamentös oder durch extrakorporale Verfahren erfolgen:
-
Dialyse (wasserlösliche Substanzen werden entfernt)
-
Hämoperfusion (Substanzen werden durch direkten Kontakt von Blut an Kohle gebunden)
-
MARS Therapie (Substanz wird über Humanalbumin als Trägersubstanz an Kohle und Harz gebunden)
-
Plasmaseparation (Blutplasma mit der darin enthaltenen Substanz wird ausgetauscht)
-
hyperbare Sauerstofftherapie (nur in speziellen Zentren möglich)
42.3.1.8 Spezifische Antidot Behandlung
Für einige Substanzen gibt es ein Gegenmittel (Antidot). Dessen Einsatz muss wegen möglicher Nebenwirkungen und Komplikationen sehr genau überlegt werden. Bei Intoxikation mit Drogen kann es nach Gabe eines Antidots zu aggressiven Verhalten des Patienten kommen, daher sollten Antidote vorsichtig dosiert (titriert) werden: Eigenschutz beachten! Gerade auch nach Gabe des Antidots und klinischer Besserung ist die Observation des Patienten unbedingt fortzuführen, da die Wirkung des Antidots oft kürzer anhält als die Wirkung des Giftstoffes, so kann es je nach Substanz nach Abklingen der Antidot-Wirkung plötzlich zu sehr ausgeprägten Symptomen wie z.B. einem Atemstillstand kommen.
Definition
Ein Antidot ist ein Stoff, der die Giftsubstanz vor der Resorption in ihrer Wirkung mindert oder an sich bindet. Ein Antidot kann auch als direkter „Gegenspieler“ die Giftsubstanz nach der Resorption im Blut chemisch verändern, seine Wirkung behindern oder die Aufnahme am Rezeptor (Wirkungsort im Körper) verhindern.
42.3.2 Pflege- und Behandlungsplan
Neben der medizinischen Versorgung bei Intoxikation ist die pflegerische- und psychologische Betreuung wichtig. Zur optimalen Versorgung des Patienten ist die Zusammenarbeit im multiprofessionellen Team unerlässlich.
42.3.2.1 Prophylaxe und Krankenbeobachtung bei der Notaufnahme
Bei der Aufnahme von intoxikierten Patienten stehen folgende Maßnahmen im Vordergrund.
Selbstschutz beachten Der Schutz der eigenen Person steht bei der Versorgung des Patienten nach Intoxikation an erster Stelle. Hier sind v. a. Kontaktgifte zu nennen, die von der Haut des Patienten über die Hände in den Körper der Pflegenden gelangen können. Zum Selbstschutz gilt: Mindestens Handschuhe und ggf. weitere Schutzkleidung tragen!
Komplikationen vorbeugen und erkennen Da bei Intoxikationen immer mit lebensbedrohlichen Komplikationen gerechnet werden muss, ist eine umfassende Krankenbeobachtung unerlässlich. Die Vielzahl der infrage kommenden Vergiftungsstoffe erschwert es, Beobachtungen eindeutig zuzuordnen. Die medizinischen Leitsymptome dienen auch der pflegerischen Anamnese. Bei der körperlichen Erstuntersuchung durch den Arzt können gleichzeitig pflegerisch relevante Befunde erhoben werden. So werden meistens als Erstes gastrointestinale Störungen in Form von Übelkeit, Erbrechen und Durchfall auch in Kombination mit Einnässen wahrgenommen. Da sie bei vielen Vergiftungen auftreten, muss immer eine Probe der Ausscheidungen zum Substanznachweis aufbewahrt werden.
Merke
Verschmutzte oder beschädigte Kleidung ist für evtl. kriminaltechnische Untersuchungen aufzubewahren.
Bewusstseinslage kontrollieren Die Störungen des Bewusstseins werden mit Hilfe sog. Bewusstseinsskalen (z. B. Glasgow-Koma-Skala, RASS) eingeteilt. Das Bewusstsein sollte in der Akutphase engmaschig kontrolliert und dokumentiert werden. Zur Kontrolle der Bewusstseinslage gehört auch die Beurteilung der Pupillen. Hierbei werden Form, Lichtreaktion, Weite und Stellung der Pupillen zueinander kontrolliert. Anhand der Weite der Pupillen lassen sich z. B. Rückschlüsse auf den auslösenden Wirkstoff ziehen ( ▶ Abb. 42.57).
Zudem müssen Husten- und Schluckreflex engmaschig kontrolliert werden. Beides sind Schutzreflexe, die verhindern, dass z. B. Speichel oder Erbrochenes in die Lungen gelangen. Bei fehlenden oder unklaren Schutzreflexen muss der Patient zum Eigenschutz intubiert werden, um eine Aspiration mit nachfolgender ▶ Aspirationspneumonie zu vermeiden.
Pupillenreaktion.
Abb. 42.57 Form und Lichtreaktion der Pupillen geben einen Hinweis auf evtl. eingenommene Substanzen.

Umgang mit Patienten nach Suizidversuch Die Akutphase ist meist geprägt durch die hohe emotionale Belastung, in der sich der Patient befindet. Je nachdem, wie er die eigene Situation interpretiert, wendet er seine Aggression nach außen, gegen die eigene Person oder er zieht sich völlig in das eigene Erleben zurück. Die Situation verschärft sich u. U. noch zusätzlich durch die Wirkung von eingenommenen Medikamenten. Der Patient sollte daher niemals unbeaufsichtigt gelassen werden sowie alle zur Selbstverletzung geeigneten Gegenstände aus der unmittelbaren Umgebung des Patienten entfernt werden.
Nach Möglichkeit kann hier auch eine Fremdanamnese durch Angehörige im Verlauf hilfreich sein sowie das Hinzuziehen psychologischen oder psychiatrischen Fachpersonals.
Merke
Im weiteren Verlauf ist es für den Patienten wichtig, sich wieder persönlich, zeitlich und örtlich orientieren zu können. Deshalb muss sein Umfeld so klar wie möglich strukturiert werden: durch Anbringen einer für den Patienten sichtbaren Uhr mit Datumsanzeige und prägnanter Information zum Aufenthaltsort.
42.3.2.2 Intensivtherapie
Auf die Intensivstation werden Patienten verlegt, die aufgrund der Schwere der Vergiftung beatmet werden müssen oder bei denen extrakorporale Eliminationsverfahren durchgeführt werden müssen. Die Pflege dieser Patienten erfordert spezielle Überwachung und Maßnahmen hinsichtlich Kreislaufregulation, Atmung und Temperaturregulation.
Kreislaufregulation
Bei einer schweren Intoxikation kommt es häufig zu teilweise lebensbedrohlichen Herz- und Kreislaufstörungen (Schock oder schwerste Herzrhythmusstörungen), die ggf. eine Reanimation nötig machen. Manche Vergiftungssubstanzen können noch bis zu 3 Tage nach der Aufnahme Rhythmusstörungen auslösen. Herz- und Kreislaufparameter müssen engmaschig überwacht, abnorme Werte frühzeitig erkannt werden. Dazu ist ein kontinuierliches Monitoring unentbehrlich. Wegen der z. T. lang wirkenden Substanzen werden die Patienten mehrere Tage überwacht.
Atmung
Oft sind Patienten mit einer Intoxikation aufgrund ihrer Bewusstseinseintrübung oder einer direkten Lungenschädigung (inhalative Intoxikation, z. B. Rauchgase) ateminsuffizient. Bei der Pflege gelten allgemeingültige Grundsätze der Pflege von Patienten mit Ateminsuffizienz bzw. Beatmung. Auch die Beatmungstherapie sollte mit der Beratungsstelle für Vergiftungen abgestimmt werden und wird ebenfalls therapeutisch auf einer Intensivstation durchgeführt.
Temperaturregulation
Bei einigen Vergiftungen, z. B. mit Schlafmitteln, treten Störungen der Temperaturregulation in Form von Unterkühlung (Hypothermie) oder Überwärmung (Hyperthermie) auf. Hypothermien können durch vorgewärmte Decken oder den Einsatz sog. Wärmedecken (z. B. Bair Hugger) ausgeglichen werden. Hyperthermien können passiv durch Oberflächenkühlung, aktiv durch Kühlgeräte (Kühlmatte) oder auch in Verbindung mit Medikamenten behandelt werden.
42.3.2.3 Zusammenarbeit im multiprofessionellen therapeutischen Team
Zwischen Station und Apotheke wird abgesprochen, welche Medikamente zur Behandlung bei Vergiftungsnotfällen wo und wie gelagert sind. Es gilt regelmäßig zu überprüfen, dass alle Materialien (z. B. Schutzkittel, Material für Magenspülungen, Behälter zum Aufbewahren von Substanzen und dazugehörige Begleitscheine) vorhanden sind.
Die Behandlung eines Patienten mit Intoxikation wird als Konzept festgelegt und das gesamte Team sollte dementsprechend geschult werden. Nach der Akuttherapie, speziell nach einem Suizidversuch, hat die Betreuung durch geschulte Personen (Psychologen, Psychiater, Seelsorger) einen hohen Stellenwert. Sie sind in der Lage, das psychische Erleben des Patienten und dessen Auswirkungen professionell aufzuarbeiten. Sind Folgeschäden für den Patienten absehbar, hilft der Sozialdienst bei der Rückkehr ins häusliche Umfeld.
Merke
Keinesfalls darf der Patient nach der erfolgten Akuttherapie sich selbst überlassen werden.
42.4 Pflege von Patienten mit Multipler Sklerose
42.4.1 Medizinischer Überblick
42.4.1.1 Definition
Die Multiple Sklerose (MS) ist eine chronisch fortschreitende, entzündliche Erkrankung des zentralen Nervensystems (ZNS). Sie verläuft meist in Schüben und kann sowohl das Gehirn als auch das Rückenmark betreffen. Durch die Entzündung der Markscheiden (Myelin) kommt es zum Abbau von Nervenfasern (axonale Degeneration) und den entsprechenden Symptomen.
42.4.1.2 Häufigkeit und Risikofaktoren
Die MS ist die häufigste neurologische Erkrankung des frühen Erwachsenenalters. Sie manifestiert sich im Alter zwischen 20 und 40 Jahren. Weltweit sind ca. 2 Millionen Menschen betroffen. In Deutschland geht man aktuell von mehr als 130 000 Menschen aus. Frauen erkranken an der schubförmigen Form 3-mal häufiger als Männer. Das Risiko, an MS zu erkranken, ist bei Rauchern 1,5-mal höher als bei Nichtrauchern.
Lebensphase Kind
Prävalenz
In Deutschland erkranken jährlich ca. 100–200 Kinder an MS (www.kompetenznetz-multiplesklerose.de [KKNMS e.V. Stand: 2016]).
Geografisch tritt die MS besonders in gemäßigten Klimazonen (z.B. Europa, Nordamerika) auf. Hellhäutige Menschen haben eine erhöhte Erkrankungswahrscheinlichkeit.
Sozialökonomisch spielen hohe Behandlungs- und Folgekosten, z.B. durch eine bleibende Einschränkung und eine vorzeitige Verrentung, eine Rolle (www.kompetenznetz-multiplesklerose.de; Stand 2016)
42.4.1.3 Ursachen
Die Ursache der Erkrankung ist noch weitgehend unbekannt. Aktuellen Studien zufolge wird von einem Zusammenhang zwischen dem Blutgerinnungsfaktor (XII) und der Entstehung einer MS ausgegangen.
Die Forschung, Untersuchung und Behandlung der MS wird in Deutschland durch das Krankheitsbezogene Kompetenznetz Multiple Sklerose (KKNMS) gesteuert. Es gibt eine eigene Untergruppe für die MS bei Kindern (ChildrenMS).
Pathophysiologie
Die Pathophysiologie der MS basiert auf einer Fehlsteuerung des Immunsystems, die zu Entzündungsreaktionen im Gehirn und Rückenmark führen ( ▶ Abb. 42.58): T-Lymphozyten lernen durch Hilfszellen Hirngewerbe zu erkennen und lösen dann die Entzündungsreaktionen aus, die Schäden an den Nerven und Gehirnzellen verursachen. Dadurch entstehende Läsionen sind im gesamten Zentralnervensystem zu finden, am häufigsten im Sehnerv, dem Rückenmark, dem Hirnstamm, dem Kleinhirn und in der ▶ Abb. 42.3. Hierdurch erklärt sich auch das sehr heterogene klinische Bild der MS.
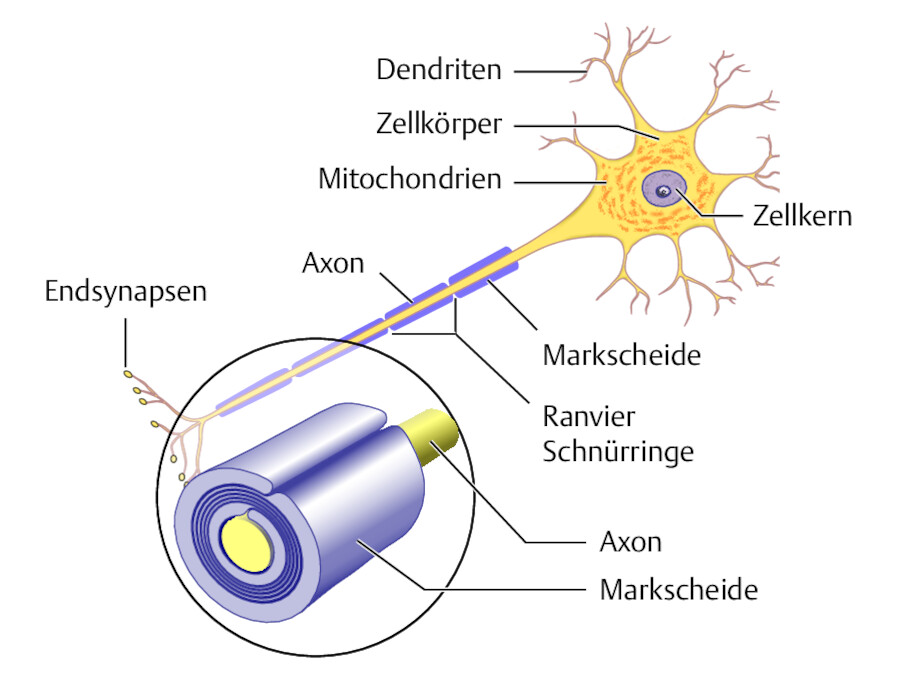
Pathophysiologie der MS.
Abb. 42.58 Markscheiden (auch Myelinscheiden genannt) isolieren größere Strecken des Axons elektrisch gegen die Umwelt. Die Erregung springt von einem Schnürring zum nächsten, die Erregungsleitung wird bis zu 20-mal schneller. Bei Schädigung der Markscheide wird die Reizleitung gestört oder ganz unterbrochen.
Normalerweise ist die Blut-Hirn-Schranke eine physiologische Barriere zwischen dem Zentralennervensystem und dem Blutkreislauf, sie dient als Schutz des Gehirns vor den im Blut zirkulierenden Krankheitserregern und Toxinen.
Durch die Schädigung der Myelinschicht ist eine Leitfähigkeit der elektrischen Impulse stark reduziert, sodass dadurch verschiedene Krankheitssymptome entstehen.
42.4.1.4 Verlaufstypen
Man unterscheidet verschiedene Verlaufstypen ( ▶ Abb. 42.59) ( ▶ Tab. 42.4 ),
-
das klinisch isolierte Syndrom (KIS),
-
die schubförmige („relapsing-remitting“, RRMS),
-
die sekundär progrediente (SPMS) und
-
die primär progrediente (PPMS) Verlaufsform.
Verlaufstypen der MS.
Abb. 42.59 Der Verlauf ist gekennzeichnet durch Schübe, Demyelinisierung und axonale Degeneration.

Klinisch isoliertes Syndrom (KIS) Frühsymptome deuten auf ein demyelinisierendes Geschehen hin. Die Diagnose kann bereits beim Vorliegen bestimmter Läsionen gestellt werden.
Schubförmiger (remittierender) Verlauf Hierbei kommt es zu einzelnen Symptomen, die sich jeweils wieder vollständig oder unvollständig zurückbilden. Unbehandelt liegt die Schubrate bei 1,8 Schüben pro Jahr (abnehmend im Verlauf).
Sekundär progredienter Verlauf Am Anfang der Erkrankung gibt es einzelne Schübe, im späteren Verlauf kommt es jedoch unbehandelt zu einem schleichenden Anstieg neurologischer Ausfälle und klinischer Symptome.
Primär progredienter Verlaufstyp Hier gibt es keine Schübe. Die Betroffenen zeigen von Beginn an nur einzelne Symptome, z. B. eine zunehmende Gehbehinderung; ca. 10 % der MS-Erkrankten haben diese Verlaufsform. Hier scheint der axonale Schaden (Degeneration) im Vordergrund zu stehen und nicht die Entzündung.
|
Prognostisch eher günstige Faktoren |
Prognostisch eher ungünstige Faktoren |
|
monosymptomatischer Beginn |
polysymptomatischer Beginn |
|
nur sensible Symptome |
früh motorische und zerebelläre Symptome |
|
kurze Dauer der Schübe |
lang dauernde Schübe |
|
gute Rückbildung der Schübe |
schlechte Rückbildung der Schübe |
|
erhaltene Gehfähigkeit |
initial zahlreiche Läsionen in der MRT |
|
Erkrankungsbeginn < 35. Lebensjahr |
früh pathologisch somatosensibel (SEP) und motorisch evozierte Potenziale (MEP) |
42.4.1.5 Symptome
Häufige Erstsymptome sind Sensibilitätsstörungen, Sehstörungen und Blasenstörungen. Späte Symptome sind Koordinationsstörungen, Lähmungen, Kleinhirnsymptome, Schmerzen und Sprachstörungen.
Sensible Symptome
Gefühlsstörungen sind bei 42 % der MS-Patienten nachweisbar, meist sind Vibrations- und Lagesinn betroffen. Der Patient selbst beschreibt es oft als „Ameisenläufe“ auf der Haut oder ein ähnliches Gefühl wie beim Zahnarzt, wenn die Betäubungsspritze nachlässt. Späte Symptome sind dann neuralgieforme Spontanschmerzen, wenn sich auch Läsionen auf den zentralen Schmerzbahnen bilden. Trigeminusneuralgien sind ebenfalls häufige Spätsymptome.
Ophthalmologische Störungen
Sehnerventzündung Die sog. Optikusneuritis ist bei 20 – 30 % der MS-Patienten das Erstsymptom. Der Patient klagt über Schleier- bzw. Verschwommensehen und hat meist eine Visusminderung auf dem betroffenen Auge.
Störung der Okulomotorik Es kommt zu Augenmuskelparesen mit entsprechenden Doppelbildern, hier sind die Kerngebiete des N. abducens und des N. oculomotorius betroffen. Bei Herden im hinteren Längsbündel kommt es zu einer komplexen Augenbewegungsstörung. Der Betroffene kann Bilder oft nicht richtig fixieren.
Blasenstörungen
75 % der MS-Patienten leiden im Laufe ihrer Erkrankung unter neurogenen Blasenstörungen. Die Blase entleert sich schon bei kleinen Harnmengen, der Patient muss häufig zur Toilette, im späten Stadium der Erkrankung besteht meist ein unwillkürlicher Harnverlust und ein Katheter ist erforderlich.
Psychische Symptome
Über 50 % der MS-Patienten entwickeln im Laufe ihrer Erkrankung, meist zu Beginn, eine behandlungsbedürftige Depression. Auch ca. 50 % klagen über kognitive Störungen (Gedächtnis- oder Konzentrationsprobleme).
Im fortgeschrittenen Stadium der Erkrankung können auch hirnorganische Symptome bis hin zu einer Demenz auftreten (der Patient legt eine freundlich-gleichgültige Haltung an den Tag).
Fatigue Dies wird als verstärkte psycho-physische Ermüdbarkeit bezeichnet. Es ist ein häufiges Symptom. Es korreliert nicht mit dem Behinderungsgrad, kann jedoch die Lebensqualität der Patienten sehr einschränken.
Motorische Symptome
Unter Spastik versteht man eine erhöhte Eigenspannung der Skelettmuskulatur. Durch Läsionen auf der Pyramidenbahn können je nach Schädigungsort, spastische Mono-, Para-, Hemi- und Tetraparesen entstehen. Diese Verkrampfungen der Muskulatur unterliegen tageszeitlichen Schwankungen und können durch verschiedene Reize (z. B. Dehnung des Muskels, Blasenfüllung, Berührung, Angst) verstärkt werden. Im späten Stadium kann auch die Sprech- und Schluckmuskulatur betroffen sein. Der MS-Patient hat eine undeutliche Sprache (Dysarthrie) oder erschwertes Schlucken (Dysphagie). Folgeschädigungen der Spastik können Gelenkdeformationen (Kontraktionen, Skoliosen) und Schmerzen sein. Allerdings muss man immer bedenken, dass, wenn man dem Patienten medikamentös die Spastik nimmt, er oft nicht mehr gehfähig ist, da die Lähmung dann zunimmt.
Kleinhirnsymptome
Unsystematischer Schwankschwindel, Ataxien (griech.: Unordnung) ist der Oberbegriff für verschiedene Störungen der Bewegungskoordination. Man unterscheidet:
-
Rumpfataxie (Unfähigkeit, gerade ohne Stütze zu sitzen)
-
Standataxie (der Patient kann nicht mehr ohne Hilfe stehen)
-
Gangataxie (die Patienten haben ein breitbeiniges, unsicheres Gangbild)
-
Ataxie bei Zielbewegungen, dies führt zu einem falschen Ausmaß der Bewegung (Dysmetrie), zu überschießend-ausfahrenden Bewegungen (Hypermetrie) und unflüssig-verwackelten Bewegungen (Asynergie)
Schädigungsorte bei der MS können das Kleinhirn, das Rückenmark oder sensible Bahnen sein.
Sexuelle Symptome
Erektionsprobleme beim Mann und geringe oder fehlende Lubrikation bei der Frau sind häufige Symptome.
42.4.1.6 Diagnostik
Zur Diagnostik gehören eine vollständige neurologische Untersuchung mit zusätzlichem umfassendem Sehtest und eine Erhebung der Vorgeschichte, z.B. nach möglichen zurückliegenden Episoden, um Hinweise auf einen Erkrankungsbeginn zu ermitteln. Des Weiteren wird eine Familien-Anamnese bezüglich Autoimmunerkrankungen erstellt. Die Ergebnisse werden über verschiedene Scoring-Systeme quantifiziert (Multiple Sclerosis Functional Composite Scale (MSFC), Expanded Disability Status Scale (EDSS).
Evozierte Potenziale Evozierte Potentiale sind elektrische Signale (Spannungsunterschiede), die im Elektroenzephalogramm gemessen werden können. Sie entstehen als Antwort auf die Stimulation eines Sinnesorgans (z.B. Auge, Haut) oder eines Nervs (z.B. Sehnerv, Mediannerv). Wichtig zur Diagnostik der MS sind die visuell evozierten Potenziale (VEPs) zur Untersuchung der Sehbahn (Netzhaut, Sehnerven, visueller Kortex im Gehirn). Der Patient blickt dabei auf ein schnell flackerndes Schachbrettmuster. Elektroden am Kopf messen die Zeit, bis der visuelle Reiz im visuellen Kortex (Sehrinde) ankommt. Bei 75 % der MS-Patienten ist dieser Wert verlangsamt und damit pathologisch. Eine Verzögerung bedeutet eine Störung der Reizweiterleitung und möglicherweise Schäden an den Nerven.
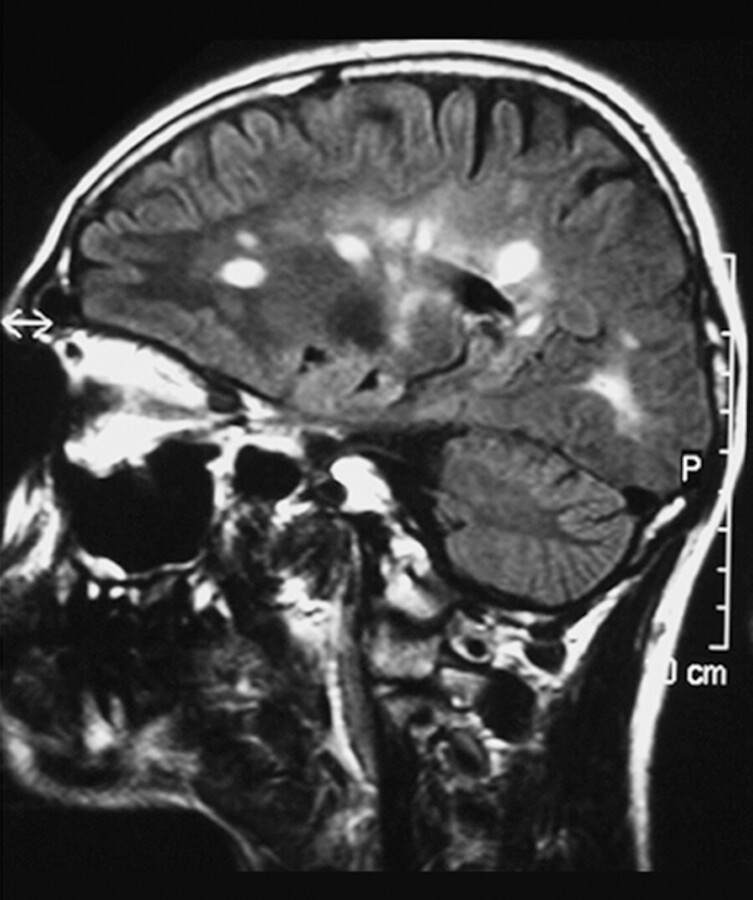
Kernspintomografie Die Kernspintomografie von Schädel und Halswirbelsäule ist ein zentrales diagnostisches Verfahren in der Abklärung einer MS. Mithilfe eines Kontrastmittels kann man frische entzündliche Läsionen sichtbar machen. Auch stumme, klinisch symptomlose Herde können aufgezeigt werden ( ▶ Abb. 42.60).
Optische Kohärenztomografie (OCT) Die optische Kohärenztomografie ist eine neuartige Untersuchungsmethode zur Erfassung neurodegenerativer Veränderungen der Retina (Netzhaut). Mit Hilfe eines sog. Breitband-Lichtstrahls wird die Retina nichtinvasiv „abgetastet“. So ist die Darstellung kleinster Strukturen der Netzhaut möglich. Vor allem in der Frühphase der MS treten oft Störungen des Sehnervs auf, die für den Patienten teilweise noch nicht wahrnehmbar sind.
Liquoruntersuchung Typischerweise findet man im Nervenwasser erhöhte Konzentrationen von Immunglobulinen, die im Rahmen der Autoimmunreaktion im ZNS gebildet werden. Diese können sich in sog. oligoklonalen Banden zusammenlagern.
Differenzialdiagnostisch werden chronisch-infektiöse Erkrankungen (Neuro-Lues, Borreliose, HIV-Infektion), Kollagenosen, Vaskulitiden und Leukodystrophien sowie Sonderformen entzündlich demyelinisierender Erkrankungen (z.B. Neuromyelitis optica oder akute disseminerte Enzephalomyelitis) ausgeschlossen.
Typische MRT-Befunde bei MS.
Abb. 42.60 Balkenherde.
42.4.1.7 Therapie
Schubtherapie Als „Schub“ wird ein akut voranschreitender Prozess oder auch neurologischer Ausfall bezeichnet, der länger als 24 Std. andauert und nicht z.B. durch einen Infekt oder Körpertemperaturschwankungen ausgelöst wurde. Treten innerhalb von 30 Tagen nach einem Schub erneut Symptome auf, wird dies nicht als neuer Schub bezeichnet, sondern zum vorherigen Schub gezählt.
Etablierter Therapiestandard ist die Behandlung mit Glukokortikosteroiden (GKS), meist mit Methylprednisolon (MP) 500–1000 mg i. v. über 3 – 5 Tage als morgendliche Einzeldosis. Kortison unterdrückt das Immunsystem und wirkt entzündungshemmend. Das Ödem im ZNS wird vermindert und die Funktion der Blut-Hirn-Schranke wird wiederhergestellt.
Schubprophylaxe In Deutschland sind derzeit 3 Hauptklassen von Interferonen zur Schubprophylaxe zugelassen (IFN-β1b Betaferon, Bayer-Schering bioidentisch mit Extavia, Novartis; IFN-β1a Avonex, Biogen Idec; Rebif. Merck-Serono). Diese Stoffe vermindern die Durchlässigkeit der Blut-Hirn-Schranke und greifen positiv in die Entzündungskaskade ein. Hauptnebenwirkungen sind grippeähnliche Symptome zu Beginn der Behandlung und Hautrötungen. Ein weiteres Medikament ist Glatirameracetat, unter dem es zu subkutanen Hautveränderungen kommen kann. Unter der Medikation ist eine Schubreduktion um ca. 30 – 40 % möglich.
Eskalationstherapie Hat ein MS-Patient trotz bestehender Basistherapie mit Interferon wiederkehrende aggressive Schübe oder bereits zu Beginn einen aktiven Krankheitsverlauf, kann eine Eskalationstherapie sinnvoll sein. Diese besteht meist aus einer medikamentösen Therapie (z.B. Natalizumab). Führt diese nicht zum gewünschten Erfolg, sollte eine Plasmapharese mittels einer Albuminsubstitution durchgeführt werden (www.kompetenznetz-multiplesklerose.de).
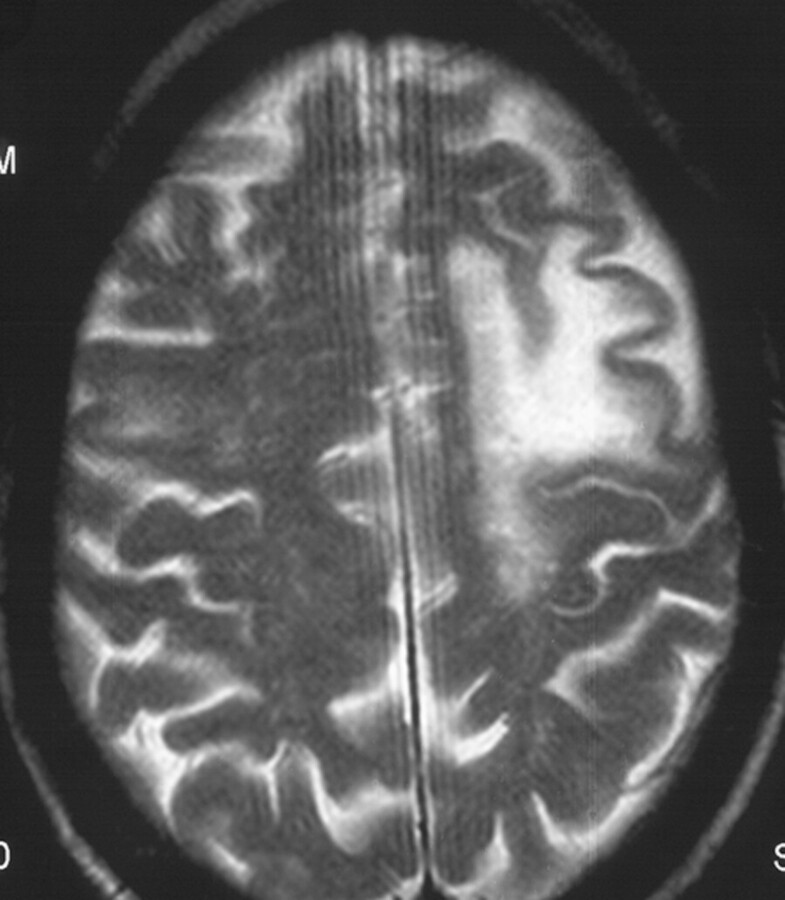
Nebenwirkungen Natalizumab Natalizumab (z. B. Tysabri) wird i. v. verabreicht. Es ist sehr wirksam in der Schubprophylaxe (ca. 70 % Schubreduktion). Treten Nebenwirkungen auf (eher selten), können diese jedoch z.T. schwerwiegend sein. Die sog. progressive multifokale Leukenzephalopathie (PML) ( ▶ Abb. 42.61) ist eine teilweise tödlich verlaufende virale Entzündung des ZNS. Um eine mögliche Erkrankung frühzeitig zu erkennen, müssen die Patienten engmaschig überwacht werden. Zurzeit wird erforscht, welche Patienten prädestiniert für die Entwicklung einer PML sind.
Typische diffuse Marklagerveränderung im Schädel-MRT bei PML.
Abb. 42.61
Mitoxantron = Chemotherapie Fingolimod (z. B. Gilenya) wird per os (über den Mund) verabreicht. Es erschwert das Freikommen der Lymphozyten aus den Lymphknoten, Nebenwirkungen können Übelkeit, Infektionen, Makulaödeme und Sensibilitätsstörungen sein.
Symptomatische Therapie Die symptomatische Therapie besteht sowohl aus nicht-medikamentösen als auch aus medikamentösen Maßnahmen. Ziel ist es, die Lebensqualität der Betroffenen zu erhalten oder zu verbessern.
Nicht-medikamentöse Maßnahmen Nicht-medikamentöse Maßnahmen, z. B. therapeutisch-aktivierende Pflege, Physiotherapie, Ergotherapie, psychologische Betreuung und Logopädie sollen den Bedürfnissen der Betroffenen individuell angepasst und ausreichend ermöglicht werden.
Medikamentöse Maßnahmen Die medikamentöse Therapie wird gegen Spastik, Depressionen, Blasenstörungen, Schmerzen und Fatigue eingesetzt.
Zur Spastik-Reduktion sind Baclofen, Tizanidin, Gabapentin (Therapie der schmerzhaften tonischen Spastik, Off-Label-Use), Nabiximols-Spray (THC & Cannabidiol) geeignet. Benzodiazepine sollen nur bei nicht beherrschbaren generalisierten Spastiken genutzt werden. Ein weiteres zugelassenes Medikament ist 4-Aminopyridin (Fampridin), dies führte bei einer Teilgruppe zu einer Verbesserung der Gehfähigkeit.
Invasive Therapiemaßnahmen sind die Injektion von Botulinum-A-Toxin und die intrathekale Applikation von Baclofen.
42.4.2 Pflege- und Behandlungsplan
MS-Patienten sind auf unterschiedliche Weise eingeschränkt. Ihre individuelle Symptomatik und deren Ausprägung sind in erster Linie von der Lokalisation der Entzündungsherde abhängig. Charakteristisch für die MS ist das unvorhersehbare Auftreten von Krankheitssymptomen. Diese Symptome bilden sich, je nach Verlauf, wieder vollständig zurück oder es kommt zu einer bleibenden Einschränkung. Wenn man die Gesamtheit der MS-Patienten betrachtet, gibt es Symptome, die häufiger am Anfang der Erkrankung stehen, und Symptome, die erst mit weiterem Fortschreiten der Erkrankung auftreten. Die pflegerische Unterstützung, die ein erkrankter Mensch benötigt, reicht von kleinen Handreichungen bis zu einer vollständigen pflegerischen Unterstützung und Versorgung bei einer ▶ Tetraplegie.
Pflegeziel Entsprechend sind auch die Pflegeziele individuell abhängig von der Symptomatik des jeweiligen MS-Kranken zu formulieren. Allgemeines Pflegeziel ist die Erhaltung der weitestmöglichen Selbstständigkeit des Erkrankten und die Vermeidung von Komplikationen.
Praxistipp
Konkrete Kenntnisse aus den ▶ Konzepten Bobath, ▶ Kinästhetik und ▶ basaler Stimulation sind für Pflegende bei der Versorgung von MS-Patienten sehr hilfreich ( ▶ Abb. 42.62). Die Konzepte haben teilweise Leitlinien für die Versorgung und einzelne Pflegemaßnahmen entwickelt, die gut nutzbar sind (z.B. siehe http://www.bika.de/leitlinien.html).
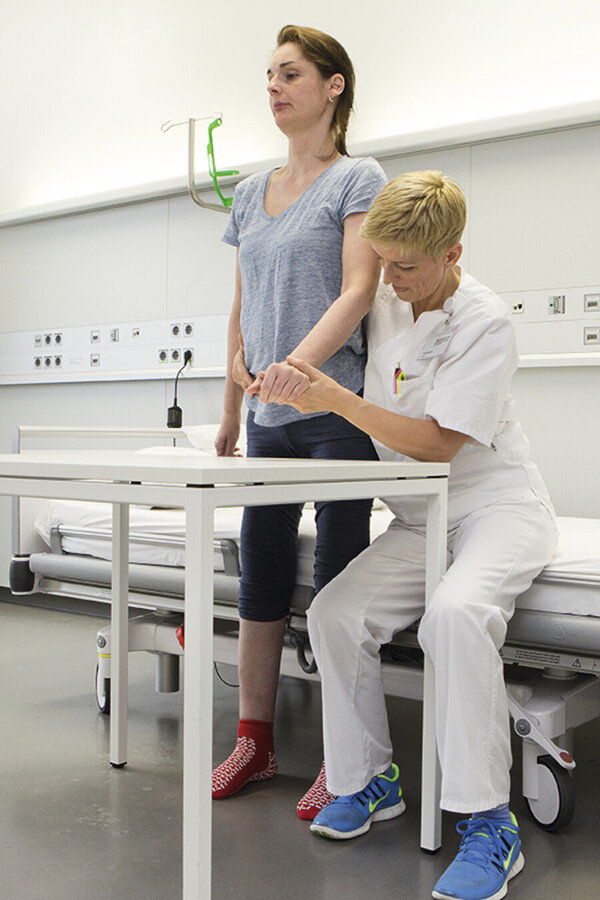
Mobilisation.
Abb. 42.62 Die Patientin lernt, sich aktiv auf die Bettkante zu setzen, ohne das der Muskeltonus sich erhöht und Spastik „einschießt“.
(Foto: K. Oborny, Thieme)

Pflegemaßnahmen Schwerpunkt ist die pflegerische Unterstützung des MS-Patienten unter Beachtung seiner vorhandenen Ressourcen. Um die Ressourcen erkennen zu können, ist eine ausführliche Pflegeanamnese erforderlich.
42.4.2.1 Hilfe bei der Diagnosestellung
Fallbeispiel
Frau Sörensen ist 24 Jahre alt. Sie ist momentan nicht berufstätig, da vor einem halben Jahr ihr erstes Kind geboren wurde. Sie verspürt seit einiger Zeit ein „Kribbeln“ in beiden Händen. Manchmal hat sie einen „Schleier“ vor den Augen, der das Sehen erschwert. Frau Sörensen sucht ihren Hausarzt auf, der sie in eine neurologische Klinik zur Diagnostik einweist. Sie ist sehr beunruhigt. Es werden verschiedene Untersuchungen durchgeführt, z. B. eine Liquoruntersuchung nach einer Lumbalpunktion, ein MRT des Schädels und ein VEP. Im MRT werden die „klassischen Herde“ gesehen, was darauf hin deutet, dass bereits unbemerkte Schübe abgelaufen waren. Im Liquor werden „oligoklonale Banden“ gefunden, sodass die Diagnose MS gesichert ist. Der behandelnde Arzt informiert sie in einem Gespräch über die Diagnose MS. Frau Sörensen ist erschrocken und hat große Angst vor der Zukunft.
Die Patienten sind zum Zeitpunkt der Diagnosestellung in den meisten Fällen in der Lage, sich körperlich selbst zu versorgen. Der pflegerische Schwerpunkt liegt auf der psychosozialen Ebene. Patienten mit MS benötigen Gespräche mit Pflegenden, die sich mit der Krankheit auskennen. Ein Patientenratgeber kann hilfreich sein. Der Besuch einer Selbsthilfegruppe zur Krankheitsverarbeitung und -bewältigung kann auch in dieser Phase für die Patienten sehr hilfreich sein. Pflegende, die MS-Kranke betreuen, sollten Kenntnis über ortsnahe Gruppen haben, um den Patienten einen Kontakt zu erleichtern.
42.4.2.2 ATL Ausscheiden
Fallbeispiel
Frau Sörensen erkennt in der Rückschau, dass sie seit längerer Zeit auch eine Blasenentleerungsstörung hat. Sie verspürt auch bei geringen Blasenfüllmengen schon Harndrang und geht häufiger auf die Toilette. Unbewusst hat sie weniger getrunken, um nicht so häufig auf die Toilette zu müssen.
Viele Patienten haben schon in der frühen Phase der Erkrankung eine Blasenentleerungsstörung. Später ist sowohl eine Inkontinenz als auch ein Harnverhalt mit Restharnbildung möglich. Pflegerisches Ziel ist es, Komplikationen vorzubeugen. Mögliche Maßnahmen sind: Beckenbodentraining, Blasentraining (regelmäßige Toilettengänge ermöglichen), „Triggern“, regelmäßiges Fremdkatheterisieren, ▶ Anleitung zum intermittierenden Selbstkatheterisieren, ▶ Pflege eines suprapubischen Katheters.
Merke
Harnwegsinfekte haben einen negativen Einfluss auf den Muskeltonus und sind deshalb besonders bei Patienten mit MS zu vermeiden.
Zusätzlich kann eine Temperaturerhöhung im Rahmen eines Infekts zu einer Zunahme bereits vorhandener neurologischer Ausfälle führen. Die Symptomatik bildet sich mit abklingendem Fieber wieder zurück, ist also kein neuer Schub.
Mögliche Ursachen für Harnwegsinfekte bei Patienten mit MS sind:
-
ständig vorhandene Restharnmengen,
-
ein liegender transurethraler Dauerkatheter,
-
nicht steriles Einmalkatheterisieren.
42.4.2.3 ATL Sich waschen und kleiden
Ataxie, Spastik, Lähmung und Intentionstremor sind mögliche Symptome, die alltägliche Verrichtungen erschweren. Führen Sie die pflegerische Versorgung deshalb aktivierend und unter Berücksichtigung der Ressourcen des Patienten durch. Unterstützen Sie den Patienten nach Bedarf bei der Mobilisation und fördern Sie seine Eigenaktivität (z.B. beim Waschen am Waschbecken). Einen positiven Einfluss auf die Ataxie hat eine ruhige, stressfreie Pflegesituation. Bei schwer eingeschränkten MS-Patienten ist die Körperpflege nach dem Bobath-Konzept in einer stabilen Seitenlage eine Möglichkeit, Sicherheit, Stabilität und eine größtmögliche Selbstpflege zu verbinden.
Bei der Körperpflege ist zu beachten, dass viele MS-Patienten aufgrund von Sensibilitätsstörungen Berührung als unangenehm empfinden. Das kann eine vorhandene Spastik verstärken. Allerdings verschlimmert das Vermeiden von Berührung auf Dauer die Situation, denn durch „Nichtanfassen“ verliert das Gehirn mit der Zeit die Fähigkeit, Berührungen korrekt zu verarbeiten. Achten Sie deshalb besonders auf die Qualität Ihrer Berührungen.
Prävention und Gesundheitsförderung
Fassen Sie den zu unterstützenden Körperteil immer mit der ganzen Hand und nicht bloß mit den Fingerspitzen an. Diese Berührung ist angenehmer als der bloße Druck der Fingerspitzen.
Merke
Ein Vollbad mit sehr warmem Wasser sollte vermieden werden, da durch den Temperaturanstieg die Lähmung verstärkt werden kann.
42.4.2.4 ATL Sich bewegen
Lähmung, Spastik, Ataxie, Gleichgewichtsstörung, Koordinationsstörung, Sehstörung und Tremor sind die Symptome einer MS, die die Bewegung des Patienten erschweren. Lähmungen äußern sich in einem Schwere- bzw. Schwächegefühl. Viele Patienten mit MS haben im späteren Verlauf der Erkrankung ein typisches breitbeiniges, unsicheres Gangbild, verursacht durch die Kombination aus Koordinationsstörung und spastischer Parese.
Der Muskeltonus ist für koordinierte Bewegungsabläufe entscheidend. Jede Berührung und Bewegung verändert den Muskeltonus des Patienten. Pflegende haben durch achtsame, eindeutige Berührungen unter Beachtung der Reaktion des Patienten die Möglichkeit, positiven Einfluss auf Spastik und Bewegung zu nehmen. Durch einen akuten Schub einer MS kann es zu einer Verschlechterung der Mobilität des Patienten kommen. Pflegende haben an dieser Stelle die Aufgabe, Bewegung zu fördern, damit verlorengegangene Funktionen nicht verlernt werden und Sekundärschäden, wie Kontrakturen, Gelenkschäden oder Verkürzung der Muskulatur, nicht auftreten.
Definition
Kontrakturen sind Veränderungen der an der Gelenkfunktion beteiligten Strukturen, die Funktions- und Bewegungseinschränkungen zur Folge haben, d.h., das betroffene Gelenk lässt sich nicht mehr vollständig beugen, strecken, ab- oder adduzieren (Wingenfeld et al. 2011).
Zitiert aus: www.pflegegesellschaft-rlp.de
Gemessen wird häufig der Grad der Beweglichkeit (Range of Motion).
Die Gelenke sollten aus diesem Grund so positioniert werden, dass sich die zugehörige Muskulatur in einer entspannten Position befindet. Des Weiteren sind häufige Bewegungsübergänge elementar für eine sicheres Gefühl und die Wahrnehmung im Raum (Propriozeption). Für schwer betroffene MS-Patienten ist der Transfer vom Bett in den Rollstuhl nicht ohne Hilfe möglich. Schon das Aufsetzen an die Bettkante kann verschiedene Symptome auslösen ( ▶ Abb. 42.63).
Als unangenehm empfinden die Patienten einen Drehschwindel, der durch Kopfbewegungen ausgelöst werden kann. Eine ruhige, stressfreie Atmosphäre gibt dem Patienten die notwendige Sicherheit, die er für den Transfer benötigt, denn auch die Angst vor einem Sturz kann schon zu einer unkontrollierten Tonuserhöhung führen. Durch das Vorbeugen des Oberkörpers (Beugung in der Hüfte) des Patienten beeinflusst der Pflegende eine evtl. „einschießende“ Spastik der Beine positiv. Auch der Fußkontakt mit dem kalten Fußboden kann eine Spastik auslösen. Um das zu vermeiden, können Pflegende dem Patienten die Schuhe schon im Bett anziehen. Außerdem kann es zu einer unwillkürlichen rhythmischen Bewegung eines Beines bei Bodenkontakt kommen.
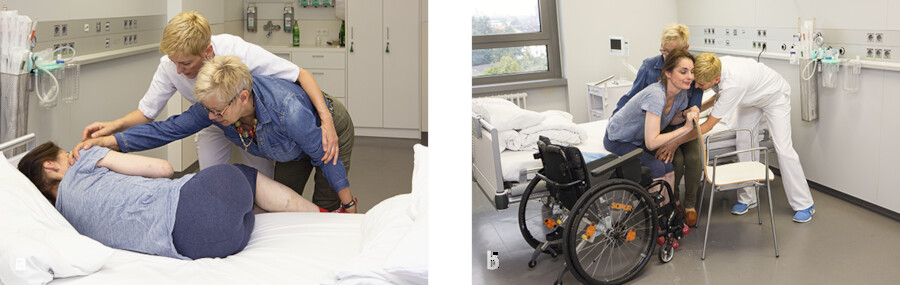
Schulung von Angehörigen.
Abb. 42.63 Die Angehörigen werden im Transfer geschult und können den Prozess des Lernens unterstützen.
(Fotos: K. Oborny, Thieme)
Praxistipp
Beim Bodenkontakt kann der Pflegende den Patienten auffordern, zu versuchen, diese Bewegung kognitiv zu beeinflussen. Hilfreich ist es auch, das Bein nochmal hochzuheben und anders zu positionieren.
Gezielte Reize an den Füßen können den Patienten dabei unterstützen, sich besser in seinem Körper zu orientieren. Das kann als Vorbereitung für einen Transfer hilfreich sein, da der Fußboden besser wahrgenommen wird ( ▶ Abb. 42.64).
Aufstehen und Stehen
Abb. 42.64 Das Aufstehen und Stehen stellt eine wichtige Kontrakturenprophylaxe dar und steigert die Motivation der Patientin. Die Umwelt sollte so gestaltet sein, dass sie eine Orientierung gibt und ein angstfreies Aufstehen möglich ist.
(Foto: K. Oborny, Thieme)
42.4.2.5 ATL Essen und Trinken
Essen und Trinken zu richten und einzunehmen kann im späteren Verlauf der MS durch Ataxie, Intentionstremor, Lähmung oder Spastik erschwert sein. Eine mangelnde Koordinationsfähigkeit führt zu unsicheren, ausfahrenden Bewegungen und damit zu einem Verlust von Geschicklichkeit.
Definition
Geschicklichkeit ist die Fähigkeit, Bewegungen zu variieren: Aspekte der Geschicklichkeit sind z. B. Feinabstimmung, Koordination, Präzision und Flexibilität. Geschicklichkeit meint hier nicht nur die Kontrolle über Hände und Finger, sondern allgemein die Fähigkeiten, sich den Anforderungen des Alltags anzupassen (Gjelsvik 2007).
Prävention und Gesundheitsförderung
Unterstützen Sie den Patienten dort, wo er Hilfe benötigt. Fördern und nutzen Sie die Ressourcen des Patienten aktiv, damit er so lange wie möglich (weitgehend) selbständig seinen Alltag gestalten kann.
Die Aufgabe der Pflege ist es aber auch, dafür zu sorgen, dass der Patient ausreichend Flüssigkeit zu sich nimmt. Im späteren Verlauf einer MS kann es auch zu einer Schluckstörung, verbunden mit der Gefahr der Aspiration und einer Aspirationspneumonie, kommen. Zur Einnahme der Mahlzeiten sollte der Patient in einer aufrechten Position, den Kopf leicht nach vorn gebeugt, sitzen. Flüssigkeiten werden, wenn notwendig, angedickt.
42.4.2.6 ATL Sich sicher fühlen
In einem akuten Schub erhalten Patienten mit MS Kortison i. v. Das kann zu einer Blutzuckererhöhung, zu Schlaflosigkeit und einer erhöhten Infektanfälligkeit führen.
Merke
Bei Patienten mit Diabetes mellitus sind häufige Blutzuckerkontrollen notwendig. Eine regelmäßige Kontrolle der Körpertemperatur ist wichtig, um einen möglichen Infekt frühzeitig zu erkennen.
42.4.2.7 Psychosoziale Gesichtspunkte
Erschöpfungszustände und schnelle motorische Ermüdbarkeit (Fatigue) als Symptom der MS können zu einer herabgesetzten Stimmung und Motivation des MS-Patienten führen. So individuell wie die Symptomatik eines MS-Patienten sind auch die unterschiedlichen Verläufe. Patienten entwickeln unterschiedliche Kompensationsstrategien. Die Adhärenz eines MS-Patienten kann durch die physischen und kognitiven Veränderungen beeinträchtigt sein. Sie ist aber entscheidend für eine positive Beeinflussung des Krankheitsverlaufs, z. B. bei der Mitarbeit bei den Therapien. Im Verlauf der Erkrankung kann es auch zu einer Wesensveränderung des MS-Patienten kommen, was sowohl Angehörige als auch Pflegende vor eine Herausforderung stellt.
42.5 Pflege von Patienten mit Morbus Parkinson
42.5.1 Medizinischer Überblick
42.5.1.1 Definition
Die Parkinson-Krankheit (lat.: Morbus Parkinson) wurde im Jahre 1817 von dem englischen Arzt James Parkinson in seinem Buch „Essay on the shaking palsy“ (Abhandlung über die Schüttellähmung) beschrieben. Das Parkinson-Syndrom oder die Parkinson-Krankheit ist eine Erkrankung der Basalganglien, die eine wichtige Rolle bei der Regulation der Motorik spielen.
42.5.1.2 Häufigkeit
Die Parkinson-Krankheit gehört zu den häufigsten neurologischen Erkrankungen. In Deutschland leben ca. 300 000 Patienten, die Zahl der Neuerkrankungen liegt jährlich bei ca. 20 000. Beide Geschlechter sind etwa gleich betroffen. Die Krankheit tritt i. A. nach dem 60. Lebensjahr auf, 10 % der Patienten sind beim Auftreten der ersten Symptome jünger als 40 Jahre. Die Erkrankungswahrscheinlichkeit steigt mit zunehmendem Alter.
42.5.1.3 Ursachen
Der Ausgangspunkt der Parkinsonerkrankung liegt in der schwarzen Substanz (Substantia nigra) im Mittelhirn. Dort befinden sich spezielle Nervenzellen, die den Botenstoff „Dopamin“ produzieren. Dopamin ist maßgeblich an der Steuerung von Bewegungen beteiligt. Durch das Absterben dieser Zellen kommt es zu einer verminderten Bereitstellung des Botenstoffes Dopamin, was zu einer langsam fortschreitenden Verminderung der Beweglichkeit führt. Als Ursache für das Absterben dieser Nervenzellen wird ein komplexes Zusammenwirken verschiedener Umwelt- und Anlagefaktoren angenommen.
Anatomie und Physiologie im Fokus
(nach Schwegler u. Lucius 2016)
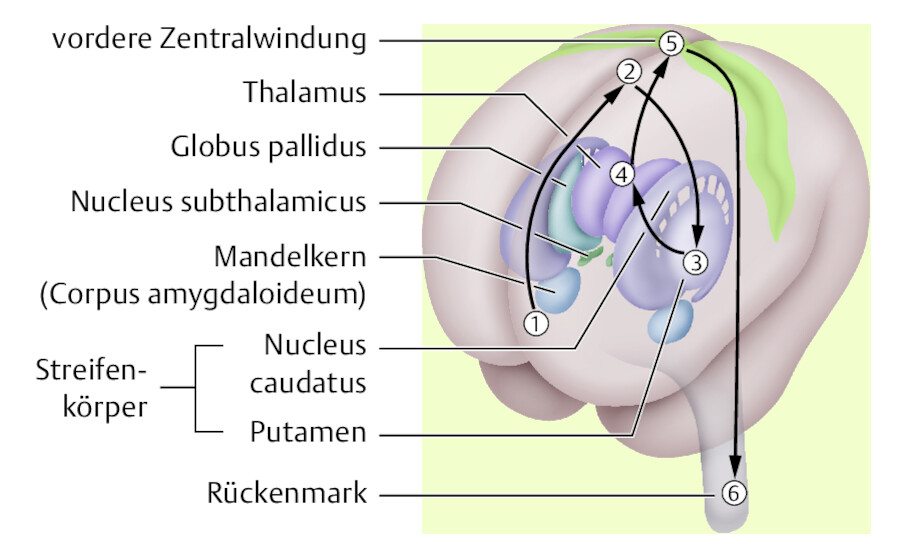
Vor der Ausführung einer Bewegung nimmt das Gehirn den wahrscheinlichen Bewegungsablauf vorweg ( ▶ Abb. 42.65). Nach dem Entschluss zur Bewegung im Frontalhirn (1) gelangen die Impulse in den oberen Stirnlappen ([2] prämotorische Hirnrinde), danach in die Basalganglien (3), den Thalamus (4), die primär motorische Hirnrinde (5) und erst jetzt ins Rückenmark (6).
Planung und Umsetzung einer Bewegung.
Abb. 42.65
Merke
Häufigste Ursache des Dopamin-Mangels ist das fortschreitende Absterben (Degeneration) der Nervenzellen in der schwarzen Substanz. Dies ist der Fall beim idiopathischen Parkinson-Syndrom (IPS).
Primäres Parkinson-Syndrom 95 % der Fälle werden unter dem Begriff des primären oder idiopathischen Parkinson-Syndroms (IPS) zusammengefasst (idiopathisch = Ursache unbekannt). Der Auslöser der Degeneration ist unbekannt. Diskutiert werden:
-
genetisch bedingter Enzymmangel
-
gestörte Entgiftungsfähigkeit des Gehirns
-
Umwelteinflüsse und oxidativer Stress
Sekundäres Parkinson-Syndrom Im Falle des sog. sekundären oder symptomatischen Parkinson-Syndroms sind die Auslöser bekannt. Durchblutungsstörungen des Gehirns, Tumor, Gehirnentzündung, Vergiftungen, Depressionen können zu Parkinson-Symptomen führen. Ebenso können sie medikamenteninduziert (Neuroleptika, Antiemetika) sein oder posttraumatisch auftreten.
Parkinson-Plus-Syndrome / atypisches Parkinsonsyndrom Dazu zählen Erkrankungen, die neben Parkinson-Symptomen auch weitere Erscheinungen zeigen. Diese Krankheiten betreffen nicht nur das bei Morbus Parkinson betroffene System, sondern mehrere Systeme gleichzeitig (Multisystematrophie). Die Erkrankung führt in diesen Fällen auch zur Zerstörung der Dopamin-Rezeptoren, sodass die adäquate Parkinson-Therapie nicht richtig wirksam sein kann.
Merke
Man unterscheidet primäre (Ursache noch unbekannt) von sekundären (Ursache bekannt) Parkinson-Syndromen.
42.5.1.4 Symptome
Die Erkrankung beginnt schleichend und schreitet danach zeitlebens fort, die Symptome werden im Verlauf stärker und daher auch besser erkennbar. Das Idiopathische Parkinson-Syndrom beginnt typischerweise einseitig (und bleibt im Verlauf einseitig stärker); als Frühzeichen gilt beispielsweise das reduzierte und später fehlende Mitschwingen eines Armes beim Laufen sowie Störungen des Geruchs- und Geschmackssinns. Häufig treten Schulterschmerzen und einseitige Muskelverspannungen auf, die den Patienten zuerst zum Orthopäden führen.
Man spricht von 4 Leit- oder auch Kardinalsymptomen,
-
Bradykinese,
-
Rigor,
-
Tremor und
-
posturale Instabilität.
Das Parkinson-Syndrom ist definiert durch das Vorliegen einer Bradykinese und eines der 3 anderen Leitsymptome.
Kardinalsymptom Akinese
Definition
Als Bradykinese wird die Verlangsamung der Bewegungen bezeichnet. Dazu zählen auch eine Verkleinerung des Bewegungsausmaßes (Hypokinese) und die Schwierigkeit, eine Bewegung überhaupt zu beginnen.
Zunächst reduzieren sich Mimik (Pokergesicht) und Gestik, dann die Feinmotorik, (z. B. Knöpfe zumachen, Zähneputzen usw.). Beim Schreiben werden die Buchstaben immer kleiner (Mikrografie).
Körperhaltung Typisch ist die eingerollte Körperhaltung, Kopf und Rumpf sind nach vorne gebeugt, die Arme angewinkelt, der Blick auf den Boden gerichtet.
Bewegungen Automatische Bewegungsabläufe gehen verloren: Das Mitschwingen der Arme beim Gehen ist eingeschränkt oder aufgehoben. Der Gang ist kleinschrittig, schlurfend, das Abrollen fehlt, der Patient geht auf Fußspitzen. Das Wenden ist mehrschrittig.
Freezing Typisch sind die Starthemmungen (Freezing) des Gehens, z. B. beim Starten, an Türschwellen, vor Engpässen: Der Patient bleibt wie angefroren oder angeklebt stehen und kann die Bewegung nach vorne nicht ohne Hilfe durchführen. Es kommt auch vor, dass er beim Gehen immer schneller wird, bis er hinfällt. Alltägliche Verrichtungen wie An- und Ausziehen, Körperpflege, Nahrungsaufnahme, Umdrehen im Bett oder Aufstehen aus dem Bett werden immer schwieriger.
Sprache Auch die Stimme ändert sich, wird heiser und leise, die Sprache wird verwaschen und schwer verständlich.
Kardinalsymptom Rigor
Definition
Als Rigor (Steifheit) wird der erhöhte Tonus der Muskulatur bezeichnet, der (im Gegensatz zur Spastik bei Schlaganfall- oder Multiple-Sklerose-Patienten) in der Beuge- und Streckmuskulatur gleichzeitig vorhanden ist.
Zahnradphänomen Bei passiver Bewegung der Großgelenke ist ein wächserner Widerstand und das sog. „Zahnradphänomen“ zu spüren: Die passive Bewegung ist ruckartig, abgehackt.
Luftkissenphänomen Der hochgradige Nackenrigor führt bei bettlägerigen Patienten zum sog. „Luftkissenphänomen“. Dabei liegt der Patient steif in der Rückenlage, der Kopf ist nach vorne gebeugt, wie auf einem unsichtbaren Kopfkissen. Der starke Rigor der Muskulatur und die Unfähigkeit des Patienten, sich im Bett zu drehen, verursachen heftige Schmerzen und ein unerträgliches Brennen der Haut.
Kardinalsymptom Tremor
Definition
Das für das Parkinson-Syndrom typische Zittern beginnt einseitig an einem Arm oder einem Bein und kann sich dann auf die anderen Gliedmaßen ausbreiten. Typisch für die Parkinsonerkrankung ist ein Ruhetremor.
Der Tremor lässt während der willkürlichen Bewegung nach und verschwindet im Schlaf. Auch ein sog. Halte-, selten auch ein Aktionstremor (z. B. beim Trinken) kann vorhanden sein. Der für die Multiple Sklerose typische Intentionstremor ist bei Morbus Parkinson nicht zu beobachten.
Kardinalsymptom posturale Instabilität
Definition
Unser Gleichgewicht wird durch Reflexe reguliert, die weitgehend automatisch ablaufen. Bei dem Parkinson-Syndrom sind diese Reflexe vermindert, sodass Betroffene immer weniger in der Lage sind, sich selbst aufzufangen, wenn sie aus dem Gleichgewicht geraten.
Fallbeispiel
Bereits vor 2 Jahren, während eines Winterurlaubs, war Herrn Schäfer beim Skifahren eine für ihn bis dahin unbekannte Ungeschicklichkeit aufgefallen, auch traute er sich nicht mehr an größere Abfahrten. In besonders glimpflichen Situationen hatte sogar seine rechte Hand gezittert. In den darauffolgenden Monaten konnte er immer schlechter schlafen und seiner Frau fiel auf, dass er im Schlaf laut schrie und um sich schlug. Seine Schrift wurde kleiner und schlechter lesbar und hin und wieder stolperte er mit dem rechten Fuß über eine Teppichkante. Gerüche konnte er schon länger nicht mehr so gut wahrnehmen, eine Untersuchung beim Hals-Nasen-Ohren-Arzt hatte jedoch keine Ursache finden können. Als er sich auch seelisch angegriffen fühlte – ständig kamen ihm wegen Kleinigkeiten gleich die Tränen –, suchte er ärztliche Hilfe. Diagnose: beginnendes Parkinson-Syndrom.
Vegetative Symptome
Bekannte vegetative Symptome sind:
-
Störungen der Wärmeregulation (starkes Schwitzen, besonders in der Nacht)
-
erhöhte Talgsekretion der Haut (Salbengesicht, ▶ Abb. 42.66)
-
Verlust des Geruchsinns (Frühsymptom)
-
Schmerzen (auch als Anfangssymptom)
-
nachlassende Stresstoleranz und Flexibilität
-
Störungen von Gedächtnis und Orientierung
-
Schlafstörungen
-
Aufmerksamkeit (Multitaskingfähigkeit nimmt ab)
-
chronische Obstipation
-
Blasenstörungen
Vegetative Symptome.
Abb. 42.66 Das Gesicht eines Parkinson-Patienten zeigt typische Züge: nach vorn geneigter Kopf, ölige Gesichtshaut („Salbengesicht“), fehlende Mimik.
(Foto: K. Gampper, Thieme)

Psychische Symptome
Typische Erscheinungen sind:
-
Antriebsmangel
-
Depression (auch als alleiniges Anfangssymptom)
-
Verlangsamung der höheren psychischen Vorgänge (Bradyphrenie)
-
im späteren Stadium auch Demenz
Die Bradyphrenie ist zusammen mit der fehlenden emotionalen Reaktion (Maskengesicht, Pokergesicht) der Grund dafür, dass der Patient häufig den Eindruck eines psychisch kranken oder abgebauten Menschen macht.
Primäre Persönlichkeit Parkinson-Patienten werden charakterisiert als gewissenhaft, präzise, akkurat, ängstlich, zurückhaltend, schamhaft, schnell resignierend, subdepressiv. Diese Eigenschaften verstärken sich häufig im Laufe der Erkrankung.
Emotionale Symptomverstärker Äußere psychische Einwirkungen wie Kummer, Stress, aber auch Freude können die körperlichen Symptome deutlich verschlechtern. Es ist am Beispiel des Zitterns gut zu sehen, aber auch weitere Symptome wie die Starthemmung und die Schwankung der Medikamentenwirkung zeigen eine erhebliche emotionale Beeinflussbarkeit. Auch Beobachtung und insbesondere Zeitdruck wirken als Symptomverstärker.
Symptome in der späten Krankheitsphase
Dank der modernen Parkinson-Therapie ist diese Krankheitsphase von den meisten Parkinson-Patienten nicht zu befürchten. Nach langjährigem Verlauf lässt die Wirkung der Medikamente nach, Akinese und Rigor nehmen zu, der Patient kann ohne Hilfe nicht mehr aufstehen oder gehen. Beim Gehversuch fällt er ständig hin, ist extrem frakturgefährdet und wird bettlägerig. Kauen, Schlucken ist nicht mehr möglich, die Nahrungsaufnahme kann nur durch Nasensonde oder durch PEG sichergestellt werden. Wegen der Blasenentleerungsstörung wird eine ▶ suprapubische Ableitung gelegt.
Merke
Bei vollständiger Unbeweglichkeit ist der Patient extrem pneumonie-, dekubitus- und kontrakturgefährdet.
Akinetische Krise
Dieser lebensbedrohliche Zustand kann bei Patienten in fortgeschrittenem Zustand auftreten. Häufigste Ursache ist, dass die Medikation aus irgendeinem Grund für längere Zeit (Tag, Tage) unterbrochen wird. Aber auch Exsikkose, Infektionskrankheiten, Narkose mit verzögerter Gabe der Parkinson-Mittel können die Auslöser sein. Der Zustand ist durch starken Rigor und totale Akinesie gekennzeichnet. Der Patient kann nicht sprechen und schlucken, er bekommt hohes, zentrales Fieber. Die Krise kann zum Tod führen, wenn der Patient nicht rechtzeitig adäquat behandelt wird.
Fallbeispiel
Frau Marianne Groß litt seit 12 Jahren unter einem Parkinson-Syndrom mit Steifheit in den Gelenken, Unbeweglichkeit und depressiven Verstimmungen. Bisher konnten ihr die Medikamente immer eine Erleichterung verschaffen, obgleich sie nun bereits 81 Jahre alt ist. Seit 2 Monaten jedoch stellte sich eine ausgeprägte Unsicherheit beim Gehen ein. Sie stürzte mehrfach und bei ihrem letzten Sturz zog sie sich eine Oberschenkelhalsfraktur zu. Sie musste in ein Krankenhaus und wurde operiert. Im Krankenhaus wurden die Parkinsonmedikamente drastisch reduziert und nach der Operation – sie konnte sehr schlecht schlucken –, ließ man die „vielen“ Medikamente einfach weg. Daraufhin wurde Frau Groß völlig unbeweglich und steif, schlucken konnte sie gar nicht mehr, sie entwickelte hohes Fieber und ein ausgeprägtes Zittern des ganzen Körpers. Diagnose: akinetische Krise durch postoperatives Absetzen der Parkinsonmedikation.
Prävention und Gesundheitsförderung
Eine ordnungsgemäße prä- und postoperative Verabreichung der Parkinsonmedikamente verhindert die Entstehung einer akinetischen Krise.
42.5.1.5 Diagnostik
Die Diagnose wird meist klinisch gestellt, d. h. aufgrund der Symptome. Sie ist insbesondere in der Frühphase schwierig. Die Diagnose gilt als gesichert, wenn eine Bradykinese und ein weiteres Kardinalsymptom vorliegen. Weiteres Kriterium ist eine Reduktion der Symptome nach Gabe von L-Dopa oder Dopamin-Agonisten (L-Dopa-Test, Apomorphin-Test). In fraglichen Fällen kann der Dopaminmangel im Gehirn durch die Positronen-Emissions-Tomografie (L-Dopa-PET) nachgewiesen oder der sog. Dopamin-Transporter durch DAT-SCAN dargestellt werden.
42.5.1.6 Therapie
Nach Entdeckung des Dopaminmangels im Gehirn wurde vor ca. 40 Jahren die sog. L-Dopa-Substitution (substituieren = ersetzen) eingeführt.
-
Ein Zusatzstoff (Decarboxylase-Hemmer) verhindert, dass L-Dopa, noch bevor es das Gehirn erreicht, in Dopamin umgewandelt wird.
-
COMT-Hemmer verbessern die Verfügbarkeit des eingenommen L-Dopa im Gehirn.
-
MAO-B-Hemmer reduzieren den zentralen Abbau von Dopamin im Gehirn.
-
Dopamin-Agonisten stimulieren direkt den Dopamin-Rezeptor.
-
Effektive Antiparkinsonmittel sind auch die Glutamat-Antagonisten (Amantadin).
Die Medikation ist besonders in den ersten 5 – 7 Jahren der Erkrankung sehr wirksam. Obwohl ein Fortschreiten der Krankheit noch nicht beeinflussbar ist, verschafft die Therapie eine fast symptomfreie Phase.
Im weiteren Verlauf der Erkrankung können sog. eskalative Therapieformen indiziert sein:
-
Duodopa-Pumpe: kontinuierliche Gabe von L-Dopa über eine PEJ (perkutane endoskopische Jejunostomie). Besonders für Patienten im fortgeschrittenen Krankheitsstadium geeignet, die trotz optimaler oraler medikamentöser Behandlung unter Wirkfluktuationen leiden.
-
Apomorphin-Pumpe: kontinuierliche Gabe von Apomorphin über eine Pumpe subkutan. Besonders geeignet für Patienten die trotz optimaler medikamentöser Behandlung unter Wirkfluktuationen leiden.
-
Tiefe Hirnstimulation: für jung erkrankte Parkinsonpatienten, die trotz optimaler medikamentöser Gabe unter Wirkfluktuationen leiden; oder Patienten bei denen der Tremor das Hauptsymptom ist.
L-Dopa-Spätsyndrom
Im späteren Verlauf kann das Dopamin nicht mehr gespeichert werden und die Dopamin-Rezeptoren werden überempfindlich (L-Dopa-Spätsyndrom). Dies ist gekennzeichnet durch Schwankungen der Medikamentenwirkung und heftige Überbewegungen.
In fortgeschrittenen Phasen der Langzeitbehandlung können auch psychische Nebenwirkungen (Albträume, Halluzinationen, Paranoidität, Delir) auftreten.
Fallbeispiel
Ängstlich schaut Herr Michael Butz um sich: Da sind lauter Personen im Raum, die er nicht kennt und die ihm Angst machen. Laut ruft er nach seiner Frau ... Herr Butz ist 75 Jahre alt und leidet seit 15 Jahren unter dem Parkinson-Syndrom. Da er sehr unbeweglich geworden ist, hat der Neurologe ihm vor 2 Tagen ein neues Medikament zusätzlich verordnet, um die Beweglichkeit zu verbessern. Leider hat dieses Medikament nun zu den oben beschriebenen Trugwahrnehmungen geführt. Nach einem Anruf beim Neurologen wird es wieder abgesetzt und die Trugbilder verschwinden. Ein durch den Neurologen daraufhin angeordneter Gedächtnistest zeigt jedoch eine beginnende Parkinson-Demenz. Herr Butz muss von nun an mit Dosissteigerungen oder neuen Medikamenten sehr vorsichtig sein. Gut, dass er sich so schnell bei seinem Arzt gemeldet hat.
Begleittherapie
Die Parkinson-Therapie ruht auf 4 Pfeilern:
-
Medikation
-
motorischen Begleittherapien (Physiotherapie, Ergotherapie, Logopädie)
-
begleitende Psychotherapie
-
Partner- und Familien-Therapie
42.5.2 Pflege- und Behandlungsplan
42.5.2.1 Psychosoziale Unterstützung
Die psychischen Symptome und die primäre Persönlichkeit der Patienten sowie die Rolle der emotionalen Symptomverstärker erfordern ein besonders sensibles Verhalten der Pflegenden. Die Patienten können plötzliche Veränderungen nur schwer verkraften. Viele verstehen das zu lustige, witzelnde Verhalten der Umgebung nicht, fühlen sich schnell beleidigt.
Ausführliche, geduldige Gespräche sind notwendig, damit der Patient die notwendigen Pflegemaßnahmen versteht. Das Fehlen der nonverbalen Kommunikation, die Sprachstörung, reduzierte Mimik und Gestik (Pokergesicht) und die extreme psychische Verlangsamung des Patienten (Bradyphrenie) erschweren Gespräche.
Simultane Aufgaben vermeiden Infolge der fortgeschrittenen Krankheit sind die Patienten meist nicht in der Lage, 2 verschiedene Aufgaben gleichzeitig zu bewältigen. Der Versuch, mit einer Tasse Tee zum klingelnden Telefon zu gehen, endet oft mit Sturz oder mit Verschütten des Tees.
Praxistipp
Überfordern Sie Parkinson-Patienten nicht, formulieren Sie kurze und eindeutige Aufgabenstellungen. Vermeiden Sie jegliche Hast und Eile, diese wirken sich eher negativ aus!
Hilfe zur Selbsthilfe Ein wichtiges Pflegeziel ist, die Selbstständigkeit des Patienten zu erhalten und zu fördern (aktivierende Pflege). Informieren Sie den Patienten und seine Angehörigen über regionale Selbsthilfegruppen. Die deutsche Parkinson Vereinigung e.V. kann hier eine zentrale Anlaufstelle sein.
Tagesstruktur und Beschäftigung Besonders wichtig ist ein geordneter Tagesablauf:
-
aufstehen zur gleichen Tageszeit
-
regelmäßige Mahlzeiten
-
pünktliche Medikamenteneinnahme
-
Einhalten der Therapiezeiten
Merke
Stress, Zeitnot und Unbeständigkeit sind „Gift“ für Parkinson-Patienten. Gleichzeitige Aufgabenstellungen sollten vermieden werden. Musikhören, Fernsehen, Teilnahme an Festen, aber noch mehr die aktiven Vergnügungen wie Hobbys, gestalterische, evtl. künstlerische Tätigkeiten (Kreativitätstherapie) steigern die Lebensqualität.
Prävention und Gesundheitsförderung
Regelmäßige Krankengymnastik und soziale Aktivitäten wirken dem Fortschreiten der Parkinson-Krankheit entgegen.
42.5.2.2 Umgebung gestalten
Um die Selbstständigkeit zu erhalten und zu fördern, wird die Umgebung des Patienten bewusst gestaltet.
Gestaltung des Raums
Folgendes sollte beachtet werden:
-
Räumliche Enge fördert die Starthemmungen und dadurch die Fallneigung. Evtl. müssen Möbelstücke weggeräumt werden.
-
Die zu bewältigenden Wege sollten kurz, dem Patienten gut vertraut, in der Nacht beleuchtet und mit Festhaltemöglichkeiten versehen sein. Haltegriffe sind auch im Bad, neben der Toilette, in der Dusche und neben dem Waschbecken notwendig.
-
Ein großer oder schwenkbarer Spiegel erleichtert die Morgentoilette, ein großer Spiegel im Zimmer ermöglicht die Haltungskorrektur.
-
Höher montierte WC-Becken oder Toilettensitzerhöhungen helfen beim selbstständigen Aufsuchen der Toilette.
-
Türschwellen und andere Stolperfallen, z. B. Teppiche, elektrische Leitungen quer durch das Zimmer, sind zu vermeiden.
Auswahl der Möbel
Bei der Auswahl der Möbel ist Folgendes zu beachten:
-
Patienten fällt es leichter, aus einem harten Armlehnstuhl aufzustehen als aus einem weichen Stuhl ohne Lehne.
-
Das Bett sollte höhenverstellbar sein. Spezielle Aufrichte-Vorrichtungen („Bettaufrichter“) ermöglichen das Aufstehen, das Drehen und den Lagewechsel im Bett.
-
Evtl. ist ein Bettgitter notwendig, um zu verhindern, dass die Patienten aus dem Bett fallen.
-
Die Matratze darf nicht so weich sein, dass die Patienten einsinken.
-
Seidene Bettwäsche fördert die Beweglichkeit und wirkt schmerzreduzierend.
-
Eine zu schwere Bettdecke schränkt die Beweglichkeit des Patienten ein und führt zu Wärmestau.
42.5.2.3 ATL Sich waschen und kleiden
Kleidung auswählen
Bei der Auswahl geeigneter Kleidung sind motorische Einschränkung und Wärmeregulationsstörung des Patienten zu beachten:
-
Schweißdurchlässige, leichtere Kleidung ist zu bevorzugen. Zu warme Kleidung verursacht bei höheren Temperaturen Wärmestau, zu leichte Kleidung bei Kälte führt zu Erkältung oder auch Pneumonie.
-
Bei starkem Schwitzen muss die Kleidung auch tagsüber öfter gewechselt werden. Bei Schweißausbrüchen in der Nacht müssen das Nachthemd und oft auch die Bettwäsche mehrfach gewechselt werden.
An- und Auskleidehilfe
Beim An- und Ausziehen soll der Patient so viel wie möglich selbst machen:
-
Kleidungstücke mit Reißverschluss oder mit Klettverschluss erleichtern das Anziehen.
-
Festes Schuhwerk mit rutschfesten Sohlen fördert die Gangsicherheit.
-
Schuhe ohne Schnürsenkel sind einfacher anzuziehen, insbesondere mit einem langen Schuhlöffel.
-
Mit einem Greifarm lassen sich Strümpfe einfacher hochziehen.
Körperpflege
Auch bei der täglichen Körperpflege sollte dem Patienten nur so viel Hilfeleistung gegeben werden wie nötig:
-
Ein geeigneter Duschstuhl, Haltegriffe, elektrische Zahnbürste, Elektrorasierer, Bürste mit langem Griff erhalten die Selbstständigkeit.
-
Auch stark unbewegliche Patienten sollten möglichst nicht im Bett gewaschen werden, sondern im Duschstuhl sitzend.
Frühmorgendliche Akinese Wird dem Patienten die erste L-Dopa-Dosis noch im Bett, ca. eine ¾ Stunde vor dem Aufstehen, verabreicht, erleichtert dies die Morgentoilette. Vor dem Wirkungseintritt sind die meisten Patienten unbeweglich (frühmorgendliche Akinese), sodass jede Verrichtung in dieser Zeit dem Patienten nur Qualen bereitet.
Hautpflege
Wegen des übermäßigen Schwitzens besteht eine erhöhte Gefahr von Hautpilzinfektionen. Die Körperhygiene ist bei inkontinenten Patienten besonders wichtig. Maßnahmen sind:
-
gründliche Intimhygiene und Abtrocknen (evtl. mit Fön)
-
häufige Haarwäsche, evtl. mit medizinischen Spezialmitteln (wegen der Schuppenbildung)
-
kontrollierte Mundpflege (verhindert Zahnfleischentzündungen und Mundgeruch und beugt einer Soor-Infektion vor)
Praxistipp
Infolge der erhöhten Talgproduktion entstehen Hautentzündungen mit Schuppen- und Aknebildung. Regelmäßiges Waschen mit Spezialmitteln kann in diesen Fällen helfen. Einige Patienten klagen über eine ausgeprägte Trockenheit der Haut, überwiegend an den unteren Extremitäten. Bei Hauttrockenheit sind pH-neutrale Salben, Ölbäder und Verzicht auf Seife angebracht.
42.5.2.4 ATL Essen und Trinken
Die Nahrungsaufnahme ist besonders im Spätstadium durch Bewegungsstörungen und Zittern für die Patienten beschwerlich. Spezielle Gegenstände erleichtern die Nahrungsaufnahme:
-
eine große Serviette, um die Kleidung zu schonen
-
Besteck mit Moosgummi-Griff ( ▶ Abb. 42.67 a)
Hilfsmittel beim Essen.
Abb. 42.67 a Durch die Verdickung der Griffflächen kann der Parkinson-Patient das Besteck besser halten, b der erhöhte Tellerrand erleichtert die Nahrungsaufnahme.

-
Antirutschmatte
-
Teller mit erhöhtem Rand ( ▶ Abb. 42.67 b)
-
stabiles Glas, dieses nur halb füllen und evtl. Strohhalm bereitlegen
Nahrungszubereitung und -aufnahme
Es ist wichtig, dass der Betroffene genügend Zeit zum Essen hat. Eine Pflegeperson ist in der Nähe, die ggf. das Essen mundgerecht schneidet oder bei Missgeschicken bzw. beim Verschlucken sofort eingreift. Evtl. muss das Essen wiederholt erwärmt werden. Viele Patienten können mundgerechte, kleingeschnittene oder passierte Nahrung selbständig und auch allein zu sich nehmen. Bei schwerkranken Parkinson-Patienten ist eine ausreichende Nahrungsaufnahme nur zu erreichen, wenn die Nahrungsaufnahme durch eine Pflegeperson unterstützt wird.
Das Kauen ist häufig gestört, der Patient hält Essensreste für längere Zeit im Mund. Dies führt zu Entzündungen, in diesem Fall sollte nach jedem Essen eine Kontrolle durchgeführt werden. Das häufige Verschlucken beim Essen ist ein Alarmzeichen und erhöht die Gefahr, eine Aspirationspneumonie zu entwickeln.
Nach dem Essen ist eine Mundhygiene durchzuführen. Durch regelmäßige Gewichtskontrollen lässt sich einschätzen, ob der Patient ausreichend isst.
Flüssigkeitsaufnahme
Täglich sollen 2 – 3 l Flüssigkeit getrunken werden ( ▶ Abb. 42.68). Austrocknung kann zu Verschlechterung der Symptome, zu Obstipation, zu Verwirrtheit und sogar zu einer akinetischen Krise führen, insbesondere bei hohen Temperaturen im Sommer.
Trinkmenge.
Abb. 42.68 Eine zu geringe Flüssigkeitszufuhr kann zur Verschlechterung der Symptomatik bis zur ▶ Akinetischen Krise führen.
(Foto: K. Oborny, Thieme)

Merke
Häufig sind Ein- und Ausfuhrkontrollen notwendig, wobei auch übermäßiges Schwitzen der Patienten zu berücksichtigen ist. Bei einer negativen Bilanz erhält der Patient ggf. Infusionen.
Ernährungsrichtlinien
Es gibt keine Spezialdiät für Parkinson-Patienten. Zu empfehlen ist eine leichte, abwechslungsreiche, vitamin- und ballaststoffreiche Nahrung mit ausreichender Trinkmenge. Die Portionen sollen eher kleiner sein, den Magen nicht belasten, die Mahlzeiten sollen häufiger gereicht werden.
Eiweiß-Akinese L-Dopa-Präparate müssen eine halbe Stunde vor oder anderthalb Stunden nach einer eiweißreichen Mahlzeit eingenommen werden. L-Dopa-haltige Medikamente dürfen nicht mit Milch oder Joghurt eingenommen werden. Bei der Aufspaltung von Eiweiß im Verdauungstrakt entstehen Aminosäuren, die die Aufnahme und dadurch die Wirkung von L-Dopa (selbst auch eine Aminosäure) verhindern.
42.5.2.5 ATL Ausscheiden
Häufig leiden die Patienten unter nächtlichem Harndrang. Hilfsmittel (Toilettenstuhl neben dem Bett, Urinflasche in Griffweite, Urinal-Kondome, Medikamente) können Erleichterung bringen. Inkontinente Patienten sind mit Inkontinenz-Schutzhosen bzw. Ähnlichem (Kondomurinal etc.) zu versorgen.
Die Ausscheidungen müssen kontrolliert werden, um rechtzeitig einen totalen Harnverhalt oder einen Darmverschluss zu erkennen. Richtige Ernährung (Ballaststoffe, eingelegtes Obst, Müsli), ausreichende Flüssigkeitsmenge und evtl. makromolekulare Trinklösungen können der Darmträgheit (Obstipation) entgegenwirken.
42.5.2.6 ATL Sich bewegen
Die Verbesserung der selbstständigen Bewegungsabläufe ist vorrangige Aufgabe der therapeutisch aktivierenden Pflege und einer gezielten Physiotherapie. Pflegende sollen diese Übungen im Alltag ständig weiterführen bzw. umsetzen. So lange wie nur möglich soll vermieden werden, dass der Patient immobil oder rollstuhlpflichtig wird. Verschiedene Hilfen und „Tricks“ zur Bewältigung von Bewegungsstörungen erleichtern das Leben der Patienten und die Arbeit der Pflegenden. Hierfür sind Fortbildungen im Bobath-Konzept, in der Basalen Stimulation oder der Kinästhetik hilfreich.
Rehabilitation im Fokus
Bewältigung von Bewegungsstörungen
Aufstehen aus dem Stuhl
Der Patient rutscht langsam mit dem Gesäß nach vorn an die Stuhlkante, zieht die Füße nach hinten, beugt den Oberkörper nach vorn, stützt sich mit den Händen ab, holt Schwung und steht so auf.
Gehen
Wenn der Patient steht, drückt er die Knie durch, bleibt eine Weile stehen und geht erst dann los:
-
Beim Gehen auf Schrittlänge achten, um Trippelschritte zu verhindern.
-
Richtiges Abrollen (Aufsetzen der Ferse zuerst) verhindert Trippelschritte und ermöglicht einen harmonischen und sicheren Gang.
-
Beim Umdrehen während des Gehens dem Patienten zeigen, dass er sich nicht eng, mehrschrittig auf der Stelle drehen soll, sondern einen kleinen Bogen geht.
Hilfsmittel
-
optische Reize auf dem Fußboden (Querstreifen, Schachbrettmusterung)
-
Rhythmus und Musik
-
Reichen einer Hand
-
Gehwagen (Rollator mit 4 Rädern, Bremse und Sitzfläche)
-
Unterarmwagen (zur Mobilisierung vorher bettlägeriger Patienten)
Unterstützung bei Freezing
Der Patient ist nicht in der Lage, den ersten Schritt zu machen. Er scheint wie eingefroren (freezing). Beim Gehversuch schnellt der Oberkörper nach vorn, die Füße bleiben festgeklebt und wenn der Patient sich nicht festhalten kann, fällt er nach vorn. Stress (z. B. Telefonklingeln), Zeitdruck und Emotionen können diese Freezing-Erscheinung zusätzlich verstärken.
Bewegungsempfehlung
-
Wenn der Patient nicht nach vorn gehen kann, sollte er einen Schritt zur Seite machen (Ausfallschritt) und sofort weitergehen
-
Beine hochreißen (Storchengang)
-
auf der Stelle treten und Gehvorgang sofort weiterführen
Reizgebung
Optische und akustische Reize können eingesetzt werden:
-
Kleines Stoffstück an einem Bindfaden befestigen und z.B. in der Hosentasche mitführen. Bei Bedarf das Stoffstück vor die Füße werfen und den Bindfaden dabei festhalten, darübertreten und den Bindfaden wieder einziehen.
-
Querstreifen am Boden zum Üben
-
nicht die Türschwelle, den Rahmen oder den eigenen Fuß anschauen, sondern das Ziel
-
Selbstkommandos (1 – 2 – 3, rechts – links) oder ein Schlag auf den Oberschenkel als Starthilfe (evtl. Marschmusik oder ein Taktgeber im Handy)
-
spezieller Freezing-Gehstock (per Tastendruck kommt ein farbiger Querstreifen unten aus dem Stock, der Patient tritt über diesen Streifen und lässt den Knopf los, ▶ Abb. 42.69 b)
Morbus Parkinson.
Abb. 42.69 Therapiemaßnahmen.
Abb. 42.69a Krankengymnastische Übungen sollen die Betroffenen animieren, ihre Schrittlänge zu vergrößern.
(Foto: K. Gampper, Thieme)

Abb. 42.69b Wenn das Signal unten am Freezing-Gehstock auf Knopfdruck ausklappt, hilft dieser Reiz dem Patienten, die Starthemmung zu überwinden.
(Foto: K. Gampper, Thieme)

Unterstützung
Auch die Helfer können mit einigen „Tricks“ die Starthemmung beeinflussen:
-
eigenen Fuß quer zum Patienten stellen und ihn bitten, darüberzusteigen
-
hinter den Patienten stellen und seinen Körper abwechselnd nach links und rechts bewegen
Anleitung zum Selbsttraining
Korrektur der gebeugten Haltung
Zum Üben der aufrechten Haltung stellt sich der Patient täglich mehrfach an die geschlossene Schranktür und versucht mit dem Hinterkopf das Türblatt zu erreichen.
Förderung der Feinbeweglichkeit der Hände
Handarbeit, Zeichnen, Malen, Arbeiten mit dem Softball und dem Igelball sollten nicht nur während der Physio- und Ergotherapie stattfinden, sondern fester Bestandteil des Alltags werden ( ▶ Abb. 42.70).
Basteln fördert die Feinbeweglichkeit der Hände.
Abb. 42.70
(Foto: spuno/adobe.stock.com)

Mobilisierung des bettlägerigen Patienten
Auch der immobile und bettlägerige Patient wird in der maximalen Nutzung seiner Ressourcen unterstützt. Ein Bettaufrichter oder andere Aufrichthilfen (Bettleiter) sowie das Ausnutzen von Kraftreserven und die Bewegung über Rotation fördern die Eigenbeweglichkeit. Der unbewegliche Patient soll nicht den ganzen Tag im Bett verbringen, sondern soll vormittags und nachmittags in einen Pflegestuhl gesetzt werden. Passive und aktive Lockerungsübungen im Bett sind mit der physiotherapeutischen Behandlung abzustimmen.
42.5.2.7 ATL Wach sein und schlafen
Die nächtliche ▶ Akinese quält viele Patienten. Sie betrifft auch Patienten, die tagsüber einigermaßen gut beweglich sind. Das starre Liegen im Bett kann dazu führen, dass der Patient häufig klingelt und bittet, seine Lage im Bett zu verändern. Er klagt über Schmerzen, ein brennendes Gefühl im ganzen Körper, ineffektiven Harndrang oder ein diffuses Schwitzen.
Aber auch nächtliche Überbewegungen, schlechte Träume, Sinnestäuschungen können den Nachtschlaf stören. Physikalische Maßnahmen (Spaziergang vor dem Schlafengehen, Sedativ-Bad) und „Schlafrituale“ (Musikhören, Lesen) können hilfreich sein.
42.5.2.8 Medikamentengabe
Eine der wichtigsten pflegerischen Maßnahmen ist es, die pünktliche (mitunter minutengenaue) Einnahme der Medikation sicherzustellen.
Einnahmezeiten Der Parkinson-Patient erhält im fortgeschrittenen Stadium eine medikamentöse Kombinationstherapie, die evtl. aus 4 – 5 Parkinsonmitteln besteht. Die Einzeldosen werden oft in engen zeitlichen Abständen, evtl. 7–10-mal täglich, gegeben. Um Schwankungen der Medikamentenwirkung zu vermeiden, ist die pünktliche Einnahme unvermeidlich. Auch kleine Verspätungen können dazu führen, dass der Patient in eine lange unbewegliche Phase („Off“) rutscht.
Merke
Die Wirkungsschwankungen können in Zusammenhang mit der Medikamenteneinnahme auftreten, in diesen Fällen reicht die Wirkung nicht bis zur nächsten Medikamenteneinnahme aus („End-of-dose“-Phänomen). Die von der Medikation unabhängigen und dadurch unvorhersehbaren Schwankungen („On-off-Perioden“) führen oft dazu, dass der gutbewegliche und fast symptomfreie Patient plötzlich absolut bewegungsunfähig wird. Dies wird von den Angehörigen und den Pflegenden häufig nicht verstanden und bringt dem Patienten den Vorwurf ein, ein Simulant zu sein.
Dosierung Ein Zusammenziehen der Medikation ist wegen der dann auftretenden heftigen Überbewegungen nicht möglich. Die Medikation ist oft sehr umständlich. Hilfreich sind sog. Mehrfachtimer, die auf die Einnahmezeit mit Piepton aufmerksam machen. Herkömmliche Medikamentendöschen sind für die Aufnahme der Tagesration nicht geeignet, spezielle Mehrfach-Dosiereinrichtungen sind notwendig.
Merke
Die medikamentöse Kombinationstherapie des Parkinson-Patienten darf nicht abrupt geändert und nicht unterbrochen werden!
Medikamente richten Aufgrund des Medikamentenplans wird die Medikation für den ganzen Tag im Voraus (am Vorabend oder nachts) zusammengestellt.
Medikamente verabreichen Bei Patienten mit leichterem Krankheitsbild wird die Tagesration auf das Zimmer gebracht. Sie können die Medikation aufgrund ihrer Medikamentenpläne kontrollieren und zeitgerecht einnehmen.
Patienten mit hochgradiger Akinese oder mit psychischen Störungen sind nicht in der Lage, die Medikamente selbstständig einzunehmen, sodass die Pflegenden die Medikamente bei jeder Einnahme pünktlich aufs Zimmer bringen und dort verabreichen. Die Einnahme muss kontrolliert werden, weil die Patienten die Tabletten oft nicht richtig herunterschlucken oder auf den Boden fallen lassen. Kontrolle und genügend Flüssigkeit verhindern, dass die Tabletten noch Stunden später im Mund zu finden sind und so nicht wirken können.
Merke
Andere Medikamente können die Parkinson-Symptome verschlechtern, sogar harmlos erscheinende Magenmittel! Der Parkinson-Patient darf ohne ärztliche Verordnung keine Medikamente bekommen. Die wichtigsten Medikamente, die bei Morbus Parkinson verboten sind, müssen auch die Pflegenden kennen! Kontraindiziert sind Medikamente, die hemmend in den Dopaminstoffwechsel eingreifen. Schon nach einmaligem Einsatz dieser Präparate, z.B. Haldol, Risperdal, Eunerpan, Sulpirid, Metoclopramid (Paspertin, MCP), kann es zu einer schweren Zunahme der Parkinson-Symptome kommen.
42.5.2.9 Krankenbeobachtung und Dokumentation
Die L-Dopa-Therapie führt in späteren Stadien zu Schwankungen der Beweglichkeit, Überbewegungen, Halluzinationen und Psychosen. Die Pflegenden haben die Aufgabe, diese Veränderungen zu beobachten und zu dokumentieren. In fortgeschrittenen Fällen wird der motorische Zustand sogar stündlich registriert. Werden die psychischen Entgleisungen (z. B. Albträume) frühzeitig bemerkt, kann der Ausbruch der Psychose evtl. noch verhindert werden. Beobachtet und dokumentiert werden sollen
-
Off-Phasen,
-
Überbewegungen,
-
Muskelkrämpfe,
-
nächtliche Störungen und
-
vegetative Probleme (RR-Abfall, Wärmestau, Austrocknung, Ausscheidungsprobleme usw.).
42.5.2.10 Umgang mit Psychosen
Besonders schwierig ist der richtige Umgang mit dem infolge der Medikation vorübergehend psychotisch gewordenen Patienten. Beim Vollbild dieser Psychose haben die Patienten Angst und ein Gefühl der persönlichen Gefährdung. Sie wollen sich verteidigen und werden evtl. aggressiv. Dieser Zustand ist höchst gefährlich und kann nur in einem dafür geeigneten Krankenhaus behoben werden. Die Pflegepersonen können beruhigend und angstlösend auf den Patienten einwirken, sollten aber nicht versuchen, die pathologischen Inhalte zu korrigieren.
42.5.3 Parkinson Nurse
Spezialisierte Gesundheits- und Krankenpfleger/-innen für Parkinson-Patienten, sog. Parkinson Nurses, gibt es seit über 30 Jahren z.B. in England, den USA und Skandinavien.
Die Einsatzgebiete und Aufgaben als Parkinson Nurse sind vielfältig:
-
Case-Management
-
Betreuung und Beratung von Parkinson-Patienten
-
Betreuung von Patienten mit eskalativen Therapien
-
Unterstützung in der klinischen Forschung
In Deutschland gibt es bislang keinen einheitlichen Ausbildungsstandard. Es gibt jedoch bereits sehr gute Ansätze. So haben die Deutsche Parkinson-Gesellschaft (DPG), die deutsche Parkinsonvereinigung (dPV) und das Kompetenznetz Parkinson (KNP) ein Fortbildungs-Curriculum entwickelt, das den Standard für Parkinson Nurses in Deutschland abbildet.
Die Fortbildung beinhaltet 4 × 2 Tage theoretische Ausbildung (freitags und samstags) an verschiedenen Kliniken und Unikliniken in Deutschland, verteilt über ein Jahr. Hinzu kommt eine zweiwöchige Hospitation in einer Parkinson-Spezialklinik.
42.6 Pflege von Patienten mit epileptischen Anfällen
42.6.1 Medizinischer Überblick
42.6.1.1 Definition
Ein einmaliger epileptischer Anfall ist keine Krankheit. Erst wenn sich die Anfälle wiederholen und keine anderen erkennbaren Ursachen wie Synkopen oder Intoxikationen vorliegen, ist es gerechtfertigt, von einer Epilepsie (griech.: Fallsucht) zu sprechen. Diese Anfälle gehen mit anfallsartigen (paroxysmalen) Spontanentladungen zentraler Neurone einher.
Anatomie und Physiologie im Fokus
(nach Schwegler u. Lucius 2016)
Jede Nervenzelle bzw. ganze Nervenzellverbände können sich maximal elektrisch entladen. Bei einem normal funktionierenden Gehirn sind allerdings Bremsaktivitäten eingebaut. Eine ungebremste Entladung der Nervenzellen in einem umschriebenen Teil oder im ganzen Gehirn ruft einen zerebralen Krampfanfall hervor. Die Entladungen in einem umschriebenen Teil können sich auch über das ganze Gehirn ausbreiten. Die Aktivität im Gehirn während eines Krampfanfalls kann im EEG gesehen werden (typische „spikes and waves“ = Spitzen und Wellen).
Status epilepticus Ein Status epilepticus ist ein lebensbedrohlicher Zustand, ab 5 Min. Anfallsdauer bei generalisierten Anfällen, ab 15–30 Min. bei anderen Anfällen. Häufig folgen mehrere langandauernde Anfälle nacheinander, zwischen denen ein Patient das Bewusstsein nicht wiedererlangt (bei fortwährenden Krämpfen mit wechselnder Bewusstseinslage spricht man von seriellen Anfällen). Komplikationen eines Status epilepticus sind ein Hirnödem und schlimmstenfalls ein Atem- und Kreislaufstillstand. Die Letalität beträgt 5 – 10 %.
42.6.1.2 Häufigkeit
Jeder Mensch kann einen epileptischen Anfall bekommen. So erleiden ca. 10% der Bevölkerung im Laufe ihres Lebens einen Gelegenheitsanfall, meist aufgrund provozierender Faktoren (z.B. Schlafmangel, Stress, Flackerlicht). Langfristig von einer Epilepsie betroffen sind in Deutschland aktuell etwa eine halbe Million Menschen. Jährlich erkranken 46 von 100 000 Einwohnern neu. 1/3 der Betroffenen erkrankt meist nach dem 60. Lebensjahr und 1/3 vor dem 18. Geburtstag. Die Epilepsie ist nach der Migräne die häufigste neurologische Erkrankung, bei Kindern sogar die häufigste.
42.6.1.3 Ursachen
Bei vielen Betroffenen ist die Ursache der Anfälle unbekannt (kryptogene, idiopathische, endogene, genuine Anfälle). Die verbesserten Möglichkeiten der Diagnostik legen für die meisten idiopathischen Anfälle genetische Gründe nahe.
Akute Ursachen (ZNS) Die Entstehung symptomatischer (fokaler oder partieller) Epilepsien kann unterschiedliche Ursachen haben, z.B.: Entzündungen wie Enzephalitis, Hirninfarkt oder -blutung, Schädel-Hirn-Traumata, Narben von Operationen, Tumoren, Gefäßmissbildungen wie Aneurysmen, Angiome, perinatale Hirnschäden oder metabolische Entgleisungen.
Fallbeispiel
Frau Richter hatte einen Autounfall, bei dem das Gehirn verletzt wurde. Sie war 4 Tage bewusstlos. In den folgenden Wochen erholte sie sich wieder vollständig von dem Unfall. Die Verletzung ist vernarbt, aber 1 Jahr nach dem Unfall treten epileptische Anfälle auf, die in der Umgebung der Narbe entstehen.
Äußerliche Auslöser Die Auslöser epileptischer Anfälle sind sehr unterschiedlich. Es gilt, die individuellen Auslöser herauszufinden und zu vermeiden. Bekannte Auslöser sind:
-
Schlafmangel
-
Flackerlicht (z. B. in Diskotheken, beim Durchfahren von Alleen bei Sonne)
-
Unterzuckerung
-
hohes Fieber
-
Menstruation
-
Alkoholkonsum, Medikamente, bestimmte Drogen
-
Nicht-Einnahme von Antikonvulsiva (Antiepileptika)
-
Angst und negativer Stress
42.6.1.4 Arten und Symptome
Klinisch unterscheidet man
-
generalisierte epileptische Anfälle: Epilepsien, die sich über das ganze Gehirn (generalisiert) ausbreiten.
-
partielle/fokale epileptische Anfälle: Epilepsien, die sich nur über einen bestimmten abgegrenzten Teil des Gehirns (fokal) ausbreiten.
Eine möglichst genaue Wiedergabe des Anfallsgeschehens ist für die Diagnostik und Therapie sehr bedeutsam. Für den Patienten sind diese Informationen wichtig, um ein realistisches Bild über seine Situation zu erlangen. Im Folgenden werden Phänomene unterschiedlicher Anfallstypen beschrieben.
Generalisierte Epilepsie
Bei der generalisierten Epilepsie (beide Hirnhälften betroffen) unterscheidet man
-
primär generalisierte Anfälle (oft genetisch bedingt) und
-
sekundär generalisierte Anfälle (entstehen oft als Folge eines fokalen Anfalls).
Epilepsien weisen ein generalisiertes Anfalls- und EEG-Muster bei herabgesetzter Vigilanz (Wachheit) auf und sind häufig von unbekannter Ursache.
Grand-mal-Anfall (generalisierter Krampfanfall)
Dieser Anfall ereignet sich bei vielen Patienten mit subjektiver Vorempfindung (Aura). Diese geht häufig mit einem Initialschrei (Verkrampfung von Atem- und Stimmritzenmuskulatur) in eine Bewusstlosigkeit über. Verletzungen häufen sich besonders, wenn die Aura fehlt und der Patient somit keine Maßnahmen zur Selbstsicherung ergreifen kann.
Aura Bei einigen Anfallsarten besteht im Vorstadium ein subjektives Vorgefühl. Patienten bemerken bei sich eine vom Magen aufsteigende Übelkeit oder Kribbelparästhesien, akustische, geschmackliche oder optische Halluzinationen bei Anfallsbeginn.
Prodromalerscheinungen Manche Patienten spüren tage- oder stundenlange Unruhe vor dem Anfall. Sie sind dann individuell reizbar, innerlich unruhig oder apathisch und leiden unter Schlafstörungen, Ängstlichkeit, Kopfschmerzen. Vielfach werden diese Zeichen für einen bald möglichen Anfall eher von der Umgebung als vom Patienten selbst wahrgenommen.
Symptome während des Anfalls Die Patienten stürzen steif hin (tonischer Krampf), der Atem steht für 10 – 30 Sek. still, die Pupillen sind weit und lichtstarr, die Blickrichtung geht nach seitlich oben. Es folgt ein rhythmisches grobes Vibrieren der Glieder (klonischer Krampf), selten länger als eine Minute, oft mit seitlichem Zungen- oder Wangeninnentaschenbiss, sich verengenden Pupillen. Möglich sind Schaum vor dem Mund, durch den Biss mit Blut vermischt, ferner Urin- und/oder Stuhlabgang.
Symptome nach dem Anfall Die Patienten werden langsam wach, oft mit einer Verwirrtheitsphase, einem Dämmerzustand oder einem postparoxysmalen Übergang in Erschöpfungs- oder Nachschlaf. Bestand zuvor ein Zustand mit z. T. Tage andauernder psychovegetativer Unruhe und Reizbarkeit, wird der Anfall von Patienten mitunter als befreiend erlebt. Kommt der Anfall unerwartet ohne Vorgefühle, fühlen sie sich danach eher bedrückt.
Petit-mal-Anfall
Generalisierte, altersgebundene kleine Anfälle treten im Kindes- oder Schulalter entweder allein oder im Übergang mit anderen Anfallstypen auf ( ▶ Tab. 42.5 ).
Fokale Krampfleiden
Fokale Anfälle sind altersungebundene, meist symptomatische Epilepsien, d. h., es besteht ein lokalisierbarer Herd (einseitige Anfalls- und EEG-Muster). Die paroxysmalen Entladungen äußern sich entweder an einer oder beiden Körperhälften. Die Vigilanz ist oft ungestört. Die Anfälle können mit motorischen, sensiblen, sensorischen, vegetativen und psychischen Symptomen einhergehen. Wenn die Vigilanz herabgesetzt ist und Bewegungsstereotypen oder auch Automatismen wie Kauen und Schmatzen auffallen, spricht man von komplexen fokalen Anfällen. Man unterscheidet kortikale Halbseitenanfälle (Jackson-Anfälle) und psychomotorische Anfälle.
|
Anfallart |
Zeitpunkt des ersten Auftretens |
Klinischer Verlauf |
|
Blitz Nick-Salaam-Anfälle |
meist im 1.– 2.Lebensjahr |
kurzer Bewusstseinsverlust mit:
|
|
myoklonisch astatische Petit-mal-Anfälle |
meist im 2.– 4. Lebensjahr |
wechselnde Bewusstseinsbeeinträchtigung:
|
|
Absencen |
meist im 6.– 8. Lebensjahr |
Bewusstseinstrübung für wenige Sekunden:
Absencen bestehen häufig als einzige Anfallsart. Angst, Konzentration und Hyperventilation können eine absencengünstige vegetative Lage schaffen. |
|
Impulsiv-Petit-mal |
meist im 14.– 17. Lebensjahr |
bei vollem Bewusstsein:
|
Kortikale Halbseitenanfälle
Im Vorfeld besteht selten eine Aura. Jackson-Anfälle äußern sich in krampfartigen (klonischen) Zuckungen (75 %) und/oder sensiblen Missempfindungen (5 %). Sie beginnen lokal und dehnen sich auf derselben Körperseite aus. Die Patienten sind dabei anfangs bei Bewusstsein. Die ganze Körperhälfte wird erfasst und kann mit Bewusstseinseintrübung in einen generalisierten Krampfanfall münden. Nach dem Anfall ist eine vorübergehende Lähmung oder Taubheit möglich.
Psychomotorische Anfälle
Die Patienten erleben eine periodische Anfallhäufung: alle 1 – 6 Wochen während 2 – 4 Tagen je 2 – 8 Anfälle. Von allen Anfallstypen haben psychomotorische Anfälle die meisten subjektiven Anteile.
Als Aura kann Vertrautes oder Fremdes verschoben oder verkehrt erlebt werden (z. B. Déjà-vu- Erlebnisse). Einzelne Sinne können Situationen verkennen oder Szenen halluzinieren, oft mit Elementen aus dem sexuellen oder religiösen Erleben. Häufig ist ein starkes religiöses Interesse bei Patienten mit diesen Anfällen zu beobachten (Wiedergeburt, Kenntnis einer anderen Welt).
Symptome während des Anfalls Ein eigentlicher Anfall muss nicht zwangsläufig folgen. Falls der Anfall auftritt, entspricht er einer ausgedehnten Absence mit motorischen Erscheinungen (meist mit Kauen, Schmatzen, Schlucken oder mit Äußerung von Lauten oder Wörtern).
Symptome nach dem Anfall Der Anfall geht in einen paroxysmalen Dämmerzustand über. Die Handlungen können kurz oder stereotyp sein: Fußscharren, Auf- und Zuknöpfen der Kleider. Sie können sich als „besonnene Dämmerzustände“ über Stunden und Tage erstrecken.
Organische Psychosyndrome bei chronischer Epilepsie
Epilepsie muss nicht zwangsläufig zu Gehirnleistungsabbau und Wesensveränderung führen. Nur häufige und schwere Anfälle verursachen als Spätfolge geistig-psychische Veränderungen. Dabei spielt auch das Ausmaß der Hirnmangeldurchblutung während der Anfälle oder Hirnatrophien nach den Stürzen eine Rolle.
Merke
Durch eine frühzeitige, konsequente Therapie und eine umfassende Aufklärung des Patienten kann der Abbau der Gehirnleistung vermieden bzw. verzögert werden.
Persönlichkeitsveränderung oder -umbau bei angeborener Epilepsie
Bestimmte Zeitmuster bei chronisch Anfallskranken ermöglichen nicht selten eine Unterteilung in Schlafepilepsie und Aufwachepilepsie.
Schlafepilepsie
Schlafepileptiker haben ihre Anfälle während des Einschlafens. Die Patienten sind vormittags aktiv und werden abends müde. Die Handlungsabläufe sind verlangsamt, das Denken und Handeln zähflüssig, umständlich, sich wiederholend (perseverierend).
Aufwachepilepsie
Aufwachepileptiker erleiden vorwiegend nach dem Aufwachen einen Grand-mal-Anfall. Sie schlafen schlecht ein, kommen erst morgens in den Tiefschlaf und deshalb schwer in Gang, werden erst abends munter. Diese Patienten haben ein massives Schlafdefizit.
Fallbeispiel
Frau Werner erzählt bei der Pflegeanamnese, was sich einen Tag zuvor ereignet hat: „Ich wachte morgens auf und fühlte mich körperlich total kaputt. Meine Oberschenkel schmerzten und ich entdeckte Blut auf meinem Zeigefinger. Als ich ins Bad kam, sah mich mein Mann mit großen Augen an und sagte, dass ich zu alledem auch noch blutige Lippen hätte. Erst jetzt bemerkte ich auch, dass meine Zunge schmerzte. Mein Mann hat in den Morgenstunden beobachtet, dass ich krampfend und zuckend im Bett lag und ganz verzerrt aussah. Das ganze dauerte bestimmt 3 – 4 Minuten, so sagte er. Er war selbst mal im Zivildienst und hat in seinem Einsatz einen epileptischen Anfall beobachtet. Deshalb meinte er, es sei besser, wenn ich ausschliefe und dann zum Arzt ginge. Mein Arzt vermutet einen epileptischen Anfall, zumal ich vor ca. 1 Jahr schon einmal beim Aufwachen einen seltsamen geistigen Zustand hatte. Das wurde mir erst wieder bewusst, als der Arzt nach früheren Ereignissen fragte, die vielleicht auch mit Orientierungsstörungen zu tun hatten. Ich litte vermutlich unter einer Art Aufwachepilepsie.“
42.6.1.5 Diagnostik
Folgende Untersuchungen werden zur Abklärung von Anfallsleiden durchgeführt:
-
Blutuntersuchungen (CK, Laktat)
-
EEG ohne Provokationsmethoden (direkt nach dem Anfall bzw. 12 bis max. 24 Std. danach)
-
EEG mit Provokationsmethoden (z. B. Hyperventilation, Schlafentzug, intermittierende Lichtimpulse oder Provokationsmedikamenten)
-
Langzeit-EEG (über 24 Std.) bzw. Schlaf-EEG (über Nacht)
-
Computertomografie
-
Kernspintomografie
-
evtl. weitere Untersuchungen (z. B. Lumbalpunktion, Angiografie der Hirngefäße)