31.5.2.3 Ausgleich der Mangelernährung
Ziel ist es, Verdauungsfunktionen zu verbessern, um den Erkrankungsverlauf positiv zu beeinflussen. In festgelegten Abständen erfassen Pflegende anthropometrische Daten wie Größe und Gewicht und dokumentieren sie im Somatogramm (Aufzeichnung der körperlichen Entwicklung eines Säuglings, Kleinkindes oder Jugendlichen). Der aktuelle Ernährungszustand sowie der bisherige Verlauf werden mit dem Patienten und ggf. auch dessen Angehörigen besprochen; bei Bedarf wird der Behandlungsplan angepasst.
Dabei existieren als Hauptproblem Ernährungsdefizite durch
-
die Pankreasinsuffizienz mit unzureichender Nahrungsresorption,
-
die vermehrte Atemarbeit und
-
den erhöhten Kalorienbedarf unter rezidivierenden Infektionen.
Da Patienten mit Mukoviszidose einen sehr hohen Energie- und Kalorienbedarf haben, basiert die Ernährung auf
-
einer hochkalorischen Ernährung. Als Behandlungsziel soll bei Frauen mit einer CF ein Body-Mass-Index (BMI) von 22 angestrebt werden, bei Männern ein BMI von 23. Die Patienten sollten häufig kleine Mahlzeiten (mind. 6 pro Tag) zu sich nehmen. Als Zwischenmahlzeiten z. B. Müsliriegel, Kräcker, Studentenfutter. Besteht Normalgewicht, ist eine ausgewogene Mischkost meist ausreichend, bei leichtem Untergewicht sind die Mahlzeiten großzügig mit Fetten anzureichern (z.B. Nudeln in Butter/Öl schwenken). Fällt das Gewicht weiter ab, müssen zusätzlich hochkalorische Shakes, Trink- und Sondennahrungen angeboten werden (s.u.) (https://muko.info.html).
-
der Anpassung der Enzymzufuhr durch Substitution fehlender Pankreasenzyme zu jeder Mahlzeit. Damit kann die Nahrung besser aufgeschlossen werden. Die Dosis dieser Präparate wird mit Nahrungsfetten ergänzt.
-
dem Ausgleich der Mangelzustände aufgrund verminderter Aufnahme durch den Darm mit Zugabe essenzieller Fettsäuren, fettlöslicher Vitamine (E, D, K, A), Mineralien, Spurenelementen und Antioxidantien.
Eine nicht ausreichend oral aufgenommene Nahrungsmenge wird mittels perkutaner endoskopischer Gastrostomie (PEG) mit zusätzlicher nächtlicher enteraler Sondennahrung ergänzt. Hier besteht pflegerisch die Versorgungsnotwendigkeit des PEG-Stomas.
Viele CF-Patienten entwickeln im Verlauf ihrer Erkrankung einen insulinpflichtigen Diabetes mellitus, oft verbunden mit einer Verschlechterung der Lungenfunktion und des Ernährungszustandes. Eine Behandlung des Diabetes über eine Ernährungsumstellung (Reduktion von Kalorien oder Kohlenhydraten) ist in den meisten Fällen nicht zielführend, ganz im Gegenteil, es ist sogar wichtig, die bewährten Ernährungsregeln für Mukoviszidosepatienten nicht aufzugeben. Da es nicht leicht ist, einen Ernährungsplan für Mukoviszidosepatienten mit Diabetes mellitus zu erstellen, ist eine Begleitung und Beratung durch einen speziell geschulten Ernährungsberater erforderlich (http://www.muko-leipzig.de/ernaehrung.html).
31.5.2.4 Physiotherapie
Die Physiotherapie hat einen hohen Stellenwert in der Behandlung der Mukoviszidose. Um Lungenveränderungen hinauszuzögern, lernen die Patienten in speziellen Schulungen, Atmung, Atemnot und Husten genau einzuschätzen und gezielt Selbstreinigungstechniken anzuwenden. Muss die Lunge von zähem Bronchialsekret gereinigt werden, kann die sog. ▶ Autogene Drainage helfen. In drei Phasen wird Sekret zunächst gelöst, dann gesammelt und schließlich abgehustet. Als Erleichterung werden ▶ mechanische Hilfsmittel wie Flutter, RC-Cornet und PEEP-Ventil-Systeme verwendet. Durch diese Hilfen wird mit kleinem Ausatemwiderstand erreicht, dass das Sputum transportiert wird, ohne dass die Bronchien kollabieren.
Ziel der Physiotherapie ist, das zähe Sekret vom Flimmerepithel der Trachea und den Bronchien weg zu befördern, da es einen guten Nährboden für Mikroben darstellt.
Lebensphase Kind
Autogene Drainage
Unterstützen Sie den Patienten bei der Autogenen Drainage, indem Sie für optimale Bedingungen für die Durchführung sorgen (z.B. Hilfsmittel bereitstellen, für Ruhe sorgen, Abwurfschale für Sekret bereitstellen, ausreichend Platz etc.)
Intensive Therapien, ergänzt durch weitere Drainagetechniken wie der Quincke-Hängelage ( ▶ Abb. 31.12), Klopfmassagen, Atemgymnastik, Inhalationen mit sekretlösenden Medikamenten und Antibiotika, unterstützten die Therapie zusätzlich. Ein individuell abgestimmtes körperliches Training kann die Leistungsfähigkeit steigern.
Arzneimittel im Fokus
Inhalative Antibiotika-Gaben erreichen eine über 100-fach höhere Konzentration in der Bronchialschleimhaut als systemische Gaben. Das wirkt sich positiv auf die Resistenzentwicklung der Keime aus, da durch Inhalation die maximale Hemmkonzentration (MHK) immer überschritten wird.
Bei der Quincke-Hängelage ist der Kopf zur Sekretdrainage tief gelagert.
Abb. 31.12
(Foto: K. Gampper, Thieme)

Arzneimittel im Fokus
Orale Expektoranzien, wie z. B. Acetylcystein, können den Patienten beim Auswurf bzw. dem Abhusten von zähem Bronchialschleim unterstützen. Trotz des fauligen Geschmacks des Inhalats sind viele Patienten bereit, ein entsprechendes Medikament zu inhalieren (Köhler 2015).
Bewährt hat sich auch die Inhalation hypertoner Kochsalzlösung mit Konzentrationen bis 7 %. Bei Verträglichkeit und nachgewiesener Wirksamkeit kann die hohe Viskosität der Sekrete u. a. mit Desoxyribonuklease (DNase), einer Substanz, die das Kernmaterial abgestorbener Zellen (DNA) spaltet, vermindert werden. Auch bei der CF haben sich atemwegerweiternde Medikamente zur Unterstützung bewährt (s. ▶ Tab. 31.4 ). Weitere Medikamente zur Schleimlockerung sind Sekretomotorika (z. B. Ambroxol).
31.5.2.5 Hygienische Prävention
Fast alle Patienten mit Mukoviszidose erwerben im Laufe ihres Lebens eine Besiedelung oder Infektion der Atemwege mit bestimmten, häufig im privaten oder klinischen Kontext vorkommenden Keimen. Hierzu zählen u.a. Pseudomonas (P.) aeruginosa und Burkholderia (B.) cepacia. Sie sind überall verbreitet (ubiquitär), z. B. in Grundwasser und Erdboden, und überleben längere Zeiträume in feuchter Umgebung („Pfützenkeime“ in Inhalatoren, Luftbefeuchtern, Waschbecken-Abflüssen usw.). Sobald Multiresistenzen gegen Antibiotika auftreten, ist in der Klinik eine ▶ Patientenisolierung geboten, ansonsten ist korrekte ▶ Basishygiene angebracht.
Kontamination vermeiden In mehreren Studien wurden P. aeruginosa und B. cepacia in Ambulanz- und Physiotherapieräumen sowie in der Raumluft von Patientenzimmern nachgewiesen. Beobachtet wurde dies bis zu 3 Stunden, nachdem die Patienten die Zimmer verlassen hatten. Daher existieren Empfehlungen, bestimmte Tage und Räume für Patienten mit konkreten mikrobiologischen Befunden vorzubehalten (Segregation). Stationär sollen diese Patienten in Einzelzimmern betreut werden (Isolierung). Weiter fordern diese Befunde intensivierte desinfizierende Flächenreinigung (Simon 2012).
Aktuelle Empfehlungen In der aktuellen Leitlinie zum Thema wird gefordert, bereits beim erstmaligen kulturellen Nachweis der P. aeruginosa unbedingt eine Eradikation (vollständige Entfernung) des Erregers zu erreichen (Müller 2015). Auch besteht bei Patienten mit dem sog. „Burkholderia-cepacia-Syndrom"‚ gekennzeichnet durch Fieber und Bakteriämie, ein rascher Abfall der Lungenfunktion mit deutlich verkürzter Überlebensdauer.
Bei stationären Patienten trägt die häufige Antibiotikagabe zur Selektion von ▶ Clostridium difficile mit bekannten Folgen bei. Sie kann jedoch auch ohne Durchfall und primär mit einem toxischen Megakolon verlaufen.
31.6 Pflege von Patienten mit Lungen- und Bronchialtumoren
31.6.1 Medizinischer Überblick
31.6.1.1 Definition
Das Bronchialkarzinom ist eine bösartige (maligne) Entartung der Bronchialschleimhaut, selten ausgehend vom Alveolarepithel (Lorenz 2015). Der Tumor wächst i. d. R. in das Bronchiallumen hinein und wird meist erst im fortgeschrittenen Stadium diagnostiziert. Man unterscheidet 2 Hauptgruppen:
-
das „kleinzellige“ Karzinom (rasches Wachstum und frühe hämatogene Metastasierung)
-
das „nicht kleinzellige“ Karzinom (relativ langsam)
31.6.1.2 Ursachen
Das Risiko, an einem Bronchialkarzinom zu erkranken, ist bei langjährigem Inhalationsrauchen stark erhöht. Der inhalierte Rauch besteht aus > 5.000 Substanzen. Trotzdem ist die Haupttodesursache des Tabakkonsums nicht der Lungenkrebs, sondern die COPD (Köhler 2015). Weitere auslösende oder begünstigende Faktoren sind:
-
belastende berufliche Inhalationen (z. B. Asbest und radioaktive Aerosole)
-
HIV-Infektion (reduzierte Immunabwehr)
-
frühere Chemotherapien und Bestrahlungen
31.6.1.3 Symptome
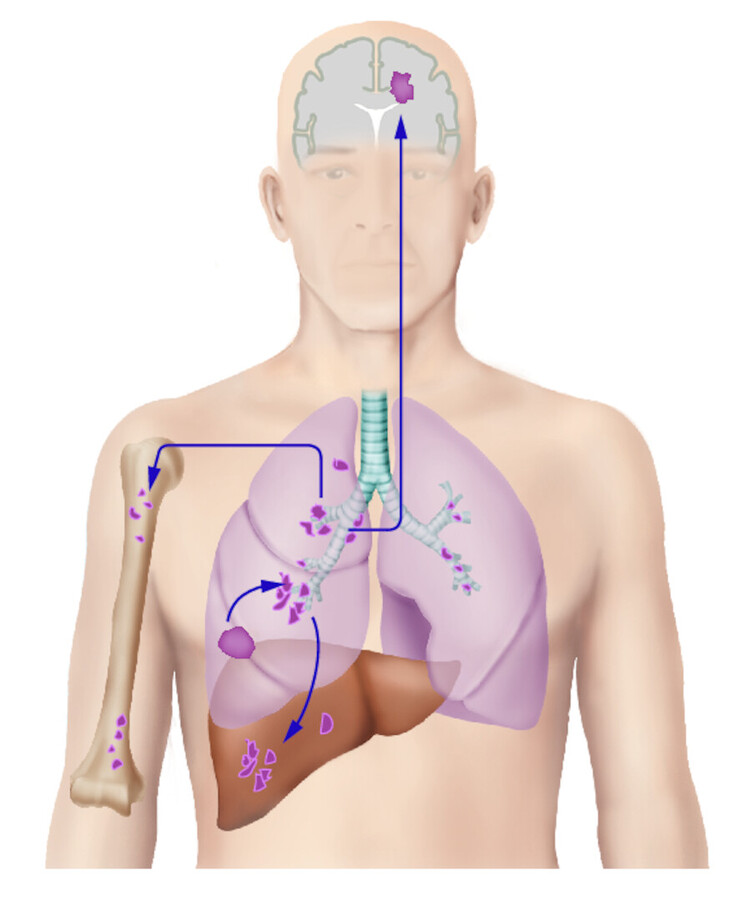
Die Symptome sind abhängig vom Stadium der Erkrankung. Im frühen Stadium gibt es keine typischen Symptome. Im fortgeschrittenen Stadium sind chronischer Husten, blutiger Auswurf und wiederkehrende Bronchopneumonien ein Hinweise auf ein Bronchialkarzinom. Im Spätstadium stehen Hustenattacken, Luftnot, Schmerzen und Symptome je nach Metastasierungsort (Knochen, Hirn, Leber, Nebennieren, ▶ Abb. 31.13) im Vordergrund.
Metastasierungswege und -organe des Bronchialkarzinoms (nach Largiadèr).
Abb. 31.13
31.6.1.4 Diagnostik
Zu den Untersuchungsmethoden gehören:
-
Röntgen-Thorax ( ▶ Abb. 31.14) und -CT
-
Ultraschall (Endosonografie)
-
Bronchoskopie mit PE (Probeentnahme)
-
evtl. Mediastinoskopie und operative PE
-
Tumormarker (tumorassoziierte Antigene im Serum)
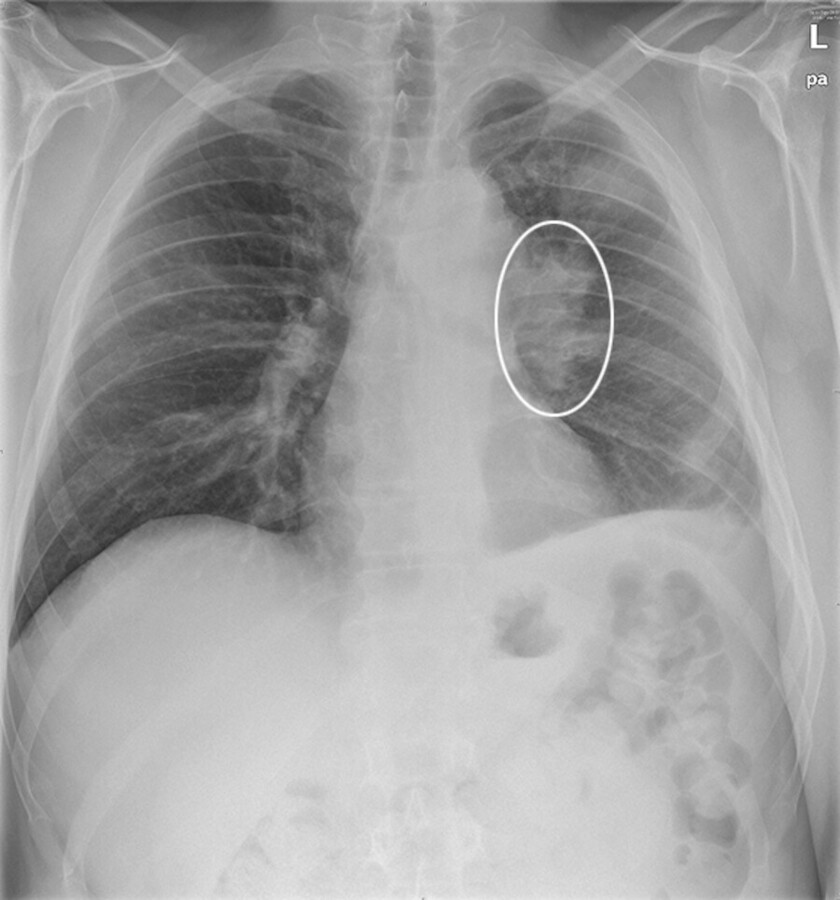
Das Röntgenbild zeigt ein Bronchialkarzinom.
Abb. 31.14
(Foto: O. Knieps, Thieme)
31.6.1.5 Therapie
Trotz der Therapiefortschritte hat sich die Mortalität (Sterberate) in den letzten 30 Jahren nicht verändert (Köhler 2015). In Frühstadien wird die operative Sanierung in Lungenkrebszentren angestrebt. In speziellen Tumorkonferenzen (sog. Tumorboard) wird unter interdisziplinärer Zusammenarbeit der Behandlungsplan erstellt.
Insbesondere das kleinzellige Karzinom und fortgeschrittenere Stadien sind meist operativ nicht zu heilen und werden i.d.R. palliativ mittels Strahlen- und Chemotherapie behandelt.
31.6.2 Pflege- und Behandlungsplan
Pflege im Eigentlichen ist nicht an Diagnose und Organbefund orientiert (Heine 2010), daher wird nicht der Versuch gemacht, die onkologische Pflege bei Tumorerkrankungen der Lunge darzustellen.
Schwerpunkte der Pflege bei thorakalen Tumoren können wie in ▶ Tab. 31.6 gegliedert werden.
|
Phase |
Herausforderung für den Patienten |
Aufgaben der Pflege |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
31.7 Pflege von Patienten mit Pneumonie
31.7.1 Medizinischer Überblick
31.7.1.1 Definition
Die Pneumonie ist eine akut oder chronisch verlaufende Entzündung des Lungengewebes (Lungenparenchym). Meist spielen Infektionen mit Bakterien, Viren oder Pilzen eine Rolle, seltener sind toxische Lungenschädigungen durch Inhalation giftiger Substanzen oder immunologische Lungenveränderungen (z. B. Kollagenosen).
31.7.1.2 Ursachen
Beteiligte Auslöser sind eine Vielzahl vorwiegend viraler und bakterieller Mikroorganismen ( ▶ Tab. 31.7 ), die bei reduzierter bronchialer Clearance (reinigende Atemwegsfunktion) dem Menschen zur Bedrohung werden können. Insbesondere bei alten Menschen besteht eine Reihe von altersphysiologischen Veränderungen, die die Risiken erhöhen.
Lebensphase alter Mensch
Ursachen für erhöhte Infektanfälligkeit im Alter
-
geschwächte Abwehr der Zellen und geringere humorale Abwehr (Antikörper, Immunbotenstoffe sowie Eiweiße)
-
reduzierte physiologische Funktionen (Hustenreflex, eingeschränkte Speiseboluskontrolle, Durchblutung, reduzierte Barrierefunktion von Haut und Schleimhäuten, z. B. durch dünnere Haut …)
-
Multimorbidität
-
behandlungsbedingte Immunsuppression
-
medikamentöse Risiken (Polypharmazie)
-
Umgebungsbedingungen (Setting): Altersarmut, Vereinsamung, Monotonie, Isolation, Deprivation
-
Unter- oder Mangelernährung (Sitzmann 2014)
Ohne schwere Begleiterkrankungen stirbt man heute an einer sog. „community-acquired pneumonia“ (CAP), einer ambulant erworbenen Pneumonie, eher selten. Ein alter Mensch stirbt mit und nicht an der Pneumonie (Köhler 2015).
|
Formen der Pneumonie |
Häufige Mikroben und Ursachen |
|
Verlaufsform (klinisch) |
|
|
typischer Verlauf |
Streptococcus pneumoniae (Pneumokokken) |
|
atypischer Verlauf |
Viren, Bakterien (Mykoplasmen, Legionellen, Chlamydien) |
|
Entstehung (epidemiologisch) |
|
|
ambulant (in der üblichen Umgebung des Patienten erworbene Pneumonie, auch im Seniorenwohnheim: CAP = community-acquired pneumonia) |
S. pneumoniae (Pneumokokken), Haemophilus influenzae, S. aureus, Viren, Mycoplasma pneumoniae, Chlamydia pneumoniae, Legionella pneumophila |
|
nosokomial (im Krankenhaus frühestens 48 Stunden nach Aufnahme erworbene Pneumonie, ohne Hinweis auf existente Infektion bei Krankenhausaufnahme oder Inkubationsphase: HAP = hospital-acquired pneumonia) |
vermehrt (resistente) Problemkeime:
|
|
Pneumonie bei definierter Abwehrschwäche (z. B. Transplantation, HIV-Infektion, Leukämie, zytostatische Therapie) |
stark erweitertes Erregerspektrum: Legionella pneumophila, Pilze (Candida albicans, Pneumocystis carinii), atypische Mykobakterien, Viren (Herpes, CMV) |
|
Pneumonie bei Disposition zur Aspiration (hohes Lebensalter, ZNS- oder Ösophaguserkrankungen, Alkoholismus) |
S. aureus, Anaerobier |
|
Lokalisation (anatomisch) |
|
|
bronchopulmonal |
|
|
alveolär (Entzündung betrifft hauptsächlich das Lungenparenchym, also den Ort des eigentlichen Gasaustausches). Man unterscheidet:
|
|
|
Ursachen (ätiologisch) |
|
|
primär: Die Lungenentzündung tritt ohne eine Vorerkrankung von Herz oder Lunge auf (▶ s. Fallbeispiel). |
Bakterien, Viren, Rickettsien, Pilze, Mykoplasmen, allergisch wirkende Substanzen, Pneumocystis carinii |
|
sekundär: Es liegt eine Vorerkrankung des Herzens oder der Lunge vor. |
Zirkulationsstörungen, Bronchusveränderungen, toxische Einwirkungen, Aspiration |
Merke
Besonders gefährlich sind die Erkrankungen, die im Krankenhaus erworben werden (nosokomiale Pneumonien). Sie sind oft schwerer behandelbar, da die beteiligten Mikroben gegen viele Antibiotika Resistenzen entwickelt haben. Ihre Übertragung kann durch Kontakt über nicht oder nicht ausreichend desinfizierte Hände sowie über kontaminierte Geräte (z.B. Inhalatoren) erfolgen.
Infektionswege
Eine Pneumonie kann auf verschiedene Weise entstehen:
-
Inhalation von in der Luft vorhandenen Mikroben als Tröpfcheninfektion
-
hämatogene Aussaat von entfernten Infektionsherden oder Mikroorganismen, die über das Blut von Infektionsherden (z. B. Katheterseptikämien) oder sogar aus dem Darm in die Lungen gelangen (bakterielle Translokation)
-
direkte Ausbreitung der Infektion aus einem angrenzenden Herd (eher selten)
-
Aspiration von Keimen aus dem Rachenraum oder von Magensaft (Mikroaspiration entlang des Tubus insbes. bei invasiver Beatmung; Makroaspiration von mehreren Millilitern)
Lebensphase alter Mensch
Aspiration
Als ein zentraler Risikofaktor bei der Entstehung einer Pneumonie gilt die Aspiration von Mikroben. Kommen weitere Faktoren, wie z.B. eine Immunsuppression, hinzu, erhöht sich das Risiko um ein Vielfaches, eine Pneumonie kann entstehen. Aspirationspneumonien entwickeln sich oft schleichend; so begünstigen z.B. nasogastrale Sonden eine Aspiration.
Anatomie und Physiologie im Fokus
(nach Schwegler u. Lucius 2016)
Luftnotattacken und Pneumonien können entstehen, wenn Substanzen aus der Nahrung die Atemwege verlegen oder aus dem Magen aufsteigende saure Speisen das Atemsystem reizen, schädigen oder gar bis in die Bronchien gelangen (Aspiration). Oft ist eine invasive Beatmung oder Fehlfunktion an der Kreuzungsstelle zwischen Atem- und Nahrungsstrom (s. ▶ Abb. 31.4) die Ursache für eine Aspiration.
Lebensphase alter Mensch
Impfung
Empfehlungen speziell für Menschen über 60 Jahre werden für eine Influenza- und Pneumokokkenimpfung gegeben (Leidl 2016).
31.7.1.3 Symptome
Pneumonien haben entweder einen klassischen Verlauf mit typischen Symptomen (z. B. Pneumokokkenpneumonie) oder einen Verlauf mit atypischen Symptomen (z. B. Viruspneumonie oder Mykoplasmenpneumonie).
Typischer Verlauf Symptome einer typisch verlaufenden Pneumonie sind:
-
akuter Beginn innerhalb von 12 – 24 Stunden
-
hohes Fieber (> 39 °C), oft mit Schüttelfrost
-
Tachykardie
-
Husten mit Auswurf (eitrig: gelblich, grün, bei Blutbeimengung hämorrhagisch)
-
pleurale Brustschmerzen (Schmerzen beim Atmen)
Atypischer Verlauf Atypische Pneumonien treten bei zuvor gesunden, jüngeren Patienten meist nach einer grippalen Vorerkrankung auf:
-
mäßig akuter Beginn
-
langsam steigendes Fieber (< 39 °C)
-
selten Schmerzen oder Erguss des Brustfells
-
zusätzliche Symptome wie Kopfschmerz, Hepatitis, Karditis oder Pankreatitis
Lebensphase alter Mensch
Geringe Symptomausprägung
Ältere Menschen zeigen bei einer Pneumonie häufig nur geringe klinische Auffälligkeiten.
Komplikationen Gefürchtete Komplikationen einer Pneumonie sind:
-
akutes Lungenversagen
-
direkte Ausbreitung innerhalb (Lungenabszess) und außerhalb der Lunge ( ▶ Abb. 31.15) (z. B. in den Pleuraspalt, Folge: Empyem)
-
Sepsis mit Multiorganversagen als indirekte Ausbreitung mit dem Blutstrom auf andere Körperteile (z. B. septischer Schock und hochgradige respiratorische Insuffizienz, Pneumokokkenmeningitis)
-
thromboembolische Komplikationen infolge von Bettruhe und Exsikkose (v. a. bei älteren Patienten)
-
kardiovaskuläre Komplikationen, d.h. Herz-Kreislauf-Versagen (toxisch und/oder durch starke Flüssigkeitsverschiebungen sowie durch Hypoxämie und hohes Fieber)
-
körpereigene entzündliche Abwehrreaktion des Gesamtorganismus („Systemic Inflammatory Response Syndrome“ = SIRS; ähnelt einer Sepsis, jedoch ohne nachweisbare Infektion)
-
akutes Nierenversagen besonders bei älteren exsikkierten Patienten
Trotz einer antimikrobiellen Behandlung kann es zu den beschriebenen Komplikationen kommen, oft auch mit Todesfolge.
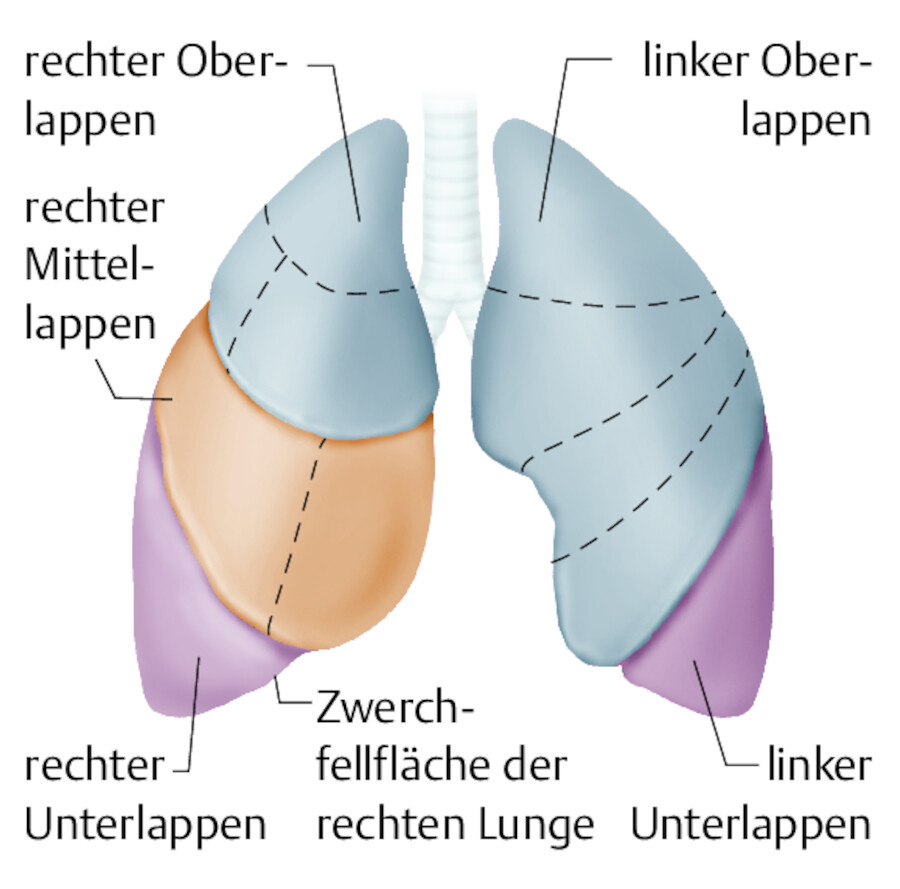
Aufbau der Lunge.
Abb. 31.15 Weil die linke Lunge eine große Aussparung für das Herz besitzt, besteht der linke Lungenflügel nur aus 2 statt 3 Lungenlappen.
Fallbeispiel
10 Tage sind es her, dass der sonst gesunde 39-jährige Till Rieger, Versicherungskaufmann, an einem banalen Virusinfekt der oberen Atemwege gelitten hat. Am Abend fühlt er sich nach einem Kundenbesuch nicht wohl. In der Nacht darauf entwickelt er hohes Fieber und Husten, der einen rötlich-bräunlichen Auswurf produziert. Es besteht beim Aufwachen ein schweres allgemeines Krankheitsgefühl mit atemabhängigen thorakalen Schmerzen. Als er aufstehen will, leidet er zusätzlich unter Atemnot und Schüttelfrost. Der gerufene Notarzt weist ihn in das Krankenhaus ein. Herr Rieger hat eine hohe Atemfrequenz (36/Min.), eine Tachykardie (140/Min.), einen hypotonen Blutdruck (90/60 mmHg) und ist zyanotisch. Im Röntgenbild des Thorax zeigen sich eine dichte Infiltration des rechten Lungenoberlappens und ein mäßiger Pleuraerguss.
31.7.1.4 Diagnostik
Zu den Untersuchungsmethoden gehören:
-
spezielle Anamnese (Art und Schwere der Grunderkrankung, Infektionen, z. B. Grippe)
-
klinische Untersuchungen (Auskultation, Perkussion)
-
Laboruntersuchungen (Leukozyten im Blutbild erhöht, PCR, Procalcitonin)
-
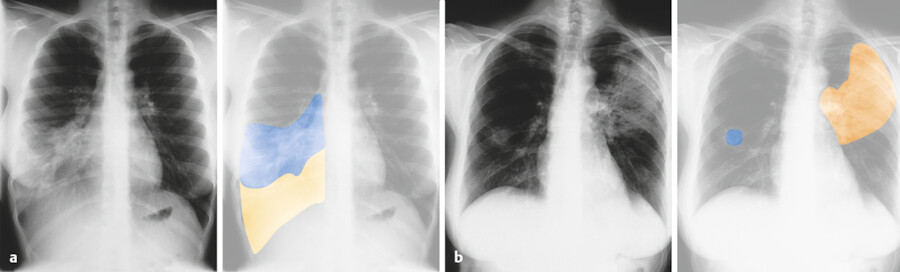
Röntgen-Thorax (bei Bronchopneumonie lockere, zusammenfließende und weit verstreute Verdichtungen; bei Lobärpneumonie am Spalt des Lungenlappens scharf begrenzte Infiltrate, ▶ Abb. 31.16)
-
mikrobiologische Untersuchungen zum Keimnachweis:
-
Blutkultur
-
Sputum (kooperative Patienten mit eitrigem Auswurf; Mund vorher ausspülen)
-
Trachealsekret
-
bronchoskopisch gewonnenes Material (Bronchoalveoläre Lavage = BAL)
-
Pleurapunktat bei Ergussnachweis durch Sonografie
-
Röntgenbild Lunge.
Abb. 31.16 a eine überwiegend rechtsseitige Bronchopneumonie, b Verschattungen im linken Oberlappen bei Lobärpneumonie.
Merke
Nach Auslandsreisen müssen Mikroben von Pneumonien, die nicht in Mitteleuropa vorkommen, in die Differenzialdiagnose mit einbezogen werden. Auch spielt die berufliche Tätigkeit eine Rolle, z.B. bei einer Arbeit mit Tieren (industrielle Tiermast, Kontakt mit Schafen, Papageien usw.) wegen der besonderen Resistenzlage.
31.7.1.5 Therapie
Eine klinische Behandlung ist nur bei schwerem Verlauf sowie unter sozialen Umständen, die eine ambulante Therapie unmöglich machen, angezeigt. Ein schwerer Verlauf ist gekennzeichnet durch eine Atemfrequenz von > 30/Min., schwere Dyspnoe, Temperatur < 35 °C oder > 40 °C, Hypotonie, Hinweis auf extrapulmonale Infektionsherde (z. B. Delirium).
Eine unkomplizierte interstitielle Lungenentzündung wird symptomatisch therapiert, da es sich bei den Mikroorganismen meist um Viren handelt, die nicht wirksam mit Antibiotika behandelt werden können. Eine Aufnahme im Krankenhaus ist i. d. R. nicht notwendig.
Häusliche Pflege im Fokus
Die häusliche Pflege bei der Pneumonie umfasst:
-
körperliche Schonung
-
Analgetikagabe bei Pleuraschmerzen
-
Antitussivagabe bei trockenem Husten
-
Inhalation von sekretolytischen und bronchodilatatorischen Medikamenten bei obstruktiver Ventilationsstörung
Ergänzend eignen sich sekretionssteigernde Tees (z. B. Thymian und Fenchel). Ihre schwach spasmolytische und antiseptische Wirkung unterstützt die spezifische antibiotische Therapie.
Eine erhöhte Flüssigkeitszufuhr ist nur dann notwendig, wenn der Patient durch höheres Fieber verstärkt schwitzt und wenig Durst hat. Normalerweise reguliert der Organismus seinen Flüssigkeitshaushalt selbst. Eine zu hohe Flüssigkeitszufuhr fördert die Ödemneigung (Köhler 2015).
Die klinische Therapie umfasst ergänzend zu den Maßnahmen der häuslichen Pflege:
-
bei Hypoxämie: ▶ Zufuhr befeuchteten Sauerstoffs über Sonde oder Maske
-
Antibiotikatherapie entsprechend dem Keimnachweis oder rationell kalkulierte Therapie nach Entstehungsursache
-
bronchoskopische Absaugung bei Sekretverhalt oder zu schwachem Hustenstoß
Beatmung Eine maschinelle (evtl. nichtinvasive) Beatmung wird nötig, wenn eine Pneumonie generalisiert oder eine kardiopulmonale Krankheit so schwer ist, dass eine adäquate Oxygenierung des Blutes mit der spontanen Atmung und zusätzlicher Sauerstoffgabe nicht mehr möglich ist.
Naturheilverfahren Diese können ebenfalls eingesetzt werden. Ätherische Öle von Thymian, Eukalyptus und Fenchel werden nach peroraler Aufnahme über die Bronchien ausgeschieden und wirken dort sekretionssteigernd. Zudem besteht eine schwache spasmolytische und antiseptische Wirkung als Unterstützung der spezifischen antibiotischen Therapie.
31.7.2 Pflege- und Behandlungsplan
Um eine Pneumonie zu verhindern, setzt die Pflege gezielt Maßnahmen zur Pneumonieprophylaxe ein. Besteht bereits eine Pneumonie, gilt es, Komplikationen frühzeitig zu erkennen und den Patienten, wo nötig, zu unterstützen (s.u.).
31.7.2.1 Maßnahmen zur Pneumonieprophylaxe
Sie umfassen die im Kapitel „ ▶ ATL Atmen, Puls und Blutdruck“ angeführten Pflegeziele, wie
-
Verbessern der Lungenventilation,
-
Vermeiden der Sekretansammlung,
-
Aspiration bei Bettlägerigen vermeiden, insbes. bei enteraler Sondenernährung,
-
gute Mundhygiene (Risiko für eine Aspirationspneumonie ist bei schlechter Mundhygiene deutlich erhöht!) (Schulz-Stübner 2010; Ewig 2016)
-
Atemtherapeutische Maßnahmen (z.B. Atemstimulierende Einreibung [ASE]),
-
Fördern der Mobilisation, insbesondere postoperativ,
-
atemfördernde Lagerungen (z.B. V-A-T-I) und
-
Inhalationstherapie.
31.7.2.2 Maßnahmen bei bestehender Pneumonie
Die Aufgaben konzentrieren sich neben der pflegerischen Mitwirkung bei der Therapie auf Folgendes:
-
mögliche Komplikationen frühzeitig erkennen
-
die Atmung unterstützen, z. B. durch geeignete Lagerung und Atemtherapie
-
die Regulierung der Körpertemperatur unterstützen
Komplikationen frühzeitig erkennen Zu möglichen Komplikationen gehören
-
Lungenabszess,
-
Pleuraempyem,
-
Pleuraerguss,
-
septischer Schock = SIRS,
-
hochgradige respiratorische Insuffizienz (ARDS),
-
Herz-Kreislauf-Versagen,
-
akutes Nierenversagen besonders bei älteren exsikkierten Patienten und
-
Antibiotika-Nebenwirkungen, z. B. Allergie, ▶ pseudomembranöse Kolitis.
Atmung unterstützen Anzustreben sind die ▶ Förderung der Lungenbelüftung, Sekretlösung und -entleerung. Dazu sind hilfreich:
-
Beeinflussen der Thoraxschmerzen durch vom Arzt angeordnete geeignete Analgetika
-
Unterstützen des Hustens, um das ▶ Sputum zu expektorieren
-
Analgetikagabe bei Pleuraschmerzen
-
Atemgymnastik
-
Mobilisation, wenn Entfieberung und Kreislaufstabilisierung erreicht ist
-
atemerleichternde Lagerung
-
frische Luft kurzfristig ohne Zugluft
-
Antitussivagabe bei quälendem, trockenem Husten
-
Inhalation von sekretolytischen und bronchodilatatorischen Medikamenten bei obstruktiver Ventilationsstörung
Merke
Wird das Sekret nicht gelöst, kann dies auf eine endobronchiale Obstruktion hinweisen und ▶ endotracheales oder bronchoskopisches Absaugen erforderlich machen. Daher ist die Beobachtung des Inhalationserfolgs sehr wichtig!
Fallbeispiel
(Fortsetzung) Herr Rieger erhält sofort eine Antibiotikatherapie. Doch trotz weiterer intensiver Versorgung verschlechtern sich die Vitalparameter. Er wird intubationspflichtig und entwickelt ein nicht zu beeinflussendes Kreislaufversagen. In der Blutkultur wird Streptococcus pneumoniae (Pneumokokken) nachgewiesen. Nach weiteren 3 Tagen verstirbt der Patient trotz der intensiven Therapie. Die Obduktion zeigt eine massive Verfestigung von Ober- und Mittellappen der rechten Lunge und des linken Unterlappens, der eine leberähnliche Konsistenz aufweist, sowie beidseitige ausgedehnte Pleuraergüsse. Todesursache war ein Herzversagen (nach Schaberg, Kaufmann 2006).
Regulierung der Körpertemperatur unterstützen Liegt eine schwere Pneumonie vor, wird die Selbstpflege des Menschen stark eingeschränkt. Hier ist unterstützende Körperpflege zur Minderung der Einschränkungen erforderlich. Je nach Temperatur- und Kreislaufverhältnissen sind ▶ wärmereduzierende äußere Anwendungen angebracht.
31.8 Pflege von Patienten mit Pleuritis
31.8.1 Medizinischer Überblick
Definition
Als Pleuritis bezeichnet man eine akute Entzündung der gesamten Pleura (Pleura parietalis und Pleura visceralis) einer Lungenhälfte oder einzelner Abschnitte. Im Volksmund wird sie auch als „Rippenfellentzündung“ bezeichnet.
31.8.1.1 Formen und Symptome
Im Folgenden werden 2 häufig auftretende Arten der Pleuritis vorgestellt:
Pleuritis sicca Diese Form der Pleuritis wird auch „trockene Pleuritis“ genannt, da meist kein Pleuraerguss in der Pleurahöhle nachzuweisen ist. Zu Beginn der Entzündung bilden sich Fibrinauflagerungen an den Pleurablättern, die dann bei jedem Atemzug aufeinanderreiben. Da die Pleura parietalis von sensiblen Nerven durchzogen ist, geben Patienten häufig starke, stechende und atemabhängige Schmerzen im Brustkorb (Thoraxschmerzen) an. Deshalb nehmen sie oft unwillkürlich eine Schonhaltung und -atmung ein, die an den flachen Atemzügen und einer erhöhten Atemfrequenz leicht erkennbar ist. Die Betroffenen versuchen auch möglichst tiefes Einatmen zu vermeiden. Beim Auskultieren (Abhören) der Lunge ist atemabhängig ein Knarren bzw. Reiben der Pleurablätter zu hören. Die Patienten klagen häufig über starken Reizhusten ohne Auswurf. Fieber tritt nur selten auf. Die Pleuritis sicca kann im weiteren Verlauf in eine Pleuritis exsudativa übergehen.
Pleuritis exsudativa Bei dieser Form der Pleuritis spricht man von einer „feuchten Pleuritis“, die durch eine entzündliche Exsudat- bzw. Ergussbildung in der Pleurahöhle gekennzeichnet ist. Dieser Erguss entsteht im Rahmen des Entzündungsgeschehens durch eine vermehrte Flüssigkeitsproduktion der Pleurablätter. Anders als bei der Pleuritis sicca wird diese Form der Entzündung nicht von starken, atemabhängigen Schmerzen begleitet, da die Flüssigkeit (Exsudat) die Pleurablätter auseinanderdrängt. Je nach Größe des Ergusses klagen die Patienten über Atemnot oder ein dumpfes Druckgefühl im Brustkorb.
Nach Abklingen der akuten Entzündung können Verwachsungen bzw. Vernarbungen der Pleurablätter zurückbleiben, die eine optimale Entfaltung der Lunge beeinträchtigen können.
31.8.1.2 Ursachen
Die Pleuritis entsteht meist sekundär, d. h. als Komplikation bzw. Folge einer Grunderkrankung, wie z.B. einer Lungenentzündung (Pneumonie), von Lungen- oder Pleuratumoren, Herzinfarkt, Lungeninfarkt, Lungentuberkulose, Bauchspeicheldrüsenentzündung (Pankreatitis) oder Kollagenose. Auch Erkrankungen aus dem rheumatischen Formenkreis (z. B. Lupus erythematodes) und Autoimmunerkrankungen können die Pleura entzünden.
31.8.1.3 Diagnostik
Folgende Untersuchungen geben Aufschluss über Ausmaß und Art der Pleuritis:
-
Auskultieren (Abhören) der Lunge
-
Blutuntersuchung: Liegt eine Infektion vor, so sind i. A. die Entzündungsparameter im Blut (BB, BSG, CRP) erhöht. Weitergehende Laboruntersuchungen geben dann Hinweise auf die Art des Erregers. Ist hingegen eine Autoimmunerkrankung Ursache für die Pleuritis, lassen sich in der Blutprobe bestimmte Autoantikörper in erhöhter Konzentration finden.
-
Röntgen-Thorax: Hier zeigt sich eine evtl. Grunderkrankung, z. B. eine Pneumonie. Auch Pleuraergüsse oder Pleuraverwachsungen können erkannt werden.
-
Ultraschall (Sonografie) des Brustkorbs
-
Tuberkulintest
-
Pleurapunktion (mit Untersuchung der Flüssigkeit z. B. auf Erreger (s. ▶ Tab. 31.8 )
|
Exsudat |
Transsudat |
hämorrhagischer Erguss |
chylöser Erguss |
|
Beschreibung (Synonyme) |
|||
|
eitriger Pleuraerguss (Pleuraempyem, Pyothorax) |
nicht entzündlicher Pleuraerguss (Serothorax) |
blutiger Pleuraerguss (Hämatothorax) häufig in Kombination mit Pneumothorax |
lymphhaltiger Pleuraerguss (Chylothorax) |
|
Aussehen |
|||
|
getrübt |
klar |
blutig |
trüb |
|
Farbe |
|||
|
grünlich, eitrig, jauchig |
hellgelb, serös wie Blutserum |
rötlich |
milchig |
|
spezifisches Gewicht |
|||
|
> 1016 |
< 1016 |
> 1016 |
> 1016 |
|
Eiweißgehalt (Rivalta-Probe) |
|||
|
positiv |
negativ |
positiv |
positiv |
|
nachweisbare Zellen im Ausstrich |
|||
|
viele Zellen, Leukozyten, Erythrozyten, Endothelzellen, Bakterien (bei Tuberkulose vorwiegend Lymphozyten) |
wenig Zellen, keine Bakterien |
Erythrozyten |
Lymphozyten |
31.8.1.4 Therapie
Da es sich bei der Pleuritis um eine sekundäre Erkrankung handelt, steht zunächst die Behandlung der Grunderkrankung im Vordergrund. Je nach Erreger werden Antibiotika gegen die bakterielle Infektion eingesetzt, die sowohl oral und intravenös als auch lokal über eine Pleuradrainage verabreicht werden können. Die sonstige Therapie richtet sich nach den Symptomen:
-
begleitende Analgesie, insbesondere bei der trockenen Pleuritis, um eine schmerzbedingte Schonatmung und damit eine Minderbelüftung der Lunge zu vermeiden
-
Wärmezufuhr, z.B. Brustwickel mit heißem Wasser und ggf. Zusätzen wie Zitronensaft, Senfmehl, Lavendel (bei Zusätzen die Haut nach spätestens 10 Min. auf allergische Reaktionen überprüfen)
-
Pleurapunktion bei größeren Ergüssen zur Entlastung und Diagnostik
-
Spülung des Pleuraraums bei Eiterbildung über eine Drainage (so können auch gezielt Medikamente in den Pleuraraum gebracht werden)
31.8.2 Pflege- und Behandlungsplan
Das Ziel aller pflegerischen Interventionen ist es, eine optimale Lungenbelüftung zu erreichen und weitere Komplikationen, wie z.B. eine Pneumonie, zu vermeiden. Dabei ist die Schmerzfreiheit des Patienten eine wichtige Voraussetzung. Schwerpunkte bei der Pflege von Patienten mit Pleuritis sind daher:
-
Schmerzerfassung und Gabe von Analgetika (Schmerzmedikamente)
-
Oberkörperhochlagerung
-
Pneumonieprophylaxe
-
Atemgymnastik
-
Mobilisation
-
atemstimulierende Einreibungen
-
Inhalation
-
ggf. Unterstützung bei der Körperpflege (bei Dyspnoe)
-
ggf. Sauerstoffgabe über Nasensonde bzw. -brille (nach Arztanordnung)
Merke
Der Patient sollte möglichst auf der gesunden Seite liegen, um die Belüftung und Ausdehnung der erkrankten Lungenabschnitte zu fördern.
31.9 Pflege von Patienten mit Pleuraerguss
31.9.1 Medizinischer Überblick
Definition
Als Pleuraerguss bezeichnet man eine abnormale und überschießende Flüssigkeitsansammlung im Pleuraspalt, d. h. zwischen der Pleura visceralis und der Pleura parietalis. Die Unterscheidung erfolgt anhand der Zusammensetzung der Flüssigkeit in seröse (nicht entzündliche), infektiöse, blutige oder lymphhaltige Ergüsse. Grundsätzlich liegt einem Pleuraerguss eine Störung des Flüssigkeitseinstroms über die Pleurablätter oder des Abtransports über pleurale Lymphgefäße zugrunde.
31.9.1.1 Ursachen
Die Hälfte aller Pleuraergüsse ist auf eine onkologische Grunderkrankung zurückzuführen (Lungenkarzinom, Mammakarzinom, Pleurakarzinose, Pleuramesotheliom). Ebenso können entzündliche Prozesse wie z. B. eine Pneumonie oder Tuberkulose einen Pleuraerguss hervorrufen. Weitere Ursachen stellen eine Herzinsuffizienz oder ein Thoraxtrauma bzw. eine -operation dar (s. ▶ Tab. 31.9 ).
|
Erkrankung |
Ursache |
Therapie |
|
Pyothorax |
|
|
|
Serothorax |
|
|
|
Hämatothorax |
|
|
|
Chylothorax |
|
|
31.9.1.2 Symptome
Häufig sind Patienten mit einem Pleuraerguss klinisch beschwerdefrei. Die Symptome sind abhängig vom Umfang des Ergusses, der Entstehungsursache und dem -zeitraum. Bildet sich ein Pleuraerguss langsam über eine längere Zeitspanne, so versucht der Körper sich an die Situation anzupassen und Einschränkungen zu kompensieren. Bei einem ausgeprägtem Erguss allerdings beschreiben Betroffene meist zunehmende Luftnot, Belastungseinschränkungen bzw. -dyspnoe und Brustenge.
Da in vielen Fällen die Ursache für einen Pleuraerguss eine andere Grunderkrankung ist, werden die Symptome durch die Beschwerden der Krankheit überdeckt. Das Leitsymptom der Linksherzinsuffizienz ist z.B. die Atemnot und je nach Ausprägung kommen noch Beschwerden wie Belastungsdyspnoe und Brustenge hinzu.
31.9.1.3 Diagnostik
Zur Diagnostik gehören:
-
ausführliche Anamnese: aktuelle und frühere Erkrankungen und Beschwerden, Einnahme von Medikamenten usw.
-
körperliche Untersuchung: Bei der Auskultation (Abhören der Lunge) ist das Atemgeräusch kaum oder gar nicht mehr hörbar; perkussorisch (Abklopfen des Brustkorbes) ist der Klopfschall über dem Erguss gedämpft.
-
bildgebende Verfahren: Röntgen-Thorax, Sonografie und ggf. Computertomografie
-
invasive Verfahren: Pleurapunktion (zur Analyse des Punktats), Thorakoskopie
31.9.1.4 Therapie
Bei einem Pleuraerguss ist die Therapie abhängig von der Ursache und der Beeinträchtigung des Patienten:
-
Diuretikagabe und Flüssigkeitsreduktion (Begrenzung der Trinkmenge): Liegt als Grunderkrankung z. B. eine Herzinsuffizienz vor, wird diese medikamentös therapiert und bei bestehenden Ödemen oder Pleuraergüssen zunächst eine negative Bilanzierung angestrebt, d.h., dass das überschüssige Wasser im Körper forciert über die Nieren ausgeschieden wird.
-
therapeutische Pleurapunktion: Bei ausgedehnten Ergüssen, die mit Beeinträchtigungen des Patienten einhergehen, kann der Pleuraerguss mittels Punktion entlastet bzw. abgelassen werden. Pro Sitzung sollten bei der Pleurapunktion nicht mehr als 500–1000 ml abgelassen werden, da es durch die Veränderung der Druckverhältnisse im Brustkorb anschließend zu einem Lungenödem kommen kann.
-
Pleuradrainage (Synonym: Thoraxdrainage): Wenn sich der Pleuraerguss nicht mehr zurückbildet, kann eine mehrtägige Drainage zur Ableitung von blutigen, serösen, lymphaltigen oder infektiösen Sekreten aus dem Pleuraspalt erforderlich sein. Bei einem Pneumothorax wird auf diese Weise Luft aus dem Pleuraspalt gezogen. Bei operativen Eingriffen am Brustkorb, wie z.B. an der Lunge, am Herzen oder Ösophagus, werden intraoperativ meist eine oder mehrere Drainagen angelegt. Die Drainage kann bei infektiösem Sekret (Pleuraempyem) auch zur Spülung genutzt werden.
-
videoassistierte Thorakoskopie (VATS): Dieses minimalinvasive thoraxchirurgische Verfahren wird eingesetzt zur Durchführung einer Pleurodese, zur Entfernung von begrenzten, entzündlichen Verklebungen im Pleuraspalt und zur Pleurektomie. Hierbei werden eine Optik und weitere Instrumente über kleine Inzisionen (0,5–1,2 cm) in das Operationsgebiet eingeführt. Von Vorteil ist, dass größere Verletzungen des Brustkorbes vermieden werden können und damit die postoperativen Schmerzen für den Patienten eher gering sind.
-
Pleurodese: Verfahren, bei dem thorakoskopisch eine Substanz (z.B. Talkum) in den Pleuraspalt appliziert wird, die an der Pleura visceralis und Pleura parietalis eine starke Entzündungsreaktion hervorruft. Durch die Sezernierung von Fibrin kommt es dann im weiteren Verlauf zu einer Verklebung der beiden Pleurablätter bzw. zu einem Verschluss des Pleuraspaltes.
-
Pleurektomie: thorakoskopischer Eingriff, bei dem die Pleura parietalis entfernt wird und die Pleura visceralis im Anschluss mit der Brustkorbwand verwächst. Dieser Eingriff erfolgt zur Entlastung des Patienten bei nicht therapierbaren Tumorerkrankungen mit rezidivierenden (wiederkehrenden) Pleuraergüssen, zur Sanierung eines Pleuraempyems oder bei der Pneumothoraxbehandlung.
-
Dekortikation (= Entrindung): operative Entfernung der Pleura visceralis. Dieses Verfahren wird angewendet bei einem Pleuramesotheliom und bei einem Pleuraempyem mit ausgeprägter Schwartenbildung der Pleura, die unbehandelt zu starken Beeinträchtigungen der Lungenfunktion führt. Dieser Eingriff erfolgt in den meisten Fällen mittels einer Thorakotomie.
31.9.2 Pflege- und Behandlungsplan
Wie sich der Pleuraerguss auswirkt, hängt stark von der Erkrankung und dem Allgemeinzustand des Patienten ab. Ein junger Patient in gutem Allgemeinzustand, dessen Pleuraerguss z. B. Folge einer Lungenentzündung ist, wird nach entsprechender Behandlung rasch genesen. Für einen älteren Patienten, der sich aufgrund seiner bestehenden Tumorerkrankung in einem schlechten Allgemeinzustand befindet, kann ein Pleuraerguss rasch lebensbedrohend sein.
Schwerpunkte bei der Pflege von Patienten mit Pleuraerguss sind folgende:
31.9.2.1 Atmung unterstützen
Der Patient sollte möglichst auf der gesunden Seite liegen, um die Belüftung und Ausdehnung der erkrankten Lungenabschnitte zu fördern. Eine Hochlagerung des Oberkörpers und die Gabe von Sauerstoff erleichtern dem Patienten das Atmen. Zusätzlich kann mit einer gezielten Atemtherapie die Belüftung der einzelnen Lungenabschnitte unterstützt werden, um weitere Komplikationen zu vermeiden.
31.9.2.2 Bei der Pleurapunktion assistieren
Eine Pleurapunktion wird einerseits zu diagnostischen Zwecken zur Klärung der Ursache und andererseits zu therapeutischen Zwecken zur Entlastung des Patienten oder Applikation von Medikamenten durchgeführt. Als Komplikation einer Pleurapunktion kann es zu einem Pneumothorax, zu Blutungen (Hämatothorax) oder zu Infektionen (Pleuraempyem) kommen.
Vorbereitung des Patienten
Maßnahmen, die vor der Punktion durchgeführt werden, sind:
-
Aufklärung des Patienten durch den Arzt
-
evtl. Prämedikation nach Anordnung (z. B. Analgesie oder Antitussiva)
-
Sonografie der Thoraxwand durch den Arzt
-
Laborergebnisse: aktueller Gerinnungsstatus (Quick, PTT und Thrombozyten)
-
bei stärkerer Behaarung Punktionsstelle rasieren
Vorbereitung des Materials
Materialien, die vor der Punktion auf einer desinfizierten Ablage gerichtet werden müssen, sind:
-
Punktionsset ( ▶ Abb. 31.17); alternativ: großlumige Venenverweilkanüle mit Dreiwegehahn, Verbindungsschlauch und Auffangbehälter
-
Händedesinfektionsmittel, Einmalunterlagen als Bettschutz
-
sterile Handschuhe, Mundschutz und Haube (Arzt), unsterile Handschuhe (Assistenz),
-
Hautdesinfektionsmittel, sterile Nierenschale, sterile Watteträger, sterile Klemme
-
Lokalanästhetikum nach Anordnung mit Spritze und Kanülen
-
sterile Kompressen, steriles Lochtuch (selbstklebend), steriles Pflaster
-
bei diagnostischer Punktion: 20-ml-Spritze, Proberöhrchen, ggf. Blutkulturflaschen und Begleitscheine je nach Anordnung
-
Abfallbehälter
Abb. 31.17 Pleurapunktionsset.
(Foto: P. Blåfield, Thieme)

Positionierung des Patienten
Der Patient sollte, wenn möglich, eine sitzende Position einnehmen mit leicht nach vorne gebeugtem Oberkörper. Dabei kann er die Arme auf einer Stuhllehne, einem Nachttisch oder bei Bedarf auf die Schultern einer Hilfsperson abstützen. Der Oberkörper sollte entkleidet sein.
Ein bettlägeriger Patient sollte auf dem Rücken mit der zu punktierenden Seite nahe an der Bettkante positioniert werden. Den Arm möglichst neben den Kopf legen.
Assistenz (Pflegeperson)
Die Pflegeperson bereitet das Material vor und reicht es während der Punktion an:
-
Bettschutz vorlegen.
-
Materialien griffbereit anordnen.
-
Handschuhe steril anreichen, danach das sterile Lochtuch.
-
Punktionsset steril öffnen und anreichen.
-
Pleurasekret nach Anweisung des Arztes aspirieren, ggf. Auffanggefäß halten.
-
Proberöhrchen füllen und beschriften.
-
Ggf. Medikamente (zur Applikation in den Pleuraspalt) anreichen.
-
Patienten während der gesamten Durchführung beobachten (Atmung, Schmerzanzeichen, Schwindel, Bewegung, Husten usw.).
Durchführung (Arzt)
Die Punktion erfolgt in folgenden Teilschritten:
-
Die Punktionsstelle wird sonografisch lokalisiert und markiert.
-
Nach der Händedesinfektion und dem Anlegen von Mundschutz und Haube wird die Punktionsstelle desinfiziert.
-
Die Lokalanästhesie wird am oberen Rippenrand gesetzt, danach wird die Punktionsstelle erneut desinfiziert.
-
Sterile Handschuhe werden angezogen, das sterile Lochtuch angelegt.
-
Unter Aspiration wird punktiert, bis sich Ergussmaterial in der Spritze zeigt ( ▶ Abb. 31.18a).
-
Dann wird die Punktionskanüle vorgeschoben, bis der Erguss abfließt ( ▶ Abb. 31.18b), und das Punktionssystem angeschlossen.
-
Dabei ist auf ein geschlossenes System zu achten: Der Dreiwegehahn darf nur zur unmittelbaren Aspiration oder zum Ablauf in einen Beutel geöffnet sein und nicht zur Atmosphäre (Umgebungsluft), weil es sonst zu einem Pneumothorax kommen kann, wenn Luft in den Pleuraspalt gelangt.
-
Bei der diagnostischen Punktion wird mit der 20-ml-Spritze Ergussmaterial aspiriert ( ▶ Abb. 31.18c).
-
Bei der Ausatmung des Patienten wird die Kanüle entfernt und die Punktionsstelle für einen kurzen Moment mit sterilen Kompressen abgedrückt ( ▶ Abb. 31.18d).
-
Anschließend wird ein steriles Pflaster aufgeklebt.
Abb. 31.18 Durchführung einer Pleurapunktion.
Abb. 31.18a Unter Aspiration wird punktiert.
(Foto: C. Hess, Thieme)
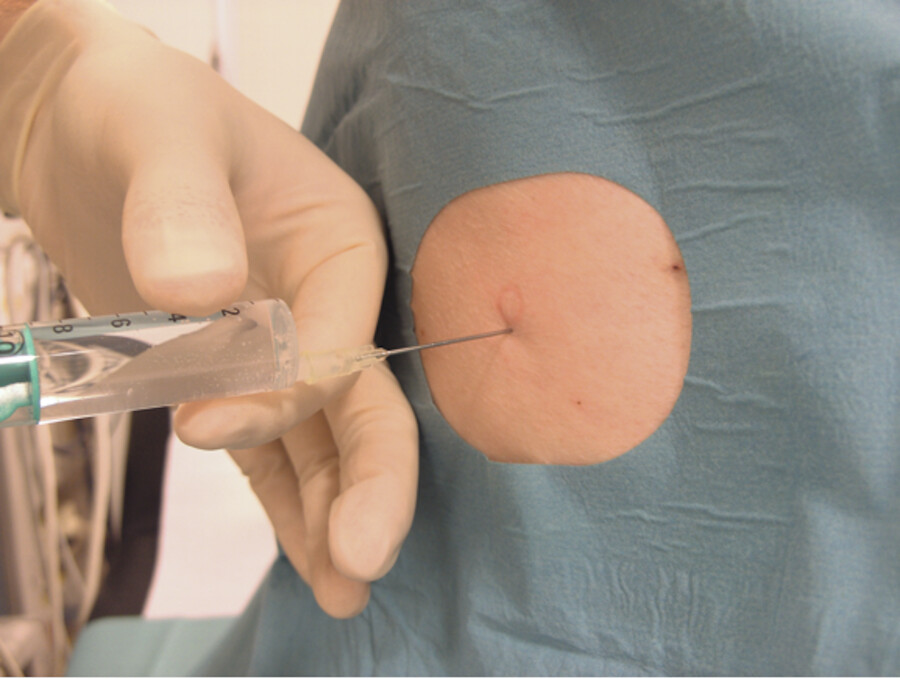
Abb. 31.18b Dann wird die Punktionskanüle vorgeschoben, bis der Erguss abfließt.
(Foto: C. Hess, Thieme)
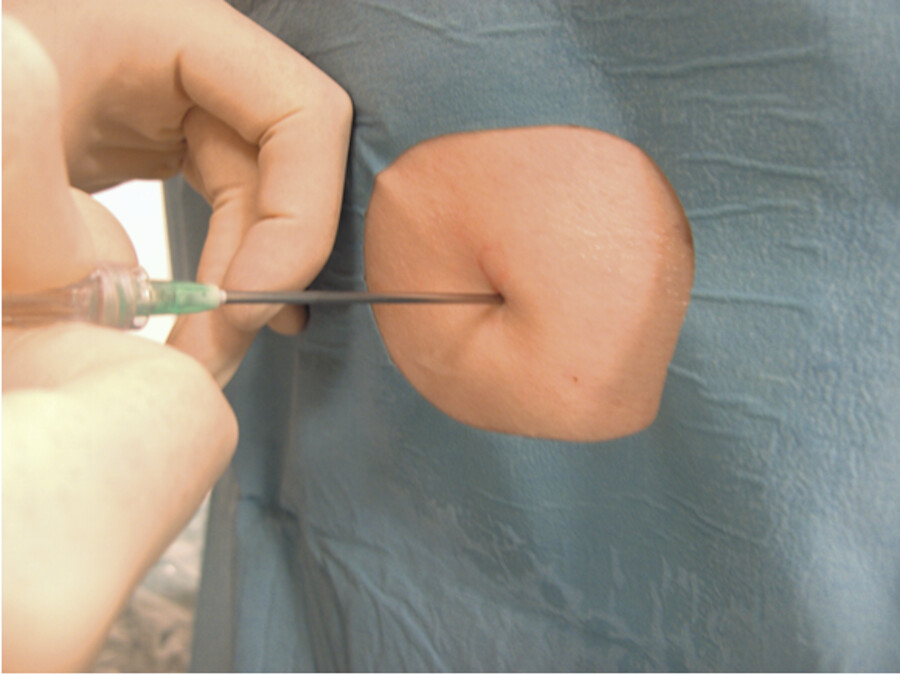
Abb. 31.18c Der Arzt kann nun den Pleuraerguss aspirieren.
(Foto: C. Hess, Thieme)
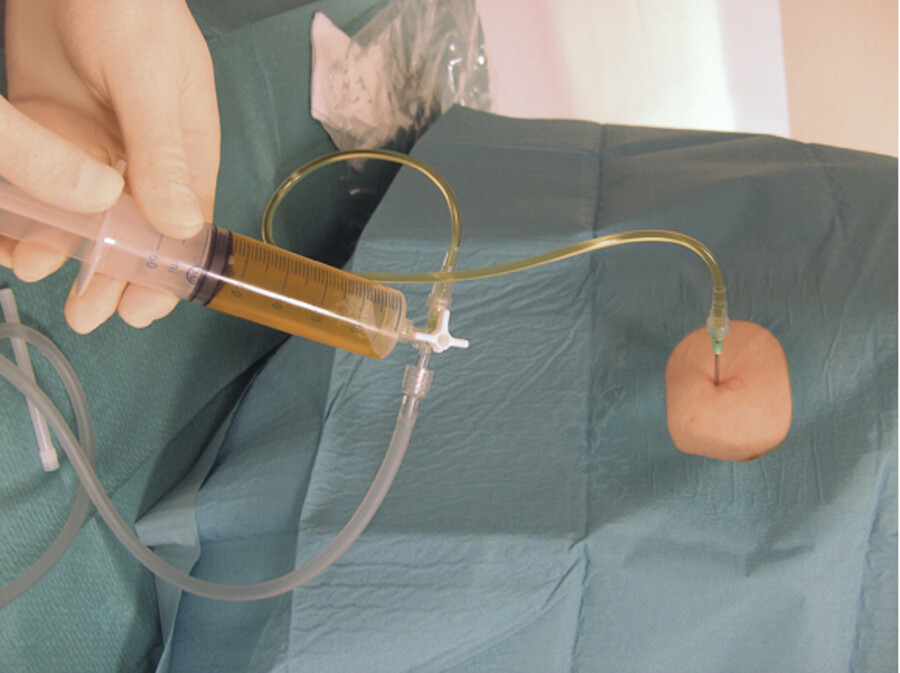
Abb. 31.18d Abschließend wird die Nadel in Exspiration entfernt und die Punktionsstelle abgedrückt.
(Foto: C. Hess, Thieme)
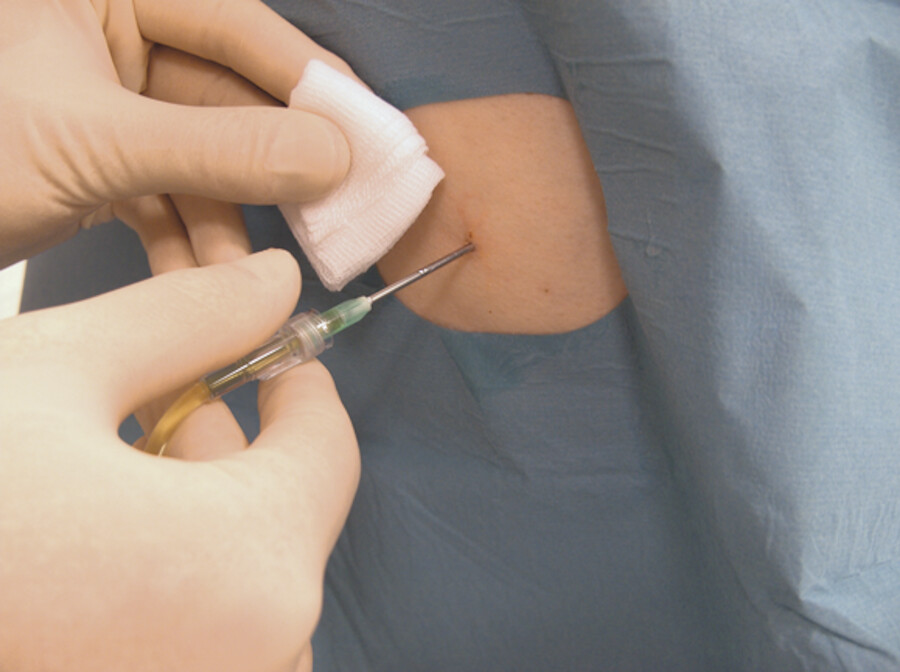
Nachbereitung
Aufgaben der Pflege nach der Punktion sind:
-
Patienten bequem, möglichst mit erhöhtem Oberkörper, lagern.
-
Vitalzeichen engmaschig kontrollieren (Blutdruck, Herzfrequenz, Atmung, Aussehen, Punktionsstelle).
-
Klingel in Reichweite des Patienten legen (Info: Bei Atemnot oder Schmerzen sofort melden).
-
Menge der abgezogenen Flüssigkeit und ggf. Besonderheiten dokumentieren.
Merke
-
Während der Pleurapunktion sollte darauf geachtet werden, dass es sich bei dem Punktionsset um ein geschlossenes System handelt und keine Luft über den Dreiwegehahn in den Pleuraspalt gelangen kann, da es sonst zum Kollabieren der Lungenhälfte (Pneumothorax) kommen kann.
-
Ein Röntgen-Thorax sollte frühestens nach 2 Stunden – bei akuter Luftnot sofort – erfolgen.
31.10 Pflege von Patienten mit Pneumothorax
31.10.1 Medizinischer Überblick
Anatomie und Physiologie im Fokus
(nach Schwegler u. Lucius 2016)
Ähnlich wie bei einem Blasebalg wird bei jeder Inspiration (Einatmung) Luft in die Lunge gezogen und bei der Exspiration (Ausatmung) wieder hinausgepresst. Damit dieser Mechanismus funktionieren kann, muss im in sich geschlossenen Pleuraspalt ein negativer Druck (-4 mmHg) herrschen. Nur so wird jede Atembewegung der Thoraxwand auf die Lunge übertragen. Ein kleines Loch in der Pleura genügt, damit Luft in den Pleuraspalt eindringt und die elastische Lunge kollabiert bzw. in sich zusammenfällt.
Definition
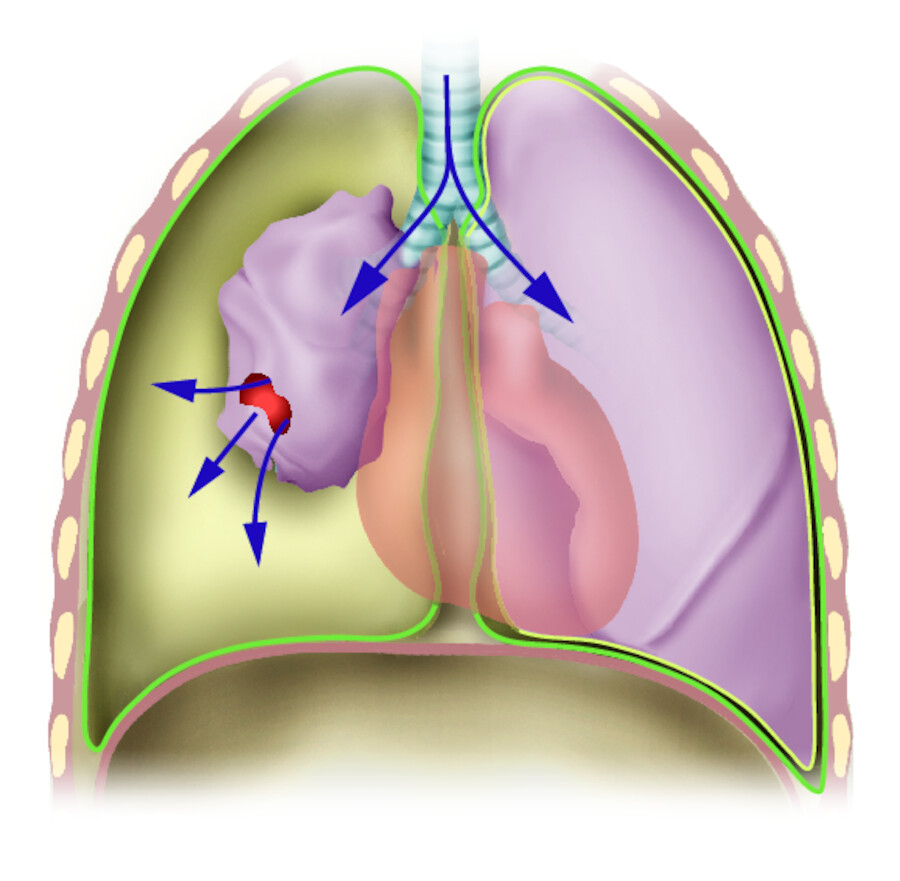
Als Pneumothorax bezeichnet man die Ansammlung von Luft im Pleuraspalt. Der sonst vorhandene Unterdruck zwischen Pleura visceralis und Pleura parietalis ist aufgehoben und so kommt es dazu, dass die Lungenhälfte teilweise oder komplett kollabiert und nicht mehr am Gasaustausch teilnehmen kann. ( ▶ Abb. 31.19)
Pneumothorax.
Abb. 31.19 Beim Pneumothorax fällt der betroffene Lungenflügel wie ein Luftballon in sich zusammen (Luftballoneffekt).
31.10.1.1 Ursachen
Abhängig von den Entstehungsmechanismen und der Grunderkrankung werden verschiedene Ursachen unterschieden:
Spontanpneumothorax Tritt bei einem Patienten mit einer gesunden Lunge ohne äußere Einwirkung plötzlich ein Pneumothorax auf, dann spricht man von einem primären Spontanpneumothorax. Häufig lassen sich bei den Betroffenen in der Lungenspitze geplatzte dünnwandige bzw. poröse Lungenbläschen unklarer Genese nachweisen, die einen Lufteintritt in den Pleuraspalt verursacht haben. Auch bei jungen, schlanken und großgewachsenen Männern zwischen 15 und 35 Jahren und bei Sportlern ist diese Form des Pneumothorax nicht selten zu beobachten. Da die Symptome bei einer gesunden Lunge eher gering ausfallen, wird die Diagnose oft erst nach einigen Tagen gestellt.
Anders verhält es sich bei einem sekundären Spontanpneumothorax. Diese Form ist immer eine Folge bzw. eine Komplikation einer bestehenden bronchopulmonalen Grunderkrankung, wie z.B. dem Lungenemphysem, Tuberkulose, Lungentumor oder subpleurale Lungenmetastasen. Da die Atemfunktion bei diesen Patienten aufgrund der Erkrankung schon eingeschränkt ist, macht sich ein Pneumothorax bei ihnen sofort durch akute Beschwerden bemerkbar.
Traumatischer Pneumothorax Die Ursache für diese Form des Pneumothorax ist meist eine stumpfe äußere Gewalteinwirkung, wie z.B. eine Rippenfraktur bei einem Unfall oder eine scharfe äußere Gewalteinwirkung, wie etwa eine Messerstichverletzung. Diese Gewalteinwirkung kann zu Verletzungen des Lungengewebes, des Brustkorbs und der Pleura führen.
Iatrogener Pneumothorax Diese Form des Pneumothorax entsteht durch eine Komplikation bei einer ärztlicher Behandlung (iatrogen: durch ärztliche Einwirkung entstanden), wie z.B. einer Pleurapunktion, einer Bronchoskopie mit Biopsie, einer Reanimation oder der Anlage eines zentralen Venenkatheters (ZVK) in der Vena subclavia.
Spannungspneumothorax (Ventilpneumothorax) Manche Verletzungen der Pleurawand wirken sich wie ein Ventilmechanismus aus, d.h., Luft dringt bei jeder Inspiration in den Pleuraspalt ein, kann aber bei der Exspiration nicht mehr entweichen. Ähnlich wie beim Aufpumpen eines Fahrradschlauchs füllt sich der Brustkorb mehr und mehr mit Luft, wodurch sich der intrathorakale Druck deutlich erhöht. Das Herz, die unbeteiligte Lunge und die großen venösen Blutgefäße (obere und untere Hohlvene) werden stark komprimiert und zur Seite gedrängt. Neben rasch zunehmender Luftnot ist in diesem Fall ein akuter Blutdruckabfall mit Tachykardie und Zyanose bis hin zu einer Schocksymptomatik zu beobachten. Hier ist eine sofortige Druckentlastung durch Punktion der betroffenen Thoraxwand erforderlich, da für den Patienten akute Lebensgefahr besteht.
31.10.1.2 Symptome
Zu den klassischen Symptomen gehören:
-
plötzlich auftretender, einseitiger, stechender und atemabhängiger Brustschmerz
-
schmerzbedingte Schonatmung (flache und schnelle Atemzüge)
-
Atemnot und Beklemmungsgefühl
-
evtl. Zyanose (bläuliche Verfärbung der Haut und der Schleimhäute, besonders der Lippen und Fingerspitzen)
-
betroffene Thoraxhälfte „schleppt“ bei der Atmung nach (asymmetrische Atembewegungen)
-
ggf. Hautemphysem (Luft drückt sich aus dem Pleuraspalt in das subkutane Fettgewebe und ist beim Abtasten als eine Art „Knistern“ in der Haut spürbar)
-
Monitoring: akuter Abfall der Sauerstoffsättigung
Merke
Obwohl bei einem Pneumothorax klinisch Bewegungen des Brustkorbes zu beobachten sind, findet durch den fehlenden Unterdruck kein Gasaustausch statt.
31.10.1.3 Diagnostik
Zur Diagnostik gehören:
-
Anamnese (u.a. pulmonale Vorerkrankungen, Raucher usw.)
-
körperliche Untersuchung: Auskultation und Perkussion der Lunge (bei der Auskultation sind nur sehr leise oder gar keine Atemgeräusche mehr zu hören)
-
Röntgen-Thorax in Exspiration (wichtigste Untersuchung zur Sicherung der Diagnose, ▶ Abb. 31.20)
-
Computertomografie (z. B. zum Ausschluss eines Lungenemphysems)
-
EKG (zum Ausschluss kardialer Erkrankungen)
-
Blutgasanalyse (zur Bestimmung der respiratorischen Leistungskapazität)
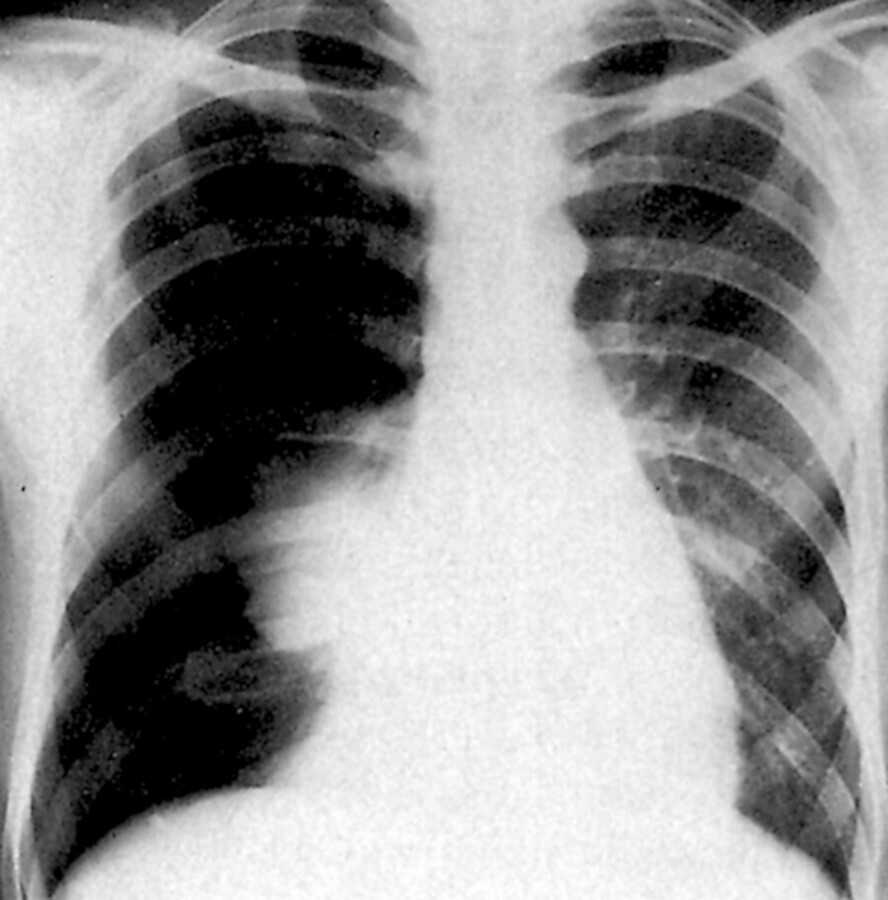
Das Röntgenbild zeigt einen rechtsseitigen Pneumothorax.
Abb. 31.20 Die rechte Lunge ist zu einem schattendichten Gebilde in Hilusnähe kollabiert.
31.10.1.4 Therapie
Die Behandlung richtet sich nach der Größe und Ursache des jeweiligen Pneumothorax und dem Befinden des Patienten.
Konservative Therapie In seltenen Fällen ist der Pneumothorax sehr klein und kann einzig mit unterstützender Sauerstoffgabe behandelt werden. Die Luft im Pleuraspalt wird langsam selbständig resorbiert und der Patient bleibt einige Tage zur Beobachtung stationär, um einen möglichen Rückfall zu vermeiden bzw. sofort zu erkennen.
Pleura- bzw. Thoraxdrainage Die am häufigsten durchgeführte Maßnahme bei fast allen Formen des Pneumothorax ist das Anlegen einer Thoraxdrainage, die mit einer Sogregulierung die Luft aus dem Pleuraspalt entfernt und gleichzeitig den Unterdruck wiederherstellt. Der Sog wird so lange aufrechterhalten, bis im Röntgenbild wieder eine vollständige Entfaltung der Lunge zu erkennen ist. Siehe ▶ Umgang mit Thoraxdrainagen.
Improvisierte Pleurapunktion Als Notfalltherapie z.B. bei einem Spannungspneumothorax führt diese Maßnahme zu einer sofortigen Entlastung des Überdrucks. Da bei lebensrettenden Sofortmaßnahmen meist kein spezielles Instrumentarium zur Verfügung steht, kann z. B. eine möglichst großlumige Braunüle zum Punktieren der Thoraxwand verwendet werden.
Pleurodese Entfaltet sich die Lunge trotz liegender Thoraxdrainage nicht vollständig oder entsteht nach der Therapie erneut ein Pneumothorax, wird eine ▶ Pleurodese durchgeführt. Dieser Eingriff erfolgt minimalinvasiv mittels einer ▶ videoassistierten Thorakoskopie (VATS). Durch das Verkleben bzw. Verwachsen der Pleurawände kann die Lunge trotz eines Lochs bzw. einer Öffnung in der Pleura nicht mehr kollabieren.
Thorakotomie Wenn eine Pleurodese aufgrund von bereits vorhandenen Vernarbungen bzw. Verwachsungen nicht möglich ist, wird der Brustkorb seitlich (im 5. Interkostalraum) eröffnet und die Lufteintrittsstelle verschlossen bzw. entfernt. Intraoperativ werden 1 oder 2 Thoraxdrainagen zum Ableiten von Luft, Blut und Sekret eingelegt, die nach ca. 3 Tagen entfernt werden können.
31.10.2 Pflege- und Behandlungsplan
Der akute Pneumothorax, insbesondere der Spannungspneumothorax, ist eine Notfallsituation. Der Arzt muss umgehend informiert werden und der Patient darf nicht alleine gelassen werden. Um Panik bei dem Patienten zu vermeiden, sollte das Gefühl von Ruhe und Sicherheit vermittelt werden.
An erster Stelle der pflegerischen Aufgaben stehen atemunterstützende und prophylaktische Maßnahmen:
-
Engmaschige Kontrolle von Atmung, Hautfarbe, Bewusstseinslage, Blutdruck und Herzfrequenz sicherstellen.
-
Schmerzmedikation nach Arztanordnung verabreichen, um Schonatmung zu vermeiden.
-
Atemunterstützende Körperhaltung bzw. Lagerungen ermöglichen.
-
Zu einer ruhigen und gleichmäßigen Atmung anleiten (z.B. Kontaktatmung oder ASE).
-
Sauerstoff über Nasensonde, Sauerstoffbrille oder -maske nach Arztanordnung verabreichen.
-
Einengende Kleidung vermeiden.
-
Auf ausreichende Frischluftzufuhr achten.
-
Ggf. Patienten bei der Körperpflege unterstützen, um körperliche Anstrengung zu vermeiden.
-
Maßnahmen zur Pneumonieprophylaxe durchführen (abhängig vom Befinden des Patienten).
-
Darauf achten, dass die Patientenklingel immer in Reichweite des Patienten ist.
-
Regelmäßig sterilen Verbandwechsel an der Punktionsstelle der Thoraxdrainage durchführen.
-
Das Hautareal rund um die Punktionsstelle der Thoraxdrainage auf Entzündungszeichen oder ein mögliches Hautemphysem untersuchen.
-
Bei Thoraxdrainagen mit Sogregulation regelmäßig den Sog überprüfen.
31.11 Pflege von Patienten mit Thorakotomie
31.11.1 Medizinischer Überblick
Definition
Unter dem Begriff Thorakotomie versteht man die chirurgische Eröffnung des Thorax durch einen Schnitt im Interkostalraum (Zwischenrippenraum).
31.11.1.1 Indikation
Die Thorakotomie wird bei Operationen an der Lunge, der Pleura und im vorderen sowie mittleren Mediastinum angewandt, z. B. bei
-
Lungentumoren oder –metastasen,
-
Thoraxtrauma,
-
Pleuraempyem,
-
Herzoperationen und
-
Pathologien an der Trachea oder am Ösophagus.
Die verschiedenen Arten des Eingriffs sind in ▶ Tab. 31.10 aufgelistet.
|
Art des Eingriffs |
Beschreibung / Zweck |
|
Keilresektion |
keilförmiges Ausschneiden des Krankheitsherds unter Mitnahme eines gesunden Parenchymsaums |
|
Segmentresektion |
Entfernung des Segments, in dem der Krankheitsherd lokalisiert ist |
|
Lappenresektion (Lobektomie) |
Entfernung eines Lungenlappens, ggf. auch des benachbarten Lappens (Bilobektomie) |
|
Manschettenresektion |
Entfernung eines Oberlappens mit manschettenförmiger Resektion des Hauptbronchus, einschließlich des Abgangs des Lappenbronchus |
|
Pneumektomie |
Entfernung der gesamten Lunge |
|
Dekortikation |
Entfernung von viszeralen und parietalen Pleuraveränderungen bzw. Schwarten (Entrindung) |
|
Thoraxfenster |
Fensterung der Brustwand am tiefsten Punkt der Emphysemresthöhle zur offenen Emphysembehandlung |
|
parietale Pleurektomie |
Entfernung der parietalen Pleura und Verklebung des Pleuraspalts (Palliativmaßnahme bei rezidivierenden, meist malignen Pleuraergüssen und bei rezidivierendem Spannungspneumothorax) |
31.11.1.2 Operationsformen
Die Wahl der Zugangsform ist abhängig von der Lage des OP-Gebiets und der Größe des Eingriffs. In der Regel wird die Form bevorzugt, bei der das Weichteiltrauma (Durchtrennung von Muskel- und Nervengewebe) und der Funktionsverlust so gering wie möglich ausfallen.
Operationsformen sind u.a. ( ▶ Abb. 31.21):
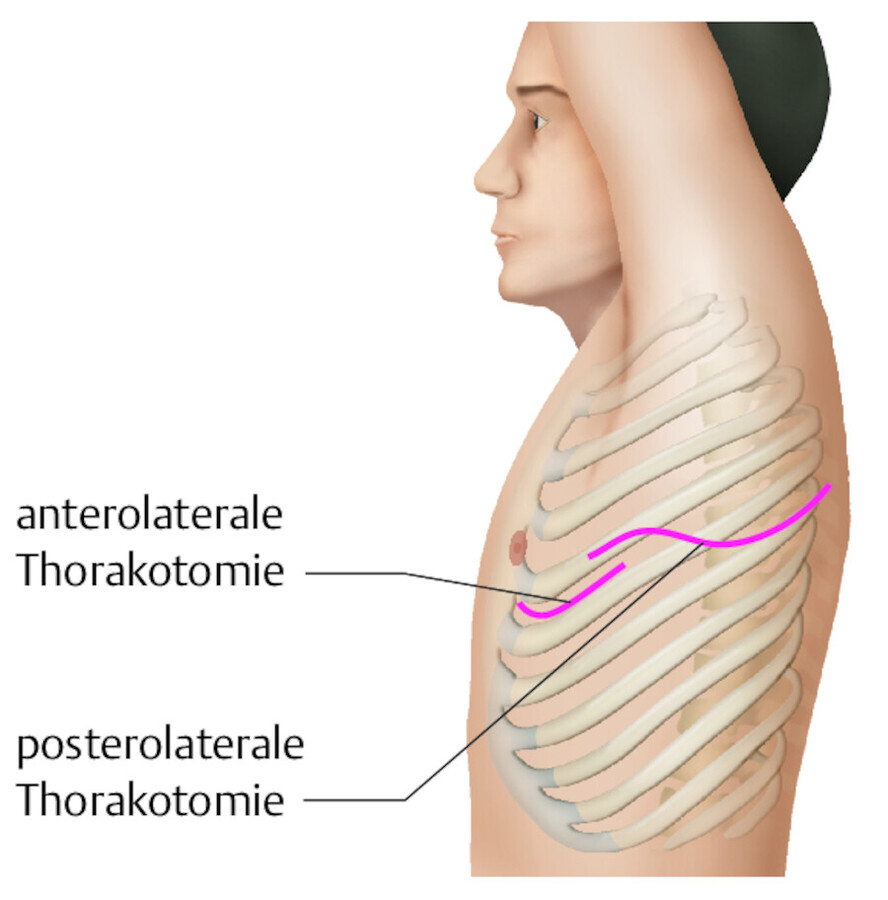
-
posterolateraler Zugang: Dieser Zugang wurde lange Zeit als Standardzugang für Eingriffe an der Lunge, der Trachea oder des Ösophagus gewählt. Die Schnittführung beginnt in der vorderen Axillarlinie und zieht im 5. ICR (Interkostalraum) dorsal bis unterhalb des Schulterblattes u. a. mit Durchtrennung des M. latissimus dorsi. Aufgrund des langen Schnitts (ca. 20–25 cm lang) und der Weichteilverletzung gilt dieser Zugang als traumatisch und postoperativ als sehr schmerzhaft für den Patienten. Zudem kann es zu Funktionseinschränkungen bei der Atmung und Beweglichkeit der betroffenen Schulter kommen.
-
anterolateraler Zugang: Dieser Zugang wird häufig bei einer Lungen- oder Metastasenresektion und Dekortikation bei Pleuraempyem gewählt. Es handelt sich um einen gewebssparsamen Eingriff, da die Schnittführung unterhalb der Brust und des M. pectoralis beginnt und in Richtung Axilla ausläuft. Die postoperativen Schmerzen sind bei dieser Methode deutlich geringer als bei der posterolateralen Schnittführung, da kaum Weichteile verletzt werden. Allerdings ist die Sicht auf das OP-Gebiet eingeschränkter.
-
Sternotomie: Hierbei wird der Thorax mit einem Längsschnitt auf Höhe des Sternums (Brustbein) eröffnet. Dies ist der klassische Zugang in der Herzchirurgie oder bei Mediastinaltumoren und seltener bei Lungenoperationen.
Abb. 31.21 Thorakotomie.
Bei der anterolateralen Thorakotomie wird ein Schnitt in der mittleren Axillarlinie; bei der postlateralen Thorakotomie im Verlauf der 5. oder 6. Rippe durchgeführt.
31.11.1.3 Komplikationen
Postoperativ können z. T. lebensgefährliche Komplikationen auftreten, die eine intensivmedizinische Überwachung unumgänglich machen:
-
Nachblutungen
-
Pneumonie
-
Pleuraerguss
-
Pneumothorax
-
Herzrhythmusstörungen
-
Herzinsuffizienz
-
Haut-, Gewebe-, Mediastinalemphysem
-
Interkostalneuralgien mit starken Schmerzen
31.11.2 Pflege- und Behandlungsplan
Ziel ist die frühestmögliche Wiederherstellung einer physiologischen Atmung und die Vermeidung postoperativer Komplikationen. Die Aufgaben der Pflege lassen sich wie folgt einteilen:
-
präoperative Maßnahmen
-
postoperative Maßnahmen
-
Umgang mit Thoraxdrainagen
-
Assistenz beim Legen einer Thoraxdrainage
-
Pflege des Patienten mit Thoraxdrainage
31.11.2.1 Präoperative Maßnahmen
Risikoerfassung
Da man nach einer Operation mit einer Verschlechterung der Lungenfunktion rechnen muss, gehört die präoperative Risikoerfassung mittels folgender Untersuchungen zur OP-Vorbereitung:
-
Anamnese (Rauchgewohnheiten, Medikamenteneinnahme)
-
Lungenfunktionsprüfung
-
Spirometrie
-
Ganzkörperplethysmografie
-
arterielle Blutgasanalyse
-
Pulmonalarteriendruck
-
Lungenszintigrafie
-
Röntgenaufnahme bzw. Computertomografie des Thorax
-
EKG
-
Labor
OP-Vorbereitung
Zu den Maßnahmen zählen:
-
Rauch- und Alkoholverbot
-
Atemgymnastik (Physiotherapie direkt bei Aufnahme anmelden)
-
Inhalation
Maßnahmen, die am Vortag oder direkt vor der Operation durchgeführt werden, sind:
-
Abführmaßnahmen am Vortag (z. B. Klysma)
-
Nahrungskarenz (ab 22.00 Uhr des Vortages)
-
Duschen am OP-Tag
-
Rasur (bei Frauen die Achselhöhlen, bei Männern zusätzlich der gesamte Brustkorb)
-
Antikoagulanzien verabreichen und medizinische Antithrombosestrümpfe anziehen
Beraten und Schulen Durch präoperative Beratung und Schulung des Patienten werden Ängste abgebaut und Sicherheit vermittelt. Fakt ist, dass sich der postoperative Verlauf durch eine gute präoperative Beratung und Schulung positiv beeinflussen lässt. Auch führt dies zu einer niedrigeren Komplikationsrate und zu einer geringeren Verweildauer.
Praxistipp
Atemübung: Zwerchfellatmung in Verbindung mit der lautlosen Lippenbremse
Der Patient liegt mit leicht erhöhtem Kopfteil auf dem Rücken und hat die Beine zur Bauchdeckenentlastung angestellt. Die Pflegekraft legt die flache Hand auf den Bauch des Patienten (etwa auf Zwerchfellhöhe) und fordert ihn auf, durch die Nase in den Bauch einzuatmen. Bei der Ausatmung bietet sich die Anwendung der lautlosen ▶ Lippenbremse an. Auf diese Weise werden auch die basalen Lungenabschnitte gut belüftet, das Zwerchfell aktiviert und ggf. Sekret mobilisiert.
Wenn nach einigen Wiederholungen diese Technik vom Patienten gut umgesetzt wird, kann er seine Hände dazunehmen und die Atembewegung mitfühlen. Im postoperativen Verlauf hat der Patient diese Übung verinnerlicht und kann sie regelmäßig und selbständig durchführen.