46.3.2.3 Chemotherapie
Ziel der onkologischen Chemotherapie ist die Abtötung bösartiger Zellen mit möglichst minimaler Begleitschädigung gesunder Gewebe. Angriffspunkt für die Medikamente der klassischen Chemotherapie (Zytostatika, ▶ Abb. 46.6) sind Unterschiede im Wachstum zwischen normalen Zellen und Tumorzellen. Aufgrund ihres unkontrollierten Wachstums sind Tumorzellen in besonderer Weise von Mechanismen der Zellteilung abhängig. Zytostatika binden Zielmoleküle des Zellzyklus, darunter v. a. Nukleinsäuren (DNA und RNA), und verursachen über direkte und indirekte Mechanismen Zellschäden, die den Tod der Zelle zur Folge haben. Die Zielstrukturen klassischer Zytostatika sind in ▶ Abb. 46.7 verdeutlicht.
Zytostatika.
Abb. 46.6 a Zubereitung von Zytostatika, b Verabreichung von Zytostatika.
Zielstrukturen klassischer Zytostatika.
Abb. 46.7
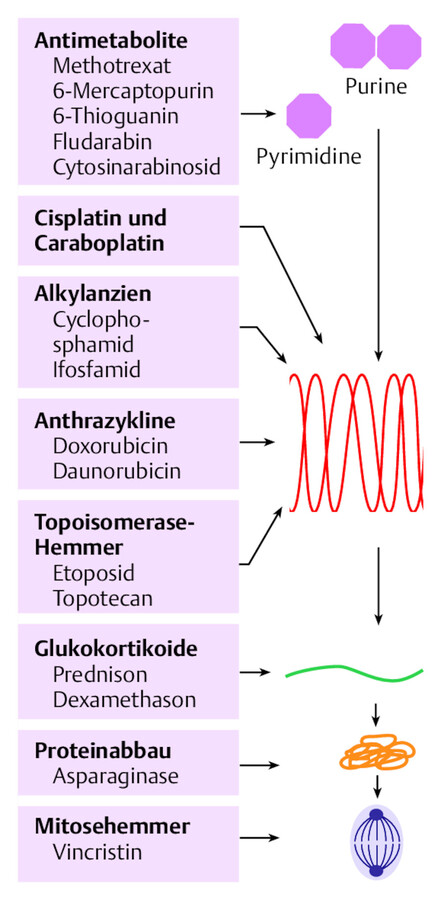
Im Rahmen der Tumortherapie werden meist mehrere verschiedene Zytostatika kombiniert. Durch die sich ergänzenden Wirkmechanismen kann die Wirkung gesteigert werden. Darüber hinaus wird die rasche Selektion einzelner resistenter Tumorzellen verhindert.
Die meisten Zytostatika werden stoßweise in Form von Chemotherapieblöcken verabreicht, um die Effektivität zu steigern und dem Körper im behandlungsfreien Intervall die Möglichkeit zur Erholung zu geben.
Nebenwirkungen der Chemotherapie
Unerwünschte Nebenwirkungen der Chemotherapie entstehen durch fehlende Spezifität der Zytostatika für die bösartigen Zellen. Geschädigt werden v. a. Zellen mit hoher Proliferationsrate, darunter die Zellen der Blutbildung und der Schleimhaut des Magen-Darm-Trakts. Häufig treten folgende unerwünschte Wirkungen auf:
Übelkeit und Erbrechen Durch regelmäßige Verabreichung von Medikamenten, die Brechreiz und Übelkeit unterdrücken (Antiemetika), können diese Symptome erheblich verringert werden. Wichtig ist die Einnahme des Antiemetikums bereits vor Auftreten von Übelkeit.
Haarausfall Viele Zytostatika verursachen einen vorübergehenden Haarausfall.
Störung der Blutbildung Durch die vorübergehende Störung der Bildung weißer (Leukozyten) und roter Blutkörperchen (Erythrozyten) und Blutplättchen (Thrombozyten) kommt es zu einer Anämie, Blutungsneigung und Infektgefährdung. Erythrozyten und Thrombozyten können durch Transfusion von Blutprodukten gesunder Spender ersetzt werden. Es wird angestrebt, die Thrombozyten mithilfe von Transfusionen über 10 – 20 000/µl und den Hb-Wert über 7 – 8 g/dl zu halten, um Blutungen und Anämiesymptome (Kopfschmerzen, Schwäche, Schwindel) zu vermeiden. Bluttransfusionen können Unverträglichkeitsreaktionen bis hin zum Kreislaufversagen auslösen, denen mit Medikamenten unmittelbar entgegengewirkt werden muss. Grundsätzlich besteht das Risiko einer Übertragung einer HIV-Infektion, das in Deutschland mit <1:16 000 000 angegeben wird, bzw. einer Hepatitis B (1:1 000 000) und Hepatitis C (<1:16 000 000).
Durch die Bildungsstörung für Leukozyten besteht eine erhebliche Infektgefährdung des Patienten. Aufgrund der individuell unterschiedlichen Gewebemerkmale auf den weißen Blutkörperchen sollten Leukozyten nur in Ausnahmefällen transfundiert werden, sodass nach Chemotherapie die Erholung der Leukozyten abgewartet werden muss. Durch Verabreichung von Granulozyten-Wachstumsfaktor (G-CSF) kann die Phase des Zelltiefs (Aplasie) um einige Tage abgekürzt werden.
Definition
Aplasie bezeichnet die Phase des Zelltiefs, die durch die Störung der Blutbildung verursacht wurde.
In der Aplasie müssen alle Fieberphasen als schwere bakterielle Infektion (Sepsis) betrachtet werden, weil ohne Leukozyten keine ausreichende Immunabwehr gegen Bakterien besteht. Nach Entnahme von Blutkulturen müssen die Patienten sofort mit Antibiotika behandelt werden. Bei anhaltendem Fieber muss an Pilzinfektionen, meist der Lunge, oder Virusinfektionen gedacht werden. Virusinfektionen, die bei normalem Abwehrsystem harmlos verlaufen, z. B. Windpocken, können für Patienten in Aplasie eine Lebensbedrohung darstellen.
Mundschleimhautentzündung (Stomatitis) Durch Schädigung der Schleimhäute in Mund, Rachen, Speiseröhre, Magen und Darm kann es zu einer schmerzhaften Entzündung mit Schluckbeschwerden und zu Durchfall kommen. In schweren Fällen kann die Nahrungsaufnahme unmöglich werden, sodass die Patienten parenteral ernährt werden müssen. Gegen die Schmerzen werden starke Analgetika bis hin zu Opiaten gegeben. Mit der Erholung der Blutwerte heilen die Schleimhäute ab.
Nebenwirkungen an einzelnen Organen Zahlreiche Zytostatika belasten die Nierenfunktion, sodass sie mit viel Flüssigkeit gegeben werden müssen. Häufig steigen die Leberwerte (Bilirubin, Transaminasen) vorübergehend an, jedoch entwickelt sich nur sehr selten eine schwere oder anhaltende Leberschädigung. Einzelne Zytostatika können darüber hinaus organspezifische Nebenwirkungen und Komplikationen verursachen, z. B. Schädigungen des Herzmuskels, des Gehörs oder des Nervensystems mit Gangstörungen, Missempfindungen oder Verstopfung. Eine blutige Harnblasenentzündung durch spezielle Zytostatika kann durch Verabreichung eines schützenden Medikaments wirksam verhindert werden.
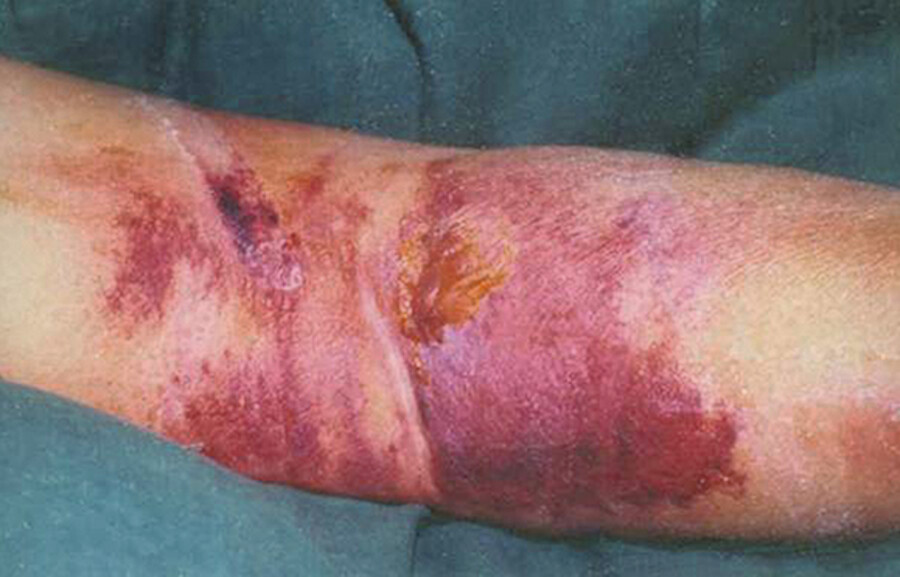
Paravasat (Fehlinjektion) Bei versehentlicher Injektion oder Infusion des Zytostatikums in eine geschädigte Vene oder außerhalb der Vene (Paravasat) können schwere lokale Entzündungen und schlecht heilende Hautnekrosen entstehen ( ▶ Abb. 46.8). In jeder Chemotherapieeinrichtung muss das Personal in Vorbeugung und Behandlung dieser Paravasate geschult sein. Die Verabreichung muss mit großer Sorgfalt geschehen. Viele Patienten erhalten vor Beginn einer intensiven Chemotherapie zur Erleichterung einer sicheren Medikamentengabe einen ▶ zentralvenösen Verweilkatheter.
Nekrose nach paravenöser Injektion eines Zytostatikums.
Abb. 46.8
Fallbeispiel
Eine 23-jährige Patientin wird seit 6 Wochen aufgrund einer akuten myeloischen Leukämie mit einer intensiven Chemotherapie behandelt. Zwischen 2 Therapieblöcken tritt zu Hause abends plötzlich hohes Fieber auf. Die Patientin fühlt sich nicht schwer krank, ist aber über die Risiken einer Infektion in ihrer Situation gut informiert und lässt sich sofort in die Klinik fahren. Eine Blutuntersuchung zeigt einen niedrigen Wert für Leukozyten (300/µl, normal > 3500/µl). Aus dem zentralen Venenkatheter werden Blutkulturen abgenommen. Das Ergebnis wird nicht abgewartet, sondern es wird sofort mit einer Behandlung mit 2 verschiedenen breit wirksamen, venös verabreichten Antibiotika begonnen. Der Patientin geht es jetzt schlechter, das Fieber lässt sich nur vorübergehend leicht senken, der Kreislauf ist jedoch stabil.
Als das Fieber nach 2 Tagen weiterhin anhält, wird die antibakterielle Therapie nach den Standards der Klinik auf 2 andere Medikamente umgestellt. Allmählich fühlt sich die Patientin besser, das Fieber sinkt. In den Blutkulturen, die zu weiteren 2 verschiedenen Zeitpunkten im Fieberanstieg entnommen wurden, lässt sich kein Keim nachweisen. Als am 4. Tag erneut eine Fieberzacke auftritt, wird eine CT-Untersuchung der Lunge durchgeführt, um eine Pilzinfektion auszuschließen. Es finden sich keine verdächtigen Herde. Allmählich kommt es zu einem Anstieg der Leukozyten, die Körpertemperatur normalisiert sich, die Patientin erholt sich zusehends. Sie kann nach Hause entlassen werden, wird jedoch wenige Tage später zur Fortsetzung der Chemotherapie erneut auf die Station aufgenommen.
Spätfolgen der Chemotherapie Als Spätfolgen können einzelne Organe wie Herz, Niere oder Leber dauerhaft in ihrer Funktion eingeschränkt sein. Hinzuweisen ist auf das gehäufte Auftreten weiterer bösartiger Erkrankungen, v. a. Leukämien, nach intensiver Chemotherapie. Aufgrund der möglichen Verminderung der Fertilität sollte Männern ab dem Jugendalter angeboten werden, vor Beginn der Chemotherapie Spermien zu gewinnen, die in flüssigem Stickstoff über viele Jahre aufbewahrt und bei Kinderwunsch für eine künstliche Befruchtung verwendet werden können. Auch bei Mädchen und Frauen werden jetzt Möglichkeiten entwickelt, Eizellen für einen späteren Zeitpunkt aufzubewahren.
Hochdosischemotherapie mit Stammzellrückgabe
Bei einigen Krebserkrankungen mit hohem Rückfallrisiko kann eine maximale Wirkung der Chemotherapie durch Steigerung der Dosis in einem Bereich erzielt werden, in dem das blutbildende Knochenmark irreversibel geschädigt wird. Dieser Zustand würde ohne weitere Maßnahmen zum Tod führen. Durch Rückgabe eigener Stammzellen im Anschluss an die Chemotherapie im Sinne einer „autologen Stammzelltransplantation“ kann jedoch eine Erholung des Knochenmarks erreicht werden. Als Voraussetzung für diese Therapie müssen im Vorfeld aus dem Blut des Patienten blutbildende Stammzellen gewonnen und in ausreichender Dosis eingefroren werden. Unter normalen Bedingungen ist die Anzahl dieser Zellen im Blut sehr gering. Durch Gabe von Wachstumsfaktoren der Blutbildung, z. B. G-CSF, im Anschluss an einen regulären Chemotherapieblock kann eine kurzfristige Ausschwemmung dieser Zellen erreicht werden, die maschinell aus dem Blut gesammelt werden (Leukapherese). Bis zur geplanten Rückgabe werden die Stammzellen in flüssigem Stickstoff aufbewahrt. Bei bekannter Metastasierung des Tumors ins Knochenmark kann eine Aufreinigung der Stammzellen erwogen werden, um eine Rückgabe von Tumorzellen an den Patienten zu vermeiden.
Im Anschluss an die hoch dosierte Chemotherapie werden die eingefrorenen Stammzellen in einem Wasserbad aufgetaut und dem Patienten über die Blutbahn zurückgegeben. Bis zum Anwachsen der Stammzellen im Knochenmark und Regeneration des Blutbilds vergehen ca. 2 – 3 Wochen. In der Zwischenzeit ist der Patient erheblich infektgefährdet und benötigt regelmäßige Bluttransfusionen. Die Hochdosischemotherapie verursacht häufig eine schwere ▶ Mukositis, die eine parenterale Ernährung und intensive Schmerztherapie erforderlich macht. Durch Gabe von Wachstumsfaktoren der Blutbildung (G-CSF) kann die Dauer der Aplasie um einige Tage abgekürzt werden, da die Regeneration der transplantierten Zellen im Knochenmark beschleunigt wird.
46.3.2.4 Hormontherapie
Hormone oder Medikamente mit antihormoneller Wirkung werden in der Tumortherapie eingesetzt, um in das Wachstum hormonell beeinflussbarer Tumoren einzugreifen. Zu diesen Tumoren zählen einige Karzinome der Mamma, der Prostata, der Gebärmutter und der Schilddrüse. Die Krebszellen dieser Tumoren besitzen Hormonrezeptoren, an die die entsprechenden Hormone binden und die Zellteilung anregen. Mehr als die Hälfte der Mammakarzinome verfügen z. B. über Rezeptoren für Östrogene. Diese Tumoren können gezielt mit Rezeptorblockern (z. B. Tamoxifen) oder Hormonsynthesehemmern (z. B. Anastrozol) behandelt werden, die den wachstumsstimulierenden Einfluss der Hormone auf das Tumorwachstum unterbinden. Vor einer Hormontherapie muss die Expression des entsprechenden Rezeptors auf der Oberfläche der Tumorzellen nachgewiesen werden.
Kommt es infolge der Chemotherapie zu einer Einschränkung der Hormonproduktion, z. B. im Sinne einer vorzeitigen Menopause oder nach Hodenentfernung, werden Hormone mit dem Ziel des medikamentösen Ersatzes eingesetzt.
46.3.2.5 Zielgerichtete Therapien
Die medikamentöse Therapie von Krebserkrankungen konnte in den vergangenen Jahren um eine Vielzahl neuer Substanzen erweitert werden, die einen anderen Wirkmechanismus als die klassischen Chemotherapien haben.
Während Zytostatika Krebszellen auf der Basis ihrer außergewöhnlich hohen Zellteilung angreifen, setzen die neuen Medikamente gezielt an den Signalwegen der Zellen an, die infolge der verursachenden Genmutationen aktiviert sind. Viele dieser neuen Medikamente können oral verabreicht werden. Nebenwirkungen dieser Therapien unterscheiden sich erheblich von denen der Chemotherapie. Sie manifestieren sich häufig
-
an der Haut, mit verschiedenen, oft hartnäckigen Hautausschlägen,
-
am Darm (Durchfall),
-
an der Lunge (Pneumonitis) oder
-
durch ausgeprägte Müdigkeit (Fatigue).
Die Blutbildung und Immunabwehr werden weit geringer beeinträchtigt als durch Chemotherapie. Welche der zielgerichteten Therapien für einen bestimmten Patienten in Frage kommen, entscheidet sich anhand molekularer Untersuchungen des individuellen Tumors, sodass häufig auch von einer „personalisierten“ Behandlung" gesprochen wird. In welchem Ausmaß die neuen Substanzen zu einer Verlängerung des Überlebens und Verbesserung der Lebensqualität von Krebspatienten und zu einer langfristigen Erhöhung der Heilungsraten beitragen können, ist noch Gegenstand klinischer Prüfungen.
46.3.2.6 Antikörpertherapie
Antikörper sind Bestandteile des körpereigenen Abwehrsystems. Sie erkennen mit hoher Spezifität Oberflächenantigene auf Zellen und können über die Aktivierung weiterer Mechanismen des Immunsystems die Zelle zerstören. Viele Tumoren unterscheiden sich in ihren Oberflächenmerkmalen von der Mehrzahl gesunder Zellen, sodass durch therapeutische Gabe gentechnologisch hergestellter Antikörper eine gezielte Tumortherapie möglich erscheint. Seit 1998 wurden verschiedene Antikörper zur Therapie solider Tumoren und bösartiger Erkrankungen des blutbildenden Systems zugelassen. Einige dieser Antikörper sind mit radioaktiven oder zelltoxischen Komponenten verbunden, um ihre Wirkung gegen die Tumorzelle zu verstärken. Die Verabreichung erfolgt entweder allein oder in Kombination, z. B. mit einer Chemotherapie. Ein Beispiel ist Rituximab, das bei B-Zell-Lymphomen eingesetzt wird. Rituximab zerstört über eine Bindung an den B-Zell-Marker CD 20 alle B-Zellen einschließlich der Tumorzellen. Die Stammzellen der Blutbildung bleiben verschont, sodass sich das gesunde B-Zell-System wieder erholen kann.
46.3.2.7 Allogene Knochenmark- und Blutstammzelltransplantation
Das Prinzip der allogenen Stammzelltransplantation beruht auf dem Ersatz eines kranken blutbildenden Knochenmarks durch ein gesundes Spendersystem. Die häufigsten Indikationen sind akute Leukämien. Im Gegensatz zur autologen Transplantation, bei der im Anschluss an eine Hochdosischemotherapie eigene Zellen des Patienten zurückgegeben werden, werden bei der allogenen Transplantation Zellen einer anderen, in den Gewebemerkmalen mit dem Patienten übereinstimmenden Person gegeben. Das Abwehrsystem des Spenders spielt bei dem Erfolg der Transplantation eine wesentliche Rolle. Abwehrzellen des Spenders, insbesondere T-Zellen, erkennen die Leukämiezellen des Empfängers als fremd und tragen auf diese Weise zur Kontrolle über die Erkrankung bei. Andererseits können sie jedoch durch Reaktionen gegen gesunde Gewebezellen erhebliche Krankheitssymptome verursachen. Neben der medikamentösen Beseitigung des Empfängermarks müssen daher bei einer allogenen Stammzelltransplantation vorübergehend abwehrschwächende Medikamente eingesetzt werden.
Passende Spender für allogene Stammzelltransplantationen werden auf der Basis von Gewebemerkmalen, sog. Histokompatibilitätsantigenen (HLA), ausgesucht. Der ideale Spender ist i. d. R. ein HLA-identischer Geschwisterspender, der im Rahmen einer Familientypisierung identifiziert wird. Gibt es innerhalb der Kernfamilie keinen passenden Spender, wird nach einem Fremdspender gesucht. Die Wahrscheinlichkeit, für einen Patienten einen geeigneten Fremdspender zu identifizieren, liegt bei 50 – 80 %.
Ablauf der allogenen Stammzelltransplantation
Die Stammzellen des Spenders werden entweder durch eine Knochenmarkbiopsie aus dem Beckenkamm entnommen oder nach Gabe des Granulozytenwachstumsfaktors G-CSF aus dem Blut gesammelt. Vor Transplantation erhält der Patient eine Vorbehandlung, die sog. Konditionierung. Dabei wird das Knochenmark des Patienten mit einer Chemotherapie oder Ganzkörperbestrahlung zerstört. Mit weiteren Medikamenten wird das Abwehrsystem intensiv geschwächt, sodass die fremden Stammzellen nicht abgestoßen werden. Der Tag der Transplantation wird als „Tag 0“ bezeichnet ( ▶ Abb. 46.9).
Ablauf der allogenen Stammzelltransplantation.
Abb. 46.9
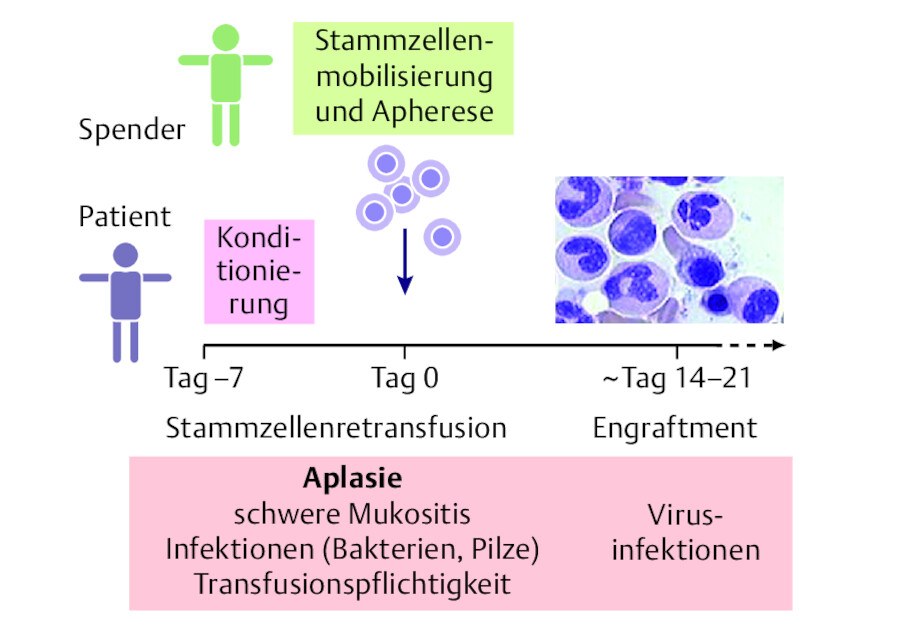
Engraftment Das Anwachsen der fremden Stammzellen im Empfängerknochenmark bezeichnet man als „Engraftment“. Dieses erkennt man 2 – 3 Wochen nach Transplantation an einem Anstieg der Leukozyten im Blut. In der Zwischenzeit ist der Patient erheblich infektgefährdet. Die Erythrozyten- und Thrombozytenbildung erholt sich häufig erst nach mehreren Wochen, sodass regelmäßig Blutprodukte transfundiert werden müssen.
Infektionsprophylaxe Um das Infektionsrisiko in der Phase der Aplasie zu senken, werden allogene Transplantationen in spezialisierten Zentren durchgeführt, in denen durch Luftfilterung der Räume eine Keimabschirmung des Patienten erreicht wird. Weitere Maßnahmen der Infektionsprophylaxe bestehen in keimarmer Kost, sterilem Umgang mit zentralvenösen Zugängen und konsequenter Mundpflege. Besondere Erfahrung des Pflege- und Ärzteteams mit diesen Patienten ist für einen komplikationsarmen Verlauf der Therapie von großer Bedeutung. Auch bei strikter Einhaltung aller Maßnahmen zur Infektionsvermeidung treten bei der Mehrzahl der Patienten in der Phase der Aplasie schwere, lebensbedrohliche Infektionen auf. Neben bakteriellen Infektionen ist der Patient in der Frühphase der Transplantation durch Infektionen mit Schimmelpilzen bedroht. Mehrere Monate besteht ein hohes Risiko für Virusinfektionen.
Transplantat-gegen-Empfänger-Reaktion Eine weitere Komplikation nach allogener Stammzelltransplantation ist die Transplantat-gegen-Empfänger-Reaktion („Graft-versus-Host-Disease“, GVHD). Dabei greifen Abwehrzellen des Spenders gesunde Gewebe des Empfängers an. In der akuten Phase bis Tag 100 nach Transplantation führt die GVHD üblicherweise zu Hautausschlägen, Symptomen des Magen-Darm-Trakts wie Übelkeit, Appetitlosigkeit, Erbrechen und Durchfall, oder Veränderungen der Leberfunktion. Um diese Probleme zu vermeiden, erhält der Patient abwehrschwächende Medikamente. Kommt es dennoch zu einer GVHD, können die Symptome oft durch weitere Medikamente beherrscht und zur Ausheilung gebracht werden. Allerdings sind auch tödliche Verläufe möglich, oder die Erkrankung geht in ein chronisches Stadium über.
Die chronische GVHD tritt erst mehrere Wochen nach Transplantation in Erscheinung. Es überwiegen Verhärtungen und narbige Veränderungen der Haut, Trockenheit der Schleimhäute, unzureichende Bildung von Tränenflüssigkeit sowie Gewichtsverlust durch Störungen der Aufnahme und Verarbeitung von Nahrungsmittelbestandteilen. Eine längerfristige abwehrschwächende Behandlung kann notwendig werden und geht dann wiederum mit einem hohen Risiko von Nebenwirkungen und Spätfolgen einher, z. B. Muskelschwäche, Osteoporose und schmerzhaften knöchernen Durchblutungsstörungen (Osteonekrosen), Magengeschwüren und Blutzuckererhöhung. Die Früherkennung von Spätfolgen nach allogener Stammzelltransplantation erfordert lebenslang regelmäßige ambulante Nachsorgeuntersuchungen.
46.3.3 Wirkung und Therapieerfolg
Die Prognose einer Tumorerkrankung ist abhängig von der Art des Tumors, seiner Ausdehnung und Metastasierung sowie von Alter und Vorerkrankungen des Patienten. Durch die Tumortherapie kann i. d. R. die Größe des Tumors reduziert werden (Teilremission), in vielen Fällen bis zum fehlenden Nachweis eines sichtbaren Tumors in bildgebenden oder mikroskopischen Untersuchungen (Vollremission). Häufig erweisen sich jedoch einige bösartige Zellen als resistent gegenüber der Therapie, verbleiben im Körper und führen im Verlauf zu Rückfällen (Rezidiven). Aufgrund ihrer Resistenz sind Rezidivtumoren häufig nicht mehr gut medikamentös zu beeinflussen und eine Heilung ist nur selten möglich.
46.4 Medizinischer Überblick über bösartige Erkrankungen des Blut- oder Lymphsystems
46.4.1 Leukämien
Leukämien entstehen durch bösartige Umwandlung einer unreifen Vorläuferzelle der Blutbildung im Knochenmark. Die genauen Ursachen der Leukämieentstehung sind nicht bekannt. Durch ungehemmtes Wachstum und fehlendes normales Absterben des leukämischen Zellklons kommt es zur Verdrängung der gesunden Blutbildung im Knochenmark und zur Ausschwemmung leukämischer Zellen im Blut. Diese Zellen setzen sich bei Zentrifugation des Blutes als weiße Schicht über den roten Blutkörperchen ab, was der Krankheit ihren Namen (Leukämie = „weißes Blut“) gegeben hat.
Die Diagnose wird durch Untersuchung einer Blut- und einer Knochenmarksprobe gestellt, die durch Punktion des vorderen oder hinteren Beckenkamms oder des Brustbeins aus dem Knochen gewonnen wird.
Abhängig von der Art der Ursprungszelle im Knochenmark, die sich bösartig verändert, unterscheidet man 4 Krankheitsbilder mit unterschiedlicher Altershäufung und Symptomatik ( ▶ Tab. 46.6 ).
|
Leukämieform |
Altershäufung |
häufige Symptome |
Therapie |
Prognose |
|
akute Formen |
||||
|
akute lymphoblastische Leukämie (ALL) |
|
|
|
Heilungschancen:
|
|
akute myeloische Leukämie (AML) |
|
|
|
Heilungschancen:
|
|
chronische Formen |
||||
|
chronische lymphatische Leukämie (CLL) |
|
|
|
|
|
chronische myeloische Leukämie (CML) |
|
|
|
|
Die Therapie der einzelnen Formen der Leukämien und auch ihre Prognose unterscheiden sich erheblich.
46.4.1.1 Akute Leukämien
Bei einer akuten Leukämie kommt es bereits wenige Wochen nach Vermehrung des leukämischen Zellklons zu schweren Krankheitssymptomen, die zur Diagnose führen. Die akute lymphoblastische Leukämie (ALL) entsteht aus einer unreifen Zelle des lymphatischen Systems, aus der sich im gesunden Organismus reife B- und T-Zellen entwickeln würden ( ▶ Abb. 46.10).
Einteilung der akuten Leukämien.
Abb. 46.10
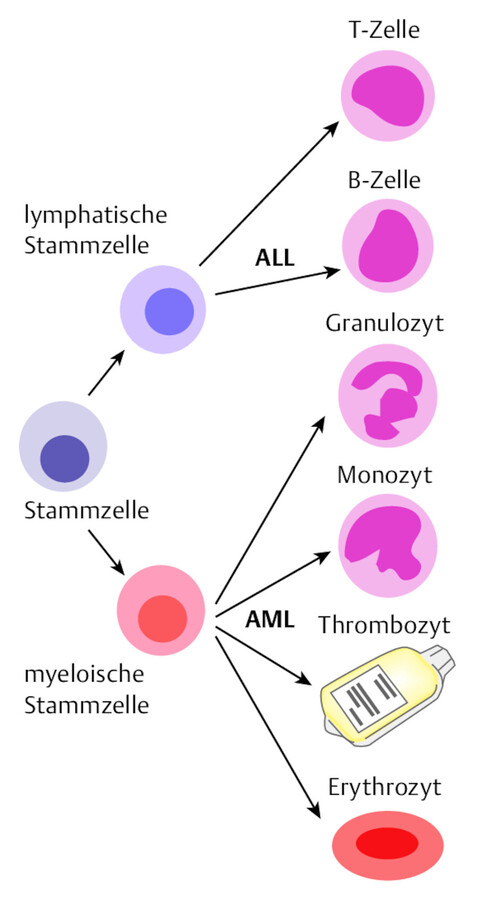
Bei akuten myeloischen Leukämien (AML) hingegen ist eine myeloische Stammzelle, die für die Bildung von Granulozyten, Monozyten, Thrombozyten und Erythrozyten verantwortlich ist, betroffen. Während im Kindesalter mit 80 % die ALL die häufigste Leukämieform darstellt, erkranken Erwachsene überwiegend (80 %) an der AML. Die Unterscheidung zwischen den beiden Formen erfolgt durch mikroskopische und molekulare Untersuchung der leukämischen Zellen, der sog. „Blasten“, in Blut und Knochenmark. Die Erfassung von Oberflächenmarkern auf den Leukämiezellen (Immunzytologie) hilft bei der Zuordnung zu einem der Subtypen.
Symptome
Vorherrschende Krankheitssymptome bei akuten Leukämien sind Folgen der Unterdrückung der normalen Blutbildung durch die Ausbreitung des bösartigen Zellklons im Knochenmark. Der Mangel an funktionsfähigen weißen Blutkörperchen geht mit einer erheblichen Anfälligkeit für fieberhafte Infekte einher, die unbehandelt einen schweren, auch tödlichen Verlauf nehmen können. Das Fehlen ausreichender Mengen roter Blutkörperchen (Anämie) führt zu Müdigkeit, Abgeschlagenheit, Kopfschmerzen und Schwindel. Eine Verringerung der Thrombozyten ist erkennbar an einer Blutungsneigung des Patienten mit Hämatomen und punktförmigen Blutungen sowie Schleimhautblutungen, z. B. Nasenbluten. Weitere Beschwerden sind durch die Infiltration von Organen bedingt. Vor allem bei lymphatischen Leukämien kann es zu Schwellungen der Lymphknoten kommen. Bei beiden Formen können Hautinfiltrationen und Milz- und Lebervergrößerungen auftreten. Eine Beteiligung des zentralen Nervensystems kann zu Sehstörungen und Krampfanfällen führen, bleibt jedoch meist ohne Symptome.
Therapie
Die Therapie besteht in einer Polychemotherapie über einen Zeitraum von 6 Monaten bis 2 Jahren. Die Art und Kombination der verwendeten Medikamente unterscheidet sich zwischen der myeloischen und der lymphatischen Form und zwischen Kindes- und Erwachsenenalter und orientiert sich eng an nationalen und internationalen Standards. Sie sollte immer an einem spezialisierten Zentrum erfolgen. Durch den Zerfall einer großen Anzahl Leukämiezellen bei Therapiebeginn kann es durch freiwerdende Blutsalze und Harnsäure zu Elektrolytstörungen und einem Nierenversagen kommen. Wichtig sind daher eine ausreichende Hydrierung des Patienten und engmaschige Kontrollen der Blutwerte. Über den gesamten Zeitraum der Therapie sind die Patienten durch die schädigende Wirkung der Zytostatika auf die normale Blutbildung erheblich infektgefährdet; ▶ s. Fallbeispiel.
Ziel der Therapie ist zunächst das Erreichen einer vollständigen Remission, bei der keine Leukämiezellen mehr im Knochenmark nachweisbar sind. Die Fortführung der intensiven Chemotherapie dient anschließend zur Erhaltung der Remission und langfristigen Vermeidung von Rezidiven. Für manche Patienten bestehen die günstigsten Heilungschancen in einer allogenen Stammzelltransplantation, die nach Erreichen einer Remission durchgeführt wird.
Prognose
Die Heilungschancen liegen für die ALL im Kindesalter bei insgesamt 90 %, bei Erwachsenen bei 20 – 40 %. Bei einer AML überleben etwa 75 % der Kinder und 30 – 50 % der Erwachsenen.
46.4.1.2 Chronische lymphatische Leukämie (CLL)
Die CLL ist die häufigste Leukämieform. Sie tritt erst ab dem Erwachsenenalter mit zunehmender Häufigkeit ab dem 50. Lebensjahr auf, dabei erkranken doppelt so viele Männer wie Frauen. Die Ursache der Erkrankung ist unbekannt. Die bösartige Umwandlung eines reifen Lymphozyten führt zu einer Anhäufung pathologischer Zellen in Blut, Lymphknoten, Milz und Knochenmark. Da die bösartigen Zellen erheblich langsamer wachsen als die Blasten der akuten Leukämie, entwickeln sich die Symptome schleichend. Viele Patienten klagen über Müdigkeit, Leistungsminderung und Nachtschweiß. Im Verlauf kommt es immer zu Lymphknotenschwellungen. Häufig sind auch die Milz und in geringerem Maße die Leber vergrößert, was ein Druck- und Völlegefühl verursachen kann. Gelegentlich tritt die Erkrankung durch Hauterscheinungen wie knotige Hautausschläge oder hartnäckigen Juckreiz in Erscheinung. Später kommt es zu einer erheblichen Infektneigung des Patienten.
Diagnostik und Therapie
Die Diagnose wird über die mikroskopische Untersuchung einer Blut- und Knochenmarkprobe und die Bestimmung der Oberflächenmarker auf den Leukämiezellen gestellt. Die Erkrankung nimmt oft einen langjährigen Verlauf. Eine Behandlung wird erst begonnen, wenn relevante Krankheitssymptome auftreten, und besteht entweder in einer Immuno-Chemotherapie aus einem anti-CD20-Antikörper und chemotherapeutischen Substanzen oder bei Subgruppen in der Gabe von zielgerichteten Signaltransduktions-Inhibitoren, die in der Regel ambulant gegeben werden. Eine allogene Knochenmarktransplantation, mit der Heilungen erzielt werden können, kann bei mehrfach rezidivierten Patienten eingesetzt werden, kommt aber aufgrund des hohen Alters vieler Patienten und des hohen Risikos nur in Einzelfällen infrage.
Prognose
Die Überlebenszeiten sind sehr variabel bis hin zu mehr als einem Jahrzehnt. Oft sterben die Patienten an unbeherrschbaren Infektionen.
46.4.1.3 Chronische myeloische Leukämie (CML)
Bei der CML handelt es sich um eine Erkrankung einer Stammzelle der Blutbildung. Im Unterschied zur AML ist jedoch die Fähigkeit zur Differenzierung der Zelle in die verschiedenen Blutzellen erhalten, sodass es zu einer Vermehrung und Ausschwemmung aller Reifungsstufen der Blutbildung kommt. Bei > 95 % der Patienten findet sich in den bösartigen Zellen das sog. Philadelphia-Chromosom, das durch eine Genumlagerung (Translokation) zwischen 2 Chromosomen entsteht. Wahrscheinlich ist die Philadelphia-Translokation für das bösartige Verhalten der Zelle verantwortlich, der Auslöser dieser Genveränderung ist jedoch nicht bekannt.
Diagnostik und Verlauf
Die Erkrankung verläuft in Phasen. Im chronischen Stadium sind die Patienten entweder symptomfrei oder fallen durch verminderte Leistungsfähigkeit, Gewichtsverlust, Nachtschweiß oder eine Milzvergrößerung mit zunehmendem Druckgefühl im Oberbauch auf. Im Blut des Patienten lässt sich zu diesem Zeitpunkt die Diagnose durch eine Vermehrung der Leukozyten und den Nachweis üblicherweise nur im Knochenmark nachweisbarer Vorstufen der Blutbildung stellen. Durch molekulare Untersuchungen wird das Philadelphia-Chromosom nachgewiesen. Unbehandelt kommt es im Verlauf zu einer zunehmenden Leukozytenvermehrung bis hin zur sog. Blastenkrise, die einer akuten Leukämie ähnelt.
Therapie
Bis vor wenigen Jahren bestand die einzige Heilungschance in einer ▶ allogenen Stammzelltransplantation. Jetzt stehen zielgerichtete Medikamente zur Verfügung, die direkt in die durch die Genumlagerung ausgelösten krankhaften Signalwege der Zelle eingreifen, z. B. Imatinib oder Dasatinib. Bei den meisten Patienten normalisieren sich die Blutwerte unter der Behandlung mit Imatinib, sie haben unter der Langzeittherapie ein weitgehend unbeeinträchtigtes Leben. Allerdings kann es im Verlauf durch Resistenzentwicklung zu Rückfällen kommen. Wie hoch der Anteil von Patienten ist, die durch die neue Therapie und auch nach Absetzen des Medikaments langfristig geheilt werden können, ist noch nicht bekannt.
Prognose
Die mittlere Lebenserwartung von Patienten mit CML nähert sich unter der neuen zielgerichteten Therapie der normalen Lebenserwartung an.
46.4.2 Maligne Lymphome
Maligne Lymphome sind bösartige Erkrankungen des lymphatischen Systems, zu dem Lymphknoten, Milz, Thymusdrüse und Knochenmark gehören. Dabei unterscheidet man das Hodgkin-Lymphom von allen anderen Lymphomtypen, die unter dem Begriff „Non-Hodgkin-Lymphom“ zusammengefasst sind.
46.4.2.1 Hodgkin-Lymphom
Merkmal des Hodgkin-Lymphoms ist der mikroskopische Nachweis typischer Riesenzellen in der Gewebeprobe. Diese Zellen leiten sich aus entarteten B-Zellen ab. Das Hodgkin-Lymphom ist durch 2 Erkrankungsgipfel im Jugend- und jungen Erwachsenenalter sowie um das 60. Lebensjahr gekennzeichnet. Im Frühstadium ist das Hodgkin-Lymphom eine lokalisierte Lymphknotenerkrankung; im fortgeschrittenen Stadium kommt es zu einer Streuung in entfernte Lymphknoten, Knochenmark und nichtlymphatische Organe (Leber, Lunge). Die Ursachen sind weitgehend ungeklärt. Es wird vermutet, dass zumindest bei einem Teil der Fälle der Erreger des Pfeiffer’schen Drüsenfiebers, das Epstein-Barr-Virus, eine Rolle spielt.
Symptome
Die Patienten fallen meist durch schmerzlose Lymphknotenschwellung auf, die von Leistungsabfall, Müdigkeit und erhöhter Temperatur begleitet sein kann. Bei Auftreten von Fieber, Nachtschweiß und Gewichtsverlust spricht man von einer „B-Symptomatik“.
Diagnostik
Die Diagnose erfolgt durch eine Gewebeentnahme aus einem befallenen Lymphknoten. Die Ausdehnung der Erkrankung wird in bildgebenden Untersuchungen dargestellt. Neben Röntgenaufnahmen der Lunge, Ultraschalluntersuchungen der Bauchorgane und Lymphknoten spielt in der modernen Diagnostik die Positronen-Emissions-Tomografie (PET-CT) eine wichtige Rolle. Dabei wird eine radioaktive markierte Substanz verabreicht, die sich in Geweben mit erhöhtem Zuckerstoffwechsel anreichert. Hodgkin-Tumoren lassen sich mit dieser Substanz gut markieren, sodass sowohl Ausgangsbefund als auch Therapieansprechen beurteilt werden können.
Therapie und Prognose
Die Therapie erfolgt entsprechend standardisierten Therapieempfehlungen mit mehreren Blöcken einer intensiven Kombinationschemotherapie, häufig gefolgt von einer Tumorbestrahlung. Bei Rezidiven kommt eine Hochdosischemotherapie mit ▶ autologer Stammzellrückgabe zur Anwendung. Im Kindes- und Jugendalter und bei geringer Lymphomausdehnung werden Heilungsraten von über 90 % erzielt. Fortgeschrittene Stadien bei Erwachsenen lassen sich in über 70 % der Fälle langfristig heilen. Zu berücksichtigen sind gerade bei jungen Patienten die Spätfolgen der Strahlen- und Chemotherapie. So entwickeln sich insbesondere bei bestrahlten Patienten nicht selten im Verlauf Schilddrüsen- oder Mammakarzinome.
46.4.2.2 Non-Hodgkin-Lymphom
Non-Hodgkin-Lymphome nehmen ihren Ausgang von unreifen oder reifen Zellen des lymphatischen Systems. Es sind zahlreiche unterschiedliche Subtypen beschrieben, die unterteilt werden in:
-
langsam wachsende, sog. indolente Lymphome
-
aggressive Lymphome
Im Kindesalter treten fast ausschließlich aggressiv wachsende Lymphome auf. Die Entstehung von Lymphomen ist weitgehend ungeklärt. Patienten mit HIV-Infektion oder unter Behandlung mit abwehrschwächenden Medikamenten sind durch Non-Hodgkin-Lymphome besonders gefährdet.
Symptome
Die Patienten fallen häufig mit Lymphknotenschwellungen auf, daneben können Allgemeinsymptome wie Fieber, Nachtschweiß, Gewichtsabnahme und Abgeschlagenheit bestehen. Während sich bei indolenten Lymphomen die Symptome schleichend entwickeln, befallen aggressive Lymphome schon im Frühstadium verschiedene Organe und können durch ihre Raumforderung zu Abflussbehinderungen mit Atemnot, Pleuraergüssen oder Harn- und Stuhlentleerungsstörungen führen. Eine Beteiligung des Knochenmarks zeigt sich in Blutbildveränderungen und einer erhöhten Infektanfälligkeit.
Diagnostik
Die Diagnose wird durch eine Gewebeprobe aus einem befallenen Lymphknoten gestellt. In weiteren Untersuchungen müssen alle Manifestationen der Erkrankung erfasst werden.
Therapie und Prognose
Die Behandlung unterscheidet sich zwischen den Subtypen erheblich. Indolente Lymphome im lokalisierten Stadium werden bestrahlt. Bei einem generalisierten Stadium wird zunächst abgewartet, bis eine Zunahme der Symptomatik zu einer Therapie zwingt. Eine Heilung durch Chemotherapie ist nicht möglich, mit einer Einzelsubstanz oder einer Kombinationstherapie kann der Verlauf jedoch verlangsamt und die Lebensqualität des Patienten verbessert und über einen begrenzten Zeitraum erhalten werden.
Aggressive Lymphome werden mit einer intensiven Kombinationschemotherapie behandelt. Bei einigen Patienten erfolgt auch eine Hochdosistherapie. Durch diese Maßnahmen kann bei der Mehrzahl kindlicher und 50 % erwachsener Patienten eine Heilung erreicht werden.
Die Therapieergebnisse der Non-Hodgkin-Lymphome konnten durch den Einsatz des Anti-CD 20-Antikörpers Rituximab in Kombination mit der Chemotherapie und die Einführung der Hochdosistherapie mit autologem Stammzellersatz deutlich verbessert werden.
46.4.2.3 Multiples Myelom
Auch das Multiple Myelom ist eine Erkrankung des lymphatischen Systems. Es entsteht durch bösartige Veränderung reifer B-Zellen, sog. Plasmazellen, die in großer Menge Antikörper (Immunglobuline) produzieren. Die Ursache der Erkrankung ist unklar. Sie betrifft überwiegend ältere Menschen um das 60. Lebensjahr.
Symptome
Im Vordergrund des klinischen Krankheitsbildes stehen Knochenschmerzen durch die Infiltration mit Nestern aus bösartigen Plasmazellen. Neben der Wirbelsäule sind häufig Schädel, Becken, Oberschenkel- und Oberarmknochen betroffen. Durch herdförmigen Knochenabbau kommt es zu Osteolysen und Knochenbrüchen. Die Ausbreitung der bösartigen Zellen im Knochenmark führt zu Anämie und Infektanfälligkeit, häufig klagen die Patienten über Müdigkeit und Schwäche. Die Ausscheidung großer Mengen von Antikörperbestandteilen über die Niere führt im Verlauf bei der Hälfte der Patienten zu einer Niereninsuffizienz.
Diagnostik
Die Diagnose erfolgt durch Nachweis der pathologischen Plasmazellen im Knochenmark und/oder befallenen Gewebe. Im Blut und/oder im Urin des Patienten können die pathologischen Immunglobuline nachgewiesen werden. Eine Röntgenuntersuchung des gesamten knöchernen Skeletts zeigt die Ausdehnung der Erkrankung und bruchgefährdete Stellen.
Therapie und Prognose
Eine Heilung ist nicht möglich. Durch eine Chemotherapie kann eine vorübergehende Remission mit klinischer Besserung erreicht werden. Eine Hochdosischemotherapie mit nachfolgender autologer Stammzelltransplantation kann zu einer deutlichen Lebensverlängerung führen. Medikamente, die den Knochenabbau hemmen, tragen erheblich zur Kontrolle der Symptome bei und verringern den Bedarf an Schmerzmedikamenten. Neue biologische Medikamente mit unterschiedlichen Angriffspunkten in der Biologie der Myelomzelle oder der umgebenden Knochenmarkstromazelle können die Überlebenszeit der Patienten deutlich verbessern und werden zunehmend als Standardtherapie eingesetzt. Lokale Knochenabbauherde können mit einer Bestrahlung stabilisiert werden, auch eine operative Fixierung kann sinnvoll sein. Um einen Patienten mit einem Multiplen Myelom sachgerecht zu behandeln, ist eine besonders gute interdisziplinäre Zusammenarbeit notwendig. Die mittleren Überlebenszeiten schwanken zwischen wenigen Monaten und mehreren Jahren.
46.5 Pflege- und Behandlungsplan von Patienten mit Leukämien, malignen Lymphomen und multiplen Myelomen
Die verschiedenen zur Therapie eingesetzten Zytostatika und die Strahlentherapie können eine Vielzahl unerwünschter Nebenwirkungen hervorrufen. Das Auftreten und die Ausprägung der Nebenwirkungen hängen von den jeweiligen Zytostatika, ihrer Dosierung sowie von der Dauer der Verabreichung ab. Außerdem spielen die individuelle Verträglichkeit und der Allgemeinzustand des Patienten eine ganz entscheidende Rolle.
Nebenwirkungen der Therapie Zu den häufigsten ▶ Nebenwirkungen, die während der ▶ Therapie auftreten können, zählen:
-
Übelkeit und Erbrechen (Nausea und Emesis)
-
Haarausfall (Alopezie)
-
Mund- und Schleimhautveränderungen (Mukositis)
-
Blutbildveränderungen (Knochenmarkdepression)
-
Ernährungsstörungen
Die genannten Nebenwirkungen können von Patient zu Patient und je nach Chemotherapie und Bestrahlung sehr unterschiedlich ausgeprägt sein.
46.5.1 Therapieinduzierte Übelkeit und Erbrechen
Definition
Übelkeit (Nausea) ist eine subjektive Empfindung von Unwohlsein in Rachen- und/oder Magengegend mit der Neigung zum Erbrechen. Nausea kann mit kaltschweißiger Haut, verstärktem Speichelfluss, Blässe, Tachykardie und evtl. Würgen einhergehen.
Erbrechen (lat. vomitus, griech. emesis) bezeichnet den kräftigen Ausstoß von Mageninhalt aus dem Mund.
Appetitlosigkeit (Anorexie, Inappetenz) ist die Herabsetzung des Triebs zur Nahrungsaufnahme.
Beim ANE-Syndrom (Anorexia-Nausea-Emesis) treten alle drei Symptome zusammen auf.
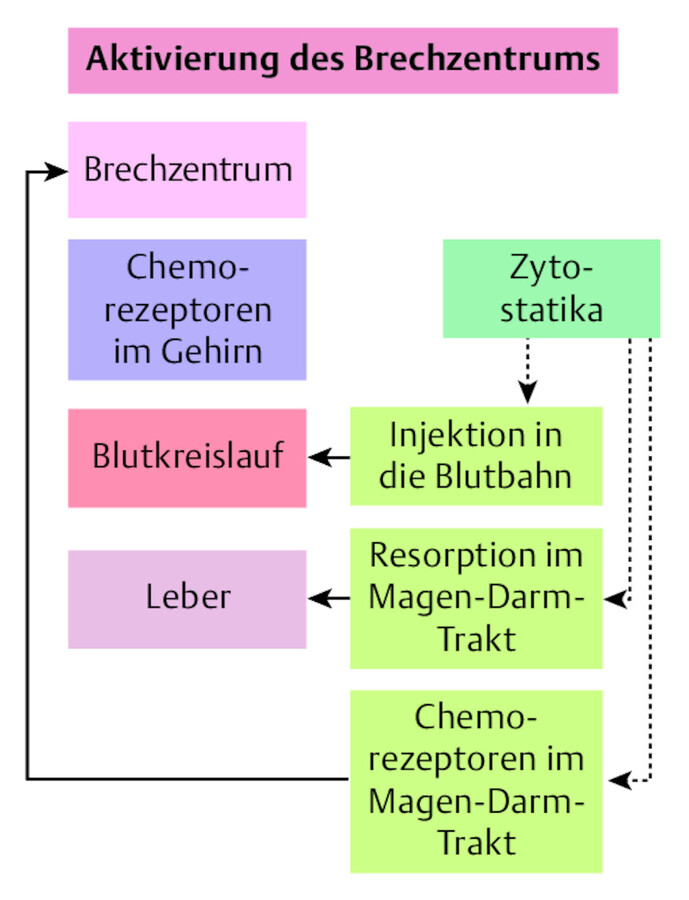
Das Erbrechen ist ein Zusammenspiel einer ganzen Reihe von Organen, Muskeln und Nerven. Im Gehirn befindet sich das Brechzentrum (Medulla oblongata), das den Brechvorgang koordiniert. Messfühler im Magen-Darm-Trakt und im Gehirn (Chemorezeptoren) registrieren, wenn ein Giftstoff in den Körper gelangt ist. Sie senden Botenstoffe (Neurotransmitter) aus, die dem Brechzentrum dann den Befehl zum Erbrechen übermitteln ( ▶ Abb. 46.11).
Aktivierung des Brechzentrums.
Abb. 46.11
Merke
Erbrechen ist eigentlich ein natürlicher Schutzmechanismus des Körpers. Durch Erbrechen kann der Körper Giftstoffe, die in den Magen gelangt sind, schnell wieder loswerden.
46.5.1.1 Chemotherapieinduzierte Übelkeit und Erbrechen
Bei der Behandlung mit Zytostatika treten Übelkeit und Erbrechen häufig gemeinsam auf. Es ist allerdings auch möglich, dass Erbrechen ohne Übelkeit und Übelkeit ohne Erbrechen auftritt. Länger anhaltende Übelkeit und Erbrechen können Folgen haben, die schlimmstenfalls so gravierend sind, dass Therapien sowohl von Patienten als auch von den behandelnden Ärzten abgebrochen werden müssen. Dazu können gehören:
-
Flüssigkeitsverlust und Dehydratation
-
Elektrolytverschiebungen (K+, Cl-)
-
Appetitlosigkeit und Gewichtsverlust
-
Aspirationspneumonie
-
Verletzung des Gastrointestinaltrakts (Mallory-Weiss-Syndrom)
-
Schwäche
-
verlängerter Krankenhausaufenthalt
-
soziale Isolation
-
eingeschränkte Lebensqualität
Formen des Erbrechens Beim chemotherapiebedingten Erbrechen laufen verschiedene Vorgänge zu unterschiedlichen Zeiten ab. Hierbei spielen je nach Zeitpunkt unterschiedliche Neurotransmitter eine tragende Rolle. Man unterscheidet daher bei Tumorpatienten verschiedene Formen des Erbrechens:
-
akutes Erbrechen: innerhalb der ersten 24 Std. nach der Chemotherapie
-
verzögertes Erbrechen: später als 24 Std. (meist nach 2 – 4 Tagen) nach der Chemotherapie
-
antizipatorisches Erbrechen: psychisch bedingtes, erlerntes Erbrechen, welches erst nach einer 1. Therapie auftritt (Auslöser sind bestimmte Situationen, die an die letzte Therapie erinnern)
Einflussfaktoren Ob und wann bei einer Chemotherapie Übelkeit und Erbrechen auftreten, ist von verschiedenen Faktoren abhängig:
-
Zytostatikum (hohes emetogenes Potenzial > 90 % bis minimal emetogenes Potenzial < 10 %)
-
Kombinationschemotherapie (mehrere Zytostatika verstärken das Emesis-Risiko)
-
Dosis und Häufigkeit
-
Art und Applikationsgeschwindigkeit der Verabreichung
Prädisponierende Faktoren sind:
-
Frauen, junge Menschen < 50 Jahre und alte Menschen neigen eher zu Erbrechen als Männer.
-
Alkoholkonsum in der Vorgeschichte
-
Vorerfahrung mit einer früheren Chemotherapie, Schwangerschaftsübelkeit
-
Angst („Mir wird schlecht vor Angst“)
-
innere Abwehrhaltung
-
genetische Neigung zu Übelkeit und Erbrechen
46.5.1.2 Radiotherapieinduzierte Übelkeit und Erbrechen
Im Allgemeinen beeinträchtigen Übelkeit und Erbrechen unter Strahlentherapie das Befinden der Betroffenen weniger stark als unter Chemotherapie. Allerdings kann die Übelkeit länger anhalten, wenn Bestrahlungen fraktioniert über einen längeren Zeitraum (über 30 und mehr Behandlungstage) durchgeführt werden. Durch die Bestrahlungsdauer kann es aber auch zu einer sog. „Gewöhnung“ kommen, d. h., dass die Übelkeit nach ca. 10 – 15 Bestrahlungen bei vielen Patienten wieder abnimmt. Vorhergehende Chemotherapien und chirurgische Eingriffe am Gastrointestinaltrakt wirken sich allerdings oft verstärkend aus.
Die akute Form von Übelkeit und Erbrechen ist typisch bei Radiotherapie, die antizipatorische Form kommt nur selten vor. Das emetogene Potenzial ist abhängig von
-
Bestrahlungsort (z. B. Oberbauch oder Beckenregion, ▶ Tab. 46.7 ),
-
bestrahltem Volumen,
-
Fraktionierung,
-
Einzel- und Gesamtdosis,
-
im Bestrahlungsfeld liegenden Organen und
-
individuellen Risikofaktoren der Patienten (s. oben).
|
Hoch |
mittel |
gering |
|
|
|
Merke
Je größer die Strahlendosis und das Volumen des bestrahlten Gewebes sind, desto größer ist das Risiko, Übelkeit und Erbrechen zu entwickeln.
46.5.1.3 Pflegerische Interventionen
Die Pflegenden nehmen eine wichtige Rolle im Umgang mit therapieinduzierter Übelkeit und Erbrechen ein. Sie informieren über Zusammenhänge, Ursachen, Behandlungsmöglichkeiten und Umgang mit Übelkeit und Erbrechen und reduzieren so Verunsicherungen und Ängste der Betroffenen. Wichtig ist hierbei, dass sie das Auftreten von Nausea und Emesis realistisch darstellen.
Die Pflegeanamnese ist ein hilfreiches Instrument, frühzeitig zu erfassen, ob Übelkeit und Erbrechen zu erwarten sind und welche Lebensgewohnheiten der Patient hat.
Häusliche Pflege im Fokus
In welcher sozialen Situation sich der ambulante Patient befindet, ist für das Auftreten von Erbrechen nach einer Chemotherapie von entscheidender Bedeutung, da der Betroffene auf die Hilfestellung und Begleitung seiner Angehörigen zu Hause angewiesen ist. Daher ist es besonders wichtig, nicht nur die Patienten, sondern auch die Angehörigen über die Möglichkeiten der Pflegeinterventionen zur Symptomlinderung bei Übelkeit und Erbrechen mit einzubeziehen.
Neben der vorbeugenden und rechtzeitigen Verabreichung von verordneten Medikamenten können Pflegende mit folgenden Maßnahmen zur Stabilisierung des Wohlbefindens beitragen.
Unterstützung und Fördern des allgemeinen Wohlbefindens
Unterstützende und fördernde Maßnahmen sind:
-
für eine bequeme Position sorgen
-
Ruhebedürfnis berücksichtigen
-
frische Luft ermöglichen
-
Wärme vermeiden
-
Atmosphäre im Zimmer gestalten (Licht, Gerüche, Intimsphäre)
-
für eine ruhige entspannte Umgebung sorgen
-
Hilfsmittel für die Sicherheit in Reichweite stellen (Nierenschale, Zellstoff, Wasser usw.)
-
bei Auftreten eines metallischen/sauren Geschmacks bei Chemotherapie Pastillen mit starkem Geschmack anbieten (Eukalyptus)
-
nach ambulanter Therapie ggf. nötige Maßnahmen absprechen
-
Eiswürfel zum Lutschen anbieten
-
Gerüche der Pflegenden vermindern (rauchende Pflegende, aufdringliches Parfüm, Schweißgeruch)
-
wärmende Fußbäder (Rosmarin eher morgens, Lavendel eher abends)
-
feuchtwarme Kompresse (evtl. mit Kamillentee) auf den Oberbauch legen
-
bei zusätzlichen Bauchkrämpfen: Gänsefingerkrautkissen oder warmes Kirschkernsäckchen (Vorsicht, Verbrennungsgefahr!)
-
wärmende Fuß-/Beineinreibungen
Unterstützende Maßnahmen bei Erbrechen
Der Patient wird beim Erbrechen unterstützt:
-
den Patienten während des Erbrechens nicht allein lassen
-
den Patienten bei Übelkeit aufrecht sitzen lassen
-
frische Luft, kühle Kompressen, kühle Getränke anbieten
-
bei Würgen/Erbrechen das Zimmer auf Quellen unangenehmer Düfte kontrollieren (Essen, Parfüm u. a.)
-
Hilfsmittel (Schale, Beutel, Tücher) in Reichweite stellen
-
auf angenehme Raumtemperatur achten
-
Lärm vermeiden
-
Patienten gegen Mitpatienten abschirmen
-
Tür schließen
-
evtl. Zahnprothesen entfernen
-
ggf. Magenablaufsonde legen
-
Erbrochenes sofort entsorgen
-
Mundspülungen anbieten
-
ggf. Wäschewechsel und lüften
-
nach Erbrechen den Patienten Hände und Gesicht erfrischen lassen
Empfehlungen zur Ernährung
Bei Übelkeit und Erbrechen helfen folgende Maßnahmen:
-
Wunschkost, wenn möglich (Diätassistentin einbeziehen)
-
nur essen, wenn man Lust hat
-
kleine Mahlzeiten anbieten
-
kalte Speisen werden besser toleriert
-
Kartoffeln, Knäckebrot, Toast werden besser vertragen
-
stark riechendes Essen meiden
-
süße, fette, stark gesalzene/gebratene Speisen meiden
-
Appetit mit sauren Speisen oder sauren Bonbons anregen
-
gekühlte Getränke anbieten (Cola, Tee, Limonade)
-
sprudelnde kalte Getränke, z. B. Gingerale (Ingwer hat eine positive Wirkung) empfehlen
-
Tee von Ingwer oder Pfefferminze oder Pfefferminzblätter und Kamillenblüten zu gleichen Teilen gemischt anbieten
-
einen kleinen Schluck Zitronensaft anbieten
-
Essen erst servieren, wenn der Patient es wünscht
-
kein Lieblingsessen während der Therapieübelkeit (Konditionierung) mitbringen lassen
-
Essen in entspannter Atmosphäre und evtl. in Gesellschaft ermöglichen
-
langsam essen und gründlich kauen lassen
-
Mahlzeiten nicht im Zimmer stehen lassen
Unterstützende und komplementäre Maßnahmen
Bei Übelkeit und Erbrechen helfen folgende Maßnahmen:
-
Ablenkung durch Musik, Lesen oder Fernsehen
-
Aromatherapie (Pfefferminze, Ingwer, Kardamom, Patchouli, krause Minze)
-
Entspannungstechniken anbieten und einüben:
-
entspannende Atemtechniken
-
Progressive Muskelentspannung (nach Jacobson)
-
gelenkte Imaginationen
-
Maltherapie
-
Autogenes Training
-
Phantasiereisen
-
Massage
-
-
Anleitung zur Akupressur:
-
Akupressurpunkt „P6“ (Neiguan-Punkt) liegt 3 Fingerbreit von der Handgelenkfalte armaufwärts, zwischen 2 gut spürbaren Sehnen
-
der Abstand sollte mit den Fingern des Betroffenen gemessen werden
-
Betroffene können nach Anleitung selbst die Akupressur durchführen, dies erhöht die Selbstwirksamkeit
-
Akupressur kann bei Bedarf mehrmals täglich durchgeführt werden, auch z.B. über spezielle Akupressurbänder (gleiches Wirkungsprinzip)
-
-
Ingwer:
-
Inhaltsstoffe wirken direkt auf den Verdauungstrakt und entspannen dort die glatte Muskulatur, wirken durchblutungsfördernd, erhöhen die Stoffwechselaktivität; dadurch lösen sich Verspannungen und Krämpfe.
-
übliche Tagesdosis: 1–2g Zintona®, Verabreichung nach initialer Dosis in 4-stündlichen Intervallen; das in den Kapseln enthaltene Pulver kann auch in Getränke eingerührt werden
-
Merke
Eine sorgfältige Anamnese, eine physische Untersuchung und ein Gespräch mit dem Patienten müssen vor der Aromatherapie erfolgen. Den Patienten immer einen Geruchstest machen lassen. Ätherische Öle unbedingt selbst vorher austesten.
46.5.1.4 Medizinische Maßnahmen
Verschiedene Medikamente (Antiemetika) stehen zur Prophylaxe und Behandlung von chemotherapiebedingtem Erbrechen zur Verfügung. Antiemetika müssen prophylaktisch vor Beginn einer Chemotherapie verabreicht werden. Die antiemetische Therapie kommt zu spät, wenn der Patient bereits während der Zytostatikagabe Übelkeit verspürt oder direkt erbricht.
Merke
Es ist besonders wichtig, prophylaktisch vor Beginn der Chemotherapie Medikamente gegen Übelkeit und Erbrechen einzunehmen. Achten Sie auf mögliche Nebenwirkungen der Antiemetika, wie: leichte Kopfschmerzen, Obstipation, Blutzuckeranstieg, Magenbrennen, Schlafstörungen, Mundtrockenheit, Schwindel, Sehstörungen, Unruhe, Müdigkeit.
Folgende allgemeine Empfehlungen gelten bei antiemetischer Therapie:
-
Aufklärung des Patienten über unerwünschte Chemotherapiewirkungen
-
Hinweis auf die Möglichkeit der gestaffelten Antiemese (also ein eindeutiger Hinweis darauf, dass eine Steigerung der antiemetischen Therapie bei Bedarf möglich ist)
-
prophylaktische Gabe des Antiemetikums
-
ausreichende Dosierung der Antiemetika
-
individuelle Einstellung nach Stufenschema mit Kombination wirksamer Einzelsubstanzen ( ▶ Tab. 46.8 )
|
emetogenes Risiko |
Akuttherapie Tag 1 |
Anschlusstherapie p. o. Tag 2–3 |
|
hoch (> 90 %) (z. B. Cisplatin, Cyclophosphamid > 1500 mg/m2 |
5-HT 3-Antagonist (Setron) + 125 mg Aprepitant + 12 mg Dexamethason |
80 mg Aprepitant + 8 mg Dexamethason |
|
mäßig hoch (30–90 %) (z. B. Carboplatin, Antrazykline) |
5-HT 3-Antagonist (Setron) + Dexamethason, ggf. Aprepitant |
5-HT 3-Antagonist (Setron) oder Metoclopramid (MCP) + Dexamethason, ggf. Dexamethason allein |
|
mittel (10–30 %) (z. B. Gemcitabine, Methotrexat) |
5-HT 3-Antagonist (Setron) bzw. andere Antiemetika |
keine |
|
niedrig (< 10 %) (z. B. Vinorelbin) |
keine |
keine |
Merke
Die bestmögliche Prophylaxe gegen akutes und verzögertes Erbrechen ist die wirkungsvollste Maßnahme, um antizipatorisches Erbrechen zu verhindern. Denn Prophylaxe ist besser als Therapie (Multinational Association for Supportive Care in Cancer 2013).
Lebensphase Kind
Lars Wicher
Übelkeit und Erbrechen
Bei Kindern und Jugendlichen stellt die „Chemotherapie-induzierte Nausea (Übelkeit) und Emesis (Erbrechen) (CINV)“ eine besondere Herausforderung für das behandelnde Team dar.
Übelkeit
Je nach Altersgruppe sind die Patienten mehr oder weniger in der Lage, auftretende Übelkeit zu benennen und um Linderung zu bitten. Vor allem Säuglinge und Kleinkinder sind auf eine gute Krankenbeobachtung durch die Pflegenden angewiesen. Es obliegt dem Team, frühzeitige Anzeichen von Übelkeit zu erkennen und darauf adäquat zu reagieren. Neben den bereits bekannten Symptomen gehören die Verweigerung der Flaschennahrung und vermehrtes Würgen zu ersten Anzeichen einer Übelkeit.
Erbrechen
Neben der Übelkeit stellt das vermehrte Erbrechen mit den Gefahren eines hohen Flüssigkeitsverlustes und einer Dehydratation ein hohes Risiko dar. Der Flüssigkeitsbedarf ist abhängig von Alter und Körpergewicht des Patienten. Es gilt: Je jünger das Kind ist, desto größer ist der Flüssigkeitsbedarf und die Abgabe (Böhles 2012). In der Regel werden die kleinen Patienten während der stationären intravenösen Zytostatikaverabreichung zusätzlich über eine Begleitinfusion mit Flüssigkeit versorgt. Für die häusliche Versorgung werden die Eltern und die jugendlichen Patienten über die Wichtigkeit der Flüssigkeitsaufnahme aufgeklärt und erhalten Tipps für die Umsetzung zuhause. Hält das Erbrechen nachstationär weiter an und ist der Patient nicht in der Lage zu trinken, erfolgt die weitere Versorgung stationär.
Anhaltende Übelkeit
Nicht immer führt das Erbrechen zu einer anschließenden Linderung. Die Übelkeit kann vielmehr weiter andauern. Der Grund und die Ursachen für diese Form der Übelkeit sind noch nicht geklärt (Rinner 2012). Sie erschwert jedoch eine adäquate Versorgung der Kinder und Jugendlichen und kann schnell zu einer Form des antizipatorischen Erbrechens führen. Als Folge können sich bei den Kindern und Jugendlichen Ängste vor den Zytostasen entwickeln.
Nicht selten beginnt die Übelkeit bereits einen Tag vor der geplanten stationären Aufnahme. Sobald die Kinder und Jugendlichen die Station betreten kann sich die Übelkeit verstärken und es kommt zum Erbrechen. Die Adhärenz sinkt und erschwert ein Fortsetzen der Behandlung. Die Ängste können so stark ausgeprägt sein, dass vorübergehend ein Benzodiazepin (z.B. Tavor) gegeben werden muss, um die Ängste zu lindern und die Belastung für die Patienten und die Eltern zu mindern.
Antiemetische Prophylaxe
Um die Belastung für die Kinder so gering wie möglich zu halten, ist eine antiemetische Prophylaxe bereits zu Beginn der Therapie besonders wichtig.
Zum Vorgehen existieren Leitlinien zur medikamentösen Behandlung einer CINV oder einer Radiotherapie-induzierten Nausea (Übelkeit) und Emesis (Erbrechen) (RINV). Jedoch gibt es bis heute aufgrund der geringen Datenmenge nur wenige Empfehlungen für eine zuverlässige und wirksame Kombination unterschiedlicher Präparate bei Kindern (Phillips et al. 2016). Nicht jedes Medikament ist für jede Altersgruppe zugelassen. So ist z.B. laut Herstellerangaben der NK-1-Rezeptor-Antagonist Aprepitant (Emend) erst für Kinder ab 12 Jahren zugelassen (msd 2016).
Applikationsformen von Medikamenten
Mittlerweile gibt es unterschiedliche Applikationsformen von Medikamenten:
-
Tabletten
-
Schmelztabletten
-
Lösungen und Säfte
-
Zäpfchen
Diese erleichtern die ohnehin oft schwere orale Gabe von Medikamenten und entlasten sowohl das Kind als auch seine Eltern.
Eine orale Applikation bei Säuglingen wird nicht über die Nahrung vorgenommen. Das Medikament wird auf einem kleinen Löffel mit etwas Tee vermischt und dann verabreicht. Eine Umstellung oraler Gaben auf eine intravenöse Verabreichung oder die Gabe von Zäpfchen bei Säuglingen und Kleinkindern erleichtert die Gabe einer festen und bedarfsorientierten antiemetischen Medikation (Rinner 2012).
Ergänzende Angebote
Eine nicht-medikamentöse Versorgung wird von den Pflegenden gemeinsam mit dem Patienten und den Eltern besprochen. Sie erfolgt altersentsprechend und ist an den Bedürfnissen des Patienten auszurichten. Viele kinderonkologische Stationen verfügen über die Möglichkeit, den Kindern und Jugendlichen folgende Angebote zu machen, die über Drittmittel finanziert werden:
-
Musik- und Kunsttherapie,
-
Bewegungsübungen durch Sporttherapeuten z.B. mit einer Nintendo Wii-Konsole,
-
„Fruchtalarm“, einmal in der Woche können die Patienten selber alkoholfrei Fruchtcocktails mischen
-
Auszeit, einmal in der Woche basteln und spielen Studenten mit den Patienten und ermöglichen den Eltern somit eine Pause.
Über diese Angebote gelingt es, die pädiatrischen Patienten von ihrer Übelkeit abzulenken und für einen Augenblick die Lebensqualität zu steigern.
46.5.2 Therapiebedingter Haarausfall (Alopezie)
Der Haarausfall ist eine häufige Nebenwirkung der medikamentösen Tumortherapie und seltener der Strahlentherapie. Die Betroffenen gehen ganz unterschiedlich mit dem plötzlichen Haarverlust um. Manche akzeptieren den Haarverlust als unabänderliche Nebenwirkung der Chemotherapie, andere wiederum haben große Probleme mit der Veränderung ihres Körperbildes. Die Tumorerkrankung wird plötzlich für alle öffentlich gemacht. Der Betroffene fühlt sich als Krebskranker gezeichnet und ist damit allen Vorurteilen der Gesellschaft gegenüber einer Krebserkrankung ausgesetzt.
Durch die fehlende Spezifität der Zytostatika für die bösartigen Zellen sind v. a. Zellen mit hoher Zellteilungsrate (Proliferationsrate) wie Schleimhaut-, Blut-, Haar- und Keimzellen betroffen. Die Strahlentherapie verursacht hierbei ähnliche Schäden wie die zytostatische Behandlung.
Da sich 85 % der Haare in der Wachstumsphase befinden und die Teilungsaktivität der Keimzellen in dieser Phase sehr hoch ist, sind sie sehr anfällig für die Schädigungen durch Zytostatika. Es gibt Zytostatika, die immer Haarausfall bewirken, und welche, die keinen Haarausfall auslösen. In der Regel ist der Haarausfall bei Zytostatikagabe reversibel. Anders verhält es sich bei der Strahlentherapie. Hohe Strahlendosen, z. B. bei Schädelbestrahlungen, schädigen die Zellen z. T. irreversibel.
Schweregrad Der Schweregrad der Alopezie ist von vielen Faktoren abhängig:
-
Art des Zytostatikums
-
Dosierung des Zytostatikums
-
Therapieplan und Applikationsart
-
Kombination der Zytostatika
-
verabreichter Strahlendosis
-
Art der Strahlentherapie
-
Empfindlichkeit der bestrahlten Kopfhaut
-
patientenbezogenen Faktoren:
-
Ältere Menschen neigen eher zu Haarausfall.
-
schlechter Allgemein-/Ernährungszustand
-
Menschen mit schütterem Haarwuchs oder dünnem Haar leiden eher unter Haarausfall.
-
Dauergewelltes, gefärbtes und strapaziertes Haar begünstigt Haarausfall.
-
individuelle Verträglichkeit
-
Merke
Bei hoch dosierter Kopfbestrahlung (z. B. Hirntumoren) werden die Haarfollikel möglicherweise irreversibel geschädigt, d. h., es erfolgt kein Haarwachstum mehr.
46.5.2.1 Pflegerische Maßnahmen
Pflegende und Ärzte müssen die Patienten frühzeitig darüber informieren, ob bei der bevorstehenden Therapie ein Haarausfall zu erwarten ist. Es ist wichtig, dass der Betroffene genügend Zeit hat, sich auf die körperliche Veränderung einzustellen, und die Möglichkeit bekommt, sich frühzeitig um einen Haarersatz zu kümmern. Die Pflegenden geben den Patienten vor und während der Therapie in einem Informationsgespräch ausführliche Informationen über:
-
prognostizierte Reversibilität
-
chronologischen Ablauf des Haarausfalls:
-
Haarverlust setzt meist 10 – 28 Tage nach Verabreichung der ersten Chemotherapiedosis ein.
-
Erneutes Haarwachstum kann schon unter fortgesetzter Therapie erfolgen, i. A. ca. 2 – 4 Wochen nach Abschluss der Chemotherapie.
-
Der Patient kann von diesem Zeitpunkt an damit rechnen, nach ca. 3 Monaten ohne Perücke auszukommen.
-
Nach niedriger Bestrahlung beginnt das Haarwachstum ca. 6 Monate nach Bestrahlungsende.
-
Nach hoch dosierter Bestrahlung können die Haarfollikel irreversibel geschädigt sein (Arzt muss diese Information geben).
-
-
Abhängigkeit des Schweregrades der Alopezie von Medikament, Dosierung, Applikationsart
Sie informieren den Patienten darüber,
-
dass das Haar langsam oder büschelweise ausfallen kann,
-
dass alle Körperhaare betroffen sein können,
-
dass sich das neu gewachsene Haar oft in Farbe und Beschaffenheit unterscheidet.
Sie empfehlen dem Patienten,
-
sich einen pflegeleichten Haarschnitt schneiden zu lassen,
-
frühzeitig eine Perücke zu beantragen (Rezept vom Arzt ausstellen lassen, Frisör informieren, Kontakt zur Krankenkasse)
-
sich auf andere Kopfbedeckungen einzustellen (HAD-Tücher, Capies, Kopftücher u. a.),
-
nasses Haar trocken zu tupfen, nicht zu föhnen,
-
milde Shampoos und weiche Haarbürsten zu benutzen,
-
Dauerwellen und Haarefärben zu vermeiden,
-
Kopfhaut vor Kälte, Hitze und direkter Sonnenbestrahlung zu schützen,
-
Kopfhaut bei Bestrahlung geschmeidig zu halten (Hailo F, Bepanthen Augen- und Nasensalbe),
-
Sonnenbrille bei Verlust von Augenwimpern zu tragen (Schutz vor intensivem Licht und Staub),
-
kosmetische Möglichkeiten zu nutzen (Kosmetikseminare der DKMS-Life).
46.5.3 Therapiebedingte Mund- und Schleimhautveränderungen (Mukositis)
Die Epithelzellen der Schleimhäute gehören zu den Geweben, die permanent eine hohe Teilungsrate aufweisen. Physiologisch erneuert sich die Mukosa alle 10 – 14 Tage. Eine funktionierende Schleimhaut bietet einen effektiven Schutz gegenüber Bakterien, Viren und Pilzen. Bei einer Schleimhautschädigung kann die Funktionalität der Mukosa stark beeinträchtigt sein, sodass die Lebensqualität des Patienten deutlich eingeschränkt ist.
Anatomie und Physiologie im Fokus
(nach Schwegler u. Lucius 2016)
Funktionen der Mukosa (Schleimhaut) sind:
-
Sekretion von Schleim, Speichel zur Befeuchtung, Enzyme in Mundhöhle und Magen
-
Resorption von Nährstoffen, Wasser in Dünndarm und Dickdarm
-
Schutz vor mechanischer Abnutzung in der Mundhöhle
-
Schutz vor chemischer Schädigung im Magen (HCl)
-
Transport des Kanalinhalts
Einige Zytostatika hemmen bereits nach 2 – 7 Tagen durch direkte Schädigung der Basalzellen die Regeneration und führen zu den typischen Charakteristika einer Entzündung, der sog. Mukositis (lat. mucus = Schleim). Die Schleimhaut wird dünn und verletzungsanfällig. Die Schädigung der Schleimhäute in Mund, Rachen, Speiseröhre, Magen und Darm kann zu starken und schmerzhaften Beeinträchtigungen führen. In schweren Fällen kann die Nahrungsaufnahme unmöglich werden, sodass Patienten parenteral ernährt werden müssen.
Eine Schleimhautschädigung stellt eine besondere Gefährdung für den Patienten dar. Bakterien und Viren können ungehindert in den Körper eindringen und lebensbedrohliche Infektionen auslösen. Sekretions- und Resorptionsstörungen führen zu Mundtrockenheit, schmerzhaften Einrissen der Mukosa und zu Nährstoff- und Wasserverlusten. Diarrhöen sind häufig die Folge einer Schleimhautschädigung.
46.5.3.1 Stomatitis
Die oralen Schleimhautveränderungen
-
erschweren die Nahrungs- und Flüssigkeitsaufnahme,
-
fördern die Appetitlosigkeit durch Geschmacksveränderungen und Schmerzen,
-
reduzieren den Speiseplan auf wenige Nahrungsmittel und
-
erschweren das Sprechen und führen zum sozialen Rückzug der Betroffenen.
Die Lebensqualität des Patienten ist häufig derart eingeschränkt, dass es schwierig sein kann, die Chemotherapie weiter durchzuführen. Die Stomatitis belastet auch die Angehörigen, wenn diese zusehen, wie der Patient leiden muss, und sie selber nichts für den Kranken tun können.
Symptome Die möglichen Symptome, die bei einer Stomatitis auftreten können, sind:
-
Rötung, Beläge
-
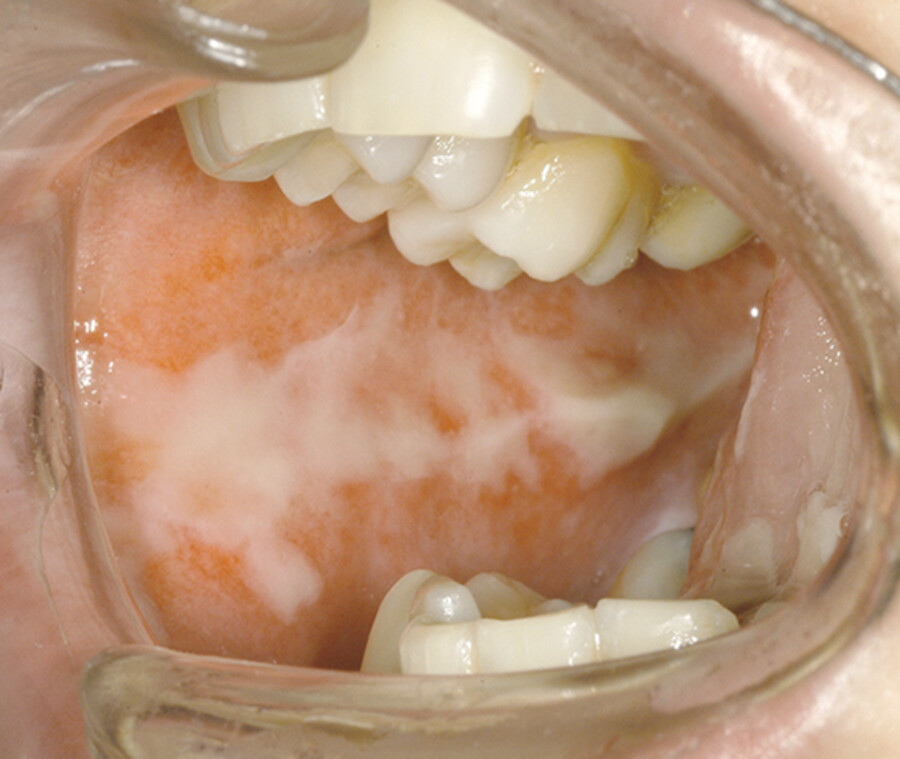
Aphthen (hirsekorngroße, vereinzelte, grauweißliche, schmerzhafte geplatzte Bläschen, in allen Teilen des Mundes, ▶ Abb. 46.12)
Schwere orale Mukositis.
Abb. 46.12
-
Schwellungen
-
Rhagaden (schmerzhafte Einrisse an den Mundwinkeln)
-
Geschmacksveränderungen
-
Schluckstörungen
-
leichte bis starke Schmerzen
-
Ulzerationen
-
Mundtrockenheit (Xerostomie)
-
Lippenbläschen, Zahnfleischbluten
Die World Health Organization (WHO) unterscheidet bei der oralen Mukositis 5 Schweregrade:
-
Grad 0: keine Symptome
-
Grad 1: Rötungen, Wundsein, keine Ulzera
-
Grad 2: Rötungen, Erosionen, kleine Ulzera, feste Speisen möglich
-
Grad 3: Rötungen, Ulzerationen, Flüssignahrung erforderlich
-
Grad 4: Stomatitis ist so ausgeprägt, dass eine parenterale Ernährung erforderlich ist
Chemotherapieinduzierte Stomatitis Sie verläuft meist bilateral und betrifft die Mukosa des weichen Gaumens und der Wangen, die Zunge und den Mundboden. Sie tritt häufig am 7. – 10. Tag nach Beginn der Therapie deutlich auf. Die Heilung nimmt je nach Schwere der Mukosadestruktion und Anstieg der Neutrophilenzahl 7 – 14 Tage in Anspruch.
Strahlentherapieinduzierte Stomatitis Bei Kopf-Hals-Bestrahlungen ist fast immer mit einer Stomatitis zu rechnen. Die radiotherapieinduzierte Mukositis ist hierbei meist auf das bestrahlte Feld begrenzt ( ▶ Abb. 46.13).
Individuelle Maske mit eingezeichneten Bestrahlungsfeldern.
Abb. 46.13

Die Schleimhautentzündung tritt i. d. R. 2 – 3 Wochen nach Bestrahlungsbeginn auf und hat bei konventioneller Therapie ihren Gipfel in der 5. – 6. Woche. Die Therapiefolgen der Bestrahlung können vorübergehende Reaktionen wie Stomatitis und Mundtrockenheit, aber auch Spätfolgen wie Stenosen, Zahnverlust, Kariesanfälligkeit und eine bleibende Xerostomie (irreversible Schädigung der Speicheldrüsen) sein.
Risikofaktoren und Schweregrad Das Risiko für die Entstehung von Schleimhautentzündungen sowie der Schweregrad hängen von verschiedenen Faktoren ab. Bei Chemotherapien sind besonders die Art und Dosis der eingesetzten Therapie ausschlaggebend. Patienten, die eine Hochdosischemotherapie erhalten, leiden sehr häufig unter einer Mukositis. Bei der Strahlentherapie sind das Bestrahlungsfeld, die Art der Bestrahlung und die Gesamtdosis wichtige Faktoren für die Entwicklung einer Mukositis.
46.5.3.2 Pflegerische Maßnahmen und Empfehlungen zur Mundpflege
Die Auswirkungen einer Mukositis machen eine sorgfältige Prophylaxe von Entzündungen im Mund- und Rachenraum erforderlich. In erster Linie ist es die Aufgabe der Pflegenden, die Patienten sehr gut über die Auswirkungen der Chemo- bzw. Strahlentherapie auf die Mundschleimhaut und die Immunabwehr zu informieren. Der Patient soll befähigt werden, selbstständig und eigenverantwortlich Mundpflege und Mundinspektion durchzuführen und mögliche Veränderungen festzustellen. Gerade im Hinblick auf ambulante Patienten sind diese Informationen von entscheidender Bedeutung. Eine weitere wichtige Aufgabe der Pflegenden ist es, den Patienten zu instruieren und ihn immer wieder zu motivieren, die Mundpflege durchzuführen. Dies gestaltet sich häufig sehr schwierig, da die Mundpflege von den Patienten meist als sehr unangenehm empfunden wird.
Folgende Maßnahmen sollten zur Mundpflege durchgeführt werden:
-
Patienten informieren
-
Mund täglich mit Taschenlampe inspizieren (s. u.)
-
auf sorgfältige Mundhygiene achten (s. u.)
-
auf scharf gewürzte, gesalzene, geräucherte Speisen verzichten
-
auf Nikotin, Alkohol und Kaffee verzichten oder den Konsum einschränken
-
gekühlte Speisen anbieten (Eiswürfel zum Lutschen)
-
mechanische, physikalische und chemische Stressoren meiden
-
für ausreichende Flüssigkeitszufuhr (zweieinhalb Liter pro Tag bei Erwachsenen) sorgen
-
eine ausgewogene Ernährung anstreben
-
bei Bedarf Schmerztherapie verabreichen
-
Speichelfluss bei intakter Mukosa mit Kaugummis, sauren Bonbons, sauren Tees, gehackten Kräutern anregen
-
Mundschleimhaut feucht halten (künstlicher Speichel, Zerstäuber mit gewünschter Flüssigkeit)
Praxistipp
Gefrorene Ananasstücke (Papain) wirken abschwellend und entzündungshemmend.
Merke
Patienten mit einer Xerostomie (Mundtrockenheit) sind Risikopatienten für eine orale Mukositis, Infektionen der Mundhöhle, Karies und Parodontose.
Tägliche Mundinspektion Mit Hilfe einer Taschenlampe beobachtet die Pflegende Zustand von Lippen, Mundschleimhaut, Zähnen, Zunge, Zahnfleisch, Rachen, Stimme, Beschaffenheit und Menge des Speichels, Schluckvermögen.
Sorgfältige Mundhygiene Dazu gehören die Säuberung, Spülung und Entfernung der Beläge, Zahnreinigung und Reinigung der Zahnprothesen sowie die Lippenpflege. Die Zahnreinigung erfolgt mit einer weichen Zahnbürste nach den Mahlzeiten. Die Mundspülungen werden nach den Mahlzeiten und zwischendurch durchgeführt. Mundspülungen sollten die Schleimhaut nicht reizen und alkoholfrei, für den Patienten wohlschmeckend, leicht verfügbar und kostengünstig sein. Zur Lippenpflege werden Bepanthen Augen- und Nasensalbe sowie Vaseline verwendet.
Mundspüllösungen sind z. B.:
-
Stomatitislösung (antiseptisch, fungistatisch, granulationsfördernd)
-
Kamillelösung (entzündungshemmend)
-
Subcutin N Lösung (schmerzlindernd)
-
Chlorhexamed Forte 0,2 % (antiseptisch)
-
Bepanthenlösung (unterstützt die Wundheilung)
-
NaCl 0,9 % (reinigend, granulationsfördernd)
-
Bepanthen-Thesit 1 % (wundheilend, schmerzlindernd)
Tees zur therapeutischen Mundpflege sind in ▶ Tab. 46.9 zusammengefasst und in der Apotheke zu erwerben.
|
Indikation |
Wirkung |
Durchführung |
|
Kamillentee |
||
|
bei Entzündungen des Zahnfleisches und der Schleimhaut |
entzündungshemmend, antibakteriell, beruhigend und schmerzlindernd |
1 – 2 Teelöffel mit 150 ml kochendem Wasser übergießen, 10 Min. ziehen lassen und absieben |
|
Salbeitee |
||
|
bei Entzündungen im Mund- und Rachenraum, bei Tumorwachstum oder Tumorzerfall im Mund- und Rachenraum |
antibakteriell, fungistatisch, virostatisch, adstringierend, austrocknend durch Gerbstoffe |
1½ Teelöffel geschnittene Blätter mit kochendem Wasser übergießen, 3 Min. ziehen lassen und absieben |
|
Thymiantee |
||
|
bei Entzündungen des Mund- und Rachenraumes und zur unterstützenden Behandlung bei Soor und Mundgeruch |
durchblutungsfördernd, antibakteriell, fungizid, desodorierend |
1½ Teelöffel Thymian mit kochendem Wasser übergießen, 10 Min. ziehen lassen und absieben |
|
Ringelblumentee |
||
|
bei Entzündungen des Mund- und Rachenraumes |
desinfizierend, adstringierend, abwehrsteigernd |
1 Teelöffel auf 150 ml Wasser, Aufguss 5 – 10 Min. ziehen lassen und absieben |
|
Malventee |
||
|
bei Entzündungen des Mund- und Rachenraumes |
schmerzlindernd, entzündungshemmend und heilend |
3 – 4 Teelöffel getrocknete Blüten oder Blätter mit 200 ml kochendem Wasser übergießen, 10 Min. ziehen lassen, 3 – 4 Tassen pro Tag |
|
Reisschleim |
||
|
zur Behandlung schmerzhafter Prozesse in Rachen und Speiseröhre |
300 ml Reisschleim (aus Milch und Reisflocken) |
|