
45 Pflege von Patienten mit Schmerzen
45.1 Einleitung
Schmerz ist eine grundlegende menschliche Erfahrung, die wir mit unseren Sinnen erleben. Jeder Mensch hat im Laufe seines Lebens immer wieder Schmerzen.
Schmerz ist ein Phänomen, mit dem wir im Alltagsleben, aber auch in beruflichen Pflegesituationen konfrontiert werden. Immer noch hat jeder zweite Patient im Krankenhaus (Fletcher et al. 2008, Maier et al. 2010) und sogar bis zu zwei Drittel der Bewohner von Einrichtungen der stationären Altenhilfe (Osterbrink et al. 2012) Schmerzen. Wir müssen davon ausgehen, dass zwischen 6,7 und 13 Millionen Menschen in der Bundesrepublik unter chronischen Schmerzen leiden (Deutscher Bundestag 2013), viele von ihnen erhalten aber keine ausreichende Therapie.
Aufgrund der gesundheitspolitischen und ökonomischen Bedeutung der Schmerztherapie und der zentralen Rolle des Phänomens für die Pflege hat das Deutsche Netzwerk für Qualitätsentwicklung in der Pflege (DNQP) 2005 den Nationalen Expertenstandard Schmerzmanagement verabschiedet. Inzwischen erfolgte eine Aktualisierung dieses Standards. Dieser liegt seit 2011 vor und regelt das pflegerische Schmerzmanagement bei akuten Schmerzen (DNQP 2011). Seit 2015 liegt zudem der Nationale Expertenstandard Schmerzmanagement in der Pflege bei chronischen Schmerzen vor (DNQP 2015).
Eine separate Darstellung der Schmerzversorgung von Menschen mit akuten bzw. chronischen Schmerzen ist notwendig, um dem spezifischen Versorgungsbedarf der Patienten gerecht zu werden. Akute Schmerzen treten z.B. nach Operationen als akute Wundschmerzen oder auch durch akute Erkrankungen, z. B. in der Inneren Medizin oder Neurologie, auf. Aber es treten auch häufig Schmerzen durch chronische Krankheiten und die durch diese Erkrankung bedingte körperliche Immobilität auf. Chronische Schmerzen können möglicherweise zu akuten Schmerzen hinzukommen.
Dabei hängen das Ausmaß und die Dauer der Schmerzen sowohl in Akutsituationen wie auch bei chronischen Prozessen häufig von der Kompetenz und der Herangehensweise der professionellen Helfer ab. Pflegende spielen eine zentrale Rolle im Schmerzmanagement, da sie durch pflegerische Anleitung und Schulung oder sogar Beratung den Patienten in der Auseinandersetzung mit dem Schmerz unterstützen und seine Ressourcen gezielt fördern. Der Patient wird damit als aktiver Partner in die Umsetzung des Schmerzmanagements einbezogen.
45.2 Medizinischer Überblick
45.2.1 Grundlagen
Definition
„Schmerz ist ein unangenehmes Sinnes- und Gefühlserlebnis, das mit aktueller oder potenzieller Gewebeschädigung verknüpft ist oder mit Begriffen einer solchen Schädigung beschrieben wird.“ (IASP 1976)
„Schmerz ist das, was der Betroffene über die Schmerzen mitteilt, sie sind vorhanden, wenn der Patient mit Schmerzen sagt, dass er Schmerzen hat.“ (McCaffery 1997)
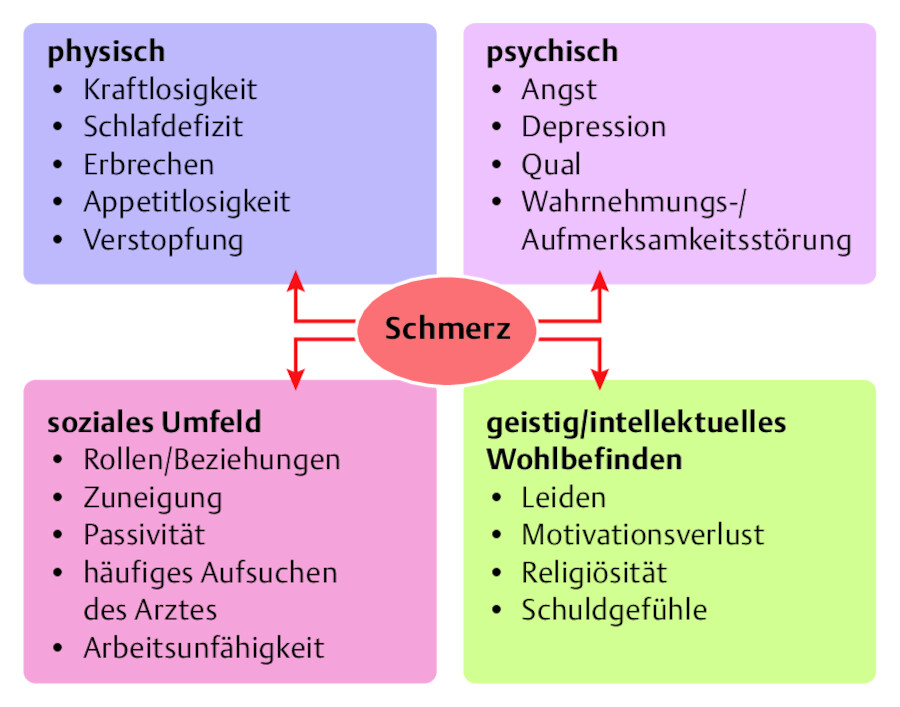
Beide Definitionen verdeutlichen Schmerz als mehrdimensionales Ereignis. Es wird auch als bio-psycho-soziales Geschehen dargestellt. Damit wird ausgedrückt, dass Schmerz nicht nur den Körper eines Menschen betrifft, sondern auch Einfluss auf das psychische, soziale und geistig-intellektuelle Wohlbefinden hat (Ferrel 2000). Schmerz ist in seiner Vielschichtigkeit eine subjektive und individuelle Erfahrung, die unser Leben begleitet. Schmerzen werden körperlich erfahren, sie haben aber auch eine psychische und soziale Komponenten ( ▶ Abb. 45.1).
Multidimensionalität des Schmerzes.
Abb. 45.1 Die verschiedenen Einflüsse des Schmerzes auf die Patienten.
45.2.1.1 Einflüsse auf das Schmerzerleben
Die Bewertung der momentanen Situation hat Einfluss darauf, wie Schmerz erlebt wird. Stellt eine Situation eine Gefahr für uns dar, z. B. bei einer ausstehenden Diagnose (z. B. Sorge vor der Diagnose einer Tumorerkrankung) oder durch eine für unsere Unversehrtheit gefährlichen Verletzung (z. B. eine drohende Arm- oder Beinamputation), so wird Schmerz sehr viel stärker empfunden als in einer nicht belastenden Situation. Dies verdeutlicht noch einmal die Individualität des Schmerzerlebens. Die subjektive Wahrnehmung macht die Stärke des erlebten Schmerzes aus. So beschreibt auch Müller-Busch, dass „es … nicht immer der Schmerz [ist], der das Leben unerträglich macht, sondern häufig ist es umgekehrt, dass das Leben den Schmerz unerträglich macht.“ (Müller-Busch 2007). Hieraus leitet sich die Notwendigkeit einer individuellen Schmerztherapie ab. Nur wenn jeder Patient die für ihn notwendige Therapie erhält, kann der Schmerz ausreichend gelindert werden.
Zudem hat das kulturelle Umfeld großen Einfluss auf unsere Schmerzwahrnehmung. Wir lernen im Laufe unserer Kindheit, Schmerzen zu äußern. Vor allem der kulturelle Kontext hat Einfluss darauf, wie der erlebte Schmerz der Umwelt gegenüber dargestellt wird. Je nachdem, wie und in welchem gesellschaftlichen Umfeld wir aufwachsen und in welcher Lebenssituation wir uns zum Zeitpunkt des Schmerzerlebnisses befinden, verspüren wir Schmerzen in unterschiedlich starker Weise und kommunizieren den Schmerz entsprechend. Von Kindern ist zudem bekannt, dass körpereigene Schmerzhemmmechanismen erst im Laufe der Kindheit, wahrscheinlich bis zum 10. Lebensjahr, ausgebildet werden. Auch hierdurch erleben Kinder Schmerzreize stärker als Erwachsene (Hoffmann 2015)
45.2.1.2 Einteilung
Schmerzen werden nach verschiedenen Kriterien eingeteilt:
-
nach dem Entstehungsort (Rücken, Bein, Kopf usw.)
-
nach der Entstehungsursache (postoperative Schmerzen, Tumorschmerzen, durch Erkrankungen bedingte Schmerzen)
-
nach der Zeitdauer (akuter Schmerz, chronischer Schmerz)
-
nach der Pathogenese (Nozizeptorschmerz, neuropathischer Schmerz)
-
durch psychische Mechanismen (mit)bedingte Schmerzen
Anatomie und Physiologie im Fokus
(nach Schwegler u. Lucius 2016)
Pathophysiologie des Schmerzes
Schmerzentstehung
Schmerz tritt auf, wenn Gewebe verletzt wird. Dies kann ein tatsächliches Trauma sein (z. B. eine Schnittverletzung), aber auch durch eine Erkrankung bedingt sein, die mit dem Untergang von Gewebe einhergeht (z. B. eine Entzündung im Körper). Der hier auftretende akute Schmerz wird unterschieden in den sog. Nozizeptorschmerz und den neuropathischen Schmerz ( ▶ Tab. 45.1 ).
|
Unterteilung in |
Verteilung von |
Beispiel |
|
Nozizeptorschmerz |
||
|
somatisch: oberflächlich somatisch: tiefe Strukturen |
Haut, Muskel, Sehnen, Bänder |
Nadelstich, Muskelkater |
|
viszeral |
Eingeweide |
Gallenblasenentzündung, Appendizitis |
|
neuropathischer Schmerz |
||
|
periphere Nerven |
Nervenverletzung durch Trauma |
|
|
Nervenwurzeln |
Bandscheibenvorfall |
|
|
zentrales Nervensystem |
Schlaganfall |
|
|
Mixed Pain (gemischter Schmerz) |
||
|
Kombination von Nozizeptor- und neuropathischem Schmerz |
Tumor, der in Nerven und Weichteile eindringt |
|
Bei chronischen Schmerzen kann auch ein sog. „Mixed Pain“ (gemischter Schmerz) auftreten, welcher eine Kombination aus Nozizeptor- und neuropathischem Schmerz darstellt.
Schmerzen aktivieren das vegetative Nervensystem mit Blutdruckanstieg, Beschleunigung der Atmung und Steigerung der Herzfrequenz. Auch reagiert der Körper mit einer hormonellen Stressreaktion, die mit einem erhöhten Metabolismus einhergeht.
Schmerzweiterleitung
Schmerz wird als Schmerz erlebt, sobald er im Gehirn verarbeitet wurde. Damit dies geschieht, erfolgt die Schmerzweiterleitung über spezifische Bahnen in unserem Körper ( ▶ Abb. 45.2). Spezifische Neurotransmitter oder Botenstoffe reizen die A-Delta- und C-Nervenfasern, die als Antwort darauf die Schmerzinformation auf elektrischem Weg (als Aktionspotenzialfolgen) bis zum Rückenmark weiterleiten. Die Nervenfasern enden in der Substantia gelatinosa. Hier finden eine Verschaltung des ankommenden Reizes am Hinterhorn und ein Weitertransport der Information zum Gehirn statt. Dort erfolgt abschließend vom Thalamus ausgehend eine Ausbreitung in verschiedene Gehirnareale (limbisches System, frontale Hirnrinde u. a.). Der eintreffende Reiz wird als Information bearbeitet. Der Schmerz wird auf der Grundlage der Stärke und Häufigkeit des eintreffenden Reizes und der Bewertung in der frontalen Hirnrinde wahrgenommen.
Physiologische Reaktion bei Schmerzen.
Abb. 45.2
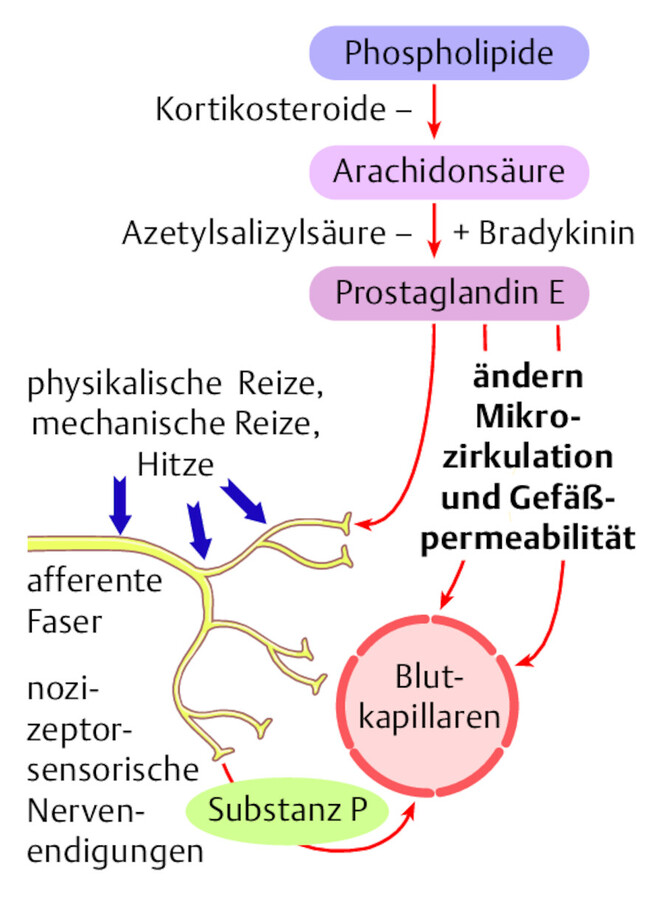
Schmerzhemmung
Als Reaktion auf den eintreffenden Schmerzreiz werden Hemmsysteme des Gehirns aktiviert, die die Ausschüttung körpereigener Schmerzhemmstoffe anregen (Endorphine, Enkephaline). Der Schmerz wird durch sie verringert.
Es kann zu einer gesteigerten Empfindlichkeit der Nervenfasern kommen, wenn Entzündungen oder andere Gewebeveränderungen vorliegen. Diese Überempfindlichkeit wird als periphere Sensibilisierung bezeichnet (primäre Hyperalgesie) und führt zu einer gesteigerten Schmerzwahrnehmung.
45.2.2 Entstehung chronischer Schmerzen
Chronische Schmerzen entwickeln sich durch nicht behandelte akute Schmerzen. Jeder akute Schmerz kann also ein chronischer Schmerz werden. Dies verdeutlicht die Notwendigkeit einer raschen und wirksamen Therapie des Akutschmerzes.
Fallbeispiel
Frau Brigitte Meinhardt hatte vor mehreren Wochen einen akuten Bandscheibenvorfall. Dieser war konservativ therapiert worden. Sie hatte Krankengymnastik und eine Schmerztherapie erhalten. Seit dem Vorfall war sie aber nie schmerzfrei und hat mittlerweile eine Fehlhaltung eingenommen, die ihr zusätzlich Schmerzen bereitet. Mittlerweile hat sie nicht nur im Sitzen und bei Bewegungen Schmerzen, sondern auch im Liegen und sie hat das Gefühl, dass der Schmerz immer stärker wird.
Wenn ein Schmerz länger andauert, verändern sich die Verschaltungen im Netzwerk der Nerven und es kommt zu Veränderungen an den Nozizeptoren. Botenstoffe werden vermehrt freigesetzt. Rezeptoren dieser Überträgerstoffe werden empfindlicher gegenüber Schmerzreizen und Gene werden aktiviert, die zur weiteren Verstärkung des Schmerzes führen. Teilweise kommt es sogar zu spontaner Aktivität von Hinterhornzellen des Rückenmarks (ohne Reiz aus dem verletzten Gewebe), sodass Schmerz ohne vorliegende Schädigung wahrgenommen wird.
Normalerweise besteht ein gesundes Gleichgewicht zwischen der Schmerzwahrnehmung und dem System der Schmerzhemmung. Wir bemerken hierdurch nur Schmerzen, die uns eine Gefahr für unseren Körper und unser Leben melden. Beim chronischen Schmerz allerdings scheint dieses Gleichgewicht nicht mehr zu bestehen. Es werden auch Schmerzen wahrgenommen, die keine Warnfunktion besitzen. Genau hier setzt eine große psychische und soziale Belastung durch den chronischen Schmerz ein. Der betroffene Mensch erleidet eine lang andauernde körperliche Stressreaktion, wodurch eine Ermüdung herbeigeführt wird. Die Erholungsphasen des Körpers nehmen ab, da ausreichende Tiefschlafphasen nicht hinreichend vorhanden sind, und es resultiert eine Erschöpfung der betroffenen Person.
Zudem gibt es Risikofaktoren, die die Entstehung chronischer Schmerzen begünstigen. Hierzu gehören bestimmte Grunderkrankungen, psychische Belastungen, aber auch Angststörungen (DNQP 2015).
45.2.3 Einfluss des Schmerzes
Wie oben bereits dargestellt, hat Schmerz Einfluss auf unser Wohlbefinden und damit auf unsere Lebensqualität (Ferrel 2000). Werden Schmerzen nicht ausreichend behandelt, können viele Aktivitäten unseres Lebens beeinträchtigt werden. ▶ Abb. 45.1 zeigt mögliche Einflüsse des Schmerzes auf unser körperliches, psychisches, soziales wie auch geistiges Wohlbefinden.
45.2.3.1 Einfluss auf das physische Wohlbefinden
Fallbeispiel
Herr Frank Peters hat nach einem Autounfall, bei dem er sich einen Unterschenkelbruch zugezogen hat, permanent Schmerzen, besonders stark sind sie bei körperlicher Bewegung. Jede Bewegung strengt ihn sehr an, sodass er meist kraftlos zu Hause auf der Couch liegt. Er hat das Gefühl, sich nicht erholen zu können. Auch nachts wird er mehrfach wach. Morgens fühlt er sich dann wie gerädert und hat nur noch die Kraft, sich wieder auf die Couch zu legen. Jeder Termin ist ihm zu viel. Mittlerweile hat er keinen Appetit mehr und isst nur noch unregelmäßig.
Schlafdefizit Die Auswirkungen des Schmerzes auf den körperlichen Zustand von Herrn Peters zeigen sich sehr deutlich. So kommt es häufig zu einem Schlafdefizit. Der Betroffene kann aufgrund vorhandener oder befürchteter Schmerzen nicht einschlafen. Er beginnt, in seinen Körper hineinzuhorchen, und nimmt Schmerzen stärker wahr. Häufig kommt es auch zu Durchschlafstörungen, da der Schmerz in der Bewegung im Schlaf einschränkt und bestehende Schmerzen keine ▶ Tiefschlafphasen, und damit für den Körper notwendige Erholungsphasen, ermöglichen.
Kraft- und Appetitlosigkeit Hieraus resultiert wiederum Kraftlosigkeit. Der Patient erlebt durch den immerwährend vorhandenen Schmerz keine ausreichenden Erholungsphasen. Jede Bewegung wird anstrengend, sodass die Kraftreserven schnell aufgebraucht sind. Häufig gehen Schmerzen auch mit Appetitlosigkeit einher, die Kraftlosigkeit wird hierdurch noch verstärkt.
45.2.3.2 Einfluss auf das psychische Wohlbefinden
Vorhandene Schmerzen können zu Angst und Unsicherheit führen. Dies hängt davon ab, in welcher Situation Schmerzen auftreten und wie diese von dem Betroffenen bewertet werden. Können wir nicht einordnen, ob die vorhandenen Schmerzen ungefährlich sind, bewirken sie Angst. Bestehen Schmerzen längerfristig, werden sie von vielen Menschen als Qual empfunden, denn sie belasten den Menschen, ohne weiterhin die Aufgabe des Warnsignals zu haben. Gerade bei lang anhaltenden Schmerzen kommt es dann auch zu Wahrnehmungs- und Aufmerksamkeitsstörungen. Der Betroffene beschäftigt sich fast ausschließlich mit seinem Schmerz und fokussiert sein gesamtes Handeln darauf. Der Alltag wird durch den Schmerz bestimmt und allein das eigene Schicksal des Schmerzes wird als bedeutsam wahrgenommen. So ziehen sich die Betroffenen immer mehr in sich zurück und fühlen sich durch die Schmerzen in ihren Alltagsaktivitäten eingeschränkt. Hieraus resultiert soziale Isolation.
45.2.3.3 Einfluss auf das soziale Wohlbefinden
Durch den Einfluss des Schmerzes auf unseren Körper und unsere Psyche wird auch unser soziales Leben beeinflusst. Patienten mit chronischen Schmerzen erleben häufig, dass sie nicht an sozialen Aktivitäten teilnehmen können, da sie sich aufgrund ihrer Schmerzen hierzu nicht in der Lage sehen. So kann z.B. ein Kinobesuch am Abend nicht möglich sein, da der Betroffene bereits zu müde und angestrengt ist und ihn ein längeres Sitzen in einem Kinosessel zudem belasten würde. Auch erleben Betroffene ein abnehmendes Mitgefühl ihrer Mitmenschen, es wandelt sich in Gleichgültigkeit gegenüber ihrem Leiden. Nicht selten schlägt es sogar in Aggression um. Dies geschieht nicht zuletzt, da vorab bestehende soziale Rollen nicht mehr wahrgenommen werden können. So kann ein Elternteil vielleicht nicht mehr berufstätig sein und damit den Lebensunterhalt der Familie sichern. Chronischer Schmerz ist zudem häufig für Arbeitsunfähigkeit verantwortlich.
45.2.3.4 Einfluss auf das geistige Wohlbefinden
Durch den vielfältigen Einfluss des Schmerzes auf unser Leben wird er häufig als Leiden erlebt und führt zu Motivationsverlust. Erhalten Patienten über lange Zeit keine adäquate Therapie, so wandelt sich anfängliche Motivation und schlägt um in Frustration. Die Sinnhaftigkeit der Therapie wird infrage gestellt und die Situation des Betroffenen ist gekennzeichnet durch Hoffnungslosigkeit und Passivität. Dies kann dazu führen, dass der Patient keine aktive Krankheitsbewältigung mehr anstrebt. Ein Teufelskreis entsteht.
45.3 Ziel pflegerischen Handelns
45.3.1 Akute Schmerzen
Das Ziel in der pflegerischen Versorgung akuter Schmerzen ist die größtmögliche Schmerzlinderung. Dabei steht die Vorbeugung gegen Schmerzen bzw. deren Reduktion auf ein für den Patienten/Betroffenen erträgliches Maß im Fokus (DNQP 2011). Dies bedeutet, dass die Intensität der erlebten Schmerzen eine wichtige Rolle spielt. Ziel ist es, eine mögliche Chronifizierung wie auch eine Verzögerung des Genesungsverlaufs zu vermeiden.
45.3.2 Chronische Schmerzen
Für die Versorgung von Patienten/Betroffenen mit chronischen Schmerzen steht neben einer für den Patienten ausreichenden Schmerzlinderung v.a. der Erhalt oder das Erreichen einer größtmöglichen Lebensqualität sowie Funktionsfähigkeit und sozialen Teilhabe im Vordergrund (DNQP 2015). Ziel ist es, eine stabile Schmerzsituation für und mit dem Betroffenen zu schaffen. Eine solche stabile Schmerzsituation wird immer durch die im Merkkasten stehenden Kriterien definiert. Dabei ist sowohl die Einschätzung der Pflegenden wie auch die des Betroffenen selber bedeutsam. Denn es ist wesentlich, eine instabile Schmerzsituation zu erkennen, damit diese in eine stabile Situation überführt werden kann. Hierzu bedarf es gemeinsamer Planungen und Maßnahmen des interprofessionellen Teams. Pflegende haben hier ihren spezifischen Anteil.
Merke
Faktoren einer stabilen Schmerzsituation (DNQP 2011):
-
Die Situation wird dauerhaft als akzeptabel und nicht veränderungsbedürftig erlebt.
-
Es sind konkrete Ziele formuliert, die sich an der Lebenswelt des Betroffenen orientieren.
-
Angehörige sind einbezogen.
-
Krisen und Komplikationen wird durch gemeinsam erarbeitete Strategien vorgebeugt.
Faktoren einer instabilen Schmerzsituation (DNQP 2011):
-
Die Schmerzlinderung und -situation sind dauerhaft nicht akzeptabel.
-
Gesundheitsbezogene und alltagsbezogene Krisen treten auf.
-
Versorgungsbrüche treten auf durch fehlende Selbstmanagementkompetenzen, familiäre oder professionelle Unterstützung.
-
Es treten Komplikationen durch oder im Laufe der Therapie oder durch Nebenwirkungen auf.
-
Funktionalität, Lebensqualität und sozialer Teilhabe werden eingebüßt.
45.4 Therapie/Pflege- und Behandlungsplan
45.4.1 Schmerzeinschätzung
Schmerz ist ein subjektives Phänomen, daher können nur die betroffenen Patienten selbst zuverlässige Aussagen über ihre Schmerzsituation machen. Es bedarf einer systematischen Schmerzerfassung, die die Basis für eine suffiziente Schmerzbehandlung bildet (DNQP 2011, Stamer u. Meißner 2008). Schmerzen, die nicht erkannt werden, können nicht behandelt werden. Daher muss Schmerz sichtbar gemacht werden (Rawal 1997). Die Schmerzeinschätzung ist Aufgabe des gesamten Behandlungsteams und es bedarf eines systematischen Vorgehens. Es darf nicht davon ausgegangen werden, dass Patienten sich von sich aus melden, denn viele Patienten erwarten aufgrund von Erkrankungen und Therapien Schmerzen und ertragen sie (Carr u. Man 2009). Dabei erfolgt die Schmerzerfassung patientenorientiert und situationsangepasst.
Bei der Schmerzerfassung hat die Selbstauskunft der Patienten immer Vorrang vor einer Fremdeinschätzung (DNQP 2011). Die Einschätzung der Schmerzsituation des Patienten sollte bereits zu Beginn der stationären Aufnahme/des pflegerischen Auftrags erfolgen und untergliedert sich in eine initiale und eine differenzierte Erfassung des Schmerzes.
45.4.1.1 Schmerzeinschätzung akuter Schmerzen
Im initialen Assessment wird kurz erhoben, ob Schmerz vorliegt oder bald vorliegen könnte. Es ist immer dem differenzierten Assessment vorgeschaltet und beinhaltet auch die Erhebung möglicher Risikofaktoren für Schmerzen und durch Schmerz bedingter Probleme wie z. B. einer verminderten Mobilität. Liegt kein Schmerz vor, wird kein differenziertes Assessment benötigt, aber die initiale Schmerzerkennung wird in regelmäßigen Abständen erneut durchgeführt.
Wird im initialen Assessment ein Schmerz festgestellt, folgt eine differenzierte Schmerzerfassung. Folgende Leitgedanken sind für die Ersteinschätzung von Schmerzen von Bedeutung.
Lokalisation der Schmerzen Der Ort des Schmerzes soll so genau wie möglich erfasst werden, um die genaue Ausbreitung des Schmerzes zu kennen. Daher sollte der Patient nach Möglichkeit gebeten werden, das Ausmaß des Schmerzes verbal zu beschreiben und am Körper zu zeigen.
Praxistipp
Dabei wird der Ort des Schmerzes mit einem Finger vom Patienten umzeichnet. Ebenso kann der Patient gebeten werden, das Ausmaß des Schmerzes in ein Körperschema einzuzeichnen ( ▶ Abb. 45.3).
Grafische Darstellung der Schmerzlokalisation.
Abb. 45.3

Intensität der Schmerzen Die Stärke der Schmerzen kann mit Instrumenten erfasst werden, die verlässlich und verständlich sind (s. u.).
Qualität der Schmerzen Um Hinweise auf die Ursache der Schmerzen zu erhalten, ist die Erhebung der Schmerzqualität wichtig. Sie beschreibt, wie sich der Schmerz anfühlt. Er kann wie folgt beschrieben werden:
-
stechend, brennend
-
reißend, krampfartig
-
pochend, spitz
-
ermüdend, unerträglich
-
ängstigend, nagend, grausam
Schmerzbedingte Probleme Der Patient kann Probleme durch bestehende Schmerzen haben (z. B. Immobilität, Appetitverlust), die neben dem Schmerz selber ein großes Leiden für den Patienten bedeuten können. Den Pflegenden müssen diese Auswirkungen bekannt sein, damit sie gezielt handeln können.
Schmerzausdruck Jeder Mensch hat eine bestimmte Haltung und Mimik bei Schmerzen. Es kann für die Pflegenden von Bedeutung sein, diese nonverbalen Schmerzzeichen des Patienten zu kennen. Vor allem bei Menschen, die sich sprachlich nicht verständigen können, sind diese spezifischen Zeichen wichtig, denn sie sind unsere primäre Möglichkeit der Schmerzerkennung. Zeichen des Schmerzausdrucks finden wir in
-
der Mimik,
-
der Gestik,
-
der Körpersprache,
-
den Lautäußerungen und
-
Veränderungen in der Kommunikation.
Lindernde oder verstärkende Faktoren Viele Menschen kennen aus ihrem Alltag Methoden und Maßnahmen (z. B. Kälte, Wärme, bestimmte Lagerungen), die ihre Schmerzen erfolgreich lindern. Diese Handlungen können z. T. auch in der vorherrschenden Situation hilfreich sein und sollten in den Pflegeplan aufgenommen und durchgeführt werden.
45.4.1.2 Schmerzeinschätzung chronischer Schmerzen
Auch bei der Erfassung chronischer Schmerzen unterscheidet man ein initiales und ein differenziertes Assessment.
Initiale Schmerzerfassung
In der initialen Erfassung wird erhoben, ob überhaupt Schmerz vorhanden ist und ob es sich um einen chronischen Schmerz handelt. Dabei ist die zeitliche Dimension (Dauer der Schmerzen) bedeutsam. Ein Schmerz wird als chronisch bezeichnet, wenn er länger als 3 Monate dauerhaft bzw. 6 Monate intermittierend besteht. Bedeutsam dabei ist aber auch, ob physische und/oder psychische Begleiterkrankungen vorliegen, da diese die Chronifizierung des Schmerzes begünstigen können.
Auch Risikofaktoren für die Ausbildung eines chronischen Schmerzgeschehens sind zu erheben. Hierzu zählen hohes Alter, weibliches Geschlecht, familiäre Disposition (Marcus 2009). Nach der Feststellung eines chronischen Schmerzes erfassen Sie, ob der Patient/Betroffene sich in einer stabilen oder instabilen Schmerzsituation befindet.
Stellen Sie eine instabile Schmerzsituation fest, gilt es die Faktoren zu identifizieren, die verantwortlich sind für diese Instabilität. Hieraus können Sie dann im Folgenden ableiten, welche Maßnahmen Sie planen müssen, um eine stabile Schmerzsituation herbeizuführen.
Können Sie eine stabile chronische Schmerzsituation feststellen, identifizieren Sie die Faktoren, die wichtig sind für die Stabilität. Sie planen dann entsprechend die notwendigen Maßnahmen, die sinnvoll sind, um die Stabilität zu erhalten.
Zu den im initialen Assessment erhobenen Informationen gehören die Schmerzintensität, die Qualität des Schmerzes, die Lokalisation, die bisherige Behandlung und die Zufriedenheit mit der Schmerzsituation und der Behandlung.
Differenzierte Schmerzerfassung
Im differenzierten Assessment erheben Sie somit alle Inhalte, die wichtig sind, um die Stabilität oder Instabilität der Schmerzsituation zu erfassen. Hierzu gehören:
Beginn, Dauer, Verlauf Für die Behandlung des Schmerzes ist es von Bedeutung zu erfahren, wie lange dieser bereits besteht und ob es Veränderungen in der Schmerzqualität gegeben hat. Auch wird erfasst, ob der Schmerz dauernd oder mit Unterbrechungen vorhanden ist. Migräne tritt z. B. mit Unterbrechungen auf. Dabei ist es bedeutsam, ob dieser Kopfschmerz zu bestimmten Zeiten (durch Hormonschwankungen im weiblichen Monatszyklus, bei Wetterumschwüngen, durch Stresssituationen) oder durch bestimmte Auslöser (z. B. Nahrungsmittel wie Rotwein, Käse, Schokolade) verursacht werden.
Lebensqualität Sie erheben mit dem Patienten/Betroffenen, wie er seine Lebensqualität einschätzt und in welchen Bereichen des Wohlbefindens er ggf. Änderungen als notwendig ansieht.
Soziale Teilhabe Die Möglichkeit, am sozialen Leben teilzunehmen, ist für Menschen mit chronischen Schmerzen sehr bedeutsam. Oft fühlen sie sich durch die Schmerzen so stark eingeschränkt, dass sie es nicht schaffen, sich mit anderen Menschen zu befassen. Ein gesellschaftliches Leben findet nicht oder nur eingeschränkt statt.
Erklärungsmuster für bestehende Schmerzen Ggf. kann es auch wichtig sein, die Erklärungen des Betroffenen für die bestehenden chronischen Schmerzen zu erfassen. Diese können sich von den Ursachen aus Sicht des therapeutischen Teams unterscheiden. Sie sind aber bedeutsam, wenn gemeinsam mit dem Patienten/Betroffenen Therapieziele vereinbart werden sollen.
Pflegerische Schmerzexperten
Für das differenzierte Schmerzassessment in einer instabilen Schmerzsituation haben Pflegende die Aufgabe, pflegerische Schmerzexperten hinzuzuziehen. Die nationale Fachgruppe der pflegerischen Schmerzexperten hat hierzu ein Kompetenzprofil entwickelt wie auch Möglichkeiten der Fortbildung zum Schmerzexperten gelistet (www.dbfk.de).
45.4.1.3 Aufgaben der Pflege
Pflegende haben über den gesamten Tag regelmäßig Kontakt zum Patienten und können somit eine systematische patientenorientierte Schmerzerfassung sicherstellen. Um die Schmerzen des Patienten umfassend beurteilen zu können, sollten akute Schmerzen nach einer Operation oder während einer akuten Erkrankung in regelmäßigen Intervallen – mindestens 3-mal täglich – vor und nach einer Schmerzbehandlung, bei neu beginnenden Schmerzen und nach Verabreichung von Analgetika oder nicht medikamentösen Therapien eingeschätzt und dokumentiert werden.
Chronische Schmerzzustände werden seltener erfasst. Die Häufigkeit ist dabei individuell zu planen und hängt davon ab, ob einen stabile oder instabile Schmerzsituation vorliegt. Ist die Schmerzsituation instabil, kann eine 1-mal tägliche Erfassung notwendig sein, dagegen kann eine monatliche Erhebung der Schmerzsituation bei stabilen Schmerzen ausreichend sein.
Zusätzlich sollte die Beeinflussung der täglichen Aktivitäten durch den Schmerz erhoben werden. Eine zeitnahe und lückenlose Dokumentation der Schmerzeinschätzung ist dabei unabdingbar und ermöglicht die Information aller Beteiligten im Behandlungsteam. Dies bildet somit eine wichtige Voraussetzung für eine effektive Schmerztherapie.
Schmerz stellt ein pflegerelevantes Phänomen dar, das durch pflegerische Maßnahmen wie die Mobilisation (z. B. Aufstehen) und auch medizinische Handlungen wie Punktionen und Verbandwechsel entstehen oder verstärkt werden kann. Hieraus ergibt sich, dass die Information über bestehende Schmerzen wesentliche Bedeutung für die Pflegeplanung hat. Die Schmerzerfassung ist damit wichtiger Bestandteil der Pflegebedarfsermittlung.
45.4.1.4 Erfassung der Schmerzintensität
Die Schmerzstärke gibt nur eine Größe des Schmerzempfindens wieder. Sie ist allerdings ein wichtiger Anteil des Schmerzerlebens. Die Schmerzstärke ist ein Faktor für das Leiden der Patienten im Alltag. Durch die Anwendung von Einschätzungsinstrumenten kann die Schmerzstärke in Zahlen oder Begriffen erfasst und damit für alle Beteiligten kommunizierbar und nachvollziehbar gemacht werden. Nachfolgend wird dann die erfasste Schmerzstärke für die Steuerung der medikamentösen wie nicht medikamentösen Schmerztherapie genutzt. Entscheidend für die Anwendung dieser Skalen ist ihre Verlässlichkeit und Verständlichkeit. Dabei muss die ausgewählte Skala so einfach sein, dass der jeweilige Patient sie ohne Probleme anwenden kann. Es ist zu beachten, dass nicht jede Skala für jeden Patienten geeignet ist.
Schmerzerfassungsskalen zur Selbsteinschätzung
Zur Erfassung der Schmerzstärke wird der Patient aufgefordert, anhand einer Skala zu benennen, wie stark sein Schmerz ist ( ▶ Abb. 45.4). Dies kann zu Beginn ungewohnt für den Patienten sein und etwas Zeit in Anspruch nehmen. Mit ein wenig Übung wird es dem Patienten und der Pflegenden aber immer besser gelingen, die Stärke der Schmerzen zu benennen und dies für die Schmerztherapie zu nutzen.
Verschiedene Skalen zur Erfassung von Schmerzen.
Abb. 45.4
(Foto: K. Gampper, Thieme)
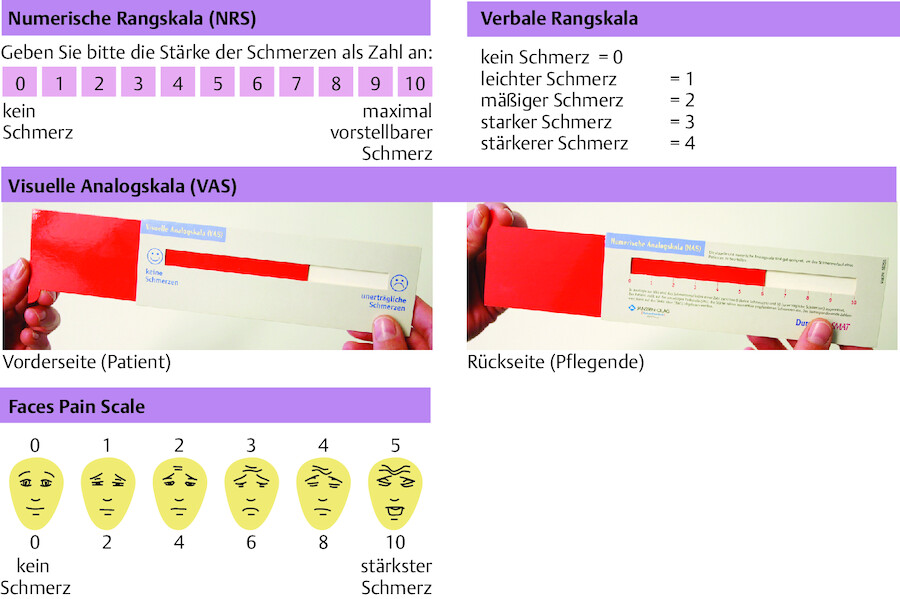
Numerische Rangskala (NRS) Die 11-stufige NRS ist die bekannteste und am häufigsten verwendete Art der Schmerzskalen. Sie kann als gedrucktes Hilfsmittel eingesetzt werden wie auch in gesprochener Form („Wie stark ist Ihr Schmerz auf einer Skala von 0 bis 10, auf der 0 ‘kein Schmerz’ und 10 ‘schlimmster vorstellbarer Schmerz’ bedeutet?“). Die NRS hat insgesamt 11 Antwortmöglichkeiten für die Schmerzeinschätzung, somit können geringe Veränderungen in der Schmerzintensität erfasst werden. Sie ist in der Anwendung unkompliziert und findet beim Patienten eine gute Akzeptanz.
Visuelle Analogskala (VAS) Die VAS ist ein sog. „Schmerzschieber“, mit dem der Patient durch die Einstellung des Schiebers die Stärke seiner Schmerzen deutlich machen kann. Der Schieber hat eine Seite, die zur Darstellung der Schmerzstärke durch den Patienten genutzt wird, und eine zweite Seite zur Erhebung einer der Schmerzstärke entsprechenden Zahl durch die Pflegenden. Die Patientenseite ist an einem ihrer Enden mit dem Begriff „kein Schmerz“ und am anderen Ende mit dem Begriff „stärkster vorstellbarer Schmerz“ gekennzeichnet. Bei dem abgebildeten Schieber besteht die Möglichkeit, durch das Drehen auf die andere Seite einen numerischen Wert auf einer Skala von 0 bis 10 abzulesen, der dann dokumentiert wird. Die VAS bietet für den Patienten eine große Zahl von Möglichkeiten, seine Schmerzintensität exakt zu bestimmen. Für Patienten mit Sehbeeinträchtigungen oder motorischen Einschränkungen sollte jedoch auf eine andere Skala zurückgegriffen werden.
Verbale Rangskala (VRS) Die zumeist 5-stufige Skala stellt Begriffe und gegenübergestellte Zahlen von 0 bis 4 dar. Jedem Begriff ist dabei eine bestimmte Zahl entsprechend der Schmerzstärke zugeordnet. Diese Skala kann schriftlich wie auch mündlich eingesetzt werden und gilt als einfach in der Handhabung. Auch ältere Menschen, Personen mit Sehbeeinträchtigungen und Menschen mit leichten kognitiven Einschränkungen können die Skala i. d. R. nutzen.
Gesichter-Skala Ursprünglich wurden Gesichter-Skalen zur besseren Veranschaulichung der Schmerzintensität für Kinder entwickelt. Eine aktuell gültige Gesichter-Skala stellt die Faces Pain Scale (Hicks et al. 2001) dar. Hier wurden die Gesichter mittels Computeranimation erstellt.
Zu beachtende Hinweise Alle genannten Skalen gelten als zuverlässig für die Schmerzerfassung bei Patienten, die die Schmerzen selber einschätzen können. Es ist sinnvoll, in einer Institution nur 1 bis maximal 2 Skalen zu verwenden, damit einheitliche Beurteilungskriterien zugrunde gelegt werden. Da Bewegungen oft eine schmerzverstärkende Wirkung haben, sollte neben dem Ruhe- auch immer der Bewegungsschmerz erfasst werden. Ziel ist die Vermeidung von Schonhaltungen des Patienten. Häufig führen Patienten aufgrund von Schmerzen bestimmte Bewegungen nicht durch, verharren in bestimmten Körperpositionen oder atmen nicht ausreichend durch. Treten diese Probleme auf, so bestehen eine erhöhte Dekubitus- und Pneumoniegefahr für den Patienten.
Schmerztagebücher In der Therapie chronischer Schmerzzustände werden häufiger Schmerztagebücher eingesetzt. In diesen Büchern können der Schmerz und schmerzbedingte Probleme (z. B. Schlafprobleme, Appetitverlust, Verdauungsprobleme), aber auch Auswirkungen auf die Aktivitäten des täglichen Lebens über einen bestimmten Zeitraum (meist 14 Tage) erfasst und dokumentiert werden. Diese Schmerztagebücher werden genutzt, um eine eindeutige Schmerzdiagnose zu stellen oder den Schmerz im Verlauf zu beurteilen.
Schmerzerfassung bei speziellen Patientengruppen
Schwieriger ist die Schmerzeinschätzung bei speziellen Patientengruppen, wie z. B.:
-
betagten und hochbetagten Menschen
-
Patienten mit kognitiven Einschränkungen (z. B. demenziell erkrankte Menschen)
-
bewusstseinsbeeinträchtigten Menschen
-
sedierten Patienten
-
Drogenabhängigen
-
Patienten mit psychischen Erkrankungen
-
nicht deutsch sprechenden Patienten
-
Kindern
Auch für diese Patientengruppen gilt die Selbst- vor der Fremdeinschätzung des Schmerzes. Bei der Auswahl möglicher Einschätzungsinstrumente müssen dabei in besonderem Maße die Einschränkungen der jeweiligen Patienten bedacht werden. Ist keine ausreichende verbale Kommunikation möglich, müssen Instrumente zur Fremdeinschätzung benutzt werden.
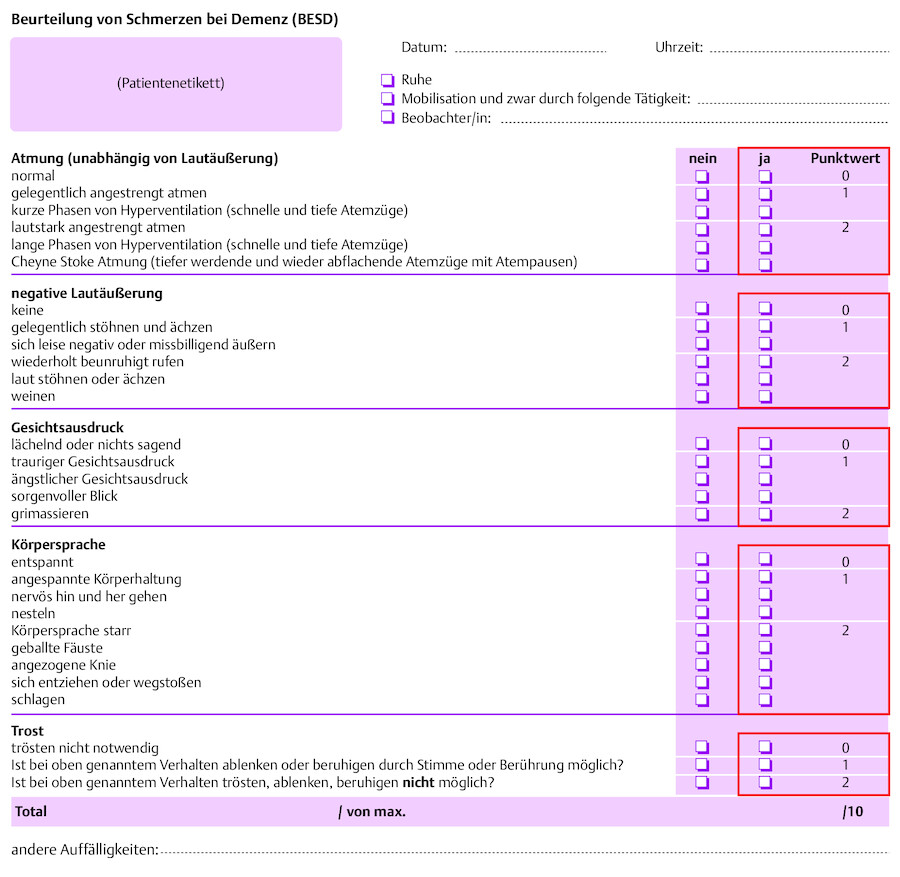
Schmerzerfassung bei kognitiv eingeschränkten Personen Mittlerweile gibt es für Menschen mit kognitiven Einschränkungen Instrumente zur Einschätzung von Verhaltensänderungen, die auf Schmerz schließen lassen (Arbeitskreis Alter und Schmerz der Deutschen Schmerzgesellschaft 2006, Kunz 2000, Landendörfer 2003, Herr u. Garand 2001, Handel 2010). Diese Fremdeinschätzungsinstrumente können helfen zu erfassen, ob ein Patient Schmerzen hat. Es gilt aber zu beachten, dass mit diesen Instrumenten Verhaltensweisen, die häufig mit Schmerz verbunden sind, erfasst werden. Problematisch bleibt dabei, dass auch die Erfassung mittels dieser Instrumente keine endgültige Sicherheit bringt, da einzelne Zeichen auch durch andere Ursachen, z. B. im Rahmen einer Demenzerkrankung, bedingt sein können ( ▶ Abb. 45.5). Es ist nicht möglich, von häufig gezeigten Veränderungen des Verhaltens auf die Stärke des Schmerzes zu schließen (Sirsch, Gnass 2011). Bereits eine Auffälligkeit im Verhalten kann auf starken Schmerz hindeuten.
Beurteilung von Schmerzen bei Demenz.
Abb. 45.5
(Abb. nach: Schuler 2007)
Fallbeispiel
Herr Josef Kaiser hat eine demenzielle Erkrankung. Diese ist so weit fortgeschritten, dass er kaum noch spricht. Manchmal sagt er noch einzelne Wörter, allerdings scheinen diese oft aus dem Zusammenhang gerissen. Zurzeit ist Herr Kaiser sehr unruhig und die ihn betreuenden Pflegefachpersonen des ambulanten Pflegedienstes fragen sich, ob er vielleicht Schmerzen haben könnte, finden allerdings keine Ursache. Daher beschließen sie, mit der BESD mögliche Verhaltensweisen für Schmerzen zu erheben. Sie stellen fest, dass Herr Kaiser, anders als sonst, gelegentlich angestrengt atmet und ebenfalls gelegentlich stöhnt. Er grimassiert und geht in seiner Wohnung nervös hin und her. Meist lässt er sich aber von den ihm vertrauten Pflegepersonen trösten. Nach der Erfassung stellen die Pflegefachkräfte fest, dass Herr Kaiser auf der BESD einen Punktwert von 6 erreicht. Sie sind sich nun ziemlich sicher, dass Herr Kaiser Schmerzen hat, und informieren seinen Hausarzt. Dieser stellt nach einer eingehenden Untersuchung eine Blasenentzündung fest. Nach Einleitung einer ursächlichen Behandlung wie auch einer Schmerztherapie stellen die Pflegenden rasch eine Besserung im Verhalten von Herrn Kaiser fest.
Schmerzerfassung bei Kindern Kinder sind eine weitere Gruppe, die bei der Schmerzerfassung besonderer Aufmerksamkeit bedarf. Schmerzen von Früh- und Neugeborenen können mittels des Instruments Neonatal Infant Pain Scale (NIPS) erhoben werden Es gibt weitere Instrumente, die aber nicht ins Deutsche übersetzt vorliegen. Bei invasiven Maßnahmen kann auch der Berner Schmerzscore für Neugeborene verwendet werden (DNQP 2011). Schmerzäußerungen von Säuglingen und Kleinkindern im vorsprachlichen Alter müssen ebenfalls über Fremdeinschätzungsinstrumente erfasst werden (DNQP 2011). Die bekannteste Skala ist die sog. KUSS-Skala (kindliche Unbehagens- und Schmerzskala), die für Säuglinge im reifen Neugeborenenalter bis zum 4. Lebensjahr verwendet werden kann ( ▶ Abb. 45.6).
KUSS-Skala.
Abb. 45.6
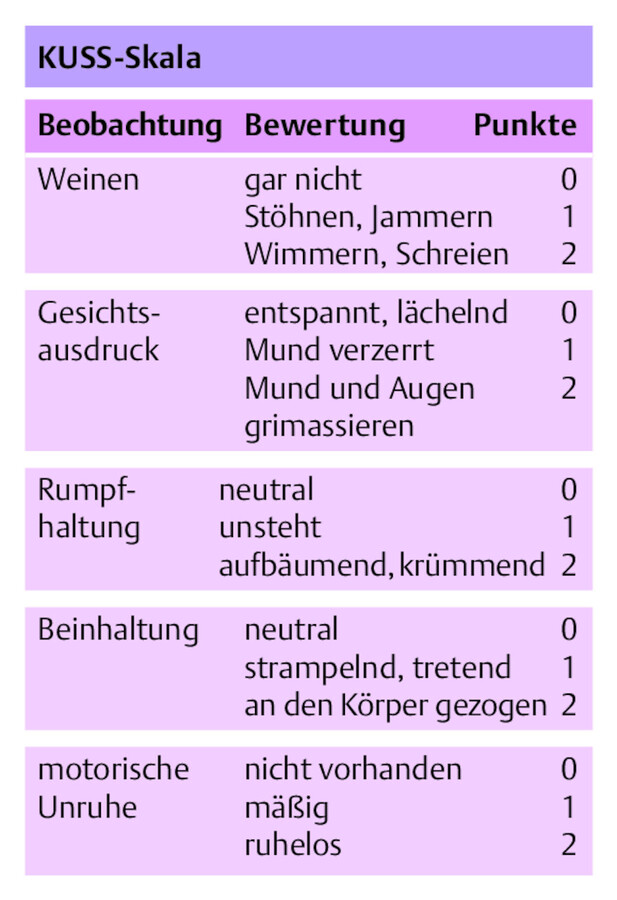
Ältere Kinder können mit dem Instrument FLACC (Face, Legs, Activity, Cry, Consolability scale) eingeschätzt werden. Allerdings ist die deutsche Übersetzung bisher nicht validiert (DNQP 2015).
Ab einem Alter von zweieinhalb Jahren kann teilweise bereits eine Selbsteinschätzung durch das betroffene Kind mit einfachen Rangskalen erfolgen. Hier wird häufig mit Bildern gearbeitet, die z. B. verschieden gefüllte Wasserbecher zeigen und die Stärke der Schmerzen darstellen sollen. Kinder im Vorschulalter können bereits mit Gesichter-Skalen (s. ▶ Abb. 45.4) die Stärke ihrer Schmerzen aufzeigen.
Kinder im Schulalter können mit abstrakteren Skalen Auskunft über ihre Schmerzen geben, sodass hier auch die NRS, VRS oder VAS angewendet werden können.
Praxistipp
Die Auswahl des geeigneten Instruments richtet sich nicht in erster Linie nach dem Alter. Dies kann nur richtungweisend sein. Bedeutsam ist, dass das Kind in der Lage ist, die Skala zu verstehen und diese als Hilfe für die Schmerzdarstellung erachtet. Um herauszufinden, welches Instrument geeignet ist, können Sie das Kind beobachten und wahrnehmen, wie es am besten Erklärungen versteht und wie es eigene Bedürfnisse darstellen kann. Diese Beobachtungen können Ihnen Hinweise auf die Auswahl des passenden Instruments geben. Wenn Sie unsicher sind, können Sie dem Kind auch 2 verschiedene Instrumente anbieten, um gemeinsam das geeignete auszusuchen. Zudem können Sie die direkten Bezugspersonen einbeziehen und ihre Erfahrung für die Schmerzerfassung nutzen. Auch sollten Sie immer die Situation, in der sich das Kind gerade befindet, mitbedenken. So kann es auch sein, dass ein Kind aus Furcht vor einer unangenehmen Situation Schmerz nicht oder zumindest in einem geringeren Umfang äußert.
Für die Erfassung chronischer Schmerzen bei Kindern liegen ebenfalls Empfehlungen für die Auswahl von Instrumenten vor. Allerdings sind diese lediglich für die Selbstauskunft vorhanden, da nach Aussage von Experten die Schmerzzeichen mit der Zeit geringer werden und sich so Verhaltensänderungen als Zeichen chronischer Schmerzen nur schwer beobachten lassen (von Baeyer u. Spagrud 2007).
Als Instrumente zur Selbstauskunft werden auch für die Erfassung des chronischen Schmerzes die Gesichter-Skalen wie auch die VAS empfohlen (DNQP 2015). Als multidimensionales Instrument kann der Deutsche Schmerzfragebogen für Kinder, Jugendliche und ihre Eltern genannt werden (DNQP 2015). Es gibt dabei verschiedene Versionen für Kinder, Jugendliche und ihre Eltern, die sich im Umfang, aber auch in der Art der Fragestellung unterscheiden.
Merke
Wie auch für die Erfassung von chronischen Schmerzen bei Erwachsenen gilt für Kinder und Jugendliche, dass die Multidimensionalität des Phänomens bedacht und eine entsprechend umfassende Erhebung der Schmerzsituation erfolgen muss. Nur wenn auch mögliche Belastungsfaktoren mit erkannt werden, kann die Schmerzsituation umfassend erfasst und daraus abgeleitet sinnvoll behandelt werden.
45.4.1.5 Pflegeplan erstellen
Alle ermittelten Informationen werden gezielt in die Pflegeplanung einbezogen. Die Erstellung des Plans erfolgt nach Möglichkeit mit dem Patienten und wird entsprechend den Veränderungen seines Pflegebedarfs aktualisiert. Dabei sind folgende Pflegeziele beim akuten Schmerz leitend:
-
Der Patient erhält die Möglichkeit, seine Schmerzen zu äußern.
-
Der Patient ist befähigt zur Schmerzerfassung.
-
Die Schmerzäußerung des Patienten wird von den Pflegenden ernst genommen.
-
Die Schmerzerfassung ist dokumentiert und steht allen Berufsgruppen zur Verfügung.
-
Die medikamentöse und nicht medikamentöse Therapie wird nach dem erhobenen Schmerz ausgerichtet.
Für den chronischen Schmerz gilt es, individuelle Therapieziele zu vereinbaren. Ihre fachliche Einschätzung und die damit verbundene Zielplanung sind gleichermaßen bedeutsam wie die vom Betroffenen dargelegten Therapieziele. Bestehen Unterschiede in den Zielen, gilt es im Aushandlungsprozess mit dem Patienten einen gemeinsamen Weg zu finden. Er können auch Information, Schulung und Beratung des Patienten, aber auch seiner Angehörigen bedeutsam sein, um sie zu einer informierten Entscheidung und damit verbundenen Zielfindung zu befähigen.
45.4.1.6 Planung und Koordination bei chronischen Schmerzen
Bestehen chronische Schmerzen, haben Pflegende insbesondere die Aufgabe, pflegerische Maßnahmen zu planen, aber auch mögliche Maßnahmen anderer Berufsgruppen zu koordinieren. Dabei ist es wichtig, ob in der Schmerzerfassung eine stabile oder instabile Schmerzsituation erfasst wurde.
Liegt eine stabile Schmerzsituation vor, wird der bestehende und im interprofessionellen Team abgestimmte Behandlungsplan der medikamentösen und nicht medikamentösen Schmerztherapie fortgeführt. Hierbei übernehmen Sie als Pflegende die Planung der pflegerischen Maßnahmen und koordinieren mögliche durch andere Berufsgruppen auszuführende Aufgaben.
In einer instabilen Schmerzsituation muss eine Abstimmung im interprofessionellen Team darüber stattfinden, welche Maßnahmen zur Stabilisierung der Schmerzsituation zu planen sind. Hierzu zieht die betreuende Pflegefachperson einen pflegerischen Schmerzexperten hinzu, der auf der Basis des differenzierten Assessments planen kann, welche weiteren pflegerischen Maßnahmen zur Stabilisierung notwendig sind. Auch hierbei erfolgt eine Abstimmung im interprofessionellen Team.
45.4.2 Schmerztherapie
Grundlegend hat die Schmerztherapie das Ziel, die Schmerzen so weit wie möglich zu beseitigen. Die verschiedenen Therapieansätze werden häufig in Kombination eingesetzt, um einen möglichst guten Therapieerfolg zu erzielen. Dabei unterscheidet man:
-
medikamentöse Schmerztherapie
-
nicht medikamentöse Verfahren der Schmerztherapie
-
psychologische Therapieverfahren
45.4.2.1 Medikamentöse Schmerztherapie
Die medikamentöse Behandlung ist i. d. R. der Grundpfeiler der Schmerztherapie. Man unterscheidet dabei folgende Medikamentengruppen:
-
Nichtopioide
-
mittelpotente Opioide
-
starke Opioide
-
Koanalgetika
-
Begleitmedikamente
Die Medikamentengruppen wurden von der Weltgesundheitsorganisation (WHO) in ein Stufenschema gebracht, das primär für die Therapie von Tumorschmerzen entwickelt und für die Behandlung dieser Schmerzen validiert wurde ( ▶ Abb. 45.7). Mittlerweile wird dieses Grundprinzip der Analgetikaanwendung für chronische Tumorschmerzen wie auch für akute und chronische Nichttumorschmerzen genutzt. Es bietet eine gute Möglichkeit der effektiven und sinnvollen Medikamentenkombination und erlaubt die Festlegung von Standardtherapieplänen.
Grundprinzip des Stufenschemas:
-
Stufe I: Beginn der medikamentösen Schmerztherapie bei leichten Schmerzen
-
Stufe II: bei unzureichender Wirkung oder stärkeren Schmerzen
-
Stufe III: bei weiterer Schmerzverstärkung oder starken Schmerzen
-
Bei Anwendung der Stufe II oder III: mögliche Kombination mit einem Nichtopioid
-
Einsatz von Koanalgetika (trizyklische Antidepressia, Antikonvulsiva usw.) für spezielle Schmerzformen und zur Linderung von Nebenwirkungen
-
Begleitmedikamente werden eingesetzt, um mögliche Nebenwirkungen zu reduzieren. So geht eine Opioidtherapie immer mit einer Obstipation einher und muss von Anfang an therapiert werden.
Abb. 45.7 Der WHO-Dreistufenplan zur Schmerztherapie (nach WHO 1996).

Regionalanalgesie und PCA Darüber hinaus kommen in der Schmerztherapie spezielle Verfahren, wie die Gabe von Medikamenten über spezielle Katheter (Regionalanalgesie) oder die Patienten-kontrollierte-Analgesie (PCA = Patient controlled Analgesia), zur Anwendung ( ▶ Abb. 45.8). Die Katheterverfahren werden bei regional begrenzten Schmerzen nach Operationen eingesetzt (z. B. nach Gelenkoperationen). Die PCA bietet die Möglichkeit, besonders starke Schmerzen zu behandeln. Der Patient hat die Möglichkeit, sich selber das angeordnete Schmerzmedikament innerhalb bestimmter Grenzen über eine Pumpe zu verabreichen.
PCA-Pumpe.
Abb. 45.8
(Foto: K. Gampper, Thieme)

Merke
Bereits Kinder im Vorschulalter können häufig mit dieser selbstständigen Medikamentenverabreichung umgehen. Zuvor ist es aber unabdingbar, sich davon zu überzeugen, dass das Kind das Verfahren verstanden hat und in der Lage ist, die Medikamentengabe selber durchzuführen.
Akutschmerzdienste In den letzten Jahren wurden in Krankenhäusern zunehmend sog. Akutschmerzdienste (ASD) eingerichtet, die durch Ärzte und immer häufiger auch Pflegende mit speziellen Kenntnissen (pflegerische Schmerzexperten) besetzt sind und sich um die Versorgung der Patienten mit speziellen schmerztherapeutischen Verfahren bemühen. Die Betreuung dieser Patienten durch einen Akutschmerzdienst bietet den Vorteil, dass sich Experten um die speziellen Verfahren kümmern und eine für den Patienten effiziente Therapie und deren Evaluation stattfinden kann.
Prinzipien der Therpie bei Tumorschmerz Das Ziel der Therapie von Tumorschmerzen ist die größtmögliche Linderung der Schmerzen. So wird dem Betroffenen ermöglicht, die verbleibende Lebenszeit ohne zusätzliche Leiden zu erleben, und die Voraussetzung dafür geschaffen, dass der Erkrankte Abschied nehmen und Dinge regeln kann, die ihm wichtig sind (Nauck u. Klaschik 2002).
Prinzipien der Therapie des akuten Nichttumorschmerzes Der Akutschmerz tritt im Zusammenhang mit einer Verletzung, einer Operation oder einer akuten Erkrankung auf. Seine Ursache ist i. d. R. klar und die Dauer des Schmerzes zeitlich begrenzt. Hier sollte so rasch wie möglich eine effektive Schmerztherapie erfolgen, um die Entstehung chronischer Schmerzen und nachfolgende Komplikationen zu verhindern. Das bedeutet, dass bei starken Schmerzen in der frühen postoperativen Phase oder im Akutstadium einer Erkrankung häufig das WHO-Stufenschema ( ▶ Abb. 45.7) in der umgekehrten Reihenfolge genutzt wird (von Stufe 3 rückwärts bis Stufe 1). Der Beginn der Schmerztherapie erfolgt dann entsprechend der Schmerzstärke ggf. mit einem starken Schmerzmedikament (Zenz u. Jurna 2001).
Prinzipien der Therapie des chronischen Nichttumorschmerzes Anders verhält es sich beim chronischen, nicht tumorbedingten Schmerz. Hier steht der Erhalt oder die Rückgewinnung der sozialen Integration im Vordergrund. Der betroffene Patient soll wieder „in die Bewegung“ gebracht werden. Viele Menschen ziehen sich zurück, treffen keine anderen Personen mehr. Die vorhandenen Schmerzen sind so anstrengend und aufreibend, dass ihnen für andere Dinge keine Kraft mehr verbleibt. Hier steht neben der Schmerzlinderung die Schmerzverarbeitung durch eine multimodale Schmerztherapie im Vordergrund. Neben der medikamentösen Therapie sind hier vor allem nicht medikamentöse Angebote wie Physiotherapie und Psychotherapie wichtige Pfeiler einer umfassenden Behandlung.
Regeln der medikamentösen Schmerztherapie
Die Anordnung der medikamentösen Schmerztherapie erfolgt durch den für den Patienten zuständigen Arzt. Die Pflegende verabreicht häufig die angeordneten Medikamente und hat hierfür die Übernahme- und Durchführungsverantwortung. Sie benötigt daher ein aktuelles und ausreichendes Wissen über Schmerzbehandlung (DNQP 2011). Dabei sollten die wichtigsten Methoden der Schmerzbehandlung bekannt sein:
-
Kenntnis des WHO-Stufenschemas und die Möglichkeiten der Medikamentenwahl.
-
Analgetikagabe nach festem Zeitschema und die Möglichkeit von Zusatzmedikationen: Die heutige Schmerztherapie erfolgt i. d. R. nach festem Zeitschema, da nur so vermieden werden kann, dass der Patient schmerzhafte Phasen erleiden muss. Wird erst ein Medikament gegeben, wenn der Patient sich bei Schmerzen meldet, kann eine Chronifizierung des Schmerzes vorangetrieben werden, da sich der Schmerzreiz als sog. Schmerzgedächtnis festschreibt.
-
Bevorzugung nicht invasiver Applikationen wie der Gabe über den Mund: Die Patienten sollten eine möglichst schonende Applikation der Schmerzmedikamente erhalten. Je schonender das Verfahren ist, umso kooperativer ist der Patient gegenüber der Einnahme des Medikaments.
-
Kenntnis der Wirkungsweise der verwendeten Analgetika und deren Nebenwirkungen (Durchführungsverantwortung): Nebenwirkungen müssen ebenso erkannt werden, um entsprechende Gegenmaßnahmen einleiten zu können bzw. den Arzt zu informieren.
Verfahrensregelung Um in der Umsetzung der Schmerztherapie eine effektive medikamentöse Einstellung sicherstellen zu können, sollte die jeweilige Einrichtung über eine interprofessionell geltende Verfahrensregelung verfügen (DNQP 2011, Becker et al. 2008). Diese regelt die Verantwortlichkeiten und Zuständigkeiten der einzelnen Berufsgruppen und legt das Vorgehen zur medikamentösen wie auch der nicht medikamentösen Schmerztherapie fest. Die genaue Form ist dabei abhängig von der pflegerischen Einrichtung (Einrichtung der stationären Altenhilfe, ambulante Pflege, Krankenhaus, Hospiz usw.), den jeweiligen Gegebenheiten und v.a. der Schmerzart. Inhalte der Verfahrensregelung sollten sein:
-
Benennung und Erreichbarkeit der für die Schmerztherapie zuständigen Ärzte
-
Benennung der unterschiedlichen, einrichtungsintern eingesetzten Behandlungsschemata (z. B. eingriffs- oder erkrankungsspezifische Basis- und Bedarfsmedikation) bzw. des für den einzelnen Patienten angeordneten Therapieschemas
-
Aussagen zur Schmerzprävention vor schmerzhaften Prozeduren (pflegerische Maßnahmen wie das Aufstehen, therapeutische oder diagnostische Maßnahmen wie Punktionen, Entfernen von Drainagen)
-
Durchführung spezieller schmerztherapeutischer Verfahren wie der PCA
-
Durchführung abteilungs- oder patientenspezifischer, nicht medikamentöser Verfahren
-
Regelung der Dokumentation
-
Aufgaben pflegerischer Schmerzexperten
-
Anwendung von Empfehlungen und Verfahrensregelungen der medizinischen/pflegerischen Fachgesellschaften (z. B. Deutsche Gesellschaft zum Studium des Schmerzes, Deutsche Gesellschaft für Palliativmedizin, Deutsches Netzwerk zur Qualitätsentwicklung in der Pflege)
Therapiestandards Therapiestandards können für die Therapie akuter Schmerzen eingesetzt werden und finden v.a. in Krankenhäusern Anwendung, wo viele Patienten mit ähnlichen Schmerzen aufgrund von Operationen oder Erkrankungen vorzufinden sind. Jedes Therapiekonzept sollte Interventionsgrenzen und Deeskalationsstufen beinhalten. Die Interventionsgrenzen schreiben fest, bei welcher Schmerzintensität oder bei welchem beobachteten Schmerzverhalten spätestens eine medikamentöse Schmerztherapie eingeleitet oder die bereits bestehende Behandlung angepasst wird. Der Nationale Expertenstandard Schmerzmanagement in der Pflege bei akuten Schmerzen (DNQP 2011) hat diesen Grenzwert für akute Schmerzen bei 3/10 analog der Numerischen Rang-Skala für den Ruheschmerz und bei 5/10 für einen Belastungs- oder Bewegungsschmerz fixiert. Dies ist sinnvoll, da es in Ruhe ab einer Schmerzintensität von 4/10 der NRS zu Komplikationen wie Bewegungs- und Schlafstörungen, Appetitverlust und Störungen in der sozialen Interaktion kommen kann. In Bewegung/unter Belastung sollte der Schmerz nicht stärker als 5/10 sein, da sonst häufig keine ausreichende Bewegung mehr möglich ist.
Durch solche Grenzwerte wird die Pflege in die Lage versetzt, die medikamentöse Schmerztherapie entsprechend den Schmerzangaben des Patienten einzuleiten oder anzupassen. Voraussetzung hierfür ist eine regelmäßige, quantifizierbare Schmerzerfassung. Ggf. ist aber auch eine Anpassung der Grenzwerte für den einzelnen Patienten notwendig, um die Interventionsgrenze an sein individuelles Schmerzempfinden anzupassen (DNQP 2011).
Für den chronischen Schmerz können keine einheitlichen Interventionsgrenzen vorgegeben werden. Hier bedarf es einer individuellen Aushandlung, ab welcher Schmerzintensität eine Bedarfsmedikation eingenommen werden sollte.
Bei der Anwendung von Fremdeinschätzungsinstrumenten gelten Veränderungen im Verhalten des Patienten als Richtwert für die Einleitung oder Anpassung einer Schmerztherapie.
Merke
Bitte beachten Sie dabei, dass bei einer Fremdeinschätzung von Schmerzen nicht die Anzahl veränderter Verhaltensweisen für einen stärkeren Schmerz spricht. Denn auffällige Verhaltensweisen deuten lediglich darauf hin, dass Schmerz vorhanden sein könnte. Dann bedarf es eines Therapieversuchs. Erst, wenn nach diesem das auffällige Verhalten verschwindet, ist ein Schmerzgeschehen wahrscheinlich und Sie sollten das auffällige Verhalten wie auch die dann eingeleitete hilfreiche Behandlung entsprechend dokumentieren und so für alle Beteiligten nachvollziehbar machen.
Deeskalationsstufen können v.a. in der Akutschmerztherapie eingesetzt werden, die eine automatische Erhöhung der Basismedikation bei mehrmaliger Anforderung eines Bedarfsmedikaments beinhalten. Wenn z. B. ein Patient nach einer Operation 3-mal am Tag ein schnell wirksames Opioid zur Beseitigung starker Schmerzen erhält, spricht dies dafür, dass die Basismedikation nicht ausreicht. Somit wird die Basismedikation erhöht, z. B. wird dem fest angeordneten Nichtopioid ein retardiertes starkwirksames Opiod hinzugefügt, so dass weniger häufig eine zusätzliche Bedarfsmedikation notwendig ist. Natürlich muss vorab eine andere Ursache wie eine mögliche operative Komplikation ausgeschlossen werden.
Wirksamkeitskontrolle Neben der Verabreichung der Analgetika ist auch die Überprüfung der Wirksamkeit der eingesetzten Analgetika häufig pflegerische Aufgabe. Das Zeitintervall hierfür richtet sich nach dem angewendeten Verfahren. Diese Wirksamkeitskontrolle erfolgt durch eine erneute Schmerzerfassung und wird dann auch als Verlauf dokumentiert.
Da bei jeder medikamentösen Therapie auch unerwünschte Wirkungen auftreten können, müssen Pflegende aktuelle fundierte Kenntnis über mögliche Nebenwirkungen von Schmerzmedikamenten besitzen (DNQP 2011, 2015). Sie sollten zudem Maßnahmen zur Prophylaxe und der Therapie häufiger Nebenwirkungen kennen und einsetzen können. Dabei gilt es, den Einsatz von Zusatzmedikamenten, die einer ärztlichen Anordnung bedürfen, von Maßnahmen wie einer ballaststoffreichen Ernährung, ausreichender Bewegung oder auch Maßnahmen gegen Mundtrockenheit (z. B. durch das Anbieten gefrorener Getränke) zu unterscheiden. Auch das Nichtauftreten dieser Nebenwirkungen muss erfasst und dokumentiert werden (DNQP 2011).
Nur durch eine suffiziente Prophylaxe und Therapie möglicher Nebenwirkungen wird die Akzeptanz des Patienten und auch seiner Angehörigen gegenüber der Schmerztherapie erhöht.
45.4.3 Nicht medikamentöse Schmerztherapie
Neben der medikamentösen Therapie und möglichen interventionellen Verfahren stellen die nicht medikamentösen Methoden eine weitere Möglichkeit der Schmerzbeeinflussung dar. Obwohl die Wirksamkeit nur eingeschränkt wissenschaftlich nachgewiesen ist (DNQP 2011, 2015), sind sie dennoch Bestandteil der Nationalen Expertenstandards Schmerzmanagement in der Pflege. Ihre Anwendung soll als Begleittherapie zur medikamentösen Behandlung erfolgen, da die Praxiserfahrungen zeigen, dass diese Methoden häufig positiv auf das Schmerzerleben des Betroffenen wirken (Carr u. Man 2009, DNQP 2011, 2015).
Die verschiedenen Methoden können von unterschiedlichen Berufsgruppen angewandt werden und es bedarf der interprofessionellen Abstimmung. Wer welche Maßnahme durchführt, hängt häufig von den Bedingungen in der jeweiligen Einrichtung bzw. den Umgebungsfaktoren ab. Die eingesetzten Maßnahmen werden systematisch als Erweiterung der medikamentösen Therapie genutzt und in den Behandlungsplan aufgenommen.
45.4.3.1 Pflegerische Methoden
Nicht medikamentöse Maßnahmen werden bisher in der deutschen Pflegepraxis meist nur unsystematisch genutzt. Die nationalen Expertenstandards zum Schmerzmanagement in der Pflege schreiben die Maßnahmen aber ausdrücklich als Erweiterung der medikamentösen Schmerztherapie fest. Daher ist es pflegerische Aufgabe, nicht medikamentöse Maßnahmen, die Möglichkeiten des zielgruppenspezifischen Einsatzes, ihrer Wirkungsweisen wie auch mögliche Kontraindikationen zu kennen. Sie werden eingeteilt in:
-
kutane Maßnahmen:
-
Kältetherapie, Wärmetherapie
-
Massage
-
Transkutane Elektrische Nerven-Stimulation
-
Angebote der Basalen Stimulation
-
Lagerung
-
-
kognitive Maßnahmen:
-
Ablenkung
-
Entspannungsübungen
-
Imagination, visuelle Reize
-
Aromatherapie
-
Merke
Selbst bei scheinbar harmlosen Anwendungen wie einer Eis- oder Wärmegabe gibt es Kontraindikationen, die Sie kennen müssen, um Komplikationen zu vermeiden.
Da kaum oder nur unzureichende wissenschaftliche Erkenntnisse zu nicht medikamentösen Maßnahmen und ihrer Anwendung vorliegen, müssen sie vor dem Erfahrungshintergrund der Pflegenden und v.a. entsprechend den Vorlieben und Abneigungen des Patienten ausgesucht werden. Die Angebote für den einzelnen Patienten werden abgestimmt auf die jeweilige Erkrankung und mögliche Begleiterkrankungen. In der Aushandlung mit dem Patienten wählt die zuständige Pflegekraft mögliche nicht medikamentöse Maßnahmen aus, wendet sie selber an oder leitet den Patienten und/oder seine Bezugspersonen hierzu an (DNQP 2011, 2015).
Um nicht medikamentöse Maßnahmen durchführen zu können, muss Mitarbeitern ermöglicht werden, sich fortzubilden.
Ziel Das primäre Ziel der Durchführung nicht medikamentöser Maßnahmen ist die Steigerung des Wohlbefindens des Patienten und hierdurch sekundär eine größtmögliche Schmerzreduktion (Osterbrink 2000). Häufig kann keine direkte und dauerhafte Schmerzlinderung erreicht werden. Allerdings kann der Patient durch die Maßnahme entspannen oder verlässt eine eingenommene Schonhaltung, sodass er hierdurch ein gesteigertes Wohlbefinden erlebt.
Der Patient und auch die Pflegende müssen dabei wissen, dass z. B. eine Eistherapie oder die Anwendung der ▶ Transkutanen Elektrischen Nervenstimulation nicht unbedingt zu einer über die eigentliche Maßnahme andauernden Schmerzlinderung führt. Auch bei den nicht medikamentösen Methoden muss nach Durchführung eine Einschätzung der Wirksamkeit durch den Patienten, gemeinsam mit der Pflegekraft, erfolgen. Nur durch eine Überprüfung kann die Effektivität nachgewiesen werden.
Für den Einsatz nicht medikamentöser Maßnahmen bei chronischen Schmerzen gilt insbesondere, dass sie häufig eingesetzt werden, um den Einsatz von Medikamenten zu begrenzen und v.a. den Patienten aus einer möglichen passiven Rolle in eine aktive Teilnahme am Schmerzmanagement zu überführen. Der Patient muss lernen, mit dem Schmerz zu leben, und hierzu gehört auch, Strategien zu entwickeln, die ihn befähigen, den Alltag zu gestalten.
Merke
Patienten mit chronischen Schmerzen kennen häufig spezifische Maßnahmen, die sie anwenden können. Je nach pflegerischem Setting sollten Sie versuchen, diese Maßnahmen in den Pflegeplan einzubeziehen.
Kutane Maßnahmen
Kälteanwendung Bei der Kältetherapie werden Gelpacks, Umschläge oder Wickel (15 °C) auf den Ort des Schmerzes gelegt, z. B. postoperativ auf die Operationswunde. Diese Form der Schmerztherapie wird seit Jahrhunderten angewendet, es erfolgt eine Schmerzreduktion durch Ödemverringerung. Auch sinkt die Sensibilität gegenüber dem Schmerz. Angewendet werden kann die Kältetherapie bei akutem Trauma, Blutungen, Schwellungen, Prellungen und Kopfschmerzen. Die Dauer der Anwendung sollte 5 – 10 Min., besser 20 – 30 Min. betragen. Kontraindikationen sind peripher vaskuläre Erkrankungen und Hautschäden, z. B. nach Bestrahlungen oder Verbrennungen.
Eisanwendung Die Eisanwendung ist von der Kälteanwendung abzugrenzen, da sie deutlich intensiver ist. Sie kann mit Gelpacks, mit eisgefüllten Plastikbeuteln, Körnerkissen oder auch mit Beuteln, die mit gefrorenen Erbsen gefüllt sind, stattfinden.
Neben der Schmerzreduktion durch eine Ödemverringerung kommt es zur Isolierung der Fettschicht. Die Sensibilität gegenüber dem Schmerz sinkt. Anwendungsbereiche sind ebenfalls das akute Trauma, Blutungen, Schwellungen, Prellungen, Gelenkbeschwerden und Herpesläsionen. Die Dauer der Anwendung beträgt 5 – 10 Min. Kontraindikationen sind periphere vaskuläre Erkrankungen, eine Kälteallergie, Morbus Reynaud und vorgeschädigte Hautareale. Bei Neugeborenen darf keine Anwendung erfolgen, da Eis das Fettgewebe koagulieren kann.
Praxistipp
Sie können harte Erbsen in einen Plastikbeutel füllen und für wenige Stunden in das Gefrierfach legen. Die gefrorenen Erbsen geben die Kälte bei Anwendung an die Haut ab und führen zu einer angenehmen Kühlung. Vorteil dieses Verfahrens ist, dass diese Beutel gut an Gelenken anliegen.
Merke
Menschen mit einer eingeschränkten Kommunikationsfähigkeit dürfen keine Kälte- oder Eistherapie erhalten, da sie unangenehme Wahrnehmungen nicht äußern können.
Wärmeanwendung Die Wärmeanwendung schafft eine Schmerzreduktion durch Vasodilatation, die Sensibilität gegenüber Schmerz sinkt. Die Wärme kann verabreicht werden durch eine Wärmflasche, durch Wickel und Auflagen, Bäder (Vollbad, Teilbad), Rotlicht (40 – 45 °C) oder auch Körnerkissen. Die Einsatzgebiete sind v.a. Gelenkbeschwerden, Rücken- und Muskelschmerzen, Krämpfe, Koliken, rheumatische Arthritis nach dem akuten Stadium und Menstruationsbeschwerden. Die Dauer beträgt 5 – 10 Min., besser 20 – 30 Min.
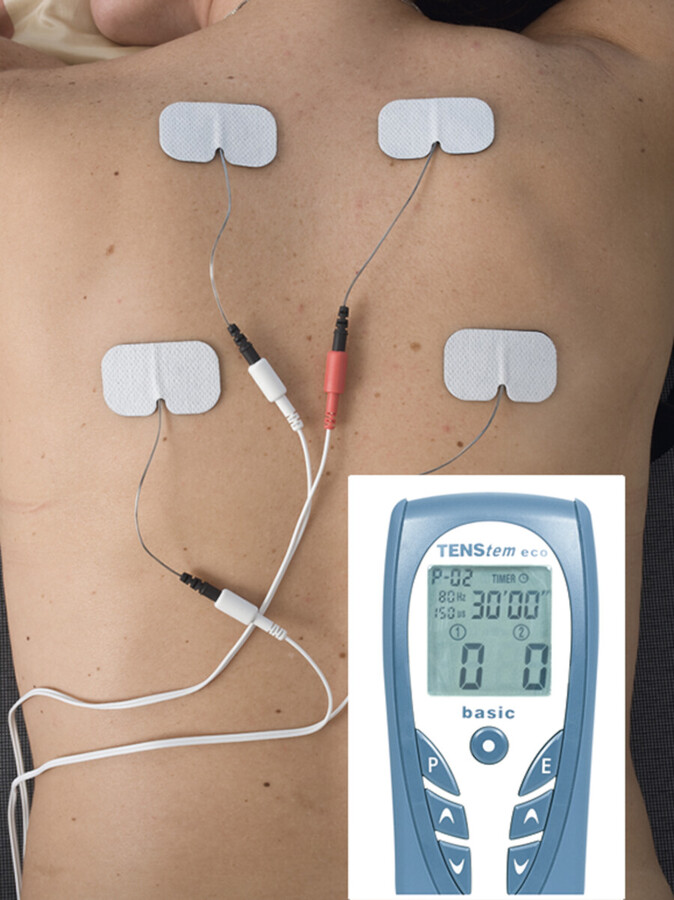
Transkutane Elektrische Nervenstimulation (TENS) Bei der TENS werden kontrollierte elektrische Reize meist über Klebeelektroden mittels eines transportablen Geräts auf die Haut gegeben und sensible Nervenendigungen in einem lokal begrenzten Körperbereich elektrisch gereizt ( ▶ Abb. 45.9). Die TENS kann kontinuierlich oder intermittierend erfolgen. Patienten beschreiben die Stimulation als kribbelndes, vibrierendes oder pulsierendes Gefühl. Einige Forschungsergebnisse weisen darauf hin, dass durch die Stimulation schmerzlindernde Substanzen im Gehirn und Rückenmark freigesetzt werden können (Thoden 2001). Andere Studien kommen zu dem Schluss, dass das Kribbeln den Schmerzreiz „übertönt“ und daher von ihm ablenkt (McCaffery 1997). Diese Therapieform muss vom Arzt verordnet werden und kann dann von den meisten Patienten nach Einweisung in das entsprechende Gerät selbstständig oder mit geringer Hilfestellung allein durchgeführt werden.
TENS.
Abb. 45.9 Transkutane Elektrische Nervenstimulation mittels Klebeelektroden.
(Foto: T. Möller, Thieme)
Merke
Kutan wirksame Maßnahmen können nur bei Patienten durchgeführt werden, die im schmerzenden Körperbereich ausreichend sensibel sind. Sonst kann es zu Verletzungen durch z. B. Verbrennungen oder Vereisungen kommen.
Zentral wirksame Maßnahmen
Entspannungstechniken Durch eine gezielte Entspannung kann ein Bewusstseinszustand erreicht werden, der schmerzablenkend wirkt, und Schmerzen können teilweise oder ganz ausgeblendet werden. Zu den Entspannungstechniken gehören z. B. das autogene Training, die progressive Muskelentspannung nach Jacobson, Atemübungen, Musik hören oder selbst musizieren.
Ablenkung (imaginative Techniken) Hier wird mit Vorstellungsprozessen, meist bildhafter Art, gearbeitet. So kann der Patient z. B. gebeten werden, sich an sein letztes Urlaubserlebnis zu erinnern. Auch die Vorstellung anderer angenehmer Situationen kann hilfreich sein.
Tiefe Atementspannung Der Patient wird aufgefordert, sich auf seine Atmung zu konzentrieren und tief ein- und auszuatmen. Diese sog. „tiefe Atementspannung“ kann vom Schmerz ablenken. Osterbrink (1999) konnte nachweisen, dass eine präoperativ erlernte tiefe Atementspannung bei orthopädisch und abdominell operierten Patienten eine positive Auswirkung auf den Schmerzverlauf in der postoperativen Phase hat.
Meist ist etwas Zeit notwendig, um die angesprochenen Techniken zu erlernen. Jedoch kennen zahlreiche Patienten Entspannungsübungen, die sie zu einem früheren Zeitpunkt erlernt haben. Diese Ressourcen können durch die Pflege genutzt werden.
Praxistipp
Sie können den Patienten nach solchen Fähigkeiten fragen und sie in den Pflegeplan einbauen. Häufig denken Patienten selber nicht daran, ihre Ressourcen in schwierigen Schmerzsituationen abzurufen.
45.4.4 Information, Anleitung und Schulung
Das Bild der Pflege hat sich in den letzten Jahren stark gewandelt und dies zeigt sich nicht zuletzt in der Übernahme von Schulungsangeboten durch Pflegende. Die Übernahme von Schulungen durch Pflegefachkräfte wird von der Weltgesundheitsorganisation als Kernbereich professioneller Pflege betrachtet. Im Nationalen Expertenstandard Schmerzmanagement in der Pflege bei akuten Schmerzen werden Informationen, Anleitungen und Schulungen als ein Element des Schmerzmanagements dargestellt (DNQP 2011). Denn nur durch zielgruppenspezifische Information, Anleitung und Schulung kann das Schmerzmanagement umfassend umgesetzt werden. Dabei steht das Ziel im Vordergrund, den Patienten in die Lage zu versetzen, die geplanten Maßnahmen zu verstehen und aktiv am Behandlungsprozess teilzunehmen (Osterbrink et al. 2008).
45.4.4.1 Patientenschulung
Definition
Die Patientenschulung hat die Vermittlung von Wissen und Fertigkeiten, bezogen auf das Problem Schmerz und der damit verbundenen schmerzbedingten Probleme, zum Ziel. Schriftlich fixierte Konzepte stellen dabei eine Voraussetzung dafür dar, das Vorgehen bei der Schulung zu vereinheitlichen.
Die einzelne Maßnahme ist weniger auf die individuelle Situation des Betroffenen ausgerichtet, sondern richtet sich vielmehr an alle Patienten einer bestimmten Gruppe (z. B. alle Patienten, die im Kontext eines Diabetes mellitus Schmerzen haben). Allerdings werden die Lernvoraussetzungen und Lernmöglichkeiten des einzelnen Patienten berücksichtigt.
Die Schulung sollte die Vermittlung von Wissen über die medikamentöse und nicht medikamentöse Schmerztherapie umfassen. Sie dient auch dem Abbau von Ängsten vor Abhängigkeit und Gewöhnung durch die Schmerzmedikamente. Ebenso sollte die Bedeutung der Schmerzerfassung und ihrer Durchführung wie auch das Einüben pflegepraktischer Fertigkeiten Inhalt sein.
Jede Schulungsmaßnahme muss daher strukturiert, geplant und patientenorientiert stattfinden. Sie sollte durch zielgruppenspezifische schriftliche Patienteninformationen (z. B. als Flyer) unterstützt werden. Diese können in der Schulungssituation von den Pflegenden genutzt werden wie auch dem Patienten zur Reflexion und/oder Vertiefung dienen. Vor allem vor dem Hintergrund ambulanter Operationen, kürzerer Krankenhausverweildauern und sich wandelnder Lebenssituationen werden mündliche wie auch schriftliche Informationen immer bedeutsamer, um den Patienten mit ausreichenden Kompetenzen zum Selbstpflege auszustatten.
45.4.4.2 Beratung von Patienten
In der Begleitung von Patienten mit chronischen Schmerzen ist häufig eine Beratung zum Schmerzmanagement sinnvoll.
Definition
Die Beratung von Patienten hat das Ziel, die Betroffenen zu einem adäquaten Schmerzmanagement zu befähigen und sie in einer eigenverantwortlichen Mitarbeit zu unterstützen.
Die konkreten Inhalte einer möglichen Beratung richten sich nach dem jeweiligen Bedarf des Patienten und ggf. auch seiner Angehörigen. Gerade im chronischen Schmerzgeschehen sind Angehörige immer Mitbetroffene und haben häufig ebenfalls Beratungsbedarf, wobei sich ihr Bedarf deutlich von dem des Patienten unterscheiden kann. Grundlegend gilt es dabei immer, das Selbstmanagement zu fördern, was bedeutet, dass sie in ihrer Eigenverantwortung und Eigenaktivität gestützt und gestärkt werden (DNQP 2015). Dabei ist eine pflegerische Beratung am Alltagsleben des Betroffenen ausgerichtet. Es geht um die Befähigung, Entscheidungen für das eigene Leben zu treffen und Strategien zu entwickeln, die zur Bewältigung des Alltags befähigen.
Merke
In einer instabilen und damit komplexen Schmerzsituation ist ein pflegerischer Schmerzexperte einzubeziehen, der mit Ihnen zusammen einen möglichen Beratungsbedarf erhebt und Sie in der Beratung des Patienten unterstützt.
Das pflegerische Schmerzmanagement unterscheidet sich je nachdem, ob ein Patient mit akuten oder mit chronischen Schmerzen pflegerisch betreut wird. In jedem Fall ist aber immer die individuelle Situation des Patienten zu berücksichtigen und das für den jeweiligen Patienten „richtige“ Schmerzmanagement mit ihm selber auszuhandeln.
45.4.5 Medikamentöse Therapie von chronischen Schmerzen
Die Grundregeln für die medikamentöse Therapie von chronischen Schmerzen lauten:
-
Einsatz von möglichst nichtinvasiven Applikationsformen
-
Festlegung von regelmäßigen Medikamenteneinnahmen
-
Ermittlung einer individuellen Dosierung
-
kontrollierte Dosisanpassung
-
effektive Prophylaxe/Behandlung von Nebenwirkungen der Schmerztherapie
-
konsequenter Einsatz von Koanalgetika
-
Festlegung einer definierten Zusatzmedikation im Bedarfsfall
-
regelmäßiger Patientenkontakt zur Kontrolle von Wirkung und Nebenwirkung
45.4.5.1 Nichtopioidanalgetika
Wirkung Nichtopioidanalgetika ( ▶ Tab. 45.2 ) sind Wirkstoffe mit unterschiedlichen Strukturmerkmalen, die ihre Wirkung in der Hemmung der Prostaglandinsynthese entfalten. Gehemmt wird die Cyclooxygenase (COX), welche ein wesentliches Enzym in der Bildung der verschiedenen Prostaglandine ist. Prostaglandine sind wichtige Mediatoren für Entzündungen und Fieber und beeinflussen die Sensitivität von Schmerzrezeptoren. Die Prostaglandinsynthesehemmung erklärt die analgetische (schmerzlindernde), antipyretische (fiebersenkende) und antiphlogistische (entzündungshemmende) Wirkung.
Nebenwirkungen Auch die typischen Nebenwirkungen im Magen-Darm-Bereich, an der Niere und im Herz-Kreislauf-System lassen sich durch die Prostaglandinsynthesehemmung erklären.
Merke
Für alle Nichtopioidanalgetika gilt, dass Nebenwirkungen dosis- und zeitabhängig sind. Folglich ist bei Erreichen der Maximaldosis die Verträglichkeit zunehmend schlechter. Aus diesem Grund verbietet sich auch die Kombination zweier NSAR; die Unverträglichkeit würde gesteigert werden.
45.4.5.2 Opioidanalgetika
Zu der Gruppe der Opioidanalgetika gehören die Substanzen, die direkte Abkömmlinge des Morphins sind, und Substanzen, die nur teilweise eine strukturelle Ähnlichkeit aufweisen. Alle Substanzen dieser Gruppe entfalten ihre Wirkungen über die sog. Opiatrezeptoren. Für die Praxis ist die Unterscheidung in schwachwirkende ( ▶ Tab. 45.3 ) und starkwirkende Opioidanalgetika ( ▶ Tab. 45.4 ) hilfreich.
|
Wirkung |
Dosierung |
Nebenwirkungen |
Bemerkungen |
|
Acetylsalizylsäure (ASS) |
|||
|
gute analgetische und antipyretische Wirkung |
Einzeldosen sollen 500 (– 1000) mg alle 4 Std. nicht übersteigen. |
Trotz der breiten Anwendung von ASS ist mit erheblichen Nebenwirkungen zu rechnen: Magen-Darm-Bereich (Ulzera, Blutungen, starke Schmerzen), Blutungsneigung und Thrombozytopenie, Bronchospasmus und Asthma. |
Wenn Nebenwirkungen oder Kontraindikationen bekannt sind, ist der Einsatz von ASS nicht mehr möglich. Insgesamt ist ASS für eine Schmerzdauertherapie nicht geeignet. |
|
Ibuprofen |
|||
|
Die antiphlogistische Wirkung ist stärker ausgeprägt als bei ASS, die analgetische und antipyretische Wirkung eher schwächer. |
Einzeldosen liegen bei 200 – 800 mg alle 8 Std., die Tageshöchstdosis liegt bei 2400 mg. |
Die Risiken und Nebenwirkungen sind prinzipiell vergleichbar mit denen von ASS, treten aber deutlich seltener auf. Allerdings ist auf eine ausreichende Nierenfunktion zu achten. |
Eins der meist verwendeten Schmerzmittel aus der Reihe der NSAR (nichtsteroidale Antirheumatika). Das Risiko von Ulzera und Blutungen im Magen-Darm-Bereich wird bei Dauertherapie mit NSAR und vorhandenen weiteren Risikofaktoren durch die zusätzliche Gabe eines Protonenpumpen-Inhibitors (PPI), meist Pantoprazol, reduziert. |
|
Naproxen |
|||
|
Die Wirkungen sind denen von Ibuprofen sehr ähnlich. |
Einzeldosen liegen bei 250 – 500 mg alle 8 – 12 Std. (max. 1250 mg pro Tag). |
Die Nebenwirkungen und Risiken sind denen von Ibuprofen sehr ähnlich. |
Naproxen ist ebenfalls ein relativ häufig verwendetes Schmerzmittel aus der Reihe der NSAR. |
|
Diclofenac |
|||
|
hohe antiphlogistische und eher geringe analgetische und antipyretische Wirkung |
Die Einzelgaben liegen bei 50 (– 75) mg alle 8 – 12 Std., wobei die Tageshöchstdosis von 150 mg nicht überschritten werden darf. |
Risiken und Nebenwirkungen sind vergleichbar denen anderer NSAR, wobei das Auftreten von starken Magen-Darm-Beschwerden für Diclofenac eher typisch ist. |
Eine Langzeittherapie hängt von der individuellen Verträglichkeit ab. Zur Prophylaxe gegen Magen-Darm-Ulzerationen werden PPIs verwendet. |
|
Indometacin |
|||
|
überwiegend antiphlogistische Wirkungen |
Die Einzeldosis liegt bei 25 (– 50) mg alle 6 – 8 Std. (max. 200 mg pro Tag). |
Die Verträglichkeit ist eher schlecht und Indometacin damit für eine Dauertherapie meist nicht geeignet. |
|
|
Paracetamol |
|||
|
Geringe analgetische und keine antiphlogistische Wirkung. Ausgeprägt und dafür bekannt ist die antipyretische Wirkung. |
Die Einzeldosis liegt bei 500 (– 1000) mg alle 4 – 6 Std. Die Tageshöchstdosis von 4000 mg darf nicht überschritten werden. |
Die Verträglichkeit, insbesondere im Magen-Darm-Bereich, ist gut. Die Ausbildung von gravierenden Leber- und Nierenschäden, insbesondere bei hohen Dosen, ist als besonderes Risiko bei einer Paracetamol-Behandlung zu berücksichtigen. |
Eine orale Schmerztherapie allein mit Paracetamol ist meist nicht ausreichend, allerdings sind Kombinationen z. B. mit Codein, ASS oder Tramadol analgetisch deutlich wirksamer. Für die parenterale Applikation steht Paracetamol als Kurzinfusion zur Verfügung (Indikation postoperative Schmerzen). In dieser Darreichungsform ist Paracetamol deutlich stärker analgetisch wirksam und ist somit mit anderen Opioidanalgetika vergleichbar. |
|
Metamizol (Novaminsulfon) |
|||
|
Metamizol ist ein starkes und effektives Analgetikum. Der antiphlogistische und antipyretische Wirkanteil ist eher kleiner. Besonders geeignet bei viszeralen und kolikartigen Schmerzen und bei Knochenschmerzen. Ausgeprägt ist zudem die gute spasmolytische Wirkung auf die glatte Muskulatur von Gallenblase, Ureter und Darm. |
Die Einzeldosis liegt bei 500 – 1000 mg alle 4 – 6 Std. (max. 3000 mg pro Tag). |
Die Verträglichkeit von oral eingenommenen Metamizol ist meist gut, Nebenwirkungen im Magen-Darm-Bereich sind kaum zu erwarten. Bei intravenöser Gabe ist mit anaphylaktischen Reaktionen zu rechnen. Deshalb muss die Injektion sehr langsam und unter strenger Kontrolle durchgeführt werden. Gefürchtet ist die schwerwiegende Komplikation einer Agranulozytose, deren Häufigkeit mit 1 auf 2 – 4 Mio. Applikationen geschätzt wird. Wegen dieser potenziell lebensbedrohenden Nebenwirkung ist Metamizol dann indiziert, wenn andere, vergleichbare Analgetika nicht indiziert bzw. nicht ausreichend wirksam waren. Aus diesem Grund ist auch auf bestehende Kontraindikationen zu achten, z. B. bekannte Allergie auf Pyrazole, Leukopenie, Granulopenie. Treten Unverträglichkeiten auf, muss Metamizol sofort abgesetzt werden. |
Vorteilhaft ist, dass Metamizol in vielen verschiedenen Arzneiformen zur Verfügung steht (Tabletten, Brausetablette, Tropfen, Zäpfchen, Ampulle, Infusionslösungskonzentrat). |
|
COX2-Hemmer (selektive Cyclooxygenase-2-Hemmer) |
|||
|
Die selektive COX2-Hemmung führt zu einer leicht besseren Verträglichkeit im Magen-Darm-Bereich (Blutungen, Ulzera). Als orales Arzneimittel verfügbar sind Celecoxib und Etoricoxib. Zur parenteralen Anwendung steht Parecoxib zur Verfügung. |
Kardiovaskuläre Nebenwirkungen (Herzinfarkt, Schlaganfall, Thrombosen). Der Vorteil der besseren Magen-Darm-Verträglichkeit ist v.a. bei kurz- und mittellanger Therapie feststellbar. |
Die verfügbaren „Coxibe“ haben sehr eng definierte Indikationen, ein breiter Einsatz ist nahezu unmöglich und nicht gerechtfertigt. Die Anwendung außerhalb von zugelassenen Indikationen muss sehr kritisch betrachtet werden. |
|
|
Flupirtin |
|||
|
Anderes Wirkprinzip (neuronaler K+-Kanalöffner) als bei NSAR. Es liegen analgetische und muskelrelaxierende Wirkmechanismen vor. |
Die Einzeldosis liegt bei 100 (– 200) mg alle 4 – 6 Std. (max. 600 mg pro Tag). 400 mg Retardtabletten 1x täglich; ggf. bei > 65-jährigen Patienten mit 2 × 100 mg/d beginnen. |
Als Nebenwirkungen sind Sedierung, Schwindel, Sehstörungen, Übelkeit, Verstopfung, Hautreaktionen zu beachten. Wegen potenziell schwerer Leberschäden ist die Anwendung stark eingeschränkt worden. |
Es besteht keine Gefahr von Abhängigkeit, von Magen-Darm-Ulzera oder erhöhter Blutungsneigung. Wegen der Leberschädigungen ist der Einsatz als Schmerzmittel nur dann indiziert, wenn andere Substanzen (z.B. NSAR, Opiate) kontraindiziert sind. Keine Langzeittherapie möglich. |
|
Wirkung |
Dosierung |
Nebenwirkungen |
Bemerkungen |
|
Tramadol |
|||
|
Tramadol hat für ein Opioid eine relativ geringe analgetische Wirkung. Für mittelstarke Schmerzen ist Tramadol i. d. R. geeignet. |
Die orale Einzeldosis von 100 (– 200) mg alle 8 (– 12) Stunden soll nicht überschritten werden (max. 600 mg pro Tag). Vorteilhaft ist, dass Tramadol in vielen Darreichungsformen (Tropfen, Kapseln, Tabletten, Zäpfchen, Injektionslösung) und Dosierungen zur Verfügung steht. |
Typisch sind die Nebenwirkungen wie Übelkeit und Erbrechen, Schwitzen, Kreislaufbeschwerden. Um eine bessere Verträglichkeit zu erreichen, sollte eine Langzeitbehandlung ausschließlich mit retardierten Tramadol-retard-Tabletten durchgeführt werden. |
Eines der meistverwendeten schwachwirksamen Opioide. Eine Dosissteigerung hat oft keine Wirkungssteigerung, sondern meist nur die Verstärkung von Nebenwirkungen zur Folge. Ein Wechsel auf eine wirksamere Substanz wäre dann erforderlich. |
|
Tilidin/Naloxon |
|||
|
Als Analgetikum hat Tilidin/Naloxon eine vergleichbare Stärke wie Tramadol. |
Auch hier ist bei Dauertherapie unbedingt die retardierte Form zu verwenden. Bei schnellem Wirkeintritt (Tropfen) ist mit einer starken Euphorisierung zu rechnen. Die Wirkdauer ist mit 2 Std. relativ kurz. Die Einzelgabe soll 100 (– 200) mg als Retardtablette (alle 8 – 12 Std.) nicht überschreiten (max. 600 mg pro Tag). |
Bei nicht ausreichender Wirksamkeit ist bei Dosiserhöhung mit einer schlechteren Verträglichkeit zu rechnen. Bei Absetzen von Tilidin/Naloxon sind Entzugssymptome möglich. Sinnvoll ist ein Ausschleichen durch Dosisreduktion auch bei Verwendung von Retardformen. |
Tilidin ist immer nur zusammen mit Naloxon, einem Opiatantagonisten, im Verhältnis 100 mg/8 mg als Kombinationsarzneimittel verfügbar. Naloxon soll die missbräuchliche Verwendung des Tilidins verhindern, da Naloxon bei Opiatabhängigen eine Entzugssymptomatik auslösen kann, z. B. bei missbräuchlicher Injektion der Tilidin-Tropflösung. Zunehmend ist aber festzustellen, dass hoch dosierte Tilidin/Naloxon-Tropfen trotzdem missbräuchlich verwendet werden. |
|
Codein |
|||
|
Codein selbst hat keine analgetische Wirksamkeit. Im Organismus wird Codein zu der eigentlich aktiven Substanz (Morphin) verstoffwechselt. Da aber Umfang und Geschwindigkeit der enzymatischen Morphin-Bildung sehr unterschiedlich sein können, ist keine sichere analgetische Wirkung möglich. |
Als typische Nebenwirkung ist mit starker Obstipation zu rechnen. |
Codein zeigt in Kombination z.B. mit Paracetamol eine ausreichende analgetische Wirkung. Dazu kommt die Codein-typische antitussive Wirkung. Diese Kombination hat dadurch eine gewisse Berechtigung. |
|
|
Dihydrocodein (DHC) |
|||
|
Hat eine stärkere analgetische Wirksamkeit als Codein selbst. |
DHC ist nur als Retardtablette verfügbar, was den Einsatz bei Akutschmerzen ausschließt (Wirkbeginn nach 2 – 4 Std.). Die Einzeldosis liegt bei 60 (– 120) mg alle 8 (– 12 Std.). |
DHC ist auch in der Retardform wenig gut verträglich (Obstipation, Übelkeit, Atemdepression, Halluzinationen). |
DHC wird kaum noch eingesetzt. |
|
Wirkung |
Dosierung |
Nebenwirkungen |
Bemerkungen |
|
Morphin |
|||
|
Morphin hat eine starke analgetische Wirksamkeit. Im Vergleich zu anderen Opioiden hat Morphin eine große therapeutische Breite. Die Resorption und die Verstoffwechselung von Morphin sind sehr unterschiedlich und patientenindividuell, so kommt es durchaus zu unterschiedlichen Wirksamkeiten und Verträglichkeiten bei gleichen Dosierungen. |
Abhängig von der Darreichungsform ist ein schneller Wirkeintritt (Tropfen oder Injektion) oder eine kontinuierliche Therapie mit Retardformen möglich. Darüber hinaus kann Morphin auch peridural und intrathekal appliziert werden. Bei diesen Applikationswegen sind kleinste mg-Mengen Morphin pro 24 Std. hocheffektiv. Akute Schmerzen können mit Morphin sehr gut „titriert“ werden. Dabei werden i. v. oder s. c. zunächst 3 – 5 – 10 mg appliziert und die entsprechende analgetische Wirkung abgewartet. Bei nicht ausreichender Wirkung kann aufdosiert werden. Nach Feststellung des Morphinbedarfs kann diese Menge dann als Dauertherapie gegeben werden. |
Die Nebenwirkungen sind vergleichbar mit denen anderer starkwirksamer Opioide: Sedierung, Übelkeit, Erbrechen, Atemdepression, Obstipation, Hautreaktionen, Schwitzen, Miktionsbeschwerden. Eine Begleittherapie zur Behandlung der typischen und zu erwartenden Nebenwirkungen ist obligat. |
Mit Morphin ist eine orale, sehr individuelle Langzeittherapie möglich. Ein Wechsel des Präparates kann bei einzelnen Patienten zu Wirkungsveränderungen führen. Eine Maximaldosis pro Tag ist für Morphin nicht gegeben, die Tagesdosis in einer Dauertherapie kann sehr unterschiedlich sein und richtet sich ausschließlich nach der analgetischen Wirksamkeit und Verträglichkeit. Die orale Morphintherapie ist bei entsprechender Wirksamkeit und Verträglichkeit Therapie der ersten Wahl. Bei ausbleibendem Erfolg kann ein anderes Opioid erprobt werden. |
|
Oxycodon |
|||
|
Oxycodon ist ein enger Verwandter des Morphins, hat aber als wesentlichen Vorteil die konstantere und verlässlichere Bioverfügbarkeit (Aufnahme und Verstoffwechselung). Zusätzlich zeigt Oxycodon eine längere Wirkdauer und birgt anders als Morphin keine Gefahr der Akkumulation von wirksamen Metaboliten. Ähnlich wie Morphin hat Oxycodon eine gute Steuerbarkeit und einen schnellen Wirkeintritt. |
Die Einzeldosis bei Behandlungsbeginn soll bei 2 x 5 mg oder 2 x 10 mg pro Tag liegen. Wie bei Morphin auch sind bei Oxycodon sehr hohe Dosierungen denkbar, immer abhängig von Wirkung und Nebenwirkungen. |
Die Nebenwirkungen sind vergleichbar mit denen anderer Opioide. Oxycodon in der fixen Kombination mit Naloxon, einem Opiatantagonisten, soll die opiattypische Obstipation reduzieren und somit eine bessere Verträglichkeit bewirken. Angenommen wird, das Naloxon im Darm die Opiatrezeptoren besetzt, die somit nicht mehr von Oxycodon besetzt werden können. Auf eine Obstipationsprophylaxe kann aber dennoch nicht verzichtet werden. |
Zunächst war Oxycodon nur als Retardtablette verfügbar. Neu ist die Oxycodon-Kapsel mit rascher Freisetzung zur Akutbehandlung von Schmerzspitzen. Die Retardtablette birgt das Risiko, dass, wenn die Tablette zerteilt oder zermörsert werden sollte, die gesamte Wirkstoffmenge sofort freigesetzt wird und resorbiert werden kann. Dadurch ist es bereits zu erheblichen und toxischen Überdosierungen mit Todesfolge gekommen. Die beschriebenen positiven pharmakologischen Eigenschaften von Oxycodon führen dazu, dass diese Substanz zunehmend als Mittel der ersten Wahl angesehen werden kann. |
|
Hydromorphon |
|||
|
Hydromorphon hat ebenfalls eine große strukturelle Ähnlichkeit mit Morphin. Die pharmakologischen Vorteile gegenüber dem Morphin sind vergleichbar mit denen von Oxycodon. |
Als möglicher Vorteil kann eine bessere Verträglichkeit im Vergleich zu Morphin im Einzelfall feststellbar sein. Ansonsten gelten die Aussagen zum Oxycodon auch für Hydromorphon. |
Hydromorphon ist in verschiedenen retardierten Formen (Palladon, Jurnista) und in einer schnellfreisetzenden Form verfügbar. Zusätzlich stehen auch verschiedene Injektionslösungen zur Verfügung. Dies ermöglicht die Dauertherapie sowie die Behandlung von Schmerzspitzen. |
|
|
Buprenorphin |
|||
|
sehr starke analgetische Wirkung |
Aufgrund seiner speziellen Rezeptorwirkung hat Buprenorphin aber eine Maximaldosis (2 – 4 mg/Tag), die nicht überschritten werden darf, da sich die starke analgetische Wirkung sonst wieder abschwächt („Ceilingeffekt“). Buprenophin kann als Injektion i. v. oder s. c. appliziert werden. Eine intrathekale (in den Liquorraum) Applikation ist nicht möglich! Die orale Gabe erfolgt mit einer Sublingualtablette. Die Resorption über die Mund- und Zungenschleimhaut ist erforderlich, da die Resorption über den Darm zu einem überdurchschnittlichen Abbau der Substanz in der ersten Leberpassage führt (hoher „First-pass-Effekt“). Als dritter Applikationsweg stehen auch Buprenorphin-Pflaster (Transtec, Norspan) zur Verfügung. Diese Pflaster können bei einer Dauertherapie effektiv und für den Patienten komfortabel sein. |
Zusätzlich zu den typischen Opioidnebenwirkungen sind bei Pflastern noch lokale Reaktionen wie Hautreizungen möglich. |
Da Buprenorphin nicht nur opiatrezeptoraktivierende Eigenschaften, sondern auch eine rezeptorantagonistische Wirkung hat, kann eine Überdosierung nicht mit Naloxon behandelt werden. Dies ist besonders bei der durch Überdosierung ausgelösten Atemdepression problematisch. Außerdem ist es nicht möglich, bei Bedarf andere Opioide (z. B. Morphin als reiner Agonist) zu verabreichen. Durch die antagonistische Wirkkomponente von Buprenorphin würde es zu Schmerzen und Entzugssymptomen kommen können. Sofern unterschiedliche Schmerzintensitäten vorliegen, ist eine Pflastertherapie oft nicht geeignet. Zudem bestehen zusätzliche Risiken bei einer Therapie mit hochwirksamen ▶ Opioiden per Pflaster. |
|
Fentanyl |
|||
|
Fentanyl ist ein wesentlicher Teil der Basismedikation zur Narkose in der Anästhesie und Intensivmedizin. Für die Schmerztherapie stehen verschiedene, andere Formen zur Verfügung. |
Fentanyl-Pflaster werden bei der Behandlung chronischer und konstanter Schmerzen verwandt. Um unter einer Behandlung mit Fentanyl-Pflastern eine Bedarfsmedikation mit Fentanyl durchzuführen, stehen auch Sublingual- oder Buccaltabletten sowie Lutschtabletten in verschiedenen Stärken zur Verfügung. Die Resorption über die Mundschleimhaut ermöglicht einen Wirkeintritt innerhalb weniger Minuten. |
Nachteilig sind der langsame Wirkeintritt (ca. 12 Std.), die geringe Steuerbarkeit und die lange Auswaschphase von 12 – 24 Std. nach Pflasterentfernung. Bei falscher Anwendung kann es zu erheblichem Überdosierungen mit Atemlähmung kommen, wenn z. B. die pflasterbeklebte Hautstelle deutlich über Körpertemperatur erwärmt ist und somit eine stark beschleunigte Wirkstofffreisetzung erfolgt (Fieber, Heizkissen!). Inwieweit die typischen Opioid-Nebenwirkungen bei einer Pflasterapplikation gleich stark oder weniger stark ausgeprägt sind, ist meist individuell und patientenabhängig. Grundsätzlich ist eine gut eingestellte Dauertherapie mit relativ geringen Nebenwirkungen möglich, unabhängig von der Applikationsart. |
Der Pflasterwechsel sollte nach 72 Std. erfolgen, im Einzelfall kann auch ein Wechselintervall von 48 Std. erforderlich sein. Die Hautstelle, auf die das Pflaster geklebt wird, muss für Betreuende oder Pflegende gut erkennbar sein. Nicht selten sind Pflaster übersehen worden und das Neukleben von Pflastern führte zu Überdosierungen. Anders als beim Buprenorphin kann bei einer Behandlung mit Fentanyl(-Pflastern) bei Bedarf auch Morphin gegeben werden, z. B. in Tropfenform bei Schmerzspitzen. |
|
Piritramid |
|||
|
starke analgetische Wirkung mit relativ schnellem Wirkungseintritt |
Bei einer intravenösen Schmerztherapie kann Piritramid auch mittels PCA-Pumpen (patientenkontrollierte Analgesie, s. o.) appliziert werden. Hier kann der Patient nach festgelegten Rhythmen zusätzliche Bolusgaben abrufen, sofern die kontinuierliche Dosis bei Schmerzspitzen nicht ausreicht. Prinzipiell ist diese Pumpenapplikation auch ambulant möglich. |
Piritramid ist fast ausschließlich in der postoperativen Schmerzbehandlung i. v. oder s. c. gebräuchlich. Hierfür ist es meist Mittel der ersten Wahl. |
|
|
Pethidin |
|||
|
starke analgetische Wirkung |
Einzelgaben im Abstand von 3 – 6 Std. Die Tageshöchstmenge liegt bei 500 mg. |
Nebenwirkungen sind stärker ausgeprägt als bei den anderen Opioiden: Atemdepression, Sedierung, Schwindel, Verwirrtheit. |
Pethidin kann zur Akutbehandlung von Schmerzen eingesetzt werden. Eine Langzeittherapie ist nicht sinnvoll und potenzielle Nebenwirkungen geben Pethidin den Status des Mittels der 2. oder 3. Wahl. |
|
Methadon |
|||
|
Levomethadon hat eine starke analgetische Wirkung. Wesentlicher Unterschied zwischen Levomethadon (L-Methadon) und DL-Methadon (als Razemat) ist, dass nur die L-Form analgetisch wirksam ist. Somit entsprechen 5 mg Levomethadon 10 mg DL-Methadon in seiner analgetischen Potenz. Dieser Unterschied ist bei einem Wechsel der Methadon-Zubereitungen zwingend zu beachten! |
Anders als bei der Schmerztherapie wird Methadon, i. d. R. als DL-Methadon, als Substitutionsmedikament Opiatabhängiger eingesetzt. Hier sind die Vorteile von Methadon: orale Einnahmemöglichkeit, keine Atemdepression und Einmalgabe pro Tag. Nach einigen Tagen werden hierbei gleichmäßige Blutspiegel erreicht, sodass diese Behandlung langfristig erfolgen kann. |
Im Vergleich zu Morphin zeigt Levomethadon einen rascheren Wirkeintritt und keine Atemdepression. Die Dauer der analgetischen Wirkung ist im Vergleich zu Morphin(tropfen) verlängert. Nachteilig sind die stark schwankende Metabolisierung und Ausscheidung. Für eine orale Dauerschmerztherapie ist Levomethadon nicht gut geeignet. |
|
|
Applikationsweg |
Dosierung |
|
oral |
30 mg |
|
rektal |
15 – 30 mg |
|
subkutan |
15 mg (Anflutzeit 20 – 30 Min.) |
|
intravenös |
10 mg (Anflutzeit 5 – 10 Min.) |
|
peridural |
1 mg |
|
intraspinal |
0,1 mg |
|
Morphin p. o. (mg/24 Std.) |
Morphin i. m. (mg/24 Std.) |
Fentanyl i. v. (mg/24 Std.) |
Fentanyl TTS (µg/Std.) |
|
bis 30 |
bis 10 |
0,3 |
12,5 |
|
bis 90 |
10 – 22 |
0,6 |
25 |
|
bis 150 |
23 – 37 |
1,2 |
50 |
|
bis 210 |
38 – 52 |
1,8 |
75 |
|
bis 270 |
53 – 67 |
2,4 |
100 |
|
Opioid |
Dosierung |
|
Morphin p. o. |
10 mg |
|
Oxycodon p. o. |
5 mg |
|
Hydromorphon p. o. |
2 mg |
|
L-Methadon p. o. |
3 mg |
|
Buprenorphin s. l. |
0,2 mg |
|
Piritramid s. c. |
15 mg |
|
Pethidin |
80 mg |
|
Dihydrocodein p. o. |
60 mg |
|
Tilidin/Naloxon p.o. |
100 mg |
|
Tramadol p. o. |
100 mg |
|
Codein p. o. |
100 mg |
Nebenwirkungen Prinzipiell sind die typischen Nebenwirkungen dieser Gruppe bei allen Substanzen zu erwarten (Atemdepression, Abhängigkeit, Sucht, Obstipation und Miktionsstörungen, Nausea und Erbrechen, Toleranzentwicklung). Individuell ist aber die Verträglichkeit bei verschiedenen Substanzen oder verschiedenen Darreichungsformen gut möglich. Die Entwicklung einer psychischen Medikamentenabhängigkeit bzw. -sucht ist bei der Behandlung von (akuten oder chronischen) Schmerzen nicht zu erwarten. Eine körperliche Abhängigkeit (Gewöhnung) zeigt sich durch Auftreten von Entzugssymptomen bei abruptem Absetzen. Daher sollte die Dosisreduktion stets schrittweise erfolgen.
Das allgemein bekannte Suchtpotenzial basiert auf der missbräuchlichen Verwendung als Suchtmittel. Diese schwierige, aber für die Behandlung notwendige Differenzierung hat den Opioiden einen Ruf eingebracht, der im Zusammenhang einer wirksamen und effektiven Schmerztherapie lange Zeit nachteilig war. Aus Sorge um die Gefahr einer Abhängigkeit wurde oftmals auf diese potenten Wirkstoffe verzichtet und mit weniger wirksamen, dafür hoch dosierten Substanzen therapiert. Nicht selten kam es dann zu erheblichen Nebenwirkungen, gerade wegen der notwendigen hohen oder maximalen Dosierung. Auch ist teilweise die Verordnung als Betäubungsmittel hinderlich für die Verordnung, da sich der verordnende Arzt exakt an die besonderen Dokumentations- und Verordnungsregeln halten muss.
Starkwirkende Opioidanalgetika
Als Leitsubstanz der starkwirkenden Opioide hat Morphin, ein natürliches Alkaloid des Schlafmohns (Papaver somniferum), eine sehr lange Geschichte als Schmerzmittel.
45.4.5.3 Koanalgetika
Kortikoide
Die wichtigste Gruppe der Koanalgetika sind die Kortikoide mit ihren eigenen antiphlogistischen und antiödematösen Wirkungen. Bei vielen chronischen Schmerzen aufgrund von Tumoren, Nervenläsionen oder Ödemen ist die Kombination sinnvoll und effektiv. Allerdings sollte diese Zusatzmedikation nur über wenige Tage bis Wochen durchgeführt werden. Meist wird hier Dexamethason eingesetzt, welches eine rein glukokortikoide Wirkung und eine relativ lange Wirkdauer hat.
Kontraindikationen sind zu beachten (Infektionen, Magen-Darm-Ulzera, Diabetes, Osteoporose). Die typischen Kortikoid-Nebenwirkungen sind: Nebennierensuppression, Magen-Darm-Ulzera, Osteoporose. Die gleichzeitige Gabe von NSAR sollte vermieden werden, um das Risiko von Magen-Darm-Ulzera zu begrenzen. In der akuten Situation ist die i. v.-Applikation vorteilhaft. Daran schließt sich eine orale Erhaltungsdosis an, die am Ende der Behandlung langsam ausgeschlichen werden soll.
Trizyklische Antidepressiva
Bei neuropathischen Schmerzen kann die analgetische Teilwirkung der trizyklischen Antidepressiva die Wirkung der Analgetika effektiv unterstützen. Auch bei anderen Schmerzursachen ergibt sich eine Wirkungsverstärkung der eigentlichen Analgetika. Die typischen Vertreter dieser Gruppe sind: Amitryptilin, Doxepin, Imipramin, Clomipramin, Nortriptylin. Die unterschiedlichen psychogenen Wirkungen der einzelnen Substanzen können je nach individueller Gegebenheit die Therapie unterstützen.
Patienten mit chronischen Schmerzen oder Tumorschmerzen haben oftmals auch behandlungsbedürftige psychogene Symptome. Amitryptilin ist indiziert wegen seiner antriebshemmenden und anxiolytischen Wirkung, Imipramin wird wegen seiner antriebssteigernden Wirkung eingesetzt. Um die typischen Nebenwirkungen der trizyklischen Antidepressiva (Kreislaufdysregulation, Obstipation, Schwindel, Mundtrockenheit) möglichst zu vermeiden, werden diese Substanzen langsam einschleichend dosiert.
Antikonvulsiva
Antikonvulsiva sind wesentliche Bausteine einer Therapie von chronischen neuropathischen Schmerzen. Die in diesem Zusammenhang am längsten verwendete Substanz ist Carbamazepin. Gabapentin und Pregabalin sind im Laufe der letzten Jahre dazugekommen. Das Einsatzgebiet ist breit und alle Formen von neuropathischen Schmerzen, Neuralgien, Phantomschmerzen und diverse Tumorschmerzen sind in Kombination mit diesen Antikonvulsiva behandelbar.
Vergleichbar mit den Antidepressiva werden auch die Antikonvulsiva langsam einschleichend dosiert. Limitierend ist oft die Verträglichkeit. Insbesondere Müdigkeit, Schwindel und Übelkeit können die Akzeptanz mindern und den Therapieerfolg gefährden. I.d.R. wird mit Carbamazepin oder Gabapentin als Standardsubstanzen begonnen. Bei fehlendem Erfolg oder schlechter Verträglichkeit kann auf Pregabalin gewechselt werden.
Neuroleptika
Neuroleptika werden zunehmend seltener bei chronischen Schmerzen eingesetzt, sofern nicht primäre Symptome für die Behandlung mit Neuroleptika vorliegen. Grund dafür ist die relativ schlechte Verträglichkeit vieler Neuroleptika (Mundtrockenheit, Obstipation, Miktionsstörungen, Verwirrtheit, extrapyramidale Störungen). Der Einsatz von niedrig dosiertem Haloperidol ist unter dem Aspekt der antiemetischen (den Brechreiz mindernden) Wirkung möglich. Patienten mit starker Unruhe und Angst könnten von Levomepromazin oder Prometazin profitieren.
Muskelrelaxanzien
Muskelrelaxanzien kommen bei der Behandlung von Rückenschmerzen oder Spastiken zum Einsatz. Wegen z.T. erheblichen Nebenwirkungen wurde die breite Verwendung von Methocarbamol (Ortoton), Baclofen, Tizanidin oder Tolperison stark reglementiert und eingeschränkt.
Bisphosphonate
Bisphosphonate haben eine zunehmende Bedeutung bei der Behandlung von Knochenschmerzen bekommen. Ursächlich kann es sich hier um Osteoporose, Knochenmetastasen, Hyperkalzämie oder ein Multiples Myelom handeln. Bisphosphonate binden spezifisch an das Kalzium-Phosphat im Knochen und greifen so in den Knochenstoffwechsel ein.
Bisphosphonate werden, abhängig von der Indikation, sehr unterschiedlich dosiert. Bei der tumorbedingten Hyperkalzämie sind meist monatliche Infusionen mit Pamidronat oder Zoledronat ausreichend. Die Bisphosphonattherapie der Osteoporose ist sehr viel differenzierter. Alendronat kann oral täglich (10 mg) oder wöchentlich (70 mg) gegeben werden. Ibandronat kann oral monatlich (150 mg) oder intravenös dreimonatlich (3 mg) gegeben werden. Mit Zoledronat ist eine Behandlung mit 5 mg einmal pro Jahr vergleichbar in der Wirkung.
Als typische Nebenwirkung einer Infusionstherapie gelten grippeähnliche Symptome wie Fieber und Schüttelfrost, Muskel- und Gelenkschmerzen, Herz-Kreislauf-Probleme, Übelkeit und Erbrechen. Substanzspezifisch für eine orale Bisphosphonat-Gabe ist, dass die Bioverfügbarkeit außerordentlich gering ist (2 – 3 %). Ebenfalls sind die Einnahmehinweise für die Tabletteneinnahme strikt zu beachten: 30 Min. vor und nach der Einnahme kein Essen oder Trinken, 30 Min. nach der Einnahme nicht hinlegen.
45.4.5.4 Behandlung von analgetikabedingten Nebenwirkungen
Obstipation
Eine Behandlung mit Opioidanalgetika muss mit einer prophylaktischen Laxanziengabe einhergehen. Erfolgt dies nicht, kann eine schwere, behandlungsbedürftige Obstipation mit ileusartigen Symptomen massive Schmerzen verursachen. Mittel der Wahl für eine Dauertherapie sind stuhlaufweichende Mittel wie Macrogol und Laktulose.
Der Wirkeintritt bei Macrogol-Gabe ist mit 24 – 48 Std. etwas verzögert. Vorteil ist aber, dass bei der Einnahme bereits mindestens 125 ml pro Beutel getrunken werden müssen (bis zu 5 Btl./Tag) und dass keine Blähungen zu erwarten sind. Die Einnahme von Laktulose ist fast immer mit starken Blähungen verbunden. Der Wirkeintritt ist mit 6 – 8 Std. schneller als bei Macrogol.
Sofern eine zusätzliche abführende Behandlung erforderlich ist, kann diese mit Bisacodyl oder Natriumpicosulfat durchgeführt werden. Bisacodyl (oral) wird meist abends eingenommen, da der Wirkeintritt mit ca. 10 Std. deutlich verzögert ist. Bisacodyl-Zäpfchen wirken jedoch deutlich schneller, hier ist mit dem Wirkeintritt innerhalb von 30 Min. zu rechnen. Die Wirkung von Natriumpicosulfat kann nach 2 – 3 Std. eintreten.
Gleitmittel wie Paraffinöl können alternativ zu den stuhlaufweichenden Mitteln und interventionell gegeben werden. Der Wirkeintritt ist verzögert (ca. 12 Std.) und eine Dauertherapie kann zu einer verminderten Aufnahme von fettlöslichen Vitaminen im Darm führen. Zum schnellen Abführen können auch Klistiere oder Einläufe appliziert werden.
Prävention und Gesundheitsförderung
Um mit möglichst wenig Laxanzien auszukommen, gehören zur Obstipationsprophylaxe grundsätzlich die ballaststoffreiche Ernährung und reichliches Trinken.
Übelkeit und Erbrechen
Übelkeit und Erbrechen sind typische und bei Behandlungsbeginn mit hoher Wahrscheinlichkeit auftretende Begleiterscheinungen einer Opioidtherapie. Anders als bei der Obstipation kann damit gerechnet werden, dass innerhalb von 2 – 4 Wochen diese Nebenwirkungen deutlich nachlassen und nicht dauerhaft behandlungsbedürftig sind.
Zunächst ist bei Opioidgabe die Gabe eines Antiemetikums notwendig. Typischerweise wird hier MCP (Metoclopramid), Dimenhydrinat, Domperidon oder ein 5HT- 3-Antagonist wie Ondansetron oder Granisetron verwendet. Sofern dies nicht ausreichend effektiv ist, kann mit niedrig dosiertem Haloperidol oder Dexamethason ergänzt werden.
Wenn eine dauerhafte Opioidtherapie erforderlich ist und diese Nebenwirkung medikamentös nicht ausreichend gut behandelt werden kann, ergibt sich u. U. die Notwendigkeit, ein anderes Opioid oder einen anderen Applikationsweg zu probieren. Gerade bezüglich der Verträglichkeit unter Dauertherapie sind Unterschiede zwischen verschiedenen Opioiden sowie zwischen verschiedenen Zubereitungen der gleichen Wirksubstanz feststellbar. Das Ziel muss sein, eine verträgliche Dauertherapie zu finden, um möglichst geringe zusätzliche Einschränkungen der Lebensqualität durch die Medikation zu realisieren.
|
Arzneimittel |
Darreichungsform |
Dosierung |
|
starke Rückenschmerzen |
||
|
Ibuprofen |
600 mg |
1 – 1 – 1 |
|
Methocarbamol |
500 mg |
2 – 2 – 2 |
|
Amitryptilin |
50 mg retard |
1 – 0 – 0 |
|
Gabapentin |
600 mg |
1 – 1 – 1 |
|
Omeprazol |
20 mg |
0 – 0 – 1 |
|
tumorbedingte Schmerzen (I) |
||
|
Hydromorphon |
8 mg retard Kapseln |
1 – 0 – 1 |
|
Hydromorphon |
1,3 mg Kapseln |
bei Bedarf |
|
MCP |
10 mg Tabletten |
1 – 1 – 1 |
|
Macrogol |
Beutel |
1 – 1 – 1 – 1 |
|
Dexamethason |
8 mg Tabletten |
1 – 0 – 1 |
|
tumorbedingte Schmerzen (II) |
||
|
Fentanyl TTS |
50 µg/Std. Pflaster |
1 – 0 – 0 Wechsel nach 72 Std. |
|
Fentanyl |
400 µg Lutschtabletten |
bei Bedarf |
|
Granisetron |
2 mg Tabletten |
1 – 0 – 0 |
|
Na-picosulfat |
Tropfen |
30 – 0 – 0 |
|
Macrogol |
Beutel |
1 – 1 – 1 – 1 |
|
Amitryptilin |
75 mg retard |
0 – 0 – 0 – 1 |
|
Wirkstoff |
Handelspräparate |
Darreichungsformen |
Wirkstärken |
|
|
Acetylsalizylsäure (ASS) |
Aspirin ASS-Generika |
Tablette, Brausetablette, Pulver zur Inj. |
meist 500 mg |
1000 mg |
|
Ibuprofen |
Imbun Ibuprofen-Generika Nurofen junior |
Tablette, Kapsel, Granulat, Suppositorium Creme, Gel Saft Suppositorium |
200 – 800 mg 300 – 600 mg 2 %ig, 4 %ig 60, 125 mg |
|
|
Naproxen |
Naproxen-Generika |
Tablette |
250, 500, 750 mg |
|
|
Diclofenac |
Voltaren Diclofenac-Generika |
Tablette, Kapsel, Brausetablette Injektionslösung Creme, Gel |
25, 50 mg 75 – 100 mg retardiert 75 mg |
|
|
Indometacin |
Indometacin-Generika |
Kapsel, Tablette Retardkapsel Suppositorium Gel, Spray |
25, 50 mg 75 mg 50,100 mg |
|
|
Paracetamol |
Ben-u-ron Paracetamol-Generika |
Tablette Suppositorium Saft Infusionslösung |
500, 1000 mg 125 – 1000 mg 200 mg/5 ml 500, 1000 mg |
|
|
Metamizol |
Novalgin Metamizol bzw. Novaminsulfon- Generika |
Tablette, Brausetablette Suppositorium Injektionslösung Tropfen |
500 mg 300, 1000 mg 1000, 2500 mg 500 mg/ml |
|
|
Celecoxib |
Celebrex |
Kapsel |
100, 200 mg |
|
|
Etoricoxib |
Arcoxia |
Tablette |
60, 90, 120 mg |
|
|
Parecoxib |
Dynastat |
Pulver zur Infusion |
40 mg |
|
|
Tolperison |
Mydocalm, Viveo Tolperison-Generika |
Tablette |
50, 150 mg |
|
|
Tramadol |
Tramal Tramadol-Generika |
Tablette, Kapsel Retardtablette, -kapsel Tropfen Injektionslösung Suppositorium |
50 mg 50, 100, 150, 200 mg 100 mg/ml 50, 100 mg 100 mg |
|
|
Tilidin/Naloxon |
Valoron N Tilidin/Naloxon-Generika |
Kapsel Retardtablette Tropfen |
50/4 mg 50/4, 100/8, 150/12, 200/16 mg 70/6 mg/ml |
|
|
Codein |
Codein-Generika |
Tablette, Retardtabl. Tropfen |
30 – 50 mg |
|
|
Dihydrocodein |
DHC |
Retardtablette |
60, 90, 120 mg |
|
|
Morphin |
Morphin-Generika Sevredol MST, MSI, MSR Oramorph |
Tablette, Kapsel Tropfen Trinkampullen Retardkapsel, -tabl. Retardgranulat Suppositorium Injektionslösung |
10 – 30 mg 0,5 %, 2 % 10 – 100 mg 10 – 100 mg 20 – 200 mg 10 – 30 mg 10, 20, 100, 200 mg |
|
|
Oxycodon |
Oxygesic Oxycodon-Generika |
Retardtablette Kapsel Injektionslösung |
5 – 80 mg 5 – 20 mg 10, 20 mg |
|
|
Oxycodon/Naloxon |
Targin |
Retardtablette |
5/2,5, 10/5, 20/10, 40/20 mg |
|
|
Hydromorphon |
Palladon, Hydromorphon-Generika Jurnista |
Retardkapsel (2x tgl.) Retardtablette (1x tgl.) Kapsel Injektionslösung |
4, 8, 16, 24 mg 8, 16, 32, 64 mg 1,3 mg, 2,6 mg 2, 10, 100 mg |
|
|
Buprenorphin |
Temgesic Transtec Pro Norspan Buprenorphin-Generika |
Sublingualtabl. Injektionslösung Pflaster Pflaster |
0,2 mg, 0,4 mg 0,3 mg 35 μg/Std., 52,5 μg/Std., 70 μg/Std. 5 – 20 μg/Std. |
|
|
Fentanyl |
Durogesic SMAT Fentanyl-Generika Actiq, Effentora u.a. |
Pflaster Injektionslösung Lutsch-, Buccal, Sublingualtabl |
12,5 μg/Std. bis 100 μg/Std. 0,1 mg, 0,5 mg 200 – 1600 μg |
|
|
Piritramid |
Dipidolor und Generika |
Injektionslösung |
7,5 mg, 15 mg |
|
|
Pethidin |
Dolantin Pethidin-Generika |
Injektionslösung Tropfen Suppositorium |
50, 100 mg 50 mg/ml 100 mg |
|
|
L-Methadon |
Polamidon |
Tropfen Injektionslösung |
5 mg/ml 2,5 mg, 5 mg |
|
Magen-Darm-Ulzera
Die gastrointestinale Toxizität der NSAR macht bei Vorliegen von Risikofaktoren (Alter, bereits erlebte Magenblutungen oder Ulzera) und bei einer Dauertherapie die zusätzliche Gabe von Protonenpumpen-Inhibitoren (PPI) notwendig. Leitsubstanz dieser Gruppe ist Omeprazol. Andere verfügbare PPI (Pantoprazol, Esomeprazol, Lansoprazol) zeigen keine substanziellen Vorteile. Bei Unverträglichkeit kann ein Wechsel sinnvoll sein. Überwiegend ist eine Einmalgabe abends, wegen der besseren Verträglichkeit, ausreichend. Antazida und H2-Antihistaminika (z. B. Ranitidin oder Famotidin) sind als Begleittherapie nicht ausreichend und deshalb nicht indiziert.
45.5 Lern- und Leseservice
45.5.1 Literatur
[2350] Arbeitskreis Schmerz und Alter. Beurteilung von Schmerzen bei Demenz.
[2351] Becker M et al. Nationale und internationale Leitlinien. In: Pogatzki-Zahn EM, Van Aken HK, Zahn P, Hrsg. Postoperative Schmerztherapie. Stuttgart: Thieme; 2008
[2352] Carr ECJ, Mann EM, Osterbrink J, Hrsg. Schmerz und Schmerzmanagement. Bern: Huber; 2009
[2353] Deutsches Netzwerk zur Qualitätsentwicklung in der Pflege (DNQP). Expertenstandard Schmerzmanagement in der Pflege bei akuten Schmerzen. 1. Überarbeitung; Osnabrück; 2011
[2354] Deutsches Netzwerk zur Qualitätsentwicklung in der Pflege (DNQP). Expertenstandard Schmerzmanagement in der Pflege bei chronischen Schmerzen. Osnabrück; 2015
[2355] Doll A, Hummel-Gaatz S. Lernfeld Beratung in der Pflege. Printernet 2006; 4: 206–217
[2356] Ferrell BR. Schmerz-Auswirkungen auf die Lebensqualität. Pflege Aktuell 2000; 2: 76–78
[2357] Fletcher D, Fermanian C, Mardaye A, Aegerter P. A patient-based national survey on postoperative pain management in France reveals significant achievements and persistent challenges. PAIN 2008; 137: 441–451
[2358] Handel E. Hrsg. Praxishandbuch ZOPA. Bern: Huber; 2010
[2359] Herr K, Garand L. Assessment and Measurement of pain in older adults. Clin Geritr Med 2001; 17 (3): 457–78
[2360] Hicks et al. The Faces Pain Scale – Revised: toward a common metric in pediatric pain measurement, PAIN 2001; 93: 173–183
[2361] Hoffmann E. Akutschmerztherapie im Kindesalter. In: Meißner W, Hrsg. Akutschmerz Taschenbuch. Berlin: MWV; 2015
[2362] Kunz R. Schmerzerfassung bei Patienten mit Demenzerkrankungen. Geriatrie Journal 2002; (6): 14–24
[2363] Landendörfer P, Hesselbarth S. Schmerzbeurteilung bei „sprachlosen“ Patienten. Der Allgemeinarzt 2003; 10: 822–828
[2364] Maier C, Nestler N, Richter H, Hardinghaus W, Pogatzki-Zahn E, Zenz M. Qualität der Schmerztherapie in deutschen Krankenhäusern. Dtsch Arztebl Int 2010; 107: 607–14
[2365] Marcus DA. Chronic pain: a primary care guide to practical management. Totowa: Humana Press; 2009
[2366] McCaffery M, Beebe A, Latham J, Osterbrink J, Hrsg. Schmerz. Handbuch für die Pflegepraxis. Wiesbaden: Ullstein Mosby; 1997
[2367] Müller-Busch C. Kreativ gegen akute Schmerzen. Richtiger Umgang mit der Pein (04.04.2007)
[2368] Nauck F, Klaschik E. Schmerztherapie, Kompendium für Ausbildung und Praxis. Stuttgart: Wissenschaftliche Verlagsgesellschaft; 2002
[2369] Osterbrink J. Tiefe Atementspannung: Einfluß auf Inzisionsschmerz, Angst und Leiden bei Patienten in der postoperativen Frühphase. Bern: Huber; 1999
[2370] Osterbrink J. Schmerz als pflegerischer Kompetenzbereich. Die Schwester/Der Pfleger 2000; 4: 311–317
[2371] Osterbrink J. Schmerz und Pflege – eine Herausforderung. KrankenPflege Journal 2001; 39: 182–185
[2372] Osterbrink J, Ewers A, Nestler N. Pflegerische Aspekte der postoperativen Schmerztherapie. In: Pogatzki-Zahn EM, Van Aken HK, Zahn P, Hrsg. Postoperative Schmerztherapie. Stuttgart: Thieme; 2008
[2373] Pogatzki-Zahn EM, Van Aken HK, Zahn P, Hrsg. Postoperative Schmerztherapie. Stuttgart: Thieme; 2008
[2374] Sirsch E, Gnass I. Wer sich melden kann, ist gut dran. Pflegezeitschrift 2011; Jg. 64 (10): 602–605
[2375] Stamer U, Meißner W. Schmerzmessung und Schmerzdokumentation. In: Pogatzki-Zahn EM, Van Aken HK, Zahn P, Hrsg. Postoperative Schmerztherapie. Stuttgart: Thieme; 2007
[2376] Thoden U. Transkutane elektrische Nervenstimulation (TENS) in der Schmerzbehandlung. In: Zenz, M, Jurna I. Lehrbuch der Schmerztherapie. Stuttgart: Wissenschaftliche Verlagsgesellschaft; 2001
[2377] Zenz M, Jurna I. Lehrbuch der Schmerztherapie. Stuttgart: Wissenschaftliche Verlagsgesellschaft; 2001
[2378] Zernikow B, Hrsg. Schmerztherapie bei Kindern. Heidelberg: Springer; 2003
[2379] Zwakhalen S, Hamers J, Abu-Saad H, Berger M. Pain in elderly people with severe dementia: A systematic review of behavioural pain assessment tools. BMC Geriatrics; Januar 2006. Im Internet: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1397844/?tool=pubmed; Stand: 18.12.2016
45.5.2 Kontakt- und Internetadressen
[2380] Deutsche Schmerzgesellschaft e.V., Bundesgeschäftsstelle, Alt-Moabit 101 b, 10559 Berlin, Tel: 030/39 409 689–0, Fax: 030/39 409 689–9, E-mail: info@dgss.org, Im Internet: www.dgss.org; Stand: 18.12.2016
[2381] Deutsche Migräne- und Kopfschmerzgesellschaft. Im Internet: http://www.dmkg.de; Stand: 18.12.2016
[2382] Deutsches Netzwerk zur Qualitätsentwicklung in der Pflege, Geschäftsstelle: Caprivistraße 30a, 49076 Osnabrück, Tel: 0541/969–2004, Fax: 0541/969–2971, E-Mail: dnqp@fh-osnabrueck.de, Im Internet: http://www.dnqp.de; Stand: 18.12.2016
[2383] Deutsche Gesellschaft für Palliativmedizin. E-Mail: dgp@dgpalliativmedizin.de, Im Internet: http://www.dgpalliativmedizin.de; Stand: 18.12.2016
[2384] Deutsche Stiftung Patientenschutz, Europaplatz 7, 44269 Dortmund, Telefon: 0231 738 073–0, Fax: 0231/738 073–1. Im Internet: https://www.stiftung-patientenschutz.de; Stand: 07.03.2017
[2385] http://www.tens.de; Stand: 18.12.2016