L’évolution en marche
L’apparition des espèces en direct
Souvent pinson varie
Depuis le passage de Charles Darwin aux Galápagos, les animaux de l’archipel, auréolés de prestige, sont protégés en tant que témoins privilégiés du grand laboratoire naturel de la biodiversité. Sur ces îles volcaniques à la végétation maigre, pas si paradisiaques qu’on aimerait l’imaginer, certaines espèces de pinsons se sont spécialisées dans la collecte des graines au sol, d’autres ont choisi les larves, voire les tiques accrochées aux iguanes. Les plus malins de ces oiseaux sont le géospize des mangroves, capable d’utiliser des brindilles pour extraire des larves d’insectes, et le géospize pique-bois, qui a appris à se servir d’une épine de cactus pour attraper les termites, un peu à la mode chimpanzé. Le plus étrange de tous, le géospize à bec pointu, grimpe sur de gros oiseaux, par exemple des fous, pique leurs veines avec son bec pointu et leur suce le sang à la mode vampire… Toutes ces espèces sont issues d’une seule espèce mère, arrivée sur les lieux voici quelque deux à trois millions d’années. On appelle ce processus de spéciations multiples la radiation adaptative.
Les géospizes sont étudiés sur le terrain depuis 1973, soit plus d’une trentaine d’années, par les zoologistes Rosemary et Peter Grant et leur équipe. Jamais auparavant des animaux sauvages n’avaient ainsi été observés sur un laps de temps assez long pour évaluer leurs variations sur plusieurs générations. Les chercheurs se sont penchés sur deux espèces en particulier : le géospize à bec moyen et le géospize des cactus. Sur l’île Daphne Major, quasiment tous les oiseaux de ces espèces ont été capturés au filet et bagués avec des couleurs visibles et distinctes. Ils pouvaient donc être identifiés et étudiés de loin, sans intervention humaine. En 1977, une sécheresse entraîna la raréfaction de la nourriture et la mort des oiseaux les plus petits – 180 survivants sur 1 200 oiseaux au départ ! Les survivants, les plus grands, avaient aussi un bec plus grand, ces deux caractères étant liés. Une deuxième sécheresse en 1982 eut les mêmes effets. Entre les périodes de sécheresse, les becs revenaient vers des structures plus légères.
Les becs des uns et des autres ont évolué en quelques générations : les pinsons nous ont montré que l’adaptation au milieu par la sélection naturelle peut se révéler bien plus rapide que ne le pensait leur découvreur ! Darwin en a rêvé, des chercheurs du XXe siècle l’ont quantifié.
Le phénomène d’apparition des espèces peut donc venir, comme l’avait suggéré Darwin, d’un isolement géographique : chaque population repliée sur elle-même évolue différemment de ses populations sœurs et donne de nouvelles formes. Pourtant, d’autres observations montrent que de nouvelles espèces peuvent également apparaître en un même lieu, au sein de populations qui se côtoient.
Les poissons de Darwin
Les lacs sont des îles à l’envers : ce ne sont pas des morceaux de terre entourés d’eau, mais des parcelles d’eau isolées par des terres. Tout logiquement, l’évolution visible des pinsons de Darwin aux Galápagos a son équivalent aquatique. Charles Darwin connaissait l’existence des cichlidés des lacs africains et leurs couleurs éclatantes, mais il n’avait pas eu l’occasion de les étudier. Ces poissons sont pourtant des cas d’école pour l’étude de l’apparition des espèces et leur diversité. Le livre du biologiste néerlandais Tijs Goldschmidt Le Vivier de Darwin1 a révélé au public l’extrême variété des poissons cichlidés du lac Victoria. Appelés localement furus, ces poissons, tous du genre Haplochromis, sont proches de notre perche. Ils montrent un autre cas de radiation adaptative : une seule espèce ancestrale en a donné environ quatre cents différentes ! Dans deux lacs voisins, le Malawi et le Tanganyika, deux autres radiations, totalement indépendantes, se sont également déroulées.
Tout comme les pinsons de Darwin, les furus ont « essaimé » dans le lac Victoria en espèces très spécialisées. On trouve les happeurs de vase, les mangeurs d’algues, les hacheurs de feuilles, les briseurs d’escargots, les videurs d’escargots, les mangeurs de zooplancton, les insectivores, les mangeurs de crevettes, les piscivores (qui regroupent à eux seuls plus de cent trente espèces), les nettoyeurs (qui débarrassent les autres de leurs parasites), les incroyables mangeurs d’écailles (que l’on pourrait rapprocher des géospizes suceurs de sang) et les surprenants pédophages.
Chez tous les furus de Victoria, les femelles gardent leurs œufs et leurs alevins dans la bouche. En cas de danger, les petits qui se sont risqués au-dehors se précipitent entre les dents de la mère ! Or, vingt-quatre espèces de cichlidés dits pédophages (ou « mangeurs d’enfants ») se sont spécialisées dans la capture des œufs ou des embryons. On peut analyser leur alimentation par le contenu de leur estomac, mais on connaît mal la manière dont ils saisissent leur nourriture. Certains guettent les parades nuptiales et la ponte avant de se précipiter. D’autres, en aquarium, ont « embrassé » une femelle couveuse, lui retournant le museau pour en extirper sa progéniture. Dans le lac Malawi, des pédophages foncent par surprise sur une femelle et lui frappent la gorge ou la bouche. La stratégie originale de protection des petits par certains poissons a entraîné une prédation adaptée tout aussi originale.
Des poissons droitiers et des gauchers
Les différents lacs africains contiennent un millier d’espèces de cichlidés. En faisant un zoom arrière sur la planète, on constate que les cichlidés sont apparus auparavant dans les lacs et les fleuves d’Amérique centrale et du Sud, en Afrique, à Madagascar et en Asie. Toutes ces espèces sont issues d’un ancêtre commun. Le plus étrange est que des espèces très semblables sont apparues de manière totalement indépendante, tels les mangeurs d’algues des lacs Tanganyika, Malawi et Victoria. Ces poissons ont non seulement les mêmes régimes, mais aussi les mêmes morphologies ! Ce sont des cas typiques de convergence évolutive : les études génétiques montrent que ces animaux de même apparence sont moins proches les uns des autres qu’ils ne le sont des poissons du même lac qu’eux, alors que ces derniers ne leur ressemblent pas.
Le lac Victoria ne recèle qu’une seule espèce connue de mangeur d’écailles. Beaucoup plus ancien que Victoria, le lac Tanganyika n’en compte pas moins de sept. Ces poissons se nourrissent en arrachant par surprise des petits morceaux d’écailles à leurs collègues fréquentant les mêmes eaux. Les cichlidés du Tanganyika, qui appartiennent au genre Perissodus, ont une particularité que ne possède pas l’Haplochromis du Victoria : ils ont une gueule asymétrique qui les spécialise dans l’attaque soit par la droite soit par la gauche ! Michio Hori a étudié pendant des années l’espèce la plus commune, Perissodus microlepsis. Il s’est aperçu que les droitiers, c’est-à-dire droitiers par la forme de la bouche, attaquaient systématiquement leurs victimes par la gauche, et que les gauchers mordaient le flanc droit ! Les analyses de leurs estomacs prouvent qu’il n’y a qu’une sorte d’écaille présente, du flanc droit ou du flanc gauche, selon les mœurs de l’animal observé. Si l’une de ces variations, attaquant droitier ou gaucher, devenait plus fréquente que l’autre, les victimes finiraient par se méfier, ce qui désavantagerait les agresseurs aux variations majoritaires. Or, d’après la fréquence de l’emplacement des cicatrices sur les victimes, Hori a établi que les deux spécialisations oscillent autour d’une proportion égale. Le maintien de cet équilibre est appelé « sélection naturelle par la fréquence ».
Les poissons droitiers et gauchers nous montrent que la spécialisation dans l’exploitation des ressources du milieu joue un rôle clé dans l’apparition de nouvelles formes et de nouvelles espèces, qu’elles soient géographiquement séparées (comme les pinsons de Darwin) ou présentes dans un même lieu (comme les poissons de Darwin). Les îles restent donc d’excellents lieux d’études de l’évolution, comme nous le montrent les lézards croates.
L’évolution fulgurante des lézards croates
L’histoire commence par un croisement entre conflits animaliers et humains. En 1971, des biologistes capturent cinq couples de lézards des ruines dans une petite île yougoslave pour les introduire dans un îlot voisin de 0,03 kilomètre carré, Pod Mrcaru. Leur but : observer la compétition entre le reptile et son cousin local, le lézard de l’Adriatique. En fait, c’est une compétition entre humains qui survient, la guerre interyougoslave ; l’expérience est interrompue ! En 2004, après plus de trente ans d’absence, des biologistes réinvestissent enfin les lieux. Et vont de surprise en surprise.
Tout d’abord, les nouveaux venus ont éliminé les lézards locaux. Ensuite, ils sont plus d’un millier ! Comment peuvent-ils survivre dans un espace aussi restreint ? En étudiant ces lézards des ruines de plus près, les scientifiques notent des différences étonnantes avec leur forme d’origine. Les reptiles sont plus grands, ils ont les pattes plus courtes et la tête plus longue. Leur contenu stomacal révèle qu’ils sont en partie devenus herbivores, caractéristique rare chez ce genre d’animaux. Leur morphologie s’est adaptée au nouveau régime : leur mâchoire est plus puissante, et ils n’ont pas besoin de courir pour attraper leurs proies. Plus étonnant encore, des muscles nouveaux sont apparus entre l’intestin grêle et le gros intestin, des valves permettant le ralentissement de la digestion de la nourriture fibreuse. Last but not least, des vers nématodes se sont installés dans ces chambres de fermentation ! Habituellement parasites des reptiles, les nématodes sont ici des partenaires puisqu’ils digèrent la cellulose. Sans s’être tout à fait transmutés en une nouvelle espèce, les lézards des ruines croates montrent la rapidité parfois fulgurante de l’évolution.
L’apparition des espèces, ou spéciation
La spéciation à partir d’une espèce initiale est un processus généralement plus lent que les radiations de cichlidés des lacs africains ou l’évolution des lézards des ruines. Elle peut durer des milliers, voire des dizaines de milliers d’années. L’isolement géographique est un des scénarios proposés pour expliquer la spéciation. Ainsi, dans la région de Juyong Guan, près de Pékin, des botanistes chinois ont trouvé des différences génétiques dans six familles de plantes selon qu’elles poussaient d’un côté ou de l’autre de la Grande Muraille ! Le début de ces spéciations est daté de six cents ans, période à laquelle le tronçon de la muraille qu’ils ont étudié a été dressé.
Les espaces restreints forment d’autres barrières d’isolement. Une espèce d’escargot aquatique n’existe que dans une seule source sur la planète, sa répartition mondiale ne représentant que quelques mètres carrés. D’autre part, dans chaque grotte des Pyrénées, on trouve au moins un insecte unique, qui n’existe nulle part ailleurs.
L’anneau est une autre forme d’isolement géographique. Ainsi, la population d’un petit oiseau discret, le pouillot verdâtre, est distribuée en anneau autour de l’Himalaya. En suivant l’anneau depuis sa base, on rencontre des races géographiques (ou sous-espèces) légèrement différentes, mais qui se reproduisent entre elles. Cependant, arrivé à l’autre bout de l’anneau, l’accumulation des modifications génétiques est devenue telle que les deux variétés de pouillots cohabitent sans s’hybrider : ils ne se reconnaissent plus comme étant de la même espèce. Si les formes intermédiaires s’éteignaient, les deux pouillots des deux extrémités de l’anneau apparaîtraient comme deux espèces parfaitement distinctes2.
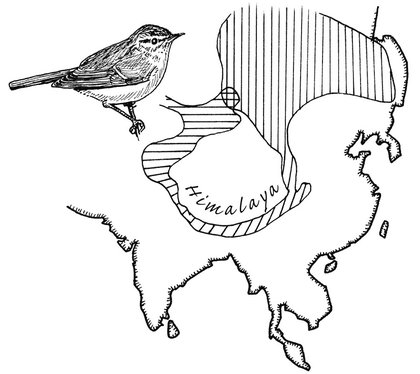
Répartition du pouillot verdâtre. La jonction des lignes horizontales et verticales représente les deux populations qui se superposent mais ne s’hybrident pas
Le petit oiseau nouveau
Les pouillots sont des petits oiseaux très attachants. En Europe, chez les ornithologues de terrain, le plus célèbre est le pouillot véloce, très commun, apprécié des débutants à cause de son chant extrêmement facile à reconnaître : un tsip-tsep-tsep-tsip-tsep-tsep qui lui a valu le nom de chiffchaff en anglais et de Zilpzalp en allemand. Si vous voulez vous initier aux chants des oiseaux, c’est par celui-ci qu’il faut commencer… En revanche, le plumage peu coloré de ces oiseaux rend les espèces extrêmement difficiles à distinguer les unes des autres. Pour les ornithos pointus, qui dédaignent la facilité, c’est le grand chic. On se pique de cocher3 le pouillot à grands sourcils déporté de sa taïga après une tempête ; en Angleterre certains bird watchers forment même des fan-clubs du pouillot.
Les pouillots sont aussi appréciés des systématiciens parce que leur genre (Phylloscopus) contient des espèces en cours de spéciation facilement interprétables par les biologistes.
Dans les années 1990, Marc Salomon, ornithologue alors attaché au Muséum national d’histoire naturelle et aujourd’hui maître de conférences de l’université Paris 6, a pour mission d’étudier le pouillot ibérique. L’oiseau, présent dans la péninsule ibérique et dans le sud-ouest de la France, est alors considéré comme une sous-espèce du véloce. L’ornithologue se penche sur les aspects différents (morphologie, comportement, etc.) et met en évidence un isolement reproductif. Le chant du pouillot ibérique est systématiquement différent de celui du véloce. La séparation entre les deux espèces est avérée, mais elle n’est pas encore totale, car il existe des cas d’hybridation. Le véloce, qui occupe une large répartition géographique, semble le moins agressif. Lorsqu’un mâle chante, il attire rarement des femelles ibériques. À l’opposé lorsqu’un mâle ibérique chante, il peut attirer des femelles de véloce, et il est très agressif avec les mâles. Il semble défendre farouchement les limites de son territoire et de son espèce naissante. D’autres études seraient à mener pour approfondir l’évolution de ces oiseaux…
Autre mode de spéciation : l’isolation écologique. Les insectes communiquent par des substances chimiques, les phéromones. Ils se procurent ces substances dans les plantes dont ils se nourrissent. Mais si cette nourriture change, les mangeurs des plantes nouvelles ne reconnaîtront pas les phéromones sexuelles des autres et ne se reproduiront plus avec eux.
Pour étudier la séparation des espèces, nous bénéficions d’une zone de recherches on ne peut plus proche : nous-mêmes…
Sauve qui pou !
Le fait que les animaux et nous soyons victimes de parasites identiques ou de la même famille était pour Darwin une preuve évidente de notre parenté. Depuis l’aube des temps, les primates se grattent et s’épouillent. Les divers poux ont évolué en espèces et sous-espèces distinctes, et remonter le cours de leur histoire grâce aux analyses génétiques est une enquête scientifico-policière. Le pou du pubis, à l’origine commun à l’ancêtre de l’homme et du gorille (qui, lui, en est infesté sur tout le corps), a divergé voici trois millions d’années. Or, les lignées des Homo et des gorilles s’étaient séparées bien avant ! Nous sommes obligés d’en déduire que les deux primates ont gardé des contacts intimes pendant des millénaires. Les gorilles ayant l’habitude de se construire des nids au sol chaque soir, on peut penser que nous avons partagé les mêmes litières. Les ancêtres des hommes actuels perdant leur fourrure, les insectes se sont réfugiés dans leurs dernières zones velues (ils fréquentent aussi les aisselles, la barbe et les sourcils). Bref, le gorille nous a filé ses morpions.
Une autre espèce amie des humains s’est, quant à elle, séparée en deux sous-espèces : les poux de la tête et les poux du corps. Le pou, c’est la biodiversité à portée de la main ! Là encore, nous pouvons suivre notre histoire commune. Les insectes se sont spécialisés et séparés en deux souches il y a quelque soixante-dix mille à quarante mille ans. Or, le pou du corps ne vit pas sur le corps, mais dans les vêtements. D’où cette déduction logique : l’homme a commencé à porter régulièrement des vêtements à cette époque, sans doute lorsqu’il a commencé à migrer de l’Afrique vers des climats plus froids. L’étude des momies péruviennes, plus exactement celle de leurs excréments, apporte d’autres précisions sur l’histoire des relations hommes-poux : nous savons grâce à elle que nous avons longtemps conservé l’habitude de manger les parasites du congénère qu’on épouille. Partout dans le monde et toujours, les hommes se sont épouillés. Même les Papous se cherchent les poux…
L’énigme ornithorynque
Régime minceur pour les cerfs de Jersey
Les pinsons et les poissons de Darwin nous ont révélé une rapidité de spéciation à laquelle Darwin lui-même ne s’attendait pas. L’espèce souche des pinsons actuels s’est installée aux Galápagos voici deux à trois millions d’années. Le lac Victoria, lui, n’est âgé que de quelque cent mille ans. Le poisson qui a donné les cichlidés date, au maximum, de cette époque, et peut-être seulement de quatorze mille ans ! À l’époque, le niveau du lac était très bas, ne formant que quelques petites flaques dans chacune desquelles les espèces ont évolué indépendamment. Au même moment, l’homme moderne, qui existait depuis longtemps (Homo sapiens est apparu voici au moins cent cinquante mille ans) avait amorcé la colonisation du continent américain, alors que d’autres avaient déjà dessiné des animaux époustouflants de force et d’élégance dans la grotte de Lascaux. Entre cette époque et aujourd’hui, l’espèce ancestrale du lac Victoria a eu le temps de se séparer en quatre cents espèces. D’autres cichlidés, au Malawi, montrent que la séparation en deux espèces peut s’opérer pendant la durée d’une vie humaine4.
Certains poissons marins se montrent aussi rapides dans leurs facultés d’évolution. Comme pour s’adapter aux mesures de restriction de la pêche destinées à les protéger. Aujourd’hui, des normes imposent que les mailles des filets ne descendent pas au-dessous de tailles d’ouverture minimales afin de préserver les jeunes. Or, on a constaté que la taille et même les mœurs des animaux suivaient cette nouvelle pression sélective exercée sur les individus les plus gros : la maturité sexuelle de la morue de Terre-Neuve est passée de six à cinq ans et sa taille de reproduction de cinquante à quarante centimètres. Très pêchée également, la sole a elle aussi, en quelques dizaines d’années, diminué sa taille (de vingt-huit à vingt-quatre centimètres) et l’âge de sa reproduction : trois ans en 1960, deux ans en 2002.
Des espèces de mammifères peuvent montrer la même plasticité. Dans l’île anglo-normande de Jersey, la population isolée des cerfs locaux a vu les individus passer d’un poids moyen de deux cents kilos à… trente-six kilos en seulement six mille ans. « Des opposants à la théorie de l’évolution ont parfois estimé que le volume de notre cerveau n’avait pas pu être multiplié par cinq en six millions d’années. Les cerfs de Jersey montrent une diminution équivalente en mille fois moins de temps », nous rappelle Jean-Baptiste de Panafieu5.

Le cerf élaphe de Jersey pèse moins de quarante kilos !
Du cichlidé africain à la morue terre-neuvas, une partie de l’évolution peut donc parfois s’accomplir à l’échelle du temps humain. Cela n’implique aucunement une création du monde récente, car ces poissons existaient déjà bien avant ces modifications « de dernière minute ». Pour passer de l’unicellulaire au T. Rex, la machinerie biologique a eu besoin de beaucoup de temps.
La nature fait-elle des bonds ?
Pour Charles Darwin, l’évolution est une lente succession de petites variations progressives. Il tenait beaucoup à sa citation latine : Natura non facit saltum (« La nature ne fait pas de sauts6 »). C’est un point de sa théorie parmi les plus contestés, notamment par des paléontologues, car les formes intermédiaires entre espèces restent majoritairement introuvables. Le très médiatique Stephen Jay Gould (1941-2002), qui a écrit de nombreux livres de vulgarisation sur la théorie de l’évolution, a formulé en 1972 avec Niles Eldredge la théorie des équilibres ponctués. Pour lui, les archives fossiles sont certes incomplètes, mais elles reflètent malgré tout la réalité de l’évolution et de ses rythmes. Se fondant entre autres sur l’étude de la faune fossile incroyablement riche de l’époque cambrienne, et très différente de celle que nous connaissons aujourd’hui, Gould avance que l’évolution s’effectue par paliers, les périodes d’équilibre étant ponctuées d’épisodes évolutifs rapides. La théorie des équilibres ponctués a elle-même été remise en question par d’autres paléontologues, et le débat entre gradualistes (tenants de l’évolution par gradations) et saltationnistes (par sauts) n’est pas tranché ; beaucoup ne les opposent pas, sinon sur leur importance respective.
Du côté des biologistes, le généticien Richard Goldschmidt (1878-1958) avance le concept des hopeful monsters (les « monstres prometteurs »). Se basant sur ses études des papillons, il suppose que des mutants, ou plutôt des macromutants spectaculairement différents de leurs parents, de forme très inattendue, pourraient donner des branches d’espèces entièrement nouvelles. C’est un argument en faveur du saltationnisme, remis à l’honneur par Gould, évidemment très controversé par les gradualistes.
Malgré ses forts penchants pour le gradualisme, Darwin lui-même, dans le chapitre 11 de L’Origine des espèces, évoque une succession de périodes avec et sans modifications qui ressemble étrangement aux équilibres ponctués. Les deux vitesses d’évolution, par sauts et par gradations, ne sont pas incompatibles, mais sans doute plutôt complémentaires. Le hasard des mutations est difficilement conciliable avec une évolution égale chez tous les individus de toutes les espèces et à toutes les époques. Ce qui déclenche une variation n’est pas prévisible. Des changements brutaux de l’environnement, par exemple, peuvent révéler pour la première fois dans un embryon en formation une accumulation de mutations non exprimées jusqu’alors.
Des espèces à vitesses évolutives apparemment très différentes se côtoient. Dans le lac Victoria, que nous commençons à bien connaître, des cichlidés champions de la spéciation rapide vivent ainsi non loin d’un dipneuste, le protoptère géant d’Afrique orientale, qui respire avec des poumons. Non seulement ce poisson ne s’est pas ramifié en espèces distinctes, mais encore il semble n’avoir pas bougé depuis l’époque du tiktaalik et de la sortie des eaux. Il est ce que Darwin a parfois appelé un « fossile vivant », un être comme égaré hors du temps et de l’évolution…
Le poisson qui n’a rien compris
C’est une belle histoire de Noël. Tout commence le 22 décembre 1938 sur une jetée maritime sud-africaine. La jeune conservatrice du musée d’East London, le Dr Marjorie Courtenay-Latimer (1907-2004), est appelée par le capitaine d’un chalutier qui pense avoir pêché des prises pouvant l’intéresser. Au moment où elle va partir, déçue, elle aperçoit une nageoire bleutée. Elle dégage un poisson de 1,65 mètres « avec une étrange queue comme celle d’un chiot », en fait un croquis et l’envoie au célèbre ichtyologiste J.L.B. Smith (1897-1968), qui n’en croit pas ses yeux : « Je n’aurais pas été plus étonné si j’avais vu un dinosaure marcher dans la rue », déclare-t-il. En effet, ce poisson ressemble à des animaux fossiles ayant vécu avant l’apparition des dinosaures !
Smith tarde à venir voir le phénomène qui, malgré les soins de Marjorie pour éviter la décomposition, a dû être naturalisé. Bien qu’il s’y attende, c’est quand même un choc : le poisson est bien un cœlacanthe, un fossile ayant vécu entre moins 400 et moins 70 millions d’années, et toujours en vie… Smith lui donne pour nom scientifique Latimeria en l’honneur de Marjorie Courtenay-Latimer, la femme qui l’a découvert.
Les nageoires du poisson, qui ressemblent à des ébauches de pattes, évoquent irrésistiblement un lointain ancêtre prêt à sortir des eaux (ce qui n’a pas été confirmé par la suite), et, à ce titre, il a bénéficié d’une grande promotion médiatique. En réalité, les dipneustes d’Amérique du Sud auxquels s’est intéressé Darwin sont plus proches des quadrupèdes.
Depuis la première découverte de 1938, on a pêché d’autres cœlacanthes dans les eaux profondes des Comores, et même une deuxième espèce en 1997 dans l’océan Indien. Hélas, le trafic de ce poisson incapable de survivre à la captivité en surface fait peser sur lui une réelle menace de disparition, car il vaut désormais des fortunes.
Des animaux surgis de la préhistoire, comme le cœlacanthe, soulèvent la question du rythme de la succession des espèces couramment appelé le « tempo de l’évolution ». Comment expliquer sa survivance ? Dans L’Origine des espèces7, Charles Darwin propose une explication : « On pourrait appeler ces formes anormales de véritables fossiles vivants ; si elles se sont conservées jusqu’à notre époque, c’est qu’elles ont habité une région isolée, et qu’elles ont été exposées à une concurrence moins variée, et, par conséquent, moins vive. » L’environnement de grottes sous-marines du cœlacanthe aurait effectivement peu changé au cours des millénaires, et les pressions sélectives non plus. Sans doute le cœlacanthe a-t-il connu des variations, mais aucune ne semble avoir été retenue par la sélection. Les deux populations connues, qui vivent à neuf mille kilomètres l’une de l’autre, ne montrent que très peu de différences. Le cœlacanthe a eu autant de temps que les autres espèces pour évoluer, mais il n’en a visiblement pas eu besoin. Il n’est pas un oublié de l’histoire, et se verrait plutôt comme un prototype de succès inaltérable !
Les fossiles vivants n’existent pas
Ne parlez jamais de « fossile vivant » à un paléontologue, vous allez l’énerver ! Les fossiles sont les témoins pétrifiés de temps révolus, datés par convention d’au moins dix mille ans, et n’ont pas de rapport avec le vivant adapté à l’environnement actuel. Certes, ces espèces ressemblent étrangement à des formes disparues, mais rien n’indique qu’elles n’ont pas évolué d’une manière ou d’une autre, et rien n’interdit leur existence. Les méduses, les requins, les tortues, les scorpions, les blattes, les libellules et bien d’autres bestioles semblent inchangées depuis des millions d’années, et l’on ne les appelle pas pour autant des « fossiles vivants ». De nombreux groupes anciens n’ont pas disparu. Le terme le plus juste pour nommer un fossile vivant est « animal panchronique », mais celui-ci est nettement moins imagé…
Une main entre les yeux
Un pont quelque part en Australie au-dessus d’une petite rivière. Le soir va tomber, les curieux sont nombreux. Ils espèrent apercevoir l’un des animaux les plus extraordinaires de la planète. Tellement incroyable que les premiers scientifiques européens à en avoir reçu une dépouille, en 1798 au British Museum, n’y ont pas cru, persuadés qu’il s’agissait d’un canular ! Cette première dépouille d’ornithorynque porte encore les traces du chercheur incrédule qui essaya de séparer les morceaux de ce qu’il pensait être une sorte de montage grossier de plusieurs animaux…
Des clapotis se font entendre sous le pont. De discrets « aaaahh » chuchotés saluent l’apparition de la bête. Pour les observateurs, c’est l’étonnement : l’ornithorynque est plus petit qu’ils ne le croyaient, de la taille d’un petit lapin plutôt que de celle d’un castor. L’animal plonge à la recherche de larves d’insectes et de crevettes, les yeux fermés, et reparaît de temps en temps à la surface de l’eau. L’ornithorynque qui nage devant les touristes fascinés est une chimère : un mammifère qui allaite ses petits mais qui pond des œufs, avec une fourrure, des pattes palmées, un éperon venimeux, une queue de castor et un « bec de canard ». Un véritable puzzle vivant…
Au cours de son étape en Australie, Darwin l’attrape-mouches a eu la chance d’observer plusieurs ornithorynques : « Ils plongeaient ou se jouaient à la surface de l’eau, mais on voyait si peu leur corps qu’on aurait pu facilement les prendre pour des rats d’eau. M. Browne en tua un ; c’est certainement un animal fort extraordinaire, les spécimen empaillés ne peuvent pas donner une bonne idée de la tête et du bec, car ce dernier se contracte en durcissant8. » Le nom scientifique de l’époque pour désigner l’animal était Ornithorhynqus paradoxus, qui veut dire « bec d’oiseau paradoxal ». Mais comme vient de nous le dire Charly, son appendice n’est pas rigide. Il est caoutchouteux et n’a, en fait, aucun rapport avec le bec en corne d’un oiseau. C’est un organe tactile sensible comme une main, un vrai radar muni de quarante mille capteurs électriques et de soixante mille capteurs mécaniques ! Lorsqu’il plonge, l’ornithorynque ferme les yeux, mais aussi les narines et les oreilles. Il ne lui reste plus que les sens de son bec pour percevoir son environnement et détecter ses proies, ce qu’il fait avec une aisance extraordinaire. En quelque sorte, l’ornithorynque « voit » avec son bec comme la chauve-souris « voit » avec ses oreilles.
L’animal impossible
L’ornithorynque et les échidnés d’Australie et de Nouvelle-Guinée, sortes de hérissons à long museau de fourmilier, sont les seuls monotrèmes au monde. En grec, monotrème signifie « orifice unique ». Chez ces mammifères pondeurs d’œufs, les voies urinaires, génitales et digestives débouchent toutes dans un cloaque, comme chez les reptiles et les oiseaux. Du reptile, l’ornithorynque a non seulement le cloaque, mais aussi des os près des clavicules typiques. En revanche, les os de sa mâchoire sont devenus l’étrier, le marteau et l’enclume de l’oreille moyenne caractéristiques des mammifères. Ses œufs ne sont pas semblables à ceux des oiseaux car ils ne sont pas protégés par une coquille rigide, mais par une membrane résistante comme ceux des reptiles. La femelle de l’ornithorynque allaite, mais elle n’a pas les mamelles qui ont donné leur nom aux mammifères. Son lait suinte par des pores sur son ventre que ses petits viennent laper.
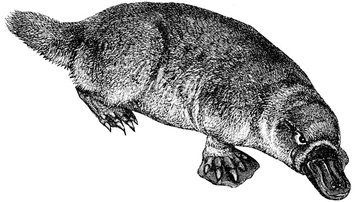
L’ornithorynque « voit » avec le bec
L’ornithorynque est « primitif » par certaines parties de son anatomie (« primitif » signifiant « proche des ancêtres »), mais son bec est très évolué. Il ne mérite pas le qualificatif de « fossile vivant ». Il n’est pas plus un « chaînon manquant », un représentant exact de ce qu’ont été les reptiles mammaliens de la préhistoire, dont rien ne dit qu’ils avaient des « becs de canard », ni qu’ils étaient aquatiques. Depuis l’époque des ancêtres des mammifères actuels, l’ornithorynque a tout simplement suivi sa propre évolution, en gardant plus de caractères reptiliens que les autres mammifères.
En 2008, le patrimoine génétique de Glennie, une femelle ornithorynque, a été analysé : c’est un patchwork de gènes ressemblant à ceux des mammifères, des reptiles et des oiseaux. L’ornithorynque est un puzzle jusqu’au plus profond de ses cellules. Il nous raconte que l’évolution suit des rythmes divers, et que ses bricolages apportent des solutions variées aux nécessités vitales : on peut « voir » le monde avec les yeux, mais aussi avec le nez ! Depuis des siècles, l’improbable ornithorynque nous fait des pieds de nez…
Les animaux évoluent ensemble
Un guépard au Pays des Merveilles
Le guépard est l’animal terrestre le plus rapide de la planète. Il est capable de dépasser les cent kilomètres-heure en vitesse de pointe. Si cette vitesse était suffisante pour attraper autant de gazelles qu’il le veut, il se multiplierait d’une telle manière que ces dernières disparaîtraient. Mais les gazelles ont des parades : elles courent en zigzaguant, et bien qu’elles ne soient pas aussi rapides que les guépards, elles s’essoufflent moins. Contre les ruses de la gazelle, le guépard doit trouver des moyens d’aller toujours plus vite, dans une « course aux armements » sans fin. Entre la proie et le prédateur, il s’établit donc un équilibre, toujours maintenu mais sans cesse remis en cause. Le guépard et la gazelle nous posent cette question : pourquoi les espèces continuent-elles d’évoluer, au lieu de s’arrêter à un point évolutif idéal ?

Le guépard est rapide
La gazelle est endurante
La réponse a été mise en lumière par un évolutionniste de l’université de Chicago, Leigh Van Valen, qui a exposé son « hypothèse de la Reine Rouge » dans un article, « A New Evolutionary Law », publié à compte d’auteur pour avoir été refusé par les journaux scientifiques. La « Reine Rouge » est une allusion à De l’autre côté du miroir de Lewis Carroll. Alice et la Reine Rouge courent ensemble, la main dans la main, droit devant elles, mais le paysage ne défile pas. La reine explique à Alice qu’il faut avancer sans cesse pour rester à la même place, comme sur un tapis roulant pris à contresens. Pour Van Valen, l’évolution des espèces fonctionne de cette manière, chacun devant constamment s’adapter à son entourage juste pour rester à sa place.
Évidemment, l’hypothèse de la Reine Rouge a été discutée, car elle semble supposer un équilibre sans fin. Les extinctions d’espèces prouvent que, parfois, Alice peut lâcher la main de la Reine…
La course du T. Rex
Dans L’Origine des espèces, Darwin énonce que l’extension géographique des êtres vivants n’est pas seulement freinée par les contraintes du milieu, mais aussi « par la concurrence que lui opposent les autres espèces9 », les unes étant les proies ou les prédateurs des autres. Chaque espèce qui évolue contraint les autres à s’adapter en conséquence, d’où la « course aux armements ».
La « lutte » pour l’existence est à tous les niveaux : la cellule, l’individu (par rapport à ses congénères, par rapport à l’autre sexe, par rapport aux autres espèces, par rapport à son environnement), le groupe, l’espèce… Pour illustrer cette superposition de compétitions, Richard Dawkins raconte cette histoire drôle. Deux brontosaures, ayant vu s’approcher un tyrannosaure, se mettent à courir. L’un dit : « À quoi bon nous fatiguer, nous ne courrons jamais aussi vite qu’un T. Rex ! ». Et l’autre répond : « Je ne cherche pas à courir plus vite que lui, je cherche à courir plus vite que toi. »
Cependant, la notion de « lutte » pour l’existence est trompeuse, car les interactions entre les espèces ne se résument pas à une sanguinaire prédation. Leur évolution conjointe n’est pas forcément une guerre, elle peut se faire en fonction de relations d’intérêt commun.
La vieille dame, le chat et les moutons
Le guépard et la gazelle ont de longues pattes de coureurs parce qu’ils vivent tous les deux dans un milieu ouvert, la savane. Ils dépendent de tout ce qui les entoure, y compris de végétaux eux-mêmes dépendants de la présence des herbivores ou des pollinisateurs. Dans L’Origine des espèces, Darwin donne une image toute britannique de l’interaction évolutive entre des espèces « fort éloignées les unes des autres dans l’échelle de la nature10 ». Il remarque que le trèfle rouge est spécialement fertilisé par le bourdon parce que les abeilles ne peuvent pas en atteindre le nectar. Or, le nombre de bourdons dépend de celui des mulots, « qui détruisent leurs nids et leurs rayons de miel » (ces insectes établissent leur nid sous terre, comme les rongeurs, et sont en concurrence avec eux). Plus des deux tiers des bourdons sont ainsi éliminés chaque année en Angleterre, rappelle-t-il en citant un naturaliste. Or les mulots, dont le nombre dépend de celui des chats, sont moins fréquents près des villages. Darwin en conclut : « Il est donc parfaitement possible que la présence d’un animal félin dans une localité puisse déterminer, dans cette même localité, l’abondance de certaines fleurs en raison de l’interaction des mulots et des bourdons11 ! »

En attrapant des mulots, le chat favorise les trèfles
Reprenant l’image de Darwin, des biologistes se sont amusés à aller plus loin. Ils ont considéré d’une part que les chats étaient fréquents chez les ladies anglaises d’un certain âge (c’est leur postulat de départ…), et d’autre part que l’élevage des moutons était tributaire des pâturages de trèfle. Ils en ont déduit que la présence de vieilles dames tricotant dans leur cottage entraînait la présence de chats, donc la raréfaction des mulots, donc l’abondance des bourdons, donc de belles prairies de trèfle, donc la prospérité des élevages de moutons, donc l’exploitation florissante de la laine dont les honorables ladies font des tricots : la boucle est bouclée.
Par une démonstration comparable à celle de Cuvier décrivant l’interaction des organes dans un animal, Darwin a mis en valeur l’importance de l’interaction des espèces dans leur environnement avec un exemple de chaîne alimentaire et de rapports proies/prédateurs. Les bourdons, les mulots, les chats, les moutons et les vieilles dames nous l’affirment en chœur : cette prise en compte des relations entre l’ensemble des êtres vivants dans un écosystème donné a aujourd’hui un nom : l’écologie.
Le lapin et l’effet domino
Dans un écosystème, tout est imbriqué. On enlève une partie et tout l’édifice s’effondre : on appelle cela l’effet domino. C’est l’une des grandes leçons de l’écologie scientifique. Les exemples d’effet domino sont légion ; l’un d’eux s’est déroulé dans le pays de Darwin.

Le lapin de garenne protège les papillons
De même qu’en France, la myxomatose a été introduite en Angleterre volontairement, au XXe siècle, pour éliminer les lapins de garenne. Par un effet de détricotage des interactions entre différentes espèces, cette introduction a eu un effet inattendu bien que prévisible : la disparition d’un joli petit papillon bleu, l’azuré du serpolet. Explication. Il existe une étrange association entre la chenille de l’azuré et les fourmis rouges de l’espèce Myrmica sabuleti. La chenille séduit les fourmis en produisant une substance sucrée dont elles raffolent. Les fourmis transportent la chenille dans leur cité, où l’ingrate est nourrie avec les propres larves des fourmis ! La chenille se métamorphose dans la fourmilière, d’où un joli papillon bleu s’envole un jour.
La disparition du lapin a provoqué l’envahissement du milieu par les broussailles, et la disparition des plantes ayant besoin de lumière, sous lesquelles les fourmis construisent leur nid, et sur lesquelles les azurés pondent. Pas de plantes, pas de fourmis, pas de papillon… L’azuré du serpolet a disparu en 1979 en Angleterre, et sa réintroduction n’a été possible dix ans plus tard qu’après une grande restauration de son milieu de vie et de ses alliés.
L’insecte et l’orchidée
Les espèces évoluent donc en fonction des autres. Cette évolution parallèle a conduit certaines d’entre elles à s’associer au point de ne plus pouvoir se passer les unes des autres. Une telle évolution conjointe s’appelle la coévolution. Darwin (eh oui, encore lui…) a beaucoup étudié les relations entre les insectes et les plantes, notamment les orchidées et leur pollinisation par des animaux spécialisés. Dans son ouvrage De la fécondation des orchidées par les insectes et des bons résultats du croisement12, publié en 1862, il montre que les mécanismes de fertilisation de ces plantes hermaphrodites se font majoritairement par la fécondation croisée due aux animaux et non par autofécondation des parties mâle et femelle de la même plante.
Certaines orchidées de nos régions, moins exubérantes que leurs homologues tropicales, sont néanmoins de fort jolies fleurs au yeux des humains, et de très aguichants leurres sexuels pour les insectes. Bon nombre d’entre elles imitent non seulement la forme et la couleur de femelles d’insectes, mais aussi leur texture velue et leur parfum : de vraies poupées gonflables végétales ! Les insectes mâles se ruent pour un pseudo-accouplement et s’imbibent au passage du pollen qu’ils transmettront à d’autres orchidées, car ces gros nigauds se font piéger plusieurs fois. Chaque espèce d’orchidée leurre est adaptée à un insecte particulier. Darwin décrit l’ophrys abeille, l’ophrys bourdon, l’ophrys mouche, etc., dont les noms, contrairement aux apparences, ne correspondent pas forcément à l’animal pollinisateur.
Dans les années 1860, Darwin reçoit un jour une orchidée comète, ou étoile de Madagascar. Le tube qui conduit son nectar a une taille impressionnante : il est long de plus d’une trentaine de centimètres ! Quel pollinisateur bizarre peut porter un organe aussi long et fin ? Darwin pense aux sphinx de son pays, ces papillons nocturnes européens à longue trompe. Il en déduit qu’il existe quelque papillon de nuit géant doté d’une trompe en rapport avec la taille de l’éperon nectarifère de l’orchidée comète. Sa supposition est tournée en dérision – un tel monstre ! –, mais plusieurs dizaines d’années plus tard, un papillon correspondant à la déduction de Darwin est découvert et appelé praedicta (prévu). Au repos, sa trompe est enroulée vingt fois sur elle-même…
La coévolution
Comment le sphinx et l’orchidée ont-ils coévolué jusqu’à produire des organes de telles tailles ? La théorie la plus courante, fidèle aux propositions de Darwin, consiste à comparer les possibilités qui s’offrent à chaque espèce. Si l’organe nectarifère de la fleur est trop court, le papillon n’a pas d’effort à faire pour l’atteindre. Il n’enfonce pas sa tête, ne s’imbibe pas de pollen et la plante, ne se reproduisant pas, ne transmet pas ses gènes. Ses caractéristiques n’ont donc pas d’avenir. Si l’organe de la fleur est un peu plus long que la trompe du papillon, celui-ci s’enfonce pour atteindre le nectar, s’imbibe de pollen et ira fertiliser d’autres fleurs. Ses caractères se transmettent. Dans une course aux armements sur le modèle de la Reine Rouge, la réponse du papillon est une sélection de trompes toujours plus longues, qui elles-mêmes engendreront des tubes nectarifères plus longs, jusqu’à atteindre des formes aussi extraordinaires que celles des organes des orchidées et des papillons malgaches.
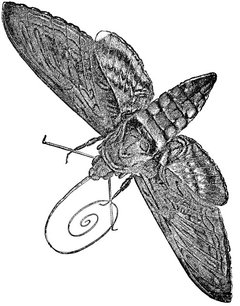
Les sphinx ont des trompes étonnamment longues
Toutes les associations ne viennent pas d’une coévolution, qui implique que l’histoire évolutive de chacune des deux espèces concernées ne puisse se concevoir qu’à travers celle de l’autre. Coévolution ou non, les exemples d’associations entre les plantes et les animaux, peaufinées pendant des millénaires, ont donné des histoires extraordinaires.
La fleur musicale
Les ombellifères de nos bords de chemins offrent une piste d’atterrissage aux insectes volants. La carotte sauvage porte même en son centre une fleur rouge probablement utilisée comme balise. Des arbres exotiques comme le bois-canon ne pourraient pas se passer des fourmis, qui les débarrassent des insectes indésirables, si bien que pour les attirer, ils leur procurent des bonbons ! Beaucoup de plantes se parfument pour les insectes. La rafflésie, la plus grosse fleur du monde, attire les mouches pollinisatrices en imitant avec une grande subtilité l’odeur d’une charogne. Une fleur d’Amérique centrale, Mucuna holtonii, joue même de la musique ! Elle porte un énorme pétale qui fait office de parabole ; cette caisse de résonance renvoie les échos qui promettent aux chauves-souris nectarivores un bon repas.
Désolé de casser l’ambiance. L’histoire des « amitiés » entre les fleurs et les animaux a l’air bien jolie, mais elle n’est que la rencontre de deux recherches égoïstes. D’ailleurs, il existe pas mal de tricheurs chez les insectes, qui déchirent les pétales pour accéder au nectar sans payer la fleur en retour. Parfois, l’association ne profite qu’à l’un des deux protagonistes : il s’agit alors de parasitisme.
Une fourrure bien mitée
Un parasite est un être vivant qui prend un autre être vivant comme habitat et/ou comme source de nourriture13. À nous, pauvres humains, il évoque immédiatement des maladies tropicales et des horreurs gratouillantes, comme les puces et les tiques. Certains autres animaux en sont envahis. Notamment le paresseux, dont la stratégie de survie est fondée sur la lenteur. Il est si lent, si lent que des algues lui poussent dessus et cette flore attire des insectes amateurs d’algues. Outre les mites qui nichent dans ses poils, il abrite tout un catalogue de suceurs de sang : tiques, mouches sans ailes, etc. – bref, un vrai bestiaire. Au Brésil, des chercheurs ont compté plus de cent vingt papillons et près de mille coléoptères sur le même individu ! Le paresseux ne descend à terre qu’une fois par semaine environ pour déféquer. Certains habitants de son pelage en profitent pour aller pondre dans ses excréments. Les larves s’y développeront, et les individus adultes s’en envoleront pour rejoindre un paresseux où ils rencontreront des partenaires.
Les parasites se synchronisent sur les cycles de leurs hôtes, comme les puces du lapin. Les puces femelles sentent, aux changements du sang de leur victime, que la lapine est en chaleur. Elles se dirigent alors vers ses oreilles où les mâles les rejoignent. Et pendant que les lapins s’accouplent, les puces en font autant ! En forêt, les parasites des cerfs se réunissent sur les places de brame, qui deviennent les lieux de rendez-vous des grandes bêtes et des toutes petites.
Quant aux poux, ils sont partout. Quasiment tous les mammifères ont leur sorte de pou, un insecte sans ailes qui n’aime qu’eux. Il y a celui du chien, du sanglier, du cobaye, du lapin, du cheval, etc. On trouve même des poux qui ne vivent que dans le nez du phoque. Quand l’animal plonge, il garde les narines fermées, tenant ses poux bien à l’abri !
Méfiez-vous des contrefaçons
Les évolutions hôte/parasite offrent de beaux exemples de course aux armements à la mode Reine Rouge. Le coucou gris est un cas d’école. Chacun sait que la femelle pond dans le nid d’autres espèces. Elle surveille les futurs parents adoptifs, et dès qu’ils s’absentent, elle enlève un de leurs œufs, pond le sien et part. Le tout en moins de dix secondes. Comme si une femme avait la possibilité d’accoucher au moment exact où elle l’a décidé, par exemple pendant la pub, entre deux programmes télé… Des chercheurs britanniques un peu farces ont disposé un coucou empaillé sur un nid de fauvettes ; le leurre a été attaqué par les propriétaires. La rapidité de la ponte a donc été sélectionnée en réponse à la méfiance des oiseaux hôtes.
Différentes lignées de coucous femelles pondent des œufs imitant parfaitement le coloris de ceux de leurs hôtes, mais aucune ne parvient à plagier les œufs très bleus de l’accenteur mouchet. La très mauvaise imitation du coucou (un œuf blanc tacheté) n’est pourtant pas rejetée par les accenteurs, alors que d’autres oiseaux éjectent parfois un œuf parasite très bien imité. D’où vient cette différence ?

Jeune coucou nourri par un de ses parents adoptifs
Nos chercheurs britanniques ont testé des centaines de nichées avec des faux œufs de coucous, et ont noté les réactions des oiseaux hôtes. Le parasitisme de l’accenteur mouchet étant relativement récent en Angleterre, ils en ont déduit qu’il n’avait pas encore déclenché de riposte. En revanche, les espèces parasitées depuis longtemps sont devenues méfiantes. Les oiseaux évacuent les mauvaises contrefaçons et sélectionnent les meilleurs faussaires au fur et à mesure des générations. En Europe centrale, où les coucous sévissent depuis longtemps, les oiseaux parasités sont extrêmement méfiants, et les œufs des parasites sont devenus des imitations quasi parfaites.
Comment sont venues au coucou gris ses mauvaises manières ? Des formes intermédiaires de parasitisme existent dans la nature, qui peuvent nous donner une idée de son évolution. Plusieurs espèces d’oiseaux non connus pour être des parasites, comme l’étourneau sansonnet ou la buse variable, pondent parfois un œuf dans le nid des voisins de même espèce. Le phénomène n’est pas rare chez plusieurs espèces de canards, comme la nette rousse, qui pond beaucoup. Chez le milouin d’Amérique, il existe trois sortes de canes qui ne diffèrent que par le comportement. Certaines femelles couvent et élèvent tous leurs petits, certaines pondent en partie chez les autres mais s’occupent du reste de leur progéniture, et enfin les dernières sont de pures parasites : elles ne construisent même pas de nid et pondent la totalité de leurs œufs dans le nid des autres.
Les vacheries des vachers
Le coucou-geai, que l’on peut observer en région méditerranéenne, est un parasite systématique comme le coucou gris. Il ne squatte que les nids des corvidés, surtout ceux des pies bavardes. Ses oisillons n’éliminent pas la couvée des parents adoptifs comme le font les petits coucous. Cela n’empêche pas des réactions de défense des hôtes. En Andalousie, on a vu des coucous-geais punir les pies qui s’étaient débarrassées de leurs œufs. Ce comportement mafieux est une spécialité du vacher à tête brune, un oiseau d’Amérique qui surveille les nids qu’il a squattés, et vandalise ceux dont les propriétaires ont éjecté ses œufs. L’hôte a donc intérêt à s’occuper de tous les oisillons, ses petits et ceux du vacher, plutôt que de risquer une destruction totale.
Les vacheries pleuvent aussi en Afrique, chez les tisserins, qui doivent se défendre contre le parasitisme du coucou didric. Récemment, des tisserins intermédiaires (c’est le nom de l’espèce) ont réduit le diamètre de leur nid si bien qu’on y a retrouvé plusieurs femelles de coucous coincées, mortes pour n’avoir pu échapper au piège. Non loin de là, les femelles de tisserins à tête rousse utilisent une parade originale : elles pondent chacune des œufs de couleurs différentes, et donc impossibles à imiter.
Enfin, retour dans le Nouveau Monde pour une histoire à double tranchant. Les couvées du cassique à tête brune sont parasitées par le vacher géant. Les petits squatters n’éliminent pas les œufs de leurs hôtes, mais ils sont tellement voraces que certains oisillons du cassique meurent de faim. Pourtant, les parents acceptent le sacrifice : le jeune vacher, seul capable d’attraper tous les insectes volants qui s’approchent de la nichée, protège d’une mouche mortelle les petits cassiques. Lorsque leur nid est situé près de celui de guêpes chasseuses de mouches, qui font le même travail sans affamer les petits, les cassiques sont beaucoup moins tolérants à l’égard des vachers.
Le moustique et le médecin
La course aux armements hôte/parasite n’est pas toujours naturelle. Les médicaments inventés par les humains les forcent à accélérer le processus, mais ces derniers partent avec quelques longueurs de retard. L’homme se reproduit environ tous les trente ans, certaines bactéries toutes les trente minutes. Une vie humaine équivaut à quelque un million cinq cent mille générations de bactéries, qui ont tout le temps de muter et s’adapter aux médicaments !
Le moustique, vecteur du paludisme
Avec plus de un million de morts par an, le paludisme, ou malaria, est l’infection parasitaire la plus répandue de la planète. Elle est due à un plasmodium transmis par la piqûre d’un moustique. Dans certaines régions d’Afrique, un homme peut contracter la maladie jusqu’à un millier de fois par an tant les moustiques sont nombreux. La chloroquine a longtemps été le médicament qui servait à s’en prémunir. Mais des moustiques ont muté, et les populations d’insectes résistants se sont multipliées d’autant plus vite que l’usage de chloroquine toujours en vigueur continuait de sélectionner des individus résistants. L’apparition de nouvelles molécules provoque la sélection d’autres moustiques mutants, dans une course sans fin.
La résistance des bactéries aux antibiotiques s’étend : il y a quinze ans, dix mille unités de pénicilline par jour suffisaient pour un traitement contre certains streptocoques. Aujourd’hui il en faut vingt-quatre millions d’unités. Face aux mutations rapides des microorganismes, certains médicaments ont entièrement perdu leur efficacité. Il faudrait non seulement tuer les virus, mais aussi prévoir et contrer leur évolution.
La bestiole qui a perdu son anus
Il n’est pas toujours aisé de reconstituer l’évolution des parasites. Dans un livre consacré au sujet14, le biologiste Claude Combes retrace l’évolution probable d’un parasite interne d’après l’exemple de plusieurs espèces actuelles de mollusques marins. Dans une première étape, les pique-assiette se contentent de rester en surface sur leur hôte et leur volent une partie de leur nourriture. D’autres prélèvent des morceaux de leur victime, et méritent déjà d’être appelés parasites. Dans une deuxième étape, ils enfoncent leur trompe dans la paroi extérieure de l’hôte pour s’en nourrir. Dans une troisième, les parasites s’insèrent en entier dans le corps de l’hôte, sans plus de communication avec l’extérieur. L’intrusion est de plus en plus profonde. Les parasites des dernières étapes ont carrément perdu leur tube digestif et leur anus. Ils se nourrissent par osmose, les nutriments pénètrent dans leur corps directement.
Les parasites, qui ont perdu des organes élaborés au cours de leur évolution, nous montrent que celle-ci ne se fait pas uniquement dans le sens de la complexification, qu’elle peut au contraire aller vers une simplification. Le ver solitaire et autres vermines rappellent à notre orgueil pointilleux que l’évolution n’est pas allée en ligne droite de la bactérie vers l’homme, merveille censée dominer toute la création. L’arbre de l’évolution prend des directions variées, et nous n’en sommes qu’une brindille.
Dans la gueule du matou
Ce rat ne se comporte pas normalement. Non seulement il ne fuit pas les chats, mais il semble chercher leur contact ! Il renifle l’urine des matous et se jette littéralement sous leurs griffes. Ce rat est manipulé de l’intérieur par un parasite unicellulaire, le toxoplasme Toxoplasma grondii, qui lui bogue le cerveau et le pousse au suicide. Vecteur de la toxoplasmose, Toxoplasma grondii doit passer par l’estomac d’un chat afin de poursuivre son cycle de vie, car c’est là qu’il se reproduit. Le rat lui a servi de taxi kamikaze.
Des études sur l’humain ont révélé que les conducteurs positifs à la toxoplasmose seraient statistiquement plus souvent victimes d’accidents de la route que les autres (2,65 fois plus)… Le toxoplasme n’a évidemment aucun intérêt à atterrir chez un garagiste, mais il modifierait des comportements tels que la capacité de concentration, l’émotivité, le contrôle de soi, la confiance en soi ou l’indiscipline15…
D’autres parasites obligent des fourmis à se faire croquer par des moutons ou des grillons à se jeter à l’eau. Ces histoires étonnantes d’êtres vivants qui doivent passer d’un hôte à l’autre en pilotant leur cerveau sont courantes y compris en mer, où certains font en sorte que des mollusques attirent l’attention d’oiseaux prédateurs et se fassent avaler. D’autre part, on a découvert que les moustiques étaient attirés de préférence par les personnes déjà infectées par le plasmodium responsable du paludisme. Cela impliquerait que le plasmodium a la faculté de manipuler le comportement de l’animal qui va le transporter…
Le mimétisme
La stratégie parasitaire du coucou est basée sur le mimétisme de ses œufs. Le mot « mimétisme » a deux sens différents. On l’emploie couramment pour désigner un camouflage inspiré du décor, mais le vrai terme est plutôt, dans ce cas, « homochromie ». Le véritable mimétisme consiste à imiter l’aspect d’une espèce différente.
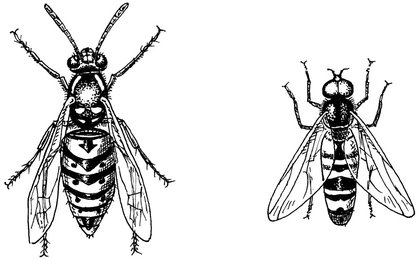
La guêpe et le syrphe, un exemple de mimétisme
Bien des exemples de mimétismes existent dans la nature : très courant dans nos jardins, le syrphe est une mouche inoffensive déguisée en guêpe jaune rayée, ce qui intimide ses prédateurs… et les humains, car son vrombissement est également spectaculaire. Le faux serpent corail, tout aussi inoffensif, imite un reptile très venimeux, etc.
Comment des déguisements aussi parfaits ont-ils pu voir le jour, et comment expliquer une telle évolution ? La question principale est l’isolement génétique entre l’animal modèle et son imitateur : la sélection ne peut pas se produire à ce niveau, puisqu’ils ne descendent pas les uns des autres. Il s’agit là encore d’un processus de coévolution, et il n’est pas différent d’autres adaptations. Les animaux polaires sont déguisés en neige et passent inaperçus, certains insectes ressemblent à des végétaux au point d’imiter les nervures des feuilles, et même les taches de moisissure ! C’est donc un ensemble de mutations semblables entre une espèce et une autre (ou une espèce avec son environnement) qui, avec le temps, a donné ces spectaculaires similitudes.
Le mimétisme existe aussi dans l’industrie et dans notre vie quotidienne. Certains emballages de produits alimentaires ou vestimentaires imitent l’aspect et les codes couleurs de marques prestigieuses, et les clients s’y trompent de la même manière que les animaux dans la nature.
Bouses volantes dans la prairie
Ce qui suit n’est qu’une hypothèse, mais elle est bien savoureuse. Dans les prairies sud-américaines, l’engoulevent nacunda passe facilement inaperçu. Cet oiseau terne et peu connu pratique une méthode bien à lui pour se faire mal voir : il s’accroupit au sol et reste figé, ce qui, grâce à ses couleurs appropriées, lui donne l’aspect d’une bouse de vache. Ce genre de déguisement n’est pas rare dans la nature. Des chenilles imitent à s’y méprendre des fientes d’oiseaux ; ces derniers n’étant guère intéressés par leurs propres déjections, les insectes courent peu de risques d’être avalés. On peut en déduire qu’il s’agit d’un cas de mimétisme. Mais au sujet de l’oiseau sud-américain, une question se pose : les objets qu’il imite ne peuvent pas être des bouses de vache, tout simplement parce que les bovins sont arrivés trop récemment sur le continent, bien après la mise au point de sa stratégie. Pour beaucoup de scientifiques la chose est entendue : l’engoulevent nacunda imite les crottes de gros animaux aujourd’hui disparus. Selon toute vraisemblance, ces animaux sont justement les tatous et les paresseux géants dont Darwin a exhumé des fossiles16.
1. Tijs Goldschmidt, Le Vivier de Darwin. Voir bibliographie.
2. De même pour les populations du goéland argenté et du goéland brun, disposées en anneau autour de l’hémisphère nord, qui cohabitent sur nos côtes sans presque jamais s’hybrider, car l’Europe occidentale représente l’extrémité de l’anneau. Les oiseaux sont considérés comme deux espèces distinctes, alors que si l’on suit la population de l’un autour de l’hémisphère nord, on se rapproche de formes intermédiaires entre les deux, jusqu’à, en continuant le trajet, aboutir à l’autre espèce.
3. Cocher, c’est mettre une coche en face du nom de l’oiseau dans son guide d’identification quand on l’a vu pour la première fois. Certains fous d’oiseaux font des concours de coche, ou recommencent un guide vierge lorsqu’ils ont rempli le leur…
4. Tijs Goldschmidt, Le Vivier de Darwin…, p. 141.
5. Jean-Baptiste de Panafieu, Évolution, p. 260. Voir bibliographie.
6. Rendons à César sa citation latine : Darwin a repris celle-ci de Leibniz.
7. Charles Darwin, L’Origine…, p. 157.
8. Charles Darwin, Voyage…, p. 472.
9. Charles Darwin, L’Origine…, p. 227.
10. Ibid., p. 123.
11. Ibid., p. 124.
12. Titre original : On the Various Contrivances by which British and Foreign Orchids Are Fertilised by Insects, and on the Good Effects of Intercrossing, sorti trois ans seulement après le très contesté L’Origine des espèces. Il ne s’agissait pas là d’une volonté de Darwin de parler d’autre chose, mais au contraire d’enfoncer le clou sur des parties jugées insuffisamment développées sous l’angle bien affirmé de la variabilité des espèces. Dans une lettre à son éditeur, il explique : « Je pense que ce petit volume fera du bien à L’Origine. » Darwin ne cherche pas la polémique, mais il est tenace.
13. Définition de Claude Combes, Darwin dessine-moi les hommes. Voir bibliographie.
14. Claude Combes, Les Associations du vivant. Voir bibliographie.
15. Voir Claude Combes, Darwin, dessine-moi les hommes.
16. Ces paresseux disparus déposaient allégrement leurs crottes dans les prairies récemment encore, et l’on retrouve ces déjections pétrifiées dans certaines cavernes. L’une de ces crottes figure au Musée américain d’histoire naturelle de New York, avec cette petite note jointe : « déposée par Theodore Roosevelt »…