28 Transfusionen
28.1 Grundlagen aus Pflege- und Bezugswissenschaften
Mit der Entdeckung der Blutgruppen durch Karl Landsteiner im Jahr 1901 und der Entdeckung des Rhesusfaktors im Jahr 1940 durch Wien und Landsteiner wurde die Grundlage für die Transfusionsmedizin geschaffen. Durch weiterentwickelte Erkenntnisse aus der Immunologie und der Serologie ist es heute möglich, Menschen mit angeborenen oder erworbenen anämischen Zuständen spezielle Blutpräparate zu übertragen und dadurch vielfach Leben zu retten.
Definition
Unter Transfusion (lat.: transfusio = das Hinübergießen) versteht man die Übertragung von Blut und Blutderivaten an einen Menschen.
28.1.1 Indikation
Durch eine Reihe von Erkrankungen, Verletzungen und Operationen können Blutungen eintreten und die Hämostase (Blutstillung) stören und damit eine vitale Bedrohung des Patienten verursachen. Insofern ist die Transfusion von Blut- und Blutbestandteilkonserven indiziert bei
-
erhöhter Infektionsanfälligkeit (bei Leukozytopenie),
-
Gefahr einer unstillbaren Blutung (bei Thrombozytopenie),
-
Unfall mit großem Blutverlust (zu wenig Erythrozyten als Sauerstoffträger).
Das macht deutlich, dass erwachsene Patienten vielfach Blut oder Blutderivate, eben den „Saft des Lebens“ benötigen, um aus einer vital bedrohlichen Situation zu gelangen.
Lebensphase Kind
Bluttransfusion
Auch bei Neugeborenen und Kindern kann eine Bluttransfusion notwendig werden, z.B. nach einem Unfall mit hohem Blutverlust. Da das kindliche Immunsystem noch nicht vollständig entwickelt ist, sind Kinder anfälliger für Nebenwirkungen. Die Notwendigkeit der Verabreichung gilt es deshalb immer im Einzelfall zu prüfen.
Hinzu kommen unterschiedliche Blutvolumina sowie unterschiedliche altersbezogene Transfusionsgrenzen. Die für diese Kinder geltenden Richtlinien zur Transfusion sind hinterlegt in den „Hämotherapierichtlinien“ und den „Querschnittsleitlinien zur Therapie mit Blutkomponenten und Plasmaderivaten“, herausgegeben von der Bundesärztekammer.
Zur Beurteilung einer Situation, die eine Bluttransfusion indiziert, sind Kenntnisse über die Blutkomponenten erforderlich.
28.1.2 Zusammensetzung und Funktionen des Blutes
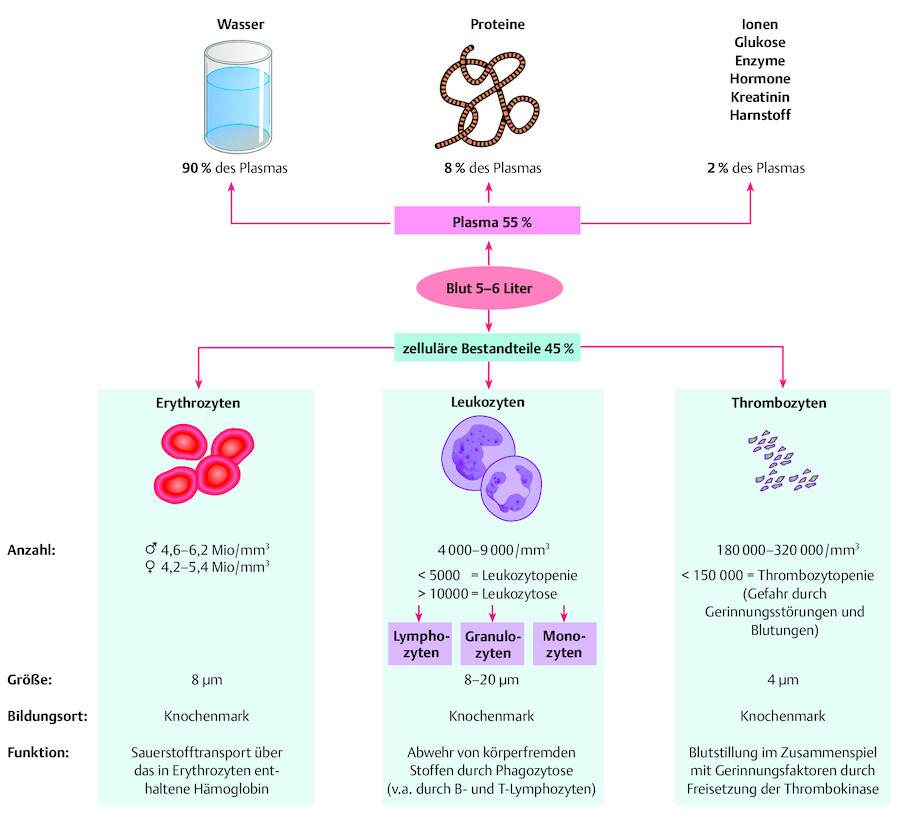
Das Blutvolumen beträgt bei einem Erwachsenen ca. 6–8 % des Körpergewichts. Dies macht bei einem Körpergewicht von 70 kg zwischen 5 und 6 Litern aus. Es teilt sich in ( ▶ Abb. 28.1):
Blutzusammensetzung.
Abb. 28.1 Feste und flüssige Bestandteile des Blutes.
-
flüssige Bestandteile: Blutplasma (ca. 55 %) und
-
zelluläre (korpuskuläre) Bestandteile: Blutzellen (ca. 45 %)
90 % des Plasmas bestehen aus Wasser, 8 % sind Proteine, der Rest verteilt sich auf Zucker, Hormone und andere Stoffe.
Besonderheiten bei Kindern
Bei Neugeborenen finden sich mütterliche Antikörper, die ggf. eine spezifische Abwehrreaktion bei Transfusion hervorrufen können. Die hämatologischen Normwerte sind altersabhängig und weichen von denen Erwachsener ebenso ab wie das Kreislaufvolumen ( ▶ Tab. 28.1 ).
|
Kreislaufvolumen in ml/kg Körpergewicht |
Hämoglobin (Hb) in g/dl |
Hämatokrit (Hk) in % |
Thrombozyten (pro nl) |
Erythrozyten (Milo./ml) |
Leukozyten (pro nl) |
|
|
Frühgeborene |
95 |
14,5–22,5 |
41–62 |
> 150 |
3,9–5,3 |
5,0–34 |
|
Neugeborene |
85 |
14,5–22,5 |
41–62 |
100–250 |
3,9–5,3 |
5,0–34 |
|
Säuglinge |
75–80 |
9,2–16,6 |
30–48 |
100–250 |
3,3–5,3 |
5,0–19,5 |
|
Kinder |
70–75 |
11,5–15,5 |
34–47 |
150–350 |
4,2–5,5 |
4,5–17,0 |
Zu den zellulären Bestandteilen gehören Erythro-, Leuko- sowie Thrombozyten. Die Hauptaufgabe der Erythrozyten besteht im Sauerstofftransport. Während Leukozyten als „Polizisten“ des Organismus fungieren und für die Abwehr von körperfremden Stoffen zuständig sind, sorgen die Thrombozyten in Kooperation mit Gerinnungsfaktoren für die Blutstillung bei Verletzungen.
Blut ist auch das Transportmittel für alle lebenswichtigen Stoffe, u.a. für Hormone und Nährstoffe, und sorgt gleichzeitig für den Abtransport von Abfall- und Schadstoffen.
28.1.3 Immunabwehr – Antikörper und Antigene
Mit der Untersuchung von Infektionskrankheiten entstand das Fach der Immunologie. Immunologen fanden bei der Untersuchung von Blutproben heraus, dass nach überstandener Krankheit eine Immunität gegen diese Erkrankungen eintrat. Das führte zu der Erkenntnis, dass Antikörper dafür verantwortlich sind.
Definition
Antikörper sind Glukoproteine, die nach Kontakt des Organismus mit artfremden Proteinen von B-Lymphozyten und Plasmazellen gebildet werden und im Serum bzw. Plasma zu finden sind. Sie bekämpfen das körperfremde Eiweiß.
Mit der Weiterentwicklung des Fachbereichs der Immunologie hin zur Serologie wurde das Ziel verfolgt, Gesetzmäßigkeiten der Antikörperbildung und -wirkung zu ergründen. So gelangte man zu der Erkenntnis, dass die Antikörperbildung nicht nur durch intakte lebende oder abgetötete Infektionserreger oder ihre Toxine angeregt wird, sondern auch durch Naturstoffe, die mit Infektionskrankheiten nichts zu tun haben. Dieser Gruppe von Stoffen gab man den Namen „Antigen“.
Definition
Antigene sind hochmolekulare Stoffe, zumeist Proteine (Eiweiße), die vom Organismus als artfremd erkannt werden und die Bildung von Antikörpern in Gang setzen.
Wird einem Menschen eine körperfremde Substanz (Antigen) über den Blutweg zugeführt, wird diese als artfremd erkannt und durch die Immunabwehr bekämpft. Dazu werden Antikörper gebildet, wodurch es zu einer Antigen-Antikörper-Reaktion kommt. Antikörper wirken auf 2 verschiedene Weisen:
-
Agglutination (Zellverklumpung)
-
Lyse (Auflösung)
Diese Erkenntnisse spielen für die Transfusionsmedizin eine bedeutende Rolle, da beide Wirkungen zu unerwünschten Reaktionen bei einer Transfusion und damit bis hin zum Tod führen können. Daher sind höchste Vorsicht und Konzentration erforderlich, wenn für einen Patienten eine Transfusion notwendig wird: Es darf zu keiner Verwechslung kommen!
28.1.4 Blutgruppen
Ehe es zu einer Bluttransfusion kommt, werden zahlreiche Analysen durchgeführt. Im Blut findet man typische Eigenschaften, die als Blutgruppe und Rhesusfaktor gekennzeichnet sind. Insofern unterscheidet man mehrere Blutgruppensysteme. Von besonderer Bedeutung sind:
-
AB0-System
-
Rhesus-System
28.1.4.1 AB0-System
Vererbung Nach den Vererbungsregeln von Gregor Mendel werden spezifische Eigenschaften vererbt (3 Mendel’sche Gesetze von 1865). Auf dem Genort (Lokus) der DNA-Kette befindet sich entweder die Information (Gen) für die Blutgruppe A oder B oder weder für A noch B. Diese Erbinformation befindet sich an jeder Zelle und somit auch auf der Oberfläche der Erythrozyten. Die Informationen tragenden Moleküle nennt man Antigene ( ▶ Abb. 28.2).
Blutgruppen.
Abb. 28.2 Die Blutgruppen A, B, AB und 0 unterscheiden sich durch die jeweils auf der Erythrozytenmembran lokalisierten Antigene und die im Blutplasma vorhandenen Antikörper.

Antigene Hat ein Mensch ein A-Antigen auf seiner Blutzelle, so hat er die Blutgruppe A. Dementsprechend hat eine Person die Blutgruppe B, wenn er B-Antigene auf seinen Blutzellen hat. Personen, die sowohl das A- als auch das B-Antigen haben, haben die Blutgruppe AB. Fehlen die Antigene A und B, handelt es sich um die Blutgruppe 0.
Antikörper Im Blutplasma befinden sich Antikörper, die gegen die Antigene auf den Erythrozyten einer anderen Blutgruppe gerichtet sind.
Blutgruppenverträglichkeit Diese Kenntnisse sind bei der Transfusion von Blut klinisch relevant, da sich verschiedene Blutgruppen nicht vertragen. Würde z. B. einem Menschen mit der Blutgruppe A Blut der Gruppe B übertragen, käme es zu einer Antigen-Antikörper-Reaktion und das Blut würde agglutinieren (verklumpen).
Dementsprechend dürfen i. d. R. nur Erythrozytenkonzentrate übertragen werden, die die gleiche Blutgruppe haben wie der Empfänger. Möglich sind aber auch AB0-kompatible (verträgliche) Transfusionen von Erythrozytenkonzentraten, die in ▶ Tab. 28.2 dargestellt sind.
|
Empfänger Blutgruppe |
Häufigkeit in % |
Serumagglutinine (Antikörper) |
AB0-kompatible Transfusion |
|
A |
43 |
Anti-B |
A oder 0 |
|
B |
11 |
Anti-A |
B oder 0 |
|
AB |
5 |
keine |
AB, A, B oder 0 |
|
0 |
41 |
Anti-A und Anti-B |
0 |
Blutgruppenverteilung Die Blutgruppen sind in der Bevölkerung sehr unterschiedlich verteilt.
28.1.4.2 Rhesussystem
Man unterscheidet weitere Antigene, die nach dem 1940 entdeckten Rhesussystem eingeteilt sind. Es handelt sich um Antigene, die sich ausschließlich an der Erythrozytenmembran, aber nicht an anderen Zellen im Organismus befinden.
Insgesamt unterscheidet man Antigene, die mit D, d, C, c, E und e bezeichnet werden. Ist der Buchstabe groß geschrieben, so ist das Antigen dominant. Ein kleiner Buchstabe bezeichnet das Fehlen des Antigens.
Das wichtigste, klinisch relevante ist das Antigen D, über das ca. 85 % der Menschen verfügen. Diese Menschen gelten als Rhesus-positiv (Rh-positiv). 15 % der Menschen haben dieses Antigen nicht und sind damit Rhesus-negativ (rh-negativ). Für sie wird der Buchstabe „d“ benutzt. Die Antikörper gegen diese Antigene werden erst nach einem Kontakt mit einem Antigen des Rhesussystems gebildet. Dies kann z. B. durch Schwangerschaft oder durch eine blutgruppenungleiche Transfusion geschehen.
28.1.4.3 Weitere Blutgruppensysteme
Neben diesen beiden beschriebenen Blutgruppensystemen gibt es noch einige andere Gruppen, von denen das Kell-System das bedeutsamste ist. Zur Minimierung von Transfusionszwischenfällen werden das Kell-Antigen (groß) K und das Cellano-Antigen (klein) k untersucht. Circa 8 % der mitteleuropäischen Bevölkerung sind Kell-pos. und ca. 92 % Kell-neg.
Das Duffy-, Kidd- und Lewis-Antigensystem sind nur dann von Bedeutung, wenn Antikörper vorliegen, die auch in diesen Systemen eine gruppengleiche Transfusion erforderlich machen.
28.1.5 Formen der Transfusion
Zur Bluttransfusion ist ein Spender erforderlich, dem eine gewisse Menge Blut entnommen wird. Das Blut wird untersucht, aufbereitet, in spezielle Behälter abgefüllt und bereitgestellt. Man unterscheidet
-
Fremdbluttransfusion (Spender und Empfänger sind 2 Personen) und
-
autogene Bluttransfusion (Spender = Empfänger).
28.1.5.1 Fremdbluttransfusion – Untersuchungen
Die Labortests sind sehr aufwendig, vielfältig und komplex. Zur Analyse des Spenderblutes gehören folgende Untersuchungen:
-
Feststellung von pathogenen Keimen (HIV, Hepatitis B, C oder D)
-
Bestimmung der Blutgruppe
-
Ermittlung von evtl. vorhandenen Antikörpern (Kreuzprobe)
Bestimmung der Blutgruppen des AB0-Systems
Nach Ausschluss von pathogenen Keimen wird das frische Spenderblut in verschiedenen Monovetten mit den 3 Testreagenzien (Anti-A, Anti-B und Anti-AB = Antikörper) gemischt und zentrifugiert. Danach wird das Blut über einer Lichtquelle geschüttelt und optisch auf Agglutination geprüft. Durch Fehlen oder Vorhandensein einer Agglutination erfolgt die Klassifikation der Blutgruppe.
Lebensphase Kind
Blutgruppe
Bei Neugeborenen werden die Antikörper meist zwischen dem 3. und 6. Lebensmonat gebildet. Die Entwicklung der AB0-Antigene ist bis dahin noch nicht abgeschlossen. Dementsprechend werden bei Neugeborenen 2 Testreihen zur Bestimmung der AB0-Eigenschaften durchgeführt und darauf hingewiesen, dass die Blutgruppe zu einem späteren Zeitpunkt nochmals zu bestimmen ist.
Bestimmung des Rhesusmerkmals
Im nächsten Schritt wird das Spenderblut mit mindestens 2 Testreagenzien (monoklonale Antikörper) vermischt. Sind beide Tests negativ (keine Agglutination), gilt der Spender als rh-negativ. Sind beide Tests positiv, gilt er als Rh-positiv. Weisen die Proben unterschiedliche Ergebnisse auf, werden weitere Tests erforderlich (indirekter Coombs-Test, s. u.).
Ermittlung von Antikörpern – Kreuzprobe
Antikörper im Blut des Empfängers oder des Spenders führen durch Antigen-Antikörper-Reaktionen zu Transfusionszwischenfällen. Sie finden sich im AB0-System, im Rhesus-System und in anderen Systemen wie Kell, Kidd u. a. Im Labor werden Spender- und Empfängerblut mit der sog. Kreuzprobe (serologische Verträglichkeitsprobe) überprüft.
Die Kreuzprobe ist die wichtigste serologische Prüfung vor Verabreichung einer Bluttransfusion. Es handelt sich um eine In-vitro-Prüfung (in vitro = im Reagenzglas) der Blutgruppenverträglichkeit von Spender- und Empfängerblut. Ihr Ziel ist eine optimale Erfassung aller Antikörper, sowohl beim Empfänger als auch beim Spender, die eine Transfusionsreaktion im Sinne einer Hämolyse (Zerstörung der Erythrozyten) verursachen könnten. Die Deutsche Gesellschaft für Transfusionsmedizin hat die Kreuzprobe vor der Transfusion von Blut zwingend vorgeschrieben.
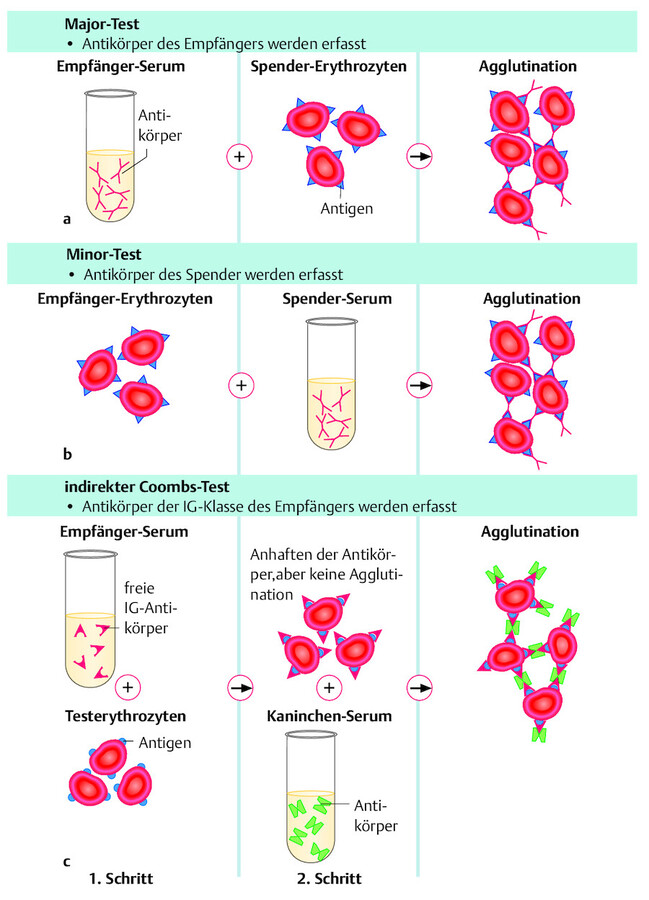
3-Stufen-Test Die Kreuzprobe wird immer im 3-Stufen-Test durchgeführt, um Unverträglichkeiten in allen Systemen zu erfassen ( ▶ Abb. 28.3):
3-Stufen-Test.
Abb. 28.3 Die Kreuzprobe dient der Erfassung aller Antikörper, sowohl beim Empfänger als auch beim Spender (a–c).
-
Major-Test
-
Minor-Test
-
Coombs-Test
Major-Test
Mit Ausnahme von Neugeborenen, evtl. alten und immunsupprimierten Menschen (nach Behandlung mit Antibiotika oder Kortison und anderen Chemotherapeutika) verfügen alle anderen Menschen über Antikörper gegen AB0-Antigene. Man bezeichnet diese Antikörper als reguläre Antikörper. Alle anderen evtl. vorhandenen Antikörper werden als irreguläre Antikörper bezeichnet, die z. B. nach einer Schwangerschaft entstehen oder sich nach einer Bluttransfusion oder nach Kontakt mit Mikroorganismen entwickeln können. Man findet irreguläre Antikörper bei 1 – 2 % aller Menschen mit der Blutgruppe A und zu 25 % bei der Blutgruppe AB.
Zum Ausschluss irregulärer Antikörper des Empfängers wird das Serum des Empfängers mit Erythrozyten des Spenders in einem Reagenzglas oder auf einem Objektträger gemischt und 20 Minuten lang bei 37 °C beobachtet. Zeigt sich makroskopisch und mikroskopisch eine Agglutination, spricht man von einer positiven Kreuzprobe ( ▶ Abb. 28.3 a). Diese Transfusion darf nicht verabreicht werden!
Minor-Test
Bei der Gegenprobe werden zum Ausschluss irregulärer Antikörper des Spenders gegen Antigene des Empfängers Erythrozyten des Empfängers mit Serum des Spenders gemischt und auf gleiche Weise untersucht ( ▶ Abb. 28.3 b). Auch hier darf das Blut nicht agglutinieren.
Coombs-Test (Antihumanglobulintest)
Da durch Major- und Minor-Test nicht alle Antikörper nachgewiesen werden können, schließt sich ein dritter Test an, der als Coombs-Phase oder auch als Coombs-Test bezeichnet wird.
Direkt Beim direkten Coombs-Test werden bisher nicht erfasste, im Patientenserum enthaltene inkomplette Antikörper der IgG(Immunglobulin)-Klasse und Komplementkomponenten, die sich auf dem Erythrozyten befinden, durch Zugabe eines Testserums (Antihumanglobulin) nachgewiesen.
Indirekt Der indirekte Test dient dem Nachweis von freien Antikörpern im Serum des Empfängers. Der Test verläuft 3-stufig. Serum des Empfängers und Testerythrozyten werden bei 37 °C inkubiert. Nicht agglutinierte, mit den inkompletten (freien) Antikörpern des Patienten beladene Testerythrozyten werden in einer Kochsalzlösung gewaschen. Danach wird auch hier das Testserum (auch Coombs-Serum genannt) hinzugefügt. Sind im Blut Antikörper der IgG-Klasse vorhanden, wird eine Agglutination ausgelöst ( ▶ Abb. 28.3 c).
Merke
Nur wenn alle Tests der Kreuzprobe negativ sind, darf dem Empfänger Spenderblut übertragen werden. Sollte nochmals Blut benötigt werden, muss die Kreuzprobe nach 3 Tagen wiederholt werden, da Antikörper nach einer Bluttransfusion auftreten können.
Vorgehen bei Notfällen Ein Abweichen von den vorgeschriebenen Richtlinien ist bei absoluten, lebensbedrohenden Notfällen möglich. Dies wird dann durch den transfundierenden Arzt schriftlich dokumentiert. Es bleibt aber bei der Bestimmung der AB0-Blutgruppe und des Rhesusfaktors durch die Blutbank und aufseiten des transfundierenden Arztes bei der serologischen Verträglichkeitsprobe (Kreuzprobe).
28.1.5.2 Autologe Bluttransfusion
Zur Vermeidung von infektiösen und immunologischen Risiken der Fremdbluttransfusion können auch Eigenblut bzw. Eigenblutbestandteile (auto = eigen) transfundiert werden. Unterschieden werden
-
präoperative Eigenblutspende,
-
Hämodilution,
-
maschinelle intraoperative Autotransfusion.
Präoperative Eigenblutspende
Vor einer geplanten OP mit der Wahrscheinlichkeit, Blut transfundieren zu müssen, kann einem Patienten nach Ausschluss von Kontraindikationen Blut entnommen und später zurückgegeben werden. Während die Risiken bei der Entnahme seines Blutes identisch sind mit denen einer Fremdblutspende liegen die Vorteile darin, dass zahlreiche Gefahren und Komplikationen ausgeschlossen werden können. Dazu gehört die Verhinderung
-
der Bildung von spezifischen Antikörpern im leuko-, thrombo- und erythrozytären System
-
von Plasmaunverträglichkeiten sowie
-
die Vermeidung von viralen Infektionen.
Die beiden Erythrozytenkonzentrate werden aus Vollblut oder mittels eines speziellen Verfahrens (Zellseparator) gewonnen und anschließend mit allen notwendigen Daten des Patienten analog zur Fremdblutspende versehen. Zusätzlich wird der Hinweis „nur zur Eigenblutspende“ addiert. Die Unterschrift des Patienten auf den Konserven erhöht die Sicherheit. So gewonnene Blutkonserven dürfen nicht an Dritte weitergegeben werden.
Bei Kindern mit einem Körpergewicht < 10 kg wird keine Eigenblutspende empfohlen. Gleiches gilt für Schwangere und für Patienten mit Tumoren (Einzelfallentscheidung).
Zu den Kontraindikationen gehören:
-
Erkrankungen des blutbildenden Systems, Gerinnungsstörungen
-
Anämie (Männer Hb < 13,5 g/dl, Frauen < 12,0 g/dl)
-
dekompensierte Herzinsuffizienz und instabile Angina pectoris
-
schwere Aortenstenose, schwere Lungenfunktionsstörungen
-
metastasierende Tumorerkrankungen
-
Infektionserkrankungen
-
Apoplexie, Kachexie
Durchführung
Um einen Patienten nicht durch die Eigenblutspende zu gefährden, wird bei ihm eine Untersuchung durchgeführt. Dabei werden Diagnosen zu Alter, Gewicht, Blutdruck, zur Funktion des Herzens und der Atmung sowie Begleiterkrankung wie Diabetes mellitus gestellt und mit Punkten beurteilt (Punkte = engl.: score). Je höher der Score, desto größer ist die Gefährdung des Patienten. Nach der Überprüfung des Risiko-Scores zur Eigenblutspende wird Blut entnommen und im Labor wie bei der Herstellung von Fremdblut überprüft.
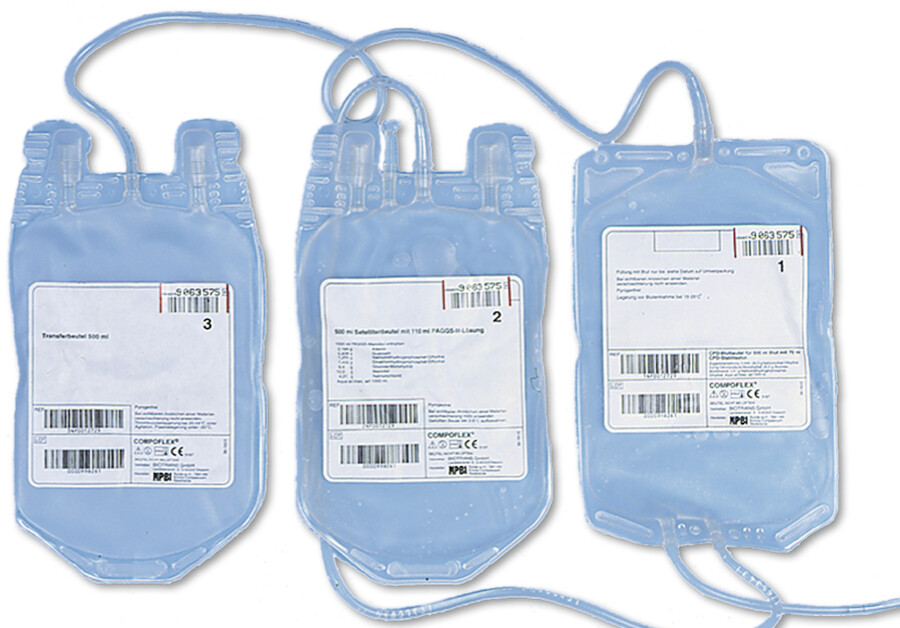
Die eigentliche Entnahme von Eigenblut (jeweils 500 ml) erfolgt in Intervallen ab 4 Wochen vor dem geplanten operativen Eingriff. Über eine großlumige Kanüle wird das abzuleitende Blut in 3 miteinander verbundene Konservenbeutel ( ▶ Abb. 28.4) geleitet. Unmittelbar am Patienten werden diese Beutel noch mit speziellen Kodierungen versehen, sodass eine spätere Verwechslung ausgeschlossen ist.
3 miteinander verbundene Blutbeutel zur Eigenblutspende.
Abb. 28.4
Als Flüssigkeitsersatz erhält der Patient unmittelbar nach der Blutentnahme 500 ml isotone Ringer-Lösung. Die Haltbarkeit beträgt für
-
Erythrozytenkonzentrate 35 – 42 Tage
-
Frischplasmen zwischen 1 – 2 Jahre.
28.1.5.3 Hämodilution
Die Hämodilution stellt eine Sonderform der autologen Bluttransfusion dar und wird v. a. unmittelbar präoperativ eingesetzt. Patientenblut wird in spezielle Blutbeutel abgeleitet, die mit allen Daten des Patienten versehen sind. Das entnommene Volumen wird parallel in Form von kristalloiden (kochsalzähnliche, niedermolekulare) oder kolloidalen (hochmolekulare, die Blutbahn nicht verlassende) Lösungen über einen zweiten venösen Zugang ersetzt, womit eine Isovolämie (Konstanz des Blutvolumens) erzielt wird.
Merke
Während der Hämodilution wird der Patient engmaschig überwacht: Kontrolle des Blutdrucks, kontinuierliche Ermittlung der Herzfrequenz sowie der ▶ Sauerstoffsättigung und, falls erforderlich, des ▶ zentralvenösen Drucks.
Sollte es während der nachfolgenden Operation zu einer chirurgisch bedingten Blutung kommen, können dem Patienten die beiden Konserven zurückgegeben werden.
Dabei ist zu bedenken, dass die Konserven nicht lagerungsfähig sind und innerhalb von 6 Stunden genutzt werden müssen.
28.1.5.4 Maschinelle Autotransfusion
Verliert ein Patient während einer Operation Blut, so kann dieses aufgefangen und aufbereitet werden. Dazu stehen spezielle Geräte, sog. Cell-Saver („Zellenretter“) zur Verfügung. Das Blut aus dem OP-Gebiet wird steril abgesaugt, in ein am Cell-Saver befindliches Reservoir geleitet, zentrifugiert und dabei von unerwünschten Bestandteilen wie Spülflüssigkeit, Antikoagulanzien (Hemmstoffe der Blutgerinnung), aktivierten Gerinnungsfaktoren, Zelltrümmern und freiem Hämoglobin befreit. Dabei werden allerdings auch Thrombozyten und Plasma entfernt ( ▶ Abb. 28.5). Das so gewonnene Blut muss innerhalb von 6 Std. retransfundiert werden. Folglich kann auch unmittelbar nach der Operation Blut über geschlossene Drainagen aufgefangen, aufbereitet und retransfundiert werden, wie es auf IMC- und Intensivstationen bzw. auch im Aufwachraum der Anästhesie vorkommt.
Maschinelle Autotransfusion (MAT).
Abb. 28.5
Abb. 28.5a Cell-Saver zur autologen Bluttransfusion,
(Foto: D. Stolecki)

Abb. 28.5b Separations- und Waschglocke der Zentrifuge.
(Foto: D. Stolecki)

Merke
Grundsätzlich kontraindiziert ist der Einsatz des Cell-Savers bei septischen Infektionen und malignen Tumoren, da es sonst zu einer hämatogenen Streuung von Keimen bzw. Tumorzellen kommt. Wenn die Möglichkeit besteht, kann man bei Tumorerkankten das gewonnene Blut bestrahlen und zurückgeben.
28.1.6 Blutprodukte
Für die Therapie von anämischen Zuständen und Gerinnungsstörungen steht eine Vielzahl von Blutkonserven und Blutderivaten zur Verfügung, die allesamt dem Arzneimittelgesetz unterliegen. In diesem Kontext hat der Gesetzgeber entschieden, dass Erythrozytenkonzentrate nicht aus Blut von unterschiedlichen Spendern hergestellt werden dürfen. Zusätzlich ist gesetzlich vorgeschrieben, dass die Leukozyten aus einem Erythrozytenkonzentrat durch Filtrierung entfernt sein müssen, was als Leukozytendepletion bezeichnet wird. Es dient der Minimierung möglicher Abwehrreaktionen des Empfängers auf spezifische Antigene des Spenders.
Nicht mehr indiziert sind Transfusionen mit Voll- und Warmblutkonserven. Durch eine Transfusion von Vollblutkonserven können Gerinnungsstörungen entstehen. Warmblutkonserven sind dagegen nicht auf Infektionsparameter untersucht.
▶ Tab. 28.3 gibt einen Überblick über Indikationen, Zusammensetzung, Lagerungsart und -dauer.
|
Präparat |
Herstellung |
Indikation |
Lagerungsart und -dauer |
Besonderheiten |
||||||||
|
Erythozytenkonzentrate |
||||||||||||
|
Erythrozytenkonzentrate (Ery-Konz.) in Additivlösung, leukozytendepletiert, buffy-coat-frei
|
Gewinnung durch Abfiltrierung von Leukozyten mittels spezieller Leukozytenfilter; dadurch Minimierung der Gefahr einer Immunisierung gegen leukozytäre Antikörper, Reduktion der Übertragung von intrazellulären Viren, z. B. Zytomegalievirus |
|
|
|
||||||||
|
gewaschenes Ery-Konz. |
durch mehrmaliges Aufschwemmen mit 0,9%iger Kochsalzlösung und Zentrifugierung befindet sich abschließend kein Plasma mehr im Konzentrat |
|
|
|
||||||||
|
bestrahlte Ery-Konzentrate |
|
bei immunsupprimierten Patienten, Knochenmarktransplantation, Leukämien, malignen Tumoren und Chemotherapie |
7 Tage bei + 2°C–6 °C im Kühlschrank |
Durch die Bestrahlung wird die Membran der Erythrozyten beeinträchtigt und Kalium vermehrt freigesetzt. |
||||||||
|
kryokonservierte Ery-Konzentrate |
|
bei Patienten mit komplexen Antikörpergemischen bzw. mit Antikörpern gegen spezifische Blutgruppenmerkmale |
10–30 Jahre bei – 80 °C und tiefer |
sehr teuer und nur bei wenigen nationalen und internationalen Blutbanken vorrätig |
||||||||
|
Thrombozytenkonzentrate |
||||||||||||
|
Thrombozytenkonzentrat, leukozytendepletiert |
|
|
Werden bis zu 5 Tage in geschlossenen Abnahmesystemen bei 20–24 °C in Bewegung gehalten (Rotatoren) und aufbewahrt |
|
||||||||
|
Präparate mit Gerinnungsfaktoren |
||||||||||||
|
Gefrorenes Frischplasma (GFP) oder FFP – (fresh frozen plasma) |
|
|
|
|
||||||||
|
PPSB (Prothrombinkomplex) |
Gerinnungsfaktoren werden aus Plasmapools gewonnen und isoliert |
bei Hämophilie B (Mangel des Faktors IX) und bei Überdosierung von Marcumar |
zwischen +2°C und +6 °C |
|
||||||||
|
Faktor-VIII-Präparate |
werden aus großen Mengen Frischplasma gewonnen oder gentechnisch produziert |
|
Nicht über 25°C lagern |
allergische Reaktion bis zur Anaphylaxie möglich |
||||||||
28.1.6.1 Konservierung von Blutprodukten
Alle Blutkonserven, also Spenderblut wie Eigenblut, werden über eine großlumige Kanüle direkt in spezielle, kodierte Beutel abgefüllt, die mit der Blutgruppe, dem Rhesusfaktor, dem Entnahme- und dem Verfallsdatum versehen werden. Anstelle des Namens des Spenders wird für Konservenbeutel und Pilotröhrchen (spezielle Blutprobenröhrchen) ein Kodierstreifen verwendet.
In den Konservenbeuteln befinden sich Stabilisatoren, durch die das Blut künstlich haltbar gemacht wird.
ACD-Stabilisator ACD bezeichnet die Kombination von Zitronensäure (Acidum citricium), Natriumzitrat (Citricium sodium) und Traubenzucker (Dextrose). Die Dextrose ernährt die Erythrozyten. Das Zitrat bindet Kalzium und hebt damit die Blutgerinnung auf. Die Zitronensäure verhindert eine Karamellisierung der Zusatzstoffe bei der Sterilisation des Blutes. Mit ACD konservierte Konzentrate können bis zu 28 Tage überleben.
CPDA-Stabilisator Dieser Stabilisator besteht aus einer Kombination von Zitronensäure, Phosphat, Dextrose und Adenin. Phosphat unterstützt den Zuckerstoffwechsel der Erythrozyten und Adenin verlängert die Haltbarkeit. Erythrozytenkonzentrate mit den Stabilisatoren CPDA können zwischen 35 und 42 Tage gelagert werden.
28.1.7 Rechtliche Aspekte im Umgang mit Transfusionen
Mit der Novellierung des Transfusionsgesetzes und weiteren Ergänzungen in den Folgejahren hat die Bundesärztekammer das Anlegen einer Transfusion als eine nicht zu delegierende ärztliche Aufgabe definiert. Dazu gehören auch vorbereitende Tests wie der sog. ▶ Bedside-Test.
Transfusionsverantwortlicher In jeder Klinik muss ein Transfusionsverantwortlicher bestellt werden, der für alle transfusionsmedizinischen Fragen zuständig ist, über notwendige Kompetenzen verfügt sowie eine spezifische Qualifikation hat.
Transfusionsbeauftragter Zusätzlich ist für jede Abteilung ein Transfusionsbeauftragter zu benennen, der über Grundkenntnisse und Erfahrung verfügen muss.
Dokumentationspflicht Für alle transfusionsmedizinischen Präparate besteht eine umfassende Dokumentationspflicht. Bei Problemen und Komplikationen sind alle mit dem transfundierten Blutprodukt in Verbindung stehenden Personen und Institute bis hin zur Bundesbehörde (Paul-Ehrlich-Institut) zu benachrichtigen. Alle mit der Transfusion auszufüllenden Dokumente müssen 15 Jahre aufbewahrt werden.
28.1.7.1 Ablehnen von Transfusionen
Jeder hat das Recht, die Transfusion von Blutprodukten abzulehnen, sei es aus religiösen Gründen (z. B. Zeugen Jehovas) oder aus anderen Erwägungen. Die Verantwortung trägt der Entscheidende selbst. Der zuständige Arzt kann aufgrund seiner Verantwortung und des abgelegten Eides wiederum die Behandlung des Patienten ablehnen, wenn durch den Verzicht auf Transfusionen das Risiko für einen operativen Eingriff zu groß ist und Komplikationen befürchtet werden.
Recht im Fokus
Lehnen Eltern z.B. aus religiösen Gründen eine lebensnotwendige Bluttransfusion bei ihrem Kind ab, ist es die Pflicht der Ärzte, in die elterliche Sorge einzugreifen und das Vormundschaftsgericht zu benachrichtigen.
Dieses kann dann den Eltern für den Zeitraum der lebensrettenden Notfallmaßnahme ihr Sorgerecht entziehen.
28.2 Situation des Patienten
Trotz immer besserer medizinischer Aufklärung haben Menschen unverändert sehr unterschiedliche Einstellungen zum Thema der Transfusion. Einige Menschen fürchten sich vor einer Transfusion, was bedingt ist durch das Wissen um mögliche Komplikationen wie bakterielle oder virale Infektionen, die u. U. eine Hepatitis oder AIDS induzieren und deren Verlauf gar tödlich enden kann. Andere Menschen haben eher eine indifferente Vorstellung. Jedoch steht dieses „Lebenselixir“ z. Z. nicht mehr in ausreichendem Umfang zur Verfügung, sodass Blutbanken von einer deutlichen Mangelversorgung sprechen.
Merke
Jeder Mensch kann unverhofft in die Situation gelangen, dass Blut übertragen werden muss.
Fallbeispiel
Herr Müller, 36 J. alt, hat als Elektriker einen Arbeitsunfall. Auf einem Gerüst übersieht er ein liegendes Kabel am Boden, stolpert und stürzt 5 Meter tief auf einen Zaun. Er kommt mit einem Polytrauma (Mehrfachverletzung, von der eine oder die Kombination lebensbedrohlich ist) in die Klinik. Die Diagnose lautet: Oberschenkel- und Beckenfraktur, Milzruptur, Durchspießung des linken Lungenlappens. Sein Hb beträgt 6,5 g/dl, die Erythrozyten im Blut sind auf 2,7 Milo./μl, die Thrombozyten auf 160 000/μl abgefallen.
Aufgrund des massiven Blutverlustes und der noch nicht gestillten Blutungen besteht absolute Lebensgefahr. Damit werden sofort 12 Erythrozyten-, 2 Thrombozytenkonzentrate sowie 12 Beutel Frischplasma bestellt.
28.3 Pflege- und Behandlungsplan
Die Indikationsstellung wie auch die Durchführung der Transfusionstherapie obliegen ausschließlich dem behandelnden Arzt und sind nicht delegierbar. Lediglich die Durchführung eines Bedside-Tests kann an Pflegende übergeben werden, das allerdings nur unter direkter Aufsicht eines Arztes.
Aufgaben der Pflege Im Rahmen der Transfusionstherapie ergeben sich folgende Schwerpunkte:
-
Vorbereitung, Lagerung und Kontrolle der Blutkonserven
-
Überwachung während der Transfusion
-
allgemeine Krankenbeobachtung und Erkennen von Früh- und Spätkomplikationen
-
erste Maßnahmen bei hämolytischen Transfusionszwischenfällen
28.3.1 Vorbereitung, Lagerung und Kontrolle der Blutkonserven
Der vom Arzt unterschriebene Anforderungsschein wird der Blutbank überstellt. Die georderten Blutkonserven werden nach dem Empfang überprüft:
-
Stimmen Patientendaten überein?
-
Sind Blutgruppe und Kreuzprobe bestimmt?
Werden die Konzentrate erst später gebraucht, müssen die Konserven im Kühlschrank gelagert werden. Sind sie für den sofortigen Gebrauch vorgesehen, so werden die Konserven sorgfältig bei 37 °C angewärmt.
Merke
Zur Erwärmung dürfen nur zu diesem Zweck hergestellte Geräte benutzt werden, da die Gefahr besteht, dass das Blut sonst zu warm wird und eine Hämolyse einsetzt.
28.3.1.1 Aufbewahrung
Blutkonserven müssen je nach Art sehr unterschiedlich aufbewahrt werden. Erythrozytenkonzentrate müssen z. B. zur Verhinderung der Hämolyse (Auflösung der Erythrozyten) bei 2 – 6 °C in einem erschütterungsfreien Kühlschrank gelagert werden. Die Kühlschränke müssen mit einer Messeinrichtung zur kontinuierlichen Registrierung der Temperatur versehen sein.
Merke
Die Kühlkette der Konserven darf weder für den Transport noch in der Klinik unterbrochen werden, wenn die Konzentrate nicht sofort transfundiert werden sollen. Erreicht die Konserve eine Temperatur von 10 °C, darf sie nicht erneut im Kühlschrank gelagert werden.
28.3.1.2 Vorbereitung der Konserve
Für die Transfusion wird der Konservenbeutel mit einem Transfusionsbesteck verbunden (nach DIN 58 360, Porengröße 170 – 230 μm, ▶ Abb. 28.6).
Transfusionsleitung (170 μm) mit Filter.
Abb. 28.6

Nach nochmaliger Überprüfung der Patientendaten wird folgendermaßen vorgegangen (Vorbereitung einer Blutkonserve ▶ Abb. 28.7):
Die Fotoserie zeigt, wie eine Blutkonserve vorbereitet wird.
Abb. 28.7
Abb. 28.7a Arbeitsfläche und Materialien vorbereiten. Handschuhe anziehen. Patientendaten prüfen und Transfusionsbesteck aus der Verpackung nehmen.
(Foto: K. Gampper, Thieme)
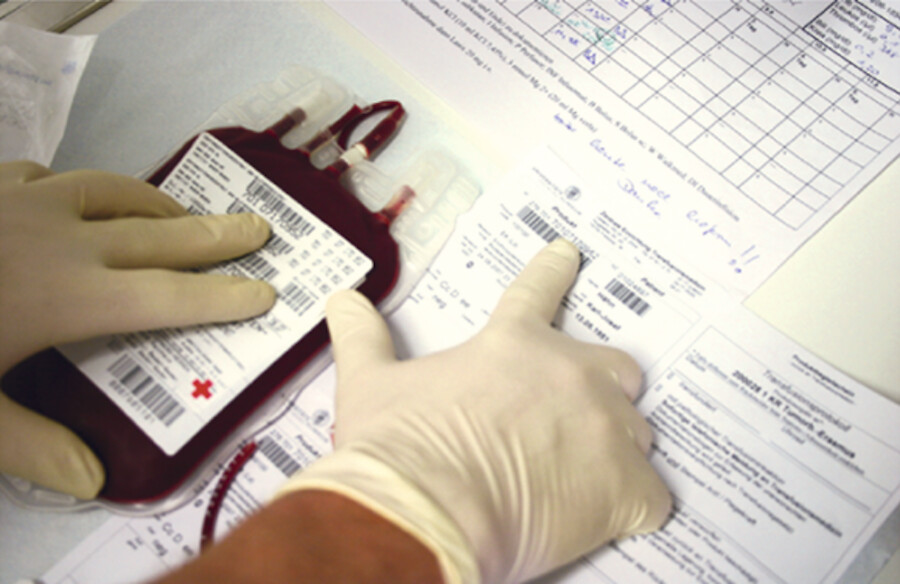
Abb. 28.7b Gegebenenfalls Anstechöffnung desinfizieren und den Einstichdorn einführen. Durchflussregler geöffnet lassen und Tropfkammer leicht anheben. Durch leichten Druck auf den Konservenbeutel Blut in die auf dem Kopf stehende Tropfkammer pressen und bis zur Hälfte füllen.
(Foto: W. Krüper, Thieme)
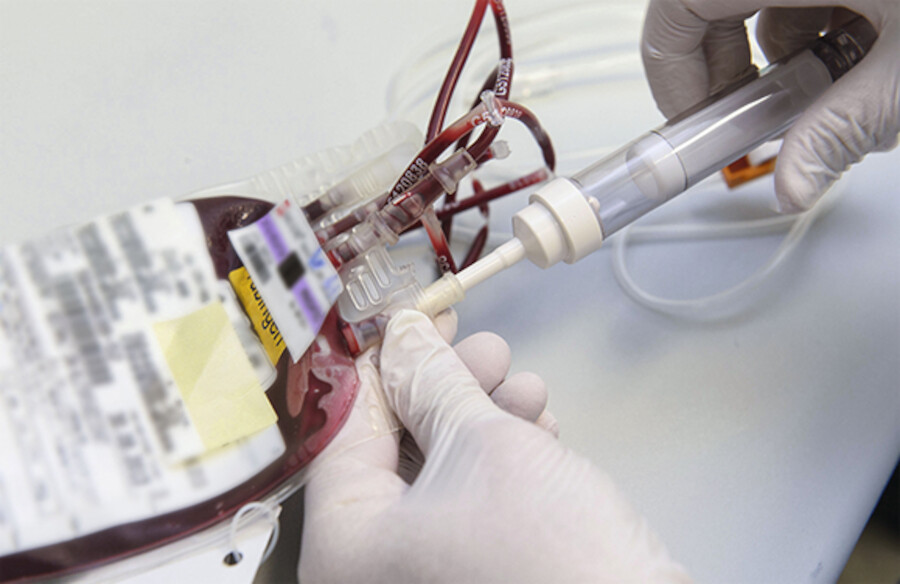
Abb. 28.7c Durchflussregler schließen und den Konservenbeutel am Infusionsständer aufhängen. Übertragungssystem vollständig entlüften und Durchflussregler schließen. Materialien entsorgen und Arzt informieren.
(Foto: W. Krüper, Thieme)

-
Handschuhe anziehen, Arbeitsfläche wischdesinfizieren, Einwirkzeit beachten
-
Handschuhe ausziehen, Händedesinfektion
-
benötigte Materialien vorbereiten (Blutbeutel, Transfusionsbesteck, Infusionsständer, Desinfektionsmittel, Einmalhandschuhe)
-
Konserve auf Unversehrtheit und Haltbarkeit prüfen, Nummer des Lieferscheins und der Konserve müssen übereinstimmen!
-
Handschuhe anziehen
-
Transfusionsbesteck aus der unbeschädigten Verpackung nehmen
-
Kunststoffversiegelung des Blutbeutels abdrehen, ggf. desinfizieren
-
Transfusionsbesteck mit dem Einstichdorn in den Konservenbeutel einführen
-
Durchflussregler geöffnet lassen und Tropfkammer leicht anheben
-
durch leichten Druck auf den Konservenbeutel Blut in die auf dem Kopf stehende Tropfkammer pressen und sie bis zur Hälfte füllen
-
Durchflussregler schließen und den Konservenbeutel am Infusionsständer aufhängen
-
Übertragungssystem vollständig entlüften und Durchflussregler schließen
-
Materialien entsorgen und Arzt informieren
28.3.1.3 AB0-Identitäts- oder Bedside-Test
Unmittelbar vor der Transfusion überprüft der verantwortliche Arzt die Blutgruppenmerkmale des Empfängerbluts auf einer speziellen Karte. Da der Test am Bett des Patienten stattfinden muss, heißt er Bedside-Test. Auch dieser Test ist zwingend vor der Transfusion von der Bundesärztekammer vorgeschrieben. Auf die Karten werden die im Kühlschrank aufzubewahrenden Testseren (Anti-A, Anti-B, Anti-AB und Anti-D) in die vorgezeichneten Felder gegeben. Danach erfolgt die Zugabe des Empfängerblutes. Bei Übereinstimmung der Blutgruppe und des Rhesusfaktors agglutiniert (verklebt, verklumpt) das Blut in den Feldern. ▶ Abb. 28.8 a zeigt, dass der Empfänger die Blutgruppe AB Rh-pos. hat. In manchen Kliniken wird zusätzlich noch das Konservenblut auf gleiche Weise geprüft, was aber nicht vorgeschrieben ist.
Bedside-Test.
Abb. 28.8 a Prinzip der Blutgruppenbestimmung auf mit Antigen-Testseren präparierten Testkarten. b Medtrokarte. Im linken, blauen Testfeld (Anti-A) sieht man ein kleines Blutgerinnsel, im rechten, roten Testfeld (Anti-B) ist keine Reaktion abzulesen; der Patient hat also Blutgruppe A.
(Foto: W. Krüper, Thieme)
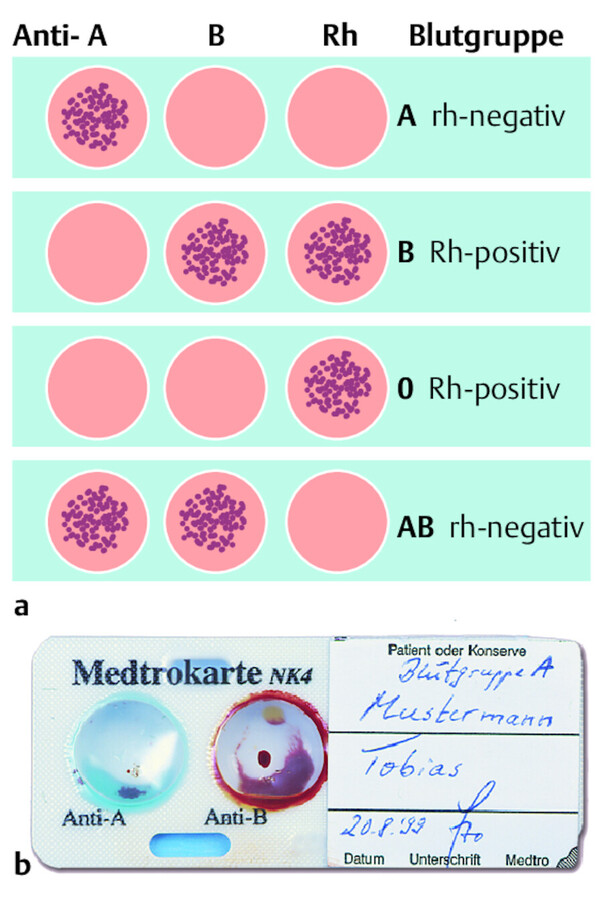
Andere Karten, z. B. Medtrokarte, enthalten bereits ein Testserum ( ▶ Abb. 28.8 b). Das Prinzip zur Bestimmung ist gleich. Das Beispiel zeigt eine Agglutination im Feld Anti-A, d. h., der Patient hat die Blutgruppe A. Stimmen die Daten des Patienten mit denen der Blutkonserve überein, kann transfundiert werden. Gibt es Unstimmigkeiten, ist die transfusionsmedizinische Einrichtung sofort zu benachrichtigen. Der Bedside-Test ist zu dokumentieren.
28.3.1.4 Biologische Vorprobe nach Oehlecker
Bei einer unklaren Kreuzprobe wird auf Empfehlung der Blutbank ein spezieller Test als biologische Vorprobe durchgeführt, auch wenn dieser Test Unsicherheiten aufweist.
Bei der Vorprobe nach Oehlecker handelt es sich um den Versuch der Früherkennung einer (akuten) Unverträglichkeitsreaktion. Der Arzt überträgt zügig 5 – 20 ml Blut einer überprüften Blutkonserve und stoppt dann die Transfusion. Für die nächsten 2–5 Minuten kontrolliert er dann das Befinden des Patienten. Mögliche Zeichen der Unverträglichkeit sind Unruhe, Übelkeit und Gesichtsrötung. Bleiben diese aus, so ist die Probe negativ und die Blutkonserve kann weiterlaufen.
28.3.2 Überwachung während der Transfusion
Um eine sichere Versorgung des Patienten zu gewährleisten, überwachen und versorgen Pflegende den Patienten kontinuierlich. Die engmaschige Überwachung ist insbesondere in den ersten 20 Minuten zu gewährleisten, da Frühkomplikationen dann eintreten. Zu den Beobachtungsmerkmalen gehören:
-
Patienten regelmäßig befragen, ob er sich wohlfühlt (Übelkeit, flaues Gefühl im Bauch, Schmerzen?).
-
Herzfrequenz, Blutdruck und Atmung kontinuierlich kontrollieren.
-
Haut insbesondere im Gesicht und am Körperstamm inspizieren (Flush, Urtikaria?).
-
Urin auf evtl. Verfärbung kontrollieren (Hämaturie).
-
Körpertemperatur kontrollieren.
-
Fließgeschwindigkeit des Blutes beobachten:
-
Einlaufzeit insgesamt ca. 1 Std. bei kardial suffizienten Patienten (ca. 40 – 60 Tropfen pro Minute)
-
Einlaufzeit 3 – 4 Std. bei Patienten mit Kreislaufinstabilität und zur Vermeidung einer Hypervolämie
-
-
Bedürfnisse des Patienten erfragen und so weit wie möglich erfüllen.
-
Bilanzierung durchführen: gesamte Menge an Blut notieren, wenn Ery-Set hinzugefügt, ebenfalls bilanzieren.
-
Alle ermittelten Parameter sowie die Angaben des Patienten dokumentieren.
Merke
Keine Glukose- oder Elektrolytlösungen in Kombination mit Blut über die gleiche Kanüle oder das gleiche Lumen laufen lassen (führt zur Hämolyse der Erythrozyten)!
28.3.3 Maßnahmen bei Beendigung der Transfusion
28.3.3.1 Blutkonserve
Die Blutkonserve wird steril abgeklemmt und sorgfältig verpackt mit dem Transfusionssystem und der Bedside-Testkarte für 24 Stunden im Kühlschrank aufbewahrt. Dadurch ist bei einer möglichen, verspäteten Transfusionsreaktion mit dem Rest des Konservenblutes (mindestens 10 ml) eine nachträgliche Überprüfung durchführbar. Sollten keine weiteren Probleme auftreten, können die gebrauchten Konservenbeutel nach 24 Std. verworfen werden.
28.3.3.2 Venöser Zugang
Der für die Transfusion benötigte venöse Zugang wird mit physiologischer Kochsalzlösung durchgespült und mit einem Mandrin verschlossen, falls keine weitere Infusion über diesen Zugang laufen soll.
Merke
Die Venenverweilkanüle darf nicht unmittelbar nach der Transfusion gezogen werden, da immer mit einer verspäteten Komplikation gerechnet werden muss und daher ein venöser Zugang von existenzieller Bedeutung sein kann.
28.3.3.3 Vitalzeichenkontrolle
Die Vitalzeichen und der Zustand des Patienten werden für eine weitere Stunde nach der Blutübertragung engmaschig im Rhythmus von 15 – 30 Minuten, danach für weitere 8 Stunden stündlich kontrolliert. Alles, was der Patient während der Therapie nicht selbstständig durchführen konnte, sollte ihm nach der Transfusion ermöglicht werden.
Bei Unwohlsein des Patienten oder Symptomen, die auf einen Transfusionszwischenfall hindeuten, ist die Blutübertragung sofort zu stoppen, die Kanüle zu belassen und der Arzt zu benachrichtigen.
28.3.4 Beobachtung auf Früh- und Spätkomplikationen
Strenge gesetzliche Auflagen sorgen für den höchsten Standard an Sicherheit. Dennoch lassen sich nicht alle Komplikationen ausschließen. Man unterscheidet Früh- und Spätkomplikationen.
28.3.4.1 Frühkomplikationen
Im Vordergrund stehen hämolytische Transfusionsreaktionen. Diese können eingeteilt werden in
-
akute hämolytische Transfusionsreaktion (Häufigkeit tödlicher Verläufe 1:1,3 Millionen) und
-
verzögerte hämolytische Transfusionsreaktion.
Akute hämolytische Transfusionsreaktion
Sie tritt während oder unmittelbar nach der Transfusion von Erythrozyten auf. Die häufigste Ursache ist eine AB0-Inkompatibilität, die meist durch Verwechslung der Konzentrate zustande kommt. Da die Komplikation mit weitreichenden Konsequenzen für den Patienten verbunden ist, muss hier die höchste Konzentration herrschen. Symptome treten fulminant auf, die Letalitätsrate ist hoch.
Symptome bei wachen, ansprechbaren Patienten Diese sind:
-
vegetativ: Unruhe, Angst
-
gastrointestinal: Übelkeit, Erbrechen
-
Schmerzen: brennender Schmerz in der für die Transfusion genutzten Vene, Kopf-, Rücken-, Bauch- oder Brustschmerzen sowie präkordiale Schmerzen
-
Haut: Fieber, Schüttelfrost, Gesichtsrötung, Hautprickeln
-
Hämodynamik: Tachykardie, Hypotonie
-
Atmung: Anstieg der Atemfrequenz
-
Niere: Hämaturie
Symptome bei sedierten, narkotisierten Patienten
-
Hier können Symptome durch Medikamente verdeckt werden. Festzustellen sind aber Hämaturie, Hypotonie, Tachykardie und bei Operationen diffuse Blutungen im OP-Gebiet, hervorgerufen durch Gerinnungsstörungen. In schweren Fällen kann es zur disseminierten intravasalen Gerinnung (engl.: DIC, Synonym: Verbrauchskoagulopathie = erhöhte Blutungsneigung durch Verbrauch von Gerinnungsfaktoren und Thrombozyten) und akutem Nierenversagen kommen.
Erste Maßnahmen bei hämolytischen Transfusionszwischenfällen
Folgende Maßnahmen sollten erfolgen:
-
Transfusion sofort abstellen und Konserve abklemmen
-
Blutkonserve für die Überprüfung der Unverträglichkeit im Labor (Blutbank) sicherstellen
-
venösen Zugang liegen lassen
-
Patienten beruhigen
-
Schockbehandlung vorbereiten und bei Maßnahmen assistieren
-
Patient zur Intensivstation bringen, dort Unterstützung bei der Kreislaufstabilisierung, Sauerstoffangebot adaptieren, Diurese forcieren
-
auf Arztanordnung Heparinisierung zur Prophylaxe der Verbrauchskoagulopathie durchführen
-
Harn alkalisieren
-
frühzeitig Hämodialysetherapie bei anzunehmendem akutem Nierenversagen einleiten
Die Fülle von Komplikationen verdeutlicht, dass nicht nur eine hohe Kompetenz vonseiten der transfundierenden Ärzte notwendig ist, sondern auch Pflegende gute Kenntnisse haben müssen, um ernste Probleme vom Patienten abwenden zu können.
Weitere Frühkomplikationen Dies können sein:
-
allergische Reaktionen (häufig): Symptome können bis zu 4 Std. nach Transfusion auftreten; Urticaria, Pruritus, Hautrötung im Gesicht und am Körperstamm
-
anaphylaktische Transfusionsreaktion: kommt selten vor, ist aber lebensbedrohlich und kann bereits nach wenigen Millilitern Blut auftreten
-
febrile, nicht hämolytische Transfusionsreaktion: Auftreten innerhalb von bis zu 4 Std. nach Erythrozyten- oder Thrombozytenkonzentraten (zumeist, wenn Patienten mehrere Konserven erhalten haben)
-
Zitratintoxikationen, Vergiftung: ausgelöst durch den in den Konserven enthaltenen Stabilisator (Zitronensäure und deren Derivate). Symptome: Hypokalziämie, evtl. Gerinnungsstörungen, Arrhythmien. Tritt v. a. bei Früh- und Neugeborenen, Patienten mit ausgeprägten Leberfunktionsstörungen und nach Massivtransfusionen auf (30 – 50 %iger Ersatz des Blutvolumens des Empfängers)
-
Hypothermie (ausschließlich bei Massivtransfusionen mit nicht aufgewärmten Konzentraten)
-
Hyperkaliämie
Verzögerte hämolytische Transfusionsreaktion
Sie tritt erst nach einigen Tagen auf, wobei die Phase der Blutübertragung unauffällig war. Ursache sind spezifische erythrozytäre Antikörper, die während der Blutübertragung nur in geringer Konzentration vorhanden waren und von der Kreuzprobe nicht erfasst wurden.
Frühsymptome Die verzögerte Transfusionsreaktion zeigt sich in einem unerklärlichen Abfall des Hämoglobins mit unterschiedlich ausgeprägten Frühsymptomen. Dazu gehören häufig
-
Fieber, Anämie, Ikterus, Hämoglobinurie.
Selten sind
-
disseminierte intravasale Gerinnung,
-
Nierenversagen und
-
tödlich verlaufende Zwischenfälle.
Spätsymptome Auftreten können
-
vegetative Symptome wie Übelkeit, Erbrechen,
-
Störungen der Atmung wie Atemnot und Zyanose,
-
Störungen des Bewusstsein wie Bewusstlosigkeit und delirante Zustände,
-
Hämodynamische Störungen wie Bradykardie und kaltschweißige Haut,
-
Störungen der Temperaturregulation wie Frieren mit nachfolgendem Anstieg der Körpertemperatur.
28.3.4.2 Spätkomplikationen
Zu den weiteren Gefahren gehören
-
Kontamination der Konserve: Die Gefahr einer bakteriellen oder viralen Infektion durch Spenderblut ist inzwischen deutlich minimiert worden, sie ist jedoch nicht ausgeschlossen (zumeist bei Thrombozytenkonzentraten). Die bakterielle Form kann lebensbedrohlich sein, da sie auch eine Hämolyse hervorrufen kann.
-
Die Kontamination mit HIV ist durch erhöhte Sicherheitsstandards in Deutschland eher eine Ausnahme geworden
-
Hepatitis:
-
Hep. B: Das Risiko liegt bei ca. 1:360.000 und ist im Vergleich zu Hep. C deutlich höher
-
Hep. C: Hier liegt das Risiko bei ca. <1: 11,7 Millionen
-
-
-
Transfusionsassoziierte Lungeninsuffizienz (TRALI). Spezifische Antikörper reagieren mit Leukozyten des Empfängers und führen zur Ateminsuffizienz
28.4 Lern- und Leseservice
28.4.1 Literatur
[1564] Booke M. Fremdblutsparende Maßnahmen. intensiv 2000; 8: 14
[1565] Deutsch E, Bender AW, Eckstein R, Zimmermann R. Ein Handbuch für Ärzte, Juristen und Apotheker. 2. Aufl. Stuttgart: Wissenschaftliche Verlagsgesellschaft; 2007
[1566] Fischer D, Meybohm P, Zacharowski KD. Patient blood management (PBM). In: Marx G, Muhl E, Zacharowski K, Zeusem S. Hrsg: Die Intensivmedizin. 12. Aufl. Berlin: Springer; 2015
[1567] Gombotz H, Zacharowski K, Spahn D. Patient Blood Management: Individuelles Behandlungskonzept zur Reduktion und Vermeidung von Anämie und Blutverlust sowie zum rationalen Einsatz von Blutprodukten. Stuttgart: Thieme; 2013
[1568] Höfert R. Von Fall zu Fall – Pflege im Recht. Rechtsfragen in der Pflege von A – Z. Berlin: Springer; 2006
[1569] Klages M, Lindhoff-Last E. Hämostase. In: Marx G, Muhl, E, Zacharowski K,, Zeusem S. Hrsg: Die Intensivmedizin. 12. Aufl. Berlin: Springer; 2015
[1570] Mengelkamp AK. Hämostase, Blutgerinnung und Transfusion. In: Ullrich L, Stolecki D. Hrsg. Intensivpflege und Anästhesie. 3. Aufl. Stuttgart: Thieme; 2015
[1571] Meyboom P, Zacharowski K. Hämorrhagischer Schock. In: Marx G, Muhl, E, Zacharowski K, Zeusem S, Hrsg. Die Intensivmedizin. 12. Aufl. Berlin: Springer; 2015
[1572] Müller-Eckhardt C, Transfusionsmedizin und Immunhämatologie, 4. Aufl. Berlin: Springer; 2010
[1573] Müller M, Fischer D, Stock U et al. Patient Blood Management – Der präoperative Patient. Anästhesiol Intensivmed Notfallmed Schmerzther 2014; 49(4): 246–254
[1574] Schwegler J, Lucius R. Der Mensch. Anatomie und Physiologie. 6. Aufl. Thieme: Stuttgart; 2016
[1575] Sibrowski W, Krakowitzky P, Kelsch R. Grundlagen der Transfusionsmedizin. In: van Aken H, Reinhart K, Zimpfer M, Hrsg. Intensivmedizin. Stuttgart: Thieme; 2014
[1576] Singbartl G, Walther-Wenke G. Transfusionspraxis. 2. Aufl. Springer: Berlin; 2014
[1577] Wirth W. Blutkrankheiten. In: Gerlach U, Wagner H, Wirth W. Hrsg. Innere Medizin für Gesundheits- und Krankenpflege. Stuttgart: Thieme; 2011
[1578] Wissenschaftlicher Beirat der Bundesärztekammer. Richtlinien zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie). Köln: Deutscher Ärzte-Verlag; 2010
28.4.2 Internetadressen
[1579] http://www.bundesaerztekammer.de/fileadmin/user_upload/downloads/RiliHaemotherapie2010.pdf; Stand: 17.12.2016
[1580] http://www.molecular-haemostasis.de/download/DRKLeitfaden.pdf; Stand: 17.12.2016
[1581] http://www.drk-haemotherapie.de/data/ausgabe_20/beitraege/beitrag5.pdf; Stand: 17.12.2016