
15 Onkologie in der Chirurgie
15.1 Grundlagen
Onkologie (onkos, griech.: Schwellung, Geschwulst) bedeutet die Lehre von den Geschwulstkrankheiten. Heute umfasst der Begriff alle bösartigen Tumorkrankheiten, also alle Krebserkrankungen. Krebs wird auch als Karzinom, bösartiger Tumor, maligner Tumor, Malignom, Neoplasma oder Blastom bezeichnet.
Zusatzinfo
Historie. „Krebs“ ist ein Begriff, der wahrscheinlich von dem griechisch-römischen Arzt Galen (2. Jahrhundert vor Christus) geprägt wurde. Er verglich das Wachstum eines exulzerierenden Mammakarzinoms mit dem Bild eines Krebs- oder Krabbentiers (latein.: cancer). „Krebs“ ist heute der Oberbegriff für alle Arten bösartiger Neubildungen.
Generell steht der Begriff „Tumor“ für jede Form von Gewebevergrößerung oder Schwellung. Die Ursache der Schwellung spielt dabei keine Rolle. So kann ein Tumor Folge einer Entzündung sein, aber auch einem Hämatom oder einer Zyste entsprechen. Wird der Begriff nicht weiter erläutert, versteht man im klinischen Alltag darunter eine bösartige Neubildung.
Man kann an der Tumorbenennung erkennen, ob es sich um einen gut- oder einen bösartigen Tumor handelt. Benigne (gutartige) Geschwulste tragen die Endung „-om“, während maligne (bösartige) Tumoren auf „-sarkom“ oder „-karzinom“ enden. Besteht eine Geschwulst aus mehreren Gewebeanteilen, werden die Wortstämme entsprechend zusammengesetzt: Ein Lipofibrom z. B. ist ein gutartiger Tumor aus Fett- und Bindegewebsanteilen, ein Osteochondrom besteht aus Knochen- und Knorpelgewebe ( ▶ Tab. 15.1 u. ▶ Tab. 15.2 ).
Merke
Fast alle Tumoren werden nach dem Ausgangsgewebe benannt.
|
Ausgangsgewebe |
Benigner Tumor |
Maligner Tumor |
|
Karzinome |
||
|
Haut |
(mehrere) |
Plattenepithelkarzinom |
|
Schleimhaut, Drüsen |
Adenom |
Adenokarzinom |
|
Sarkome |
||
|
Bindegewebe |
Fibrom |
Fibrosarkom |
|
Bindegewebe |
Myxom |
Myxosarkom |
|
Fettgewebe |
Lipom |
Liposarkom |
|
Lymphgewebe |
Lymphom |
Lymphosarkom |
|
Knorpel |
Chondrom |
Chondrosarkom |
|
Knochen |
Osteom |
Osteosarkom |
|
(glatte) Muskulatur |
(Leio-)Myom |
(Leio-)Myosarkom |
|
(quergestreifte) Muskulatur |
(Rhabdo-)Myom |
(Rhabdo-)Myosarkom |
|
Nervengewebe |
Neurinom |
Neurosarkom |
|
Blutgefäß |
Hämangiom |
Hämangiosarkom |
|
Benigne Tumoren |
Semimaligne Tumoren |
Maligne Tumoren |
|
|
Wachstum |
|
|
|
|
Abgrenzung |
scharf abgrenzbar wegen kapselartiger Strukturen |
nicht abgrenzbar |
nicht abgrenzbar |
|
Metastasen |
keine Metastasierung |
keine Metastasierung |
Metastasierung |
|
Allgemeinsymptome |
keine Allgemeinsymptomatik |
keine Allgemeinsymptomatik |
ausgeprägte Tumorsymptomatik |
|
Rezidive |
selten gutartiges Rezidiv |
häufig Lokalrezidiv |
häufig lokales Rezidiv oder Metastasierung |
15.1.1 Tumorentstehung
Die meisten Krebserkrankungen treten in höherem Alter bei nachlassender Regenerationskraft der Zellen auf. Als Auslöser kommen exogene Faktoren wie z.B. Lebensstil und Umwelteinflüsse infrage. So ist die Entstehung von Lungenkrebs bei Rauchern etwa 10-mal wahrscheinlicher als bei Nichtrauchern. Die Krebsentstehung (Karzinogenese) ist in vielen Details nicht geklärt. Die Ursache ist multifaktoriell. Weitere Entstehungsfaktoren können
-
körpereigene Hormone,
-
molekularbiologische Veränderungen,
-
individuelle Abwehrkräfte und
-
genetische Veränderungen sein.
Körpereigene Hormone Hormonabhängig wachsende Tumoren sind z.B. der Brust- und Prostatakrebs. Bei 70 % der Mammakarzinome finden sich an der Zelloberfläche Rezeptoren für die Geschlechtshormone Östrogen oder Progesteron. Die Hormone regen das Zellwachstum an. Eine Hemmung der Rezeptoren durch eine pharmakologische antihormonelle Behandlung kann das Tumorwachstum beim Brustkrebs bremsen, wenn die Tumorzellen über Hormonrezeptoren verfügen. Ob Hormonrezeptoren auf den Tumorzellen vorhanden sind („rezeptorpositive Patientin“) oder nicht, lässt sich durch Untersuchung des Gewebes im entnommenen OP-Präparat nachweisen.
Molekularbiologische Veränderungen Neben den Hormonen im engeren Sinne gibt es noch viele andere köpereigene Botenstoffe, die das Zellwachstum beeinflussen können. Dazu gehören z.B. Wachstumsfaktoren. Diese binden sich an Rezeptoren auf der Zelloberfläche und geben Signale zum Zellwachstum in das Zellinnere ab. Bei einigen (nicht allen) Karzinomen sind derartige Rezeptoren bekannt und genauer erforscht. Ein Beispiel ist der Wachstumsfaktorrezeptor HER (human epidermal growth factor receptor), der sich bei 20% aller Mammakarzinome und bei einigen Magenkarzinomen findet. Eine pharmakologische Hemmung dieses Signalweges durch eine „zielgerichtete Therapie“ ist inzwischen möglich und kann das Wachstum bei HER-positiven Tumoren hemmen (Kap. ▶ 15.2.3).
Individuelle Abwehrkräfte Die Funktionsfähigkeit des Immunsystems spielt für die Krebsentstehung ebenfalls eine Rolle. Körpereigene Abwehrstoffe können Krebszellen hemmen oder gar abtöten. Auch einige Immuntherapeutika werden bei manchen Krebsformen eingesetzt, z.B. Ipilimumab (Handelsname Yervoy) bei schwarzem Hautkrebs.
Zusatzinfo
Physiologie. Im Blut jedes „gesunden“ Menschen lassen sich vereinzelte Krebszellen nachweisen, ohne dass eine maligne Krankheit vorliegt. Der Körper kann einzelne entartete Zellen vernichten, wobei körpereigene immunologische Abwehrmechanismen notwendig sind.
Genetische Veränderungen Etwa 5% aller Krebserkrankungen sind erblich bedingt. Man bezeichnet sie als hereditäre (= vererbte) Karzinome. Nicht erbliche Krebsformen werden als sporadischer Krebs bezeichnet.
Typisch für vererbbare Tumoren ist das Auftreten der Krebsfälle in jungen Jahren und in den vorhergehenden Generationen. Im Entstehungsprozess von hereditären Karzinomen spielen Mutation (spontane Genveränderung) und Vererbung eine entscheidende Rolle. Tumorsuppressorgene unterdrücken normalerweise die unkontrollierte Zellvermehrung. Daneben können Mismatch-Reparatur-Proteine Fehler beim physiologischen Teilungsvorgang des Erbgutes in den Chromosomen korrigieren.
Der Mensch hat etwa 30.000 Gene. Meistens ist bei hereditären Karzinomen nur ein Gen beschädigt. Die Genveränderung betrifft alle Körperzellen, weshalb sich verschiedene Tumorarten in unterschiedlichen Organen entwickeln können. Derzeit werden ständig neue Gene identifiziert, die Karzinomerkrankungen auslösen können.
Aber nicht alle genetischen Veränderungen führen zum Ausbruch einer Krebserkrankung. Die Gene haben ein unterschiedliches „Durchsetzungsvermögen“ (Penetranz) für die Entwicklung einer Krebserkrankung. Die Penetranz bei Genen bezeichnet die Wahrscheinlichkeit, ein bestimmtes Karzinom hervorzurufen zu können. Es gibt hoch- und niedrigpenetrante Gene.
Manche Gendefekte führen zwingend zur Krebserkrankung ( ▶ Tab. 15.3 ). Klassisches Beispiel ist die familiäre adenomatöse Polyposis (FAP, angeborene Dickdarmpolypen, Kap. ▶ 23.5.1). Andere Organkrebse treten sowohl sporadisch (ohne bekannte genetische Ursache) als auch genbedingt auf. Beim erblichen Darmkrebs ohne Polyposis liegt die Wahrscheinlichkeit, an Dickdarmkrebs zu erkranken, bei 80 %. Das Mammakarzinom tritt zu 90 % sporadisch auf und ist zu 10 % genetisch verursacht.
Merke
Die Veranlagung für einen erblichen Tumor wird mit 50%iger Wahrscheinlichkeit an die Kinder beiderlei Geschlechts weitergegeben.
Gentest Die genetischen Veränderungen können durch eine Blutprobe mit aufwendigen molekulargenetischen Methoden nachgewiesen werden. Ein solcher Gentest wird nicht grundsätzlich empfohlen, nur bei deutlichen Hinweisen auf ein familiäres Risiko. Das liegt nicht nur an den hohen Kosten, sondern auch an den problematischen Konsequenzen.
Das „positive“ Testergebnis mit dem vorhandenen Gendefekt kann Betroffene sehr belasten. Neben der psychischen Belastung kommen soziale und wirtschaftliche Folgen hinzu. Der Arbeitsplatz kann gefährdet sein und Versicherungsverhältnisse müssen neu überdacht werden.
Zusatzinfo
Beratung. Vor der Durchführung eines Gentests muss eine humangenetische Beratung erfolgen, bei denen die Ratsuchenden auch mit den Konsequenzen des Testergebnisses vertraut gemacht werden.
|
Organ |
Genetische Ursache |
Erbliche Krebsmanifestation |
Wahrscheinlichkeit, an Krebs zu erkranken |
|
Darm |
familiäre adenomatöse Polyposis (FAP) |
hereditäres kolorektales Karzinom mit Polypen |
100 % |
|
Schilddrüse |
Multiple endokrine Neoplasie (MEN2-Mutation) |
familiäres medulläres (C-Zell-) Schilddrüsenkarzinom |
100 % |
|
Brustdrüse |
Mutation im BRCA1- oder BRCA2-Gen |
familiäres Mammakarzinom |
60–80 % |
|
Darm |
Herditary Nonpolyposis Colorectal Cancer (HNPCC) |
hereditäres kolorektales Karzinom ohne Polypen |
75% |
|
Eierstock |
Mutation im BRCA1- oder BRCA2-Gen |
familiäres Ovarialkarzinom |
30–40 % |
|
Bauchspeicheldrüse |
diverse |
hereditäres Pankreaskarzinom |
10 % |
15.1.1.1 Tumormalignität
Tumoren lassen sich nach ihrem Malignitätsgrad einteilen:
-
Benigne (gutartige) Tumoren zeichnen sich durch ein langsames, verdrängendes (nicht infiltrierendes) Wachstum aus. Sie sind gegen das gesunde Gewebe gut abgrenzbar, da sie häufig kapselartige Strukturen bilden. Eine Metastasierung erfolgt nie.
-
Semimaligne Tumoren nehmen eine Mittelstellung zwischen gut- und bösartigen Geschwulsten ein. Sie zeigen ein unkontrolliertes, organzerstörendes, infiltratives Wachstum, setzen aber keine Metastasen, z. B. Basaliom (Hautkrebs).
-
Präkanzerosen sind Vorstufen eines Malignoms. Typisches Beispiel ist der Dickdarmpolyp (Dickdarmadenom), der ab einer gewissen Größe zum Dickdarmkarzinom entartet.
-
Maligne (bösartige) Tumoren wachsen rasch, infiltrierend, örtlich zerstörend und setzen Metastasen. Außerdem führen sie zu ausgeprägten Allgemeinsymptomen, z.B. Leitungsknick, Gewichtsverlust, Kachexie.
Merke
Den Ausgangsherd einer bösartigen Tumorkrankheit (Muttergeschwulst) nennt man Primärtumor. Als Sekundärtumor werden die von ihm gestreuten Metastasen bezeichnet.
Karzinome und Sarkome Nach entwicklungsgeschichtlichen Gesichtspunkten werden maligne Geschwulste in 2 große Gruppen eingeteilt, die Karzinome und die Sarkome ( ▶ Tab. 15.1 ). Karzinome kommen etwa 20-mal häufiger vor als Sarkome.
Karzinom Ein Karzinom ist ein bösartiger Tumor, der von epithelialem Gewebe abstammt. Dazu gehören die Haut und Schleimhaut sowie die Auskleidung drüsiger Organe, z. B. Hautkarzinome, Magen-, Darm-, Brust-, Eierstock-, Bauchspeicheldrüsenkarzinom. Entsprechend dem histologischen Zelltypus unterscheidet man im Wesentlichen Adeno-, Plattenepithel- und entdifferenzierte Karzinome.
Sarkom Beim Sarkom handelt es sich um einen bösartigen Tumor, der vom Binde- und Stützgewebe abstammt, z. B. Weichteilsarkome wie Liposarkom, Fibrosarkom. Der Begriff „Sarkom“ – griech.: Fleisch – ist auf das fleischartige Aussehen aufgeschnittener Weichteiltumoren zurückzuführen.
Zusatzinfo
Sonderformen. Mit der Unterteilung in Karzinome und Sarkome sind jedoch nicht alle bösartigen Tumoren zu erfassen. Mehrere Zwischen- und Sonderformen werden unterschieden, z. B.
-
maligne Tumoren blutbildender Organe = hämatologische Neoplasie (z. B. Leukämie, malignes Lymphom),
-
maligne Geschwulste des zentralen Nervensystems (z. B. Medulloblastom, Glioblastom) oder
-
maligne Mischtumoren (z. B. Speicheldrüsengeschwulste, Wilms-Tumor der Niere).
Wachstumstendenz Das Wachstum des Primärtumors (oder der Metastasen) nennt man Progression (Fortschreiten). Bildet sich eine maligne Geschwulst zurück, wird also kleiner, spricht man von Remission. Der Begriff ist vor allem bei der Strahlen- und Chemotherapie maligner Geschwulste gebräuchlich. Man unterscheidet:
-
Vollremission: Der Tumor hat sich durch (nichtchirurgische Maßnahmen) komplett zurückgebildet, er ist mit keiner diagnostischen Maßnahme mehr nachweisbar.
-
Spontanremission: Es ist ohne Behandlung zu einer Tumorverkleinerung gekommen. Dies kommt bei bösartigen Tumorerkrankungen selten vor.
Prognose Von Rezidiv spricht man, wenn ein maligner Tumor nach radikaler chirurgischer Entfernung (oder Vollremission) erneut nachweisbar ist. Die bis dahin verstrichene Zeit nennt man rezidivfreies Intervall. Der Begriff Fünf-Jahres-Überlebensrate ist gebräuchlich, um die Prognose einer malignen Tumorerkrankung zu beschreiben. Die Angabe in Prozent beschreibt, wie viele Patienten mit einem bestimmten Tumor 5 Jahre nach Diagnosestellung bzw. Therapie überleben.
15.1.2 Tumorhäufigkeit
Krebs ist bei uns nach den Herz-Kreislauf-Erkrankungen die zweithäufigste Todesursache. Jeder 5. Mensch stirbt an den Folgen eines malignen Tumors. Die ▶ Tab. 15.4 orientiert über die häufigsten Krebsformen in Deutschland.
|
Männer |
Frauen |
|
|
1 |
Prostata |
Brustdrüse |
|
2 |
Lunge |
Darm |
|
3 |
Darm |
Lunge |
|
4 |
Harnblase |
Gebärmutterkörper |
|
5 |
Haut (malignes Melanom) |
Haut (malignes Melanom) |
|
6 |
Niere |
Bauchspeicheldrüse |
|
7 |
Mundhöhle und Rachen |
Non-Hodgkin-Lymphom |
|
8 |
Magen |
Eierstock |
|
9 |
Non-Hodgkin-Lymphom |
Magen |
|
10 |
Bauchspeicheldrüse |
Niere |
Zusatzinfo
Aktuelle Informationen über Krebserkrankungen in Deutschland bietet das Robert Koch-Institut unter http://www.rki.de.
Allgemein nimmt die Häufigkeit maligner Erkrankungen mit dem Alter zu. Einige Tumortypen finden sich allerdings bevorzugt in jüngeren Lebensjahren (z. B. Wilms-Tumor oder Hodentumoren).
Obwohl rasches Wachstum für Malignome typisch ist, dauert der Gesamtverlauf einer bösartigen Tumorkrankheit weitaus länger als gemeinhin angenommen. Bis zur Diagnosestellung vergehen meist viele Jahre, weil ein Tumor erst ab einer gewissen Größe klinisch erkennbar wird.
Zusatzinfo
Mammakarzinom. Bei einem Mammakarzinom dauert es etwa 100 Tage, bis sich die Zahl der malignen Zellen durch Teilung verdoppelt hat. Bei dieser Wachstumsgeschwindigkeit dauert es etwa 3 Jahre, bis der Tumor die Größe von 1 mm (entspricht etwa 1 Mio. Zellen) erreicht hat. Geht man davon aus, dass ein Mammakarzinom bei 1 cm Durchmesser klinisch diagnostiziert wird, braucht der Tumor bis zum Erreichen dieser klinisch fassbaren Größe etwa 10 Jahre. Eine weitere Größenzunahme auf 5 cm Durchmesser dauert dann nur noch 2 Jahre (nach Diagnosestellung). Das eigentliche Krankheitsgeschehen (ab der Entstehung der ersten malignen Zellnester) erstreckt sich allerdings schon über 12 Jahre.
15.1.3 Tumorsymptomatik
Es gibt keine klinischen oder laborchemischen Parameter, die einen malignen Tumor beweisen. Die in Zusammenhang mit einer Tumorkrankheit beobachteten Symptome sind vorwiegend unspezifisch und oft Zeichen eines fortgeschrittenen Tumorstadiums ( ▶ Tab. 15.5 ). Bei Auftreten dieser Zeichen sollte zur weiteren Diagnostik baldmöglichst ein Arzt konsultiert werden.
Merke
Beweisend für einen malignen Tumor ist nur die histologische Bestätigung. Dazu ist die Gewinnung einer Gewebeprobe (Probeentnahme = PE oder Biopsie) erforderlich.
|
Klinische Zeichen |
Auffällige Laborparameter |
|
|
15.1.4 Biomarker in der Onkologie
Der Begriff „Biomarker“ oder „Marker“ (manchmal auch „Faktor“ genannt) steht in der Krebsmedizin für molekulare Merkmale, die sich besonders bei Krebspatienten finden. Krebszellen können unterschiedliche Marker produzieren oder deren Bildung als „Antwort“ des Körpers hervorrufen. Viele dieser Marker können in einer Blutprobe oder Gewebeprobe nachgewiesen werden. Bisher sind für viele (aber nicht alle) Krebsarten Markersubstanzen bekannt.
Tumormarker Der seit Jahrzehnten genutzte Begriff „Tumormarker“ umfasst etwa 100 Substanzen, die bei manchen Krebsarten im Blut erhöht nachweisbar sind. Die Höhe der Tumormarkerwerte korreliert in hohem Maße mit dem Tumorwachstum bzw. einer therapiebedingten Verkleinerung. Ein postoperativer Anstieg eines Tumormarkers spricht für erneutes Tumorwachstum durch ein Rezidiv oder eine Metastasierung. Viele Tumormarker sind nicht spezifisch für einen bestimmten Tumor und deshalb nicht für eine Frühdiagnose geeignet. Erhöhte Tumormarkerwerte erlauben weder die sichere Diagnose einer Krebserkrankung noch die Planung der richtigen Therapie. Außerdem sind manche Tumormarker auch bei Patienten ohne Krebs erhöht.
Ein klassischer Tumormarker ist das CEA (karzinoembryonales Antigen), das typischerweise beim Dickdarmkarzinom im Blut erhöht ist, seltener bei anderen Tumoren. Auch bei Betroffenen ohne Karzinom kommen erhöhte CEA-Werte vor (z.B. bei Rauchern). Weitaus organbezogener ist das PSA (prostataspezifisches Antigen). Ein erhöhter PSA-Wert spricht für Prostatakrebs, kommt aber auch bei Prostataentzündung vor.
Molekularbiologische und genetische Marker In der Krebsmedizin spielen krankhafte Veränderungen der Erbsubstanz eine zunehmende Rolle. Das gilt nicht nur für die vererbbaren Karzinome ( ▶ Tab. 15.3 ). Es gibt auch Aktivitäten einzelner Gene, die neue pharmakologische Therapieansätze erlauben. Dazu gehören vor allem Gene, die an Wachstumsprozessen der Zellen beteiligt sind (z.B. das HER2-Gen).
Prognosemarker Anhand von Prognosemarkern oder Prognosefaktoren lässt sich der statistisch wahrscheinliche Verlauf einer Krebserkrankung abschätzen. Dabei werden alle durchgeführten Untersuchungen und die aktuellen Studienergebnisse und Leitlinien berücksichtigt.
Beim Prostatakarzinom gilt es als prognostisch günstig, wenn der Ausgangswert für PSA niedrig ist und über mehrere Messungen nur langsam steigt. Diese Situation spricht dafür, dass sich der Tumor nur langsam weiterentwickeln wird.
Beim Brustkrebs ist das Vorhandensein von HER2-Rezeptoren hingegen prognostisch ungünstig. Der Nachweis dieser Rezeptoren beweist eine hohe Genaktivität des Tumors, was zu einem ungünstigen aggressiven Krankheitsverlauf führen kann.
Prädiktive Marker Prädiktive (voraussagende) Faktoren zeigen an, ob eine bestimmte Therapie überhaupt wirken kann. Einige Tumoreigenschaften erlauben eine „zielgerichtete“ pharmakologische Behandlung, andere nicht. Der Tumor muss molekulare Veränderungen aufweisen, an denen das Medikament angreifen kann.
Ein prädiktiver Marker ist z.B. der Hormonrezeptorstatus für Östrogen und Progesteron beim Brustkrebs. Sind Hormonrezeptoren vorhanden, wächst der Tumor hormonabhängig und kann durch eine Antihormontherapie behandelt und günstig beeinflusst werden.
15.1.5 Tumormetastasierung
Unter Metastasierung versteht man die Einnistung abgedrifteter Tumorzellen in andere Organe, die sich dort vermehren und erneut verstreuen können.
Ein Primärtumor kann sich im Körper ausbreiten und dort maligne „Ableger“ von gleichartiger histologischer Struktur bilden. Diese nennt man Metastasen oder Filiae (Tochtergeschwülste, Sekundärtumor). Im klinischen Sprachgebrauch sind für den Ausdruck der Metastasierung folgende Synonyme gebräuchlich: Filialisierung, Generalisierung oder Disseminierung.
Bei der Metastasierung eines Tumors gibt es tumorspezifische „Organpräferenzen“, z. B. metastasiert ein Mamma- oder Prostatakarzinom häufig in das Skelett. Die Organe Milz und Pankreas sind selten von Metastasen betroffen.
Generell kann sich jede maligne Geschwulst über 3 Wege ausbreiten:
-
direkte Tumorausdehnung
-
lymphogene Metastasierung
-
hämatogene Metastasierung
Alle 3 Ausbreitungsformen können gleichzeitig auftreten.
Direkte Tumorausdehnung Der Tumor wächst durch direkte Ausbreitung unter Überwindung der Organgrenzen in benachbartes Gewebe ein, z. B.:
-
Peritonealkarzinose: Tumorausbreitung im Bereich des Bauchfells, z.B. bei Darmkrebs
-
Pleuritis carcinomatosa: Ausbreitung im Bereich des Brustfells („Pleuritis“ bedeutet hier einen entzündlichen Reizzustand, keinen bakteriellen Infekt), z.B.: bei Lungenkarzinom
Lymphogene Metastasierung Infiltriert der Tumor ein Lymphgefäß, spricht man von einer Lymphangiosis carcinomatosa. Die Tumorzellen bleiben im Filterwerk der Lymphknoten hängen, vermehren sich und führen zu Lymphknotenmetastasen.
Zusatzinfo
Physiologie. Lymphknoten filtrieren die Lymphflüssigkeit auf Schadstoffe jeglicher Art, z. B. Bakterien, Krebszellen. Sie entsprechen also „zwischengeschalteten“ Auffangsystemen und spielen somit eine zentrale Rolle in der Immunabwehr.
Der erste Lymphknoten im Abflussgebiet eines Tumors wird als Wächterlymphknoten (Sentinel-Lymphknoten = SLN) bezeichnet. Er wird bei lymphogener Metastasierung zuerst von Tumorzellen befallen. Die Lymphknotengruppe um den Wächterlymphknoten herum bezeichnet man als regionäre Lymphknoten. Es handelt sich um die Lymphknotenstation, die dem Tumor am nächsten gelegen ist.
Beim Mammakarzinom z.B. liegen die regionären Lymphknoten im Bereich der Axilla (Achselhöhle). Wenn die Tumorzellen diese Lymphknotenstation überwinden, können sie über die gemeinsame Mündung der großen Lymphstränge am Hals (Ductus thoracicus) weiter in den Blutkreislauf gelangen und auf hämatogenem Weg weitere Metastasen setzen ( ▶ Abb. 15.1).
Abb. 15.1 Lymphogene Metastasierung. Beispiel Mammakarzinom. Die großen Lymphbahnen münden über den Ductus thoracicus in das Venensystem (Kreis). So kann über die Lymphbahnen eine hämatogene Metastasierung erfolgen.
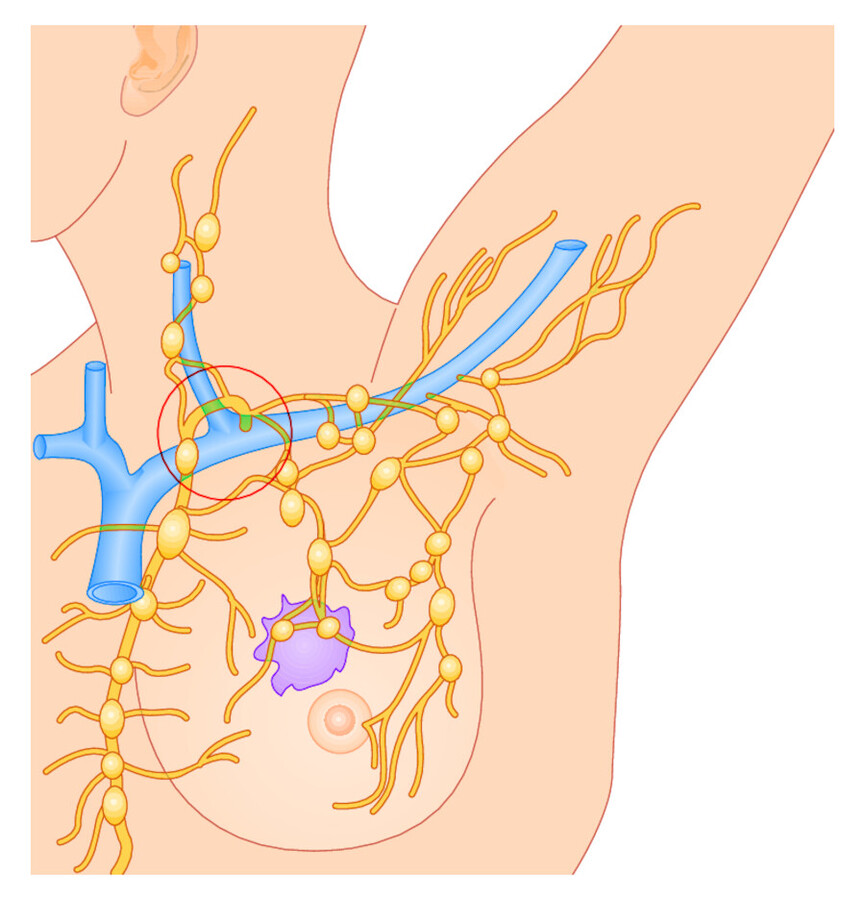
Der Wächterlymphknoten kann nach sonografischer oder szintigrafischer Markierung intraoperativ identifiziert werden. Er lässt sich dann isoliert entfernen und histologisch untersuchen. Wenn der Wächterlymphknoten keine Tumorzellen aufweist, ist das nachgeschaltete Lymphknotengebiet wahrscheinlich auch tumorfrei.
Hämatogene Metastasierung Wird die Wand eines Blutgefäßes vom infiltrativen Wachstum einer malignen Geschwulst durchbrochen, finden die Tumorzellen direkten Eingang in das Blutgefäßsystem. Meist werden kleine Venen infiltriert, weil sie dünnere Wände haben als die Arterien.
Hämatogene Metastasen bilden sich, wenn die Krebszellen mit dem venösen Blutstrom in nachfolgende Organe gelangen, wo sie sich festsetzen und vermehren können. Weil diese Metastasen oft weit vom Primärtumor entfernt gelegen sind, spricht man bei hämatogen entstandenen Absiedlungen von Fernmetastasen.
Je nach Lokalisation des Primärtumors sind bestimmte Organe bei der hämatogenen Metastasierung gehäuft betroffen. Entsprechend der Anatomie des venösen Abflusses ist das zuerst durchflossene Organ die erste hämatogene Metastasenstation ( ▶ Abb. 15.2). Daraus folgt:
-
ein venöser Abfluss über die Lungenvenen führt zu Organmetastasen
-
ein venöser Abfluss über die Pfortader führt zu Lebermetastasen
-
ein venöser Abfluss über die Vena cava führt zu Lungenmetastasen
Abb. 15.2 Hämatogene Metastasierung.
Abb. 15.2a Lungentyp. Tumoren der Lunge metastasieren über den großen Kreislauf in unterschiedliche Organsysteme (z.B. in Knochen oder Gehirn).

Abb. 15.2b Pfortadertyp. Tumoren der Verdauungsorgane metastasieren bevorzugt über die Pfortader in die Leber.
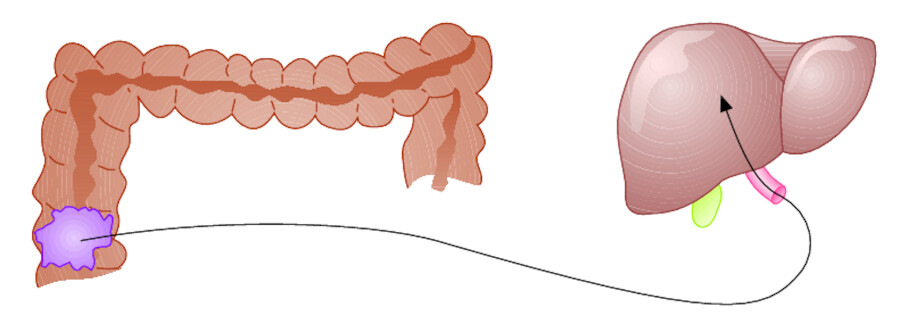
Abb. 15.2c Kavatyp. Tumoren mit venösem Abstrom zur Hohlvene (z.B. Niere) metastasieren bevorzugt in die Lunge.

15.1.6 Tumorklassifikation
15.1.6.1 TNM-Klassifikation
Die TNM-Formel erlaubt eine Klassifizierung des Krebswachstums unter der Berücksichtigung lymphogener und hämatogener Metastasierung.
Merke
Die 3 Buchstaben TNM sind Abkürzungen und stehen für:
-
T = Tumorgröße, gibt Größe und lokale Ausbreitung des Primärtumors an
-
N = Nodus lymphaticus, steht für Anzahl der Lymphknotenmetastasen
-
M = Metastase, gibt an, ob hämatogene Fernmetastasen vorhanden sind
Das international einheitliche TNM-System wird seit 1950 von der UICC (Union internationale contre le cancer) aktualisiert. Das TNM-System erlaubt eine weltweit einheitliche Tumorklassifikation mit Angabe international akzeptierter Therapieoptionen. Mit der Ziffer hinter den Buchstaben wird die Ausdehnung des Tumorwachstums angegeben. Je höher die Ziffer, desto fortgeschrittener die Tumorausdehnung ( ▶ Tab. 15.6 ).
|
Abkürzung |
Ausdehnung des Wachstums |
|
T = Primärtumor |
|
|
T0 |
kein Nachweis eines Primärtumors |
|
T1 |
Tumorgröße < 2 cm * |
|
T2 |
Tumorgröße 2 bis < 5 cm * |
|
T3 |
Tumorgröße > 5 cm * |
|
T4 |
Tumor infiltriert die Umgebung |
|
N = regionäre Lymphknotenmetastasen |
|
|
N0 |
keine Zeichen für Lymphknotenbefall |
|
N1 |
nur die erste Lymphknotenstation befallen |
|
N2 bis N3 |
zunehmender Lymphknotenbefall |
|
M = Fernmetastasen |
|
|
M0 |
keine Zeichen für Fernmetastasen |
|
M1 |
Fernmetastasen vorhanden |
|
* Für einige Tumoren gelten andere Größenangaben |
|
Fallbeispiel
TNM-Einstufung. Die Angabe T4 N3 M0 bedeutet: Der Primärtumor ist in umliegendes Gewebe eingewachsen (T4). Es wurden mehrere Krebszellen in Lymphknoten gefunden. Was genau die Angabe „N3“ bedeutet, ist für jede Tumorart unterschiedlich definiert. Manchmal steht sie für einen besonders deutlich geschwollenen Lymphknoten, manchmal bedeutet sie, dass mehrere Lymphknoten betroffen sind. Eine Metastasierung in andere Organe liegt jedoch nicht vor (M0), soweit es sich mit den vorgenommenen Untersuchungen beurteilen lässt.
Die TNM-Formel bietet vielfache Ergänzungsmöglichkeiten zur Tumorklassifikation, indem Buchstaben vor oder hinter den 3 Buchstaben TNM erscheinen. Eine Auflistung ist an dieser Stelle zu umfangreich. Nachfolgend finden Sie einige Beispiele mit Buchstaben vor der TNM-Formel.
Klinische und pathologische Ergänzungen Bei der Bestimmung der TNM-Formel zum Tumorstaging ist die Aussagekraft davon abhängig, mit welchen Methoden die TNM-Parameter ermittelt wurden. Deshalb kann die TNM-Formel mit einem vorangestellten Buchstaben versehen werden. Beispiele sind:
-
c-Symbol. „c“ steht für „clinical“. Wird das Staging durch klinische Untersuchungen und kleinere Eingriffe (Biopsien) ermittelt, spricht man von einem klinischen oder prätherapeutischen TNM, also einem cTNM.
-
p-Symbol. „p“ steht für „histopathologisch“. Das „p“ macht deutlich, ob eine histopathologische Untersuchung erfolgt ist. Beispiel: pT1pN0M0 kennzeichnet einen kleinen Primärtumor ohne Lymphknotenbefall und ohne Fernmetastasen. Der Primärtumor und die Lymphknoten wurden pathologisch untersucht, die Fernmetastasen nicht.
-
a-Symbol. „a“ steht für Autopsie. Wenn die Tumorklassifikation erst bei einer Obduktion (Leicheneröffnung) erfolgt, wird der TNM-Formel ein a-Symbol vorangestellt. Beispiel: aT1N1M0 beim Magenkarzinom heißt, dass der Tumor die Muskelschichten des Magens noch nicht erfasst hat, regionäre Lymphknoten sind befallen, Fernmetastasen existieren nicht.
-
y-Symbol. „y“ steht für eine vorausgegangene neoadjuvante (präoperative) Therapie. Beispiel: Wenn bei einem Brustkrebs mit der Primärtumorgröße T2 eine erfolgreiche präoperative Chemotherapie oder Strahlentherapie zur Tumorverkleinerung erfolgt ist, kann eine brusterhaltende operative Therapie (BET) erfolgen. Im Idealfall findet sich dann bei der histopathologischen Untersuchung des OP-Präparats kein Tumorrest: ypT0N0M0. Das bedeutet, während der Operation war kein Tumorgewebe sichtbar.
Frühkarzinom TIS Tis (Tumor in situ) bezeichnet sehr kleine Primärtumoren mit günstiger Prognose. „In situ“ bedeutet „vor Ort“ oder „lokal begrenzt“. Diese Karzinome setzen keine Metastasen, weil sie auf die oberflächliche Zellschicht begrenzt sind und die Basalmembran nicht durchbrechen.
CUP-Syndrom Es gibt Tumoren mit klinisch erkennbaren Metastasen (M1), obwohl der primäre Tumor nicht nachgewiesen werden kann. In diesen Fällen spricht man von einem CUP-Syndrom (Cancer of unknown primary).
Lokalisation von Fernmetastasen Bekannte Fernmetastasen werden durch zusätzliche Abkürzungen hinter dem „M“ aus der englischen Sprache ergänzt. Beispiele sind PUL für Lunge, OSS für Knochen, HEP für Leber, BRA für Gehirn, MAR für Knochenmark, PLE für Pleura oder PER für Peritoneum. Beispiele:
-
M1 (OSS) bedeutet also Knochenmetastasen.
-
M1 (PUL) bedeutet Lungenmetastasen.
Grenzen des TNM-Systems Für manche Tumorarten wendet man die TNM-Klassifikation nicht an, weil Therapie und Prognose dieser Krebserkrankungen von anderen Faktoren abhängen. Beispiele sind:
-
Hirntumoren. Tumoren des Gehirns stammen aus unterschiedlichen Geweben. Bei den Hirnzellen bestimmt die Entdifferenzierung (Entartung) die Malignität und Prognose (Kap. ▶ 16.4).
-
Hautkrebs. Beim Melanom (schwarzer Hautkrebs) ist die Eindringtiefe des Tumors in die Haut entscheidend für das Risiko einer Metastasierung. Die Eindringtiefe wird nach Clark oder Breslow in 4 Stufen (Levels) eingeteilt.
-
Leukämie. Bei Leukämie kommen die erkrankten Zellen überall im Körper vor und lassen sich daher nicht mit dem TNM-System beschreiben. Man unterscheidet akute und chronische Verlaufsformen und nach den Herkunftszellen myeloische und lymphatische Leukämien.
-
Malignes Lymphom. Auch bei bösartigen Lymphomen finden sich Krebszellen im Blut. Die Einteilung erfolgt nach der Art der Ausgangszelle und der Ausbreitung im Körper.
15.1.6.2 Tumorstaging
Auf Grundlage der TNM-Klassifikation hat die UICC (Union Internationale Contre le Cancer) 4 Stadien des Krebswachstums definiert. Damit soll eine international anerkannte, einheitliche Therapie gewährleistet werden.
Zusatzinfo
Staging. Für die „Stadieneinteilung“ bei bösartigen Tumoren ist in der Krebsmedizin der englische Begriff „Staging“ üblich. Das Tumorstaging nach UICC baut auf der TNM-Klassifikation auf. Für jede Tumorart wird gesondert festgelegt, welche T-, N- und M-Kategorien welchem der 4 Krankheitsstadien entsprechen.
Die UICC-Einteilung wird ständig dem aktuellen Wissensstand angepasst und ist weltweit Maßstab für klinische Studien und moderne Therapieempfehlungen. Fast alle Tumorarten werden in 4 Stadien eingeteilt. Stadium 1 entspricht einem Frühstadium und Stadium 4 einem sehr fortgeschrittenen Krebswachstum (T4-Tumor oder Fernmetastasen). Für eine differenzierte Therapie unterteilt die UICC bei manchen Tumoren in Untergruppen mit nachgestellten Buchstaben (a bis d), z.B. Tumorstadium 2a oder Stadium 2b.
Fallbeispiel
Tumorstadium 2 nach UICC. Bei einer Patientin mit einem Mammakarzinom und der präoperativen Tumorformel cT2N1M0 ist der Primärtumor mehr als 2 cm groß und nur wenige Lymphknoten wie Wächterlymphknoten in der gleichseitigen Achselhöhle sind befallen. In bildgebenden Untersuchungen wurden keine Fernmetastasen entdeckt.
Tumorstadium 4 nach UICC. Ein Darmkrebspatient mit einer pT1N1M1-Einstufung hat nur einen kleinen Tumor, der nicht tief in das Darmgewebe eingewachsen ist. Auch sind nur wenige Lymphknoten befallen. Da der Patient aber Lebermetastasen aufweist (M1 HEP), gilt seine Krankheit trotzdem als fortgeschritten und wird nach UICC in das Stadium 4 eingestuft.
15.1.6.3 Weitere Tumorcharakteristika
Typing (Zelltyp) Hierunter versteht man die histologische Klassifikation eines Tumors nach seinem Ausgangsgewebe. Beispiele für eine diesbezügliche Tumoreinteilung sind also: Adenokarzinom, Plattenepithelkarzinom, Leiomyosarkom.
Die Unterteilung ist für die weitere Therapie von Bedeutung, weil die einzelnen Zelltypen sehr unterschiedlich auf Strahlenbehandlung, Chemotherapie oder zielgerichtete Medikation ansprechen.
Grading (Zelldifferenzierung) Neben der Tumorausbreitung hat auch der Grad der histologischen Differenzierung (Ähnlichkeit mit dem gesunden Ausgangsgewebe) des malignen Gewebes prognostische Bedeutung. Man verwendet zur Festlegung des Gradings den Buchstaben „G“:
-
G1 – gut differenziert (weniger bösartig)
-
G2 – mäßig differenziert
-
G3 – schlecht differenziert
-
G4 – nicht differenziert (sehr bösartig)
Bei einem G1-Tumor ist das Tumorgewebe dem Ursprungsgewebe noch relativ ähnlich. Bei G4-Tumoren lässt sich das Ursprungsgewebe mikroskopisch kaum noch erkennen. Je entdifferenzierter die malignen Zellen sind, desto schlechter ist die Prognose.
Infiltrationstiefe Die histologisch nachweisbare Tiefenausdehnung eines malignen Tumors in das Gewebe ist prognostisch von großer Bedeutung. Hierbei geht es um die Frage, ob sich unter dem Mikroskop Tumoreinbrüche in Lymphbahnen oder Venen finden. Bei nachgewiesenen Gefäßeinbrüchen ist es wahrscheinlich, dass der Primärtumor bereits Metastasen auf dem Lymph- oder Blutweg gesetzt hat.
R-Klassifikation Für die Prognose des Krebspatienten nach einer Operation ist es entscheidend, ob Tumorreste im Körper verblieben sind. Dieser Prognosefaktor der lokalen Tumorfreiheit wird mit der R-Klassifikation erfasst:
-
R0-Resektion: kein Resttumor
-
R1-Resektion: mikroskopischer Resttumor (mit dem bloßen Auge nicht erkennbar)
-
R2-Resektion: makroskopischer Resttumor (mit dem bloßen Auge erkennbar)
15.2 Onkologische Therapiemöglichkeiten
Im Folgenden sind wichtige Begriffe im Zusammenhang mit der onkologischen Behandlung kurz erläutert.
Kurative Therapie (lat.: heilend) Sie hat die Heilung des Patienten zum Ziel. Bei einer kurativen Operation ist die Geschwulst vollständig entfernt (R0-Resektion), der Patient ist also voraussichtlich von seiner Tumorkrankheit geheilt. Ist Tumorgewebe verblieben (R1- oder R2-Resektion), muss evtl. postoperativ ein anderes Therapieverfahren angeschlossen werden, je nach Ausdehnung des Tumorrestes mit kurativer oder palliativer Zielsetzung.
Palliative Therapie (lat.: lindernd) Eine dauerhafte Heilung des Patienten ist nicht möglich. Palliative Therapie wirkt demzufolge nicht kurativ, sondern symptomatisch. Sie dient der Besserung der Lebensqualität oder der Verlängerung der Lebenszeit.
Adjuvante Therapie (lat.: unterstützend) Zusätzliche Behandlung nach der Operation mit dem Ziel, ein Rezidiv oder eine Metastasierung zu verhindern (z. B. Chemotherapie oder Bestrahlung nach Operation).
Neoadjuvante Therapie Auf eine Tumorreduktion und Verhinderung einer frühzeitigen Metastasierung zielende Therapie vor einer lokalen operativen Behandlung mit kurativer Intention (z. B. Chemotherapie oder zielgerichtete Medikamente vor einer Operation).
Erstlinientherapie (First-line-Therapie) Dabei handelt es sich um die erste Behandlungswahl bei Wiederauftreten des Tumors oder Metastasennachweis. Als Erstlinientherapie werden meistens Chemotherapeutika gegeben, oft zusammen mit modernen zielgerichteten Medikamenten.
Zweitlinientherapie (Second-line-Therapie) Wenn nach einer Erstlinientherapie kein Behandlungserfolg auftritt und der Tumor weiterwächst oder Metastasen bildet, kommt eine Zweitlinientherapie infrage. Dabei wird ein anderer Wirkstoff bzw. eine andere Behandlungsmethode gewählt, die für diese Therapieform in dem jeweiligen Land zugelassen ist.
Multimodale Therapie Hierunter versteht man den gleichzeitigen Einsatz mehrerer Verfahren.
Sequenzielle Therapie Zeitlich nacheinander durchgeführte Therapien (z. B. zunächst Chemotherapie, gefolgt von Radiotherapie).
Zusatzinfo
Aktuelle Leitlinien zur Krebsbehandlung finden Sie unter: www.krebsgesellschaft.de
15.2.1 Chirurgische Therapie
Die größte Aussicht auf endgültige Heilung bietet die totale Entfernung des malignen Gewebes (En-bloc-Resektion).
Kurative Operation Gelingt die Tumorentfernung vollständig, kann die Therapie nach der Operation abgeschlossen sein (kurative = heilende Operation). Neben der herkömmlichen „offenen“ Operation sind auch minimalinvasive Operationstechniken („Knopfloch“- oder „Schlüsselloch“-Chirurgie) in der onkologischen Chirurgie anerkannt. Sie haben gleiche Erfolgsaussichten wie die offenen Verfahren.
Palliative Debulking-OP Ein ausgedehnter Weichteiltumor, der in lebenswichtige Blutgefäße infiltriert ist, kann oft nicht total entfernt werden. Die chirurgische Teilentfernung kann jedoch indiziert sein, um mechanische Beschwerden (Schmerzen, Druck auf Nerven oder Gefäße) zu lindern oder um bessere Voraussetzungen für eine anschließende postoperative Chemo- oder Strahlentherapie zu schaffen (geringere verbliebene Tumormasse).
Palliative Bypassoperation Es handelt sich um Operationen zur Umgehung eines Hindernisses, z. B. eine Duodenalstenose bei Pankreaskopfkarzinom (Kap. ▶ 26.3).
Zusatzinfo
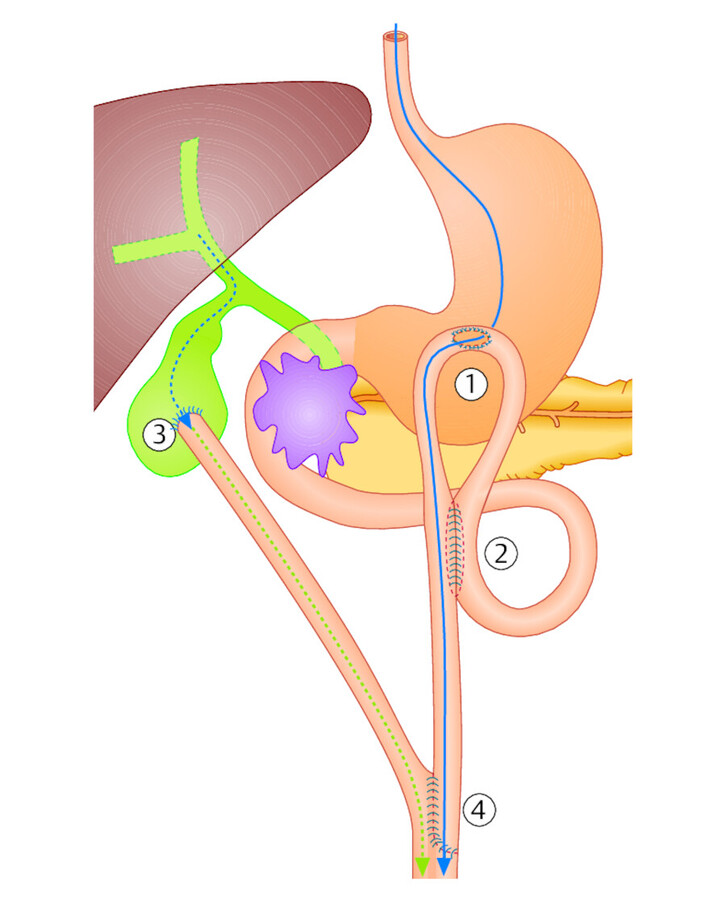
Umgehungsoperation bei Bauchspeicheldrüsenkrebs. Ein Pankreaskopfkarzinom führt aufgrund seiner anatomischen Lage häufig zu einer Einengung (Stenose) des Zwölffingerdarms (Duodenum) mit entsprechender Beeinträchtigung der Nahrungspassage ( ▶ Abb. 15.3). Kann die Geschwulst wegen zu großer Ausdehnung oder Metastasierung nicht entfernt werden, besteht die Möglichkeit, die Stenose durch eine Anastomose zwischen Magen und Duodenum (Gastroenterostomie = „GE“) zu umgehen, wobei vom Tumor selbst nichts reseziert wird. Die Nahrungspassage ist aber (zumindest vorübergehend) erhalten. Hat der Pankreaskopftumor auch den Gallengang eingeengt (Verschlussikterus), kann auch hier eine Umgehung (Bypass) geschaffen werden, indem eine Dünndarmschlinge mit der Gallenblase anastomosiert wird (biliodigestive Anastomose).
Abb. 15.3 Palliative Bypassoperation bei einem Pankreaskopfkarzinom. Die Enge im Duodenum wird durch Gastroenterostomie = GE (1) umgangen, Speisepassage blau. Zusätzliche Braun-Anastomose (2) für den Abfluss des Duodenalsekrets. Abfluss der Galle (grüne Punkte) bei Verschlussikterus über eine Cholezystojejunostomie = biliodigestive Anastomose (3) zwischen Gallenblase und hochgezogener Jejunumschlinge (Roux-Schlinge). (4) = Roux-Anastomose.
Explorative Laparotomie Der intraabdominelle Befund soll „erforscht“ (exploriert) und gleichzeitig die Möglichkeit einer operativen Behandlung geprüft werden. Meist handelt es sich um fortgeschrittene Tumorstadien, bei denen präoperativ kein exaktes chirurgisches Behandlungskonzept bestimmt werden konnte. Zeigt sich nach Eröffnung der Bauchhöhle, dass chirurgische Maßnahmen nicht mehr möglich sind, der Tumor also inoperabel ist, wird die Operation beendet. Sind weder am Tumor noch an anderen Organen chirurgische Maßnahmen erfolgt, spricht man von einer Probelaparotomie (PL).
15.2.2 Strahlentherapie
Bei der Strahlentherapie (Radiotherapie) werden die Krebszellen durch ionisierende Strahlung oder Teilchenstrahlung zerstört. Die Radiotherapie kann isoliert oder als Kombinationstherapie mit anderen Therapieverfahren eingesetzt werden. Im Gegensatz zur medikamentösen, im ganzen Körper wirkenden („systemischen“) Chemotherapie ist die Strahlenbehandlung eine lokale Maßnahme. Die tumorzerstörende Wirkung tritt nur innerhalb des Bestrahlungsfelds auf.
Einige Krebsarten, z.B. lokal begrenzter Kehlkopfkrebs oder Prostatakrebs, können durch eine alleinige Strahlentherapie geheilt werden.
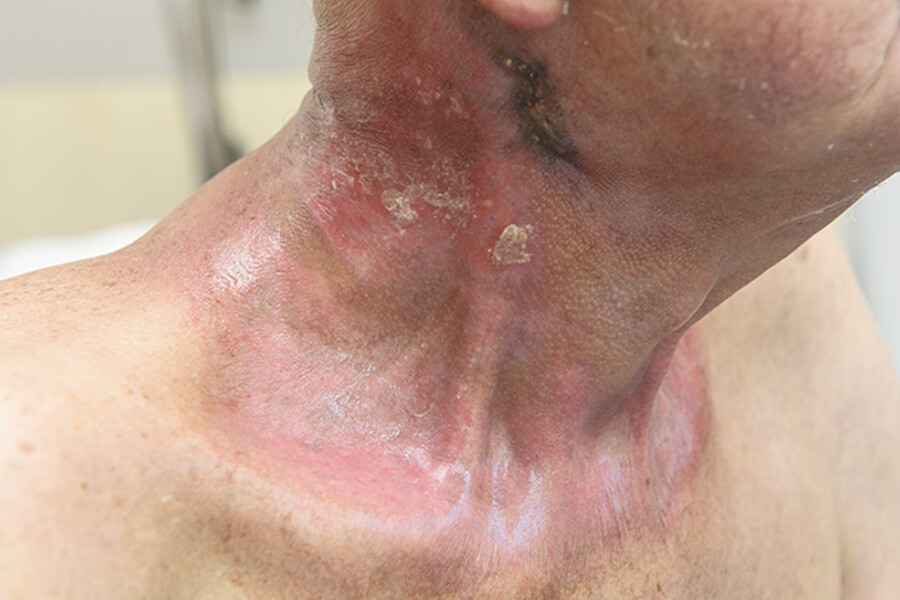
Teletherapie (perkutane Bestrahlung) Bei der Teletherapie stehen Tumor und Strahlenquelle nicht in direktem Kontakt ( ▶ Abb. 15.4. Der Tumor wird aus einer geringen Entfernung durch die Haut (perkutan) bestrahlt. Meistens erfolgt diese Strahlenbehandlung in mehreren Sitzungen (fraktioniert).
Abb. 15.4 Teletherapie. Bei diesem Patienten befand sich ein Tumor im Halsbereich. Nach 7-wöchiger perkutaner Bestrahlung hat sich der Tumor komplett zurückgebildet. Die Hautschäden sind weitgehend reversibel.
(Abb. aus: I care Pflege. Thieme; 2020)
Stereotaktische Bestrahlung Wenn die Behandlungsstrahlen aus verschiedenen Einstrahlwinkeln punktgenau auf den Tumor gelenkt werden, lässt sich eine höhere Präzision erzielen, vergleichbar mit einem chirurgischen Eingriff („Strahlenchirurgie“). Man spricht auch vom „GammaKnife“ oder „CyberKnife“ (Knife = Messer). Die stereotaktische Bestrahlung ist für Hirntumoren, Tumoren und Metastasen in Lunge, Leber, Prostata und Wirbelsäule geeignet.
Pflegepraxis
Hautpflege bei Strahlentherapie. Es gibt einige Empfehlungen zur Hautpflege während der Strahlentherapie. Generell gilt, dass jede Hautreizung im Bestrahlungsfeld vermieden werden sollte (z.B. besondere Hitze oder Kälte, Make-up, Chlor- oder Salzwasser). Stattdessen sollte das betroffene Hautareal so oft wie möglich der Luft ausgesetzt und ausschließlich pH-neutrale Hautpflegeprodukte gewählt werden.
Brachytherapie (Kontaktbestrahlung) Bei der Brachytherapie liegt die Strahlenquelle direkt im oder am Tumor. Die erzeugten Strahlen haben nur eine kurze Reichweite („brachy“ = kurz). Dadurch kann weitgehend vermieden werden, dass das umliegende gesunde Gewebe durch die Kontaktbestrahlung geschädigt wird. Beispiele für die Anwendung sind Lippen- oder Zungenkrebs und gynäkologische Tumoren.
Afterloading Bei dieser Kontaktbestrahlung aus dem Köperinneren wird der Tumor mit Schläuchen, Hohlröhren oder Hohlnadeln „gespickt“. Durch diese inneren Zugänge werden starke Strahlungsquellen für einen kurzen Zeitraum eingebracht. Am Ende der Therapie werden die Schläuche entfernt. Eingesetzt wird das Afterloading z.B. bei Enddarmkrebs, beim Prostatakarzinom oder beim Gebärmutterhalskrebs.
IORT (Intraoperative Radiotherapie) Hierunter versteht man die direkte Bestrahlung des Gewebes während der OP bei eröffneter Wunde. Bestrahlt wird das „Tumorbett“ nach operativer Tumorentfernung. Geeignet ist die IORT bei Bestrahlungen im Bauchraum, weil umliegende Organe gut geschützt werden können, z.B. beim Rektumkarzinom. Auch beim Mammakarzinom wird die IORT von einigen Kliniken angeboten, um durch intraoperative Bestrahlung bei brusterhaltender OP die postoperative Bestrahlung durch die Haut zu reduzieren.
15.2.3 Chemotherapie
Chemotherapeutika (auch Zytostatika genannt) greifen die Krebszellen in unterschiedlichen Phasen der Zellteilung an. In der Krebstherapie sind über 50 Zytostatika gebräuchlich. Je nach Präparat gibt es Tabletten oder Infusionen.
Im Gegensatz zu einer OP oder Bestrahlung wirkt eine Chemotherapie (oft als „Chemo“ abgekürzt) im gesamten Körper, was man „systemisch“ nennt. Krebszellen haben eine höhere Teilungsrate als gesunde Zellen und reagieren daher empfindlicher auf Chemotherapeutika. Viele Tumoren bilden schon früh Mikrometastasen (winzige Tochtergeschwülste), die in den bildgebenden Untersuchungsverfahren nicht sichtbar sind. Sie können aber mit der systemischen Chemotherapie zerstört werden.
Bei der Chemotherapie werden oft mehrere Substanzen miteinander kombiniert, um so viele Tumorzellen wie möglich in den unterschiedlichen Phasen der Zellvermehrung zu erreichen. Bei den meisten Krebserkrankungen werden Zytostatika mit anderen Therapieverfahren wie Operation oder Bestrahlung kombiniert.
Adjuvante Chemotherapie Die unterstützende Chemotherapie erfolgt nach einer Operation oder Bestrahlung. Sie hat das Ziel, verbliebene Tumorreste und Metastasen zu bekämpfen.
Neoadjuante Chemotherapie Diese erfolgt vor einer Operation oder Strahlenbehandlung. Ziel der neoadjuvanten Chemo ist es, den Tumor zu verkleinern, wodurch eine bessere Ausgangssituation für die weitere Behandlung erreicht werden soll.
Zusatzinfo
Nebenwirkungen. Chemotherapie ist verantwortlich für viele unerwünschte Wirkungen. Besonders Gewebe mit einer hohen Zellteilungsrate (z.B. Haut, Schleimhäute, Haare und die blutbildenden Zellen im Knochenmark) wird von Zytostatika betroffen. Es zeigen sich z.B. Haarausfall, Mukositis (Mundschleimhautentzündung) und Leukopenie. Mit dem Ende der Behandlung können sich die Zellen regenerieren.
Chemoembolisation Bei dieser Behandlung handelt es sich um eine regionale Chemotherapie. Das Zytostatikum wird über einen von der Leiste eingebrachten Katheter direkt in das Tumorgewebe eingebracht. Dadurch werden systemische Nebenwirkungen auf den Gesamtorganismus deutlich reduziert. Ein gängiges Beispiel ist die transarterielle Chemoembolisation (TACE) bei Leberkrebs.
15.2.4 Antihormontherapie
Die wichtigsten Tumoren mit einem hormonabhängigen Wachstum sind Brustkrebs und Prostatakrebs. Eine antihormonelle Behandlung dieser Tumoren ist seit Jahrzehnten bekannt und gebräuchlich.
Operativer Hormonentzug Die Produktion der Geschlechtshormone kann durch die operative Entfernung der hormonproduzierenden Organe gestoppt werden. Um Betroffenen eine dauerhafte Medikamenteneinnahme mit Nebenwirkungen zu ersparen, können z.B. befallene Eierstöcke oder Hoden entfernt werden.
Pharmakologischer Hormonentzug Inzwischen stehen alternativ antihormonelle Medikamente zur Verfügung.
-
Antiöstrogene: Medikamente, die die Wirkung weiblicher Geschlechtshormone blockieren
-
Antiandrogene: Medikamente, die die Wirkung männlicher Geschlechtshormone blockieren
Antihormonelle Behandlung bei Brustkrebs 4 von 5 Patientinnen mit bösartigen Brusttumoren haben Rezeptoren für hormonelle Botenstoffe. Um das zu prüfen, werden feingewebliche Untersuchungen einer Tumorprobe auf Hormonrezeptoren durchgeführt. Bei vorhandenen Hormonrezeptoren spricht man von einer „hormonrezeptorpositiven Patientin“. Bei diesen Patientinnen ist die Behandlung mit dem Antiöstrogen Tamoxifen (Nolvadex) sinnvoll. Wenn keine Hormonrezeptoren in der operativ entnommenen Tumorprobe nachweisbar sind, erzielt eine ▶ antihormonelle medikamentöse Therapie hingegen keinen Erfolg.
Antihormonelle Behandlung bei Prostatakrebs Das männliche Geschlechtshormon Testosteron wird vorwiegend in den Hoden gebildet und fördert auch das Wachstum von Prostatakrebszellen. An einem (fortgeschrittenen) Prostatakarzinom erkrankte Männer erhalten ein Antiandrogen (z.B. Flutamid) oder die operative Hodenentfernung (Kastration), was vom Einzelfall abhängt.
Zusatzinfo
Hormonrezeptorbestimmung. Bei Frauen mit Brustkrebs erfolgt zwingend eine Rezeptorbestimmung aus dem Tumorgewebe vor einer Antihormonbehandlung. Bei Männern mit Prostatakrebs muss eine Rezeptorbestimmung hingegen nicht erfolgen. Alle Prostatakarzinome gelten als empfindlich für eine antihormonelle Behandlung.
15.2.5 Molekularbiologische Therapie
Die Fortschritte in der Molekularbiologie haben Grundlagen geschaffen, die Therapie auf das individuelle molekulare Tumorprofil abzustimmen. Diese neuen „zielgerichteten“ Medikamente befinden sich in kontinuierlicher Weiterentwicklung.
Grundsätzlich können zielgerichtete Therapien nur dann wirken, wenn die jeweilige Zielstruktur in den Krebszellen auch tatsächlich vorhanden ist. Aus diesem Grund werden bei der Diagnosestellung vieler Krebsarten umfangreiche molekulare Gewebeuntersuchungen vorgenommen. Anhand der Ergebnisse dieser Tests kann eine individuelle Strategie mit einer zielgerichteten Therapie festgelegt werden.
Derzeit sind es vor allem fortgeschrittene Krankheitsstadien, in denen molekularbiologische Wirkstoffe zugelassen sind. Die Forschungsbemühungen konzentrieren sich auch auf die Entwicklung entsprechender Therapien für Tumoren in früheren Stadien.
Merke
Zielgerichtete Therapie. Die zielgerichteten Arzneimittel („targeted therapies“) wirken gegen Merkmale, die es nur in Tumorzellen gibt. Zellen in gesundem Gewebe werden nur wenig beeinträchtigt.
Es gibt verschiedene Gruppen zielgerichteter Medikamente. Nachfolgend einige Beispiele.
Monoklonale Antikörper Die Wirkstoffnamen von monoklonalen Antikörpern enden auf „-mab“ (z. B. Bevacizumab, Trastuzumab und viele andere). Die im Labor entwickelten Eiweißstoffe blockieren Wachstumsrezeptoren an der Zelloberfläche und hindern Tumorzellen auf diese Art am Wachsen. Einer der klinisch bedeutsamen Rezeptoren ist der epidermale Wachstumsfaktor EGFR (epidermal growth factor receptor), der in zahlreichen Tumoren vermehrt nachweisbar ist. Die Aufgabe des Antikörpers ist es, die Bindestelle des Rezeptors zu blockieren, um ein Andocken von wachstumsfördernden Faktoren aus der Umgebung der Zelle zu verhindern.
Ähnlich ist es mit dem HER-2-Rezeptor, der bei manchen Brustkrebspatientinnen oder Patienten mit Magenkrebs deutlich überproduziert wird. Dadurch empfängt die Tumorzelle verstärkt Befehle zur Zellteilung. Die Behandlung mit einem geeigneten monoklonalen Antikörper richtet sich gegen den HER-2-Rezeptor auf Tumorzellen und bremst ihr Wachstum.
Tyrosinkinasehemmer Die Wirkstoffnamen von Tyrosinkinasehemmern enden auf „-mib“ oder „-nib“ (z. B. Erlotinib, Gefitinib und viele andere). Kinasen sind Enzyme und geben Wachstumssignale innerhalb der Zelle weiter. Die Tyrosinkinasefunktion ist für das ungebremste Wachstum von Tumoren verantwortlich. Kinasehemmer blockieren die Signalübertragungsketten im Zellinneren. Durch die Hemmung der Signalweiterleitung kommt es letztlich zum Absterben der entarteten Zelle. Inzwischen gibt es eine ganze Reihe von Tyrosinkinasehemmern für verschiedene Krebserkrankungen.
mTOR-Hemmer Der Wirkstoffname von mTOR-Hemmern endet auf „-mus“ (z.B. Everolimus, Sirolimus). mTOR (mechanistic Target of Rapamycin) steuert zentrale Vorgänge des Tumorwachstums. mTOR-Hemmer sind eine neue Medikamentengruppe. Sie beeinflussen Zellteilung und Eiweißsynthese, hemmen das Einwachsen von Gefäßen in den Tumor und behindern das Zellüberleben. Auch aus dieser Medikamentenklasse sind in Deutschland bereits mehrere Produkte zur Krebstherapie zugelassen.
15.2.6 Immuntherapie
Die Immuntherapie gilt als Hoffnungsträger in der künftigen Krebsmedizin. Tumorspezifische Antigene bilden geeignete Angriffsziele für eine Immunreaktion. Immun-Checkpoints (Kontrollpunkte) verhindern normalerweise eine Überfunktion des Immunsystems gegen gesunde Zellen. Manche Tumoren aktivieren gezielt solche Immun-Checkpoints. „Checkpoint-Inhibitoren“ wirken dem entgegen. Sie verhindern die Unterdrückung der Immunantwort und bewirken so, dass das Immunsystem den Tumor verstärkt angreift.
Beim malignen Melanom (schwarzer Hautkrebs) und bei fortgeschrittenem Lungenkrebs hat die Immuntherapie erste Erfolge erzielt, z.B. mit Ipilimumab (Handelsname Yervoy).
15.2.7 Alternative Krebsmedizin
Als alternative Therapien oder Komplementärmedizin werden Behandlungsmethoden bezeichnet, die alternativ oder ergänzend zur Schulmedizin angeboten werden. Am häufigsten gefragt sind Mistelpräparate, Vitamine und Spurenelemente.
15.2.8 Palliativmedizin
Als Palliativmedizin bezeichnet man die Gesamtheit lindernder Maßnahmen in der letzten Lebenszeit von schwer kranken Patienten, die z.B. an malignen Tumoren leiden.
15.3 Pflegeschwerpunkt: Krebs
„Sie haben Krebs“ – diese 3 Worte verändern die Lebenssituation des Betroffenen auf vielfältige Weise. Die Wucht der Diagnose zeigt sich vor allem durch das beeinträchtigte Körperschema nach chirurgischer Therapie:
-
mit lebenslang sichtbaren Veränderungen, z.B. Narben, Stomata
-
mit bleibenden Anpassungen des Körpers an die onkologischen Sicherheitsabstände, z.B. fehlende Organe, Verlust der Kontinenz
Bei ausgedehntem Tumorwachstum kann der vergleichsweise kleine Schnitt für eine explorative Laparotomie ein Symbol für fehlende therapeutische Optionen sein.
Das Image der Diagnose Krebs verunsichert die Betroffenen massiv. Sie fragen sich, welche Therapieverfahren sichere Heilungs- bzw. Überlebenschancen bieten.
Neue medizinische Strategien verlangen von den Pflegenden eine rasche Anpassung ihres Wissens, damit sie für die Wirkungen und Folgen der Behandlungsmaßnahmen ein entsprechendes Pflegeangebot gestalten können. So erfordert z.B. die rasante Entwicklung der tumorzellspezifischen Therapie ein Management der unerwünschten Wirkungen, für das manchmal noch keine Literatur verfügbar ist. In der Chirurgie entwickeln sich die organerhaltenden Operationen mit zunehmendem Wissen über die Tumorbiologie immer weiter. Zeitgleich werden die multimodalen Konzepte mit voroperativer (neoadjuvanter) und nachoperativer (adjuvanter) Radio- bzw. Chemotherapie immer komplexer und ermöglichen Multiviszeralresektionen, die größere Heilungschancen bieten.
Der Volksmund sagt: „Man muss heil aus einer Sache herauskommen.“ „Die Zeit heilt alle Wunden.“ Bei einer Operation kommt man „unters Messer“.
Die aktuelle Lebenssituation – an Krebs erkrankt zu sein und eine (möglicherweise sehr umfangreiche) Operation vor sich zu haben – erschüttert und entsetzt die Patienten. Es gilt deshalb auch für die Pflegenden, diesen Schrecken auszuhalten, den Problemen zu begegnen und gemeinsam nach Lösungen zu suchen.
Fallbeispiel
Herr Walter.
Die Aufnahmeformalitäten sind erledigt. Herr Walter muss mehr als 2 Stunden auf seinen Bettplatz warten. Er hatte zuvor bereits viele Schilderungen vom Alltag im Krankenhaus gehört, sie aber nicht auf sich bezogen. Nun ist er überfordert, von den juristischen Formulierungen im Behandlungsvertrag, den er in der Verwaltung unterzeichnen musste, vom pflegerischen Erstgespräch, von der Aufklärung des Narkosearztes, vom Gespräch mit einem Chirurgen, vom Studienarzt, der Gewebeproben untersuchen möchte.
Herr Walter konnte nicht viele Fragen stellen. Meist musste er nur antworten und wurde mit seinen Anliegen auf später vertröstet. Er hört und sieht in der Wartezeit viele Details aus dem Stationsalltag, Flurgespräche von Patienten, die entlassen werden, eine weinende Frau, die ein Patientenzimmer verlässt, einige blasse und schwache Patienten, die mühsam Infusionsständer schieben.
Die Pflegenden wissen zu Dienstbeginn meist nicht, wer an diesem Tag aufgenommen wird und wem sie während der Schicht begegnen. Kommt dieser Patient zur explorativen Laparotomie? Sollen Metastasen entfernt werden? Muss bei diesem Patienten nachoperiert werden, weil der erste Eingriff den Tumor nicht vollständig erfassen konnte? Gelingt bei diesem Patienten lediglich eine Verkleinerung des Tumors (Debulking), weil dessen anatomische Lage weitergehende Optionen nicht zulässt?
Zu den Gefühlen im Zusammenhang mit der Erkrankung gehören Hoffnungen, Befürchtungen und nicht selten der Glaube, dass sich ein Wunder einstellen könnte. Pflegerische Kompetenz ist eine wichtige Voraussetzung für die umfassende Unterstützung bei der Krankheitsbewältigung. Psychosoziale Pflegekompetenz zeigt sich am personorientierten Eingehen auf die Ängste der Patienten. Dazu zählen:
-
Befürchtungen, wie sich die diagnostizierte Erkrankung entwickeln wird
-
Befürchtungen, ein ähnliches Schicksal zu erleiden, wie es Mitpatienten zu tragen haben
-
große Unsicherheit bezüglich der Verdachtsdiagnose aus bildgebenden Verfahren. Patienten können die Hoffnung hegen, dass der Befund aus der Computertomografie bereits den gesamten Umfang des Tumors abbildet oder dass sich während der Operation ein günstigeres Bild bietet
-
Verzweiflung über das Auftreten eines Rezidivs, obwohl der Onkologe gesagt hatte, es sei alles in Ordnung
Die Pflegebeziehung zu diesen Patienten ist einerseits geprägt durch eine positive Haltung bezüglich des Nutzens onkologischer Therapien. Andererseits müssen Pflegende die Balance zwischen empathischer Mitbetroffenheit und der Auseinandersetzung mit der Endlichkeit des menschlichen Lebens finden.
15.3.1 Art und Umfang der Diagnosemitteilung
Die Form der Krankheitsaufklärung wirkt nicht nur auf den Betroffenen selbst, sondern auch auf alle Personen, die mit der Pflege, der Behandlung und der Betreuung des onkologisch erkrankten Patienten befasst sind. Dazu gehören auch die Angehörigen, die in dieser Phase intensive Unterstützung benötigen ( ▶ Abb. 15.5). Im günstigsten Fall ist die Vermittlung der Diagnose als Dialog angelegt, dessen Umfang und Zeitrahmen der Patient bestimmt.
Es stellen sich folgende Fragen:
-
Zu welchem Zeitpunkt soll aufgeklärt werden? Am Tag nach der Operation, wenn sich makroskopisch und per Schnellschnitt die präoperative bildgebende Verdachtsdiagnose bestätigt hat, man aber noch nichts über den Lymphknotenbefall weiß, der die Prognose beeinflusst? Erst zwischen dem 6. und 8. postoperativen Tag, weil zu diesem Zeitpunkt der gesamte histologische Befund vorliegt?
-
Soll der Patient allein oder mit seinen Angehörigen aufgeklärt werden? Die Beteiligung weiterer Personen an einem Aufklärungsgespräch setzt zwingend eine Einverständniserklärung des Betroffenen voraus.
Abb. 15.5 Diagnose Krebs. Nicht nur die Patienten, sondern auch deren Angehörige benötigen nach dieser Nachricht häufig Unterstützung.
(Foto: P. Blåfield, Thieme)

Zusatzinfo
„Für die Patienten ist der Gedanke an Krebs so ähnlich wie das Eingesperrtsein in einem dunklen Zimmer, zusammen mit einem Mörder. Man weiß nicht, wo und wie und ob er angreifen wird.“ (Wander, 1984).
Patienten mit malignen Erkrankungen sind von großer Angst betroffen. Sie kann lähmen oder zu vergeblichen Fluchttendenzen führen. Pflegende sind sich dieser massiven Gefühle bewusst und wählen angemessene Gesprächstechniken. Sie lassen nicht zu, dass ihre Alltagsroutine zu einer Gleichgültigkeit gegenüber persönlichen Schicksalen führt.
Fallbeispiel
Spätdienst. Alltag auf einer onkologischen Station im Spätdienst. 2 Pflegende sind anwesend, 1 Pflegeschüler und 1 Fachpflegekraft. Sie wissen aufgrund der Übergabe von den Kolleginnen der Frühschicht, dass der Stationsarzt mit 3 Patienten die Befunde besprechen wird:
-
Mit Herrn Anton (38 Jahre). Er hat ein Rektumkarzinom, es sind Lymphknoten befallen. Nach der anterioren Rektumresektion wird ihm eine adjuvante Chemotherapie empfohlen.
-
Mit Frau Tochter (64 Jahre). Sie hat ein Pankreaskopfkarzinom. Der Tumor ist nicht resezierbar. Während des Eingriffs wurde eine biliodigestive Anastomose angelegt, es besteht die Möglichkeit, sie mit Chemotherapie im Rahmen einer Studie weiterzubehandeln.
-
Mit Herrn Wilhelm (76 Jahre). Er wurde mit einem akuten Abdomen aufgenommen. Die postoperative Diagnose ergibt ein perforiertes Sigmakarzinom.
Der Arzt und die Pflegenden haben die Verpflichtung, jedem Patienten die Wahrheit erträglich zu machen. Im Rahmen der unterschiedlich festgelegten Kompetenzen halten die Pflegenden sich an den Informationsrahmen, den der Arzt während seines Aufklärungsgesprächs gesteckt hat. Sie erläutern Sachverhalte, die den Patienten unklar geblieben sind, hüten sich aber davor, Informationen zu geben, die über die ärztliche Aufklärung hinausgehen – insbesondere vor einer Einschätzung der Prognose.
Pflegende sind häufig mit der Frage konfrontiert, wie viel Wissen ein Mensch benötigt, um über seinen Körper und dessen Erkrankungen nachdenken zu können. Wie viel und was kann man behalten bei der Fülle der panikauslösenden Fakten? Wie viel Konzentration kann ein Patient aufbringen, wenn die Mitpatienten gleichzeitig telefonieren oder pflegerische Hilfe brauchen?
Oftmals können Patienten nach der Übermittlung einer ungünstigen Diagnose in dem laufenden Gespräch keine weiteren Informationen verarbeiten. Es kommt zu einer Art seelischer Gehörlosigkeit. So erklärt sich auch die Anmerkung eines Patienten kurz vor der Entlassung: „Wann spricht endlich der Stationsarzt mit mir über die Befunde?“
15.3.1.1 Reaktion des Patienten
„Haben Sie noch Fragen?“ So lautet häufig das Ende eines ersten Informationsgesprächs mit dem behandelnden Arzt. Wenig später zeigt sich den Pflegenden die existenzielle Krise, die der Patient erlebt. Mögliche Äußerungen lauten:
-
„Wie lange werde ich noch leben?“
-
„Kennen Sie Patienten, bei denen eine Chemotherapie wirklich geholfen hat? Meine Nachbarin ist trotzdem an ihrem Krebs ganz schnell gestorben.“
-
„Wie arg muss ich leiden, wenn der Krebs bald unaufhaltsam weiterwächst?“
Kommunikationskompetenz und Berufserfahrung in der Betreuung von Tumorpatienten sind notwendige Voraussetzungen, um diese emotional schwierigen Gespräche führen zu können.
Es ist wichtig, die eigenen Formen der Kommunikation wahrzunehmen und zu reflektieren. Zielgerichtete Techniken (z.B. personenzentrierte Gesprächsführung nach Rogers) helfen, mit sensiblen Situationen umzugehen. Der Patient erlebt Kommunikationshindernisse wie eine Schlüsselsituation. Er spürt das Unausgesprochene. Auch mit nonverbalen Signalen können Pflegende zeigen, dass sie mehr wissen als der Betroffene. Patienten ahnen den Informationsvorsprung und formulieren nicht selten Fragen wie: „Schwester Ute, warum gehen Sie mir seit gestern richtig aus dem Weg?“. Oder: „Pfleger Tom, seit gestern kümmern Sie sich so rührend um mich, steht es schon so schlimm?“
Patienten erleben Informationsdefizite als Belastung. Sie assoziieren: „Meine schlimmsten Vermutungen bestätigen sich – wie ernst muss es sein, wenn mir alle ausweichen, sich keiner traut, mir etwas zu sagen?“
Auch die Wahl des Gesprächspartners ist bedeutsam. So will ein Patient mit seinem Anliegen oftmals weder mit Auszubildenden noch mit Helfern im freiwilligen sozialen Jahr sprechen. Dem Patienten ist bewusst, dass diese meist jungen Menschen über wenig Wissen zu seiner Gesamtsituation verfügen. Dennoch fragt er gerade sie, weil er sie in der Betreuung als sehr einfühlsam und zugewandt erlebt hat. Vielleicht braucht dieser Patient einen Menschen, der nur zuhört. Stille Gedanken können ihren ersten Schrecken verlieren, wenn man sie mit jemandem teilt, der ebenfalls hilflos ist. In professionellen Pflegeteams sind Belastungen von Teammitgliedern durch solche Gespräche abzufangen, etwa im Rahmen einer kollegialen Beratung oder im Zuge einer Supervision.
Fallbeispiel
Herr Freit. Entgegen allen Erwartungen ist der Tumor von Herrn Freit nicht operabel. Er war auf eine 4-stündige Operationszeit mit anschließender Nachbeatmung auf der Intensivstation vorbereitet worden. Stattdessen erwacht er im OP-Trakt und sieht, dass es erst 9.30 Uhr ist. Er ertastet ein kleines Pflaster, hat keine Drainage. Bei der Rückverlegung auf die Station gegen Mittag sieht er seine Ehefrau, die tränenüberströmt auf dem Flur steht. Warum?
Es ist nicht vorhersehbar, mit welcher Verzweiflung Patienten und ihre Angehörigen auf ungünstige Therapienachrichten reagieren. Mögliche Diskussionen um den Wachheitsgrad und Nachwirkungen der Narkosemedikamente auf das Erinnerungsvermögen sind keine überzeugenden Gründe, intraoperative Befunde erst am nächsten Tag zu übermitteln. Wissen und Informiertheit sind Patientenrechte.
15.3.1.2 Informationsweitergabe
Nicht nur in erfahrenen onkologischen Teams, sondern in allen Pflegesituationen ist der Wahrhaftigkeitsgrundsatz die wichtigste Maßgabe der Kommunikation. Diese Forderung ist jedoch nicht mit Eigenmächtigkeit gleichzusetzen. Es geht um die Mitverantwortung und nicht nur um die Zuständigkeiten bei der Informationsweitergabe. Wenn der Patient fragt: „Wieso war die Narkose so kurz?“, müssen Pflegende sagen können, dass die Operation nicht in dem Umfang durchgeführt wurde, wie es vorgesehen war. Auf den postoperativen Papieren ist in jedem Fall die Eingriffsart vermerkt. Dort könnte der Patient aufgrund seiner Informationsrechte selbst nachlesen. Weitere Einzelheiten muss einer der behandelnden Ärzte erläutern. Es ist ein Gebot der Fairness und des Respekts allen Beteiligten gegenüber, dass in jeder (chirurgischen) Abteilung eine Regelung etabliert ist, die dem Patienten ganz sicher in nächster Zeit (am selben Tag) einen kompetenten Gesprächspartner zur Verfügung stellt. Es geht um den Lebensmut des Patienten, deshalb ist es unzumutbar, einen Tumorpatienten mit seinem Wissens- und Informationsbedarf auf unbestimmte Zeit zu vertrösten.
15.3.2 Ziele der onkologischen Therapie
Der histologische Befund des entfernten Gewebes und die Ergebnisse der Umfelddiagnostik ermöglichen die Einschätzung des Tumorstadiums und der Prognose. Es ist das Ziel, Heilungsraten zu verbessern, tumorfreie Lebenszeit zu sichern und das Intervall bis zum nächsten Rezidiv zu verlängern. Die statistischen Zahlen der Therapieerfolge und der Misserfolge können jedoch niemals Einzelschicksale abbilden. Trotzdem möchte jeder Patient wissen, wie sein Leben nach der ersten Auseinandersetzung mit der Erkrankung weitergeht:
-
Habe ich den Krebs besiegt und überlebt? Wie lange werden die Nachuntersuchungen die Heilung bestätigen?
-
Wie geht das Leben weiter, wie schnell ist mein Leben beendet?
Vor allem die Pflegebeziehungen gestalten die Rahmenbedingungen, durch die der Patient während seiner Krankheitsbewältigung Unterstützung erhält. Dazu gehört, dass die Pflegenden Gefühle wie Ungeduld, Wut, Enttäuschung und Anklagen deuten, zuordnen und zulassen.
Bestellt ein Patient innerhalb von 5 Minuten 3-mal das Frühstücksgetränk um, verwechselt er nicht die Pflege mit einem Hotelservice. Es kann sein, dass sich in diesem Verhalten seine Ambivalenz gegenüber der Therapieplanung zeigt: Ist dies oder das besser?
Für nicht beeinflussbare Organisationsabläufe haben Krebspatienten meist überhaupt kein Verständnis. Alles geht ihnen zu langsam. Sie glauben, man habe sie vergessen. Möglicherweise fühlen sie sich von ihrer subjektiven Zukunftsperspektive bedroht. Sie haben den Eindruck, es bleibe ihnen nicht mehr viel Zeit.
Die emotionale Gefühlslast der Patienten mitzutragen bedeutet ebenfalls, jedes Mal zu reflektieren und zu akzeptieren, dass die Krankheit und die Therapie den Patienten massiv beeinträchtigen können.
Zusatzinfo
„Burn-out (ausbrennen) heißt das Schlagwort dafür. Gemeint ist das Phänomen, dass bei primär hoch motivierten engagierten Menschen langsam und schleichend als Folgezustand von chronischer Überlastung körperliche, emotionale und geistige Erschöpfung eintritt und es immer schwerer für sie wird, sich auf die Patienten mitfühlend einzustellen.“(Ratsak, Schiebel-Piest, 1992).
Vorbeugende Krisenintervention kann durch entlastende Teamgespräche in Form einer Supervision erfolgen.
15.3.3 Postoperative Pflege
Die pflegerische Arbeit auf chirurgischen Stationen konzentriert sich u. a. auf die Überwachung der vitalen Funktionen, die Schmerzlinderung, die Frühmobilisation, den Kostaufbau, die Darmtätigkeit, die Drainagen und die Versorgung von Wunden.
Ernährungsmanagement Auf viszeralchirurgischen Stationen sind Kostaufbau und das klinische Management der Darmtätigkeit wichtige Tätigkeitsschwerpunkte. Sie sind nach den Maßgaben des Operateurs zu gestalten. Oftmals verhindern Probleme an den Anastomosen oder eine verzögerte intestinale Organmobilität im Zusammenhang mit ausgedehnten abdominellen Operationen den raschen und bedarfsdeckenden oralen Kostaufbau. Ödeme, die u.a. Folge des perioperativen Flüssigkeitsmanagements und der veränderten Funktion von Zellmembranen sein können, verschleiern oft einen Gewichtsverlust. Hinzu kommt ein mögliches präoperatives Energiedefizit. Wenn der Patient bereits präoperativ – etwa bedingt durch Untersuchungen mit Nüchternheitspflicht – weniger essen konnte, ihm die Sorgen „auf den Magen geschlagen“ sind oder er im Zuge der Aufklärung „vieles hat schlucken müssen“ –, will er postoperativ möglicherweise alles tun, um rasch wieder zu Kräften zu kommen.
Viele Kliniken haben individuelle Strategien zum Kostaufbau etabliert. Grundsätzlich legt der Operateur das Vorgehen fest. Mögliche Stufen: ausschließlich Flüssigkeiten, flüssige Kost, Breikost, weiche Kost, streng passierte Kost, leichte Kost. Es ist Aufgabe der Pflegenden, die Bedingungen der Anastomosenpassage, der intestinalen Motilität und der Geschmacksvorlieben des Patienten in Einklang zu bringen mit den Gegebenheiten der Krankenhausküche:
-
Was ist erlaubt bei Flüssigkeiten (z.B. Tee, Wasser, Fruchtsäfte, Softdrinks, Milchmixgetränke, Kaffee)?
-
Welche Konsistenz darf Flüssigkost haben? Gehören Joghurt, Pudding, Wassereis dazu?
-
Welche Zutaten sind bei Breikost erlaubt (Weichweizengrieß, Reis, Quinoa, Sago)?
-
Was ist für den Koch der Unterschied der Zutaten bei Breikost und streng passierter Kost?
-
Gibt es in der Klinik auch für diese Kostaufbauformen einen Speiseplan, was kann der Patient wählen?
-
Hält ein Patient Pastinaken, Zucchini, Kürbis, Möhren grundsätzlich für gesunde Nahrungsmittel, wünscht sich aber relativ rasch ein deftiges Fleischgericht?
Es wäre hilfreich, wenn bereits während des pflegerischen Erstgesprächs in Erwartung eines Eingriffs geklärt würde, ob der Patient süße Breie essen mag, ob ihm Suppen schmecken oder ob er andere diätetische Regeln befolgt, z.B. Vegetarismus, Veganismus, Lactose- oder Glutenfreiheit. Wichtig zu wissen ist auch, ob die Küche solchen Erfordernissen entsprechen kann.
Sexualität Die Dramatik des Krankheitsgeschehens sowie die darauf bezogenen Kommentare von Verwandten und Bekannten sind bedeutsame Einflüsse, wenn die Patienten sich mit den Therapiefolgen an und in ihrem Körper beschäftigen. Körperliche Liebe und Zärtlichkeit scheinen zunächst unerreichbar zu sein. Nach der Therapie ist der Körper im besten Fall tumorfrei. Dieses Ergebnis hat sich jedoch nicht selten nur mit einem Verlust wesentlicher Organfunktionen verwirklichen lassen. Von nun an müssen die Patienten mit einem künstlichen Darmausgang, mit einem Tracheostoma oder anderen eingeschränkten Fähigkeiten leben. Darunter leidet häufig ihr Sexualleben. Das veränderte Körperbild und die sichtbare Konfrontation mit den Krankheitsfolgen können zu Selbstzweifeln sowie Unsicherheiten bezüglich der eigenen Attraktivität führen.
Wenn Zeit, Raum und Bereitschaft während der Entlassungsberatung angemessen geplant sind, bieten Pflegende ein Gespräch an, das folgende Inhalte umfassen kann:
-
Welche Folgen hat die Krebstherapie auf das Geschlechtsleben?
-
Wie findet man geeignete Ansprechpartner außerhalb der Klinik? Welche Materialien stehen zur Verfügung (z.B. Broschüren, DVDs, individuell anwendbare Hilfsmittel)?
Das Ansprechen sexueller Bedürfnisse ist mit Tabus belastet, die seitens der Patienten und der Pflegenden bestehen. Viel etablierter ist es, sich auf klassische pflegerische Themen zu beschränken, z.B. Wundversorgung, Erstmobilisation, Pneumonieprophylaxe.
Ein professionelles Pflegeteam ist jedoch gefordert, den Patienten in allen Dimensionen wahrzunehmen. Dazu gehört eben auch die zielorientierte Ansprache tabubesetzter Lebensbereiche, wie es etwa die Sexualität ist. Insbesondere Erektionsstörungen, die nach Prostata- und Rektumoperationen auftreten, sind unbedingt zu besprechen.
Hilfreich ist in jedem Fall der Hinweis auf Selbsthilfegruppen, in denen Patienten Ansprechpartner treffen, die aus dem eigenen Erleben sehr authentisch Kenntnisse und Fertigkeiten vermitteln, mit deren Hilfe eine schrittweise Gewöhnung an die veränderten Bedingungen des Körpers nach dem chirurgischen Eingriff gelingen kann:
-
Auseinandersetzung mit Körperbildveränderungen
-
Umstellung der bisherigen Ernährungsgewohnheiten
-
Handhabung von Zu- und Ableitungen
-
Auswirkungen auf das Privat- und Berufsleben
Themen eines psychosozialen Beratungsangebots können sein:
-
medizinische Rehabilitation: Anschlussheilbehandlung
-
sozialrechtliche Angelegenheiten: Rentenversicherung, Schwerbehindertengesetz
-
Hinweise zu Beratungsstellen und Selbsthilfegruppen
Alternative Therapien Viele Patienten suchen Rat zu Sinn und Nutzen von therapeutischen Ansätzen, die nicht zur Schulmedizin gehören. Man bezeichnet diese Behandlungsformen auch als alternative, unkonventionelle, komplementäre, umstrittene oder unbewiesene Methoden.
Die Diskussion um Wirkungen oder mögliche schädliche Einflüsse dieser alternativen Therapien auf den Organismus und den Tumor wird in Tagungen, Talkshows und anderen Veröffentlichungen heftig geführt. Vor allem Tumorpatienten verfolgen diese brisante und von vielfältigen Interessen geprägte Auseinandersetzung mit großem Interesse. Unseriöse Angebote und substanzlose Heilungsversprechen sind in diesem Markt häufig anzutreffen. Es ist nicht leicht zu entscheiden, wer lediglich ein selbsternannter Experte ist, der nur unnötige, ineffiziente und teure Mittel anpreist. Pflegende sollten eine persönliche Haltung zu allen bekannten Therapieverfahren erwerben, indem sie sich fortlaufend über aktuelle Entwicklungen informieren und sie mit wissenschaftlichen Erkenntnissen abgleichen. Dann sind sie in der Lage, Patienten sachgerecht zu informieren.
Pflegepraxis
Beratung. Es ist Aufgabe aller Beteiligten, die in den Betreuungsprozess eingebunden sind, dem Patienten verlässliche Informationsquellen zu nennen. Dazu gehören Fachgesellschaften und anerkannte Selbsthilfegruppen.