
20 Herz
20.1 Untersuchungsmethoden
20.1.1 Klinische Befunde
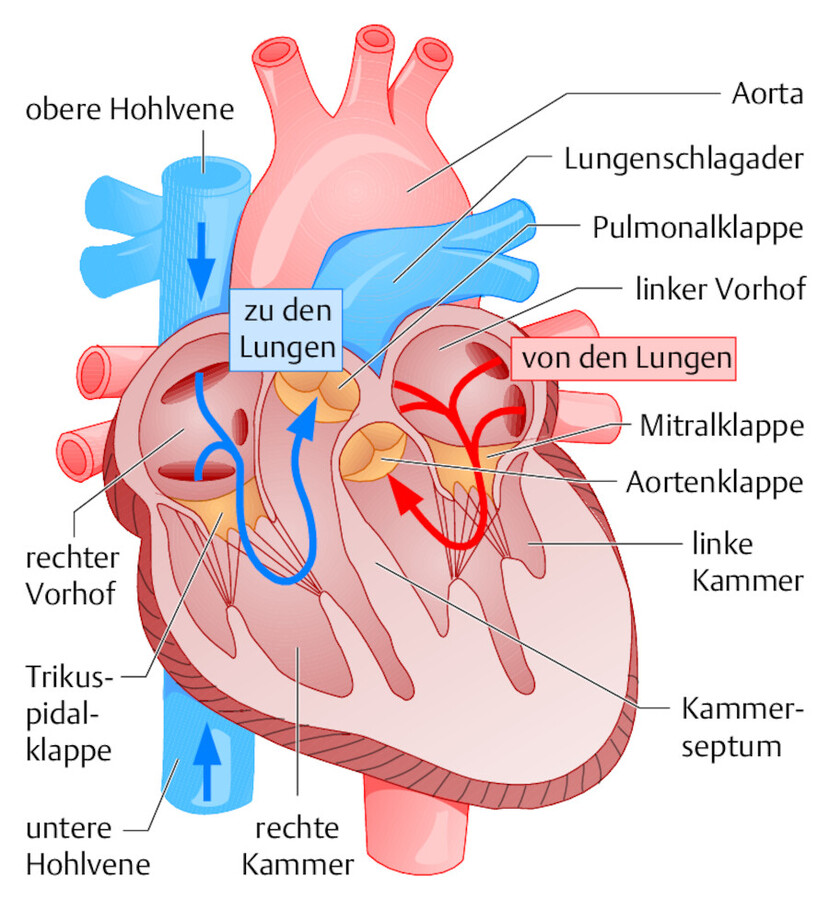
Puls und Blutdruck sind die wichtigsten Parameter zur Beurteilung des Kreislaufs. Veränderungen bei Belastung geben wichtige Hinweise auf Störungen der kardialen Funktion. Atemnot bei Belastung (z. B. beim Treppensteigen) und Knöchelödeme am Abend sprechen für eine Herzinsuffizienz. Die Zyanose ist ein wichtiges Symptom bei Herzfehlern mit Rechts-links-Shunt. Bei der Diagnose geben die Auskultation und Perkussion weiteren Aufschluss ( ▶ Abb. 20.1).
Abb. 20.1 Anatomie des Herzens. Das Wissen über die Anatomie und Physiologie des Herzens ist Voraussetzung, um pathologische Zusammenhänge verstehen zu können.
20.1.2 Spezielle Diagnostik
Das Elektrokardiogramm (EKG) spiegelt den Erregungsablauf im Herzen wider, wobei das Ruhe-EKG im Liegen vom Belastungs-EKG auf dem Fahrradergometer zu unterscheiden ist. Die Röntgenaufnahme des Thorax in 2 Ebenen (Thoraxübersichtsaufnahme) ermöglicht Aussagen über die Herzgröße und das Aussehen sowie Stauungszeichen im Lungenkreislauf.
Die Sonografie des Herzens ist von transthorakal (durch die Brustwand) und über die Speiseröhre (transösophageale Endosonografie= TEE) möglich. Die Schalluntersuchung erlaubt eine Beurteilung der Wanddicke, der Pump- und Klappenfunktion und die Feststellung eines eventuellen Perikardergusses.
Große Bedeutung hat die Herzkatheterisierung, die praktisch vor allen Operationen am Herzen erforderlich ist. Durch Kontrastmittelinjektion lassen sich die Herzkammern (Ventrikulografie) und auch die Herzkranzgefäße (Koronarangiografie) röntgenologisch abbilden. Über den Katheter kann der Blutdruck in allen Herzhöhlen und den großen Gefäßen gemessen werden. Auch Blutentnahmen zur Blutanalyse sind möglich. Der Herzkatheter erlaubt ferner die Bestimmung des Kreislaufvolumens und eines eventuellen Shunt-Volumens. Die Katheterisierung des Herzens erfolgt als Linksherzkatheter durch Punktion einer Arterie (A. femoralis oder A. brachialis), wobei der Katheter retrograd bis in den linken Ventrikel vorgeschoben wird. Während der Linksherzkatheter-Untersuchung kann eine Behandlung an den Herzkranzgefäßen mittels Ballondilatation oder Stentimplantation durchgeführt werden. Mit dem Rechtsherzkatheter gelangt man nach Punktion einer Vene der oberen Körperhälfte (bevorzugt Ellenbeuge) über die obere Hohlvene in den rechten Vorhof, den rechten Ventrikel und die A. pulmonalis.
Die Computertomografie des Herzens (Kardio-CT; CCT) ist eine röntgenologische, nichtinvasive Maßnahme und kann Verkalkungen der Herzkranzgefäße (KHK) diagnostizieren. Daneben kann auch die Durchgängigkeit von Bypässen nach einer aortokoronaren Bypassanlage (ACB) überprüft werden.
Die Magnetresonanztomografie (Kardio-MRT) liefert bewegte Bilder des Herzens, in denen angeborene Herzfehler und erworbene Erkrankungen wie eine Herzmuskelschwäche oder Herzklappenerkrankungen diagnostiziert und im Verlauf kontrolliert werden können. Das Verfahren ist ebenfalls nichtinvasiv, benötigt aber keine Röntgenstrahlen.
20.2 Angeborene Herzfehler
Durch die komplizierte entwicklungsgeschichtliche Entstehung des Herzens und der großen Gefäße gibt es eine Vielzahl angeborener Fehlbildungen, von denen hier nur die häufigsten betrachtet werden können.
Zusatzinfo
Etwa jedes 100. neugeborene Kind hat einen Herzfehler.
Zu beachten ist, dass auch die angeborenen (also bei Geburt vorhandenen) Herzfehler letztlich erworben sind, und zwar in der Frühschwangerschaft. Ursache können Virusinfekte (z. B. Röteln), exogene Noxen (z. B. Alkohol) und Strahleneinwirkung sein. Die angeborenen Herzfehler sind also (bis auf wenige Ausnahmen) nicht genetisch determiniert (vererbt), sondern in den ersten Embryonalwochen erworben. Zu den wichtigsten angeborenen Herzfehlern zählen Shunts und Stenosen ( ▶ Tab. 20.1 ).
|
Relative Häufigkeit (ca. %) |
Herzfehler |
Links-rechts-Shunt |
Rechts-links-Shunt |
Zyanose |
|
30 |
Kammerseptumdefekt (VSD) |
+ |
– |
– |
|
7 |
Vorhofseptumdefekt (ASD) |
+ |
– |
– |
|
7 |
Aortenisthmusstenose |
– |
– |
– |
|
7 |
Pulmonalstenose |
– |
– |
– |
|
6 |
persistierender Ductus Botalli |
+ |
– |
– |
|
6 |
Fallot-Tetralogie |
– |
+ |
+ |
|
5 |
Transposition der großen Gefäße (TGA) |
– |
+ |
+ |
|
4 |
Aortenklappenstenose |
– |
– |
– |
20.2.1 Pathophysiologie Shunt
Linkes und rechtes Herz sind normalerweise durch eine Scheidewand (Septum) voneinander getrennt. Ein direkter Blutübertritt von einer Herzhälfte in die andere findet also nicht statt. Linkes und rechtes Herz pumpen mengenmäßig das gleiche Blutvolumen, das den großen und kleinen Kreislauf nacheinander passiert. Der Druckwiderstand im großen Kreislauf ist allerdings wesentlich höher als im Lungenkreislauf. Die linke Herzkammer (Ventrikel) muss einen ca. 6-fach höheren Druck aufbauen als die rechte Herzkammer, um das gleiche Volumen in die Organe des Körperkreislaufs auswerfen zu können. Der gleiche Druckgradient findet sich zwischen Aorta und Lungenarterie.
Besteht eine pathologische direkte Verbindung zwischen großem und kleinem Kreislauf, wird ein Teil des Blutes, der Druckdifferenz entsprechend, von links nach rechts strömen. Eine solche Kurzschlussverbindung bezeichnet man als Shunt (engl.), in diesem Fall als Links-rechts-Shunt.
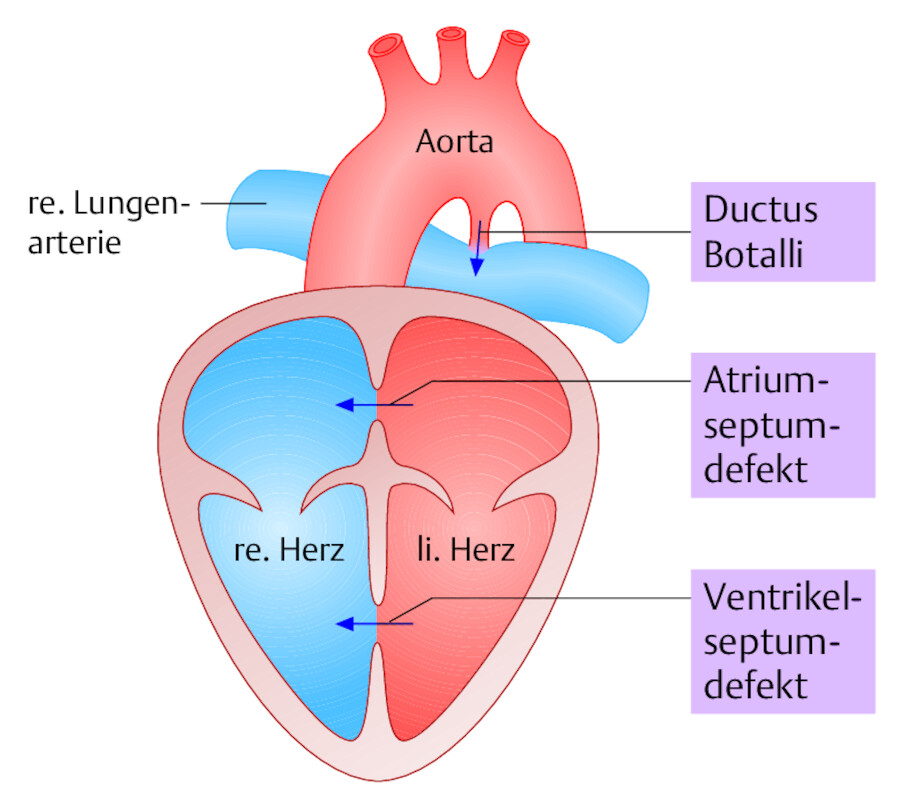
Die daraus entstehende Mehrbelastung der Herzkammern äußert sich in Wandverdickung (Hypertrophie) und Größenzunahme (Dilatation), was in Röntgenbild, EKG und TEE zu erkennen ist. Die Lunge ist beim Links-rechts-Shunt vermehrt durchblutet, das Volumen im kleinen Kreislauf also höher als im großen Kreislauf. Eine Zyanose findet sich beim Links-rechts-Shunt nicht, weil das Shuntblut in der Lunge mit Sauerstoff versorgt ist (oxygeniert). Die bedeutendsten Links-rechts-Shunts zeigt ▶ Abb. 20.2.
Von rechts nach links wird ein Shunt nur durchströmt, wenn der Druck im rechten Herzen (ausnahmsweise) höher ist als im linken. Ein solcher Rechts-links-Shunt findet sich praktisch nur, wenn gleichzeitig zur Kurzschlussverbindung eine Abflussbehinderung im Bereich der Lungenstrombahn besteht (z. B. Stenose der Pulmonalarterie). Diese Kombination ist beispielsweise bei der Fallot-Fehlbildung gegeben. Beim Rechts-links-Shunt ist das Kurzschlussblut sauerstoffarm, weil es die Lunge nicht passiert hat. Der große Kreislauf wird also auch von nichtoxygenisiertem Blut durchströmt, was sich klinisch als Zyanose und Hypoxie äußert. Der häufigste Rechts-links-Shunt tritt im Rahmen der Fallot-Fehlbildung auf (Kap. ▶ 20.2.5).
Abb. 20.2 Links-rechts-Shunts. Die angeborenen Kurzschlussverbindungen zwischen großem und kleinem Kreislauf treten bevorzugt in Höhe der Vorhöfe (ASD = Atriumseptumdefekt, der Herzkammern (VSD = Ventrikelseptumdefekt) und in Form des persistierenden Ductus Botalli auf.
Die angeborenen Stenosen finden sich bevorzugt im Gebiet des absteigenden Aortenbogens (Isthmusstenose) und an der Pulmonalisklappe. Stenosierungen der 3 anderen Herzklappen sind hingegen meistens im nachgeburtlichen Leben erworben. Angeborene Klappeninsuffizienzen haben keine nennenswerte klinische Bedeutung.
Zusatzinfo
Die seitenverkehrte Anordnung der intrathorakalen Organe (Situs inversus) ist ohne Krankheitswert, auch wenn sie die Bauchorgane umfasst (Situs inversus totalis). Häufiger ist er auf das Herz beschränkt, das dann rechtsseitig liegt (Dextrokardie).
20.2.2 Vorhofseptumdefekt (ASD)
Definition
Als Vorhofseptumdefekt (Atriumseptumdefekt = ASD) bezeichnet man die angeborene offene Verbindung zwischen linkem und rechtem Vorhof (Atrium) mit Links-rechts-Shunt. Eine Sonderform des ASD ist das offene Foramen ovale. 30 % aller Erwachsenen haben ein PFO (persistierendes Foramen ovale).
Symptome Es besteht keine Zyanose. Abhängig von der Shuntgröße (großer oder kleiner Defekt) sind die klinischen Beschwerden mehr oder weniger stark ausgeprägt: Luftnot, Herzklopfen, vermehrte Belastung des rechten Vorhofs (Dilatation), verstärkte Lungendurchblutung (um das Shunt-Volumen erhöht), paradoxe Embolie.
Therapie Klinisches Bild und Größe des Defekts bestimmen, ob eine Therapie erforderlich ist.
Katheter-Technik Von der Leistenvene wird das Herz unter Röntgendurchleuchtung mit einem Katheter erreicht. Am Katheterende befindet sich ein spezielles Verschlusssystem, das 2 Scheibchen freisetzt und damit das Loch im Vorhofseptum verschließt. Es handelt sich um ein minimalinvasives Verfahren, das auf die Eröffnung des Brustkorbs und die Verwendung einer Herz-Lungen-Maschine verzichtet.
Offene OP Die operative Korrektur mit chirurgischem Verschluss des Vorhofseptumdefekts durch direkte Naht oder mittels eines Patch (engl.: Flicken) ist das traditionelle Verfahren. Es erfordert die Sternotomie und den Einsatz einer Herz-Lungen-Maschine.
20.2.3 Kammerseptumdefekt (VSD)
Definition
Als Kammerseptumdefekt (Ventrikelseptumdefekt = VSD) bezeichnet man die angeborene offene Verbindung zwischen linker und rechter Herzkammer mit Links-rechts-Shunt.
Symptome Es besteht keine Zyanose. Die Symptomatik ist abhängig von der Größe des Defekts. Leistungsminderung, vermehrte Belastung beider Ventrikel mit Größenzunahme und Herzinsuffizienz sind die wichtigsten Symptome. Durch die vermehrte Lungendurchblutung kann nach Jahren eine massive Druckerhöhung im kleinen Kreislauf (Pulmonalarteriensklerose) entstehen. In manchen Fällen übersteigt der Druck im rechten Ventrikel dann den Druck in der linken Kammer, was eine Shuntumkehr (Rechts-links-Shunt) zur Folge hat. Der VSD ist gelegentlich mit anderen Herzfehlern kombiniert, so z. B. bei der Fallot-Missbildung.
Therapie Führt die stark erhöhte Lungendurchblutung bereits im Säuglingsalter zu schweren Komplikationen (Lungenödem), so kann als Palliativmaßnahme die Lungenarterie künstlich eingeengt werden. Dies geschieht durch Drosselung mit einem um das Gefäß gelegten Bändchen, weshalb man dieses Verfahren auch als „Banding“ (engl.) bezeichnet. Besser ist jedoch die operative Totalkorrektur, die man möglichst vor dem Schulalter durchführen sollte, weil selbst bei einem kleinen VSD immer das Risiko besteht, dass sich eine Endokarditis (Herzinnenwandentzündung) entwickelt. Der Defekt wird mit einem Kunststofflappen (Patch) verschlossen. Für die Operation ist eine Herz-Lungen-Maschine (HLM, s. Kap. ▶ 20.5.1) erforderlich. Die Operationsletalität beträgt ca. 1 %.
20.2.4 Persistierender Ductus arteriosus Botalli
Definition
Ein persistierender Ductus arteriosus Botalli ist das angeborene Offenbleiben der embryonalen Verbindung zwischen Aorta und Pulmonalarterie (Ductus arteriosus Botalli) mit Links-rechts-Shunt. Die Fehlbildung ist nach dem italienischen Anatom Botallo (um 1530) benannt.
Physiologie Beim Fetus fließt das Blut aus dem rechten Ventrikel nur zu einem geringen Teil durch das Lungenparenchym, weil die fruchtwasserhaltige, kollabierte Lunge für den Gasaustausch nicht benötigt wird und der Strömungswiderstand in den Lungengefäßen entsprechend hoch ist. Der größte Teil des fetalen Blutes aus der rechten Herzkammer gelangt auf einer direkten Kurzschlussverbindung, dem Ductus arteriosus Botalli, von der A. pulmonalis in die Aorta (Rechts-links-Shunt).
Mit der Geburt entfaltet sich die Lunge beim ersten Atemzug. Dadurch nehmen Strömungswiderstand und Druck im Pulmonalarterienkreislauf ab. Folge ist eine Strömungsumkehr im Ductus arteriosus (Links-rechts-Shunt). Normalerweise verschließt sich der knapp 1 cm lange Duktus innerhalb weniger Tage. Der bindegewebige Rest beim Erwachsenen wird als Lig. arteriosum (Botalli) bezeichnet. Bleibt der Duktus hingegen offen, so resultiert ein persistierender hämodynamisch wirksamer Links-rechts-Shunt ( ▶ Abb. 20.2).
Symptome Es besteht keine Zyanose. Die Symptomatik ist abhängig vom Durchmesser des offen gebliebenen Duktus. Typisch sind eine erhöhte Blutdruckamplitude und ein auskultatorisch hörbares „Maschinengeräusch“. Das linke Herz zeigt sich als Folge der Volumenbelastung dilatiert, die Lungendurchblutung ist um das Shunt-Volumen vermehrt. Auch bei dieser Fehlbildung ist nach Jahren eine Shuntumkehr (Rechts-links-Shunt) möglich, wenn der Druck im Lungenkreislauf durch Pulmonalgefäßsklerose höher wird als in der Aorta. Nach Shuntumkehr gelangt sauerstoffarmes Blut in den großen Kreislauf (Zyanose).
Therapie Der offene Ductus Botalli findet sich häufig bei Frühgeborenen. Bei diesen unreifen Säuglingen kann der Verschluss oftmals medikamentös mit Indometacin (Amuno) herbeigeführt werden. Gelingt dieses Vorgehen nicht, wird der Shunt bei anhaltender respiratorischer Insuffizienz per Katheter oder durch eine offene OP verschlossen.
Katheter-Technik Nach Punktion der Leistenarterie wird der offene Ductus Botalli mit einem Transportkatheter unter Röntgendurchleuchtung erreicht und durch Einbringen kleiner Spiralen (Coils) oder Fixieren eines Scheibchens (Occluder) verschlossen.
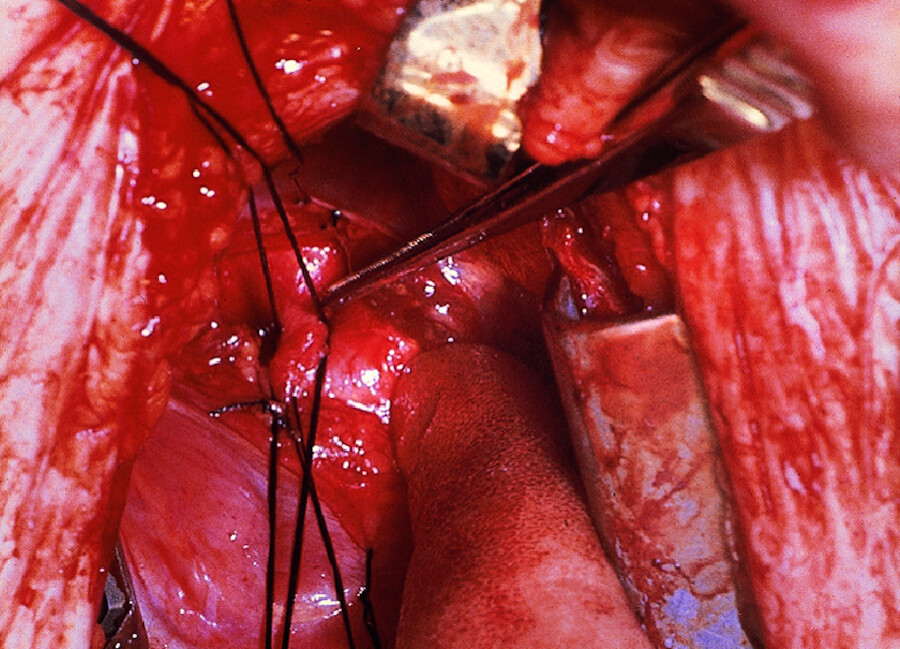
Offene OP Das krankhafte Verbindungsgefäß wird mit einem Faden zugeknotet (Duktusligatur, ▶ Abb. 20.3), was bei Kindern ohne Herz-Lungen-Maschine (HLM) möglich ist. Beim Erwachsenen ist der persistierende Ductus Botalli oft stark verkalkt, sodass die Korrektur mit der HLM vorgenommen werden muss.
Zusatzinfo
Kleinere Links-rechts-Shunts des Herzens werden minimalinvasiv durch interventionelle Katheterverfahren verschlossen. Das endovaskuläre Vorgehen kann in geeigneten Fällen beim persistierenden Foramen ovale, beim Vorhofseptumdefekt und beim persistierenden Ductus Botalli die offene Operation (Thorakotomie) ersetzen.
Abb. 20.3 Ductus Botalli. Die Verbindung zwischen Aorta und Lungenarterie wird mit Faden unterbunden (Duktusligatur).
20.2.5 Fallot-Tetralogie
Definition
Die Fallot-Tetralogie ist eine angeborene komplexe Fehlbildung des Herzens mit Rechts-links-Shunt und Zyanose ( ▶ Abb. 20.4). Das Vitium ist nach seinem Erstbeschreiber, dem italienischen Anatom Fallot (1850–1911), benannt.
Abb. 20.4 Fallot-Tetralogie. Schematische Darstellung der 4 Fehlbildungen.
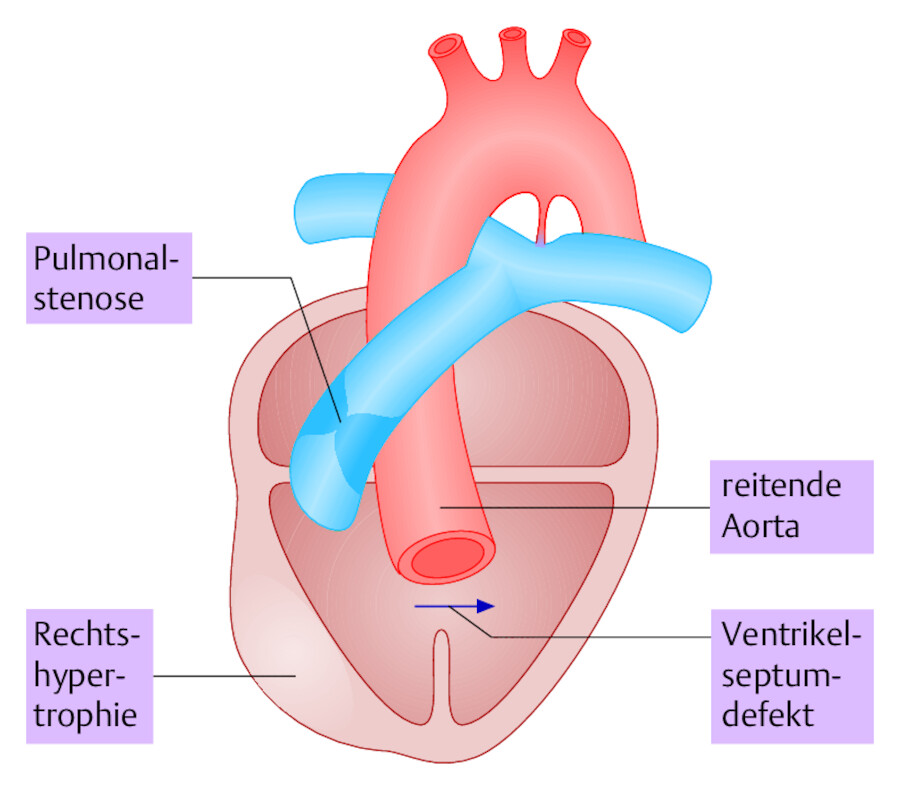
Pathophysiologie Die Bezeichnung Tetralogie (auch Tetrade) besagt, dass der Morbus Fallot durch 4 wesentliche Fehlbildungen charakterisiert ist (Fallot IV):
-
Kammerseptumdefekt (VSD)
-
Pulmonalstenose (im Bereich der Pulmonalisklappe oder unmittelbar darüber oder darunter)
-
reitende Aorta (diese erscheint in Frontalansicht wie ein „Reiter“ auf die Kammerscheidewand aufgesetzt)
-
Hypertrophie des rechten Ventrikels (Wandverdickung)
Der Rechts-links-Shunt kommt zustande, weil der Strömungswiderstand in der stenosierten Ausflussbahn des rechten Ventrikels (Pulmonalis) höher ist als im großen Kreislauf (Aorta). Die Rechtshypertrophie ist Folge der vermehrten Belastung des rechten Ventrikels. In die Aorta gelangt sauerstoffarmes Blut aus der rechten Kammer, weshalb diese Fehlbildung mit einer Zyanose einhergeht.
Zusatzinfo
Seltener ist die Fallot-Trilogie (Fallot III), bei der sich ein Vorhofseptumdefekt mit Pulmonalstenose und Rechtshypertrophie findet. Die Aorta entspringt normal. Es gibt auch eine Fallot-Pentalogie (V), die durch die Tetrade des Fallot IV mit zusätzlichem Vorhofseptumdefekt gekennzeichnet ist.
Symptome Die Zyanose besteht bereits bei der Geburt („blue baby“). Die charakteristischen Trommelschlägelfinger und Uhrglasnägel werden als Folge der Hypoxie im großen Kreislauf gedeutet ( ▶ Abb. 20.5). Meist findet sich eine erhebliche Leistungsminderung mit Minderwuchs. Die Kinder verharren häufig in Hockstellung, weil dadurch die Lungendurchblutung verbessert wird. Unbehandelt beträgt die Lebenserwartung durchschnittlich 20 Jahre, wobei die Betroffenen an Rechtsherzinsuffizienz oder Begleiterkrankungen sterben.
Abb. 20.5 Fallot-Fehlbildung. Neben der Zyanose sind die Trommelschlägelfinger charakteristisch.

Therapie Die Totalkorrektur durch Operation mit der Herz-Lungen-Maschine wird möglichst frühzeitig innerhalb der ersten beiden Lebensjahre angestrebt. Der Eingriff umfasst die operative Erweiterung der Pulmonalisstrombahn (Resektion der stenosierenden Gewebeanteile), den Verschluss des VSD (direkt oder mittels Flicken) und die Erweiterung des Ausflusstrakts der rechten Herzkammer. Die Operationsletalität bei Eingriffen innerhalb der ersten 2 Lebensjahre liegt bei 5 %.
Wenn die Lungenstrombahn noch nicht adäquat entwickelt ist, wird beim Kleinkind als Palliativmaßnahme eine Anastomose zwischen herznahen Arterien (Aorta oder Subklavia) und Pulmonalarterie angelegt, wodurch die Lungendurchblutung akut verbessert wird. Gleichzeitig wird durch diese Maßnahme längerfristig auch das pulmonale Gefäßsystem zum Wachstum angeregt und damit die Voraussetzung zur Korrekturoperation geschaffen. Nach einer Palliativoperation bleiben die Kinder in kardiologischer Kontrolle, um zu gewährleisten, dass die endgültige Korrektur noch im Vorschulalter erfolgen kann.
20.2.6 Transposition der Aorta
Definition
Als Transposition der Aorta bezeichnet man eine angeborene Fehlbildung der großen Herzgefäße mit Rechts-links-Shunt. Der Abgang von Aorta und Pulmonalarterie ist hierbei vertauscht.
Therapie Nur bei gleichzeitigem Bestehen einer zusätzlichen Shuntverbindung zwischen linkem und rechtem Herzen können die Kinder vorübergehend überleben. Zwei Operationsverfahren stehen zur Verfügung, die sog. Switch-Operation und die Vorhofumkehr. Beide Eingriffe erfordern die Herz-Lungen-Maschine und haben eine Letalität von ca. 6 %.
20.2.7 Aortenisthmusstenose
Definition
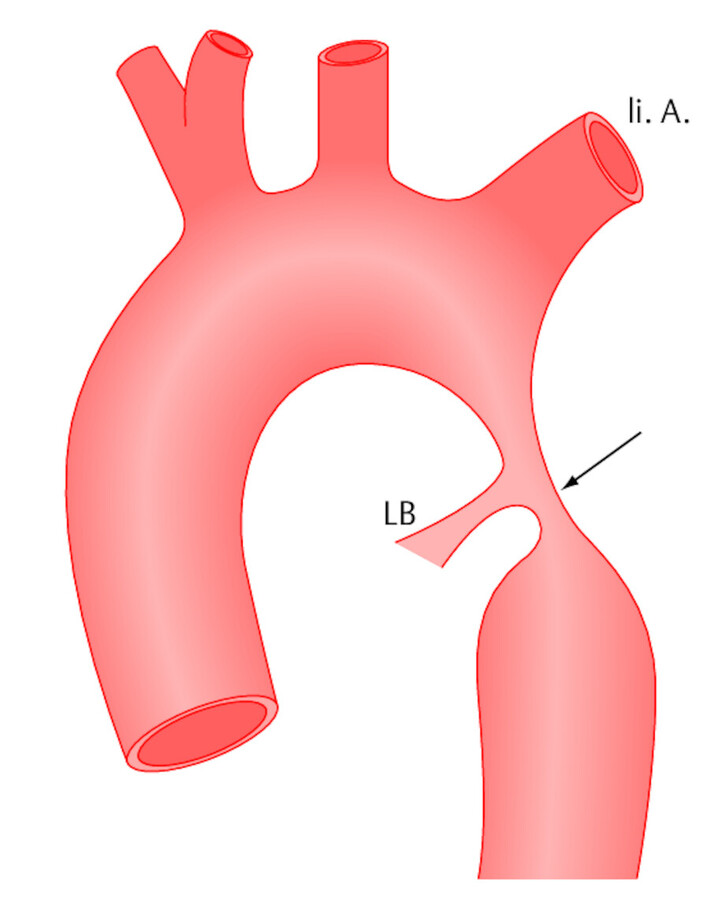
Die Aortenisthmusstenose (ISTA) ist eine angeborene Verengung des Aortenbogens (Isthmus, griech.: schmale Verbindung). Die Stenose ist in Höhe der Einmündung des Ductus Botalli lokalisiert ( ▶ Abb. 20.6), kurz darüber (präduktale Form) oder kurz darunter (postduktale Form). Synonym: Coarctatio der Aorta.
Symptome Im Frühkindesalter bestehen meist keine Beschwerden. Typisch ist die Blutdruckdifferenz zwischen oberer und unterer Extremität, wobei am Arm systolische Werte um 200 mmHg gemessen werden, an den Beinen hingegen kaum ein Puls tastbar ist. Die Minderdurchblutung der unteren Körperhälfte kann sich als muskuläre Schwäche der Beine äußern. Meistens führt jedoch die Hypertonie (bei Messung am Arm) in Kombination mit dem systolischen Herzgeräusch zur Diagnose. Das linke Herz ist als Folge der vermehrten Druckbelastung hypertrophiert. Mit der Isthmusstenose sind häufig Anomalien der Aortenklappe verbunden. Ein Shunt-Volumen gibt es nicht, auch keine Zyanose.
Therapie Die Behandlung erfolgt bevorzugt endovaskulär mit einem Katheter. Durch Ballonaufdehnung (PTA) mit oder ohne Implantation eines Stents wird die Enge der Aorta aufgedehnt, insbesondere bei Kindern. Nur selten ist die offene chirurgische Korrektur erforderlich (Thorakotomie).
Abb. 20.6 Aortenisthmusstenose. Angeborene Verengung (Pfeil) der Hauptschlagader in Höhe des Ligamentum Botalli (LB) unterhalb des Abgangs der linken Armarterie (li. A.).
20.2.8 Pulmonalstenose
Definition
Als Pulmonalstenose bezeichnet man die angeborene Verengung der Ausflussbahn des rechten Ventrikels. Die Stenose kann im Bereich der Pulmonalisklappe (valvuläre Stenose) lokalisiert sein, betrifft jedoch häufig den herznahen Abschnitt der Pulmonalarterie (supravalvuläre = infundibuläre Pulmonalstenose).
Symptome Nur bei hochgradiger Stenosierung treten Beschwerden (Leistungsminderung, Dyspnoe) schon im Kindesalter auf. Rechter Ventrikel und rechter Vorhof sind vermehrt belastet, was nach Jahren zur Rechtsherzinsuffizienz führen kann. Die Fehlbildung tritt oft in Kombination mit anderen Vitien auf, so z. B. bei der Fallot-Tetralogie ( ▶ Abb. 20.4).
Therapie Nur bei erheblicher Stenose ist eine Behandlung indiziert. In geeigneten Fällen kann die Klappe über einen Katheter mit einem Ballon ohne Operation erweitert werden (Ballonvalvuloplastie). Ansonsten erfolgt die operative „Sprengung“ der stenosierten Klappe (Komissurotomie oder Valvulotomie) über eine Inzision im Stamm der Pulmonalarterie, die danach wieder vernäht wird. Der Eingriff kann in Hypothermie erfolgen, meistens jedoch unter zusätzlicher Verwendung einer Herz-Lungen-Maschine.
20.3 Erworbene Herzfehler
Die im Laufe des Lebens erworbenen Funktionsstörungen der Herzklappen sind im Gegensatz zu den angeborenen Herzfehlern (Herzvitien) vorwiegend durch die Spätfolgen des rheumatischen Fiebers oder eine bakterielle Endokarditis verursacht. Daneben gibt es noch degenerative Veränderungen (Verkalkungen) und einige seltenere Ursachen.
Merke
Jede Bakteriämie birgt die Gefahr, dass eine Endokarditis entsteht.
Ausgangspunkt („Herd“) der hämatogenen bakteriellen Aussaat stellen häufig chronische Infekte im Bereich des Rachens und Kiefers dar. Besonders Streptokokken neigen dazu, sich am Endokardüberzug der Herzklappen festzusetzen, wobei die „Bakterienrasen“ und Ulzerationen eine weitgehende Zerstörung des Klappenapparats bewirken. Die erworbenen Klappenfehler betreffen vorwiegend das linke Herz (Mitral- und Aortenklappe).
20.3.1 Pathophysiologie Herzklappenfehler
Die 4 ventilartigen Herzklappen sind normalerweise nur in eine Richtung für das Blut durchgängig.
Herzklappenstenose Bei einer Klappenstenose ist das Lumen verengt und der Durchstrom erschwert. Um dennoch genügend Blut durch die stenotische Klappe zu treiben, muss die vorgeschaltete Herzhöhle einen höheren Druck erzeugen. Diese unphysiologische Mehrarbeit führt zur kompensatorischen Muskelhypertrophie, später zur Dilatation und letztlich zur Überlastung, also einer Herzinsuffizienz.
Zum Beispiel muss bei einer Mitralklappenstenose der linke Vorhof gegen die verengte Klappe pumpen, er ist also vermehrt belastet und dilatiert. Vor der Stenose bildet sich ein „Blutstau“, der den gesamten Lungenkreislauf betreffen kann (Lungenstau, Lungenödem). Dadurch kann auch die Druckbelastung im rechten Ventrikel ansteigen, der das Blut in den gestauten kleinen Kreislauf treibt.
Herzklappeninsuffizienz Bei einer Klappeninsuffizienz schließt die Klappe nicht komplett. Es bleibt also ein Restlumen, durch das Blut in die falsche Richtung zurückfließt (Pendelblut). Dieses Pendelblut muss zusätzlich zum normalen Schlagvolumen gepumpt werden. Für die entsprechende Herzhöhle resultiert daraus eine vermehrte Volumenbelastung, die auch hier zur Hypertrophie (Dilatation) und letztlich zur Insuffizienz der Herzleistung führt.
Zum Beispiel fließt bei einer Mitralklappeninsuffizienz das Blut während der Systole nicht nur in die Aorta. Ein Teil strömt über die insuffiziente (nicht geschlossene) Mitralklappe zurück in den linken Vorhof. In der folgenden Diastole „pendelt“ es zurück in die linke Kammer. Folge ist eine Mehrarbeit für die linke Kammer und den linken Vorhof. Auch bei der Mitralinsuffizienz ist ein Rückstau in den kleinen Kreislauf mit Belastung des rechten Ventrikels möglich.
Zusatzinfo
Klappeninsuffizienzen sind im Allgemeinen erworben. Treten Stenose und Insuffizienz bei einer Klappe gleichzeitig in Erscheinung, so spricht man von einem kombinierten Klappenfehler.
20.3.2 Aortenklappenstenose
Definition
Als Aortenklappenstenose bezeichnet man eine Verengung der Aortenklappe. Die Aortenklappenstenose ist meistens eine Erkrankung des höheren Alters.
Die kalzifizierende Aortenklappenstenose ist die häufigste Herzklappenerkrankung in der westlichen Welt. Ihre Inzidenz steigt mit zunehmendem Lebensalter an. Die Klappentaschen verkleben oder verkalken alterungsbedingt. Es gibt auch angeborene Fehlbildungen der Aortenklappe, wobei die Stenose im Klappenbereich (valvulär), darunter (subvalvulär) oder darüber (supravalvulär) lokalisiert sein kann.
Symptome Je nach Ausmaß der Stenose findet sich eine Leistungsminderung durch Minderperfusion des großen Kreislaufs, die auch die Herzkranzgefäße betreffen kann (Angina pectoris). Die linke Herzkammer ist vermehrt belastet (Linkshypertrophie).
Therapie Konservativ-medikamentöse Maßnahmen stehen im Vordergrund. In geeigneten Fällen kann die Klappe über einen Katheter mit einem Ballon ohne Operation erweitert werden (Ballonvalvuloplastie). Ansonsten kann die Aortenklappe prothetisch ersetzt werden. Entweder als offene Aortenklappenoperationen, mithilfe der Herz-Lungen-Maschine (Kap. ▶ 20.5.1) oder mit der TAVI-Prozedur (Transcatheter Aortic-Valve Implantation). Bei dieser kathetergestützten Aortenklappenreparatur wird das Implantat über einen Zugang von der Leiste (transfemoral) oder über ein kleines Loch von der Herzspitze (transapikal) eingebracht (Abb. 20.16). Ein extrakorporaler Kreislauf mittels HLM ist nicht erforderlich.
Zusatzinfo
TAVI. Die endovaskuläre TAVI-Prozedur wurde 2002 erstmalig am Menschen angewendet. Aktuell werden in Deutschland jährlich mehr TAVI-Prozeduren (ca. 13.000) als offene Aortenklappenoperationen (ca. 10.000) bei einer Aortenklappenstenose durchgeführt (www.aqua-institut.de). Deutschland ist weltweit führend in dieser Technik (Stand: 2016).
20.3.3 Aortenklappeninsuffizienz
Definition
Als Aortenklappeninsuffizienz bezeichnet man die Schlussunfähigkeit der Aortenklappe. Die Erkrankung ist durch eine bakterielle oder rheumatische Endokarditis erworben. Seltener sind Bindegewebserkrankungen wie das Marfan-Syndrom verantwortlich.
Symptome und Therapie In der Diastole fließt Blut aus der Aorta zurück in den linken Ventrikel (Pendelblut), was zu einer hohen Blutdruckamplitude und vermehrter Belastung der linken Kammer (Linkshypertrophie) mit ungenügender Herzleistung führt.
Schwere hämodynamisch wirksame Störungen verlangen den operativen Klappenersatz unter Verwendung einer Herz-Lungen-Maschine.
20.3.4 Mitralstenose
Definition
Als Mitralstenose bezeichnet man die Verengung der Mitralklappe. In 50 % der Fälle ist diese durch eine rheumatische Endokarditis erworben. Daneben kommen auch eine bakterielle Endokarditis und einige seltene Erkrankungen als Ursache vor.
Die Mitralstenose ist der weltweit am häufigsten erworbene Herzklappenfehler. Diese tritt meistens mehrere Jahre nach einem durchgemachten rheumatischen Fieber auf. Durch die frühzeitige Antibiotikatherapie von Streptokokkeninfekten in der westlichen Welt ist das rheumatische Fieber seltener geworden.
Symptome Während der Kammerdiastole muss der linke Vorhof das Blut gegen die Stenose anpumpen. Er ist folglich vermehrt druckbelastet, was eine Größenzunahme und häufig Rhythmusstörungen (Vorhofflimmern) bewirkt. Durch einen Blutrückstau in den kleinen Kreislauf (Lungenstau, Lungenödem, Dyspnoe) kann die Druckbelastung auch den rechten Ventrikel erfassen. Nicht selten findet man thrombotische Auflagerungen an der zerstörten Klappe, die bei Abstrom über den linken Ventrikel in die Aorta zu arteriellen Embolien führen (z. B. Femoralisembolie, Apoplex).
Therapie Die Behandlung ist primär immer medikamentös (Digitalis, Diuretika). Nur bei erheblichen Beschwerden erfolgt die operative Korrektur mit prothetischem Klappenersatz unter extrakorporalem Kreislauf (Kap. ▶ 20.5.1). Ist die Klappe (ausnahmsweise) kaum verkalkt, so kommt auch eine „Sprengung“ (Kommissurotomie) der stenosierten Klappe durch Ballondilatation oder Operation infrage.
20.3.5 Mitralinsuffizienz
Definition
Als Mitralinsuffizienz bezeichnet man die Schlussunfähigkeit der Mitralklappe. Ursache ist in den Industrieländern die Durchblutungsstörung des Herzmuskels (Herzinfarkt, KHK), seltener eine Anomalie der Herzklappe oder eine Endokarditis.
Die Insuffizienz tritt häufig gleichzeitig mit einer Stenose in Erscheinung (kombiniertes Mitralvitium).
Symptome Während der Systole fließt das Blut aus dem linken Ventrikel zurück in den linken Vorhof (Pendelblut). Daraus resultiert eine vermehrte Belastung der beiden linken Herzhöhlen (Linksinsuffizienz), bei Rückstau in den kleinen Kreislauf zusätzlich eine Rechtsbelastung mit Atemnot.
Therapie
Mitralclipping Bei diesem minimalinvasiven Verfahren wird ein spezieller Clip mit einem Katheter über die Leistenvene in das rechte Herz vorgebracht. Über eine Punktion der Herzscheidewand wird dieser dann in das linke Herz vorgeschoben. Der Clip an der Katheterspitze kann unter Ultraschall- und Röntgenkontrolle positioniert werden, um die Klappensegel miteinander zu fixieren und die Undichtigkeit der Mitralklappe zu reduzieren. Der Eingriff erfolgt typischerweise in einem Herzkatheterlabor (Kardiologie) in Narkose.
Offene OP mit Sternotomie Unter Verwendung einer Herz-Lungen-Maschine werden die insuffizienten Klappensegel durch Naht „gerafft“ (Klappenraffung) oder es wird die gesamte Klappe ersetzt ( ▶ Abb. 20.7).
Minimalinvasive offene OP Alternativ zur herkömmlichen Sternotomie ist zum Erreichen der Mitralklappe ein kleiner seitlicher Zugang unter der Mamma möglich. Über diesen Minischnitt kann die Mitralklappe sowohl rekonstruiert als auch ausgetauscht werden. Der Anschluss an die Herz-Lungen-Maschine erfolgt über eine femorale Kanülierung.
Abb. 20.7 Prothetischer Mitralklappenersatz. Die Fäden werden im Herz und an dem Kunststoffbezug der Prothese fixiert. Dann wird die künstliche Herzklappe mit Führungsinstrumenten in ihre Position gebracht und festgeknotet.

20.4 Sonstige Erkrankungen des Herzens
20.4.1 Koronare Herzkrankheit (KHK)
Definition
Als koronare Herzkrankheit bezeichnet man die erworbene, arteriosklerotisch bedingte Verengung der Herzkranzgefäße. Die dadurch bedingte Minderperfusion des Myokards ist Ursache des Herzinfarkts.
Die KHK ist die häufigste und wichtigste Erkrankung des Herzens. In Deutschland sind etwa 6 Mio. Bürger an KHK erkrankt. Mehr als 300.000 Menschen erleiden in Deutschland pro Jahr einen Herzinfarkt.
Symptome Der Herzschmerz („Brustenge“, Angina pectoris) mit Ausstrahlung in die linke Schulter und den linken Arm ist typisch. Die Beschwerden, die mit charakteristischen EKG-Veränderungen einhergehen, treten bevorzugt unter körperlicher Belastung auf. Es gibt jedoch auch „stille“ Herzinfarkte, denen jegliche Schmerzsymptomatik fehlt (bspw. bei Diabetikern).
Therapie
Konservative Maßnahmen Die Behandlung der Risikofaktoren (z. B. Rauchen, Bluthochdruck, erhöhte Blutfette) und eine medikamentöse Therapie haben vorrangige Bedeutung.
Koronarangioplastie (PTCA, PCI) Bei symptomatischen Stenosen der Herzkranzarterien stehen nichtoperative Behandlungsverfahren mit Kathetern im Vordergrund, die man als PTCA (Perkutane transluminale Koronarangioplastie) oder PCI (Perkutane koronare Intervention) bezeichnet. Dabei wird die verengte Koronararterie mit einem Ballonkatheter aufgedehnt und meistens ein Stent (Koronarstent = Gefäßstütze) eingesetzt ( ▶ Abb. 20.14). Über die A. femoralis oder A. radialis (Leiste oder Arm) wird der Herzkatheter in Lokalanästhesie eingeführt. Unter Verwendung von speziellen Führungskathetern und Führungsdrähten wird der Ballon- oder Stentkatheter dann über die Aorta in die jeweiligen Herzkranzgefäße vorgeschoben und positioniert.
Maßnahmen beim akuten Koronarsyndrom Beim akuten Koronarsyndrom (ACS) handelt es sich um eine akute Minderdurchblutung des Herzmuskels, infolge von atherosklerotischen Plaqueablagerungen in den Herzkranzgefäßen. Deshalb wird baldmöglichst eine medikamentöse Hemmung der Thrombozytenaggregation eingeleitet (z.B. durch ASS, Clopidogrel, Prasugrel, Ticagrelor). Der Notarzt kann bereits vor Ort diese Behandlung beginnen. Meistens werden dabei 2 Präparate kombiniert, was man duale Plättchenhemmung (oder duale Thrombozytenaggregationshemmung) nennt.
Bei einem akuten ST-Hebungsherzinfarkt (STEMI) wird dann in der Klinik möglichst schnell eine Herzkatheteruntersuchung durchgeführt. Die ursächliche Stenose oder der Verschluss der Koronararterie wird mit einem Ballonkatheter aufgedehnt (Akut-PTCA, Akut-PCI) und meist ein Stent eingesetzt. Immer ist nach einem koronaren Stent eine duale Plättchenhemmung für 6 Monate erforderlich.
Pflegepraxis
Injektionen. Bei dem Verdacht auf einen Herzinfarkt darf keine i.m.-Injektion erfolgen. Die intramuskuläre Injektion stellt wegen der Blutungsgefahr im punktierten Muskel eine Kontraindikation für eine Lysebehandlung dar!
Koronarchirurgische Eingriffe Bypassoperationen sind indiziert, wenn eine PTCA nicht möglich ist oder der Patient mit diesem Verfahren nicht ausreichend behandelt werden kann. Für einen Bypass benötigt man körpereigene Blutgefäße, um die geschädigten bzw. verschlossenen Herzkranzgefäße ersetzen zu können. Dazu kann die Brustwandarterie (sog. Mammaria-Bypass), die Arterie vom Unterarm (A. radialis, sog. Radialis-Bypass) oder die V. saphena magna oder parva vom Bein (sog. aortokoronarer Venenbypass = ACVB) verwendet werden.
Fallbeispiel
Koronarer Bypass. Herr Burger (56) leitet eine mittelständische Firma und leidet eigentlich immer unter Stress. Er muss dienstlich nach New York. Schnell hat er sich noch in der Raucherkabine des Flughafens 3 Zigaretten angesteckt. Dann hetzt er zu seinem Gate. Plötzlich durchfährt ihn ein heftiger Schmerz im Brustkorb und im linken Arm. Er stürzt. Sofort bildet sich eine Menschentraube um ihn herum. Ein Mitarbeiter des Flughafens erkennt das Problem und holt das nur 10 m entfernt aufgestellte AED-Gerät zur automatischen Reanimation. Herr Burger atmet nur oberflächlich, ist nicht mehr ansprechbar und ein Puls ist weder am Arm noch am Hals tastbar. Der Flughafenangestellte beginnt die Reanimation mit einigen Herzdruckmassagen und schließt dann das automatische Defi-Gerät an. Herr Burger hat Kammerflimmern. Nach der automatischen externen Defibrillation (AED) ist wieder ein schwacher Puls tastbar. Herr Burger wird vom inzwischen eingetroffenen Notarzt intubiert und mit Sinusrhythmus ins nächste Herzzentrum gebracht. Dort zeigt sich, dass das Herzenzym Troponin massiv erhöht ist. Herr Burger hat einen frischen Herzinfarkt. Die sofort durchgeführte Koronarangiografie zeigt ausgeprägte Verschlüsse der Herzkranzarterien, die durch eine PTCA nicht therapiebar sind. Notfallmäßig wird eine Bypassoperation, unter Verwendung der Brustwandarterie (A. Mammaria), mit Sternotomie vorgenommen. Der Genesungsverlauf ist komplikationslos, sodass Herr Burger nach 10 Tagen in eine Reha-Einrichtung verlegt werden kann. Dort ist das Ziel, seine kardiovaskulären Risikofaktoren (Rauchen, Bluthochdruck, Hyperlipidämie, Stress) zu reduzieren.
20.4.2 Herzrhythmusstörungen
Definition
Als Herzrhythmusstörung bezeichnet man jede Abweichung vom normofrequenten Sinusrhythmus. Die klinische Vielfalt der Rhythmusstörungen wird in Tachykardien (über 100 Schläge pro Minute) und Bradykardien (unter 60 Schläge pro Minute) unterteilt. Daneben werden auch Extrasystolen und atypische Erregungsbildungszentren (unterhalb des Sinusknotens) dazugezählt.
Symptome Die Symptomatik ist von der Art der Rhythmusstörung abhängig. Tachykarde Formen können zur ungenügenden Pumpleistung führen, weil sich die Kammern in der stark verkürzten Diastole nicht genügend füllen. Bei extremen Bradykardien ist die Organperfusion (Gehirn!) durch zu seltene Ventrikelkontraktionen ebenfalls vermindert. Kurzzeitige Bewusstseinsverluste (Synkopen) können die Folge sein, da das Gehirn schnell unter der Minderperfusion leidet.
Therapie
Medikamente Die meisten Herzrhythmusstörungen können medikamentös behandelt werden und sind dann ein Fall für die innere Medizin (Kardiologie).
Schrittmacher Bei schweren Bradykardien, mit regelmäßig auftretenden Synkopen, wird eine ausreichende Herzfrequenz durch Implantation eines Herzschrittmachers gewährleistet.
Elektrische Kardioversion Das Verfahren ähnelt der elektrischen Defibrillation (Kap. ▶ 12.1.1). Bei Vorhofflimmern, Vorhofflattern oder einer ventrikulären Tachykardie kann durch den kurzen Stromstoß oftmals ein normaler Sinusrhythmus herbeigeführt werden, wenn der Patient noch einen tastbaren Puls hat. Im Gegensatz zur Defibrillation wird der Stromstoß gezielt unter EKG-Überwachung abgegeben (d.h. EKG-getriggert). Außerdem wird weniger Energie verwendet (i.d.R. bis 200 Joule). Der Patient muss dabei kurzeitig sediert werden (z.B. mit Midazolam).
Merke
Eine Defibrillation erfolgt ausschließlich im Rahmen von Notfallsituationen bei pulslosen Patienten mit lebensbedrohlicher Herzrhythmusstörung (Kammerflimmern, Kammerflattern, pulslose ventrikuläre Tachykardie).
Katheterablation Bei schweren Herzrhythmusstörungen werden die ursächlichen pathologischen Leitungsbahnen im Herzen durch punktgenau abgegebene Hitze (Hochfrequenzablation) ober Kälte (Kryoablation) zerstört. Die Maßnahme erfolgt nach einer elektrophysiologischen Untersuchung. Abhängig von der Lokalisation im Herzen wird die Elektrode auf transvenösem oder transarteriellem Weg in das Herzinnere geführt. Eine Lokalanästhesie reicht meist aus.
20.4.3 Perikarditis
Definition
Eine Perikarditis ist eine erworbene Entzündung des Herzbeutels mit Perikarderguss.
Ursache Ursachen einer Perikarditis können rheumatische Erkrankungen und Kollagenosen, infiltrierende Tumoren (Bronchialkarzinom), Herzinfarkt, allergische Reaktionen sowie virale und bakterielle Infekte sein.
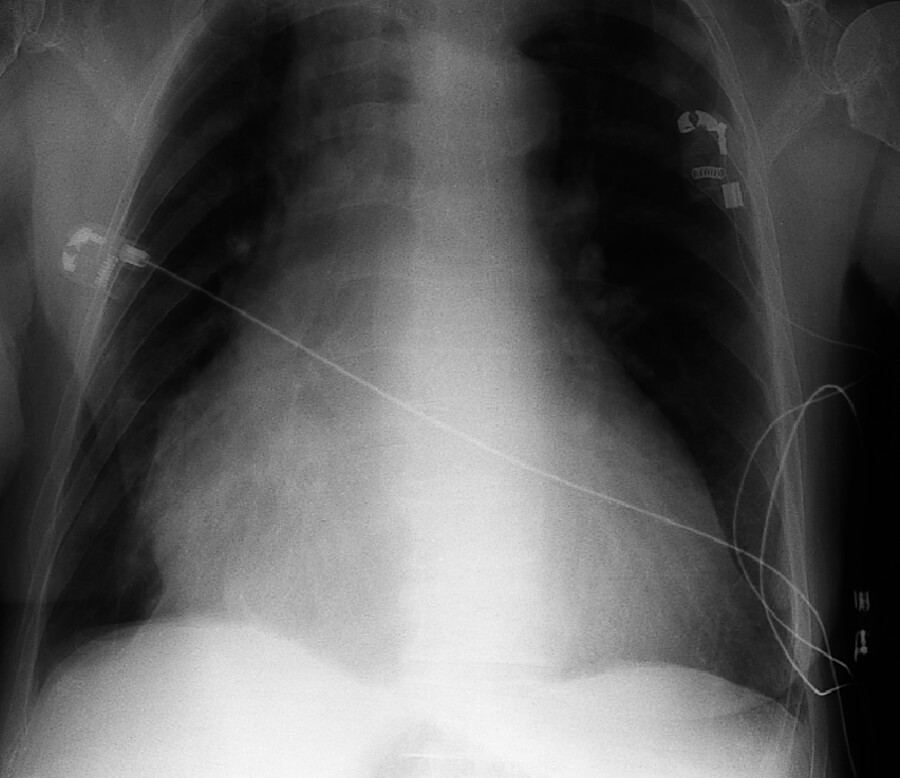
Symptome Die Reizung des Herzbeutels geht anfangs ohne Ergussbildung einher (Pericarditis sicca). In diesem Stadium finden sich Brustschmerzen, ein auskultatorisches Reibegeräusch über dem Herzen sowie uncharakteristische Entzündungsparameter. Mit Ausbildung des nachfolgenden Perikardergusses (Pericarditis exsudativa) verschwinden der Schmerz und das Reibegeräusch. Klinisch treten jetzt die Folgen der mechanischen Einengung des Herzens durch den Erguss in den Vordergrund in Form von Atemnot, Brustenge, Blutdruckabfall, Tachykardie. Röntgenologisch ist das Herz vergrößert (Bocksbeutelform, ▶ Abb. 20.8). Bei einer Echokardiografie lässt sich der Erguss am besten nachweisen.
Abb. 20.8 Perikarderguss. Zu erkennen ist ein vergrößertes Herz durch den Erguss.
Therapie Die konservativ-medikamentöse Behandlung richtet sich nach der Grunderkrankung und umfasst bei rheumatischer Genese beispielsweise die systemische Kortisongabe und bei bakterieller Ursache die Gabe von Antibiotika. Jeder größere Erguss, der zu einer mechanischen Herzeinengung führt, sollte unter Lokalanästhesie punktiert werden, um das Herz zu entlasten. Das Punktat wird anschließend bakteriologisch, zytologisch und chemisch untersucht.
20.4.4 Konstriktive Perikarditis
Definition
Die konstriktive Perikarditis ist eine erworbene, narbige Verschwielung der beiden Herzbeutelblätter (Epikard und Perikard), wodurch die mechanische Herztätigkeit wie durch einen äußeren „Panzer“ eingeschränkt wird. Man spricht auch von „Panzerherz“.
Ursache und Symptome Chronische Reizzustände (Perikarditis) mit Erguss, Thoraxtraumen oder Herzoperationen können Ursache eines Panzerherzens sein. Der Ventrikel kann sich während der Diastole nicht mehr ausreichend füllen, da aufgrund des Perikardergusses das Herz eingeengt ist. Dadurch verringern sich das Schlagvolumen (Herzinsuffizienz) und die Organperfusion. Der venöse Rückfluss zum Herzen ist gestaut, dadurch ist der zentralvenöse Druck erhöht.
Therapie Ist der Panzer hämodynamisch wirksam, kann nur die operative Behandlung Erfolg bringen. Sie besteht in der Resektion des Perikards, das von beiden Ventrikeln „abgeschält“ wird. Das Herz wird dabei nicht eröffnet, eine Herz-Lungen-Maschine ist nicht erforderlich.
20.4.5 Herzbeuteltamponade
Definition
Als Herzbeuteltamponade (Perikardtamponade) bezeichnet man einen größeren Herzbeutelerguss, der zu einer kreislaufwirksamen Behinderung der mechanischen Herztätigkeit durch Kompression des Herzens führt. Unbehandelt entwickelt sich ein lebensbedrohlicher kardiogener Schock.
Ursache Jede Perikarditis mit größerer Ergussbildung (Pericarditis exsudativa) kann eine Herzbeuteltamponade verursachen. Auch als Komplikation nach einem herzchirurgischen Eingriff (bspw. nach einem Aortenklappenersatz) kann eine Herzbeuteltamponade auftreten.
Von großer Bedeutung sind auch die Thoraxverletzungen (z.B. durch Stürze oder Unfälle). Durch Ruptur der Herzwand infolge eines stumpfen oder perforierenden Traumas kommt es zu Blutungen in den Herzbeutel. Gelegentlich beobachtet man auch Spontanrupturen im Bereich einer Myokardnarbe oder eines Herzwandaneurysmas nach Infarkt.
Symptome Je mehr Blut sich im Herzbeutel ansammelt, desto weniger Raum steht dem Herzen während der diastolischen Füllung zur Verfügung. Das Schlagvolumen wird folglich immer geringer. Bei offener Verbindung zwischen Ventrikel und Herzbeutel (Wandruptur) wird bei jeder Systole ein Großteil des Kammerbluts in den Herzbeutel gepumpt, womit sich die Tamponade drastisch verstärkt. Der hämorrhagische Erguss wird durch Sonografie (Echokardiografie) am schnellsten verifiziert.
Therapie Herzbeuteltamponaden mit progredienter Schocksymptomatik (Kap. ▶ 12.2.4) verlangen die sofortige Punktion und Entlastung des Herzbeutels, da sie einen lebensbedrohlichen Zustand darstellen. Bei starker Blutung ist die operative Revision (Sternotomie) mit Versorgung der Verletzung (Herzwandnaht) erforderlich.
20.5 Operative Verfahren am Herzen
Kardiochirurgische Maßnahmen werden unterschieden in Operationen am geschlossenen und am offenen Herzen.
Um eine geschlossene Operation handelt es sich, wenn das Herz seine Funktion während des Eingriffs kontinuierlich fortsetzt, also keine Unterbrechung des Kreislaufs erforderlich ist (z. B. Kommissurotomie zur Behebung der Mitralstenose). Von einer Operation am offenen Herzen spricht man, wenn das Organ seine Funktion während des intrakardialen Eingriffs einstellt, der Kreislauf also für eine gewisse Zeit unterbrochen ist (z. B. beim Klappenersatz).
20.5.1 Herz-Lungen-Maschine
In Normothermie (37 °C) kann das Herz für maximal 3 Minuten abgeklemmt werden, weil bei längerer Dauer mit irreversiblen, ischämisch bedingten Schäden des Gehirns zu rechnen ist. Diese kurze Zeit ist allenfalls für die notfallmäßige Embolektomie bei fulminanter Lungenarterienembolie ausreichend.
Um die zur Verfügung stehende Zeit am offenen Herzen zu verlängern, sind mehrere Methoden entwickelt worden, die bevorzugt in Kombination eingesetzt und häufig unter dem Begriff Herz-Lungen-Maschine zusammengefasst werden:
Hypothermie Eine Temperatursenkung des Gesamtorganismus verlangsamt den Stoffwechsel und reduziert den Sauerstoffverbrauch, womit die tolerable Ischämiezeit der Organe verlängert wird. Die meisten Herzoperationen werden bei einer Hypothermie von 32 bis 34 °C durchgeführt.
Zusatzinfo
32 °C dürfen ohne Herz-Lungen-Maschine nicht unterschritten werden, weil das erwachsene Herz bei dieser Temperatur zu schlagen aufhört („Flimmerschwelle“).
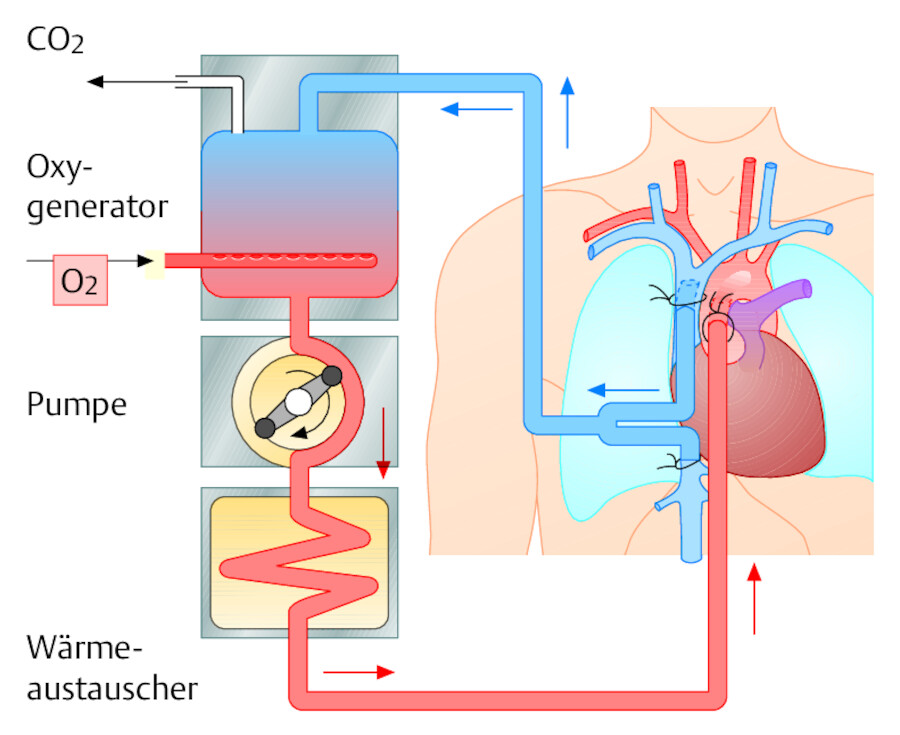
Extrakorporaler Kreislauf (EKK) Längere Operationszeiten am offenen, abgeklemmten Herzen sind nur möglich, wenn der Kreislauf durch eine außerhalb des Körpers befindliche, maschinelle Pumpe aufrechterhalten wird. Die Geräte werden als Herz-Lungen-Maschine (HLM) bezeichnet ( ▶ Abb. 20.9).
Das zum Herzen fließende venöse Blut wird in den maschinellen Bypass umgeleitet (kardiopulmonaler Bypass). Dazu bringt man nach Thoraxeröffnung eine dicke Kanüle mit zwei Öffnungen in die Hohlvene ein (Hohlvenenkanülierung).
Über einen Schlauch gelangt das Blut vom Patienten in die HLM, wo es zuerst die künstliche Lunge (Oxygenator) passiert. Dort wird das Blut mit Sauerstoff aufgesättigt und das Kohlendioxid entfernt. Nächste Station des extrakorporalen Kreislaufs ist das künstliche Herz, das als Rollerpumpe oder Zentrifugalpumpe konstruiert ist und den mechanischen Vortrieb des Blutes gewährleistet. Anschließend passiert das Blut den Wärmeaustauscher, der das Blut kühlen oder wärmen kann, bevor es zurück in den Patientenkreislauf strömt. Der Rückfluss in das Arteriensystem erfolgt über eine dicke Kanüle, die man in die Aorta ascendens einbindet.
Abb. 20.9 Extrakorporaler Kreislauf. Das venöse (zum Herzen strömende) Blut wird von den Hohlvenen in die HLM geleitet und von dort wieder in die Aorta ascendens zurückgeführt.
Kardioplegie Für die meisten Operationen am offenen Herzen darf das Herz nicht schlagen. Den beabsichtigten, reversiblen intraoperativen Herzstillstand bezeichnet man als Kardioplegie (Herzlähmung).
Das Herz lässt sich still stellen, indem man die Herzkranzarterien mit einer Lösung perfundiert, die das Herz zum Stillstand bringt (z. B. kardioplegische Lösung nach Bretschneider). Durch die Ruhigstellung des Herzens wird auch die Durchblutung der Herzkranzarterien unterbrochen.
Merke
Voraussetzung für mehrstündige Operationen am offenen Herzen:
-
Hypothermie des Gesamtorganismus
-
extrakorporaler Kreislauf (Herz-Lungen-Maschine)
-
Kardioplegie (Herzstillstand durch spezielle Spüllösung)
20.5.2 Zugänge und Drainagen
Zugänge Der übliche operative Zugang zum Herzen ist die mediane Sternotomie, bei der das Brustbein in Längsrichtung komplett oder in seinem oberen Anteil (partiell) gespalten wird. Der spätere Verschluss des Knochens erfolgt durch Drahtcerclagen, die im postoperativen Röntgenbild sichtbar sind und normalerweise lebenslang belassen werden.
Zusatzinfo
Minithorakotomie. Einige Eingriffe in der Herzchirurgie können über einen wenige Zentimeter langen Interkostalschnitt (Querschnitt zwischen den Rippen) unterhalb der Brust durchgeführt werden.
Drainagen Bei einer Sternotomie wegen einer Bypassoperation oder einem Klappenersatz wird das Operationsgebiet (Mediastinum) mit einer substernalen (unter dem Brustbein gelegen) Drainage versehen, die wie eine ▶ Bülau-Drainage an einem Sog angeschlossen ist und für 1–2 Tage verbleibt.
Pflegepraxis
Perikarddrainage. Zusätzlich befindet sich ein ebenfalls an Sog angeschlossener Drain im Herzbeutel (Perikarddrainage), der häufig „gemolken“ werden muss, um einer Herzbeuteltamponade vorzubeugen.
Bülau-Drainagen (Intrapleurale Thoraxdrainagen) werden nur eingelegt, wenn bei der Präparation eine der Pleurahöhlen eröffnet werden musste. Mit dieser Drainage kann der physiologische Unterdruck im Pleuraspalt wiederhergestellt werden.
Passagerer Schrittmacher Ferner ist es nach Herzoperationen mit HLM und Kardioplegie üblich, intraoperativ vor Verschluss des Brustkorbs einen passageren epikardialen Schrittmacher von außen in den Herzmuskel einzubringen. Die Schrittmacherdrähte werden dann perkutan ausgeleitet und können an einen externen Schrittmacher angeschlossen werden. Diese Maßnahme gestattet auf einfache Weise die elektronische Behebung von postoperativen Rhythmusstörungen, die nach Verwendung von EKK und Kardioplegie gelegentlich vorkommen. Die Schrittmacherdrähte werden nach ca. 2–4 Tagen gezogen.
20.5.3 Herzschrittmacher
Definition
Ein Herzschrittmacher (Pacemaker) ist ein industriell gefertigtes, batteriegetriebenes Gerät zur Stimulation der Herzfrequenz ( ▶ Abb. 20.10 u. ▶ Abb. 20.11).
Pflegepraxis
MRT. Patienten mit einem Herzschrittmacher dürfen nicht mit einem Kernspintomografen untersucht werden, da die elektromagnetischen Energien die Software der Geräte stören und sich die Sondenspitzen erhitzen können.
Die Implantation ist bei einer Bradykardie mit Synkopen indiziert. Die Schrittmacher sind derart konstruiert, dass sie nur in Funktion treten, wenn die Eigenfrequenz des Herzens abfällt. Man nennt sie deshalb Stand-by-Schrittmacher oder Demand-Schrittmacher. Die Implantation erfolgt in lokaler Infiltrationsanästhesie. Die korrekte Impulsübertragung wird intraoperativ mit entsprechenden Messgeräten überprüft.
Abb. 20.10 Transvenöser Herzschrittmacher. Von einem Schnitt unterhalb des Schlüsselbeins wird die Batterie (B) im Unterhautfettgewebe positioniert. Das Elektrodenkabel führt man über die V. cephalica unter Röntgendurchleuchtung bis zum rechten Herz. Dort wird die Elektrodenspitze durch Drehen am Kabel im Endokard fixiert.
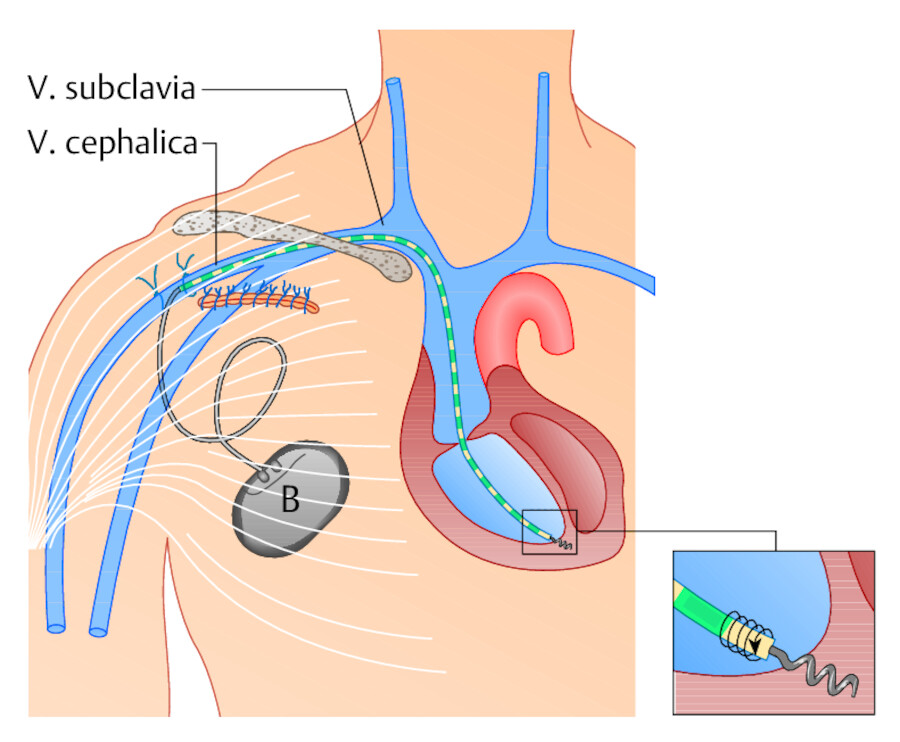
Abb. 20.11 Herzschrittmacher. Auf dem Röntgenbild sind deutlich die Batterie (B) und das Kabel (K) zu erkennen. Die Elektrodenspitze (ES) liegt im Herzen.
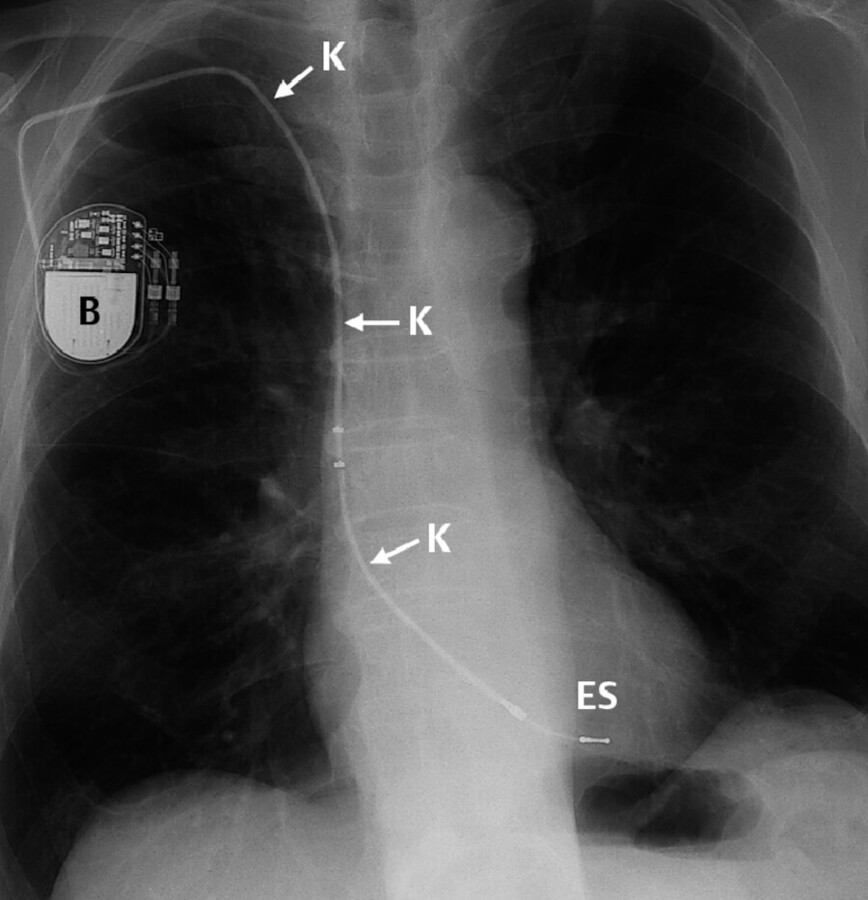
Die Batterie eines Herzschrittmachers hat eine Lebensdauer von ca. 10 Jahren. Bei einer Batterieerschöpfung wird das gesamte Schrittmacheraggregat in Lokalanästhesie ausgewechselt. Eine Neuimplantation des Elektrodenkabels ist nicht erforderlich.
Zusatzinfo
Notfall. Es besteht die Möglichkeit, mittels einer Venenpunktion im Notfall (nur auf Intensivstationen) eine Schrittmacherelektrode in das Herz einzuschwemmen. Das Aggregat bleibt außerhalb des Körpers. Der temporäre Schrittmacher wird später durch einen permanenten ersetzt oder herausgezogen, wenn die Indikation nicht mehr gegeben ist.
20.5.4 Herzklappenrekonstruktion
Definition
Als Herzklappenrekonstruktion bezeichnet man die Reparatur einer funktionsunfähigen körpereigenen Herzklappe.
Wegen der guten Langzeitergebnisse sollten defekte Herzklappen möglichst rekonstruiert und nicht ausgetauscht werden. Der operative Zugang erfolgt konventionell mit der HLM und über eine mediane Sternotomie oder in geeigneten Fällen minimalinvasiv über einen kleinen lateralen Schnitt zwischen den Rippen.
Herzklappenersatz Der Klappenersatz betrifft vorwiegend die Mitral- und Aortenklappe, wobei meistens erworbene kombinierte Vitien (Stenose und Insuffizienz) vorliegen. Beim konventionellen Verfahren werden die erkrankten Klappenanteile unter extrakorporalem Kreislauf nach Eröffnung des Herzens reseziert. Danach wird in gleicher Position eine neue Klappe mit nichtresorbierbaren Fäden eingenäht. Als Material werden mechanische Implantate oder Bioprothesen verwendet.
Mechanische Herzklappen Die künstlichen Implantate bestehen aus Metall und Kunststoff (alloplastischer Klappenersatz, ▶ Abb. 20.7 u. ▶ Abb. 20.13). Die Metallanteile sind im postoperativen Röntgenbild sichtbar. Der Ventilmechanismus ist bei einigen Modellen als pulssynchrones „Klicken“ vom Patienten und von seiner näheren Umgebung hörbar.
Zusatzinfo
Mechanische Herzklappen haben prinzipiell eine lebenslange Haltbarkeit. Daher werden diese bei jüngeren Patienten eingesetzt. Nachteil ist die hohe Neigung zur Bildung von Blutgerinnseln an der Klappe, was zu einer arteriellen Embolie führen kann (z.B. Apoplex). Die Patienten benötigen deshalb eine lebenslange orale Antikoagulation (Phenprocoumon, z.B. Marcumar). Diese darf nur abgesetzt werden, wenn überlappend eine kontinuierliche intravenöse Heparingabe in therapeutischer Dosis erfolgt. Langfristig besteht durch die starke Blutverdünnung ein hohes Risiko für Blutungen oder Embolien.
Bioprothesen Bei den Bioprothesen handelt es sich um Klappen vom Schweine- oder Rinderperikard (heterologer Klappenersatz). Sie arbeiten geräuschlos.
Zusatzinfo
Bioprothesen haben eine begrenzte Haltbarkeit von 10–20 Jahren und werden deshalb bei älteren Patienten eingesetzt (über 70 Jahre). Je jünger der Patient ist, desto kürzer ist die Haltbarkeit der biologischen Klappe. Von Vorteil von Bioprothesen ist die geringere Neigung zu Thrombenbildung in der Klappe, weshalb eine orale Antikoagulation nur für 3 Monate erfolgt. Danach sind 100 mg ASS pro Tag ausreichend.
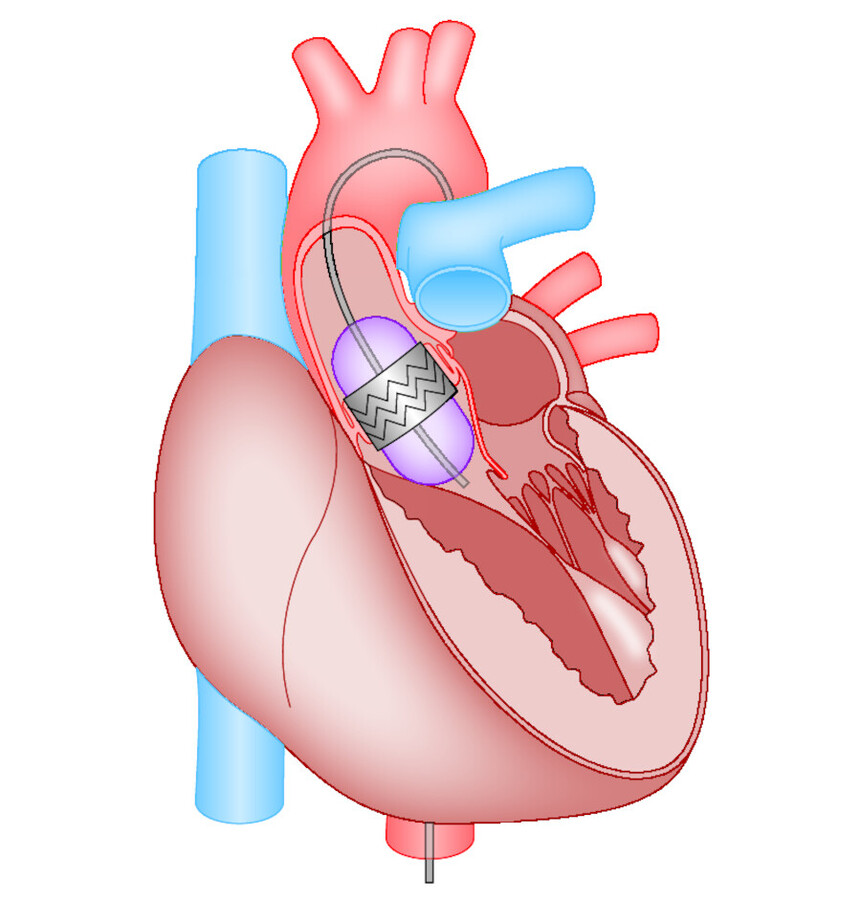
Endovaskulärer Herzklappenersatz Bei diesem minimalinvasiven Verfahren wird eine spezielle biologische Herzklappe ( ▶ Abb. 20.12) mit Kathetern in das Herz geschoben und in Position der Aortenklappe fixiert. Der Zugang erfolgt von der Leiste (transfemoral) oder über ein kleines Loch von der Herzspitze (transapikal). Damit ist ein Herzklappenersatz ohne herkömmlichen chirurgischen Eingriff (Sternotomie) möglich.
Abb. 20.12 Endovaskulärer Herzklappenersatz. Die Herzklappe ist in einen Katheter eingebaut, der von der Leistenarterie bis in die Aortenklappenposition vorgeschoben wird. Dort erfolgen Freisetzung und Fixierung der Klappe.
Zusatzinfo
TAVI. International wird die Prozedur als TAVI bezeichnet (Transcatheter Aortic-Valve Implantation). Die endovaskuläre Methode wird heute häufiger als die konventionelle Methode beim Aortenklappenersatz eingesetzt.
Die heute zur Verfügung stehenden Klappen haben Vor- und Nachteile. Der neue Forschungsbereich der Gewebezüchtung (Tissue Engineering) bietet vielversprechende Ansätze, in naher Zukunft eine „ideale“ Herzklappe herzustellen.
Pflegepraxis
Antikoagulation. Patienten mit künstlicher Herzklappe müssen postoperativ lebenslang Antikoagulanzien einnehmen (Marcumar). Nach der Implantierung von Bioprothesen ist keine Dauerantikoagulation erforderlich (lediglich passager für ca. 3 Monate).
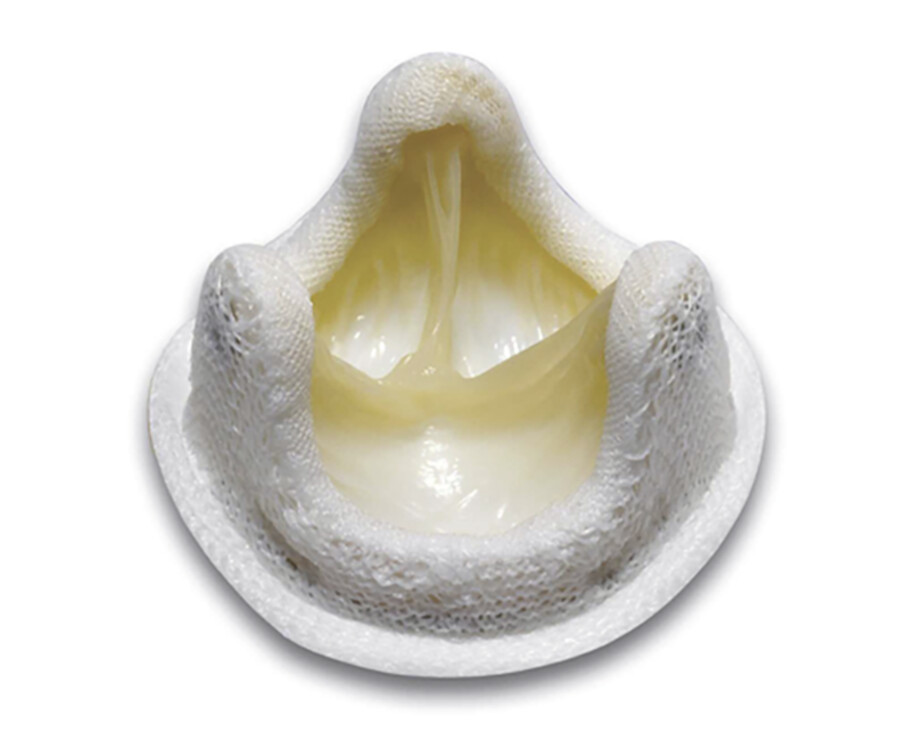
Abb. 20.13 Herzklappenersatz. Alle Modelle sind von einem textilen Kunststoffring umzogen, durch den die Nähte zur Verankerung der Klappe im Herzmuskel gestochen werden. Das Blut kann nur in einer Richtung passieren, ein Rückstrom wird durch selbsttätiges Schließen des Ventilmechanismus verhindert.
Abb. 20.13a Künstliche Herzklappe.
(Foto: Medtronic GmbH)

Abb. 20.13b Bioprothese.
(Foto: Medtronic GmbH)
20.5.5 Perkutane transluminale Koronarangioplastie (PTCA)
Definition
Unter PTCA (perkutane transluminale Koronardilation) versteht man die Ballondilatation einer verengten Herzkranzarterie. Synonym wird die Abkürzung PCI (perkutane coronare Intervention) verwendet.
Die PTCA ist das Behandlungsverfahren der Wahl bei symptomatischer koronarer Herzkrankheit (KHK). Meistens wird die Dilatation mit der Einlage einer Gefäßstütze (Stent) kombiniert.
Der Katheter wird in Lokalanästhesie von der A. femoralis (wie bei einer Angiografie) durch die Aorta unter Röntgendurchleuchtung bis in die verengte Herzkranzarterie vorgeschoben. Die Dilatation erfolgt mithilfe eines aufblasbaren Ballons, der am Ende des Katheters angebracht ist ( ▶ Abb. 20.14). Häufig wird zum Offenhalten der Koronararterie eine Gefäßstütze aus Metall (Stent) eingebracht.
Abb. 20.14 PTCA. Aufdehnung einer verengten Herzkranzarterie und Einbringen eines Stents.
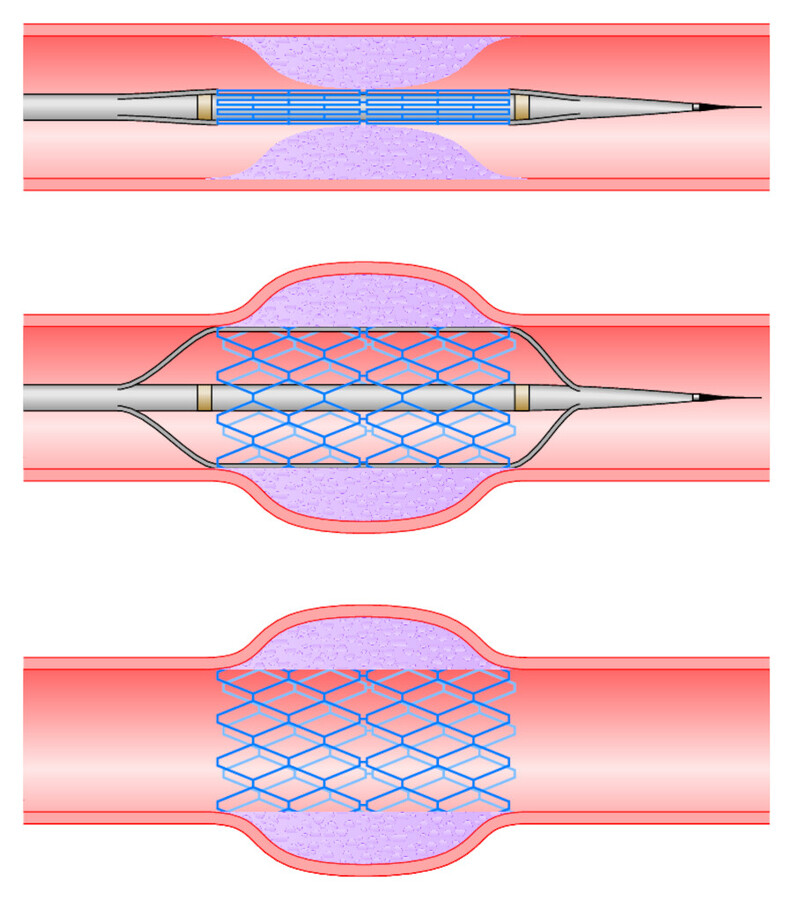
Drug Eluting Stent (DES) Die Verengung der Koronararterie innerhalb des eingelegten Stents durch Ablagerungen und Zellproliferation (In-Stent-Stenose) ist das Hauptproblem der PTCA. Die Drug Eluting Stents sind mit speziellen Medikamenten beschichtet, die über lange Zeit lokal in der Koronararterie freigesetzt werden und die Rezidivstenose verhindern sollen.
20.5.6 Koronarer Bypass
Definition
Als koronaren Bypass bezeichnet man die Überbrückung einer Stenose oder eines Verschlusses im Bereich der Koronararterien durch ein parallel geschaltetes neues Gefäß (Bypass).
Ziel des koronaren Bypasses sind die Therapie der koronaren Herzkrankheit (Angina pectoris) sowie die Prophylaxe des Myokardinfarkts. Eine Bypass-Operation kommt bei einer KHK infrage, wenn wegen der Lokalisation der Stenosen und der Verschlüsse in den Herzkranzarterien eine Katheterbehandlung (PTCA mit oder ohne Stent) nicht geeignet ist.
20.5.6.1 Bypassmaterial
Die Arteria mammaria interna, die Vena saphena und die Arteria radialis sind die am häufigsten verwendeten Bypassmaterialien (Grafts) am Herzen.
Zusatzinfo
Es besteht der Trend, koronare Bypässe mit arteriellen Grafts der A. mammaria anzulegen, da diese gegenüber dem Venenbypass eine bessere Langzeitfunktion haben.
Mammaria-Bypass (Mammaria-koronarer Bypass = MCB) Die Arteria mammaria interna (IMA) ist ein Ast der Schlüsselbeinarterie. Sie verläuft rechts und links innen an der Vorderwand des Brustkorbs nach unten, um die Muskeln der Thoraxwand mit Blut zu versorgen. Für den Anschluss an die Herzkranzgefäße wird der Stamm der A. mammaria interna in Herzhöhe durchtrennt und mit der erkrankten Koronararterie anastomosiert ( ▶ Abb. 20.15). Je nach anatomischer Situation wird die linke oder rechte Mammaria interna gewählt, evtl. auch beide. Die A. mammaria interna wird im Allgemeinen gestielt als koronarer Bypass-Graft verwendet, d. h., der natürliche Abgang des Gefäßes aus der Arteria subclavia wird als „Graft-Inflow“ benützt. Um bei einer koronaren Herzerkrankung möglichst viele Koronaräste zu erreichen, kann es erforderlich sein, die rechte A. mammaria proximal abzutrennen und als freies Transplantat in die linke einzunähen („T-Graft“). Als freies Transplantat kann auch die Speichenarterie vom Arm angeschlossen werden ( ▶ Abb. 20.16).
Abb. 20.15 Mammaria-Bypass. Der periphere Anteil der linken A. mammaria interna (IMA) wurde mit einer Herzkranzarterie anastomosiert (Pfeil).
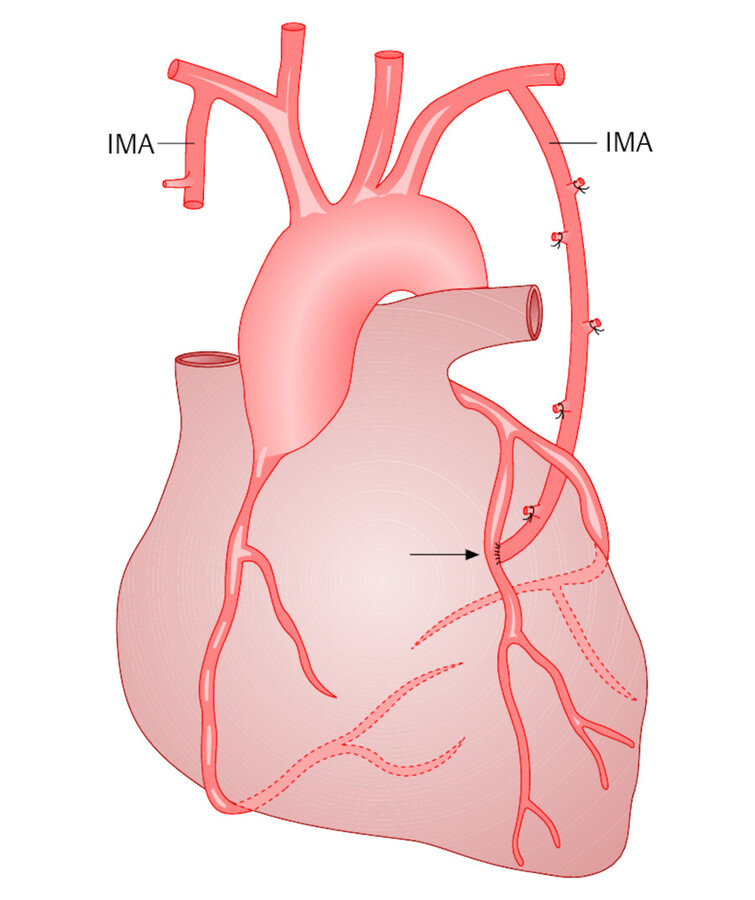
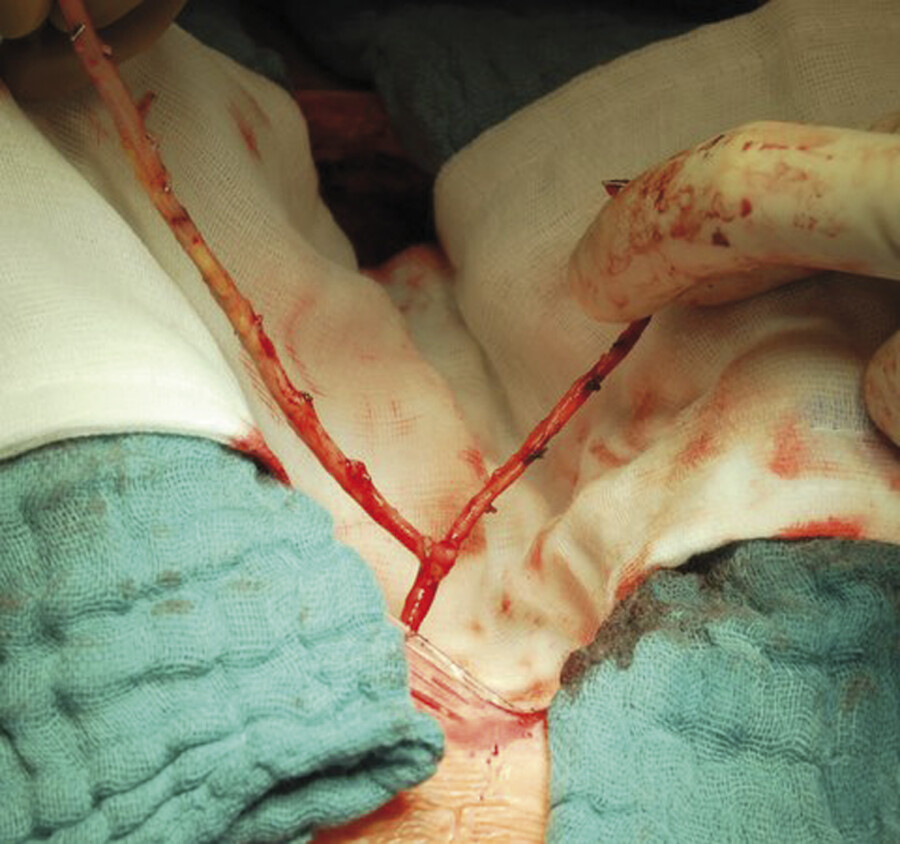
Abb. 20.16 T-Graft. Für eine komplette arterielle koronare Rekonstruktion werden mehrere autologe Arterienabschnitte benötigt. Das OP-Foto zeigt, wie eine Armarterie (A. radialis) T-förmig an einen Mammaria-Bypass anastomosiert wurde.
Aortokoronarer Venenbypass (ACVB) Als Bypassmaterial wird die autologe (körpereigene) V. saphena magna aus dem Bein des Patienten entnommen. Der Bypass beginnt am Stamm der Aorta, wo er eingenäht wird ( ▶ Abb. 20.17 u. ▶ Abb. 20.18). Das periphere Ende wird distal der Stenose mit der Koronararterie anastomosiert. Oft finden sich multiple Gefäßverengungen, sodass bei einer Operation mehrere Bypässe angelegt werden müssen (z. B. 3-fach-ACVB).
Abb. 20.17 Aortokoronarer Venenbypass. Dargestellt ist ein 3-fach-Bypass, der die Stenosen in den Herzkranzgefäßen überbrückt. Die Ligaturen am Venenbypass entsprechen den abgebundenen Seitenästen der V. saphena.
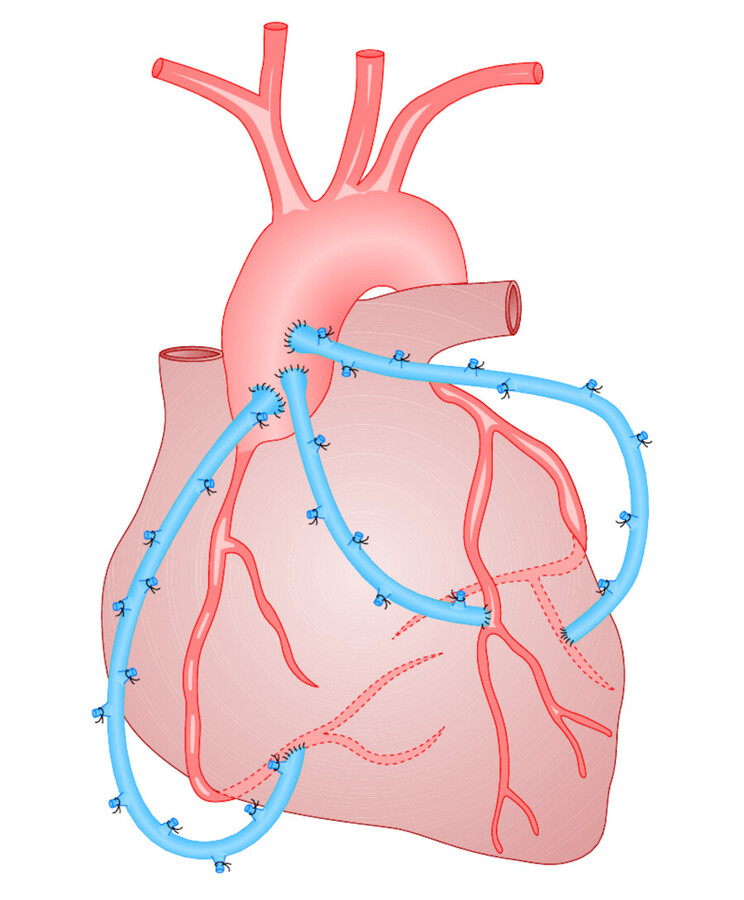
Abb. 20.18 ACVB. Blick durch den eröffneten Herzbeutel auf die Herzvorderwand. Man sieht die Aorta (Ao) und 2 Venenbypässe, die von der Aorta zu den Herzkranzgefäßen verlaufen (2-fach-ACVB).

20.5.6.2 OP-Technik
Standardtechnik Die klassische koronare Bypasschirurgie (an deutschen Herzzentren derzeit 70 %) erfolgt am nicht schlagenden Herzen unter Verwendung einer Herz-Lungen-Maschine (On-pump-Technik). Operativer Zugang ist die mediane Sternotomie.
Minimalinvasive Technik Die koronare Anastomose mit der A. mammaria interna (IMA) erfolgt über eine ca. 6 cm kleine laterale Minithorakotomie am schlagenden Herzen ohne Herz-Lungen-Maschine (Off-pump-Technik). Die Anastomose wird unter Verwendung spezieller Stabilisatoren von Hand unter direkter Sicht genäht oder von Roboterarmen ausgeführt, die von den Händen des Operateurs gesteuert werden (Verkleinerung des Zugangswegs zum Herzen).
Zusatzinfo
Hierbei unterscheidet man die MIDCAB-Technik (minimally invasive direct coronary artery bypass) mit limitiertem (kleinen) Zugang über eine seitliche Minithorakotomie von der OPCAB-Technik (off-pump coronary artery bypass) über eine konventionelle Sternotomie. Hintergrund dieser neuen OP-Techniken ist die Vermeidung des HLM-Einsatzes mit seinen potenziellen Risiken wie Gerinnungsstörungen, zerebrale Embolien, Entwicklung einer systemischen Entzündungsreaktion (SIRS).
20.5.7 Intraaortale Ballonpumpe (IABP)
Definition
Bei der intraaortalen Ballonpumpe (IABP) handelt es sich um eine mechanische Kreislaufunterstützung durch eine EKG-gesteuerte Ballonpumpe in der Aorta bei akuter Herzinsuffizienz.
Diese Form der assistierten Zirkulation ist ein gängiges Verfahren in der Kardiologie und Herzchirurgie. Indikationen sind kardiogener Schock nach Myokardinfarkt und Low-output-Syndrom in der Herzchirurgie. Die IABP wird zur perioperativen Kreislaufunterstützung bei ca. 5 % der Koronar- und Klappenoperationen eingesetzt.
Die Applikation der Ballonpumpe ist keine „Herzoperation“. Über die Femoralarterie wird ein Katheter retrograd durch die Hauptschlagader bis in die Aorta descendens unterhalb der linken Arteria subclavia hochgeschoben. Am Ende des Katheters befindet sich ein Gummiballon, der durch Gasfüllung von außen in pulssynchrone Pulsationen versetzt werden kann. Wesentliche Aufgabe der Ballonpumpe sind die Förderung der Koronarperfusion während der Herzkammerdiastole sowie die Entlastung des linken Herzens während der Systole.
20.5.8 Herztransplantation
Definition
Als Herztransplantation bezeichnet man den Austausch des körpereigenen Herzens durch das Herz eines hirntoten menschlichen Spenders.
Eine Herztransplantation kommt nur infrage, wenn eine schwerste Organschädigung vorliegt, die durch keine andere medikamentöse oder chirurgische Maßnahme behandelt werden kann.
In Deutschland werden zurzeit etwa 300 Herzen pro Jahr transplantiert. Die Vergabe der Organe erfolgt zentral durch Eurotransplant. Kommt es zu einer terminalen, also endgültigen Herzinsuffizienz, kann der betroffene Patient auf die Warteliste gesetzt werden. Hierzu müssen die Transplantationskandidaten umfangreich untersucht werden, um die weitreichenden Ausschlusskriterien zur Transplantation abzuklären. Derzeit warten in Deutschland 800 Patienten auf ein Spenderherz, die Wartezeit auf ein Organ liegt bei ca. 1 Jahr, viele Patienten versterben auf der Warteliste (http://www.dso.de).
Nach einer Herztransplantation sind engmaschige Kontrolluntersuchungen und eine konsequente Einnahme mehrerer Immunsuppressiva erforderlich. In der ersten Zeit nach der Transplantation erfolgen regelmäßig Biopsien des Herzens im Rahmen eines Rechtsherzkatheters, um Hinweise auf eine Abstoßungsreaktion zu erhalten. Das Risiko einer Abstoßungsreaktion wird in den Jahren nach der Transplantation immer geringer. Die mittlere Lebenserwartung nach einer Herztransplantation beträgt heute etwa 10 Jahre.
Zusatzinfo
Gesundheitlich kritischen Patienten auf der Warteliste kann ein Herzunterstützungssystem implantiert werden (sog. Kunstherz). Bei Kontraindikationen zur Transplantation steht diese Therapieoption auch als Alternative zur Herztransplantation zur Verfügung.
20.5.9 Kunstherz
Definition
Ein Kunstherz ist ein mechanisches Pumpsystem, das bei Herzmuskelschwäche implantiert wird. Echte Kunstherzen, also Systeme, die beide Herzkammern unterstützen, werden selten implantiert. In der Regel ist die Unterstützung der linken Herzkammer durch ein LVAD (Left ventricular assist device, Linksherzunterstützungssystem) ausreichend. Die Begriffe Kunstherz und Herzunterstützungssystem werden häufig synonym verwendet ( ▶ Abb. 20.19).
In Deutschland werden aktuell etwa 1.000 Herzunterstützungssysteme pro Jahr implantiert. Dem stehen nur 300 Herztransplantationen gegenüber. Der Einsatz eines Herzunterstützungssystems kann zur Überbrückung der Wartezeit auf ein Spenderherz als langfristige Alternative zur Transplantation oder bis zur Erholung des eigenen Herzen eingesetzt werden.
Komplikationen Sie entstehen durch Blutgerinnsel (Thromben) im System und durch Infektionen. Zum Betrieb der Herzunterstützungssysteme ist eine erheblich Blutverdünnung durch verschiedene Medikamente notwendig, die ihrerseits auch schwerwiegende Komplikationen (Blutungen) hervorrufen können. Es gibt Patienten, die bereits 5 Jahre mit diesen Systemen leben.
Abb. 20.19 Kunstherz. Mechanische Unterstützung des körpereigenen Herzens durch eine implantierte Pumpe. Die Batterien werden außerhalb des Körpers getragen.

20.6 Pflegeschwerpunkt: Herz-OP
Im Rahmen einer Herzoperation haben Pflegende vielfältige Aufgaben. Dazu zählen die präoperative Vorbereitung, die postoperative Überwachung und die Unterstützung bei den ATL (Aktivitäten des täglichen Lebens) sowie die Gesundheitsberatung für das Leben nach der Operation.
20.6.1 Präoperative Pflege
In der präoperativen Phase unterstützt die Pflegeperson den Patienten bei der Auseinandersetzung mit seinen Ängsten und führt alle allgemeinen präoperativen Maßnahmen (Kap. ▶ 9.3) durch, die vor einem extraabdominellen Eingriff notwendig sind. Daneben sind in Rücksprache mit dem Operateur ausreichend Blutprodukte zu bestellen und das Medikamentenregime wird vonseiten der behandelnden Ärzte bei Bedarf umgestellt. Dazu werden bspw. oral eingenommene gerinnungshemmende Medikamente (z.B. Marcumar) oder orale Antidiabetika abgesetzt. Vor einem herzchirurgischen Eingriff ist es zudem besonders wichtig, chronische Entzündungen auszuschließen, da sich mögliche Krankheitserreger an den Herzklappen anlagern und eine Sepsis auslösen können. Deshalb sind neben den kardiologischen Untersuchungen auch Befunde anderer Fachdisziplinen (z. B. Zahnstatus, HNO-Konsil, gynäkologischer bzw. urologischer Untersuchungsbefund) einzubeziehen.
Psychosoziale Betreuung Aufgrund der zentralen Bedeutung des Herzens für Leben und Tod kommt es bei vielen Patienten vor der Operation zu einer intensiven Auseinandersetzung mit der eigenen Sterblichkeit. Informationen über den Ablauf der Operation, den Einsatz der HLM, die sich daran anschließende Intensivtherapie sowie die Aufklärung über potenzielle Komplikationen sind wichtig, können aber beim Patienten auch Ängste hervorrufen. Je nachdem, welche Stressbewältigungsstrategien der Patient verinnerlicht hat und welche sozialen und emotionalen Unterstützungssysteme (z. B. Partner, Familie, Freunde) zum Tragen kommen, können daraus ganz unterschiedliche Verhaltensweisen resultieren. Von angepasstem, ängstlich-hilflosem Verhalten bis zu Gereiztheit und Impulsivität sind vielfältige Reaktionsmuster zu beobachten.
Pflegepraxis
Pflegebeziehung. Schon vor der Herzoperation sollte eine vertrauensvolle Pflegebeziehung zum Patienten und zu seinen Angehörigen aufgebaut werden. Dem Patienten kann ein Teil der Angst genommen werden, wenn er fachlich fundierte Informationen erhält und eine fürsorgliche Atmosphäre, gewissenhaft arbeitende Pflegende sowie einen reibungslosen Organisationsablauf erlebt. Ein respektvoller Umgang und angemessene Reaktionen auf die unterschiedlichen Verhaltensweisen sind für die Vertrauensbildung förderlich.
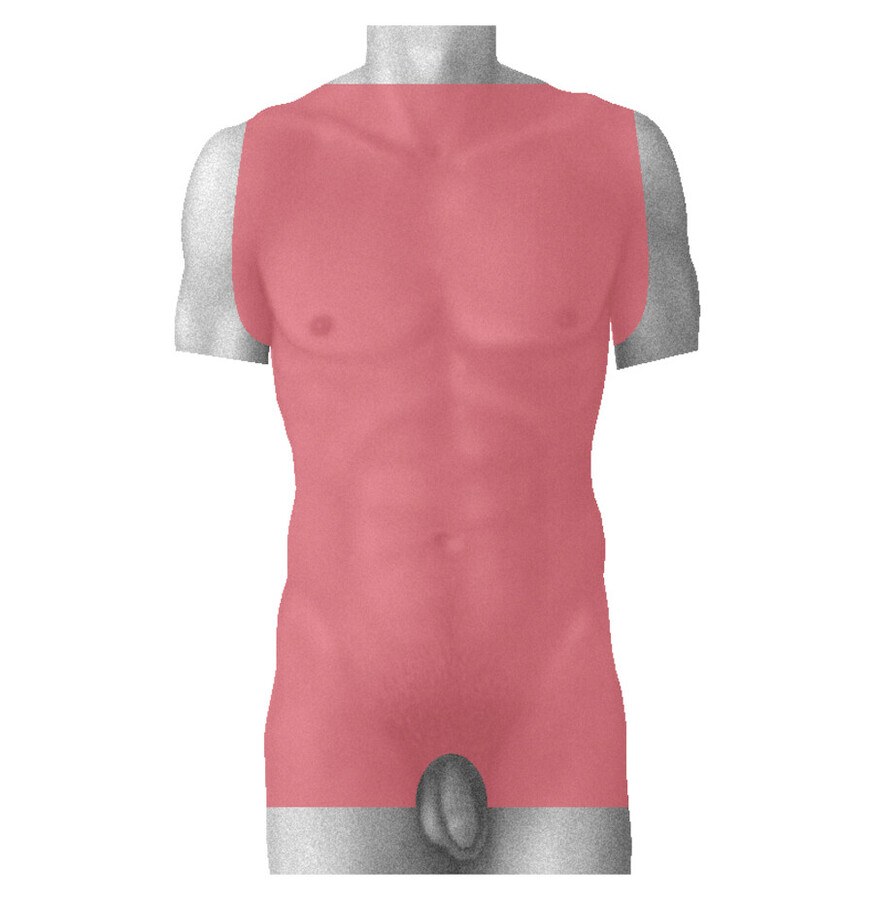
Körperinspektion und Rasur Bei der Rasur des OP-Gebiets wird eine Hautinspektion vorgenommen. Sowohl bei einem minimalinvasiven Eingriff als auch bei der konventionellen Operationstechnik erfolgt eine schonende Rasur mit einer elektrischen Haarschneidmaschine folgender Körperteile:
-
gesamter Brustkorb (vom Hals bis zur Schambehaarung unter Einbeziehung der Achselhaare, ▶ Abb. 20.20)
-
behaarte Unterarme für venöse und arterielle Zugänge
-
beide Beine einschließlich Leistenbereich (zur Gefäßentnahme bei geplanter Bypass-Operation)
Die Maßnahmen zur Körperhygiene richten sich nach dem Allgemeinzustand des Patienten. Ist der Patient kardial belastbar, sollte er am Abend vor der Operation oder am frühen Morgen duschen. Bei stark eingeschränkter Herz-Kreislauf-Situation erfolgt eine sorgfältige Ganzkörperwaschung im Sinne einer entlastenden Pflege durch die Pflegeperson.
Abb. 20.20 Rasurschema bei Herzoperationen mit medianer Sternotomie.
Einüben postoperativer Fähigkeiten Nach der OP sind die Bewegungen des Patienten durch den thoraxchirurgischen Eingriff und die Drainagesysteme schmerzbedingt eingeschränkt. Deshalb werden bereits präoperativ eine sternumentlastende Aufstehtechnik und Bewegungen eingeübt, bei denen der Brustkorb fixiert bleibt und nicht einseitig belastet wird, um die Gefahr einer Sternuminstabilität zu reduzieren. Aus diesem Grund sollte bei Patienten, die eine Sternotomie erhalten haben, auch auf einen Bettbügel verzichtet werden, da Patienten postoperativ dazu neigen, spontan mit einer Hand nach der Halterung zu greifen.
Merke
Eine einseitige und unkontrollierte Belastung des Brustkorbs birgt die Gefahr der Sternuminstabilität. Dabei werden die Drahtcerclagen ( ▶ Abb. 20.21) verschoben oder reißen aus. Sie fixieren so die beiden durchtrennten Knochenplatten nicht mehr, sodass die Frakturheilung gestört wird.
Abb. 20.21 Thoraxinstabilität. Wenn der Brustkorb nur einseitig und unkontrolliert belastet wird, besteht die Gefahr der Sternuminstabilität. Die auf dem Thorax-Röntgenbild sichtbaren Drahtcerclagen könnten sich verschieben oder einreißen.
Neben der sternumentlastenden Bewegungs- und Aufstehtechnik ist auch die Einübung atemprophylaktischer Maßnahmen von zentraler Bedeutung. Aufgrund des erhöhten Pneumonierisikos nach einem thoraxchirurgischen Eingriff werden gezielte atemtherapeutische Fähigkeiten vermittelt, wie bspw. der Umgang mit Hilfsmitteln zur Atemgymnastik (z.B. Triflow).
20.6.2 Postoperative Pflege
Patienten werden nach einem herzchirurgischen Eingriff zunächst auf einer Intensivstation betreut, da i.d.R. eine Nachbeatmung notwendig ist und stark kreislaufwirksame Medikamente (sog. Katecholamine) wie z.B. Suprarenin, Dobutamin eingesetzt werden.
Sobald der Beatmungsschlauch (Tubus) entfernt werden konnte (Extubation) und der Kreislauf stabil ist, wird der Patient auf eine Intermediate Care verlegt. Der Zeitraum bis zur Verlegung ist abhängig vom Alter, von den Vorerkrankungen, dem Operationsverlauf und dem Allgemeinzustand des frisch operierten Patienten.
Nach herzchirurgischen Eingriffen können schwerwiegende Komplikationen auftreten, daher ist eine kontinuierliche Überwachung notwendig.
Überwachung Postoperativ können Herzrhythmusstörungen auftreten, z.B. aufgrund einer kardialen Hypoxie oder durch Flüssigkeits- und Elektrolytverschiebungen. Nach Herzklappenoperationen besteht zudem die Gefahr, dass beim Einnähen der künstlichen Klappen das Reizleitungssystem verletzt wird. Hierdurch können dauerhafte Herzrhythmusstörungen (z.B. AV-Block II.–III. Grades) entstehen. Eine kontinuierliche Monitorüberwachung ist daher notwendig. Bei Rhythmusstörungen und wenn eine antiarrhythmische Therapie eingeleitet werden muss, wird der an den epikardialen Schrittmacherelektroden angeschlossene Herzschrittmacher eingeschaltet.
Daneben ist die Kontrolle der Elektrolyte von zentraler Bedeutung, besonders der Kaliumspiegel muss überwacht werden.
Bis zum 10. postoperativen Tag besteht außerdem die Gefahr einer Herzbeuteltamponade (s. Kap. ▶ 20.4.5). Der Patient zeigt dabei anfangs Symptome wie Blässe, Dyspnoe, Halsvenenstauung und einen steigenden ZVD. Im Verlauf kann sich ein kardiogener Schock mit RR-Abfall, Tachykardie und Oligurie bis hin zum Herz-Kreislauf-Stillstand entwickeln.
Drainagen, Sonden und Wundmanagement Nach der medianen Sternotomie hat der Patient eine Wunde am Brustbein und an der Hautoberfläche treten die Schrittmacherdrähte heraus. Zudem liegen im Wundgebiet verschiedene Saugdrainagen: substernale Drainagen (unter dem Sternum), Perikarddrainagen (im Herzbeutel) und Pleuradrainagen (s. Kap. ▶ 20.5.2 und Kap. ▶ 7.5.2). Die Sekretmenge und das Thoraxsaugsystem werden engmaschig kontrolliert (Nachblutungsgefahr!). Bei Bedarf können die Drainagen „gemolken“ werden, um den Drainagefluss zu gewährleisten, dies sollte nur unter Monitorüberwachung geschehen.
Die Drainagen werden i.d.R. nach 2–4 Tagen entfernt, eine Röntgenkontrolle ist danach notwendig. Der Verbandwechsel erfolgt alle 2 Tage und das Wundgebiet wird auf Entzündungszeichen beobachtet ( ▶ Tab. 3.3 ).
Eine mögliche Sternuminstabilität äußert sich durch „Knack- und Knistergeräusche“ (Krepitation) beim Husten und durch tastbare Beweglichkeit der Sternumteile. Solche Auffälligkeiten sind dem zuständigen Arzt bei der Visite mitzuteilen.
Schmerzmanagement Thoraxchirurgische Eingriffe, bei denen das Brustbein eröffnet oder Rippen stark gedehnt werden, sind sehr schmerzhaft. Der Arzt ordnet eine Schmerztherapie an, bei der die Schmerzmittel nach festgesetzten Zeiten verabreicht werden, sowie zusätzlich eine Bedarfsmedikation. Pflegende schätzen regelmäßig pro Schicht die Schmerzsituation des Patienten ein und sorgen ggf. für eine Anpassung der Medikation. Ziel ist ein weitestgehend schmerzfreier Zustand.
Lagerung und Mobilisation Bereits am 1. postoperativen Tag wird der Patient, sofern es seine Kreislaufsituation zulässt, mobilisiert. In den ersten Wochen nach der Operation sollte der Patient im Bett eine Rückenlage einnehmen, da eine (90-Grad-) Seitenlage die Wundheilung des Sternums stören kann. Es dürfen keine ruckartigen Bewegungen und Verdrehungen sowie einseitige Belastungen des Brustkorbes erfolgen.
Aufgrund der Operationsdauer (ca. 2–3 Stunden), des extrakorporalen Kreislaufs (durch die HLM) und der Hypothermie besteht bereits intraoperativ ein hohes Dekubitusrisiko. Schwer mobilisierbare und kreislaufschwache Patienten können dabei unterstützt werden, eine 30-Grad-Seitenlage einzunehmen. Auch beim Sitzen im Sessel kommen bei dekubitusgefährdeten Patienten Weichlagerungsmaterialien zur Anwendung.
Merke
Patienten sollen nach einer Herzoperation in den ersten Wochen möglichst nur auf dem Rücken liegen, um die Wundheilung des Sternums zu unterstützen. Zur Dekubitusprophylaxe kann der Patient eine 30-Grad-Seitenlage einnehmen oder durch Mikrolagerungen unterstützt werden.
Viele Patienten klagen nach der Operation über Verspannungen und Schmerzen im Rücken. Ursache hierfür kann der intraoperativ eingesetzte Thoraxsperrer sein, mit dem der knöcherne Brustkorb auseinandergedehnt wird. Durch diese Brustkorbüberdehnung wird ein erhöhter Druck von den Rippen und den Schulterblättern auf die Wirbelsäule und die dazwischenliegende Rückenmuskulatur ausgeübt und dabei evtl. Nerven komprimiert. Mittels rhythmischer Einreibungen, Wärmebehandlung, der Einleitung einer Massagetherapie wird die Durchblutung der Rückenmuskulatur verbessert, der Spannungszustand gelockert und die Schmerzen gelindert.
Atmung Postoperativ besteht die Gefahr einer Ateminsuffizienz, die Gründe hierfür sind vielfältig:
-
unzureichende Belüftung der Lunge während der HLM-Zeit
-
eine lange Nachbeatmungsphase
-
Opiatüberdosis
-
Schmerzen und dadurch bedinge Schonatmung
-
eingeschränkte Mobilität etc.
Die Atmung und die Laborparameter (BGA) werden daher engmaschig kontrolliert, zudem ist i.d.R. eine vorübergehende kontinuierliche Sauerstoff-Verabreichung notwendig.
Bei thoraxchirurgischen Eingriffen besteht zudem eine erhöhte Pneumoniegefahr. Die präoperativ eingeübte Atemtherapie kommt bereits am 1. postoperativen Tag zur Anwendung. Bei der Atelektasen- und Pneumonieprophylaxe ist zu beachten, dass der Patient
-
kontinuierlich und bedarfsgerecht Schmerzmittel erhält, um ein schmerzfreies Durchatmen und Abhusten zu gewährleisten,
-
angeleitet wird, abzuhusten und dabei mit beiden Händen einen Gegendruck auf das Brustbein auszuüben, um die Belastung auf das Sternum zu reduzieren,
-
eine intensive Atemtherapie erhält und
-
ggf. ein Stütz- und Entlastungsverband (z.B. Tricodur, Tubigrip) um den Brustkorb herum angelegt bekommt.
Ernährung Zur Aufrechterhaltung des Wasser- und Elektrolythaushalts erhält der Patient Elektrolytlösungen über einen zentralen Venenkatheter (ZVK). Bereits 4–6 Stunden nach der Extubation darf er trinken. Treten weder Übelkeit noch Erbrechen auf, kann schrittweise am 1. postoperativen Tag mit dem Kostaufbau begonnen werden. Der ZVK wird möglichst zwischen dem 4. und 5. postoperativen Tag entfernt. Voraussetzung hierfür sind ein ausgeglichener Flüssigkeits- und Elektrolythaushalt und ein komplikationsloser Genesungsverlauf.
Ausscheidung Als Reaktion auf die HLM entsteht eine erhöhte Zellmembrandurchlässigkeit und daher entwickeln Patienten verstärkt Ödeme. Häufig ist eine Gewichtszunahme von 2–5 kg zu beobachten. Daher werden in den ersten postoperativen Tagen die Ein- und Ausfuhr bilanziert und 2-mal täglich das Gewicht kontrolliert. Die Ausscheidung kann mithilfe von Diuretika (z.B. Furosemid) unterstützt werden.
Außerdem können Störungen der Magen-Darm-Passage auftreten (bspw. aufgrund von Opioiden und der eingeschränkten Mobilität). Pflegende sollten daher die Darmperistaltik mithilfe eines Stethoskops kontrollieren. Der Patient sollte spätestens zwischen dem 3. und 4. postoperativen Tag abführen, ansonsten muss die Defäkation (bspw. mit Laxanzien) eingeleitet werden.
Bewusstseinszustand Bei vielen Patienten tritt postoperativ ein akuter Verwirrtheitszustand (Delir) auf. Die Betroffenen können halluzinieren und desorientiert sein (örtlich, zeitlich, zur Situation und zur Person). Als mögliche Ursachen werden diskutiert: Nebenwirkungen der Narkotika, Dehydration, Elektrolytverschiebungen, Begleiterkrankungen (z.B. Diabetes mellitus, Alkoholabusus) etc.
Ältere Patienten sind besonders gefährdet. Der Zustand kann mehrere Tage bis Wochen andauern, normalisiert sich jedoch i.d.R. wieder. Unruhe und Gereiztheit können erste Anzeichen sein. Mögliche Maßnahmen und Beobachtungspunkte:
-
Patienten engmaschig auf selbstgefährdende Verhaltensweisen überwachen (z.B. Patient entfernt Drainage)
-
starke Außenreize reduzieren und Ruhe- und Erholungsphasen gewährleisten
-
Orientierungshilfen geben (über Ort, Zeit, Situation, Person) und Angehörige informieren
-
eine wertschätzende, ruhige Kommunikation beachten sowie konkrete und prägnante Handlungsanweisungen bei allen Pflegemaßnahmen geben
Zusatzinfo
Bei komplikationslosem Verlauf wird der Patient nach 10–12 Tagen entlassen oder tritt direkt im Anschluss daran eine 3-wöchige Rehabilitation an.
Entlassungsmanagement Die statistische Überlebensraten nach Herzoperationen liegt bei über 95% (Schäfer, 2015, S. 34). Was nach der Operation in der häuslichen Situation beachtet werden muss, sollte im Rahmen der Entlassungsberatung mit dem Patienten und ggf. mit seinen Angehörigen besprochen werden. Wichtige Aspekte des Gesprächs beziehen sich auf das Verhalten nach der Operation (Schonung der Wunde, die ersten Wochen nicht über 10 kg tragen) sowie dem Abbau von arteriosklerosefördernden Risikofaktoren (wie z.B. Ernährungsumstellung, Bewegungsverhalten und Nikotinabstinenz).
Antikoagulationstherapie Zur Thromboseprophylaxe, vor allem nach einer koronaren Bypassoperation, erhalten viele Patienten täglich Acetylsalicylsäure (ASS, z.B. Aspirin). Eine Antikoagulationstherapie (z. B. mit Marcumar) soll beim Einsatz einer mechanischen Herzklappe eine Thrombenbildung an der künstlichen Klappe und somit eine Embolie verhindern. Zum einen erhält der Patient einen Marcumar-Pass, in dem die täglich eingenommene Medikamentendosis und die aktuellsten Gerinnungswerte dokumentiert werden (Quick/INR). Zum anderen wird ihm ein Herzklappen-Pass ausgestellt, aus dem hervorgeht, was für eine Herzklappe von welchem Hersteller implantiert ist. Wurde eine biologische Herzklappe eingesetzt, ist in der Regel eine Antikoagulation für drei Monate ausreichend.
Endokarditisprophylaxe Gleichzeitig besteht nach dem Einsatz einer künstlichen Herzklappe lebenslänglich ein erhöhtes Endokarditisrisiko. Über kleine Hautverletzungen, Zahnwurzelvereiterungen, Halsentzündungen usw. können Erreger in das Blut gelangen und sich im Bereich der künstlichen Herzklappe anlagern. Zum einen besteht hierbei eine Sepsisgefahr. Zum anderen kann es infolge der entzündlichen Veränderungen am Herzen zu Gewebedefekten im Bereich der Klappennaht kommen (paravalvuläres Leck). Aus diesen Gründen muss bei allen Eingriffen im Mund- und Rachenbereich, bei allen Operationen oder Eingriffen an den oberen Luftwegen und im Gastrointestinal- und Urogenitalbereich eine Endokarditisprophylaxe mit Antibiotika erfolgen.
Zusatzinfo
Patienten können über die Herzstiftung (www.herzstiftung.de) ein Merkblatt zur Endokarditisprophylaxe beziehen, auf dem die aktuellsten Informationen und Therapievorschläge aufgeführt sind. Dieses Merkblatt sollte der Betroffene vor jeder geplanten Behandlung dem zuständigen Arzt aushändigen.