
12 Chirurgische Notfallsituationen
Als chirurgischer Notfall gelten sowohl Patienten, die akut lebensbedrohlich erkrankt sind, als auch solche, bei denen die Gefahr einer raschen bedrohlichen Verschlechterung besteht.
Eine Übersicht über die in diesem Buch behandelten chirurgischen Notfallsituationen zeigt ▶ Tab. 12.1 .
|
Beispiele (alphabetisch) |
Querverweis |
|
Akute Extremitätenischämie |
Kap. ▶ 31.2 |
|
Akutes Abdomen |
Kap. ▶ 12.6 |
|
Arterielle Blutung |
Kap. ▶ 3.1 |
|
Gastrointestinale Blutung |
Kap. ▶ 12.4 |
|
Herzbeuteltamponade |
Kap. ▶ 20.4.5 |
|
Herzinfarkt |
Kap. ▶ 20.4.1 |
|
Herz-Kreislauf-Stillstand |
bei Reanimation, Kap. ▶ 12.1 |
|
Ileus |
Kap. ▶ 12.7 |
|
Inkarzerierte Hernie |
Kap. ▶ 29.1.1 |
|
Instabiler Thorax |
Kap. ▶ 19.5 |
|
Intraabdominelle Blutung |
Kap. ▶ 12.5 |
|
Intrazerebrale Blutung |
Kap. ▶ 33.2 |
|
Lungenembolie |
Kap. ▶ 31.2.3 |
|
Magenperforation |
Kap. ▶ 22.3.2 |
|
Mesenterialinfarkt |
Kap. ▶ 23.4.1 |
|
Milzruptur |
Kap. ▶ 26.6.1 |
|
Nachblutung |
Kap. ▶ 9.4.5 |
|
Offene Fraktur |
Kap. ▶ 32.3 |
|
Ösophagusvarizenblutung |
Kap. ▶ 25.3.1 |
|
Perforierte Appendizitis |
Kap. ▶ 23.3.1 |
|
Peritonitis |
Kap. ▶ 12.8 |
|
Platzbauch |
Kap. ▶ 9.4.5 |
|
Pneumothorax |
Kap. ▶ 19.5.2 |
|
Polytrauma |
Kap. ▶ 12.9 |
|
Querschnittlähmung |
Kap. ▶ 33.7.7 |
|
Schädel-Hirn-Trauma |
Kap. ▶ 33.2 |
|
Schlangenbiss |
Kap. ▶ 3.2.1 |
|
Schock |
Kap. ▶ 12.2 |
|
Stumpfes Bauchtrauma |
Kap. ▶ 12.5 |
|
Tiefe Venenthrombose |
Kap. ▶ 30.2.3 |
|
Transfusionsreaktion |
Kap. ▶ 10.2.3 |
|
Verbrennung |
Kap. ▶ 13.1 |
Merke
Bei einem chirurgischen Notfall gilt der Grundsatz „rasche Diagnose, rasche Therapie“!
12.1 Kardiopulmonale Reanimation
Definition
Als kardiopulmonale Reanimation (CPR) bezeichnet man die Herz-Lungen-Wiederbelebung bei Herz- und Atemstillstand.
Merke
Bei jedem bewusstlosen Patienten muss an einen plötzlichen Kreislaufstillstand gedacht werden. Ein zügiges und sicheres Handeln in einer Notfallsituation ist ausschlaggebend für die Überlebenschancen des Patienten.
Wichtig ist das zügige Erkennen einer Notfallsituation, damit sofort mit einer Reanimation begonnen werden kann:
-
Bewusstlosigkeit: Der Patient zeigt keine Reaktion auf Ansprache und Anfassen (vorsichtiges Rütteln an den Schultern).
-
Keine normale Atmung: Keine Atmung erkennbar oder es bestehen Zweifel daran, dass eine normale Atmung vorhanden ist.
Zusatzinfo
Zum Reanimationsablauf gibt es weltweit geltende Empfehlungen, die regelmäßig vom European Resuscitation Council (ERC) überarbeitet werden (http://www.erc.edu).
12.1.1 Automatische externe Defibrillation (AED)
Der automatische externe Defibrillator (AED-Gerät) ist für die Anwendung durch medizinische Laien im außerklinischen Bereich entwickelt. AED-Geräte stehen an Plätzen mit hohem Publikumsverkehr, um einen sofortigen Reanimationsbeginn durch Laienhelfer zu ermöglichen ( ▶ Abb. 12.1). Die internationale Kennzeichnung verzichtet auf Buchstaben ( ▶ Abb. 12.2).
Abb. 12.1 Laien-Defibrillator. Geräte zur automatischen externen Defibrillation (AED) bei Herzstillstand stehen weltweit an gut erreichbaren Plätzen.
(© brostock/stock.adobe.com)

Abb. 12.2 Internationales Rettungszeichen. Das Herz mit dem Blitz-Symbol markiert den Standort für einen Laien-Defibrillator.

12.1.1.1 Durchführung
Wenn ein Defibrillationsgerät (AED) zur Verfügung steht, sollte dieses unverzüglich herbeigeholt werden. Unabhängig davon muss der Notruf 112 gewählt und sofort mit der Herz-Lungen-Wiederbelebung begonnen werden (30 x Herzdruck, 2x Atemspende, s.u.).
Ein AED-Gerät gibt nach Einschalten automatische Sprachanweisungen, die von Laienhelfern umgesetzt werden können. Auch die Platzierung der Elektroden wird erläutert. Das AED-Gerät erkennt, ob eine Indikation für eine Defibrillation vorliegt, und führt den Stromstoß weitgehend automatisch durch.
Pflegepraxis
Notfallmaßnahmen. Die Herzdruckmassage darf für die Defibrillation maximal 10 Sekunden unterbrochen werden. Jede Minute ohne wirksame Herzkompression reduziert die Überlebenswahrscheinlichkeit um 10 %, auch wenn eine frühzeitige Defibrillation erfolgt.
12.1.2 Herzdruckmassage
Durch eine externe Herzdruckmassage kann das Schlagvolumen aufrechterhalten werden. Dabei werden die Herzkammern durch stoßweisen Druck auf den Thorax zwischen Brustbein und Wirbelsäule rhythmisch komprimiert.
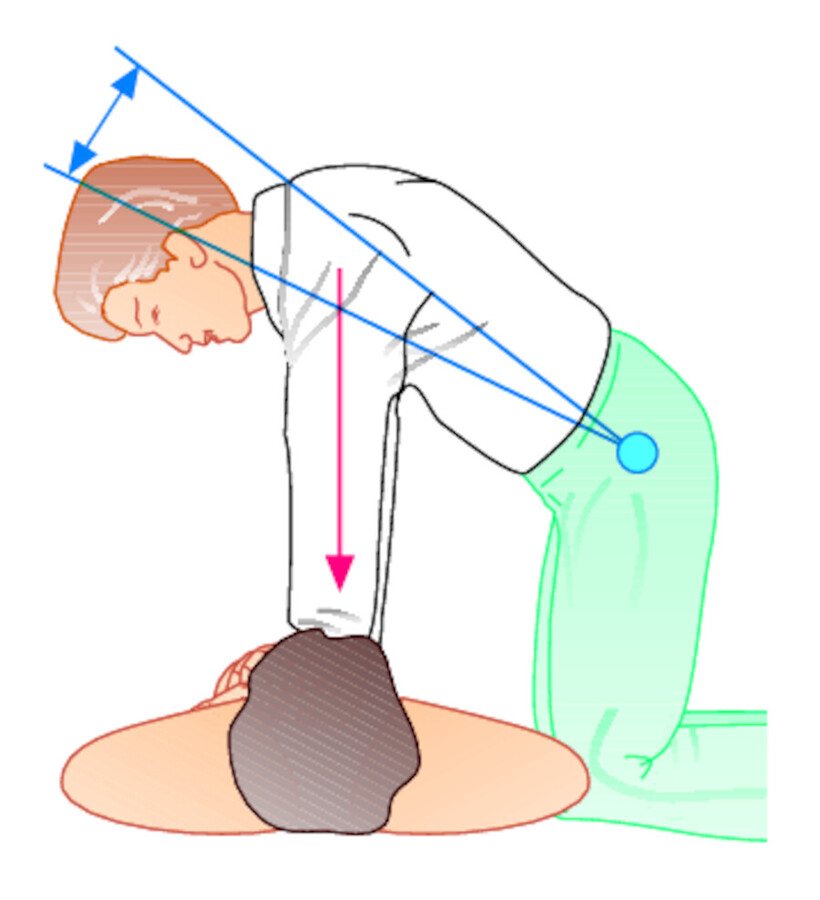
Abb. 12.3 Externe Herzdruckmassage.
Abb. 12.3a Der Druckpunkt liegt über dem Brustbein in der Mittellinie.
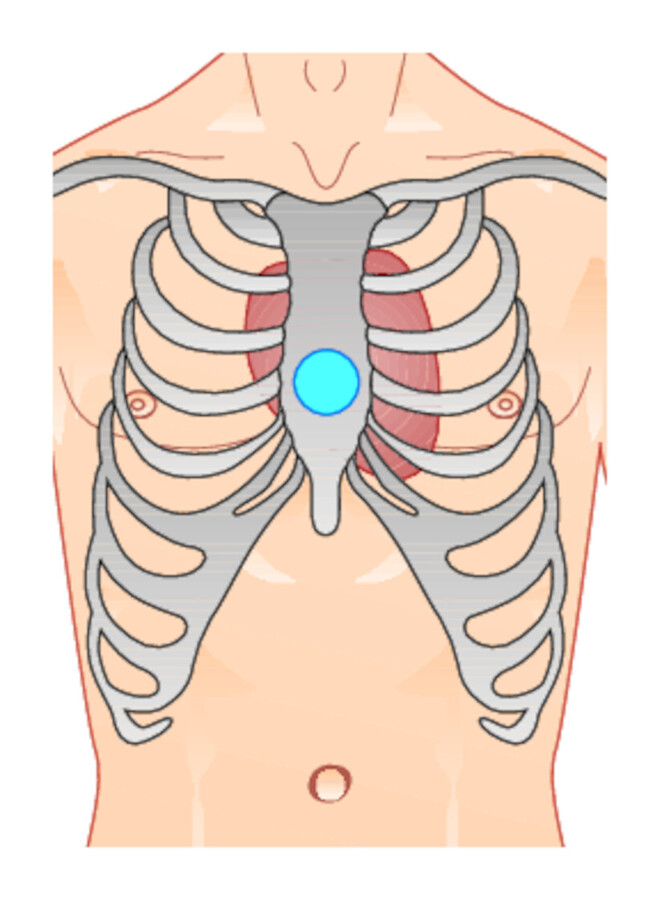
Abb. 12.3b Es wird nur der Handballen aufgesetzt, die Finger sind vom Brustkorb abzuheben.
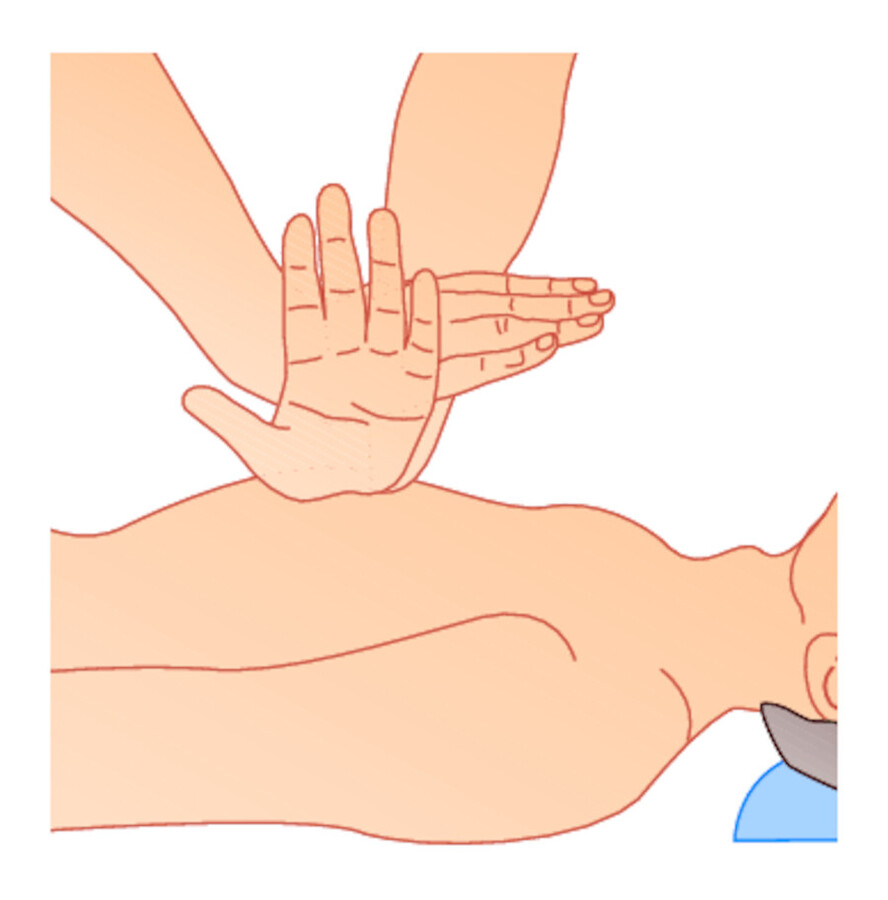
Abb. 12.3c Die stoßweise Druckausübung (ca. 100x pro Minute) erfolgt zur Kraftersparnis mit gestrecktem Ellenbogen.
12.1.2.1 Durchführung
-
Harte Unterlage (Brett) unter den Brustkorb des Patienten schieben, wenn der Untergrund weich ist.
-
Seitlich des Patienten in Höhe des Brustkorbes knien, s. ▶ Abb. 12.3c (oder bei tief gestelltem Bett stehen).
-
Aufsetzen eines Handballens auf den Druckpunkt des unteren Sternums, s. ▶ Abb. 12.3a.
-
Die Finger sind dabei nach oben gestreckt, um eine Verletzung durch Druck auf die umgebenden Organe (Rippen, Milz, Leber) zu vermeiden, s. ▶ Abb. 12.3b.
-
Aufsetzen des anderen Handballens auf den Rücken der ersten Hand.
-
Arme in den Ellenbogengelenken strecken (Arbeitserleichterung).
-
Stoßweiser Druck mindestens 5 cm tief senkrecht über die gestreckten Arme. Dabei immer auf vollständige Entlastung zwischen den Kompressionen achten.
-
Frequenz: 100 bis 120/min.
-
Herzdruckmassage 30x und Beatmung 2x im steten Wechsel fortführen, bis professionelle Hilfe kommt und ein EKG anschließt.
Zusatzinfo
Bei Kindern erfolgt die Herzdruckmassage nur mit einer Hand, bei Säuglingen mit lediglich 2 Fingern. Die Frequenz soll ca. 120/min betragen.
AED-Geräte erkennen automatisch, ob eine Indikation zur Defibrillation vorliegt. Nach Eintreffen professioneller Hilfe entscheidet der Arzt anhand der Herzstromkurve im EKG über das weitere Vorgehen.
Pflegepraxis
Notfallmaßnahmen. Bei der Defibrillation hält der Arzt die isolierten Elektrodengriffe, alle anderen Personen halten zum Selbstschutz einen Mindestabstand von ca. 1 m zu Patient und Bett.
12.1.3 Atemspende
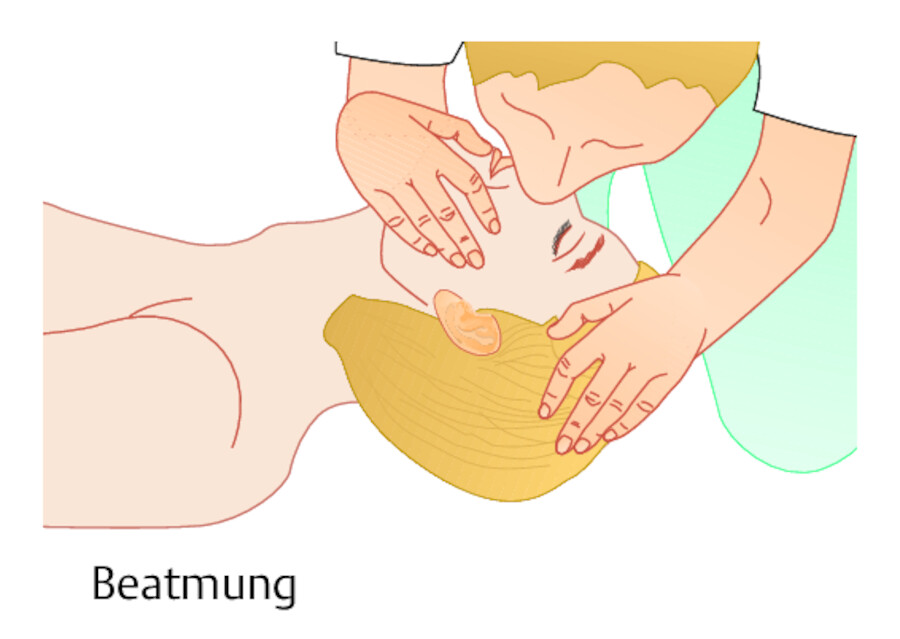
Ein akuter Kreislaufstillstand führt nach ca. einer Minute zum Atemstillstand. Deshalb sollte zusätzlich zur Herzdruckmassage eine Atemspende erfolgen ( ▶ Abb. 12.4 u. ▶ Abb. 12.5). Im innerklinischen Kontext erfolgt die Beatmung des Betroffenen meist durch eine Maske und Beatmungsbeutel. Außerhalb einer Klinik ist die Mund-zu-Nase- oder Mund-zu-Mund-Beatmung üblich.
12.1.3.1 Durchführung: Mund-zu-Nase-Beatmung
-
Freimachen der Atemwege durch Neigen des Kopfes nach hinten, wobei der Unterkiefer nach vorn gezogen wird (Kopf-Kiefer-Griff oder Esmarch-Handgriff). Dadurch wird der Zungengrund von der Rachenhinterwand abgehoben.
-
Durchführen der Mund-zu-Nase-Beatmung. Der Kopf des Patienten wird dabei durch Anheben des Kinns nach hinten gezogen. Die Hand am Kiefer hält mit dem Daumen den Mund des Patienten geschlossen, während man in die Nase einbläst. Alternativ kann eine Mund-zu-Mund-Beatmung erfolgen, wobei dann die Nasenlöcher mit der stirnseitigen Hand verschlossen werden.
-
Normal einatmen und Luft über einen Zeitraum von einer Sekunde gleichmäßig in die Nase des Betroffenen blasen, so dass sich der Brustkorb sichtbar hebt. Dann eigenen Kopf zur Seite drehen und darauf achten, ob sich der Brustkorb des Betroffenen wieder senkt.
-
Betroffenen ein zweites Mal beatmen, dann wieder 30x Herzmassage durchführen.
-
Falls die Spontanatmung einsetzt, den Betroffenen in stabile Seitenlage bringen.
-
Falls der Betroffene bewusstlos bleibt, Druckmassage und Atemspende im Wechsel 30:2 fortführen, bis Fachpersonal eintrifft und weitere Maßnahmen ergreift (wie z.B. endotracheale Intubation).
Abb. 12.4 Atemwege frei machen. (Abb. aus: Rettungssanitäter. Thieme; 2017)
Abb. 12.4a In Rückenlage fällt die Zunge zurück und verschließt die Atemwege.
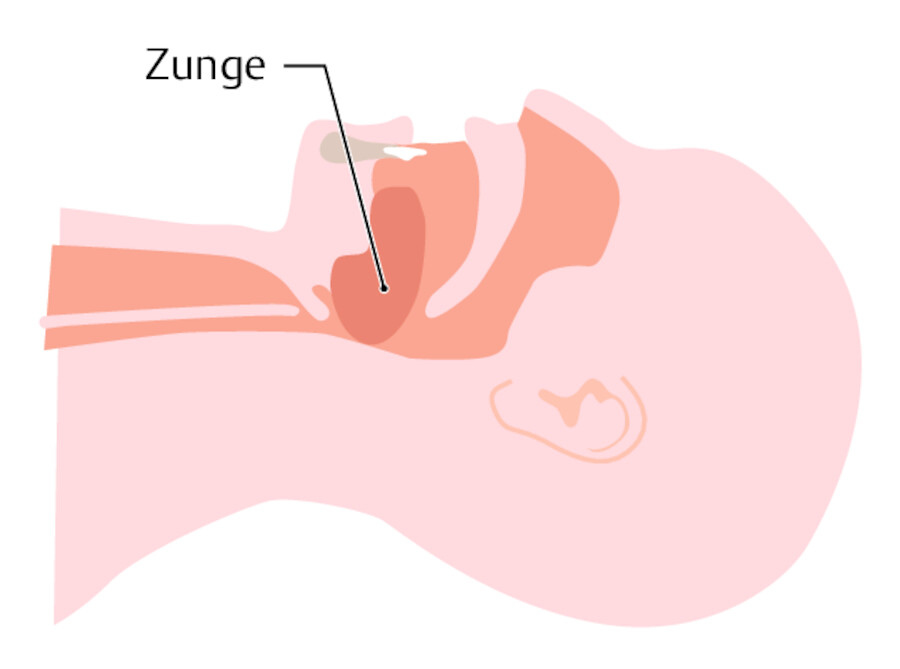
Abb. 12.4b Deshalb muss der Hals überstreckt werden, wodurch sich die Zunge von der Rachenhinterwand abhebt und die Atemwege frei macht.
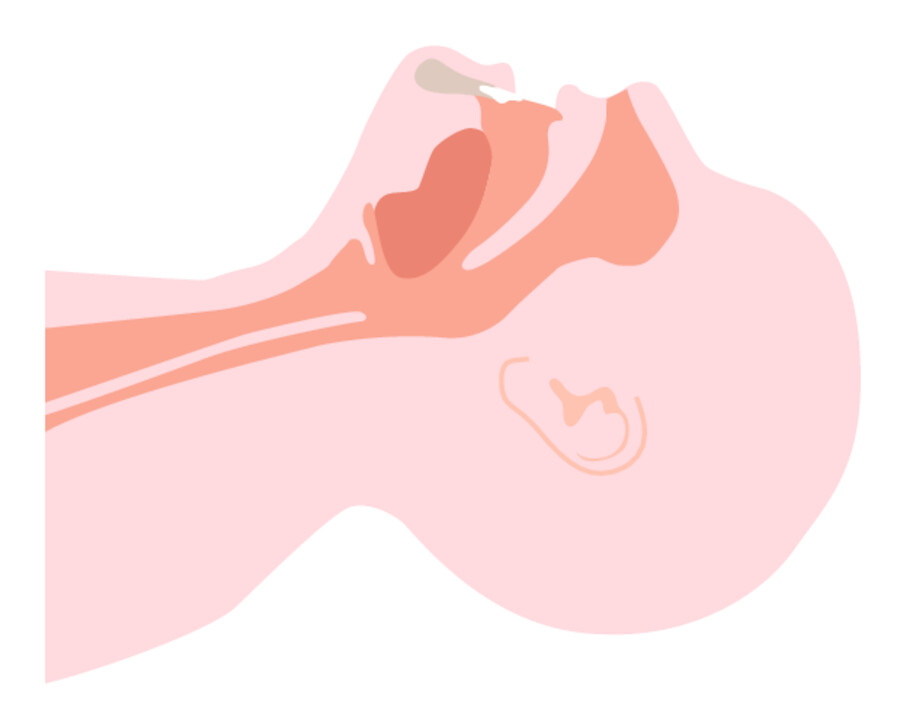
Abb. 12.5 Mund-zu-Nase-Beatmung.
Abb. 12.5a Durch Überstrecken des Halses (Esmarch-Handgriff) werden die Atemwege freigehalten.

Abb. 12.5b Die Beatmung erfolgt in die Nase, wobei der Mund des Patienten mit einer Hand am Kinn geschlossen gehalten wird.
12.1.4 Kombinierte Herz-Lungen-Wiederbelebung
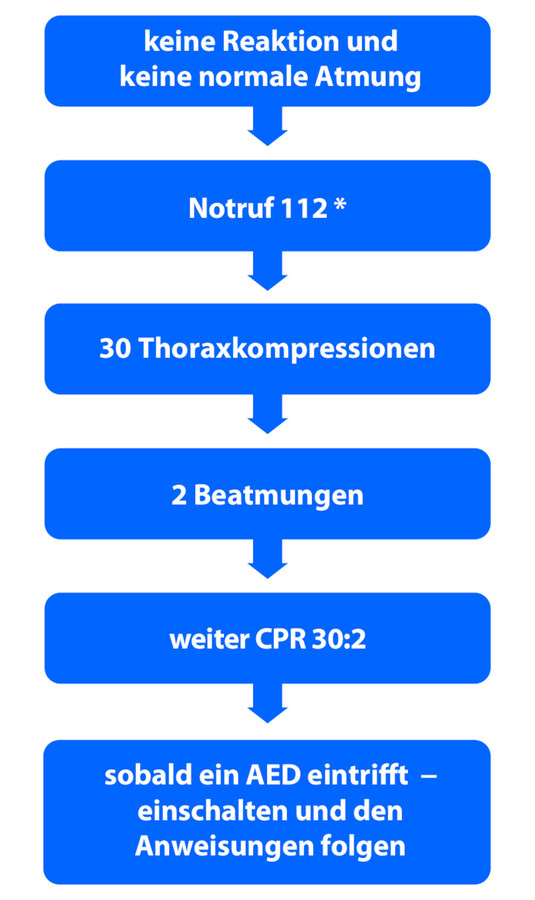
Bei einem Herz- und Atemstillstand muss sofort mit Herzdruckmassage und gleichzeitiger Atemspende begonnen werden. Der Ablauf einer kardiopulmonalen Reanimation zeigt ▶ Abb. 12.6. Eine alleinige Unterstützung der kardialen Pumpleistung würde zwar den Kreislauf aufrechterhalten, dem Blut aber nicht den notwendigen Sauerstoff zuführen. Umgekehrt gelangt durch die Beatmung Sauerstoff in die Lunge, dieser wird jedoch bei unterlassener Herzmassage nicht weitertransportiert.
12.1.4.1 Durchführung
Steht für die Reanimation nur eine Person zur Verfügung, so muss zwischen Herzdruckmassage 30x und Atemspende 2x abgewechselt werden. Zu zweit teilt man die Herzdruckmassage und die Atemspende in demselben Rhythmus auf. Auf einer Intensivstation verteilen sich die Aufgaben entsprechend ▶ Tab. 12.2 . In jedem Falle sind die Bemühungen bis zum Eintreffen des Arztes fortzusetzen.
Abb. 12.6 Handlungsablauf Wiederbelebung Erwachsener.
(Abb. von: Perkins, G., Handley, A., Koster, R. et al. Notfall Rettungsmed (2015) 18: 748. © German Resuscitation Council (GRC) und Austrian Resuscitation Council (ARC) 2015)
|
Aufgaben der Pflegefachkräfte |
Aufgaben des Arztes |
|
|
12.1.4.2 Komplikationen
Als Komplikation der Herzdruckmassage kommen äußere und innere Verletzungen vor:
-
häufigste Komplikation sind Rippen- und Sternumfrakturen (⅓ der Fälle)
-
Pneumothorax als mögliche Folge der Rippenfrakturen
-
innere Blutungen (Milz- und Leberrupturen)
12.1.4.3 Pharmaka zur Reanimation
Auf einer Normalstation sind die Medikamente zur Reanimation ( ▶ Tab. 12.3 ) zusammen mit anderem Notfallinstrumentarium (Intubationsbesteck) in einem Notfallkoffer verfügbar. Die regelmäßige Überprüfung auf Vollständigkeit und Verfallsdatum muss stationsintern geregelt und dokumentiert werden.
Merke
Adrenalin (Suprarenin) ist das wichtigste Medikament im Rahmen einer Reanimation. Es entspricht dem körpereigenen Hormon der Nebenniere und wird während einer Reanimation im 5-Minuten-Abstand in einer Dosis von 1 mg verabreicht.
|
Wirkstoff |
Wirkung |
Indikation |
Dosierung |
Applikation |
|
Adrenalin (Suprarenin) |
starke Stimulation der Herztätigkeit |
Asystolie |
0,5–1 mg (1 : 10 verdünnt mit 0,9 % NaCl) |
intravenös oder über Tubus (höhere Dosierung nötig) |
|
Amiodaron |
starke Wirkung auf den Herzrhythmus |
Kammerflimmern |
Bolus bis 300 mg |
intravenös |
|
Natriumbicarbonat |
Pufferung des Säure-Basen-Haushalts |
metabolische Azidose |
Kurzinfusion (50–100 ml 8,4 %ige Lösung) |
intravenös, keine routinemäßige Anwendung, nur nach BGA- und Elektrolytkontrolle |
12.2 Schock
Definition
Unter Schock versteht man eine Kreislaufstörung verschiedener Ursachen, wobei als Folge ein schweres Missverhältnis zwischen Sauerstoffbedarf und tatsächlichem Sauerstoffangebot resultiert.
Die kontinuierliche Verminderung der Gewebedurchblutung, die eine Kette pathophysiologischer Mechanismen auslöst, führt ohne Behandlung zum Organtod durch Hypoxie (Sauerstoffmangel).
Zusatzinfo
Der Begriff „Schock“ wird unterschiedlich definiert. Der Ausdruck wurde im 18. Jahrhundert für verschiedene Verletzungsformen geprägt, als noch keinerlei pathophysiologischen Vorstellungen vorhanden waren. Verwirrend ist, dass gelegentlich auch banale, spontan reversible orthostatische Kreislaufreaktionen wie Kollaps, Synkope oder „Ohnmachtsanfall“ als Schock bezeichnet werden. In Laienkreisen bezeichnet man sogar kurzfristige nervöse Erschöpfungs- oder Erregungszustände ohne jegliche Kreislaufsymptomatik als „Unfallschock“.
12.2.1 Ursachen
Wesentlicher Faktor im Schockgeschehen ist die Verringerung der arteriellen Blut- und Sauerstoffzufuhr. Ursächlich hierfür können sein:
-
Abnahme des intravasalen Volumens (z. B. bei Blutungen oder bei Flüssigkeitsverlust)
-
Beeinträchtigung der Pumpleistung des Herzens (z. B. beim Herzinfarkt oder bei einer Lungenembolie)
-
reflektorische Blutumverteilung vom Arterien- in das Venensystem. Dadurch bleibt die intravasale Blutmenge zwar unverändert, für die arterielle Organdurchblutung steht jedoch ein stark reduziertes Volumen zur Verfügung. Man spricht von „relativem Volumenmangel“.
Merke
Häufigste Ursache für eine Schocksymptomatik in der Chirurgie ist die Blutung (sog. hämorrhagischer Schock.
Blutumverteilung In den Arterien herrscht normalerweise ein höherer Blutdruck (Hochdrucksystem) als in den Venen. Die Arterienwände sind deshalb dick und wenig dehnbar. Da der vom linken Ventrikel erzeugte Blutdruck in den Arteriolen abnimmt, herrscht in den Venen nur noch etwa ¹⁄₁₀ des arteriellen Blutdrucks (Niederdrucksystem). Deshalb sind die Venenwände viel dünner gebaut, sie können sich leicht aufdehnen und große Volumina aufnehmen. Reize für eine Venenerweiterung sind verschiedene humorale und nervale Einflüsse (z. B. Azidose, Parasympathikuserregung, Schmerz). Dadurch vergrößert sich der Anteil der venösen Blutmenge, der arterielle Blutvorrat nimmt entsprechend ab.
Vom gesamten Blutvolumen eines Erwachsenen (ca. 5 Liter) befinden sich normalerweise nur 20 % im Arteriensystem, hingegen 80 % in den Venen. Diese werden deshalb auch „kapazitive“ Gefäße genannt, weil sie den Großteil der intravasalen Flüssigkeit beherbergen.
Krankhafte Zustände (z. B. Peritonitis) führen zu einer Erweiterung der Venen. Wenn sich bspw. der Blutinhalt in den Venen von 80 % auf 90 % erhöht, so muss die Blutmenge in den Arterien von ursprünglich 20 % auf 10 % abnehmen. Das zur Gewebeperfusion verfügbare arterielle Blut hat sich also um die Hälfte verringert. Dadurch kann eine ausreichende Organdurchblutung nicht mehr gewährleistet werden. Es resultiert ein Missverhältnis zwischen erforderlicher und vorhandener Blutversorgung, also ein Schock.
Schockformen Es werden verschiedene Schockformen hinsichtlich ihrer Ursache unterschieden ( ▶ Tab. 12.4 ).
|
Schockform |
Ursache |
Beispiel |
|
hämorrhagischer Volumenmangelschock |
äußere Blutung |
|
|
innere Blutung |
|
|
|
hypovolämischer Volumenmangelschock |
Verminderung des Kreislaufvolumens durch Flüssigkeitsverlust |
|
|
kardiogener Schock |
Die Förderleistung des Herzens nimmt akut ab, es resultiert eine unzureichende Versorgung der Organe mit Blut und Sauerstoff |
|
|
neurogener Schock |
Zentralnervöse Störungen führen zur Beeinträchtigung der Herzleistung bei gleichzeitiger reflektorischer Erweiterung des venösen Niederdrucksystems |
|
|
spinaler Schock |
arterielle Minderperfusion und/oder direkte mechanischer Schädigung des Rückenmarks |
|
|
anaphylaktischer Schock |
extreme allergische Reaktion auf eine bestimmte Substanz, bei immunologischer Disposition |
|
|
toxisch bedingter Schock |
Vergiftung |
|
|
septischer Schock (= Endotoxinschock) |
Infektion durch Toxine |
|
|
endokriner Schock |
Hormone |
|
12.2.2 Pathophysiologie des Schocks
Am Anfang des – wie eine Kettenreaktion ablaufenden – Schockgeschehens steht der Volumenverlust ( ▶ Abb. 12.7. Welche Grunderkrankung diese Situation verursacht hat, spielt für den weiteren Ablauf eine nur unwesentliche Rolle. Die Folgen sind weitgehend identisch und werden deshalb für alle Schockformen gemeinsam dargestellt.
Abb. 12.7 Pathophysiologie des Schocks.

Ein Schock verläuft in 3 Phasen. In jeder dieser zeitlich aufeinanderfolgenden Abschnitte versucht der Körper auf unterschiedliche Weise die drohenden Schockfolgen zu kompensieren:
-
Phase: Ökonomisierung der Herzarbeit, Mobilisierung der Blutreserven
-
Phase: Zentralisation
-
Phase: irreversible Organschäden
12.2.2.1 1. Phase: Ökonomisierung der Herzarbeit, Mobilisierung der Blutreserven
Die arterielle Minderperfusion kann in gewissen Grenzen durch die Steigerung der kardialen Leistung ausgeglichen werden. Dies geschieht durch eine Ökonomisierung der Herzarbeit:
-
Steigerung des Schlagvolumens
-
Steigerung der Herzfrequenz
Gleichzeitig verengen sich die Venen, wodurch ein Teil der venösen „Blutreserve“ im Niederdrucksystem mobilisiert und in die arterielle Zirkulation eingeschleust wird.
12.2.2.2 2. Phase: Zentralisation
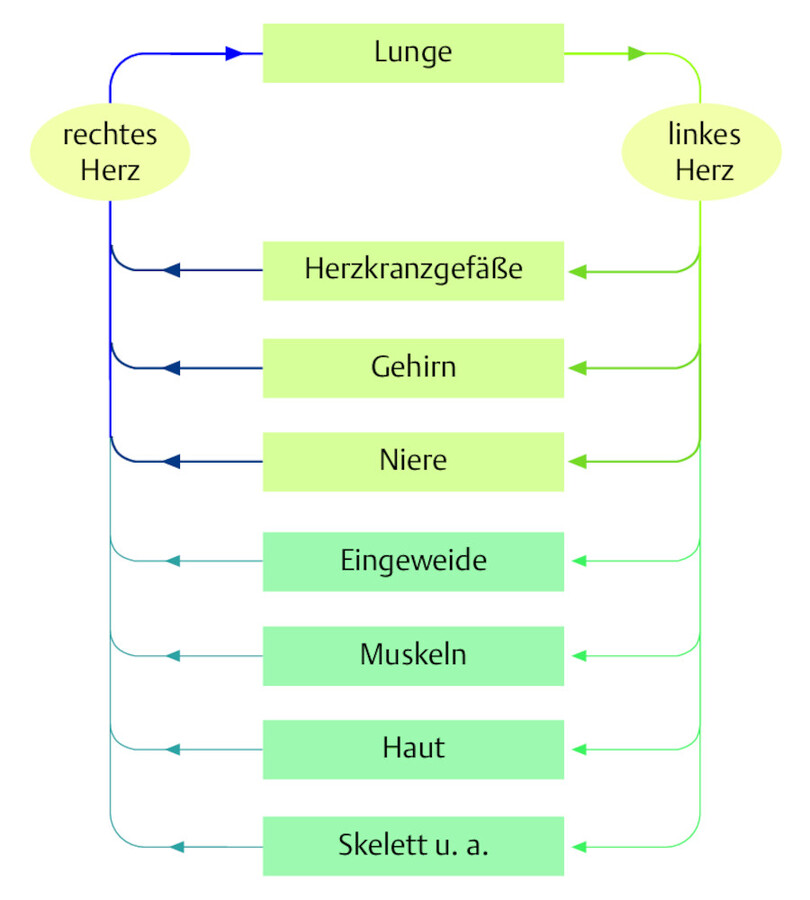
Reichen diese Kompensationsmechanismen für eine ausreichende Sauerstoffsättigung nicht aus, so muss der Körper einschneidendere Gegenmaßnahmen ergreifen: Er „schaltet“ unwichtigere Organsysteme von der Durchblutung weitgehend aus, um den lebenswichtigeren Organen mehr Blut zukommen zu lassen ( ▶ Abb. 12.8). Diesen Regelkreis nennt man „Zentralisation“.
Über lange Zeit ausreichend durchblutet bleiben dabei Herz, Lunge, Gehirn und Nieren (zentrale Organe). Hingegen wird die Blutzufuhr für Eingeweide, Muskeln und Haut durch Engstellung der entsprechenden Arteriolen gedrosselt (periphere Vasokonstriktion).
Die genannten Effekte beruhen auf einer starken Stimulierung des sympathischen Nervensystems (Sympathikusreiz), wobei Adrenalin (sog. „Notfall-“ oder „Stresshormon“) und andere Katecholamine aus den sympathischen Nervenendigungen und dem Nebennierenmark freigesetzt werden. Diese Schockphase entspricht pathophysiologisch einer maximalen „Stresssituation“.
Abb. 12.8 Zentralisation. Im Kreislaufschock ist die Durchblutung von Herz, Lunge, Gehirn und Nieren gegenüber den unwichtigeren Organen begünstigt.
12.2.2.3 3. Phase: irreversible Organschäden
Dauern die schockauslösenden Ursachen an, so können auch die zentralen Organe nicht mehr genügend perfundiert und mit Sauerstoff versorgt werden. Infolge dieser eingeschränkten Gewebedurchblutung werden die Zellen nicht ausreichend mit Sauerstoff und Nährstoffen (z. B. Glukose) versorgt. Gleichermaßen behindert ist der Abtransport von Kohlendioxid und anderen Stoffwechselprodukten. Folge ist eine Gewebeschädigung, die bei stärkerem Ausmaß irreversibel ist.
Wenn nicht spätestens in dieser Phase eine adäquate Behandlung einsetzt, entstehen irreversible Schäden an den lebenswichtigen Organen.
Der Vorgang beginnt mit einer Schädigung der Gefäßinnenwand (Endothel), die dadurch für kleinmolekulare Stoffe durchlässig wird (Permeabilitätsstörung der Kapillaren). Es resultiert ein Flüssigkeitsaustritt in die Gewebespalten (interstitielles Ödem). Die ödematöse Schwellung bewirkt wiederum eine Verschlechterung der Durchblutung (Mikrozirkulationsstörung), wodurch die O₂-Versorgung weiter reduziert wird (Hypoxie).
Bei einem Sauerstoffmangel werden die Energieträger (Glukose, Fette, Aminosäuren) in den Zellen nicht vollständig verbrannt, wodurch sich saure Stoffwechselprodukte (z. B. CO₂ und Milchsäure = Laktat) anhäufen und zu entsprechenden Veränderungen des pH-Wertes führen (metabolische Azidose).
Die dadurch bedingten Milieuänderungen im Schockgebiet verändern die Gerinnungsaktivität. Das geschädigte Gewebe setzt gerinnungsaktive Stoffe frei, wodurch das Blut leichter gerinnt (Hyperkoagulabilität). Als Folge bilden sich Blutgerinnsel in den kleinen Gefäßen (Mikrothromben). Die Thromboseneigung kann sich auf den gesamten Organismus ausdehnen, weshalb man dann von einer disseminierten intravasalen Gerinnung spricht. In einem solchen Fall werden alle verfügbaren Gerinnungsfaktoren (besonders Fibrinogen) „verbraucht“, sodass – trotz disseminierter Thrombusbildung – eine erhöhte Blutungsneigung besteht. Dies nennt man Verbrauchskoagulopathie.
Zusammenfassend stellt das Schockgeschehen einen komplizierten Vorgang dar, der bei fehlender Intervention wie eine Kettenreaktion abläuft. Das Fatale dabei ist, dass die schockbedingte Minderperfusion im Organismus Veränderungen hervorruft, die zu einer weiteren Verschlechterung der verbliebenen Gewebeperfusion führen.
Zusatzinfo
Ein solcher „Teufelskreis“ wird in der Medizin als Circulus vitiosus bezeichnet, weil die einzelnen Störungen sich wechselseitig verstärken.
12.2.3 Schockbedingte Organschäden
Haut und Muskeln nehmen bei einem Kreislaufschock praktisch nie Schaden. Sie können bekanntlich bei Extremitätenoperationen in „Blutsperre“ 2 Stunden oder länger ohne jegliche arterielle Durchblutung tolerieren.
Niere, Lunge, Gehirn und Herz reagieren dagegen besonders anfällig auf eine Minderperfusion. Deshalb konzentriert der Organismus im Schock durch „Zentralisation“ das zirkulierende Blutvolumen so lange wie möglich auf diese lebenswichtigen Organe.
Niere Für eine ausreichende Urinproduktion muss in den Nierenarterien ein systolischer Blutdruck von ca. 80 mmHg herrschen bzw. ein mittlerer arterieller Druck (MAD) von > 65 mmHg. Bei geringerem Blutdruck kann die Harnausscheidung drastisch abnehmen (Oligurie: unter 400 ml/Tag) oder ganz sistieren (Anurie). Man spricht dann von einer Schockniere, die eine spezielle Form des akuten Nierenversagens darstellt.
Bei schneller Behebung der Schocksymptomatik kann sich die Niere innerhalb von Tagen erholen. Oftmals schließt sich dann eine polyurische Phase an.
Merke
Die Niere ist das empfindlichste und das am häufigsten betroffene Schockorgan.
Lunge Auch die Lunge ist bei einem Schock häufig betroffen (Schocklunge). Das Ausmaß der Schädigung macht sich jedoch oft erst Stunden bis Tage nach dem Schockereignis bemerkbar.
Ursache ist der Flüssigkeitsaustritt in das Lungenparenchym (interstitielles Ödem) aufgrund der Endothelschädigung. Durch die ödematöse Schwellung ist der Gasaustausch zwischen Alveolen und Kapillaren (verlängerte Diffusionsstrecke) deutlich erschwert. Die Folge ist eine unzureichende Sauerstoffsättigung des Blutes mit klinischen Zeichen der respiratorischen Insuffizienz. In schweren Fällen muss eine künstliche Beatmung erfolgen.
Gehirn Schockbedingte zerebrale Ausfälle sind seltener, weil die Hirngefäße bei vermindertem Blutangebot kaum mit Vasokonstriktion reagieren.
Herz Im Rahmen der „Zentralisation“ kommt es zu einer Begünstigung der Herzdurchblutung. Bei Dekompensation dieser Mechanismen kommt es zur Vasokonstriktion der Koronargefäße. Der Energiebedarf des Myokards kann dann nicht mehr gedeckt werden.
Diese Veränderungen führen zu einem hypoxischen Herzmuskelschaden, der sich in Rhythmusstörungen und nachlassendem Schlagvolumen äußert und letztlich zum Kreislaufstillstand führt.
12.2.4 Schocksymptome
Typische Frühsymptome sind Unruhe, kalter Schweiß und Übelkeit. Die Symptome des manifesten Schocks sind durch die Zentralisation bedingt ( ▶ Abb. 12.8).
Pflege
Pulskontrolle. Man palpiert beim Schockpatienten möglichst zentrale, rumpfnahe Arterien (A. carotis oder A. femoralis), um Pulsfrequenz und Pulsqualität zu prüfen.
Zeichen der Kreislaufdekompensation Diese treten auf, wenn der Sparmechanismus der Zentralisation zur Perfusion der lebenswichtigen Organe nicht mehr ausreicht:
-
Zunehmende Tachykardie.
-
Tachypnoe: Die Atmung wird schneller, weil das Sauerstoffdefizit zunimmt. Dabei kann sich die Atemfrequenz von etwa 12 (Normalwert) auf 30–40 Atemzüge/Min. steigern. Der Gasaustausch wird dadurch aber nicht in gleichem Maße verbessert, weil die Luft bei hohen Atemfrequenzen „hin und her pendelt“, ohne dass eine ausreichende Diffusion ins Lungenparenchym erfolgen kann (Totraumventilation).
-
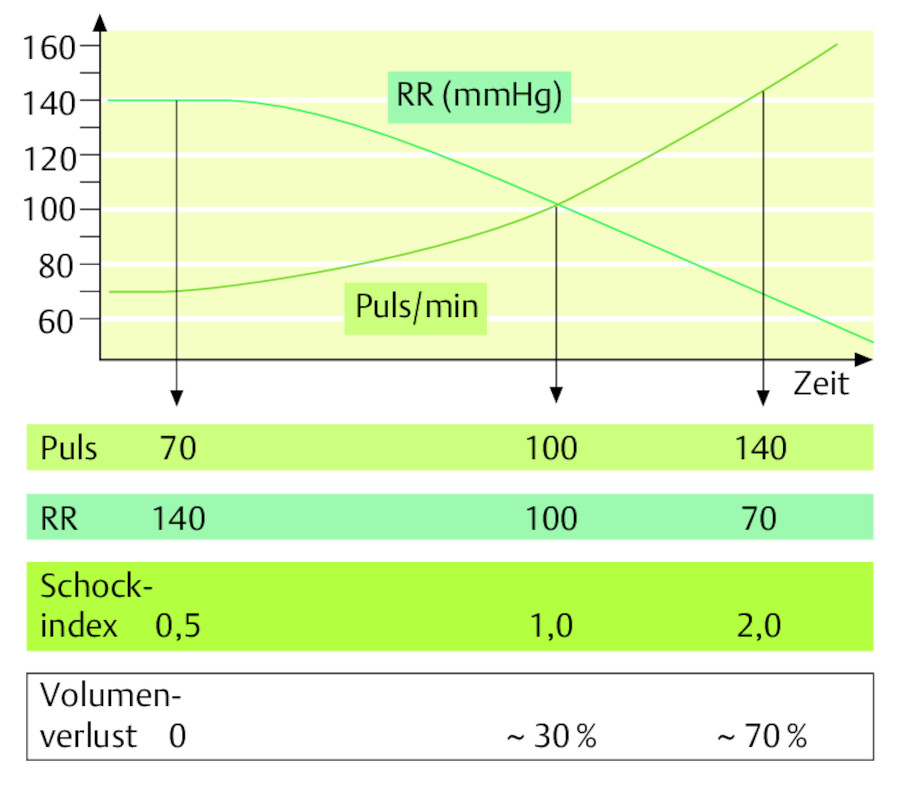
Tachykardie bei Hypotonie (Schockindex): Der Quotient aus Pulsfrequenz und systolischem Blutdruck wird als Schockindex bezeichnet. Der Wert ist zur groben Schätzung des verlorenen Blutvolumens geeignet ( ▶ Abb. 12.9). Der Blutdruck bleibt bei jüngeren Patienten länger stabil als die Pulsfrequenz.
-
Abnahme der Urinproduktion: Mit zunehmendem Blutdruckabfall reicht die Nierenperfusion zur Harnfiltration nicht mehr aus. Schon mit Beginn der Zentralisation kann die Ausscheidung abnehmen (Oligurie), bei ausgeprägter Hypotonie mit systolischen Werten um 60–80 mmHg wird kein Urin mehr produziert (Anurie).
Zusatzinfo
Mit zunehmender Sauerstoffverarmung und metabolischer Entgleisung kommt es letztlich zum multiplen Organversagen (MOV), wobei der Tod durch einen hypoxisch bedingten Herzstillstand eintritt.
Abb. 12.9 Schockindex. Puls- und Blutdruckkurve verhalten sich beim Schockpatienten gegenläufig. Der Quotient aus Puls (pro Minute) und systolischem Blutdruck (mmHg) ergibt den Schockindex (normal: 0,5). Der Schockindex erlaubt eine grobe Schätzung des verlorenen Blutvolumens.
12.2.5 Therapie des Schocks
Pflegepraxis
Notfallmaßnahmen. Bei einem Patienten mit Schocksymptomatik müssen alle Maßnahmen möglichst schnell ergriffen werden, weil bei verzögerter Behandlung die Gefahr einer irreversiblen Organschädigung besteht.
Ursache beseitigen Die ursächliche Verletzung oder Erkrankung sollte baldmöglichst behoben werden. Das gilt besonders für die Beseitigung der Blutungsquelle beim hämorrhagischen Schock.
Eine innere Blutung (z. B. stumpfes Bauchtrauma mit abdomineller Organverletzung) erfordert so schnell wie möglich die operative Behandlung durch Laparotomie! Bei einer Milzruptur kann der Patient schon nach einer Stunde verblutet sein.
Volumensubstitution Entscheidend für die Überlebenschancen bei Volumenmangelschock ist die rechtzeitige intravenöse Verabreichung einer ausreichenden Flüssigkeitsmenge. Nach ärztlicher Anordnung werden Plasmaexpander, Elektrolytlösungen oder Bluttransfusionen gegeben.
Medikamente Weil die Blutzirkulation im Schock beeinträchtigt ist, werden Medikamente möglichst intravenös injiziert.
Merke
Die orale Medikamentenapplikation ist im Schock kontraindiziert.
Lagerung Die Lagerung eines Patienten in einer Notfallsituation richtet sich nach
-
der Diagnose (z.B. Schädel-Hirn-Trauma, kardiogener Schock, Lungenödem),
-
der Bewusstseinslage (z.B. ansprechbar, bewusstlos, somnolent) und
-
dem Umfeld (klinisches Umfeld, Patientenbett, außerklinisches Umfeld).
Die Schocklagerung ( ▶ Abb. 12.10a.) unterstützt den venösen Rückfluss und damit die Durchblutung der lebensnotwendigen Organe. Diese Lagerung wird häufig bei Schocksymptomen oder bei einem akuten Blutdruckabfall eingesetzt.
Im außerklinischen Umfeld sollte ein bewusstloser Patient, der spontan atmet, in die stabile Seitenlage gebracht werden ( ▶ Abb. 12.10b). In dieser Lage ist die Gefahr einer Aspiration durch Erbrechen am geringsten.
Patienten mit einem Schädel-Hirn-Trauma (oder auch nur der Verdacht darauf) müssen immer mit leicht erhöhtem Oberkörper (30°) gelagert werden, um den Hirndruck zu senken bzw. ihn nicht zusätzlich zu steigern. Daneben ist die achsengerechte (gerade) Positionierung des Kopfes, zum besseren venösen Rückfluss, sehr wichtig.
Weitere Lagerungen und Indikationen sind der ▶ Abb. 12.10 zu entnehmen.
Abb. 12.10 Lagerung bei Notfallpatienten.
Abb. 12.10a Schocklage: Kopf tief, Beine hoch (z.B. bei Volumenmangelschock, kardiogenem Schock).
(Foto: W. Krüper, Thieme)
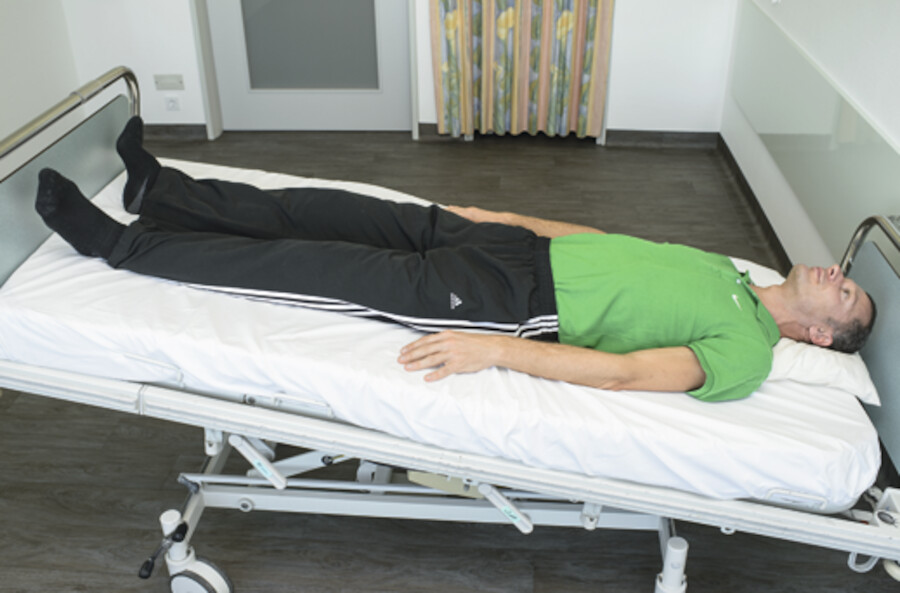
Abb. 12.10b Stabile Seitenlage: als Sofortmaßnahme bei bewusstlosen Patienten (meist im außerklinischen Umfeld).
(Foto: W. Krüper, Thieme)

Abb. 12.10c Herzbettlagerung: Oberkörper hoch, Beine tief (z.B. beim Lungenödem, Dyspnoe).
(Foto: W. Krüper, Thieme)

Abb. 12.10d Bauchdeckenentspannte Lagerung: Knierolle und Kopfpolster (z.B. beim Abdominaltrauma).
(Foto: W. Krüper, Thieme)
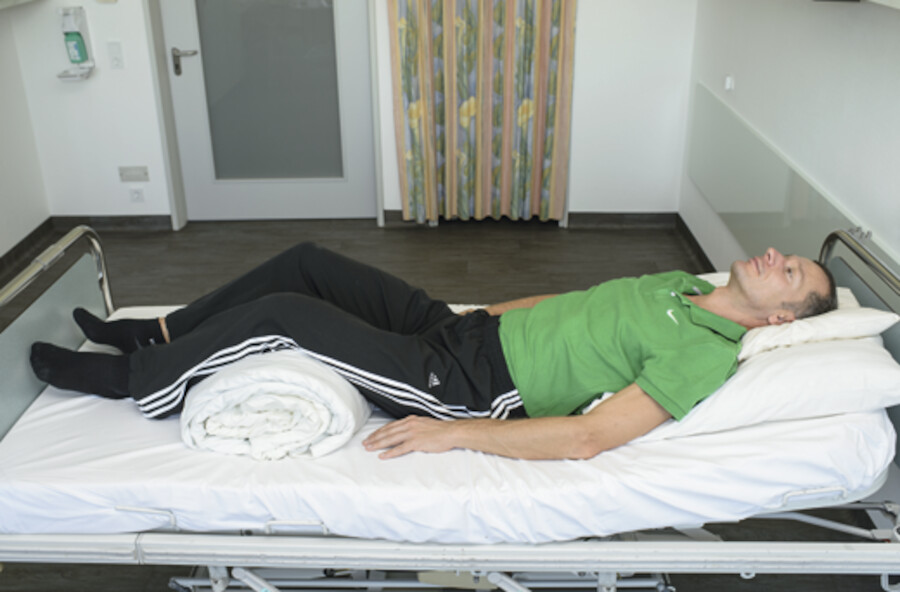
Abb. 12.10e Oberkörperhochlagerung: Oberkörper erhöht auf ca. 30° (z.B. beim Schädel-Hirn-Trauma).
(Foto: W. Krüper, Thieme)
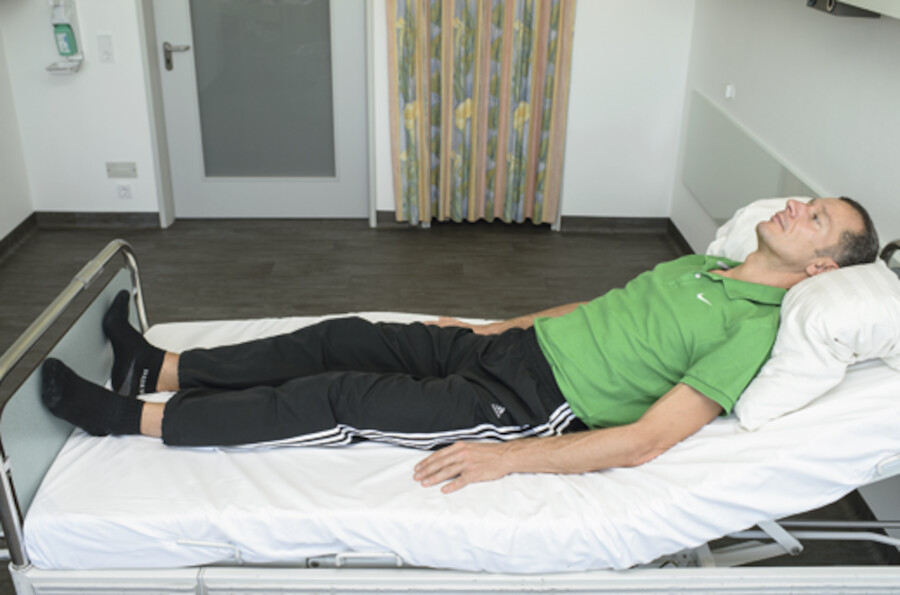
Abb. 12.10f Flachlagerung (z.B. bei Wirbelsäulentrauma).
(Foto: W. Krüper, Thieme)

12.3 Pflegeschwerpunkt: Schock
Die Pflegekraft ist dem Patienten meist am nächsten und wird so die Schocksymptome oftmals als Erste erkennen. Besteht bei einem Patienten eine Schocksymptomatik, ist dies immer ein Notfall. Der behandelnde Arzt sowie ein Notfallteam sind unverzüglich zu informieren. Der Patient ist sofort in eine entsprechende ▶ Lagerung zu bringen, je nach Kreislauf- und Bewusstseinszustand. Dem Patienten wird Sauerstoff verabreicht (wenn möglich 100 %), um die Gewebehypoxämie zu mindern.
Ist eine Reaktion auf Medikamente als Schockursache nicht auszuschließen, werden alle Infusionen und Transfusionen sofort gestoppt. Blutdruck und Puls sind engmaschig zu kontrollieren und, sofern noch nicht vorhanden, eine Venenverweilkanüle ist zu legen. Alle Maßnahmen werden mit der notwendigen Ruhe durchgeführt, um den Patienten nicht weiter zu ängstigen und somit die Symptomatik zu verstärken. Die weitere Behandlung erfolgt entsprechend der Ursache bzw. den auslösenden Faktoren.
Vitalparameter Bei jedem Patienten im Schock werden auch im Verlauf die Vitalparameter engmaschig kontrolliert. Hier ist zu beachten, dass der systolische Blutdruck nicht < 80 mmHg liegen bzw. der mittlere arterielle Druck nicht < 50 mmHg abfallen sollte, um die Organperfusion zu gewährleisten. Die Herzfrequenz gibt Aufschluss über das zirkulierende Blutvolumen. Eine hohe Herzfrequenz ist ein Indiz dafür, dass weiter Volumen verabreicht werden sollte. ß-Blocker können diesen Volumenmangel verschleiern (Herzfrequenz ist niedrig trotz Volumenmangel im Körper).
Atmung Solange das Schocksyndrom besteht, erhält der Patient Sauerstoff.
Ausscheidung Zur Überwachung der Diurese wird ein Blasendauerkatheter mit kontinuierlicher Harnableitung benutzt. Die Ausscheidung sollte 0,5–1,0 ml/kg/KG nicht unterschreiten.
Blutgerinnung Bei einer Blutung und daraus resultierendem Schock kommt es zum Verbrauch von Gerinnungsfaktoren. Ebenfalls kann die Blutgerinnung durch den Verdünnungseffekt der Volumensubstitution mit Plasmaexpandern stark beeinträchtigt werden. Starke Kälte oder hohe Temperaturen beeinflussen ebenfalls unser Gerinnungssystem. Befindet sich ein Patient im Schock, sind die Gerinnungsparameter laborchemisch zu überprüfen. Die wichtigsten Laborparameter sind:
-
Blutgruppe/Kreuzprobe
-
Hämoglobin/Hämatokrit
-
Serumelektrolyte
-
CK-MB/Troponin (bei kardialem Schockgeschehen)
-
Gerinnungsstatus (mit D-Dimere bei Verdacht auf Lungenembolie)
-
Blutkultur und CRP (bei septischem Schockgeschehen)
Zusatzinfo
Das Ziel bei jeder Form des Schocks ist es, die Herz-Kreislauf-Situation wiederherzustellen und somit die Organperfusion und die Versorgung mit Sauerstoff zu sichern.
12.4 Gastrointestinale Blutung
Definition
Als gastrointestinale Blutung (GI-Blutung) bezeichnet man eine Blutung in das Lumen des Magen-Darm-Traktes.
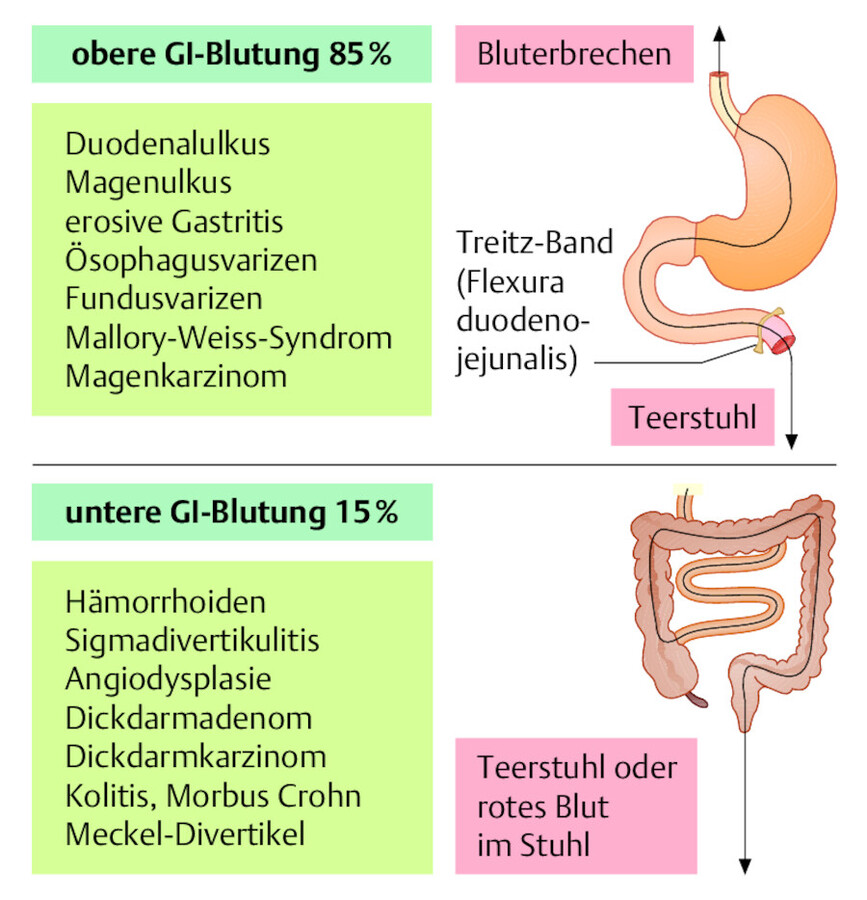
Ursache und Lokalisation Eine GI-Blutung entsteht durch Schleimhautläsionen verschiedenster Art ( ▶ Abb. 12.11). Nach der Lokalisation der Blutungsquelle unterscheidet man:
-
obere GI-Blutung (Ösophagus, Magen, Duodenum)
-
untere GI-Blutung (übriger Dünndarm, Dickdarm, Enddarm)
Anatomische Grenze zwischen oberer und unterer GI-Blutung ist die Flexura duodenojejunalis (= Biegung zwischen Duodenum und Jejunum), hier liegt auch das sog. Treitz-Band.
Zusatzinfo
Die obere GI-Blutung ist 6-mal häufiger als die untere. Häufigste Blutungsquelle überhaupt ist das Duodenalgeschwür (Kap. ▶ 22.3.1).
Abb. 12.11 Gastrointestinale Blutung. Die wichtigsten Blutungsquellen bei oberer und unterer GI-Blutung entsprechend ihrer klinischen Häufigkeit.
Symptome Massiver und akuter Blutverlust kann zum hämorrhagischen Schock mit Hb-Abfall, Tachykardie und Blässe führen.
Eine Anämie entwickelt sich, wenn über einen längeren Zeitraum nur geringe Blutmengen verloren werden (chronischer Blutverlust, z. B. bei Magen- oder Kolonkarzinom). Die subjektiven Beschwerden sind trotz hochgradiger Anämie oft erstaunlich gering.
Obere gastrointestinale Blutung Eventuell besteht Bluterbrechen(= Hämatemesis). Das Blut erscheint bei massiver Blutung hellrot. Bei längerer Verweildauer des Blutes im Magen ist es durch die Säureeinwirkung bräunlich-schwarz verfärbt. Man spricht dann von „kaffeesatzartigem Erbrechen“. Das in den Dünndarm abfließende Blut tritt (mit zeitlicher Verzögerung) als „Teerstuhl“ (= Meläna) zutage. Die schwarze Farbe des Teerstuhls ist durch Hämatin bedingt, das infolge enzymatischer Zersetzung während der Darmpassage aus Hämoglobin entsteht.
Untere gastrointestinale Blutung Bei der unteren GI-Blutung erfolgt der Blutabgang ausschließlich mit der Stuhlpassage. Eine Blutentleerung nach oben (Bluterbrechen) gibt es nicht. Die Farbe des Stuhls lässt gewisse Rückschlüsse auf die Höhe der Blutungsquelle zu: je dunkler der Stuhl, desto höher die Blutung.
Pflegepraxis
Stuhlverfärbung. Als Faustregel gilt:
-
schwarzer Stuhl = obere GI-Blutung
-
dunkelroter Stuhl = Blutung aus Dünndarm oder rechtem Kolon
-
hellroter Stuhl = Blutung aus linkem Kolon oder Enddarm
Aussagen über die Blutungslokalisation anhand der Stuhlfärbung sind jedoch unsicher, weil der chemische Aufbau des Blutfarbstoffs auch von der Blutungsstärke und Verweildauer im Darm abhängt.
Diagnostik Weil die Mehrzahl aller GI-Blutungen aus dem oberen Intestinaltrakt stammt (85 %), erfolgt bei unklarer Blutungsquelle immer eine Gastroskopie. Findet sich bei der Gastroskopie keine Blutungsquelle, so muss weitere Diagnostik erfolgen, z.B. Koloskopie, CT, Angiografie.
Therapie Bei einer kreislaufwirksamen akuten Blutung muss eine sofortige Infusion erfolgen. In den meisten Fällen ist eine Blutstillung auf endoskopischem Wege möglich. Zur Verfügung stehen die lokale Injektion (z.B. mit Adrenalin oder Fibrin), thermische Verfahren (z.B. Elektrokoagulation oder Laser) und die mechanische Blutstillung (z.B. Gummibandligatur oder Metallclips).
Auch die Embolisierung über einen von der Leistenarterie eingeführten Katheter mit Einbringen blutstillender Substanzen kommt infrage. Ansonsten bleibt die offen-chirurgische Therapie (z.B. Ulkusübernähung, Darmresektion).
12.5 Intraabdominelle Blutung
Definition
Eine intraabdominelle Blutung (Hämaskos) ist eine Blutung in die freie Bauchhöhle.
Ursache und Symptome Die wichtigsten Ursachen für eine intraabdominelle Blutung sind:
-
Postoperative Nachblutung: Dies ist die häufigste Ursache für eine Blutansammlung in der Peritonealhöhle. Sie kommt durch Abrutschen oder Aufgehen einer Gefäßunterbindung zustande.
-
Stumpfes Bauchtrauma: Hier kommt es zu traumatisch bedingten Organzerreißungen, die meist Milz oder Leber betreffen.
-
Spontanrupturen innerer Organe sind seltener. Voraussetzung ist eine vorbestehende krankhafte Veränderung wie z.B. beim Bauchaortenaneurysma.
Pflegepraxis
Beobachtung. Bei postoperativen Patienten ist ein stärkerer Blutverlust aus Drainagen (über 200 ml in der ersten Stunde) ein leicht erkennbares und untrügliches Zeichen einer Nachblutung, weshalb Sie sofort den Arzt verständigen müssen.
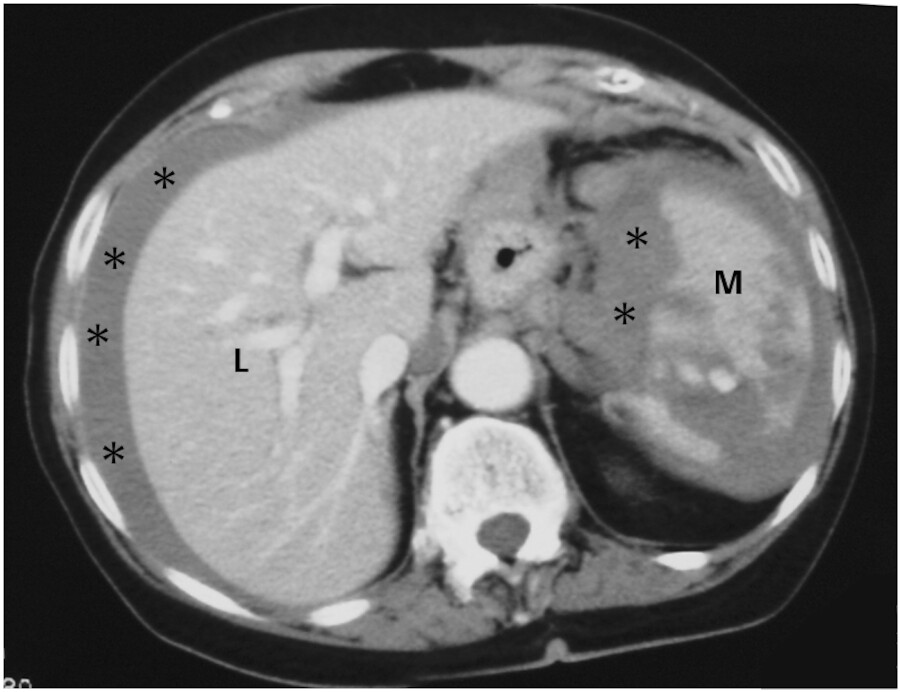
Diagnostik und Therapie Eine intraabdominelle Blutung ist im CT besser zu sehen als in der Sonografie ( ▶ Abb. 12.12). Möglichst erfolgt eine laparoskopische oder interventionelle Maßnahme, wie z.B. der endovaskuläre Stent beim rupturierten Aortenaneurysma. Ansonsten ist die Laparotomie mit operativer Blutstillung erforderlich. Bis dahin wird der Volumenverlust durch Infusionen und ggf. Transfusionen unter fortlaufender Kreislauf- und Hb-Kontrolle ersetzt.
Pflegepraxis
Beobachtung. Die traditionelle Messung des Bauchumfanges ist diagnostisch wenig zuverlässig.
Abb. 12.12 Intraabdominelle Blutung. Das CT zeigt freies Blut (*) in der Bauchhöhle. Ursache ist eine Milzverletzung (M) durch ein stumpfes Bauchtrauma (L: Leber).
12.6 Akutes Abdomen
Definition
Das „akute Abdomen“ („akuter Bauch“) ist ein Sammelbegriff für verschiedene Krankheitsbilder, die eine akut bedrohliche, meist mit Schmerzen einhergehende Situation in der Bauchhöhle hervorrufen.
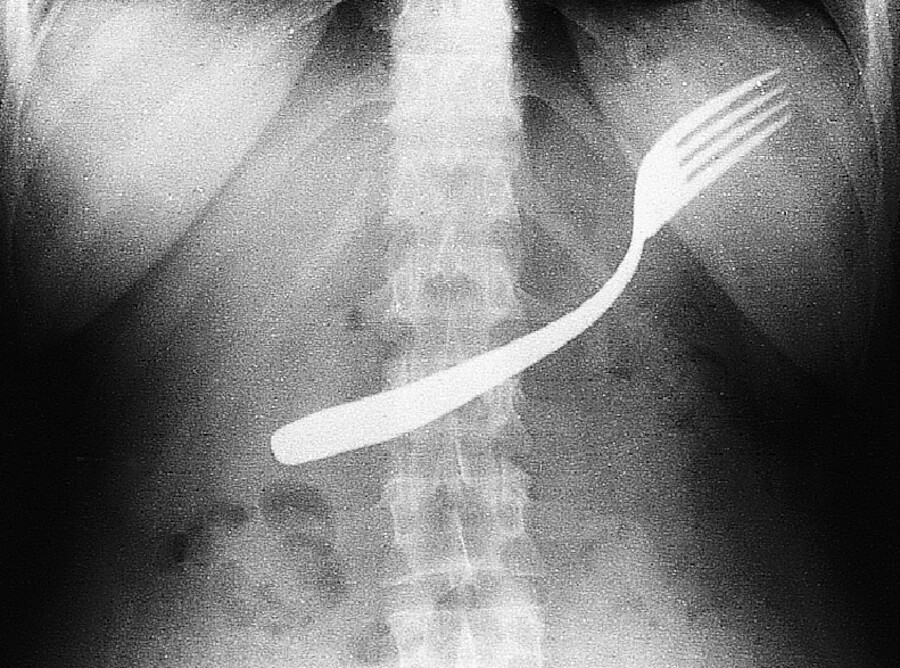
Das akute Abdomen ( ▶ Abb. 12.13) erfordert sofortiges diagnostisches und therapeutisches Handeln. Meist ist eine chirurgische Behandlung erforderlich.
Abb. 12.13 Akutes Abdomen. Magenperforation durch eine Gabel, die in suizidaler Absicht verschluckt wurde.
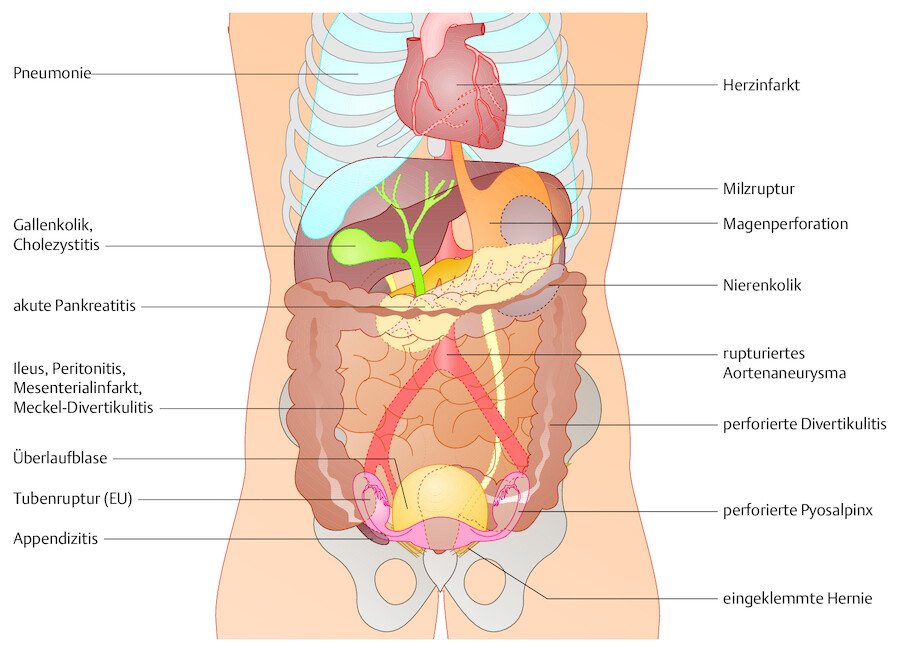
Ursache Die wichtigsten Ursachen eines akuten Abdomens können Sie der ▶ Tab. 12.5 entnehmen.
|
Ursache |
Querverweis |
|
Entzündung von Organen in der Bauchhöhle, z. B.: |
|
|
Kap. ▶ 23.3.1 |
|
Kap. ▶ 25.2.3 |
|
Kap. ▶ 26.2 |
|
Perforation von Hohlorganen, z. B.: |
|
|
Kap. ▶ 23.3.1 |
|
Kap. ▶ 22.3.2 |
|
Kap. ▶ 23.3.5 |
|
Kap. ▶ 25.2.5 |
|
Zirkulationsstörung, z. B.: |
|
|
Kap. ▶ 29.1.1 |
|
Kap. ▶ 12.7 |
|
Kap. ▶ 23.4.1 |
|
Steineinklemmung, z. B.: |
|
|
Kap. ▶ 27.2.3 |
|
Kap. ▶ 25.2.1 |
|
stumpfes Bauchtrauma, z. B.: |
|
|
Kap. ▶ 26.6.1 |
|
Kap. ▶ 25.4 |
|
Kap. ▶ 27.3 |
|
sonstige Blutungen in die Bauchhöhle oder in den Magen-Darm-Trakt, z. B.: |
|
|
Kap. ▶ 31.4.1 |
|
Kap. ▶ 12.4 |
Zusatzinfo
Auch „nichtchirurgische“ Prozesse außerhalb der Bauchhöhle können die Symptomatik eines akuten Abdomens vortäuschen (z. B. Herzinfarkt, basale Pneumonie, entgleister Diabetes mellitus).
Abb. 12.14 Akutes Abdomen. Die wichtigsten ursächlichen Krankheitsbilder.
Symptome Das akute Abdomen ist charakterisiert durch:
-
Bauchschmerzen (Dauerschmerz, krampfartiger Schmerz oder Kolik)
-
Abwehrspannung der Bauchmuskeln („harter Bauch“)
-
Erbrechen (oder Brechreiz)
-
Kreislaufsymptome (evtl. Schock)
Diagnostik Anamnese und körperliche Untersuchung geben Hinweise auf die ursächliche Krankheit, wobei besonders Charakter und Lokalisation des Bauchschmerzes von Bedeutung sind. Das Ausmaß erforderlicher Laboruntersuchungen wird in den Kliniken heute unterschiedlich gehandhabt. Ein sinnvolles Beispiel zeigt ▶ Tab. 12.6 .
Pflegepraxis
Eine Temperaturdifferenz von mehr 0,5 °C zwischen rektalem und axillärem Wert kann auf einen Entzündungsprozess im Becken hinweisen (z. B. Appendizitis).
|
Laborwert |
Fragestellung |
|
kleines Blutbild |
Blutung (Hb), Entzündung (Leukozyten) |
|
C-reaktives Protein (CRP) |
Entzündungsvorgänge |
|
Lipase oder Amylase |
Pankreatitis |
|
Kreatinin |
Nierenfunktion |
|
Elektrolyte |
Stoffwechselentgleisung |
|
Blutzucker |
diabetische Entgleisung |
|
Laktat |
Darmischämie |
|
Urinsediment |
Ureterstein (Mikrohämaturie) |
|
Troponin und EKG |
Herzinfarkt |
Die beim akuten Abdomen ehemals dominierende „Abdomenleeraufnahme“ (Röntgenaufnahme ohne Kontrastmittel) ist durch die Sonografie und die Computertomografie abgelöst worden, weil diese Untersuchungsmethoden eine bessere Differenzialdiagnose ermöglichen. Diese Verfahren zeigen krankhafte Organveränderungen, wie z. B. vergrößerte Appendix, Gallenblasensteine, Aortenaneurysma ( ▶ Abb. 12.15).
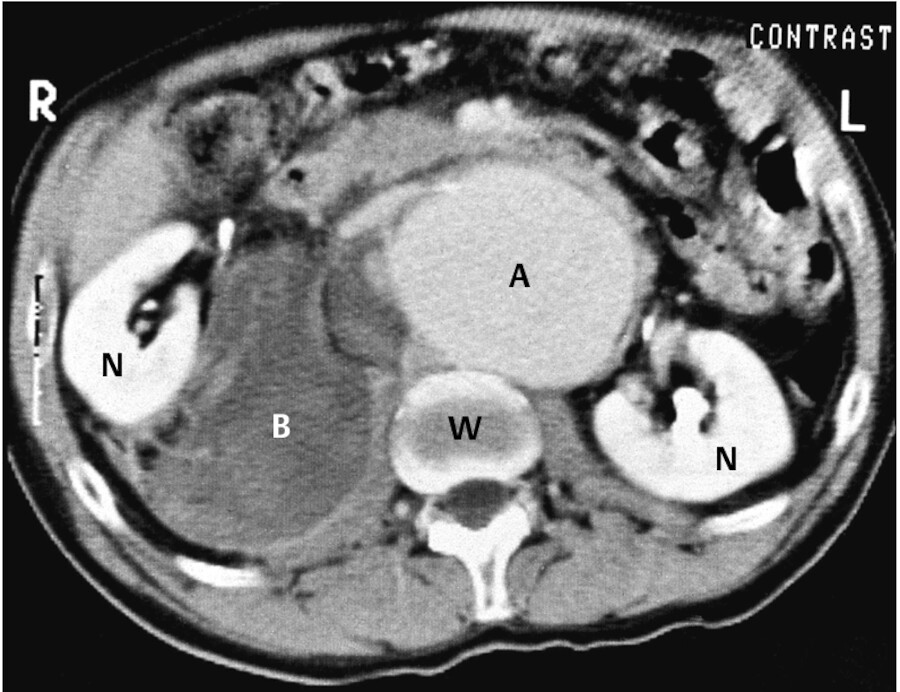
Abb. 12.15 Akutes Abdomen. Das CT zeigt ein rupturiertes Aortenaneurysma, A: erweiterte Aorta, B: Blutung, N: Niere, W: Wirbelkörper.
Therapie Die Behandlung richtet sich nach der Grunderkrankung ( ▶ Tab. 12.5 ).
Pflegepraxis
Ernährung. Bis zur Klärung des therapeutischen Vorgehens bleibt jeder Patient mit akutem Abdomen nüchtern.
12.7 Ileus
Definition
Ein Ileus ist eine Darmpassagestörung. Üblicherweise wird der Begriff „Ileus“ (griech.: Verdrehung, Verwindung) mit „Darmverschluss“ gleichgesetzt.
12.7.1 Ursachen
Man unterscheidet 2 Ileusformen:
-
Mechanischer Ileus: Die Ursache der Darmpassagestörung ist ein mechanisches Hindernis innerhalb oder außerhalb des Darmlumens.
-
Paralytischer Ileus: Hier ist die Ursache eine Lähmung der Darmmuskulatur.
Merke
Der Ileus gehört zu den gefährlichsten Erkrankungen im Bauchraum.
Insgesamt ist die Passagestörung ( ▶ Tab. 12.7 ) häufiger im Dünndarm als im Dickdarm lokalisiert (Dünndarmileus 80 %, Dickdarmileus 20 %).
12.7.1.1 Mechanischer Ileus
Obturationsileus Der Obturationsileus ist ein mechanischer Darmverschluss, der durch Einengung der Darmlichtung von innen oder außen bedingt ist.
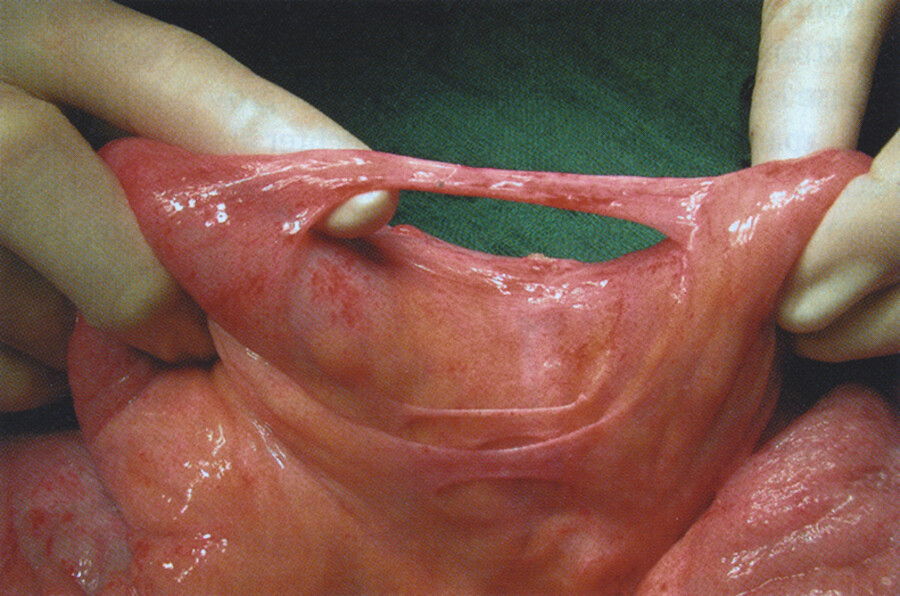
Nach jeder Operation in der Bauchhöhle können sich Verwachsungen (Adhäsionen) zwischen den Darmschlingen entwickeln oder narbige Stränge (Briden) bilden, wodurch das Darmlumen eingeengt wird ( ▶ Abb. 12.16). Der postoperative Adhäsions- oder Bridenileus kann bereits wenige Tage nach einer Bauchoperation auftreten, aber auch nach Monaten oder Jahren. Hat der Patient bereits mehrere abdominelle Voroperationen durchgemacht, so steigt die Wahrscheinlichkeit, dass er später einen Adhäsions- oder Bridenileus bekommt. Auch nach einer Peritonitis (z. B. bei perforierter Appendizitis) steigt das Risiko, später einen Ileus zu entwickeln.
Weitere wichtige Ursachen des Obturationsileus können Sie der ▶ Tab. 12.7 entnehmen.
Abb. 12.16 Bridenileus. Ein narbiger Bindegewebsstrang zwischen zwei Darmschlingen hat zum Darmverschluss geführt.
Strangulationsileus Hier besteht eine zusätzliche Beeinträchtigung der Darmwanddurchblutung durch Verdrehung oder Abschnürung der Mesenterialgefäße ( ▶ Tab. 12.7 ).
Merke
Die häufigsten Ursachen einer Ileussymptomatik sind abdominelle Voroperationen (meist Dünndarmileus) und Tumoren (meist Dickdarmileus).
|
Obturationsileus (ohne Störung der Durchblutung) |
Strangulationsileus (mit Störung der Blutzirkulation) |
|
|
12.7.1.2 Paralytischer Ileus
Bei dieser Form des Darmverschlusses ist die Darmlichtung nicht eingeengt. Die Stuhlpassage ist durch metabolische, toxische oder reflektorische Darmlähmung (Paralyse) behindert ( ▶ Tab. 12.8 ).
Zusatzinfo
Die häufigste Ursache des paralytischen Ileus ist die diffuse Bauchfellentzündung (Peritonitis).
|
Metabolisch |
Reflektorisch |
Toxisch |
|
Hypokaliämie |
|
|
12.7.2 Symptome
Die Symptomatik eines Darmverschlusses kann plötzlich als „akutes Abdomen“ in Erscheinung treten (z. B. bei eingeklemmter Hernie), sich jedoch auch schleichend und diskret ausbilden (z. B. bei stenosierendem Tumor), was man als „Subileus“ bezeichnet.
Wichtige Symptome eines Ileus:
-
Als Folge der Darmdilatation ist das Abdomen aufgetrieben (Meteorismus).
-
Der Darminhalt staut sich bis in den Magen, was zu kotigem Erbrechen führt (Miserere, wörtlich: „erbarme dich“).
-
Schmerzen durch krampfartige Darmkontraktionen (Hyperperistaltik bei mechanischem Ileus) mit einer evtl. gleichzeitig bestehenden Peritonitis. Oftmals entwickelt sich ein Ileus jedoch schmerzfrei.
-
Stuhl- und Windverhalt ist besonders typisch für den paralytischen Ileus.
Pflegepraxis
Beobachtung. Beim mechanischen Darmverschluss kann bei hoher Verschlusslokalisation (Dünndarmileus) durchaus normal Stuhlgang abgesetzt werden.
12.7.3 Diagnostik
Beim mechanischen Ileus ergibt die Auskultation kräftige Darmgeräusche (Hyperperistaltik), weil die Darmmuskulatur durch verstärkte Kontraktionen das Hindernis zu überwinden versucht. Man spricht bei einer solchen Stenoseperistaltik deshalb treffend von „metallischen“, „hochgestellten“ oder „klingenden“ Darmgeräuschen.
Beim paralytischen Ileus hingegen fehlen die Darmgeräusche völlig, weil die gesamte Peristaltik gelähmt ist („Totenstille“ im Abdomen).
Bei unklaren Bauchbefunden erfolgt ein CT des Abdomens.
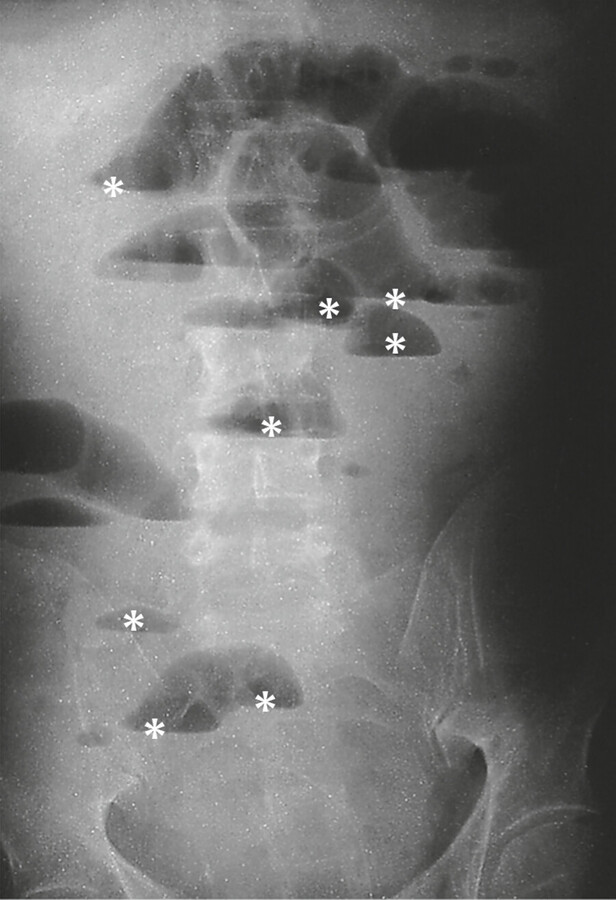
Die in manchen Kliniken noch übliche ▶ Röntgen-Leeraufnahme des Abdomens zeigt beim Ileus ein typisches Bild ( ▶ Abb. 12.17).
Beim mechanischen Ileus staut sich der Darminhalt vor dem Passagehindernis. In den dilatierten Darmschlingen proximal der Stenose trennen sich Darmgas und flüssige Stuhlbestandteile entsprechend ihrem spezifischen Gewicht. Die Gase steigen nach oben („stehende Schlingen“), während unten der flüssige Darminhalt in der Darmschlinge steht. Die horizontal verlaufende scharfe Grenze zwischen Luft und Flüssigkeit bezeichnet man als „Spiegel“.
Pflegepraxis
Darmentleerung. Beim mechanischen Ileus sind peristaltikfördernde Medikamente (z.B. Metoclopramid, Neostigmin) und Abführmaßnahmen (wie z.B. Darmeinläufe) kontraindiziert, da die Perforationsgefahr, durch die zunehmende Überdehnung der Darmschlingen, steigt.
Beim paralytischen Ileus hingegen sind Darmeinläufe und peristaltikfördernde Medikamente wichtige therapeutische Maßnahmen.
Abb. 12.17 Ileus. Typisches Röntgenbild ohne Kontrastmittel (Abdomenleeraufnahme im Stehen). Einige der horizontalen Spiegelbildungen (*) und stehenden luftgefüllten Darmschlingen (Pfeile) sind hervorgehoben.
12.7.4 Komplikationen
Volumenmangel Jeder Ileus entzieht dem Patienten Flüssigkeit, weil die in das Darmlumen sezernierten Sekrete (Magensaft, Galle, Pankreas- und Dünndarmsekret) nicht mehr rückresorbiert werden. Hinzu kommen die Verluste durch Erbrechen. Folge ist ein Volumenmangel (Dehydratation), der zu Bluteindickung, Oligurie und hypovolämischem Schock führen kann.
Durchwanderungsperitonitis Bei längerem Bestehen der Ileussituation kommt es zur bakteriellen Zersetzung (Autolyse) des gestauten Darminhalts, wodurch die Darmwand für Toxine und Bakterien durchlässig wird. Es kommt zur Toxineinschwemmung in den Kreislauf und zur Bauchfellentzündung (Peritonitis), was die Prognose drastisch verschlechtert.
12.7.5 Therapie
Patienten mit einem Ileus benötigen einen venösen Zugang. Über diesen kann zum einen Flüssigkeit substituiert und zum anderen können Medikamente appliziert werden, die oral nicht mehr vom Körper aufgenommen werden können.
Daneben ist häufig eine Magensonde infiziert, um den Magen-Darm-Trakt zu entlasten und somit die Beschwerden des Patienten (z.B. Übelkeit, Völlegefühl) zu lindern.
Pflegepraxis
Magensonde. Eine Magensonde kann nach Absprache mit dem Arzt bereits prophylaktisch gelegt werden, um dem Patienten das mögliche Erbrechen erträglicher zu machen. Zudem kann über eine Magensonde mit einer großlumigen Spritze gestautes Sekret vorsichtig abgesaugt werden.
Mechanischer Ileus Der mechanische Ileus stellt eine Indikation zur sofortigen Operation dar, die laparoskopisch oder offen chirurgisch erfolgt. Das Vorgehen richtet sich nach der Ileusursache. Im günstigsten Fall brauchen lediglich Verwachsungen gelöst zu werden (Adhäsiolyse oder Bridenlösung). Beim Strangulationsileus ist meist eine Darmresektion erforderlich.
Paralytischer Ileus Der paralytische Ileus wird möglichst konservativ behandelt (Einlauf und parenteral zugeführte darmstimulierende Medikamente).
12.8 Peritonitis
Definition
Eine Peritonitis ist eine diffuse oder lokale Entzündung des Bauchfells.
Ursachen Bei der bakteriellen Peritonitis gelangen Bakterien von einem kontaminierten Hohlorgan in die Bauchhöhle. Mögliche Ursachen:
-
Bakterielle Peritonitis:
-
Die häufigste Ursache ist eine Perforation eines Hohlorgans (z. B. perforierte Appendizitis, Magendurchbruch).
-
Postoperative Anastomoseninsuffizienz (ein „Leck“ bedingt durch eine aufgegangene Darmnaht).
-
Bei der Durchwanderungsperitonitis ist die Darmwand nicht komplett eröffnet, sondern durch Entzündung (z. B. Appendizitis), Ischämie (z. B. Strangulationsileus, Inkarzeration, Mesenterialinfarkt) oder einen Tumor derart geschädigt, dass sie für Bakterien durchlässig wird.
-
-
Chemische Peritonitis:
-
Blutung in Bauchhöhle
-
toxische Stoffe im Bauchraum
-
Meist ist die Entzündung lokal begrenzt (z. B. Unterbauchperitonitis bei Appendizitis, Oberbauchperitonitis bei Magendurchbruch). Verteilt sich das eitrige, bakterienhaltige Exsudat hingegen über die gesamte Bauchhöhle, so resultiert eine diffuse Peritonitis mit wesentlich schlechterer Prognose.
Diagnostik Bei der Diagnostik werden CT und Sonografie eingesetzt.
Symptome Die Peritonitis äußert sich als akutes Abdomen mit folgenden Symptomen:
-
Bauchschmerz
-
Abwehrspannung (bei Palpation):
-
Bei der lokalen Peritonitis findet sich eine lokalisierte Abwehrspannung.
-
Bei der diffusen Peritonitis ist das gesamte Abdomen „bretthart“ angespannt.
-
-
Als Folge der reflektorischen Darmlähmung entwickelt sich ein paralytischer Ileus (keine Peristaltik) mit aufgetriebenem Bauch (Meteorismus).
-
Erbrechen sowie Stuhl- und Windverhalt.
-
Fieber, Leukozytose und CRP-Erhöhung sind Zeichen der schweren Entzündung.
Zusatzinfo
Die diffuse Peritonitis ist ein lebensbedrohlicher Zustand. Die Letalität liegt bei 50 %.
Therapie Bei einer bakteriellen Peritonitis muss die Ursache operativ beseitigt werden (z. B. Appendektomie, Übernähung eines perforierten Ulkus). Dabei wird die Bauchhöhle intraoperativ gespült und mit Drainagen versehen. Meist entleert sich über die Drainagen für einige Tage noch etwas schmutzig graues Sekret. Die Drainagen können gezogen werden, wenn sie nichts mehr fördern.
In schweren Fällen müssen im Abstand von 1–2 Tagen mehrere Laparotomien erfolgen, um die sich neu bildenden Gewebenekrosen und Wundsekrete zu entfernen und auszuspülen („Spülbauch“). Dieses Vorgehen wird als programmierte Lavage, Etappenlavage oder geplante Relaparotomie bezeichnet.
Immer ist eine Infusionsbehandlung erforderlich. Bei drohendem Erbrechen mit der Gefahr der Aspiration erhält der Patient eine Magensonde.
Zusatzinfo
Als Spätkomplikationen können sich bei einer bakteriellen Peritonitis Abszesse in der Bauchhöhle bilden (z. B. Schlingenabszesse) oder ein verwachsungsbedingter Adhäsionsileus.
12.9 Polytrauma
Definition
Als Polytrauma (Mehrfachverletzung) bezeichnet man die Verletzung von zwei oder mehr Körperregionen oder Organsystemen, von denen mindestens eine Verletzung oder die Kombination mehrerer Verletzungen für den Patienten lebensbedrohlich ist.
Die meisten Polytraumen sind Folge eines Verkehrsunfalls.
12.9.1 Therapiephasen
Beim Polytrauma stellt sich das Problem, mit welcher Priorität die einzelnen Verletzungen behandelt werden sollen. Dazu ist es notwendig, dass man sich über die Dringlichkeit der Einzelverletzungen im Klaren ist und dementsprechend handelt.
Das praktische Vorgehen lässt sich in 3 Phasen einteilen, wobei die Dringlichkeit der Versorgung hinsichtlich des Überlebens des Patienten ausschlaggebend ist ( ▶ Abb. 12.18):
-
Phase 1: Reanimationsphase
-
Phase 2: Notoperationsphase
-
Phase 3: Stabilisierungsphase
Abb. 12.18 Polytrauma. Phasengerechtes Vorgehen bezüglich Diagnostik und Therapie nach Dringlichkeit der Verletzungen.

12.9.1.1 Phase 1: Reanimationsphase
In der Reanimationsphase stehen 2 Ziele im Vordergrund:
-
Sicherung der Vitalfunktionen
-
Diagnostik von akut lebensbedrohlichen Verletzungen
Die Versorgung des Patienten erfolgt in einem entsprechend ausgestatteten Notfallversorgungsraum (Schockraum). Die Lagerung bei Transport und im Schockraum richtet sich nach der im Vordergrund stehenden Verletzung ( ▶ Abb. 12.10).
Beim Polytrauma entscheiden häufig die ersten Minuten der Behandlung darüber, ob der Patient seine Verletzungen überlebt oder nicht. Daher ist ein sofortiger Therapiebeginn (möglichst schon am Unfallort) unumgänglich.
Sicherung der Vitalfunktionen
Freimachen der Atemwege Die Atemwege werden von Erbrochenem, Blut, Zahnprothese oder sonstigen Fremdkörpern freigemacht, was meist mit den Fingern gelingt. Um eine Verlegung im Rachenraum durch die zurückfallende Zunge zu verhindern, bedient man sich des Esmarch-Handgriffs ( ▶ Abb. 12.5). Bei Bedarf kann auch zusätzlich ein Guedel-Tubus gelegt werden. Bei anhaltender Ateminsuffizienz und/oder Bewusstlosigkeit wird intubiert und beatmet.
Schockbekämpfung Patienten, die eine Schocksymptomatik aufweisen, benötigen ausreichend Flüssigkeit. Meist wird vor Ort vom Notfallarzt zunächst ein peripherer Zugang gelegt. In der Klinik muss dann zeitnah ein großlumiger venöser Zugang (ZVK) gelegt werden. Zur Volumensubstitution finden Plasmaexpander und/oder Elektrolytlösungen Anwendung. Kalorische Infusionen sind bei der Schockbekämpfung nicht indiziert.
Spezielle Therapie
Je nach Verletzung werden unterschiedliche therapeutische Maßnahmen ergriffen ( ▶ Tab. 12.9 ).
|
Verletzung (Diagnose) |
Therapeutische Maßnahme |
Querverweis |
|
Pneumo- oder Hämatothorax |
baldmöglichst Bülau-Drainage |
|
|
Spannungspneumothorax |
sofortige Entlastung durch Punktionskanüle oder Bülau-Drainage |
Kap. ▶ 19.5.2 |
|
Herzbeuteltamponade |
sofortige Entlastung durch Perikardpunktion |
Kap. ▶ 20.4.5 |
|
arteriell spritzende Wunden |
Druckverband und evtl. operative Versorgung |
|
|
nicht blutende Wunden |
Wundversorgung zweitrangig |
Ein Patient mit einem Polytrauma muss immer an einen Überwachungsmonitor angeschlossen werden.
Pflegepraxis
Notfallmaßnahmen. Das Herz-Kreislauf-Monitoring muss unverzüglich erfolgen und sollte mindestens die Überwachung von EKG, Blutdruck und Pulsoxymetrie umfassen.
Das CT von Thorax und Abdomen lassen das Ausmaß der Verletzungen abschätzen. Bei Bewusstlosigkeit oder sonstiger neurologischer Symptomatik erfolgt zusätzlich ein Schädel-CT.
Pflegepraxis
Lagerung. Bis zur röntgenologischen Abklärung der gesamten Wirbelsäule ist jeder bewusstlose Patient so zu behandeln, als wenn eine Wirbelsäulenfraktur (Querschnittgefahr) vorliegen würde. Gerade beim Polytrauma werden Wirbelbrüche häufig übersehen.
Ausscheidung. Häufig ist das Legen eines transurethralen Blasenkatheters indiziert (z.B. bei kreislaufinstabilen, bei bewusstlosen Patienten oder bei Harnverhalt).
12.9.1.2 Phase 2: Notoperationsphase
Ziel in dieser Phase ist die operative Versorgung akut lebensbedrohlicher Verletzungen.
Die bisher genannten vorrangigen Maßnahmen sind erforderlich, um eine akute Lebensgefahr abzuwenden und sich anhand der Diagnostik über bestehende lebensbedrohliche Zustände zu orientieren. Seit Klinikaufnahme dürfte 1 Stunde vergangen sein. Optimalerweise hat sich die Schocksymptomatik verbessert, Blutkonserven sind gekreuzt und die Laborwerte liegen vor. Jetzt müssen dringliche operative Eingriffe durchgeführt werden.
Operatives Vorgehen Müssen mehrere Verletzungen operativ angegangen werden, so gibt es auch hier eine Behandlungsreihenfolge:
-
Dringlichkeitsstufe: Verletzungen des Thorax
-
Dringlichkeitsstufe: Verletzungen des Abdomens (intraabdominelle Blutung)
-
Dringlichkeitsstufe: Verletzungen des Schädels (ZNS)
Andere Verletzungen sind weniger dringlich, sodass man ihre operative Versorgung einige Stunden aufschieben kann, z. B. Verletzungen der übrigen Viszeralorgane (z. B. Niere, Blase, Darm) sowie periphere Gefäßläsionen. Offene Frakturen sind zwar nicht lebensbedrohlich, haben wegen der schwerwiegenden Langzeitprobleme bei Infektion (Osteomyelitis) dennoch eine gewisse Dringlichkeit (Zeitlimit: 6 Stunden).
12.9.1.3 Phase 3: Stabilisierungsphase
Ziele in dieser Phase sind:
-
Stabilisierung der vitalen Organfunktionen
-
operative Versorgung nicht akut lebensbedrohlicher Verletzungen
Die Stabilisierungsphase schließt sich direkt an die Notoperationsphase an. Der Patient liegt auf der Intensivstation.
Die in dieser Phase durchzuführenden Maßnahmen umfassen
-
die Fortführung der Beatmung,
-
weiteren Volumen- und Blutersatz,
-
Kontrolle und Ausgleich der Elektrolyte, Blutgase, Gerinnungswerte, Nierenfunktion usw.,
-
Medikamenten- und Infusionsplan,
-
noch ausstehende diagnostische Maßnahmen, die in der Phase 1 aus Zeitmangel nicht erfolgen konnten, werden jetzt nachgeholt (z. B. Röntgenaufnahmen der Extremitäten),
-
geschlossene Frakturen werden im Gipsverband ruhiggestellt. Die operative Versorgung (Osteosynthese) erfolgt frühestens nach 3–4 Tagen, wenn die Weichteilschwellung abgeklungen ist.
Pflegepraxis
Tetanusimpfung. Auf der Intensivstation sollten Sie nochmals überprüfen, ob der Patient im Schockraum gegen Tetanus geimpft worden ist.