25 Leber und Gallenwegsystem
Untersuchungsmethoden Die transkutane Sonografie ist die Methode der Wahl, um Veränderungen der Leber oder Steine in der Gallenblase nachzuweisen. Die Endo-Sonografie (ähnlich einer Magenspiegelung) lässt Steine im Gallengang gut erkennen. Bei speziellen Fragestellungen ist ein CT, mit intravenöser Gabe von Kontrastmittel, oder ein MRT indiziert.
Die spezielle Labordiagnostik umfasst Gamma-GT, AP, ALT, Bilirubin, Lipase.
25.1 Entzündliche Erkrankungen der Leber
Die meisten Erkrankungen der Leber fallen in den Fachbereich der Inneren Medizin (Hepatitis, Fettleber, Zirrhose, Stoffwechselerkrankungen).
25.1.1 Leberabszess
Definition
Ein Leberabszess ist eine abgekapselte bakterielle Entzündung in der Leber.
Ursache Die Erreger gelangen über den Gallengang oder auf dem Blutweg zur Leber. Die bakterielle Infektion der Gallenwege (Cholangitis) ist also häufige Ursache. Die hämatogene Streuung erfolgt bevorzugt aus dem Pfortaderquellgebiet (z. B. phlegmonöse Appendizitis, zerfallende Darmkarzinome, Nabelschnurinfekt des Neugeborenen). Außerhalb Europas ist der Leberabszess häufig durch eine Amöbenruhr verursacht (Amöbenabszess).
Symptome Das schwere Krankheitsbild ist durch Fieber, Schüttelfrost und septischen Verlauf gekennzeichnet. Der Ikterus ist meist gering, Schmerzen im rechten Oberbauch treten nur bei Leberschwellung auf.
Diagnostik Die intrahepatische Raumforderung ist sonografisch und im CT erkennbar.
Therapie Unter sonografischer Kontrolle kann eine Punktion des Abszesses erfolgen. Diese ermöglicht einen präzisen Erregernachweis, gestattet ferner bei kleineren Abszessen die mehrtägige Spülung über eine durch die Punktionsnadel eingebrachte Drainage. Hochdosierte Antibiotika, entsprechend dem Antibiogramm, sind immer erforderlich. Gelingt mit der Spülbehandlung keine Ausheilung, so muss die operative Ausräumung mit Einlegen von Drainagen erfolgen.
25.2 Erkrankungen des Gallenwegsystems
25.2.1 Gallenblasensteine
Definition
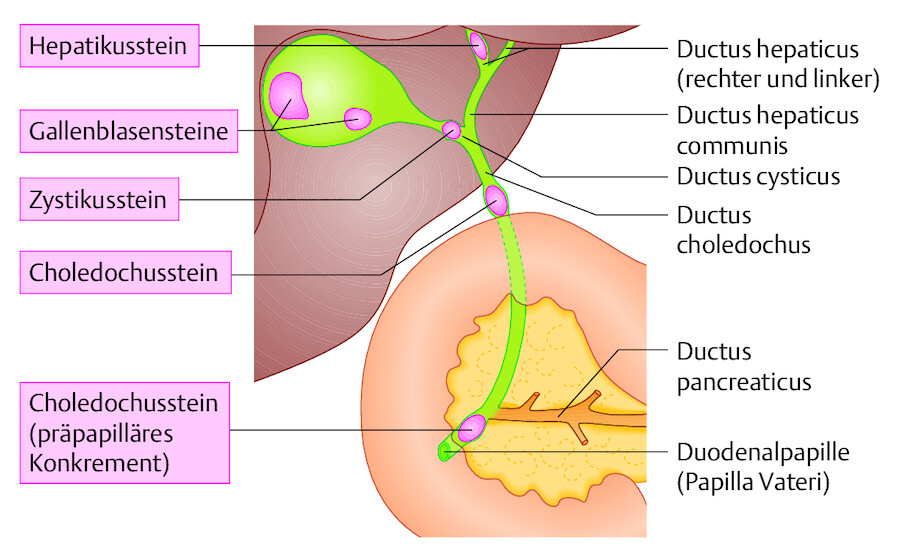
Als Cholelithiasis bezeichnet man das Vorhandensein eines oder mehrerer Gallensteine. Befinden sich diese in der Gallenblase, handelt es sich um eine Cholezystolithiasis, bei Steinen im Gallengang (Ductus choledochus) um eine Choledocholithiasis ( ▶ Abb. 25.1).
Abb. 25.1 Gallensteine. Typische Lokalisationen von Gallensteinen und ihre Bezeichnungen.
Ursache Wichtige lithogene (steinfördene) Faktoren sind Veränderungen in der Zusammensetzung der Gallenflüssigkeit sowie Störungen des Galletransports. Dadurch bilden sich wasserunlösliche Substanzen wie Cholesterin oder Bilirubin als kleinste Kristalle, die sich bei Größenzunahme zum Gallenstein entwickeln. Eingedickte, zähflüssige Galle (ohne Konkremente) bezeichnet man als Sludge.
Merke
Gallensteine entstehen in der Gallenblase ( ▶ Abb. 25.2). Über den Ductus cysticus können sie in den Ductus choledochus gelangen.
Abb. 25.2 Gallensteine.
Abb. 25.2a Entfernte Gallenblase.
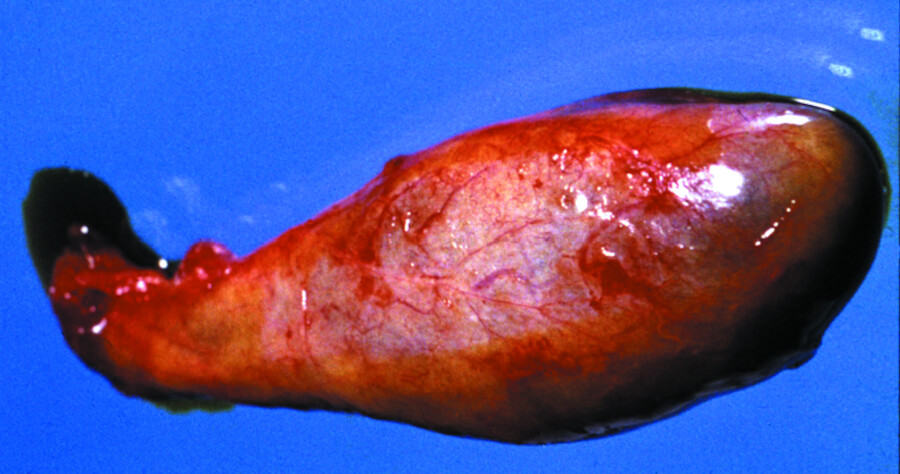
Abb. 25.2b Aufgeschnittene Gallenblase mit multiplen Steinen.

Gallensteine sind sehr häufig. In Deutschland sind von den über 70-Jährigen 70 % Gallensteinträger. Frauen sind doppelt so oft betroffen wie Männer. Neben Alter und Geschlecht gelten als disponierende Faktoren z. B.:
-
Adipositas
-
Schwangerschaft
-
Hypercholesterinämie
-
Diabetes mellitus
Zusatzinfo
Die 4 „f“. Die typische Gallensteinpatientin ist im englischen Sprachgebrauch anschaulich durch 4 „f“ gekennzeichnet: „female, forty, fatty, fertile“.
Diagnostik Die wichtigsten Bestandteile eines Gallensteins sind Cholesterin, Pigment (Bilirubin) und Kalksalze ( ▶ Abb. 25.3). Nur kalkhaltige Gallensteine stellen sich in der Abdomenleeraufnahme als röntgendichte „schattengebende“ Konkremente dar.
Abb. 25.3 Gallensteine. Sammelsurium einiger Steine von unterschiedlichen Patienten.

Symptome Die meisten Gallensteine sind klinisch „stumm“, machen also keine Beschwerden. Deshalb ist nicht jeder Gallensteinträger auch ein Gallensteinkranker. Kommt es jedoch zur Steineinklemmung im Bereich des Ductus cysticus oder Ductus choledochus, so entsteht eine Gallenkolik ( ▶ Abb. 25.4). Häufig ist eine üppige, fettreiche Mahlzeit vorausgegangen, wodurch sich die Gallenblase kontrahiert und die Steineinklemmung begünstigt wird.
Die Gallenkolik geht mit krampfartigen Schmerzen im rechten Oberbauch einher, die zur rechten Schulter ausstrahlen können. Häufig sind Übelkeit und Erbrechen.
Abb. 25.4 Gallenkolik. Die Steineinklemmung verursacht starke Schmerzen im Oberbauch.

Therapie Die akute Gallenkolik wird durch parenterale Gabe eines Spasmolytikums (z. B. Buscopan) sowie Nahrungskarenz behandelt.
Der asymptomatische Stein bedarf keiner Behandlung.
Der symptomatische Stein sollte hingegen operiert werden, um Steinkomplikationen (z.B. Koliken, Verschlussikterus, Gallenblasenperforation) vorzubeugen. Dazu wird die Gallenblase als Entstehungsort der Steine komplett entfernt, was heute bevorzugt minimalinvasiv erfolgt. Näheres zum operativen Verfahren finden Sie in Kap. ▶ 25.6.1.
25.2.2 Gallengangssteine
Definition
Gallengangssteine liegen im Gallengang (Ductus choledochus). Sie sind aus der Gallenblase über den Gallenblasengang (Ductus cysticus) in den Gallengang gewandert.
Symptome Gallengangssteine sind oft asymptomatisch. Bei einem Stau der Galleflüssigkeit kommt es zu Koliken oder/und einem Verschlussikterus (Kap. ▶ 25.2.4).
Diagnostik Die Sonografie durch die äußere Haut (perkutan) oder vom Duodenum aus (Endosonografie) ist geeignet. Exakter ist die aufwendigere ▶ MRCP. Die Röntgen-Leeraufnahme des Abdomens zeigt nur kalkhaltige Steine und erlaubt keine Lokalisation der Steine.
Therapie Heute bevorzugt man ein kombiniertes zweizeitiges endoskopisch-chirurgisches Vorgehen. Zuerst erfolgt eine Extraktion der Steine aus dem Gallengang. Dazu wird eine ERC (endoskopische retrograde Cholangiografie, ▶ Abb. 8.9b) durchgeführt, wobei der Gallengang mit den Steinen radiologisch dargestellt wird. Der Ablauf ähnlich einer Gastroskopie, eine Narkose ist nicht erforderlich. In gleicher Sitzung erfolgt die endoskopische Papillotomie mit Extraktion der Steine aus dem Gallengang (Kap. ▶ 25.6.4). Einige Tage später folgt die operative Entfernung der Gallenblase durch laparoskopische Cholezystektomie.
Zusatzinfo
Aktuelle Informationen zum Thema Gallensteine: http://www.dgvs.de
25.2.3 Cholezystitis und Cholangitis
Definition
Eine Cholezystitis bezeichnet die Entzündung der Gallenblase. Sie ist Folge von Konkrementen in der Gallenblase (Cholezystolithiasis). Sind die Gallenwege mitbetroffen, spricht man von Cholangitis.
Symptome Die Entzündung kann akut oder chronisch verlaufen.
Bei der „akuten Galle“ findet sich ein kolikartiger oder dauerhafter Schmerz im rechten Oberbauch, der in die rechte Schulter ausstrahlen kann.
Weitere Symptome sind Fieber, Schüttelfrost, Leukozytose und CRP-Erhöhung. Bei Verschluss des Ductus cysticus (durch Stein oder entzündliches Ödem) ist die Gallenblase massiv gestaut, was man als Hydrops bezeichnet. Ist der Hydrops bakteriell infiziert, spricht man vom Gallenblasenempyem. Der Ikterus ist hingegen nur zu erwarten, wenn auch der Abfluss im Ductus choledochus behindert ist (Stein oder Cholangitis). Beim chronischen Verlauf kommt es zu ähnlichen Symptomen, die lediglich weniger heftig ausgeprägt sind.
Therapie Die Primärbehandlung der akuten Cholezystitis ist konservativ:
-
Nahrungskarenz
-
Infusion
-
Spasmolytika
-
Analgetika
-
Antibiotika
Später erfolgt die endgültige Sanierung durch Cholezystektomie.
Fallbeispiel
Akute Cholezystitis. Frau Gahl (48) aus Oldenburg macht eine Kohlfahrt mit ihrem Bridgeclub. Dabei gibt es schon tagsüber einige Schnäpse. Abends wird dann Kohl und Pinkel gegessen. Beim Nachtisch (Rote Grütze, gehört obligatorisch dazu) verspürt Frau Gahl plötzlich einen starken krampfartigen Schmerz im rechten Oberbauch, der ihr „den ganzen Leib“ zusammenschnürt und viel schlimmer ist als damals, wo sie das Magengeschwür hatte. Die krampfartigen, starken Schmerzen hören einfach nicht auf, sodass sie im Sitzen kollabiert. „Ich kann nicht mehr“, stöhnt sie, „holt einen Arzt“. Da alle getrunken haben, fährt Frau Gahl in Begleitung von 3 Bridgedamen mit dem Taxi ins Städtische Krankenhaus.
Das Labor ist unauffällig, das CRP ist ein bisschen erhöht, Leberwerte und Lipase sind normal. Noch am Abend erfolgt eine Oberbauchsonografie. „Alles voller Steine“, murmelt der Radiologe. Auch ein „Abdomen leer“ wird gemacht, das „keine freie Luft“ zeigt. „Die akute Galle soll auf Station 5“ hört Frau Gahl jemanden rufen. Damit ist offenbar sie gemeint. „Infusion, Buscopan und Diclofenac“ wird verordnet. „Bis morgen nüchtern lassen“, heißt es ferner. Am nächsten Morgen ist Frau Gahl ausgenüchtert und beschwerdefrei. Wegen der Ulkusanamnese wird eine Gastroskopie durchgeführt, die unauffällig ist. Danach darf sie sogar frühstücken und will nach Hause. Die Ärzte erklären ihr aber, dass es besser wäre, die Gallenblase bald, also innerhalb der nächsten Tage, zu entfernen. Ohne OP würde es bei 70 % zu erneuten Koliken oder Entzündungen innerhalb von 2 Jahren kommen, und viele Patienten müssten dann als Notfall operiert werden, was gefährlicher sei als „jetzt“ bei Frau Gahl. Am Folgetag steht Frau Gahl als „MIC-Galle“ auf dem OP-Programm.
Wir halten fest: Pinkel ist eine sehr fetthaltige Wurst, die man nur in Teilen Norddeutschlands kennt, eine „Reizmahlzeit“ für die Gallenblase. Jede (reichliche) protein- und fetthaltige Nahrung führt zu einer maximalen Kontraktion der Gallenblase. Steine in der Gallenblase werden mit der Galleflüssigkeit ausgetrieben und können im Gallenblasengang hängen bleiben. Dadurch entsteht der plötzliche Schmerz, die Kolik. Die frühelektive laparoskopische Cholezystektomie innerhalb von 3 Tagen nach Diagnosestellung ist die Therapie der Wahl bei der akuten Cholezystitis.
25.2.4 Verschlussikterus
Definition
Beim Verschlussikterus (Cholestase) handelt es sich um einen gestörten Abfluss von Gallenflüssigkeit aus der Leber. Es wird durch verschiedene Krankheitsbilder verursacht.
Ursache Die Cholestase kann intrahepatische Ursachen haben (z. B. Nebenwirkungen einiger Medikamente). Meistens liegt jedoch eine extrahepatische (mechanische) Behinderung des Galleflusses zugrunde.
Die wichtigsten Ursachen des extrahepatischen Verschlussikterus sind:
-
Gallensteine (im Choledochus)
-
Cholangitis (entzündliche Schwellung und Galleeindickung)
-
narbige Stenose (des Choledochus oder der Papille)
-
Tumoren (z. B. an Ductus hepaticus, Choledochus, Pankreaskopf)
Symptome Der Verschlussikterus kann mit oder ohne Schmerzen einhergehen. Weil der Blutfarbstoff Bilirubin nicht mit der Galle in den Darm ausgeschieden wird, staut sich der Farbstoff im Blut (Gelbsucht= Ikterus,). Im Darm fehlt das Pigment, der Stuhl entfärbt sich (heller = acholischer Stuhl). Weil die Niere einen Teil des Bilirubins ausscheidet, wird der Urin dunkel. Der Juckreiz (Pruritus) ist Folge der vermehrten Gallensäureeinlagerung in der Haut ( ▶ Abb. 25.5.
Abb. 25.5 Ikterus. Die Gelbsucht sieht man besonders deutlich an der Bindehaut der Augen.
(Foto: H. S. Füeßl, Thieme)

Diagnostik Laborchemisch ist der Verschlussikterus durch Hyperbilirubinämie und Anstieg der sog. Cholestaseenzyme (z. B. alkalische Phosphatase, Gamma-GT) gekennzeichnet. Der Nachweis der Verschlusslokalisation erfolgt durch Sonografie, CT, MRT oder ERC.
Therapie Nach Ausschluss anderer Gelbsuchtformen (z. B. Hepatitis, Hämolyse) wird der extrahepatische mechanische Verschlussikterus endoskopisch oder chirurgisch behandelt. Bei Gallengangssteinen geht das Konkrement nach endoskopischer Papillenspaltung meist spontan über den Darmkanal ab. Ansonsten muss der Stein zertrümmert und/oder endoskopisch entfernt werden. Führen endoskopische Maßnahmen nicht zum Ziel, wird der Stein chirurgisch entfernt (Choledochusrevision, Kap. ▶ 25.6.5). Die Gallenblase als Produktionsstätte der Steine muss auch bei primär endoskopischer Behandlung operativ entfernt werden (Cholezystektomie).
Bei inoperablen Tumoren kann eine endoskopisch eingeführte Drainage ( ▶ Abb. 7.14) den Gallefluss vom Ductus choledochus zum Duodenum wiederherstellen und so den Ikterus und quälenden Juckreiz lindern. Alternativ kommt als operative Maßnahme eine biliodigestive Anastomose infrage (Kap. ▶ 25.6.5).
25.2.5 Gallenblasenperforation
Definition
Bei einer Gallenblasenperforation (Gallenblasenruptur) handelt es sich um einen Durchbruch der Gallenblasenwand.
Ursache Ursache einer Gallenblasenperforation ist häufig die chronische steinbedingte Cholezystitis. Bei freier Perforation in die Bauchhöhle entsteht eine gallige Peritonitis. Bei freier Perforation in das Duodenum können auch größere Gallensteine (ca. 3 cm) in die Stuhlpassage gelangen. Bleibt ein solches Konkrement im Darm hängen, meist im Ileum, so entsteht der Gallensteinileus.
Symptome Die vielfältige Symptomatik kann sich als plötzlicher Schmerz (akutes Abdomen) oder als fast schmerzfreier mechanischer Ileus äußern.
Therapie Die Behandlung ist immer operativ (Cholezystektomie, Kap. ▶ 25.6.2).
Zusatzinfo
Choledochusstein. Die biliäre Pankreatitis (Bauchspeicheldrüsenentzündung) ist durch einen präpapillären Stein im Gallengang (Choledochusstein) verursacht, der den Pankreasausführungsgang blockiert, was zur lebensbedrohlichen Pankreatitis führen kann (Kap. ▶ 26.2).
25.3 Portale Hypertension
Definition
Als portale Hypertension (Pfortaderhochdruck) bezeichnet man den erhöhten Blutdruck in der V. portae als Folge einer Abflussbehinderung des Pfortaderbluts.
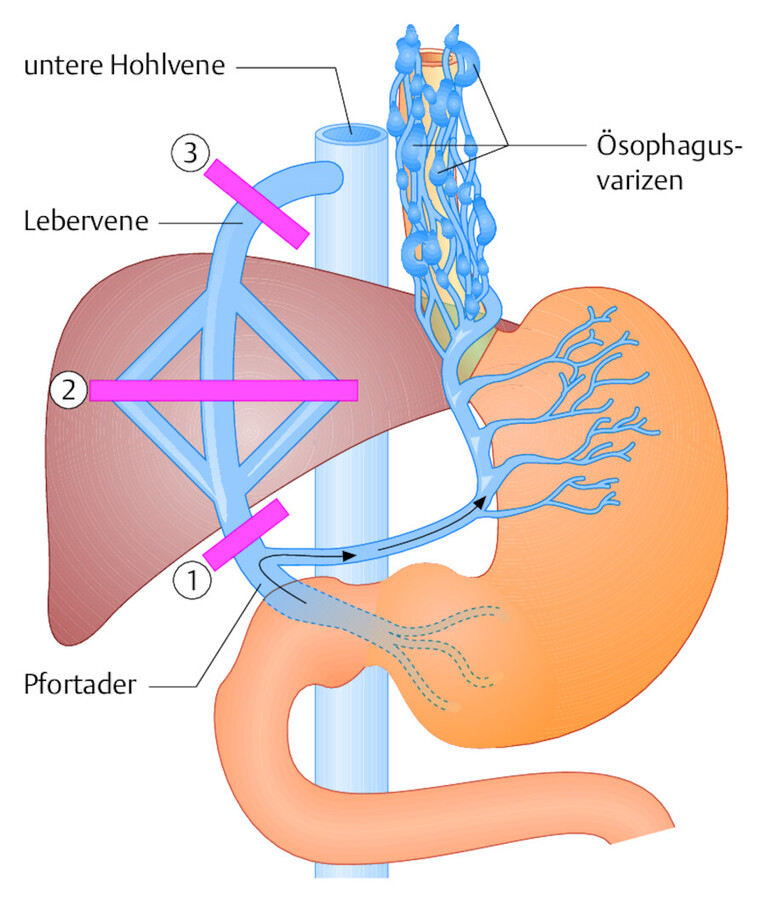
Ursache Die portale Hypertension ist eine Folgeerkrankung bzw. ein Symptom, für das mehrere ursächliche Faktoren infrage kommen. Diese teilt man üblicherweise nach ihrer Lokalisation in Bezug zur Leber ein ( ▶ Abb. 25.6). Von diesen Ursachen ist in Europa der intrahepatische Block durch Leberzirrhose die bedeutendste:
-
Prähepatischer Block: Die Abflussbehinderung liegt vor der Leber, also im Bereich der Pfortader selbst, z. B.: Pfortaderthrombose, Einengung der Pfortader durch Tumoren von außen (z. B. Lymphknotenmetastasen in der Leberpforte, Gallenwegstumoren).
-
Intrahepatischer Block: Die Abflussbehinderung ist durch krankhafte Veränderungen des Leberparenchyms bedingt, z. B.: Leberzirrhose, Lebermetastasen, primäre Lebertumoren.
-
Posthepatischer Block: Die Passage des Blutes durch Pfortader und Leber selbst ist frei, die Abflussbehinderung ist hinter der Leber lokalisiert, also im Bereich der Lebervenen oder des Zuflusses zum rechten Herzen, z. B.: angeborener oder erworbener Verschluss der Lebervenen (Budd-Chiari-Syndrom).
.
Zusatzinfo
Alkoholabusus. Die portale Hypertension ist in ca. 90 % der Fälle durch eine Leberzirrhose verursacht. Häufigste Ursache der Leberzirrhose in Europa ist der chronische Alkoholabusus.
Abb. 25.6 Portale Hypertension. Lokalisation der Flussbehinderungen im Pfortaderverlauf (Balken): 1: prähepatischer Block, 2: intrahepatischer Block, 3: posthepatischer Block. Umgehungskreislauf über die Magen- und Ösophagusvenen.
Symptome Bedeutendste Folge der portalen Hypertension sind die Ösophagusvarizen, deren Ruptur zur lebensbedrohlichen Blutung führt. Die Abflussbehinderung im Bereich der Leber führt zum Druckanstieg in der Pfortader und ihren venösen Zuflüssen. Das Blut versucht, unter Umgehung der Leber über andere Gefäßverbindungen (Kollateralen) zum rechten Herzen zu gelangen. Dieser Umgehungskreislauf führt in erster Linie über die Venen des Ösophagus und Magenfundus. Infolge des vermehrten Blutdurchflusses schwillt das Kaliber dieser Venen massiv an. So entstehen die Ösophagusvarizen ( ▶ Abb. 25.7) und Varizen des Magenfundus bei portaler Hypertension.
Abb. 25.7 Ösophagusvarizen. Kontrastmitteldarstellung der Speiseröhre. Die Varizen wölben sich in das Lumen vor und stellen sich als unregelmäßige Kontrastmittelaussparungen dar (Pfeile).

Die portale Stauung führt ferner zur Milzvergrößerung (Splenomegalie, Kap. ▶ 26.6) und Aszites (seröse Flüssigkeit in der Bauchhöhle). Auch die Bildung der Blutgerinnungsfaktoren ist häufig beeinträchtigt (niedriger Quick-Wert). Weitere Zeichen der Leberzirrhose können hinzukommen.
Therapie Solange die Ösophagusvarizen nicht geblutet haben, ist die Behandlung rein konservativ-internistisch (Aszitesausschwemmung, Leberschutztherapie usw.).
25.3.1 Ösophagusvarizenblutung
Definition
Eine Ösophagusvarizenblutung ist eine lebensbedrohliche Blutung aus gestauten Venen in der Speiseröhre bei portaler Hypertension.
Symptome Die Ösophagusvarizenblutung tritt als massives Bluterbrechen mit hypovolämischem Schock in Erscheinung. Häufig kommt es zur Aspiration mit nachfolgender Pneumonie. 10 % aller oberen Gastrointestinalblutungen (Kap. ▶ 12.4) sind Ösophagusvarizenblutungen.
Prognose Die Letalität beträgt 20 %, wenn der Patient zum ersten Mal blutet. Bei Rezidivblutung steigt die Letalität auf 50 %.
Therapie Zur Behandlung stehen endoskopische, medikamentöse, radiologisch-interventionelle und chirurgische Verfahren zur Verfügung.
Bei Aufnahme des Patienten wird primär die Therapie des hämorrhagischen Schocks eingeleitet (Infusion, Transfusion, Substitution von Gerinnungsfaktoren, Kap. ▶ 12.2). Danach erfolgt die spezifische Behandlung der Ösophagusvarizenblutung. Im Folgenden sind verschiedene Verfahren erläutert:
Notfallendoskopie Als Notfallmaßnahmen wird immer eine sofortige Notfallendoskopie durchgeführt. Sie dient nicht nur der Diagnosesicherung, sondern ermöglicht in 90 % der Fälle eine zumindest vorübergehende Blutstillung.
Endoskopische Sklerosierung Die Blutstillung wird durch Einspritzen eines Verödungsmittels in die Schleimhaut des Ösophagus erreicht. Die Sklerosierung (Verödung) kann mehrfach wiederholt werden.
Endoskopische Varizenligatur Die Ösophagusvarizen werden mit einem endoskopisch eingebrachten Multibandligator (ähnlich wie Gummibänder) abgebunden, wodurch sie thrombosieren, vernarben und abgestoßen werden.
Medikamente Neben der endoskopischen Blutstillung werden vasoaktive Substanzen intravenös zur Drucksenkung im Pfortaderkreislauf verabreicht. Gebräuchliche Präparate sind Betablocker und Nitrate sowie Somatostatin.
Ballontamponade Führt die endoskopische Blutstillung nicht zum Erfolg, so wird eine Sengstaken-Sonde gelegt ( ▶ Abb. 7.7). Damit wird die Blutungsregion in der Speiseröhre mechanisch komprimiert („geblockt“).
Pflegepraxis
Sonden. Wegen der Gefahr von Druckschäden an der Ösophaguswand darf die Ballontamponade nicht länger als 12 Stunden geblockt sein. Zur Entblockung zieht man die Luft aus dem Ösophagusballon mit einer Spritze ab, lässt die Sonde jedoch vorsichtshalber noch einige Stunden in der Speiseröhre liegen, damit sie im Falle einer erneuten Blutung sofort wieder aufgeblasen werden kann.
Nach Entfernen der Sonde erfolgt eine Kontrollendoskopie, ggf. mit nochmaliger Sklerosierung.
Transjugulärer intrahepatischer portosystemischer Stent-Shunt (TIPSS oder TIPS) Bei diesem endovaskulären Verfahren wird durch Punktion über einen Katheter von außen ein Drahtgitterzylinder (Stent) in die Blutgefäße der Leber eingebracht ( ▶ Abb. 25.8). Der Stent erweitert die Blutgefäßverbindung zwischen Pfortader und Lebervenen. Dadurch wird die portale Hypertension bei intrahepatischem Block (z. B. Leberzirrhose) vermindert. Vorteil der Methode ist die geringe Invasivität (keine Operation, keine Narkose).
Abb. 25.8 TIPSS bei portaler Hypertension. Wenn die Leber bei Leberzirrhose das Blut von den Darmvenen nicht mehr durchlässt, kann ein Stent in der Leber den Blutfluss zum Herzen verbessern und die Symptome des Pfortaderhochdrucks mindern.

Sperroperation Ist mit den bisherigen Maßnahmen keine Blutstillung zu erreichen, so kommt eine operative Devaskularisation infrage. Die zum Ösophagus ziehenden Venen werden in Höhe des Magenfundus mit einem Klammernahtinstrument verschlossen ( ▶ Abb. 25.9). Damit ist der Zufluss zu den Ösophagusvarizen „gesperrt“. Die Maßnahme ist nur als Notfalleingriff bei anders nicht stillbarer Blutung indiziert. Der Pfortaderhochdruck wird nicht beseitigt.
Abb. 25.9 Sperroperation bei Ösophagusvarizenblutung.
Abb. 25.9a Nach Eröffnung des Magens werden die zur Blutungsstelle in der Speiseröhre ziehenden Venen in der Magenwand mit einem Klammernahtinstrument verschlossen.
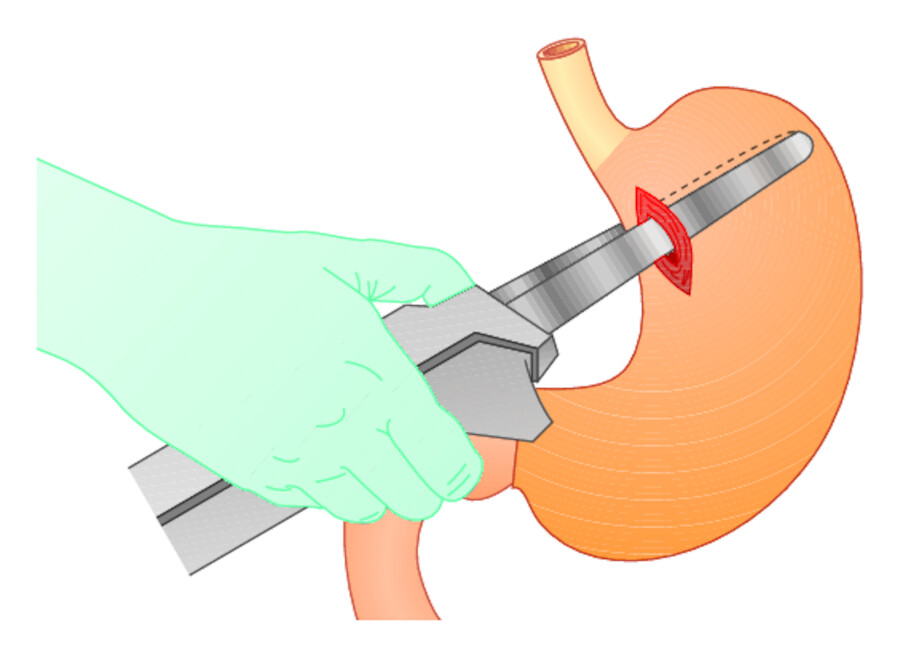
Abb. 25.9b Die Klammernahtreihe versperrt den Blutzufluss vom Magen zu den Ösophagusvarizen.

Shunt-Operation Die gebräuchlichsten operativen Verfahren zur Senkung des erhöhten Pfortaderdrucks zeigt ▶ Abb. 25.10. Gemeinsames Prinzip aller Shunt-Operationen ist die Schaffung einer Kurzschlussverbindung (Shunt oder Anastomose) zwischen dem Pfortadersystem (erhöhter Druck) und der unteren Hohlvene (niedriger Druck). Nach der Druckentlastung kollabieren die gestauten Ösophagusvarizen, wodurch sich das Rupturrisiko (Blutung) erheblich vermindert. Shunt-Operationen kommen nur irage, wenn der Patient mindestens ein Blutungsereignis hinter sich hat. Zur Prophylaxe werden diese Eingriffe nicht durchgeführt, möglichst auch nicht während einer Ösophagusvarizenblutung („Not-Shunt“).
Abb. 25.10 Shunt-Operationen bei portaler Hypertension.
Abb. 25.10a Splenorenaler Shunt nach Warren: Das Blut aus dem Pfortadersystem wird über eine operativ geschaffene Anastomose zwischen Milzvene und linker Nierenvene in die untere Hohlvene abgeleitet.
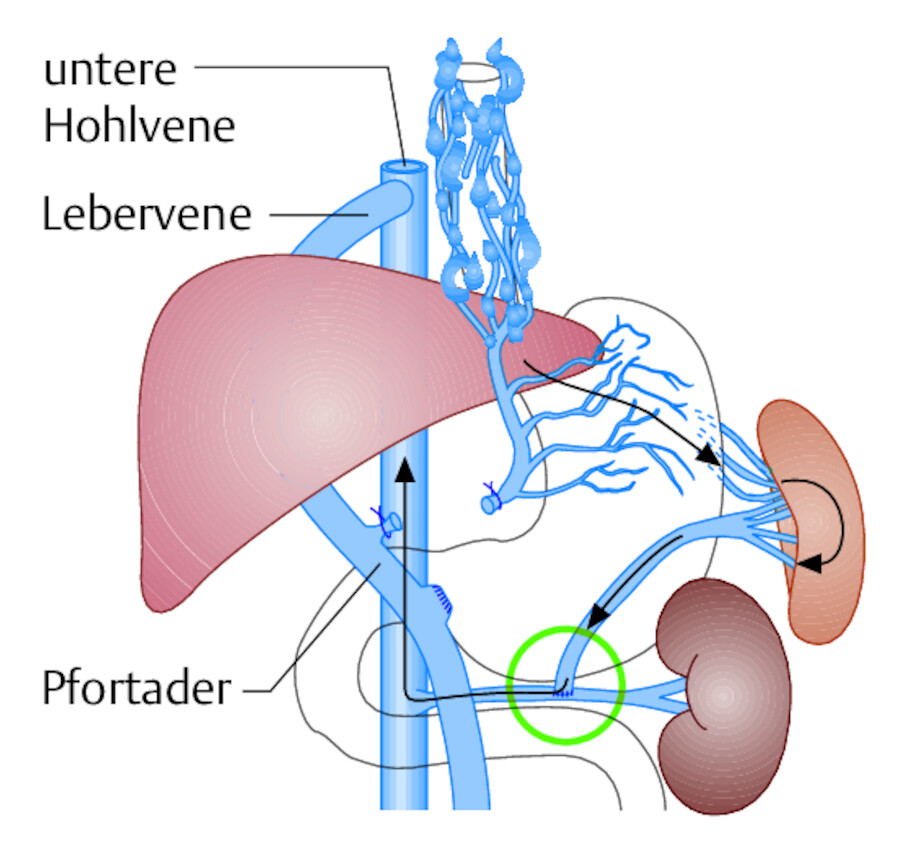
Abb. 25.10b Portokavaler Shunt: Das Pfortaderblut fließt über eine Anastomose direkt in die untere Hohlvene. Die Leber wird dann nur über die (nicht eingezeichnete) A. hepatica mit Blut versorgt, was ausreichend ist.

Lebertransplantation Die Indikation kann bei therapieresistenten Rezidivblutungen gegeben sein.
25.4 Verletzungen der Leber
Ursache Die häufigste Verletzung ist die Leberruptur beim stumpfen Bauchtrauma ( ▶ Abb. 25.11). Selten sind Spontanrupturen (z. B. beim Leberadenom).
Abb. 25.11 Leberruptur.
Abb. 25.11a Einriss der Leberkapsel (Pfeil), links im Bild Dünndarm.

Abb. 25.11b CT des Abdomens, 1: Hämatom, 2: normales Lebergewebe, M: Milz.

Symptome Das klinische Bild entspricht einem akuten Abdomen (Kap. ▶ 12.6). Die Blutung in die freie Bauchhöhle führt zu einer peritonealen Reizung mit Abwehrspannung der Bauchdecke sowie paralytischem Ileus (keine Peristaltik). Abhängig vom Ausmaß des inneren Blutverlusts (bis zu 2 l und mehr!) stellt sich rasch ein hypovolämischer Schock mit Tachykardie, Blutdruckabfall und Sinken des Hämoglobinwerts ein (Kap. ▶ 12.2).
Therapie Wichtigste Erstmaßnahme ist die sofortige Schockbehandlung durch Transfusionen und Infusionen. Das Blut in der freien Bauchhöhle wird durch Sonografie oder/und CT nachgewiesen. Bestätigt sich die intraabdominelle Blutung, so muss die sofortige Laparotomie erfolgen. Die Risse der Leber werden mit dickem, resorbierbarem Faden vernäht. Nur in Ausnahmefällen ist eine Leberresektion erforderlich. Bei ausgedehnten Parenchymverletzungen kann eine komprimierende Tamponade durch Bauchtücher erfolgen („Leber-Packing“). Die Tücher werden nach 3 Tagen durch Relaparotomie entfernt. Immer werden mehrere dicklumige Ableitungsdrainagen eingelegt.
Pflegepraxis
Beobachtung. Die exakte postoperative Dokumentation der Drainagenfördermenge sowie der Kreislaufparameter ist wegen der Nachblutungsgefahr von besonderer Wichtigkeit.
25.5 Tumoren
Gutartige Lebertumoren müssen in der Regel nicht behandelt werden. Dazu gehören die angeborene harmlose Leberzyste, deren multiples Auftreten als Zystenleber bezeichnet wird. In der Oberbauchsonografie finden sich häufig Hämangiome und Adenome, die sonografisch beobachtet werden.
Bösartige Lebertumoren stehen klinisch im Vordergrund.
25.5.1 Bösartige Lebertumoren
Unter den bösartigen Lebertumoren unterscheidet man primäre und sekundäre Lebermalignome.
Ursache Die primären Lebertumoren haben ihren Ursprung im Leberparenchym. Es handelt sich um das hepatozelluläre Karzinom (Leberkrebs), das meist als Folge einer Leberzirrhose entsteht.
Bei den sekundären Lebermalignomen handelt es sich um Fernmetastasen anderer Organkrebse, bevorzugt aus dem Magen-Darm-Kanal (venöser Abfluss über die Pfortader). Die Prognose ist schlecht.
Merke
Der häufigste maligne Lebertumor ist die Lebermetastase!
Symptome Bei den Lebermalignomen kommt es erst im fortgeschrittenen Stadium zu Symptomen. Dazu gehören Druckgefühl und Schmerzen im rechten Oberbauch, Gewichtsverlust und Ikterus.
Diagnostik Zur Abklärung geeignet sind die Sonografie, CT, MRT und Angiografie.
Therapie Mehrere Behandlungsverfahren stehen zur Verfügung, die auch in Kombination eingesetzt werden (multimodale Therapie). Leberkrebs bleibt jedoch eine schwerwiegende Erkrankung mit schlechter Prognose. Mögliche Therapieverfahren sind:
Operative Tumorentfernung Das primäre Leberkarzinom wird möglichst operativ reseziert. Lebermetastasen werden nur in Ausnahmefällen chirurgisch entfernt, wenn auch der Primärtumor potenziell kurativ resezierbar ist. Dazu kann die halbe Leber (Hemihepatektomie) oder mehr entfernt werden. Mit 20 % des Organs kann der Mensch überleben, sofern das restliche Lebergewebe intakt ist und nicht zu stark durch Leberzirrhose vorgeschädigt ist. In Ausnahmefällen kann eine Lebertransplantation vorgenommen werden.
Thermotherapie Bei der radiofrequenzinduzierten Thermotherapie wird in Narkose unter Ultraschall- oder CT-Kontrolle eine Sonde in den Tumor eingeführt. Durch diese Sonde werden Radiofrequenzwellen appliziert, um das Tumorgewebe zu „verkochen“. Ähnlich wirkt die Mikrowellenablation.
Transarterielle Chemoembolisation Es handelt sich um ein Behandlungsverfahren, bei dem die beiden Prinzipien der Embolisation und Chemotherapie kombiniert werden. Über die Leiste wird in Lokalanästhesie ein Katheter in die Leberarterien vorgeschoben. Bei der Embolisation werden durch den Katheter kleine Kunststoffteilchen oder Metallspiralen (Coils) in die tumorversorgende Arterie gespritzt, bis das Gefäß verstopft. Die Tumorzellen sterben ab, weil sie keine Nährstoffe mehr erhalten. Zusätzlich wird ein Chemotherapeutikum (Zytostatikum) in den Katheter gespritzt und damit direkt am Tumor platziert (lokale Chemotherapie). Durch die Chemoembolisation kann das Tumorwachstum verzögert werden.
Transarterielle Radioembolisation Diese Therapie wird auch selektive interne Strahlentherapie genannt. Es handelt es sich um eine neuartige örtliche Bestrahlungsbehandlung der Lebertumoren von innen. Bei diesem Verfahren werden mit einem Katheter von der Leistenarterie radioaktive Kügelchen (Mikrospheren) direkt in die Leber eingebracht. Die Tumoren werden dadurch einer hohen örtlichen Strahlendosis ausgesetzt.
Perkutane Ethanol-Injektion Bei der perkutanen Ethanol-Injektion wird unter Ultraschall- oder CT-Kontrolle mithilfe einer feinen Nadel 95%iger Alkohol in den Tumor gespritzt. Dadurch stirbt das Tumorgewebe ab. Die Behandlung wird meist in mehreren Sitzungen durchgeführt.
Externe Strahlentherapie (Radiotherapie) Für große örtlich begrenzte Leberkarzinome, die weder operativ noch mit alternativen Verfahren verkleinert werden können, hat die von außen angewandte Strahlenbehandlung Bedeutung.
Medikamentöse zielgerichtete Behandlung Zielgerichtete Arzneistoffe (Target-Medikamente) greifen in verschiedene Signalwege des Tumorstoffwechsels ein und wirken deshalb gezielt gegen bösartiges Gewebe. Für die Behandlung von Brust-, Darm-, Prostata- und Lungenkrebs stehen seit mehreren Jahren Medikamente zur Verfügung, die gezielt Wachstumssignale und Wachstumsfaktoren hemmen. Diese neuartigen Medikamente richten sich gegen Faktoren auf molekularer Ebene, die das Wachstum des Leberkrebses fördern. Ein Teil der Leberkrebsfälle weist auf der Oberfläche der Krebszellen Bindungsstellen (Rezeptoren) für derartige Wachstumsfaktoren auf. Dadurch ergeben sich pharmakologische therapeutische Ansätze, wie z.B. mit dem Tyrosinkinasehemmer Sorafenib, der die Überlebenszeit von Patienten mit fortgeschrittenem Leberkrebs verlängert. Derzeit werden noch andere zielgerichtete Medikamente auf ihre Wirksamkeit bei der Behandlung von Leberkrebs untersucht.
Immuntherapie Die Immuntherapie mit innovativen Arzneistoffen wie den sog. Checkpoint-Inhibitoren sind die neuen Hoffnungsträger der Tumormedizin. Erfolg versprechende Ergebnisse gibt es mit dem PD-1-Inhibitor Nivolumab.
Chemotherapie Die systemische Gabe von Zytostatika kommt bei der Behandlung des Leberkrebses selten zum Einsatz, weil die gesamte Leber durch die meist zusätzlich bestehende Leberzirrhose zu stark vorgeschädigt ist.
Pflegepraxis
Schmerzmanagement. Im fortgeschrittenen Stadium der Leberkrebserkrankung stehen Schmerzen im Vordergrund, wodurch die Lebensqualität der Betroffenen erheblich eingeschränkt wird. Deshalb ist eine wirksame Schmerzbehandlung auch mit Morphium indiziert. Schmerzambulanzen und Palliativstationen verfügen über besondere Kompetenz.
25.5.2 Lebertransplantation
Im Jahr 1963 erfolgte die weltweit erste Lebertransplantation (LTX). In Deutschland werden pro Jahr knapp 1000 Lebertransplantationen durchgeführt. Derartige Operationen dürfen nur an spezialisierten Zentren vorgenommen werden.
Wenn konservative Maßnahmen aussichtslos sind, kann eine LTX angezeigt sein, z. B. bei angeborenen metabolischen Störungen, bei fortgeschrittener Leberzirrhose, bei primären und sekundären Lebertumoren, bei akutem Leberversagen (z.B. aufgrund einer Pilzvergiftung). Die häufigste Indikation für eine LTX in Deutschland ist die alkoholisch bedingte Leberzirrhose.
Zusatzinfo
Spendermangel. Die Ursache des Organmangels ist im Wesentlichen darin begründet, dass zu wenig Menschen bereit sind, zu Lebzeiten einen Organspendeausweis auszufüllen. Der Organmangel ist derzeit das Hauptproblem der Lebertransplantation.
Die klassische Lebertransplantation (LTX) erfolgt mit der explantierten Leber eines hirntoten Menschen. Wegen der Organmangelsituation haben sich weitere Methoden etabliert.
Splitlebertransplantation Aufteilung der Spenderleber in 2 Teile und Verpflanzung auf 2 unterschiedliche Empfänger.
Lebendspende Verpflanzung eines Teils der Leber (typischerweise des linken Leberlappens) von einem gesunden lebenden Menschen auf einen anderen Menschen. Die Lebendspende ist nur erlaubt, wenn sonst kein geeignetes Organ zur Verfügung steht und wenn Spender und Empfänger miteinander verwandt sind oder sich in besonderer persönlicher Verbundenheit nahestehen.
Zusatzinfo
Liver engineering. Der Mangel an Spenderorganen beflügelt die Entwicklung einer künstlichen Leber. Dazu werden menschliche Stammzellen oder ausgereifte Leberzellen verwendet, die auf ein Gerüst (Matrix) aufgebracht werden. Die Matrix wird synthetisch hergestellt oder aus explantierten Lebern gewonnen. Das Verfahren ist klinisch noch nicht einsetzbar.
25.5.3 Tumoren des Gallenwegsystems
Tumoren der Gallenblase und Gallenwege sind insgesamt selten, meistens jedoch bösartig. In ca. 80 % liegen gleichzeitig Gallensteine vor, weshalb die Lithiasis als wesentlicher pathogenetischer Faktor angesehen wird (Kap. ▶ 25.2.1).
Die Prognose ist schlecht, weil die Karzinome sehr früh in die Leber einbrechen.
Zusatzinfo
Die lebernahen Karzinome der Gallenwege werden nach dem Erstbeschreiber Klatskin-Tumorengenannt.
Therapie Nach Möglichkeit erfolgt die operative Tumorentfernung. Meistens kommen lediglich palliative Eingriffe zur Beseitigung des Verschlussikterus infrage: Offenhalten der Gallenwege durch innere Drainage oder Stent ( ▶ Abb. 7.14), ansonsten biliodigestive Anastomose (Kap. ▶ 25.6.5).
25.6 Operative Verfahren am Gallenwegsystem
25.6.1 Laparoskopische Cholezystektomie
Definition
Unter der laparoskopischen Cholezystektomie versteht man die minimalinvasive endoskopische Totalentfernung der Gallenblase (MIC-Galle) durch Spiegelung der Bauchhöhle ( ▶ Abb. 25.12).
Heute werden 95 % aller Gallenblasenentfernungen laparoskopisch vorgenommen. Die minimalinvasive laparoskopische Cholezystektomie („MIC-Galle“) ist mit 200 000 Eingriffen pro Jahr in Deutschland die Standardtherapie des symptomatischen Gallenblasensteins.
Abb. 25.12 Laparoskopische Cholezystektomie. Operationsfotos.
Abb. 25.12a Blick von rechts auf den Bauch. Rechter Rippenbogen mit Farbpunkten markiert. Die 4 Arbeitsinstrumente sind durch die Bauchdecke in die Bauchhöhle eingeführt. Die Extraktionshülse mit dem weißen Aufsatz steckt im Nabel.
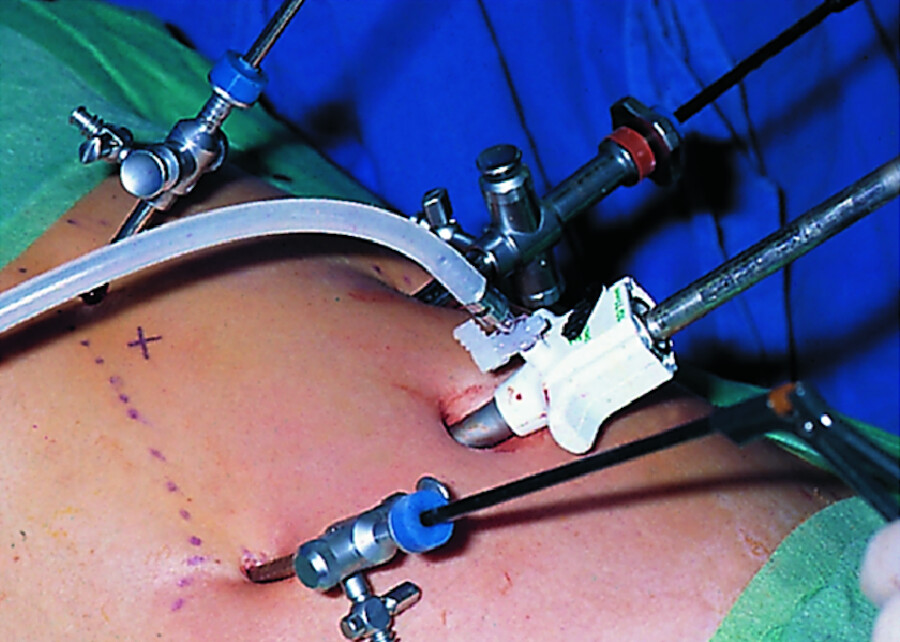
Abb. 25.12b Blick durch das Video-Endoskop in die Bauchhöhle. Die Gallenblase (G) wird von 2 Fasszangen gehalten, dahinter die Leber (L), Bauchdecke (B) von innen.

Zusatzinfo
Historie. Die laparoskopische Gallenblasenentfernung war 1986 die erste minimalinvasive OP im Bauchraum überhaupt. Diese Operation hat sich seit den 1990er-Jahren weltweit verbreitet und den bis heute anhaltenden Erfolg der videoassistierten Operationen in allen Fachbereichen begründet.
Operationsablauf Der Eingriff erfolgt in Vollnarkose und Rückenlage. Zu Anfang füllt man die Bauchhöhle über eine Punktionsnadel mit Kohlendioxid (Pneumoperitoneum), um genügend Übersicht und Bewegungsraum für die einzubringenden Spezialinstrumente zu haben. Dann wird das Endoskop durch den Nabel eingestochen. Über kleine Zusatzinzisionen werden die chirurgischen Instrumente in die Bauchhöhle eingeführt. Gallenblasengang (Ductus cysticus) und die daneben verlaufende Arterie (A. cystica) werden zwischen Metallclips durchtrennt. Danach lässt sich die Gallenblase von der Leber ablösen und durch ein 2 cm dickes Rohr im Nabel herausziehen. Wenn die gefüllte Gallenblase nicht durch das Rohr hindurchpasst, muss vor der Extraktion Flüssigkeit abpunktiert werden und/oder eine Zerquetschung größerer Steine in der Bauchhöhle erfolgen. Eine Drainage wird nicht eingelegt.
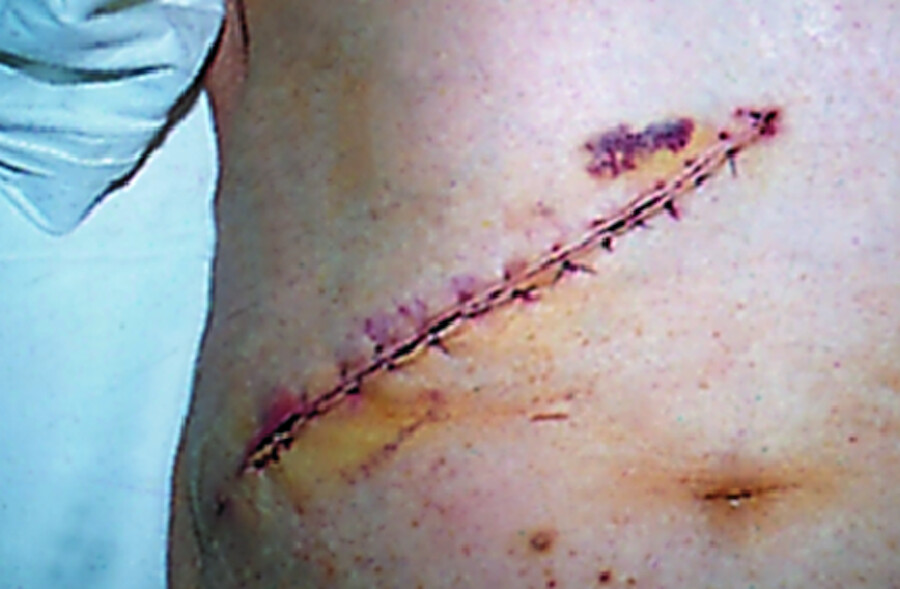
Nach laparoskopischer Cholezystektomie bleiben lediglich kleine Narben sichtbar ( ▶ Abb. 25.13). Die größte Inzision für den 2 cm dicken Trokar liegt in der Nabelgrube und ist deshalb nicht als Narbe erkennbar.
Abb. 25.13 Narben nach Gallenblasenoperation.
Abb. 25.13a Nach laparoskopischer Cholezystektomie (5. Tag).

Abb. 25.13b Nach offen-chirurgischer Cholezystektomie (5. Tag).
Pflegepraxis
Ernährung. Die Patienten dürfen schon am Abend der Operation aufstehen, Tee trinken und zur Toilette gehen. Am Folgetag können sie leichte Kost zu sich nehmen. Die Entlassung erfolgt nach ca. 4 Tagen.
Konversion Wenn bei einer laparoskopischen Operation Schwierigkeiten oder Komplikationen auftreten, die endoskopisch nicht beherrschbar sind (z. B. Blutung), so muss der Eingriff als „offene“ Operation mit Eröffnung der Bauchhöhle fortgeführt werden. Den Wechsel von der geplanten laparoskopischen Cholezystektomie zur offenen konventionellen Operation in gleicher Narkose bezeichnet man als „Umsteigen“ oder Konversion. Die Patienten werden präoperativ über diese Möglichkeit aufgeklärt.
25.6.2 Offen-chirurgische Cholezystektomie
Definition
Als konventionelle offen-chirurgische Cholezystektomie bezeichnet man die Totalentfernung der Gallenblase durch offene Operation (Laparotomie).
Zusatzinfo
Historie. Die „offene“ operative Entfernung der steintragenden Gallenblase mittels Laparotomie wurde erstmals 1882 durchgeführt. Sie galt über 100 Jahre in der Behandlung des Gallensteinleidens als „Goldstandard“, an dem sich alternative Therapieverfahren messen mussten. Heute ist die offene OP durch die minimalinvasive Chirurgie (MIC-Galle) weitgehend abgelöst worden.
Die Indikation zu der offen-chirurgischen Cholezystektomie wird nur noch gesehen, wenn Kontraindikationen zum laparoskopischen Vorgehen bestehen (meistens akute Cholezystitis).
Operationsablauf Der Eingriff erfolgt in Vollnarkose und Rückenlage. Der Zugang erfolgt über einen Rippenbogenrandschnitt rechts oder eine senkrechte Inzision im rechten Oberbauch von etwa 10 cm Länge ( ▶ Abb. 3.17 und ▶ Abb. 25.13). Ductus cysticus und A. cystica werden mit einem Faden ligiert (zugebunden) oder mit einem Metallclip verschlossen und dann durchtrennt. Nach konventioneller Entfernung der Gallenblase wird in den meisten Kliniken eine Zieldrainage in den Operationsbereich eingelegt.
Wenn die präoperative Diagnostik einen Steinbefall des Ductus choledochus nicht zweifelsfrei ausschließen kann, wird intraoperativ eine Röntgendarstellung der Gallenwege ( ▶ Abb. 25.14) oder die Spiegelung des Gallengangs (Choledochoskopie) vorgenommen.
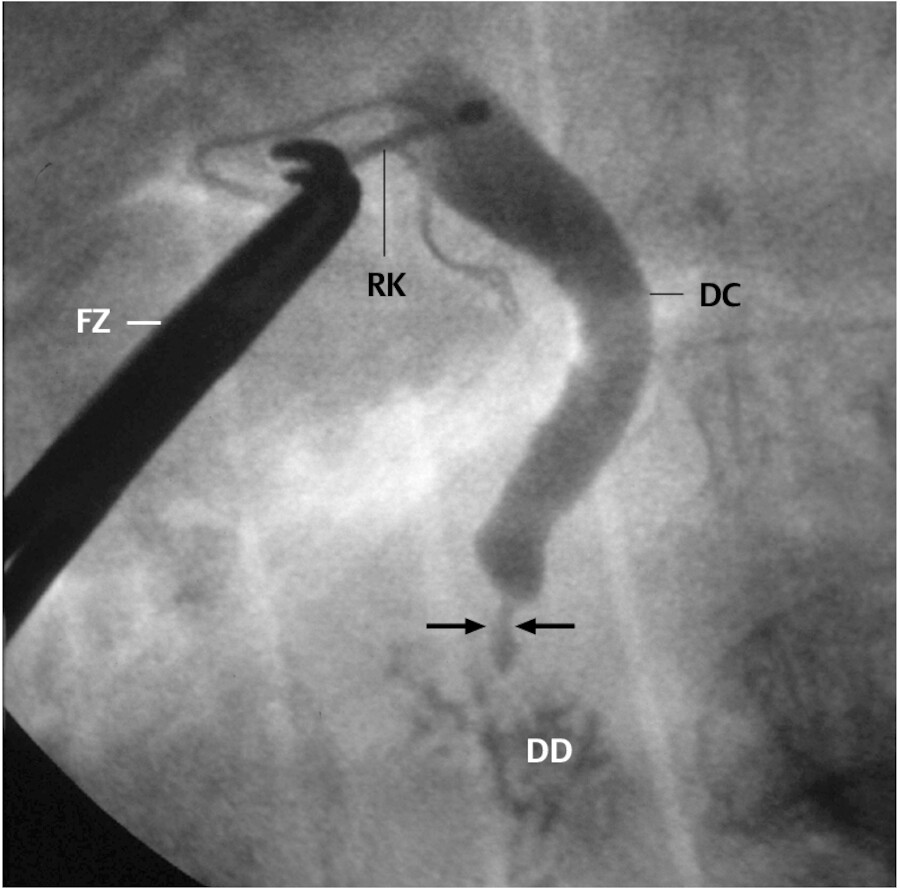
Abb. 25.14 Intraoperative Choledochografie. Eine Fasszange (FZ) hält die Röntgenkanüle (RK). Der Ductus choledochus (DC) füllt sich mit Kontrastmittel, welches in das Duodenum (DD) abfließt. Die Engstellung (Pfeil) entspricht einem Stein im Gallengang (präpapilläres Konkrement).
25.6.3 Choledochusrevision
Definition
Als Choledochusrevision bezeichnet man die Eröffnung und „Revision“ des Gallengangs zur Steinausräumung.
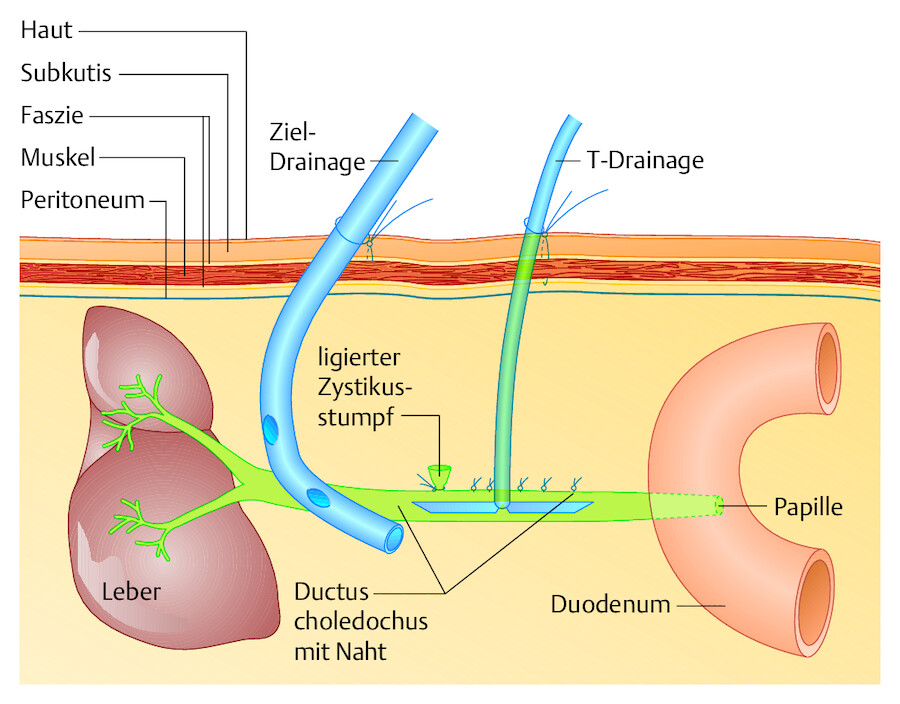
Die Choledochusrevision ist indiziert, wenn sich Steine im Gallengang befinden, die sich nicht endoskopisch durch Papillotomie entfernen lassen. Dazu wird der Ductus choledochus unterhalb des durchtrennten Ductus cysticus („Zystikusstumpf“) über 2 cm eröffnet. Mit geeigneten Löffeln und Zangen lassen sich die Steine aus dem Gallengang entfernen. Die Choledochotomie wird nach Einlegen einer T-Drainage zugenäht. Zusätzlich liegt eine Zieldrainage im Operationsgebiet ( ▶ Abb. 25.15).
Abb. 25.15 Choledochusrevision. Schematischer Längsschnitt durch den Gallengang (liegender Patient). Postoperativer Zustand nach offener Cholezystektomie und Gallengangsöffnung mit Drainagen.
25.6.4 Papillotomie
Definition
Als Papillotomie bezeichnet man die Spaltung der Vater-Papille (Sphinktermuskel des Gallengangs).
Bei Verengung des Sphinktermuskels zwischen Gallengang und Zwölffingerdarm (Papillenstenose) muss die Papille erweitert werden. Bevorzugtes Vorgehen ist die endoskopische Papillotomie (Ablauf ähnlich einer Gastroskopie), wobei der Papillenmuskel unter Sicht geschlitzt wird und präpapilläre Konkremente aus dem Ductus choledochus entfernt werden können (endoskopische Steinextraktion). Bei dem chirurgischen Vorgehen (Laparotomie) erfolgt die Papillenspaltung nach Eröffnung des Zwölffingerdarms(transduodenale Papillotomie).
25.6.5 Biliodigestive Anastomose
Definition
Die Bezeichnung biliodigestive Anastomose ist ein Sammelbegriff für chirurgische Anastomosen zwischen Gallensystem („bilio“) und dem („digestiven“) Magen-Darm-Kanal.
Bei einem Verschlussikterus durch maligne Tumoren (z. B. Pankreaskopfkarzinom oder Gallengangskarzinom) versucht man, eine palliative Umleitung des Galleflusses für die verbleibende Lebenszeit zu erreichen. Dazu wird das nichtoperative Einbringen einer inneren Drainage oder eines Stents auf endoskopisch-transpapillärem oder perkutan-transhepatischem Weg bevorzugt. Die operative Schaffung einer biliodigestiven Anastomose ist deshalb nur noch selten erforderlich. Ein Beispiel (Cholezystojejunostomie) findet sich in ▶ Abb. 15.3.
25.6.6 Folgezustände nach Operationen am Gallenwegsystem
Die Leber bildet pro Tag etwa 1 Liter Galleflüssigkeit, die auf ihrem Weg zum Duodenum zum Teil in der Gallenblase gespeichert und eingedickt wird. Damit entspricht die Gallenblase einem Reservoir (ca. 50 ml). Diese Speicherfunktion entfällt nach einer Cholezystektomie. Der Gallefluss erfolgt dann mehr oder minder kontinuierlich, was klinisch jedoch keine nennenswerten Nachteile mit sich bringt.
Postcholezystektomie-Syndrom Dies ist ein Sammelbegriff für unterschiedliche Oberbauchbeschwerden, die nach einer Cholezystektomie beobachtet werden. Hierzu gehören uncharakteristische Symptome wie Schmerzen, Speiseunverträglichkeit, Übelkeit, Unwohlsein. Diese Symptome sind keinesfalls immer durch den operativen Eingriff bedingt (z. B. Residualstein, zu langer Zystikusstumpf), sondern häufig durch operationsunabhängige Leiden verursacht (z. B. Gastritis, Ulkus, Cholangitis, Dickdarmerkrankung). Eine differenzierte Diagnostik ist also immer erforderlich.
25.7 Pflegeschwerpunkt: Gallen-OP
Die meisten Cholezystektomien erfolgen heute laparoskopisch ( ▶ Abb. 25.12).
25.7.1 Präoperative Pflege
Da bei ca. 5 % der Fälle der Eingriff in eine offene chirurgische Operation ausgedehnt werden muss, erfolgt die Vorbereitung wie für eine konventionelle Bauchoperation. Die Details können Sie im Kap. ▶ 22.6 nachlesen.
25.7.2 Postoperative Pflege bei laparoskopischer Cholezystektomie
Es werden lediglich kleine Bauchschnitte gesetzt und keine Drainagen eingelegt. So ist der Wundschmerz gering, der Patient insgesamt weniger beeinträchtigt und kann i. d. R. 4 Tage nach dem Eingriff das Krankenhaus verlassen. Folgende pflegerische Maßnahmen werden durchgeführt:
Wundmanagement Der erste Verbandwechsel erfolgt am 2. postoperativen Tag. Die Fäden werden am 7. postoperativen Tag gezogen.
Mobilisation Die erste Mobilisation erfolgt am Abend des Operationstags.
Ernährung Am Operationsabend erhält der Patient schluckweise Tee und am 1. postoperativen Tag leichte Kost.
Entlassungsmanagement Am 3. postoperativen Tag wird der Patient i. d. R. entlassen.
Pflegepraxis
Beratung. Viele Patienten klagen nach einem laparoskopischen Eingriff über Nacken- und Schulterschmerzen, was auf das Einbringen von Kohlendioxid in die Bauchhöhle zurückzuführen ist. Lindernd wirken Nacken- und Schultermassagen (Physiotherapie).
25.7.3 Postoperative Pflege bei offen-chirurgischer konventioneller Cholezystektomie
Die Gallenblase wird im Rahmen einer Laparotomie entfernt. Befinden sich Steine im Gallengang, erfolgt anschließend eine Choledochusrevision (Kap. ▶ 25.6.3). Bei diesem Eingriff werden Drainagen eingelegt. Neben den allgemein üblichen postoperativen Pflege- und Überwachungsmaßnahmen (Kap. ▶ 9.3 und Kap. ▶ 9.5) sind einige Besonderheiten zu beachten:
T-Drainage Die T-Drainage hat die Aufgabe, den Abfluss der Galle bei postoperativen Schwellungen im Bereich der Papilla Vateri zu ermöglichen ( ▶ Abb. 25.15). Um einen ungehinderten Abfluss gewährleisten zu können, müssen Sie den Sekretbeutel unterhalb des Patientenniveaus am Bett befestigen. Die Sekretmenge liegt an den ersten 1–3 Tagen bei ca. 1 000 ml täglich. Je mehr der Papillenbereich abschwillt, desto weniger Sekret wird gefördert. Am 4.–5. Tag kann dann der Sekretbeutel schrittweise höher gehängt oder auf Arztanordnung abgeklemmt werden. Somit wird der physiologische Galleabfluss in das Duodenum gesteigert.
Verträgt der Patient diese Maßnahme gut und bleibt beschwerdefrei, wird mittels Cholangiografie ( ▶ Abb. 8.9) der freie Galleabfluss kontrolliert. Anschließend entfernt der Arzt die Drainage, i. d. R. nachdem der Sekretbeutel nochmals für kurze Zeit unter Patientenniveau befestigt wurde, um ein Austreten von Galle nach dem Ziehen der Drainage zu verhindern. Der anschließend aufgebrachte Verband wird auf Austritt von Galle und Nachblutungen kontrolliert. Die Drainageöffnung verschließt sich innerhalb von 1–3 Tagen spontan.
Pflegepraxis
Dislokation der T-Drainage. Wenn Sie beobachten, dass kein oder plötzlich nur noch geringe Mengen Sekret abfließt, der Patient verstärkt über Druckgefühl im Oberbauch und Juckreiz klagt oder einen Ikterus aufweist, müssen Sie einen Arzt informieren. Diese Zeichen können auf eine Dislokation der T-Drainage hinweisen.
Zieldrainage Sie liegt im Wundgebiet ( ▶ Abb. 25.15), zusätzlich zur T-Drainage. Erfolgte keine Choledochusrevision, wird sie am 3.–4. postoperativen Tag gezogen, ansonsten meist erst 1–2 Tage nach dem Entfernen des T-Drains. So ist gewährleistet, dass die austretende Galle nach Entfernung der T-Drainage über die Zieldrainage abfließen kann.
Magensonde Die Magensonde wird frühzeitig entfernt. Bei Fast Track wird sie erst gar nicht gelegt oder am 1. postoperativen Tag entfernt.
Mobilisation und Lagerung Die Frühmobilisation kann bereits am Abend des Operationstags erfolgen. Eine bauchdeckenentspannende Lagerung ( ▶ Abb. 12.10d) kann das Wundgebiet entlasten und Schmerzen reduzieren.
Ernährung und Ausscheidung Am 1. postoperativen Tag darf der Patient schluckweise Tee zu sich nehmen, danach kann der Nahrungsaufbau langsam erfolgen. Die Darmtätigkeit muss überwacht werden, nach 3–4 Tagen ohne spontane Stuhlentleerung sollten Sie Abführmaßnahmen einleiten (z. B. ein Klistier).