
31 Erkrankungen der Arterien
31.1 Untersuchungsmethoden
Die Palpation (Pulsfühlen) ermöglicht eine gute Orientierung über den Gefäßstatus des Patienten ( ▶ Abb. 31.1).
Spezielle apparative Verfahren zur Untersuchung der Blutströmungsverhältnisse sind die Doppler-Sonografie mit Ermöglichung des Knöchel-Arm-Index (ABI, Kap. ▶ 8.2.2) und die Farbduplex-Sonografie (Kap. ▶ 8.2.1). Bei der Oszillografie werden die pulssynchronen Volumenveränderungen in den Arterien mithilfe von Blutdruckmanschetten und Pulssensoren grafisch dargestellt.
Zur weiterführenden Diagnostik ist die 3-dimensionale Darstellung der Arterien im Computertomogramm (CT-Angio) oder in der Kernspintomografie (MR-Angio) Standard (Kap. ▶ 8.1). Die invasive Katheterangiografie (DSA) wird zur Diagnostik kaum noch eingesetzt. Die DSA ist nur indiziert, wenn eine therapeutische Maßnahme mit dem Katheter möglich erscheint (PTA oder Stent).
Abb. 31.1 Pulsstatus. Die wichtigsten tastbaren arteriellen Pulse.

31.2 Akute Arterienverschlüsse
Thrombose und Embolie können zu einem akuten arteriellen Verschluss führen. Meistens betrifft der akute Verschluss die A. femoralis (Oberschenkelarterie), seltener die A. brachialis (Oberarmarterie) oder die obere Mesenterialarterie (Darm). Der akute Verschluss einer wichtigen Arterie führt zur akuten Ischämie.
Merke
Der akute arterielle Gefäßverschluss ist ein chirurgischer Notfall.
Die Wiederherstellung der arteriellen Durchblutung (Revaskularisation) muss bei kompletter Ischämie innerhalb von 6 Stunden erfolgen.
Pflegepraxis
Beobachtung. Jeder plötzliche Extremitätenschmerz ist verdächtig auf eine akute arterielle Ischämie durch Thrombose oder Embolie.
Für die typischen Symptome gilt der Merksatz: „6 × P“:
-
Pain = Schmerz
-
Pulseless = fehlender Puls
-
Paleness = Blässe (und Kälte)
-
Paresthesia = Gefühlsverlust
-
Paralyse = Bewegungsverlust
-
Prostration = Kreislaufversagen (selten)
Pflegepraxis
Notfallmaßnahmen. Wichtigste Sofortmaßnahmen bei akutem arteriellem Extremitätenverschluss:
-
Arm oder Bein tief lagern (bessere Blutversorgung)
-
Extremität in Watte wickeln (geringerer Wärmeverlust)
-
intravenöse Heparinisierung nach Arztanordnung (ca. 5000 I. E., soll eine weitere Thrombusbildung verhindern)
31.2.1 Arterielle Thrombose
Definition
Als Thrombose bezeichnet man einen akuten Gefäßverschluss, der durch eine lokale Gerinnselbildung (Thrombus) entsteht. Der Thrombus verbleibt im Gegensatz zur Embolie an Ort und Stelle, wird also nicht mit dem Blutstrom abgeschwemmt.
Ursache Voraussetzung ist ein vorbestehender Gefäßschaden (Arteriosklerose) oder eine thrombogene Gefäßinnenfläche (z. B. Thrombose nach einer Bypassoperation = Bypassverschluss).
Therapie Bei einer arteriellen Thrombose erfolgt die Therapie bevorzugt durch eine medikamentöse Gerinnselauflösung (Katheterlyse), ansonsten operativ durch Thrombektomie (Kap. ▶ 31.2.4).
Zusatzinfo
Arterielle oder venöse Thrombose. Die Thrombose in einer Arterie führt zur arteriellen Ischämie. Völlig anders sind die Verhältnisse bei einer Thrombose im Venensystem: Hier resultiert eine Beinschwellung mit der Gefahr einer Lungenembolie ( ▶ Tab. 30.2 ).
31.2.2 Arterielle Embolie
Definition
Als Embolie bezeichnet man die Verstopfung eines Blutgefäßes durch einen Embolus. Ein Embolus ist ein mit dem Blutstrom verschleppter Thrombus.
Ursache Voraussetzung für eine Embolie ist eine Streuquelle, aus der das thrombotische Material stammt und bei Ausschwemmung in den Kreislauf zum Embolus wird. Der wichtigste Ursprung für Embolien des großen Kreislaufs ist das linke Herz.
Folgende Veränderungen können zu Thrombenbildung im linken Herzen führen, sodass eine embolische Streuung in das arterielle System erfolgen kann:
-
absolute Arrhythmie mit Vorhofflimmern (häufigste Ursache), führt zu Thrombenbildung im linken Vorhof
-
Mitralklappenfehler (besonders Mitralstenose)
-
künstlicher Herzklappenersatz
-
Herzschrittmacher
-
narbige Wandveränderungen nach Myokardinfarkt
-
Herzwandaneurysma
Therapie Im Gegensatz zur Thrombose erfolgt die Embolektomie bevorzugt operativ (Kap. ▶ 31.2.4).
31.2.3 Spezielle Krankheitsbilder
31.2.3.1 Femoralisembolie
Die Femoralisembolie ist der häufigste akute Arterienverschluss des Menschen. Das Gerinnsel bleibt typischerweise in der Leistenregion haften.
Symptome Die Zeichen der akuten Ischämie sind mehr oder weniger deutlich ausgeprägt. In der Leiste ist der Puls meist noch tastbar, weiter distal finden sich keine Pulse mehr.
Diagnostik Für die Diagnose und zur Stellung der Operationsindikation reicht die klinische Untersuchung (Pulsverlust), das EKG und eine Duplex-Sonografie. Ein CT oder eine Angiografie ist bei typischem Befund nicht erforderlich.
Therapie Die Embolektomie erfolgt über einen Leistenschnitt mit einem Ballonkatheter in Lokalanästhesie (Kap. ▶ 31.2.4). Zur Prophylaxe ist nach kardialer Untersuchung (Streuquelle?) eine dauerhafte Blutverdünnung mit Marcumar üblich.
Fallbeispiel
Femoralisembolie. Frau Embde (76) hat Herzrhythmusstörungen und einen Schrittmacher. Sie lebt allein, kommt aber gut zu Hause zurecht. Heute Morgen um 6 Uhr wird sie wach, weil das rechte Bein wehtut. Es ist auch ganz kalt und blass und sie kann kaum auftreten. Sie ruft den Notdienst und kommt in die Klinik. Man fragt sie nach vorbestehenden Gehbeschwerden im Sinne einer Schaufensterkrankheit. „Ich konnte bis gestern problemlos über eine Stunde spazieren gehen“ sagt Frau Embde, „der Schmerz kam heute Morgen ganz plötzlich innerhalb von Minuten.“ Der Ambulanzarzt untersucht die Beine. „Links sind alle Pulse tastbar“, stellt er fest, „rechts aber nur der Leistenpuls.“ Das klinische Bild mit bekannten kardialen Rhythmusstörungen (Streuquelle für die Embolie), plötzlicher Ischämie und erhaltenen Pulsen am gegenseitigen gesunden Bein (keine vorbestehende AVK) ist nahezu beweisend für die arterielle Embolie. Bei der Duplex-Sonografie sieht man den Gefäßverschluss in der Femoralisgabel rechts. „Die Diagnose ist eindeutig, wir brauchen keine Angiografie, die würde nur unnötig Zeit kosten“, heißt es. Frau Embde wird zur Femoralisembolektomie in Lokalanästhesie im OP angemeldet. Der OP-Koordinator weiß, dass eine arterielle Embolie ein Notfall ist wie eine arterielle Blutung und stoppt den nächsten freien OP-Saal, in dem eine Schenkelhalsfraktur geplant war. Eine Stunde später ist das Gerinnsel aus der Oberschenkelarterie entfernt. Frau Embde kann das Bein wieder schmerzfrei bewegen und die Fußpulse rechts sind tastbar. Frau Embde muss dauerhaft Marcumar zur Blutverdünnung einnehmen, um weitere embolische Ereignisse möglichst zu verhindern.
Zusatzinfo
Leriche-Syndrom. Als Leriche-Syndrom (Pariser Chirurg, 1879–1955) bezeichnet man den Verschluss der Aortenbifurkation. Folge ist eine Ischämie beider Beine.
31.2.3.2 Brachialisembolie
Eine Brachialisembolie ist ein akuter Verschluss der Oberarmarterie durch einen Embolus.
Symptome Der Radialispuls ist am betroffenen Arm nicht tastbar. Oft verspürt der Patient nur geringe Schmerzen, weil die Kollateralgefäße am Arm besser ausgebildet sind als am Bein.
Therapie Die Embolektomie erfolgt über einen kleinen Schnitt in der Ellenbeuge mit einem Ballonkatheter (Fogarty-Katheter) in Lokalanästhesie. Nach erfolgreicher Rekanalisation ist der Radialispuls sofort tastbar (Kap. ▶ 31.2.4).
31.2.3.3 Mesenterialarterienverschluss
Ein Mesenterialarterienverschluss (Mesenterialinfarkt) ist ein Verschluss der Darmarterien mit der Folge der Darmgangrän.
Symptome Durch Embolie oder Thrombose kann ein akuter Verschluss der oberen Darmarterie (A. mesenterica superior) auftreten. Folge ist eine Darmischämie (Mesenterialinfarkt). Die Ischämie führt zur Darmgangrän, die im schwersten Fall den gesamten Dünn- und Dickdarm betrifft ( ▶ Abb. 23.13).
Typisch ist der sog. 3-Phasen-Verlauf:
-
1. Phase (1.–6. Stunde): plötzliche, akute Bauchschmerzen
-
2. Phase (bis zu 12 Stunden): Die Beschwerden verringern sich (freies Intervall), allerdings ist der Patient in einem schlechten Allgemeinzustand.
-
3. Phase (12 Stunden): Die Symptomatik entspricht einem paralytischen Ileus mit hoher Leukozytose, was auf die Durchwanderungsperitonitis zurückzuführen ist, die von den nekrotischen Darmabschnitten ausgeht.
Ohne Behandlung folgt der Tod im septisch-toxischen Schock aufgrund bakterieller Peritonitis.
Therapie Nur die Frühoperation bietet Aussicht auf Erfolg. Bei embolischem Verschluss der A. mesenterica superior wird die Darmarterie embolektomiert (Mesenterica-Embolektomie). Ischämische Darmabschnitte werden reseziert.
Oftmals ist jedoch so viel Darm zerstört, dass eine Resektion nicht mehr infrage kommt. Dann muss der Eingriff als Probelaparotomie beendet werden und der Patient verstirbt nach Stunden oder Tagen an der unvermeidlichen Peritonitis.
31.2.3.4 Lungenembolie
Eine Lungenembolie ist ein partieller oder totaler Verschluss der Lungenarterien durch einen Embolus aus den Beinvenen.
Merke
Eine Lungenembolie kann nach jeder Operation oder jeder Vollnarkose auftreten (Häufigkeit 1 : 1000), aber auch bei nichtchirurgischen Patienten.
Ursache Die Lungenembolie ist Folge einer ▶ tiefen Venenthrombose im Becken-, Oberschenkel- oder Wadenbereich. Über die V. cava inferior gelangt der Embolus in das rechte Herz und in die Lungenstrombahn ( ▶ Abb. 31.2).
Abb. 31.2 Lungenembolie. Das Blutgerinnsel gelangt von den Beinvenen über das rechte Herz in die Lungenarterie.

Symptome Insgesamt ähnelt das Bild einem Myokardinfarkt:
-
akuter thorakaler Schmerz
-
Dyspnoe
-
Zyanose
-
Tachykardie
-
Blutdruckabfall
Meist strömen nur kleine Emboli in die Lungenstrombahn, wodurch nur periphere Arterien verschlossen werden. Die Beschwerden können dann gering sein (Tachykardie, leichte Dyspnoe) und sich innerhalb weniger Tage zurückbilden.
Wird ein größerer Teil der pulmonalen Strombahn oder gar der gesamte Truncus pulmonalis versperrt, so resultiert eine fulminante Lungenembolie (fulmen, lateinisch: Blitz), die „wie ein Blitz aus heiterem Himmel“ zum Tod innerhalb weniger Minuten führen kann (Rechtsherzversagen).
Diagnostik Die Blutgasanalyse zeigt das Ausmaß der respiratorischen Insuffizienz. Zum Ausschluss eines Myokardinfarkts werden die Herzenzyme bestimmt. Das EKG und eine Ultraschalluntersuchung zeigen die typische Rechtsherzbelastung bei einer Lungenembolie. Die Ausdehnung der Embolisierung wird am besten durch ein CT mit intravenöser Kontrastmittelgabe erfasst. Die Duplex-Sonografie der Beinvenen erfolgt zum Ausschluss bzw. Beweis der ursächlichen Venenthrombose.
Therapie Schon bei klinischem Verdacht muss eine sofortige Antikoagulation mit Heparin erfolgen, noch vor Abschluss der Diagnostik (z.B. 5000 I.E. als Bolus i.v.). In leichten Fällen sind die therapeutische Vollheparinisierung und die Sauerstoffgabe über eine O2-Sonde ausreichend. Therapie der Wahl ist die medikamentöse Lyse. Bei schwerer kardiopulmonaler Beeinträchtigung kommt eine katheterbasierte Thrombusentfernung (Aspirationsembolektomie) oder eine offene OP infrage.
Rezidivprophylaxe Nach einer Lungenembolie erfolgt eine Blutverdünnung mit dem Vitamin-K-Antagonisten Marcumar oder einem Faktor-X-Hemmer aus der Gruppe der DOAKs (Kap. ▶ 9.2.2) wie z.B. Rivaroxaban (Xarelto) für mindestens 3 Monate. Die Zeitdauer hängt vom individuellen Risikoprofil ab.
31.2.3.5 Luftembolie
Als Luftembolie bezeichnet man den partiellen oder totalen Verschluss der Lungenarterien durch Luftblasen.
Ursache Luft kann nur in das Kreislaufsystem gelangen, wenn eine offene Verbindung zwischen Vene und Außenwelt besteht und ein negativer Venendruck vorliegt. Die Luft strömt über das rechte Herz in die Lungenarterien.
Die häufigste Ursache einer Luftembolie ist ein fehlerhafter Umgang mit zentralvenösen Kathetern. Auch bei Infusionen mit ungenügender Entlüftung des Schlauchsystems kann eine Luftembolie entstehen. Mikroblasen im System haben aber keine ernsthaften Konsequenzen. Erst eine Luftmenge von mehr als 0,4 ml pro Kilogramm Körpergewicht und pro Minute hat tödliche Konsequenzen. Das sind 28 ml Luft bei einer 70 kg schweren Person, was in etwa der Füllmenge eines gesamten lnfusionsbestecks entspricht.
Zusatzinfo
Periphere VVK. Bei Diskonnektion eines lnfusionsschlauchs an einer peripheren Venenverweilkanüle ist die Gefahr einer Luftembolie gering, weil kein Unterdruck im Venensystem herrscht.
Pflegepraxis
Umgang mit zentralvenösen Kathetern. Grundsätzlich muss
-
das Infusionssystem immer komplett entlüftet und
-
der venöse Katheter vor Diskonnektion immer abgeklemmt werden.
Bei einem Patienten mit einem niedrigen zentralen Venendruck (ZVD), z.B. aufgrund eines massiven Flüssigkeitsdefizits, kann zusätzlich der Oberkörper tief gelagert werden, um den ZVD so zu erhöhen.
Symptome und Therapie Die Symptome sind ähnlich wie bei einer ▶ Lungenembolie. In schweren Fällen erfolgt eine Herzpunktion bzw. ein Rechtsherzkatheter oder eine Reanimation.
31.2.4 Operative Verfahren bei akuten Verschlüssen
31.2.4.1 Katheterlyse
Als Katheterlyse bezeichnet man die medikamentöse Auflösung eines Gerinnsels über einen in der Arterie liegenden Katheter. Der Angiografiekatheter wird unter Röntgendurchleuchtung bis zum Thrombus vorgeschoben. Dann wird das Medikament (z. B. Urokinase, rt-PA) kontinuierlich mithilfe einer Infusionspumpe (Perfusor) über mehrere Stunden injiziert. Nach erfolgreicher Thrombolyse ist die ursächliche Stenose im arteriellen Gefäß angiografisch erkennbar und kann durch Ballondilatation (PTA) oder operativ (Bypass) beseitigt werden.
Pflegepraxis
Überwachung. Die Katheterlyse erfordert eine Überwachung auf Intensivstation.
31.2.4.2 Thrombektomie
Eine Thrombektomie ist die operative Entfernung eines Thrombus aus einem Blutgefäß oder einem Bypass. Die technische Durchführung entspricht der Embolektomie (s.u.).
31.2.4.3 Embolektomie
Eine Embolektomie ist die operative Entfernung eines Embolus aus einer Arterie. Die Embolektomie erfolgt mit einem speziellen Ballonkatheter (Fogarty-Katheter). Die Länge des Fogarty-Katheters ermöglicht es, auch Emboliematerial fernab der Inzisionsstelle zu erreichen (Fernembolektomie). Die ▶ Abb. 31.3 zeigt die Prozedur einer Femoralisembolektomie, ▶ Abb. 31.4 zeigt eine Brachialisembolektomie.
Abb. 31.3 Femoralisembolektomie.
Abb. 31.3a Von einem Schnitt in der Leiste mit Eröffnung der Arterie wird der Fogarty-Katheter mit nicht aufgeblasenem Ballon an dem Gerinnsel vorbeigeschoben.

Abb. 31.3b Nach Füllung des Gummiballons wird der Katheter zurückgezogen. Der Embolus quillt aus der Arterienöffnung.

Abb. 31.4 Brachialisembolektomie. Der Katheter (K) mit seinem Ballon (B) am Ende zieht das Gerinnsel (G) aus der Oberarmarterie (A).

Zusatzinfo
Medikamentöse Rezidivprophylaxe. Bei Patienten mit einer arteriellen Embolie ist eine dauerhafte Blutverdünnung erforderlich.
31.3 Chronische Arterienverschlüsse
31.3.1 Arteriosklerose
Definition
Die Arteriosklerose (Gefäßverkalkung) ist eine Verschleißerkrankung der Arterien mit zunehmender Verengung des inneren Lumens.
Die Arteriosklerose kann unterschieden werden in:
-
AVK: Die arterielle Verschlusskrankheit (AVK) ist eine Systemerkrankung, die alle arteriellen Gefäße mehr oder weniger stark befallen kann.
-
pAVK: Die periphere arterielle Verschlusskrankheit (pAVK) liegt vor, wenn die Arterien der Beine betroffen sind.
Ursache Neben einer erblichen Komponente begünstigen vaskuläre Risikofaktoren das Entstehen einer Arteriosklerose:
-
arterielle Hypertonie
-
Nikotinabusus
-
erhöhte Blutfettwerte
-
Diabetes mellitus
-
Dialyse
-
Adipositas
-
Bewegungsmangel
-
Stress und psychosoziale Faktoren
-
genetische Disposition (Männer, Infarkte in der Familie)
Liegen mehrere Risikofaktoren vor (z.B. Übergewicht, Nikotinabusus und Diabetes mellitus), so ist das Arterioskleroserisiko deutlich erhöht.
Lokalisation Arteriosklerotische Stenosen oder Verschlüsse betreffen bevorzugt die in ▶ Tab. 31.1 genannten Gefäße.
|
Lokalisation |
Komplikation |
|
Koronargefäße |
Herzinfarkt |
|
Oberschenkel und Beckenarterien |
Schaufensterkrankheit, „Raucherbein“ |
|
Halsschlagader |
Schlaganfall |
|
Darmarterien |
Mesenterialinfarkt |
|
Nierenarterien |
renovaskuläre Hypertonie |
|
Hauptschlagader |
Bauchaortenaneurysma |
In der Gefäßchirurgie steht die Arteriosklerose der Beinarterien (pAVK) im Vordergrund.
Symptome bei pAVK Die Stadieneinteilung der pAVK (untere Extremität) richtet sich ausschließlich nach dem klinischen Beschwerdebild ( ▶ Tab. 31.2 ):
-
pAVK Stadium I: Arteriosklerotische Stenosen entwickeln sich langsam; daher hat der Organismus Zeit, die drohende Ischämie durch Bildung von Kollateralen (Umgehungskreislauf) zu kompensieren. Deshalb sind Patienten in diesem Stadium der pAVK beschwerdefrei, auch wenn kein Puls tastbar und die Becken- oder Oberschenkelarterie komplett verschlossen ist.
-
pAVK Stadium II: Ist das Kollateralnetz unzureichend, so treten bei körperlicher Anstrengung Beschwerden in der entsprechenden Extremität auf. Typisch ist der Wadenschmerz beim Gehen, der das Weiterlaufen beeinträchtigt (Claudicatio intermittens = zeitweiliges Hinken) oder den Patienten sogar zu gelegentlichem Stehenbleiben zwingt („Schaufensterkrankheit“).
-
pAVK Stadium III: Bei weiterer Verschlimmerung der pAVK treten die Schmerzen nicht nur bei Belastung, sondern auch in Ruhe auf (Ruheschmerz).
-
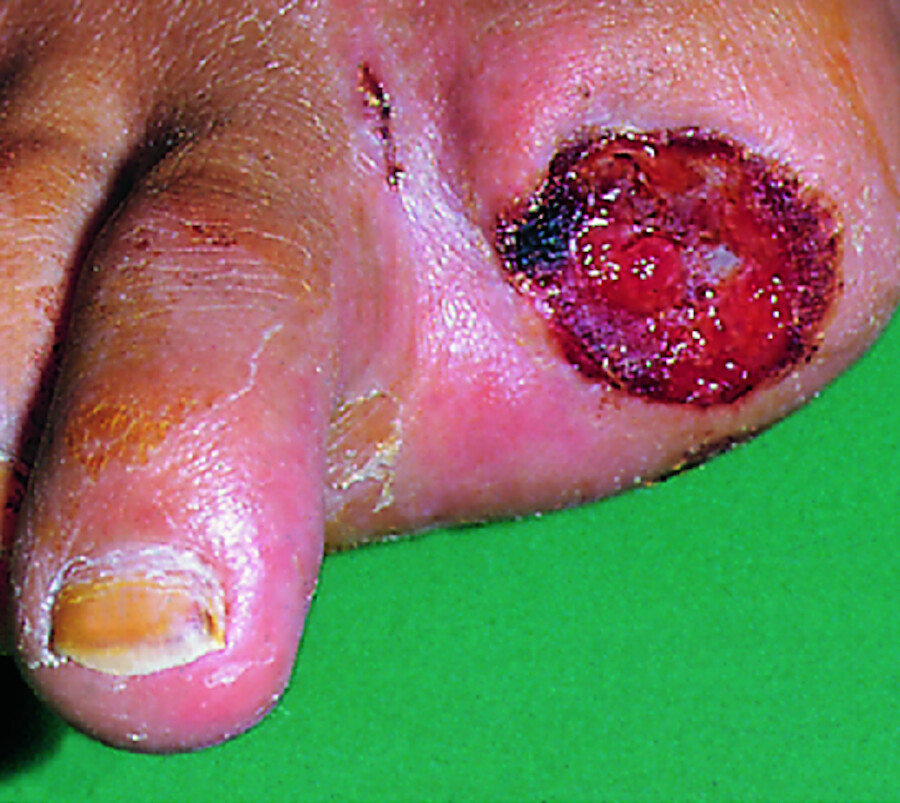
pAVK Stadium IV: Bei dieser schwersten Form der pAVK ist die Durchblutung so gering, dass das körpereigene Gewebe abstirbt. Die ischämisch bedingte Gewebenekrose tritt bevorzugt im Bereich der Fußzehen auf, wo die Sauerstoffversorgung am geringsten ist ( ▶ Abb. 31.5). Die Nekrose tritt als Ulkus oder als Gangrän in Erscheinung.
Abb. 31.5 pAVK Stadium IV.
Abb. 31.5a Nekrose der Großzehe vor Bypassoperation.

Abb. 31.5b Granulierende Wunde 2 Wochen nach Grenzzonenamputation (derselbe Patient).
|
Stadium |
Symptome |
|
Stadium I |
keine Beschwerden (asymptomatisch) |
|
Stadium II |
Gehstreckenbegrenzung (= Claudicatio intermittens) |
|
Gehstrecke über 200 m |
|
Gehstrecke unter 200 m |
|
Stadium III |
Ruheschmerzen |
|
Stadium IV |
Ulkus, Nekrose (= Gangrän) |
Komplikationen bei pAVK Bei der pAVK besteht immer die Gefahr der irreversiblen Minderdurchblutung. Bei Fortschreiten der Arteriosklerose kann es zur Gangränbildung kommen ( ▶ Abb. 31.5 u. ▶ Abb. 31.6).
Hier unterscheidet man:
-
trockene (= nicht infizierte) Gangrän: Die Zehen erhalten durch Austrocknung ein mumifiziertes Aussehen (schwarze Verfärbung).
-
feuchte (= bakteriell infizierte) Gangrän: Hier hat die Zersetzung der Nekrose durch Fäulnisbakterien begonnen, dies führt zu einem übel riechenden, jauchigen Zerfall. Bei der feuchten Gangrän besteht die Gefahr eines aufsteigenden Infekts (Phlegmone), was zum Extremitätenverlust oder zur Sepsis führen kann.
Abb. 31.6 pAVK Stadium IV. Feuchte Gangrän mit Infektzeichen am linken Fuß, trockene Gangrän am rechten Fuß.

Therapie bei pAVK
Konservative Therapie Bei der pAVK im Stadium I und II sind konservative Maßnahmen meistens ausreichend:
-
Ausschaltung der arteriosklerosebegünstigenden Risikofaktoren
-
Gehtraining (täglich 1–2 Stunden, Pause bei Schmerzbeginn, dann weiter)
-
durchblutungsfördernde Medikamente
Operative Therapie Bei der pAVK im Stadium III und IV sind invasive Maßnahmen indiziert. Je nach Befund kommen interventionelle Katheterverfahren oder gefäßrekonstruktive Operationen zum Einsatz (Kap. ▶ 31.3.3).
Therapie bei feuchter Gangrän Die Behandlung verläuft nach Möglichkeit in 3 Schritten:
-
Infektsanierung: Durch lokale Wundbehandlung und systemische Antibiotikagabe muss die feuchte Gangrän in eine trockene umgewandelt werden.
-
Revaskularisierung: Durch interventionelle Maßnahmen oder eine gefäßchirurgische Operation wird eine Eröffnung des stenosierten Gefäßes angestrebt.
-
Amputation: Die Amputation des nekrotischen Gewebes, die bei peripherer Gangrän möglichst im Sinne einer Grenzzonenamputation (Kap. ▶ 31.6) erfolgen sollte, wird erst ca. 10 Tage später vorgenommen, wenn die Durchblutung der Extremität für eine Heilung ausreichend ist und sich die Nekrose demarkiert (abgegrenzt) hat.
Pflegepraxis
pAVK. Grundsätzlich gilt für alle Patienten mit ischämiebedrohtem Bein (pAVK Stadium III oder IV):
-
Beine tief lagern, zur Förderung der Durchblutung
-
Feuchtigkeit reduzieren (keine Fußbäder, Vollbäder), um die Entwicklung einer feuchten Gangrän nicht zu begünstigen
-
Kompression vermeiden (keine Kompressionsverbände, -strümpfe oder medizinische Thromboseprophylaxestrümpfe)
-
sorgfältige Hautpflege und Beobachtung auf Läsionen
-
Beine warm halten
31.3.2 Spezielle Krankheitsbilder bei AVK
31.3.2.1 Karotisstenose
Bei der Karotisstenose handelt es sich um eine Verengung der inneren Halsschlagader. Die arteriosklerotische Stenose befindet sich am Abgang der A. carotis interna.
Symptome Von dem stenosierenden Material in der inneren Halsschlagader ( ▶ Abb. 31.7) können sich kleine Partikel ablösen und in das Gehirn embolisieren. Dadurch entstehen reversible oder irreversible neurologische Halbseitensymptome.
Zusatzinfo
Seitenwechsel im Gehirn. Wegen der Pyramidenbahnkreuzung im Gehirn betreffen die Lähmungen die Gegenseite. So kommt es bei einer rechtsseitigen Karotisstenose zu embolischen Verschlüssen in der rechten Hirnhemisphäre mit Lähmungen der linken Körperhälfte.
Abb. 31.7 Karotisstenose.
Abb. 31.7a Duplex-Sonografie. Von der A. carotis interna ist nur der kleine farbige Bereich (*) durchblutet. Der Querschnitt der Halsschlagader ist mit Punkten umrandet.

Abb. 31.7b Angiografie. Einengung (Pfeil) der inneren Halsschlagader.

Abb. 31.7c OP-Foto. Aufgeschnittene Halsschlagader (*) mit der hochgradigen Stenose (Pfeile).
Von der zerklüfteten Innenfläche nehmen die Embolien ihren Ausgang in das Gehirn.

Typisch ist die flüchtige (Sekunden bis Minuten andauernde) kontralaterale Lähmung, die man als TIA bezeichnet (transitorische ischämische Attacke).
Streut die Mikroembolie in die Netzhaut, so resultiert ein meist kurzfristiger Visusverlust des gleichseitigen Auges (Amaurosis fugax).
Bilden sich die neurologischen Ausfälle nicht zurück, handelt es sich um einen Schlaganfall (Apoplex).
Therapie Bei einer frischen (wenige Stunden) Embolie in das Gehirn kann eine medikamentöse Lyse indiziert sein, weshalb geprüft werden muss, ob die Sofortverlegung in eine Spezialeinheit für Schlaganfallpatienten (Stroke Unit) möglich ist. Ansonsten erfolgt bei neurologischer Symptomatik oder hochgradiger Stenose im Intervall die operative Ausschälung(Karotis-TEA) oder eine ▶ PTA mit Stent.
31.3.2.2 Subclavian-Steal-Syndrom
Als Subclavian-Steal-Syndrom bezeichnet man den Verschluss der Armarterie (A. subclavia) an ihrem Abgang mit retrograder Blutversorgung des gleichseitigen Armes über die Vertebralarterie.
Symptome Bei einem Verschluss der A. subclavia erfolgt die Blutversorgung des gleichseitigen Armes über das Gehirn ( ▶ Abb. 31.8). Besonders bei Muskeltätigkeit des betroffenen Armes (stärkerer Blutfluss) wird dem Gehirn durch den Umgehungskreislauf über die Vertebralarterie Blut entzogen (Steal-Syndrom oder Anzapfsyndrom). Dies führt zu reversiblen neurologischen Symptomen (z. B. Schwindel).
Abb. 31.8 Subclavian-Steal-Syndrom.
a Normalerweise wird das Gehirn durch 4 Arterien versorgt, die im Schädel über einen Kollateralkreislauf in Verbindung stehen.
b Bei Verschluss einer A. subclavia erfolgt die Blutversorgung des gleichseitigen Armes indirekt über den Gehirnkreislauf, wobei die gleichseitige A. vertebralis retrograd durchströmt wird.

Therapie Bei Beschwerden erfolgt die Ballondilatation (PTA), evtl. mit Stentimplantation. Wegen zu starker Verkalkung gelingt diese manchmal nicht. Dann ist eine operative Rekonstruktion des Blutwegs durch Subclavia-Transposition (Einnähen der A. subclavia in die A. carotis communis) oder einen Karotis-Subclavia-Bypass indiziert.
31.3.2.3 Thoracic-Outlet-Syndrom (TOS)
Als Thoracic-Outlet-Syndrom (TOS) oder obere Brustkorbenge bezeichnet man eine Kompression von Arterie, Vene oder Nerv an der Stelle, wo diese Strukturen den knöchernen Thorax verlassen.
Symptome Ursächlich ist eine anatomische Enge zwischen 1. Rippe und Schlüsselbein oder eine Halsrippe ( ▶ Abb. 16.5). Die wichtigsten Symptome sind Parästhesien und Durchblutungsstörungen am Arm bei Bewegungen im Schultergelenk, insbesondere beim Hochhalten des Armes (Wäsche aufhängen).
Therapie Nur bei erheblichen Beschwerden erfolgt eine operative Korrektur (Halsrippenentfernung, Resektion der 1. Rippe).
31.3.2.4 Nierenarterienstenose
Die Verengung einer Nierenarterie kann bei älteren Menschen durch Arteriosklerose entstehen, wesentlich seltener bei jüngeren Menschen durch fibromuskuläre Dysplasie.
Symptome Über den Renin-Angiotensin-Aldosteron-Mechanismus führt eine Nierenarterienstenose zum Bluthochdruck (renovaskuläre Hypertonie). Harnvolumen und Kreatininwert sind selbst bei völligem Ausfall einer Niere normal, sofern das kontralaterale Organ funktionsfähig ist.
Therapie Eine Nierenarterienstenose kann dilatiert (PTA oder Stent) oder operativ korrigiert werden (aortorenaler Bypass).
31.3.2.5 pAVK vom Beckentyp
Als AVK vom Beckentyp bezeichnet man Durchblutungsstörungen der Beckenarterien, fast immer durch Stenosen oder Arterienverschluss im Rahmen der Arteriosklerose bedingt.
Symptome Der Pulsstatus ergibt bereits in der Leiste einen abgeschwächten oder fehlenden Puls. Zudem bestehen Schmerzen im Bein nach längerem Gehen (je nach Stadium der AVK, ▶ Tab. 31.2 ).
Therapie Kurzstreckige Stenosen und Verschlüsse können interventionell behandelt werden (PTA oder Stent). Operative Therapiemöglichkeiten ( ▶ Abb. 31.9) sind die Ausschälplastik (Becken-TEA) oder die Implantation einer Kunststoffprothese (Bypass).
Abb. 31.9 Operative Verfahren bei Beckenarterienverschluss.
Abb. 31.9a Retrograde Becken-TEA.

Abb. 31.9b Iliakofemoraler Cross-over-Bypass.

Abb. 31.9c Unilateraler aortofemoraler Bypass (hier mit Anschluss an die A. femoralis profunda = aortoprofundaler Bypass).

Abb. 31.9d Aortobifemoraler Bypass (Bifurkationsbypass = Y-Prothese).

Abb. 31.9e Axillofemoraler Bypass.

31.3.2.6 pAVK vom Oberschenkeltyp
Verengungen (Stenosen) und Verschlüsse an der Oberschenkelarterie (A. femoralis) werden als pAVK vom Oberschenkeltyp bezeichnet.
Merke
pAVK. Die Oberschenkelarterie ist die häufigste Lokalisation für arteriosklerotische Durchblutungsstörungen.
Symptome Unterhalb der Leiste sind keine Pulse tastbar. Typisch ist der Wadenschmerz beim Gehen, der zum Stehenbleiben zwingt (Schaufensterkrankheit = Claudicatio intermittens = pAVK Stadium II).
Therapie Bei ausreichender Gehstrecke ist keine invasive Behandlung erforderlich. Gehtraining und Abbau der Risikofaktoren (Nikotinkarenz, Blutdruckeinstellung) sind geeignete Maßnahmen. Bei erheblichem Leidensdruck oder amputationsbedrohter Extremität (AVK Stadium III oder IV) sind interventionelle oder operative Maßnahmen indiziert.
PTA und Stent Bei kurzstreckigen Stenosen ist eine kathetergestützte Ballonaufdehnung (PTA) ▶ möglich. Bei längeren Verengungen wird über den Katheter ein Stent zum Offenhalten der Arterie eingelegt ( ▶ Abb. 31.13).
Profundaplastik Ausschälung der tiefen Oberschenkelarterie an ihrem Abgang, mit oder ohne Kunststoffpatch ( ▶ Abb. 31.10).
Femoropoplitealer Bypass Die Umleitung überbrückt den Verschluss der A. femoralis. Der Bypass beginnt an der Femoralisgabel und endet ober- oder unterhalb des Kniegelenks ( ▶ Abb. 31.10). Bypassmaterial ist entweder die V. saphena magna (Venenbypass) oder Kunststoff (Kunststoffbypass).
Abb. 31.10 Operative Verfahren bei Oberschenkelarterienverschluss.
Abb. 31.10a Profundaplastik (Verschluss der Arteriotomie hier mit einem Kunststoff-Patch).

Abb. 31.10b Femoropoplitealer Bypass oberhalb des Knies.

Abb. 31.10c Femoropoplitealer Bypass kniegelenksüberschreitend.

Femorokruraler Bypass Ist auch die A. poplitea verschlossen, wird der Bypass an eine der 3 Unterschenkelarterien anastomosiert („krural“ von lateinisch: crus = Unterschenkel). Als Bypassmaterial wird die V. saphena magna bevorzugt (Venenbypass, ▶ Abb. 31.11).
Die V. saphena magna hat Venenklappen, die das Blut nur in eine Richtung strömen lassen. Für den peripheren Venenbypass gibt es deshalb 2 Varianten:
-
In-situ-Bypass: Die V. saphena magna bleibt in ihrer anatomischen Umgebung („in situ“ = an Ort und Stelle). Da das arterielle Blut (anders als zuvor das venöse Blut) von oben nach unten fließen soll, werden die Venenklappen mit einem Valvulotom beseitigt.
-
Umkehrbypass: Die V. saphena magna wird entnommen und in umgekehrter Position (oben und unten vertauscht) als Bypass eingesetzt. Das arterielle Blut fließt dann in der gleichen Richtung an den Venenklappen vorbei wie zuvor das venöse Blut.
Abb. 31.11 Femorokruraler Venenbypass.
Abb. 31.11a In-situ-Bypass. Die Venenklappen müssen mit einem Valvulotom zerstört werden.

Abb. 31.11b Umkehrbypass. Die V. saphena magna wird in umgekehrter Position als Bypass eingesetzt. Eine Klappenzerstörung ist nicht notwendig.

31.3.3 Operative Verfahren bei AVK
31.3.3.1 Endovaskuläre Katheterverfahren
Grundsätzliches Prinzip der endovaskulären Verfahren ( ▶ Abb. 31.12) sind der perkutane Zugang in Lokalanästhesie (Arterienpunktion) und die Beseitigung des Gefäßproblems mit speziellen Kathetern unter Röntgendurchleuchtung vom Inneren des Blutgefäßes (endovaskulär). Beispiele zeigt ▶ Tab. 31.3 .
Abb. 31.12 Katheterverfahren. Endovaskuläre Katheterverfahren zur Behandlung der AVK.
Abb. 31.12a PTA (Ballondilatation).

Abb. 31.12b Auffräsen einer Verengung (Atherektomie).

Abb. 31.12c Dilatation und innere Gefäßstütze (Stent-Implantation).

|
Verfahren |
Erläuterung |
|
perkutane transluminale Angioplastie (PTA) |
Ballondilatation von Gefäßstenosen |
|
perkutane transluminale koronare Angioplastie (PTCA) |
Ballondilatation von Herzkranzgefäßen |
|
perkutane transluminare renale Angioplastie (PTRA) |
Ballondilatation von Nierenarterien |
|
Stent-Implantation |
Aufdehnen und Aufhalten einer Gefäßstenose durch eine innere Gefäßstütze (Endoprothese aus Metall) |
|
Rekanalisation mit Rotationskatheter |
Auffräsen einer exzentrischen Gefäßstenose |
|
Katheterembolisation |
therapeutischer Verschluss einer Arterie durch Einbringen embolisierender Substanzen zur Blutstillung |
|
perkutane lokale Thrombolyse |
medikamentöse Gerinnselauflösung über einen im Thrombus platzierten Katheter |
|
Aspirationsembolektomie |
Absaugen eines Blutgerinnsels über einen perkutan eingebrachten Katheter |
|
transjugulärer intrahepatischer portosystemischer Stent-Shunt (TIPSS) |
Erweiterung des Pfortadersystems in der Leber bei portaler Hypertension |
Zusatzinfo
Interventionelle Radiologie. Endovaskuläre Chirurgie und interventionelle Radiologie umfassen identische Therapieverfahren, lediglich die Fachrichtung der Therapeuten ist unterschiedlich. Die Katheterbehandlungen unter Röntgendurchleuchtung wurden primär von Radiologen durchgeführt. Heute sind es zunehmend Gefäßchirurgen, die die Kathetertechniken anwenden und dafür zertifiziert sind, z.B. als „endovaskulärer Chirurg“. Der Begriff „interventionell“ (von intervenieren = eingreifen) kennzeichnet die therapeutische Zielsetzung der Kathetermaßnahme, im Gegensatz zur diagnostischen Angiografie.
Perkutane transluminale Angioplastie (PTA) Das wichtigste interventionelle Therapieverfahren ist die PTA (Ballondilatation). Von der Leistenarterie wird nach Punktion (perkutan) ein Katheter im Gefäß (transluminal) bis zur Gefäßverengung (Stenose) vorgeschoben. Dort wird durch Füllung des Ballons eine Aufdehnung der Arterie (Angioplastie) erreicht. Ideale Indikation ist die kurzstreckige Arterienverengung.
Stent-Implantation Um den Dilatationserfolg zu sichern, kann zum Aufhalten der Gefäßwand ein Metallgitter (Stent = Gefäßstütze) eingelegt werden ( ▶ Abb. 31.13). Der Stent lässt sich ebenfalls von der Leiste über einen Katheter in die Arterie einführen.
Medikamentenbeschichtung Die Aufdehnung eines Blutgefäßes führt zu einer mechanischen Gefäßwandverletzung. Die Arterie reagiert darauf mit einer inneren Narbenbildung (Proliferation), was zu einer erneuten Gefäßverengung (Re-Stenose) führen kann. Seit 2003 entwickelt sich eine Technik, bei der Ballons und Stents mit antiproliferativen Medikamenten (z.B. Sirolimus, Paclitaxel) beschichtet werden. Diese Wirkstoffe (engl. „Drugs“) werden bei der Gefäßaufdehnung lokal auf die Innenwand der Arterie übertragen (engl. „elute“ = herauslösen) und verbessern das Langzeitergebnis durch weniger Re-Stenosen (geringere Rezidivrate). Der klinische Einsatz begann an den Herzkranzgefäßen (PTCA) und erobert zunehmend auch die periphere Gefäßchirurgie. Gängige Bezeichnungen für die medikamentenbeschichtete Kathetertechnik sind:
-
drug-eluting balloon (DEB)
-
drug-eluting stent (DES)
Abb. 31.13 Stent-Implantation.
Abb. 31.13a Die Angiografie zeigt eine Stenose der A. femoralis.

Abb. 31.13b Nach PTA liegt der Stent im ehemaligen Stenosebereich.

Abb. 31.13c Kontrollangiografie.

31.3.3.2 Thrombendarteriektomie (TEA)
Bei der Thrombendarteriektomie wird arteriosklerotisches stenosierendes Material aus einer Arterie entfernt.
Arteriosklerotische Plaques können (im Gegensatz zu einem frischen Embolus oder Thrombus) nicht mit dem Ballonkatheter gelöst werden, weil sie zu hart, oft verkalkt und mit der Gefäßwand fest verwachsen sind (chronische AVK).
Prinzip Das stenosierende Material wird nach Eröffnung der Arterie (Arteriotomie) mit speziellen Metallgeräten (Spatel, Ringstripper) „ausgeschält“ ( ▶ Abb. 31.14 u. ▶ Abb. 31.15).
Wird die Arterie nach TEA nicht durch fortlaufende Naht direkt verschlossen, sondern ein „Flicken“ (engl.: patch) eingenäht, so spricht man von Patch-Plastik oder Streifen-Plastik. Der Patch wird aus der V. saphena magna gewonnen oder besteht aus Kunststoff (z. B. Dacron-Patch).
Abb. 31.14 Thrombendarteriektomie.
Abb. 31.14a Operative Ausschälung eines arteriosklerotischen Verschlusses (*) im Leistenbereich.

Abb. 31.14b Blick in die Femoralarterie (○) nach Thrombendarteriektomie (unten), Operationspräparat (oben).

Abb. 31.15 Operative Verfahren bei AVK. Ausschälung (TEA), Streifenplastik (Patch), Zwischenschalten einer Prothese (Interponat) und Umgehungsgefäß (Bypass) sind die wichtigsten arteriellen Operationen.

Klinische Anwendung Die wichtigsten Einsatzgebiete der Thrombendarteriektomie sind:
-
Karotis-TEA
-
Becken-TEA
-
Femoralis-TEA
-
Profundaplastik
Zusatzinfo
Profundaplastik. Die Profundaplastik ist eine TEA (Ausschälung) der tiefen Oberschenkelarterie (A. femoralis profunda) in Leistenhöhe mit oder ohne Patchverschluss.
31.3.3.3 Interponat
Unter einem Interponat versteht man die Überbrückung eines Gefäßdefekts durch Zwischenschalten (Interponieren) eines Ersatzgefäßes ( ▶ Abb. 31.15).
31.3.3.4 Bypass
Als Bypass (Umleitung) bezeichnet man die Umgehung eines erkrankten Gefäßabschnitts durch die Parallelschaltung eines Umleitungsgefäßes ( ▶ Abb. 31.15).
Terminologie Die Bezeichnung der Bypassoperation lässt erkennen, an welche Gefäße der Bypass angeschlossen wird. Beispielsweise beginnt der femoropopliteale Bypass an der Femoralarterie und endet an der A. poplitea.
Prinzip Üblicherweise liegt der Bypass direkt neben dem Gefäß, das er überbrücken soll, wobei die erkrankte (verschlossene) Arterie im Körper belassen wird. Wird die Prothese an anderer Stelle implantiert (z. B. subkutan), so spricht man von einem extraanatomischen Bypass (z. B. axillofemoraler Bypass, ▶ Abb. 31.9). Postoperativ ist eine medikamentöse Nachbehandlung nötig ( ▶ Tab. 31.4 ).
|
Medikamentengruppe |
Handelspräparate (Beispiele) |
Klinischer Einsatz (Beispiele) |
|
Thrombozytenaggregationshemmer |
ASS, Aspirin, Clopidogrel |
Nach PTA, Stent oder Bypass-OP |
|
2 Medikamente: (Duale Plättchenhemmung) Thrombozytenaggregationshemmer |
ASS + Clopidogrel |
Nach medikamentenbeschichtetem Stent |
|
Direkte orale Antikoagulanzien (DOAK*) |
Pradaxa, Xarelto |
Vorhofflimmern (nicht valvuläre Form) |
|
Direkte orale Antikoagulanzien (DOAK*) |
Arixtra, Eliquis, Pradaxa, Xarelto |
Perioperative Thromboseprophylaxe |
|
Direkte orale Antikoagulanzien (DOAK*) |
Arixtra, Xarelto |
Beinvenenthrombose, Lungenembolie |
|
Vitamin-K-Antagonisten |
Marcumar |
Mechanische Herzklappe ** |
|
3 Medikamente: (Triple-Therapie) |
ASS + Clopidogrel + DOAK* (oder Marcumar) |
Hohes Embolierisiko bei Vorhofflimmern oder koronarem medikamentenbeschichtetem Stent |
|
* zu DOAK (NOAK) vgl. Kap. ▶ 9.2.2 **Bei Venenthrombose und nach Lungenembolie ist Marcumar noch weit verbreitet, wird aber zunehmend durch DOAK ersetzt |
||
Material Am Bein wird als Material die V. saphena magna bevorzugt (Venenbypass), weil Kunststoffprothesen postoperativ häufiger thrombosieren (Bypassverschluss). Bei größeren Gefäßen (Aorta, Beckenarterien) ist das Verschlussrisiko weniger vom Bypassmaterial abhängig, sodass in dieser Körperregion Kunststoffprothesen implantiert werden.
Extraanatomische Bypässe sind immer aus Kunststoff, weil dieser den mechanischen Belastungen unter der Haut besser standhält als eine Vene.
Klinische Anwendung Bypassoperationen werden an nahezu allen Stellen des arteriellen Systems angewendet, um die Strombahn bei arteriosklerotischen Stenosen und Verschlüssen wiederherzustellen. Voraussetzung für jede Bypassoperation ist allerdings ein ausreichender Blutfluss in die nachgeschaltete Körperregion. Bei unzureichendem Abstrom in die Peripherie müssen alternative Behandlungsformen gewählt werden (z.B. konservativ oder TEA). Verschlossene Arterien am Unterschenkel sind heute die häufigste Ursache für eine Majoramputation am Ober- oder Unterschenkel.
Zusatzinfo
Abflusswiderstand. Sind beispielsweise alle 3 Unterschenkelarterien verschlossen, hat es keinen Sinn, einen femoropoplitealen Bypass zur Umgehung der verschlossenen Femoralarterie anzulegen, weil dieser Bypass keine Durchblutungsverbesserung in der Peripherie bringen würde. Einfach ausgedrückt: Es hat auch keinen Sinn, ein verengtes Wasserrohr zu erweitern, wenn der nachgeschaltete Wasserhahn nicht aufgeht.
31.3.3.5 Sympathektomie
Als Sympathektomie bezeichnet man die Unterbrechung des Grenzstrangs (N. sympathicus) im oberen Brustkorb (thorakal) oder in Lendenhöhe (lumbal).
Durch die Sympathektomie werden eine Weitstellung der kleinsten Arterien, eine Senkung des peripheren Gefäßwiderstands und eine Erhöhung der Hautdurchblutung erreicht. Die Nervendurchtrennung erfolgt heute im CT durch Punktion und Verödung des Nervs.
Thorakale Sympathektomie Unterbrechung der sympathischen Nervenversorgung für die obere Extremität in Höhe BWK1 (Brustwirbelkörper). Seltene Indikationen können sein:
-
Morbus Raynaud (seltene Form der Durchblutungsstörung in den Händen: thorakale Sympathektomie).
-
extreme Schweißbildung (Hyperhidrosis: thorakale Sympathektomie).
Lumbale Sympathektomie Unterbrechung der sympathischen Nervenversorgung in Höhe der Lendenwirbel L2 bis L4. Seltene Indikationen können sein:
-
pAVK Stadium III und IV, wenn keine gefäßrekonstruktiven Maßnahmen durchgeführt werden können. Man erhofft sich eine (geringe) Verbesserung der Blutversorgung für ein amputationsgefährdetes Bein.
31.4 Aneurysmen
Pathoanatomische Einteilung Ein Aneurysma ist eine umschriebene krankhafte Erweiterung eines Blutgefäßes, fast immer an den Arterien. Pathoanatomisch unterscheidet man das echte und das falsche Aneurysma ( ▶ Abb. 31.16).
Abb. 31.16 Aneurysmen. Pathoanatomische Einteilung.

Echtes Aneurysma Bei einem echten Aneurysma ist die gesamte Gefäßwand mit allen 3 Schichten (Intima, Media, Adventitia) vorgewölbt. Ursache ist eine degenerative Gefäßschwäche durch Arteriosklerose. Die häufigsten Lokalisationen sind:
-
Aortenaneurysma (Bauch häufiger als Brustkorb)
-
Beckenarterienaneurysma
-
Popliteanaeurysma
Falsches Aneurysma (Aneurysma spurium) Beim falschen Aneurysma sind die 3 Schichten der Gefäßwand nicht vorgewölbt. Das falsche Aneurysma wird nicht von „echter“ Gefäßwand, sondern von einer „falschen“ Bindegewebskapsel begrenzt. Voraussetzung ist ein Defekt in der Gefäßwand, aus dem Blut nach außen neben das Gefäß austreten kann. Häufige falsche Aneurysmen sind:
-
Punktionsaneurysma in der Leiste, nach z.B. Arterienpunktion für einen Herzkatheter, PTA oder Stenteinlage
-
Anastomosenaneurysma durch ausgerissene Gefäßnaht bei einer Anastomose, am häufigsten in der Leiste, z. B. nach aortofemoralem Bypass
-
traumatisches thorakales Aortenaneurysma mit Aortenruptur im Brustkorb durch Unfall ( ▶ Abb. 19.12).
31.4.1 Spezielle Krankheitsbilder
31.4.1.1 Thorakales Aortenaneurysma (TAA)
Die Aussackung an der Hauptschlagader im Brustkorb ist ein echtes arteriosklerotisches Aneurysma, das bei älteren Menschen auftritt.
Symptome und Diagnostik Es können starke Schmerzen in Brustkorb und Rücken auftreten. Meistens wird das TAA zufällig im CT oder MRT entdeckt. Die herkömmliche Röntgenaufnahme („Rö-Thorax“) zeigt den Befund oft nicht.
Therapie Mit zunehmendem Außendurchmesser steigt das Risiko einer spontanen Ruptur mit lebensbedrohlicher Blutung in den Brustkorb. Ab etwa 5 cm Größe wird das Aneurysma durch eine minimalinvasive Operation behandelt. Bei dieser endovaskulären Maßnahme wird ein prothesenbeschichteter Stent (auch Endograft oder Stentgraft genannt) von der Leiste mit einem Katheter unter Röntgendurchleuchtung in das Aneurysma vorgeschoben.
Zusatzinfo
PAU. Als PAU bezeichnet man ein „penetrierendes aortales Ulkus“, das eine hohe Rupturgefahr birgt. Ein PAU tritt besonders an der thorakalen Hauptschlagader auf und wird endovaskulär mit einem Stentgraft behandelt, auch wenn es kleiner als 5 cm ist.
31.4.1.2 Thorakoabdominelles Aneurysma
Diese Aneurysmen der Hauptschlagader betreffen den Bereich in Zwerchfellhöhe. Zwischen ihrem thorakalen und abdominellen Abschnitt gibt die Aorta wichtige Seitenäste ab. Diese sind der Truncus coeliacus (versorgt Leber und Magen), die A. mesenterica superior (Darm) und die Nierenarterien. Diese Arterien müssen bei einer operativen Aneurysmaausschaltung erhalten bleiben. Deshalb ist die operative Behandlung von thorakoabdominellen Aneurysmen besonders schwierig und risikoreich.
Therapie Auch bei thorakoabdominellen Aneurysmen wird die minimalinvasive endovaskuläre Implantation eines Stentgrafts wegen des geringeren Behandlungsrisikos gegenüber der offenen Operation angestrebt. Ein Stentgraft in der Aorta würde diese Arterien aber verschließen, weil die Gefäßprothese in der Aorta nach außen blutdicht ist. Aus diesem Grund werden spezielle Aortenprothesen (nach CT-Diagnostik) individuell für den Patienten ausgemessen, um die Durchblutung der wichtigen Arterien in Zwerchfellhöhe zu erhalten. Beispiele:
-
Fenestrierte Aortenstentgrafts. Diese Stentgrafts haben in ihrer Ummantelung Löcher („fenestriert“ = gefenstert), die einen Blutfluss in die Seitenäste der Aorta ermöglichen.
-
Gebranchte Aortenstentgrafts. Diese Stentgrafts haben industriell gefertigte Seitenarme (engl. „branch“ = Ast), die bei der endovaskulären Implantation in die abgehenden Arterien der Aorta eingeführt werden, z.B. in die Nierenarterien ( ▶ Abb. 31.18).
31.4.1.3 Aortendissektion
In der inneren Gefäßwand (Intima) der Hauptschlagader kommt es zu einem Riss (sog. „Entry“), während die äußere Schicht (Adventitia) noch standhält. Dadurch kann sich das Blut innerhalb der Gefäßwand (in der Media) sammeln und die einzelnen Schichten auseinandertrennen (disseziieren). Der ursprüngliche Blutfluss in der Aorta („echtes“ Lumen) kann durch den Falschkanal („falsches“ Lumen) komprimiert werden, was die Minderperfusion lebenswichtiger Organe zur Folge hat.
Ursache Die Dissektion entsteht im Bereich des Aortenbogens bei einer erworbenen oder angeborenen Bindegewebsschwäche der Arterienwand. Betroffen sind überwiegend Männer im mittleren Lebensalter mit Bluthochdruck.
Symptome und Diagnostik Typisch ist ein plötzlicher thorakaler Vernichtungsschmerz. Nach Ausschluss eines Herzinfarkts erfolgt ein CT der gesamten Aorta ( ▶ Abb. 31.17).
Abb. 31.17 Aortendissektion. Das CT zeigt den Längsriss in der Hauptschlagader, der vom Aortenbogen bis in die Beckenarterien reicht (Pfeile).

Therapie Bei Übergreifen der Dissektion Richtung Herz (Typ A) ist eine sofortige kardiochirurgische Notfalloperation mit Ersatz der Aorta ascendens unter Herz-Lungen-Maschine erforderlich, weil der Verschluss der Herzkranzgefäße oder eine Herzbeuteltamponade droht.
Ist die Dissektion unterhalb des Aortenbogens lokalisiert (Typ B), wird konservativ unter Blutdrucksenkung und Analgetika vorgegangen. Bei Minderperfusion im echten Lumen oder bei aneurysmatischer Ausweitung ist die endovaskuläre Einbringung eines Stents in den Bereich des Intimaeinrisses (Entry) indiziert.
31.4.1.4 Bauchaortenaneurysma (BAA)
Das Bauchaortenaneurysma ist eine Aussackung der Bauchschlagader. Das obere Ende des Aneurysmas liegt typischerweise unterhalb des Nierenarterienabgangs (infrarenales Aneusyma) und kann bis in die Beckenetage reichen.
Merke
Das Bauchaortenaneurysma (BAA) ist häufiger als alle anderen Aneurysmalokalisationen zusammen.
Ursache Das BAA ist ein echtes Aneurysma. Es betrifft ältere Menschen mit generalisierter Arteriosklerose, überwiegend Männer. Das BAA wächst über Jahre und macht primär keine Beschwerden. Die Gefahr besteht in dem plötzlichen Platzen(Ruptur) der erweiterten Hauptschlagader, was ohne jede Vorwarnung erfolgen kann.
Symptome Die Aneurysmaruptur geht mit Bauch- oder Rückenschmerzen einher und führt zu einem starken inneren Blutverlust. Die Letalität bei Ruptur des Aortenaneurysmas beträgt 90 %.
Diagnostik Das BAA wird oft zufällig in der Sonografie entdeckt. Vor Implantation eines Stents muss ein CT mit intravenöser Kontrastmittelgabe erfolgen, damit die für den Patienten passende Stentgröße ausgewählt werden kann.
Therapie Wegen der lebensbedrohlichen Rupturgefahr sollten auch asymptomatische Bauchaortenaneurysmen über 5 cm Durchmesser operiert werden. Die endovaskuläre Stentimplantation ist heute das Verfahren der Wahl.
Minimalinvasive Operation Ein prothesenbeschichteter Stentgraft (Endograft) wird ohne Bauchschnitt von der Leiste aus über einen Katheter unter Röntgendurchleuchtung in das Aneurysma vorgeschoben ( ▶ Abb. 31.18). Das Metallgitter des Stentgrafts (Stent) klemmt sich in der Hauptschlagader fest. Die am Stent fixierte blutdichte Gefäßprothese (Graft) schaltet das Aneurysma vom Blutstrom aus, womit die Rupturgefahr gebannt ist.
Zusatzinfo
EVAR. Die minimalinvasive Stenteinlage beim Aortenaneurysma wird international als „EVAR“ abgekürzt (endovascular aortic repair).
Abb. 31.18 Minimalinvasive Operation beim Bauchaortenaneurysma. Der prothesenummantelte Stent wird über einen Katheter in die Aorta eingeklemmt. Das Bild zeigt einen „gebranchten“ Stentgraft mit 2 Armen in den Nierenarterien.

Konventionelle offene Operation Das Aneurysma wird nach medianer Laparotomie durch eine Kunststoffprothese ersetzt ( ▶ Abb. 31.19 u. ▶ Abb. 31.20). Die äußeren Narben nach minimalinvasiver und offen chirurgischer OP sehen Sie in ▶ Abb. 31.21.
Abb. 31.19 Infrarenales Bauchaortenaneurysma. Offen chirurgische Behandlung durch Interposition einer Rohrprothese (Tube) oder einer Bifurkationsprothese (Y-Prothese). Präoperative Aneurysmaausdehnung violett.

Abb. 31.20 Infrarenales Bauchaortenaneurysma.
Abb. 31.20a Intraoperativer Befund nach Eröffnung der Bauchhöhle. Aneurysma (An) mit 10 cm Durchmesser, Ao: Aorta, B: Beckenarterien (A. iliaca communis).

Abb. 31.20b Der Aneurysmasack ist eröffnet. Zwischen Aorta und Beckenarterien wurde eine Bifurkationsprothese aus Dacron eingenäht.

Abb. 31.20c Thrombusmaterial aus dem Aneurysma. Das zentrale Loch entspricht dem Lumen für den Blutfluss.

Abb. 31.21 Narben nach Bauchaortenaneurysma-OP.
Abb. 31.21a Die minimalinvasive Implantation eines Stentgrafts hinterlässt äußerlich nur 2 kleine Punktionslöcher in der Leiste nach der Einführung der Katheter.

Abb. 31.21b Die offen chirurgische Implantation einer Gefäßprothese in die Hauptschlagader hinterlässt eine Narbe nach medianer Laparotomie.

31.4.1.5 Popliteaaneurysma
Die Erweiterung der Kniekehlenarterie (A. poplitea) ist ein echtes Aneurysma. Sie ist die häufigste Aneurysmalokalisation außerhalb der Aorta.
Symptome Als Folge der Blutverwirbelungen (Turbulenz) setzen sich an der Aneurysmawand Thromben ab. Diese können sich lösen (Embolie) und in die Unterschenkelarterien abschwemmen, was zu Durchblutungsstörungen führen kann. Im Gegensatz zum Aortenaneurysma rupturieren Popliteaaneurysmen selten.
Diagnostik und Therapie Die Diagnose wird durch Sonografie und CT gestellt. Abhängig vom Einzelfall wird das Aneurysma minimalinvasiv mit einem Stentgraft oder offen chirurgisch durch ein femoropopliteales Veneninterponat vom Blutstrom ausgeschaltet.
31.5 Dialyseshunts
Ein Dialyseshunt ist eine operativ geschaffene arteriovenöse (AV-)Fistel zum Zweck der Hämodialyse. Autologe Shunts mit körpereigener Vene werden bevorzugt, weil sie seltener thrombosieren und bessere Langzeitergebnisse haben als Kunststoffshunts.
31.5.1 Cimino-Fistel
Es handelt sich um den häufigsten autologen Dialyseshunt ( ▶ Abb. 31.22). Eine oberflächliche Hautvene wird oberhalb des Handgelenks durchtrennt und mit der A. radialis anastomosiert. Durch den arteriellen Zufluss weitet sich die abführende Vene massiv auf, sodass sie zur Hämodialyse punktiert werden kann.
Abb. 31.22 Cimino-Fistel am Unterarm.
Abb. 31.22a Operative Anastomose zwischen A. radialis und einer oberflächlichen Hautvene. Die Vene wird bei der Hämodialyse punktiert.

Abb. 31.22b Klinisches Bild 10 Jahre nach Shuntanlage.

Im Zeitverlauf kann die Vene am Unterarm dünner werden (stenosieren) und dadurch nicht mehr zur Hämodialyse geeignet sein. Dann kommt eine neue Anastomose etwas weiter proximal infrage (Kletteranastomose), wenn eine interventionelle Aufdehnung nicht möglich ist (Shunt-PTA). Alternativ kann ein Shunt in Ellenbogenhöhe operativ angelegt werden (Ellenbogenfistel).
Pflegepraxis
Blutdruckmessung. Am shunttragenden Arm darf niemals Blutdruck gemessen werden (Gefahr der Shuntthrombosierung
Blutentnahme. Bei Dialysepatienten sollen Blutentnahmen nur aus Handrückenvenen vorgenommen werden, um die wertvollen Venen des Unterarms und der Ellenbeuge für operative Shuntanlagen zu schonen.
31.5.2 Prothesenshunts
Wenn am Arm keine körpereigene Vene zur Verfügung steht, muss der Shunt aus Kunststoffmaterial gebildet werden. Der bekannteste Prothesenshunt ist der schlingenförmig am Arm angelegte „Gore-Loop“ aus PTFE (benannt nach der Herstellerfirma). Ein Prothesenshunt kann auch am Brustkorb oder am Bein implantiert werden.
31.6 Amputationen
Die pAVK Stadium IV (sog. „Raucherbein“) ist die häufigste Indikation für eine Amputation.
Die Amputation kommt nur infrage, wenn eine Erhaltung der Extremität mit allen zur Verfügung stehenden Mitteln nicht möglich ist.
Majoramputation Das Bein wird in seiner Länge verkürzt. Je nach Amputationshöhe unterscheidet man:
-
Oberschenkelamputation (Ablatio femoris)
-
Amputation im Kniegelenk (Exartikulation)
-
Amputation im proximalen Unterschenkel (Ablatio cruris)
Minoramputation Das Bein bleibt in seiner Länge erhalten. Beispiele:
-
Mittelfußamputation (transmetatarsal)
-
Zehenamputation
Grenzzonenamputation Abtragung einer peripheren Nekrose (Gangrän) im Zehen- oder Fußbereich. Die Absetzungslinie liegt in Höhe der Demarkationslinie (Grenze zwischen noch durchblutetem und gangränösem Gewebe).
Im Gegensatz zu den anderen Amputationslokalisationen wird bei der Grenzzonenamputation die Wunde nicht durch Naht verschlossen. Sie bleibt offen und heilt sekundär durch Granulation ( ▶ Abb. 31.5)
31.7 Pflegeschwerpunkt: Amputation
31.7.1 Präoperative Pflege
Psychosoziale Betreuung Für alle Patienten ist eine Amputation ein einschneidender Eingriff, der das zukünftige Leben verändert. Patienten, bei denen eine Amputation als zeitlich geplanter Eingriff erfolgt, können sich vorab mit der Situation auseinandersetzen. In manchen Fällen erhoffen sie sich sogar eine Verbesserung der Lebensumstände durch die Amputation der erkrankten Gliedmaßen.
Einüben postoperativer Fähigkeiten Patienten mit Beinamputation können schon vor der Operation den Umgang mit Unterarmgehstützen lernen. Dazu wird ihnen ein präoperatives Training angeboten. Der gezielte Aufbau von Muskelgruppen erleichtert die vermehrte Beanspruchung und vermeidet Muskelkater.
In einem Beratungsgespräch können Informationen zum Verlauf der Behandlung und zur Prothesenversorgung gegeben werden. Vorab können auch schon Kontakte zu sozialen Diensten geknüpft werden, wenn es um die Klärung von Fragen in beruflicher oder finanzieller Hinsicht geht. Auch Gespräche mit einem Patienten in einer vergleichbaren Situation können ermutigen und motivieren.
31.7.2 Postoperative Pflege
Im Folgenden sind spezielle pflegerische Schwerpunkte aufgeführt, um einen komplikationslosen Genesungsverlauf zu gewährleisten. Immer zu berücksichtigen sind die allgemeinen postoperativen Grundlagen (Kap. ▶ 9.5)
Überwachung Die Durchtrennung aller Blutgefäße im betroffenen Bereich bedingt eine hohe Nachblutungsgefahr. Der Verband und die Drainagen sind gezielt zu kontrollieren. Wegen der Verstopfungsgefahr der Saugdrainagen ist die Sogkontrolle besonders wichtig.
Schmerzbehandlung Nach der Amputation kommt es in den ersten postoperativen Tagen zu den üblichen Wundschmerzen, die durch den großen Eingriff und die Traumatisierung des Gewebes bedingt sind. Maßnahmen zur Analgesie werden nach ärztlicher Anweisung durchgeführt. Das Schmerzmittel muss rechtzeitig verabreicht werden, um dem Patienten unnötige Schmerzen zu ersparen. Ein enger Kontakt zum Patienten und eine gute Beobachtungsgabe werden dabei von den Pflegepersonen erwartet. Auch im Hinblick auf den Phantomschmerz ist der frühzeitige Therapiebeginn entscheidend für den Erfolg.
Zusatzinfo
Phantomschmerz. 60–80 % der Patienten leiden nach einer Amputation unter Phantomschmerzen, d.h., sie nehmen Schmerzen im nicht mehr vorhandenen Körperteil war. Analgetika können begrenzt Schmerzen lindern. Wichtig ist ein multimodales Behandlungskonzept mit Psycho- und Physiotherapie.
Lagerung des Stumpfes Die spezielle Lagerung des Amputationsstumpfs hat 2 Schwerpunkte:
-
Entlasten des Wundgebiets
-
Vermeiden von Kontrakturen
Intraoperativ werden Blut- und Lymphgefäße durchtrennt, sodass postoperativ die Weichteile anschwellen können. Durch Schwellungen wird die Durchblutung verringert, was einerseits zu mehr Schmerzen, aber auch zu einer Verschlechterung der Wundheilung führt. Zur Prophylaxe eines Wundödems sollte daher das Stumpfende in den ersten 24 Stunden auf ein kleines Kissen hochgelagert werden. Bei ausgedehnten Schwellungen wird der Stumpf noch länger stundenweise 30° hochgelagert.
Kontrakturen entstehen vorwiegend im benachbarten Gelenk. Sie behindern die schon eingeschränkte Beweglichkeit und die prothetische Versorgung. Beugekontrakturen in der Hüfte (nach Oberschenkelamputationen) und im Knie (nach Unterschenkelamputationen) erschweren das Aufrichten des Oberkörpers und die Gewichtsübernahme auf die Prothese. Deshalb wird der betroffene Körperteil gestreckt gelagert, damit die Muskeln und Sehen, die zum Beugen wichtig sind, nicht verkürzen. Wichtig ist auch ein adäquates Schmerzmanagement, da eine schmerzbedingte Schonhaltung wieder eine Beugung zur Folge hätte.
Je nach Lokalisation der Amputation sind folgende spezielle Lagerungen zu empfehlen, um Wundödeme und Kontakturen zu vermeiden:
-
Bei Oberschenkelamputation wird im Liegen das Hüftgelenk in Nullstellung, der Stumpf flach und gestreckt gelagert. Die korrekte Lagerung des Stumpfes wird im Rollstuhl durch entsprechende Hilfsmittel gewährleistet. Der Patient sollte nur kurzzeitig am Bettrand sitzen. Zur Streckung des Stumpfes ist es möglich, dass der Patient zeitweise auf dem Bauch liegt.
-
Bei einer Unterschenkelamputation kann eine zusätzliche Streckung des Stumpfes erreicht werden, wenn der Stumpf mit einem Sandsäckchen beschwert wird.
-
Bei Fingeramputationen wird der Fingerstumpf geschient und befindet sich damit kontinuierlich in der Streckstellung.
Mobilisation Eine frühzeitige Mobilisation am 1. oder 2. postoperativen Tag verringert das Dekubitusrisiko sowie die Gefahr einer Thrombose oder Pneumonie und stabilisiert den Kreislauf.
Ein Patient mit einer Amputation an den oberen Extremitäten benötigt Hilfe bei der Körperpflege und beim Essen. Ein Patient mit einer Amputation der unteren Extremitäten benötigt Hilfe bei der Veränderung seiner Körperlage. Unterstützt von 2 Pflegepersonen wird der Patient für kurze Zeit aufgerichtet und vor das Bett gestellt. Ausmaß und Dauer der Mobilisation hängen von mehreren Faktoren ab, z. B.:
-
Einschränkung des Patienten
-
Schmerzsituation
-
körperliche Verfassung
Pflegepraxis
Rollstuhl. Eine Dauerversorgung mit einem Rollstuhl wird nicht angestrebt. Unbeweglichkeit und Bewegungseinschränkung im Hüft- und Kniegelenk werden dadurch gefördert und ein späteres Gehen evtl. unmöglich gemacht.
Physiotherapie Die Beeinträchtigung von Körperschema und Gleichgewicht ist erheblich und sollte schon frühzeitig mit einer täglichen speziellen Bewegungsschule durch Physiotherapeuten behandelt werden. Mobilisation und physiotherapeutische Behandlung werden nach Absprache im therapeutischen Team erweitert und intensiviert.
Ergotherapie Verluste von oberen Extremitäten verlangen eine Hilfsmittelberatung durch Ergotherapeuten, um die Greif- und Haltefunktion des verlorenen Körperteils auszugleichen.
Wundmanagement Das Pflegeziel ist eine ungestörte Wundheilung mit einer reizlosen weichen Narbe. Eine Wundheilungsstörung hätte die Verzögerung der Rehabilitation und Versorgung mit einer Prothese zur Folge.
Den Zeitpunkt des ersten Verbandwechsels bestimmt der Arzt und kann an Pflegefachkräfte delegiert werden. Der Patient sieht beim ersten Verbandwechsel auch das erste Mal seinen Amputationsstumpf. Das kann für ihn sehr belastend sein. Hier benötigt er die einfühlsame Unterstützung durch die Pflegefachkraft, ggf. kann auch eine klinikinterne Psychologin involviert werden.
Wickeln des Stumpfes Um den venösen und lymphatischen Rückstrom zu unterstützen und den Stumpf prothesengerecht, d. h. konisch, zu formen, wird der Stumpf gewickelt. Die Gestaltung und Intensität beim Wickeln bestimmt der Arzt.
Um Abschnürungen zu vermeiden, wird mit Kurzzugbinden in Achtertouren gewickelt. Bei vorbestehenden Sensibilitätsstörungen muss besonders auf den Druck geachtet werden, da der Patient Schmerzen, die durch die Minderdurchblutung entstehen, nicht richtig wahrnehmen kann. Begonnen wird an der Stumpfspitze, weiter wird mit abnehmendem Druck zum Körper hin gewickelt. Der diagonale Zug bestimmt die Formung des Stumpfes. Zur besseren Fixierung und um das Verrutschen zu vermeiden, wird das nächste höhere Gelenk miteingebunden ( ▶ Abb. 31.23). An Stellen mit geringer Weichteildeckung oder Knochenvorsprüngen sollten Stumpfkissen aus Schaumgummi oder Rollenwatte eingewickelt werden.
Abb. 31.23 Wickeln des Stumpfes nach Oberschenkelamputation. Um den venösen und lymphatischen Rückstrom zu unterstützen und den Stumpf prothesengerecht konisch zu formen, wird er elastisch gewickelt. Die Wickelung erfolgt in Achtertouren, der Druck der Binde nimmt nach proximal ab.

Pflegepraxis
Wickeln des Stumpfes. Die Binde darf nicht zu straff angelegt werden, um einem druckbedingten Schwund der Stumpfmuskulatur vorzubeugen. Beim Wickeln des Oberschenkelstumpfs muss darauf geachtet werden, dass der Stumpf in Streckstellung gewickelt wird. Deshalb ist es empfehlenswert, den Stumpf im Stehen zu wickeln.
Der Stumpf wird so lange gewickelt, bis er vollständig abgeschwollen ist. Wenn der Patient das Wickeln erlernt hat, kann er dessen Durchführung selbst übernehmen.
Merke
Nach Oberschenkel- und Unterschenkelamputation werden die Fäden frühestens nach 3 Wochen entfernt.
Silikonliner Mittlerweile gibt es eine Vielzahl sog. Liner von verschiedenen Herstellern ( ▶ Abb. 31.24). Dies sind fertige, polsternde Überzüge aus Silikon für den Oberschenkel- oder Unterschenkelstumpf. Sie verbessern den Sitz in der Prothese und beugen Druckstellen vor. Nachdem die Redondrainage gezogen ist und die Wunde unauffällig heilt, kann der Liner das Wickeln des Stumpfes komplett ersetzen
Abb. 31.24 Silikonliner. Liner verbessern den Sitz der Prothese.
(Foto: Bauerfeind AG, Zeulenroda-Triebes)

Stumpfhygiene Beim täglichen Wickeln muss der Stumpf sorgfältig von der Pflegeperson inspiziert werden. Sie achtet dabei auf die Stumpfhaut, die Hautdurchblutung und die Narbe. Veränderungen im Narbenbereich, Druckstellen oder Hautreizungen können zu einer verzögerten Prothesenanpassung und zu einer Immobilität des Patienten führen und sollten verhindert werden.
Zur sorgfältigen Hautpflege gehört das tägliche kurze Waschen mit warmem Wasser und einer ph-neutralen Seife. Die Haut darf nicht aufgeweicht werden. Nach der Stumpfwaschung muss dieser sehr sorgfältig abgetrocknet werden. Hautcremes (Wasser-in-Öl-Lotionen) dürfen nur bei trockener Haut aufgetragen. Zudem sollten Cremes nur abends und nicht vor dem Anlegen der Prothese aufgetragen werden, um eine Mazeration zu vermeiden.
Pflegepraxis
Selbstständigkeit. Ein Handspiegel hilft dem Patienten, seinen Stumpf besser zu sehen. Nach einer behutsamen Anleitung kann er selbstständig die Haut am Stumpf auf Veränderungen beobachten.
Stumpfhaut abhärten Nach abgeschlossener Wundheilung kann mit Abhärtungsmaßnahmen begonnen werden, damit die Stumpfhaut weniger empfindlich gegenüber mechanischen Reizen und den Druckbelastungen durch die Prothese ist. Der Patient wird über die Bedeutung dieser Maßnahmen aufgeklärt und frühzeitig in die Durchführung einbezogen:
-
nach dem Waschen kräftig abfrottieren
-
die Stumpfhaut nach dem Waschen weich bürsten
-
Luft und Licht einwirken lassen
-
durchblutungsfördernde kalt-warme Wechselbäder
-
Narbenpflege mit pH-neutraler Salbe
-
Stumpfbewegungen in Materialien wie Sand, Erbsen oder spezieller Knetmasse
Prothesenversorgung Prothesen dienen als Ersatz für ein amputiertes Körperteil, zur Wiederherstellung der Steh-, Geh- und Greiffähigkeit und sorgen für einen optischen Ausgleich.
Hand-, Arm- und Beinprothesen sind meist mit Gelenkvorrichtungen und der Möglichkeit zur Bewegung ausgestattet.
Nach der abgeschlossenen Wundheilung wird der Patient mit einer Übungsprothese versorgt und kann erste Geh- oder Greifübungen ausführen. Die individuelle Versorgung mit einer Prothese wird der Amputationsart sowie den Bedürfnissen und Möglichkeiten des Patienten angepasst. Über die Art des Prothesenaufbaus entscheiden z. B. das Alter und die Beweglichkeit.
Es können verschiedene Prothesenarten unterschieden werden:
-
Oberschenkelprothesen. Um ein möglichst normales Gangbild zu erreichen, sind die Prothesen mit Kniegelenken und Prothesenfuß versehen.
-
Armprothesen. Hier kann weiter unterschieden werden:
-
Schmuckprothesen, die in Form und Farbe gut angepasst sind, aber keine Funktion übernehmen können.
-
Eigenkraftprothesen übertragen die Bewegungen des Schultergürtels auf die Mechanik der Prothese.
-
Myoelektrische Fremdkraftprothesen erfordern eine hohe Kooperation des Betroffenen. Willkürliche Muskelkontraktionen, verstärkt durch einen batteriebetriebenen Motor, ermöglichen z. B. das Öffnen und Schließen der Prothesenhand.
-
6–12 Monate nach der Amputation hat der Stumpf seine endgültige Form. Dann kann vom Orthopädiemechaniker eine individuelle Dauerprothese angepasst werden.
Entlassungsmanagement Wenn die Wundheilung abgeschlossen und der Patient mit einer Übungs- oder Testprothese versorgt ist, wird er in einer ambulanten oder teilstationären Rehabilitationseinrichtung auf die Belastungen und Anforderungen seines Alltags vorbereitet. Der Umfang und die Möglichkeiten der Maßnahmen zur Rehabilitation orientieren sich am Alter und am Ausmaß der Einschränkungen. Besondere Trainingsprogramme verbessern die Greiffunktion bzw. die Steh- und Gehfähigkeit, leiten an zum Stufensteigen, Gehen auf unebenem Gelände und Überwinden von Hindernissen. Vor allem jüngeren Menschen wird Anleitung zur sportlichen Betätigung mit Prothese gegeben. Sie bieten die Möglichkeit, sich positiv mit der Situation auseinanderzusetzen und sich zu beweisen.
Ist eine Weiterbeschäftigung im Beruf nicht möglich, müssen Maßnahmen der Berufsfindung und Umschulung eingeleitet werden. Sie erfolgen in Abstimmung mit der Arbeitsagentur oder bei Berufsunfällen mit den Berufsgenossenschaften und Berufsförderungswerken.