
38 Pflege von Patienten mit Erkrankungen des endokrinen Systems
Anatomie und Physiologie im Fokus
(nach Silverthorn 2009)
Endokrines System im Überblick
Der menschliche Körper benötigt für das sinnvolle Zusammenwirken aller Zellen ein System, das den gesamten Organismus zu einer funktionierenden Ganzheit koordiniert. Dazu steht neben dem Nervensystem vor allem das endokrine System zur Verfügung ( ▶ Abb. 38.1).
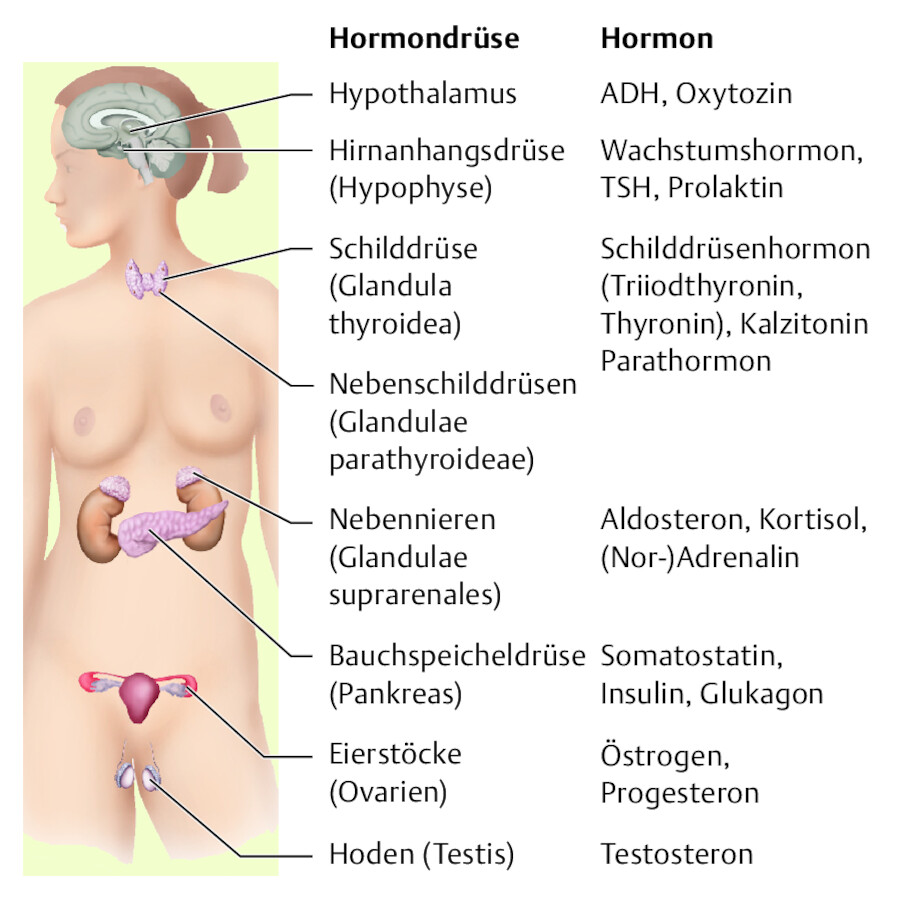
Endokrine Drüsen.
Abb. 38.1 Sie geben ihr Sekret (Hormone) unmittelbar in die Blutbahn ab. Einige dieser Drüsen sind anatomisch und funktionell eigenständige Organe (z. B. Schilddrüse), einige endokrin tätige Organe erfüllen noch andere Aufgaben (z. B. Bauchspeicheldrüse, Syn. Pankreas).
Beide Systeme vermitteln über Nervenimpulse Signale und Rückkoppelungen, die unterschiedliche Prozesse steuern können:
-
Wachstum und Entwicklung
-
Stoffwechsel (Ernährung)
-
Regulation des inneren Milieus (Homöostase: z.B. Temperatur, pH-Wert)
-
Fortpflanzung
-
Leistungsanpassung an Umwelteinflüsse
Um diese Aufgaben bewältigen zu können, bedarf es eines guten Zusammenspiel des endokrinen Systems mit dem Nervensystem. Das autonome Nervensystem (N. sympathicus und N. parasympathicus) leitet schnell Signale weiter (elektrisch-nerval), wenn ein Organ umgehend gehemmt oder angeregt werden soll. Das endokrine System reagiert im Gegensatz zum schnellen Nervensystem langsam, aber beständig. Dazu werden über den Blutweg Signale, sog. Botenstoffe, gesendet.
Hormone
Das Wort „Hormon“ kommt vom griech. „horman“ = in Bewegung setzen, antreiben, anregen. Bei einem Hormon handelt es sich um eine Substanz, die durch endokrine Zellen oder endokrine Drüsen ins Blut ausgeschüttet und zu einer entfernten Zielzelle transportiert wird, wobei bereits eine sehr niedrige Konzentration die Wirkung hervorruft. Es handelt sich also um chemische Botenstoffe, die nach ihrer Struktur in Peptide, Steroide und Amine klassifiziert werden. ▶ Tab. 38.1 zeigt eine beispielhafte Einteilung der Hormone nach ihrer Struktur.
Die Wirkung dieser Hormone beruht auf folgenden Mechanismen:
-
Kontrolle der Geschwindigkeit von enzymatischen Reaktionen.
-
Kontrolle des Transports von Ionen oder Molekülen durch die Zellmembran.
-
Kontrolle der Genexpression und somit der Synthese von Proteinen.
Einzelne Hormone (z. B. Insulin und Glukagon) arbeiten als Gegenspieler. Die hormonelle Steuerung kann wie ein Zahnradgetriebe gesehen werden, bei dem alles in einem Funktionskreislauf miteinander verbunden ist.
|
Substanzklasse |
Anatomische Lage |
Drüse oder Zellen |
Hormone |
Ziele |
Hauptwirkung |
|
Peptide |
Adenohypophyse |
Drüse |
Prolaktin (PRL) |
Brust |
Milchproduktion |
|
Thyrotropin (TSH) u.v.m. |
Schilddrüse |
Synthese/Freisetzung von Schilddrüsenhormonen |
|||
|
Bauchspeicheldrüse |
Drüse |
Insulin, Glukagon, Somatostatin |
verschiedene Gewebe |
Stoffwechsel von Glukose und anderen Nährstoffen |
|
|
Magen und Dünndarm |
Zellen |
Gastrin, Sekretin u.v.m. |
Verdauungstrakt und Pankreas |
fördert die Verdauung/Absorption von Nährstoffen |
|
|
Steroide |
Hoden |
Drüse |
Androgen |
verschiedene Gewebe |
Spermienproduktion, sekundäre Geschlechtsmerkmale |
|
Eierstöcke |
Drüse |
Östrogen, Progesteron |
verschiedene Gewebe |
||
|
Amine |
Epiphyse |
Drüse |
Melatonin |
beim Menschen unklar |
zirkadianer Rhythmus |
|
Nebennierenmark |
Drüse |
Adrenalin, Noradrenalin |
verschiedene Gewebe |
Kampf-Flucht-Reaktion |
Steuerung
Viele Funktionen im endokrinen System werden im Gehirn, im sog. Hypothalamus-Hypophysen-System, reguliert. Nervale Reize werden dabei in hormonelle Botenstoffe umgesetzt. Verschiedene Faktoren, wie Einflüsse der Außenwelt und/oder des Organismus sowie psychisch-emotionale Eindrücke, werden als Signal im Gehirn verarbeitet. Es folgt die Ausschüttung von Hormonen des Hypothalamus, die auf die Hypophyse wirken. Besonders der Hypophysenhinterlappen (Adenohypophyse) mit seinen neuroendokrinen Zellen produziert verschiedene Hormone, die vorwiegend auf endokrinen Drüsen des Körpers, wie z.B. die Schilddrüse, wirken. Eine konstante und kontrollierte Konzentration von Hormonen wird im Blut durch sog. Rückkopplungsvorgänge erreicht. Durch die vermehrte Ausschüttung einiger Hormone werden andere gedrosselt, was dazu führt, dass der Körper variabel auf vielerlei Reize reagieren kann. Bei erhöhter Konzentration wird die Produktion gedrosselt (Hypothalamus-Hypophysen-System). Kommt es zu einem Ausfall eines Stellgliedes (einer Drüse oder auch nur eines Hormons) erfolgt eine fehlerhafte Kettenreaktion. Meist ist dann eine medizinische Therapie notwendig.
In diesem Kapitel werden aus dem großen Spektrum der Endokrinopathien 2 der am häufigsten vorkommenden Krankheitsbilder mit der adäquaten Pflege vorgestellt:
-
Pflege von Menschen, die an Diabetes mellitus erkrankt sind
-
Pflege von Patienten, die an der Schilddrüse erkrankt sind
38.1 Pflege von Menschen mit Diabetes mellitus
Anatomie und Physiologie im Fokus
(nach Silverthorn 2009)
Aufbau und Funktion des Pankreas im Überblick
Hinter dem Magen und vor der Wirbelsäule liegt die Bauchspeicheldrüse (Pankreas). Das Pankreas besitzt exokrine und endokrine Funktionen:
-
exokrine Funktion: Enzyme werden zur Verdauung von Eiweiß, Kohlenhydraten und Fett produziert und in den Dünndarm abgegeben.
-
endokrine Funktion: Hormone werden gebildet und direkt ins Blut abgegeben.
In den endokrinen Langerhans-Inseln ( ▶ Abb. 38.2) der Bauchspeicheldrüse werden 3 für die Blutzuckerregulation wichtige Hormone gebildet, die anschließend ins Blut abgegeben werden.
Inselorgan im Pankreasschwanz.
Abb. 38.2 Zwischen den Drüsenazini des Pankreas liegen die hormonsezernierenden Zellen der Langerhans-Inseln.

-
β-Zellen produzieren Insulin: senkt den Blutzuckerspiegel, fördert die Glykogenspeicherung und hemmt die Lipolyse; wirkt antagonistisch zu Glukagon
-
α-Zellen produzieren Glukagon: erhöht den Blutzuckerspiegel und baut über den Leberstoffwechsel Glykogen ab; wirkt antagonistisch zu Insulin
-
δ-Zellen produzieren Somatostatin: hemmt die Freisetzung von Glukagon und Insulin
Je nach Höhe des Blutzuckerspiegels wird Insulin direkt in das Blut abgegeben. Dort wirkt es als Schlüssel an einem Rezeptor und öffnet der Glukose die Tür zu einer Zelle; der Blutzuckerspiegel sinkt. Darüber hinaus reguliert Insulin das Speichern überschüssiger Glukose in Muskel und Leber als Glykogen und die Abgabe von Speicherglukose (Glykogenolyse) aus der Leber ins Blut. Insulin wirkt anabol, es baut Fett auf (Lipogenese) und reguliert den Eiweißstoffwechsel.
Als Schlüsselhormone regulieren Insulin und Glukagon den Kohlenhydrat-, Eiweiß- und Fettstoffwechsel. Zudem wird der Blutzuckerspiegel konstant gehalten.
38.1.1 Medizinischer Überblick
38.1.1.1 Definition
Diabetes mellitus ist eine Stoffwechselkrankheit, die den Kohlenhydrat-, Eiweiß- und Fettstoffwechsel betrifft. Glukose, die von außen in den Körper gelangt, wird nicht mehr ausreichend verwertet (Bahrmann 2014). Bei den unterschiedlichen Formen des Diabetes mellitus handelt es sich um heterogene Stoffwechselstörungen, eine zentrale Rolle spielt das Hormon Insulin.
Beim Diabetes mellitus liegt entweder
-
eine gestörte Insulinsekretion oder/und
-
eine verminderte Insulinwirkung vor.
Zentrales Leitsymptom ist die chronische Hyperglykämie.
38.1.1.2 Häufigkeit
In regelmäßigen Abständen veröffentlicht die „International Diabetes Federation (IDF)“ aktuelle Zahlen rund um das Thema Diabetes mellitus. Schätzungen zufolge sind weltweit ca. 415 Millionen Menschen an Diabetes mellitus erkrankt. Hinzu kommen 318 Millionen Menschen, die aufgrund einer gestörten Glukosetoleranz ein erhöhtes Risiko besitzen, an Diabetes mellitus zu erkranken. Für 2040 prognostiziert die IDF einen Anstieg der Erkrankten auf über 640 Millionen (International Diabetes Federation 2015). Zu Recht spricht die IDF von einer der größten Gesundheitsgefahren unseres Jahrhunderts.
Aktuellen Zahlen der „Deutsche Diabetes Gesellschaft (DDG)“ zufolge leiden in Deutschland rund 7,6 Millionen Menschen an Diabetes mellitus. Die meisten Betroffenen haben einen Diabetes mellitus Typ 2. Dieser Typ betrifft meist erwachsene Menschen. Doch aufgrund der zunehmend ungesunden Lebensweise und des damit einhergehenden Anstiegs der Zahl adipöser Kindern und Jugendlicher ist auch deren Erkrankungsrisiko nicht unbeträchtlich gestiegen. Die Deutsche Diabetes-Hilfe spricht hier von ca. 200 Neuerkrankungen jährlich.
Auch die Zahlen der an Diabetes mellitus Typ 1 erkrankten Menschen steigt, liegt jedoch weit unter der der an Diabetes mellitus Typ 2 erkrankten. So lebten 2015 in Deutschland rund 30 500 Kinder und Jugendliche im Alter zwischen 0 und 19 Jahren mit dieser Stoffwechselerkrankung (DiabetesDE 2016).
38.1.1.3 Klassifikation
Eine einheitliche Klassifikation der Kriterien zur klinischen Definition der vielfältigen Diabetesformen erleichtert Diagnose, Therapie und Pflege. Damit dies von allen Beteiligten durchgeführt werden kann, sind Diagnose und Therapie des Diabetes international und national festgelegt. Die WHO klassifiziert verschiedene Diabetestypen, die national von der DDG übernommen werden. Die aktuelle Klassifikation sieht wie folgt aus (Kerner u. Brückel 2015):
Diabetes mellitus Typ 1 (DMT 1) Die Erstmanifestation dieser Form betrifft vorwiegend Kinder und Jugendliche und tritt im Vergleich zum DMT2 relativ selten auf.
Eine Sonderform, die ebenfalls dem DMT1 zugeordnet wird, der LADA (Late onset autoimmunity diabetes in the adult). Gemeint ist ein verzögert auftretender autoimmunbedingter Diabetes beim Erwachsenen.
Diabetes mellitus Typ 2 (DMT 2) Dieser Typ stellt die häufigste Form des Diabetes mellitus dar und betrifft meistens Erwachsene ab dem 40. Lebensjahr.
Gestationsdiabetes Als Gestationsdiabetes wird eine Glukosetoleranzstörung bezeichnet, die erstmals in der Schwangerschaft auftritt, oder diagnostiziert wird. Der Gestationsdiabetes kommt häufig vor – ca. 5 % aller Schwangeren sind betroffen. Unbehandelt bestehen sowohl für die Mutter als auch für das Kind z.T. erhebliche Risiken. Um diese zu minimieren, ist die blutzuckergestützte Diagnostik seit 2012 fester Bestandteil der Schwangerenvorsorge.
Andere spezifische Diabetes-Typen Diese Formen treten eher selten auf und sind verschiedensten Ursachen zuzuordnen:
-
Erkrankungen des exokrinen Pankreas, z. B. Pankreatitis, zystische Fibrose
-
Endokrinopathien, z. B. Cushing-Syndrom, Akromegalie
-
medikamentös induziert (Glukokortikoide, Alpha-Interferon)
-
genetische Defekte der β-Zell-Funktion, z.B. MODY-Formen (Maturity-Onset Diabetes of the Young. Frei übersetzt: Erwachsenendiabetes, der beim Jugendlichen auftritt)
-
genetische Defekte der Insulinwirkung
-
Infektionen
-
seltene Formen eines autoimmun vermittelten Diabetes mellitus
Diabetes mellitus Typ 1
Diabetes mellitus Typ 1 entsteht durch eine pathogenetische Immunreaktion (Autoimmunerkrankung). Es besteht eine genetische Prädisposition, Autoantikörper gegen körpereigene β-Zellen zu bilden.
So kommt es zunächst zu einem relativen Insulinmangel, der sich mit Fortschreiten der Erkrankung zügig zu einem totalen Mangel entwickelt. Die regelmäßige und individuell angepasste Gabe von Insulin ist daher überlebensnotwendig. Grundsätzlich kann der DMT1 in jedem Lebensalter auftreten; die Erstmanifestation erfolgt jedoch meist in der Kindheit oder Jugend. Neben der genetischen Disposition spielen exogene Trigger (äußere Auslöser), wie z.B. Viruserkrankungen oder andere Umwelteinflüsse, ebenfalls eine Rolle. Die meisten Patienten sind nicht übergewichtig, jedoch gibt es auch Fälle, in denen eine ausgeprägte Adipositas vorliegt (Danne, Kordonouri u. Lange 2015).
Diabetes mellitus Typ 2
Der Diabetes mellitus Typ 2 unterliegt anderen Entstehungsprozessen als der Diabetes mellitus Typ 1. Diese sind komplex und haben zahlreiche Ursachen. Im Gegensatz zum DMT1 sind die β-Zellen zunächst funktionstüchtig und produzieren Insulin.
Zu Beginn der Erkrankung liegt eine verminderte Wirksamkeit des Insulins an den Rezeptoren der Zielzelle vor, es besteht eine sog. Insulinresistenz. Folglich wird die Glukose nicht schnell genug und in ausreichendem Umfang über die Zellmembran in die Zielzelle geschleust. Dadurch bildet sich ein „Rückstau“ der Glukose im Blut. Als Reaktion auf diesen Zustand produzieren die β-Zellen mehr Insulin.
Durch die vermehrte Insulinproduktion soll der hohe Blutzucker ausgeglichen werden. Doch stattdessen kommt es zur sog. Down-Regulation der Rezeptoren.
Down-Regulation Die Down-Regulation ist ein Mechanismus, der die Zelle vor einem Überangebot an Insulin schützen soll. Die Sensibilität der Zellmembranrezeptoren wird also herabgesenkt, die Insulinwirksamkeit weiter reduziert.
Schreitet die Erkrankung weiter voran, lassen die β-Zellen sowohl mit der Schnelligkeit als auch der Menge der Insulinausschüttung nach und es entsteht ein Insulinmangel, der sich in einem Diabetes Typ 2 manifestiert.
Risikofaktoren Diabetes mellitus Typ 2 Das Risiko, an einem Diabetes mellitus Typ 2 zu erkranken, ist multifaktoriell. Man unterscheidet beeinflussbare Faktoren (z.B. Bewegungsmangel, Übergewicht) und nicht beeinflussbare Faktoren (z.B. genetische Disposition). Ist ein Elternteil an Diabetes mellitus erkrankt, vererbt er mit 40%iger Wahrscheinlichkeit den Diabetes mellitus an seine Nachkommen (Hien, Böhm, Claudi-Böhm et al. 2013).
Merke
Die pathologischen Stoffwechselveränderungen, die sich gegenseitig verstärken, werden auch als „Metabolisches Syndrom“ (abdominale Adipositas, Hyperinsulinämie/Insulinresistenz, gestörte Glukosetoleranz, Dyslipoproteinämie, Hypertonie, Albuminurie) bezeichnet (DGG Preisempfehlung).
38.1.1.4 Symptome
Diabetes mellitus Typ 1
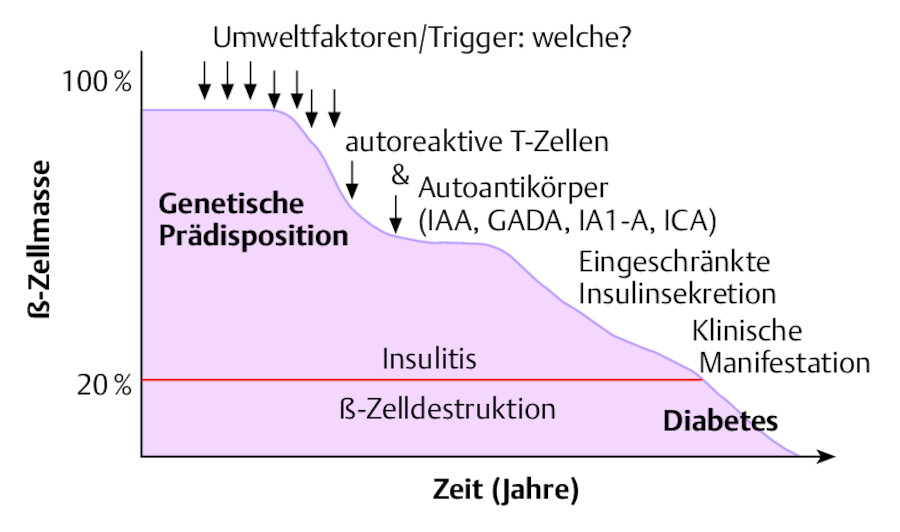
Der Diabetes mellitus Typ 1 manifestiert sich i. d. R. scheinbar plötzlich. Wie aus ▶ Abb. 38.3 ersichtlich, verläuft der Autoimmunprozess längere Zeit, bis die klassischen Symptome auftreten. Dies sind:
Verlauf des Diabetes mellitus Typ 1.
Abb. 38.3 Der Autoimmunprozess dauert längere Zeit, bis die klassischen Symptome auftreten.
-
Polyurie – die abnorm hohe Blutglukose wird im Tubulus nicht rückresorbiert, bindet Wasser und führt zu großen Mengen an Urin
-
Polydipsie – aufgrund des hohen Flüssigkeitsverlustes trinken die Betroffenen 4 – 5 l tgl.
-
Gewichtsabnahme – die Glukose gelangt nicht in die Körperzellen und der Körper baut zur Glukosebildung Fett (Lipolyse) und Eiweiß (Proteolyse) ab
-
trockene Haut, Juckreiz, entzündliche Hautveränderungen wie Furunkel usw.
-
Leistungs- und Konzentrationsschwäche, ausgeprägte Abgeschlagenheit und Müdigkeit
-
Ketoazidose durch ungehemmten Fettabbau führt zur Übersäuerung des Blutes und geht bei fehlender Insulinsubstitution schnell in ein ▶ ketoazidotisches Koma über
Die eindeutigen Anzeichen bedürfen i. d. R. keiner weiteren Diagnostik als der Bestimmung des Blutzuckers und des Azetons im Urin.
Diabetes mellitus Typ 2
Der Diabetes Typ 2 wird häufig zufällig befundet, weil die Symptome weniger auffällig sind als beim Typ 1; der Organismus gewöhnt sich an die erhöhten Blutzuckerwerte. Symptome für einen Diabetes mellitus Typ 2 sind
-
Hyperglykämie, Glukosurie, Exsikkose,
-
Müdigkeit, Abgeschlagenheit,
-
Mykosen, Pruritus,
-
Polyurie und Polydipsie nur in Ausnahmefällen,
-
bereits vorhandene Folgeerkrankungen, z. B. Polyneuropathie oder Retinopathie.
▶ Tab. 38.2 zeigt die Unterschiede zwischen den beiden häufigsten Diabetestypen.
|
Diabetes mellitus Typ 1 (DMT 1) |
Diabetes mellitus Typ 2 (DMT 2) |
|
Synonyme |
|
|
insulinpflichtiger Diabetes; IDDM; jugendlicher Diabetes |
nicht primär insulinpflichtiger Diabetes; NIDDM; Erwachsenen- oder Altersdiabetes |
|
Alter |
|
|
vorwiegend Kinder, Jugendliche |
> 40. Lebensjahr |
|
Krankheitsbeginn und -verlauf |
|
|
schnelle Entwicklung mit Polyurie und Polydipsie oft dramatischer Beginn mit ausgeprägter Exsikkose Betroffene sind sehr krank: 5 – 15 % Erkrankungsbeginn mit einer Ketoazidose |
keine auffälligen Anzeichen; häufig Zufallsbefund evtl. hyperosmolares Koma mit Exsikkose und neurologischen Ausfallzeichen, keine Ketoazidose |
|
Körpergewicht und Folgeerkrankungen |
|
|
vorwiegend schlanke Menschen, Gewichtsverlust |
übergewichtige Menschen und häufig schon nachweisbare Folgeerkrankungen, oft KHK, Hypertonus |
|
Sehvermögen |
|
|
Sehverschlechterung (osmotisch aufquellende Linse) |
Sehverschlechterung (osmotisch aufquellende Linse) |
|
Leistungsfähigkeit |
|
|
auffällige körperliche und mentale Leistungsminderung, Schulprobleme |
auf Nachfrage Müdigkeit oder Schläfrigkeit |
38.1.1.5 Diagnostik
Zur Diagnose eines Diabetes mellitus wird ein Anamnesegespräch (Familienanamnese) mit dem Betroffenen geführt und der Patient körperlich untersucht. Zudem wird der Nüchternblutzucker ( ▶ Tab. 38.3 ), ein Oraler Glukosetoleranztest (OGTT) und ggf. auch weitere technische Untersuchungen (z.B. EKG) durchgeführt (Landgraf, Kellerer, Fach et al. 2015).
Der OGTT wird nach den Kriterien der WHO durchgeführt ( ▶ Tab. 38.4 ). Zu Testbeginn werden 75g Glukose in 300 ml Wasser (Kinder 1,75 g/ kgKG, max. 75 g) aufgelöst und getrunken. Begleitend werden Blutentnahmen zu Testbeginn und nach 120 Min. durchgeführt.
Praxistipp
Folgende Punkte sind bei der Durchführung des OGT-Tests zu beachten:
-
nicht bei akuten Erkrankungen (Infekt, Fieber)
-
≥ 3 Tage vor dem Test kohlenhydratreiche Kost (≥ 150 g KH pro Tag)
-
2 Tage vor dem Test kohlenhydratreiche Kost
-
ggf. Absetzen spezieller Medikamente: (z.B. Prednisolon, L-Thyroxin u.a.)
-
10–16 Std. vor dem Test: Nahrungskarenz, nicht rauchen, kein Sport
-
während des Tests: nüchtern, keine Bewegung, nicht rauchen
Besteht bei einem Patienten eine Auffälligkeit des OGTT, kann dies ein Hinweis auf die Entstehung eines Diabetes mellitus sein. Die abnorme Nüchternglukose (Impaired Fasting Glukose = IFG) bzw. gestörte Glukosetoleranz (Impaired Glukose Tolerance = IGT) ist assoziiert mit dem Auftreten erster Folgeerkrankungen, wie z.B. Makroangiopathien (BÄK 2014, KBV 2014, AWMF 2014). Risikopatienten wird empfohlen, lebensmodifizierende Maßnahmen vorzunehmen (z.B. Gewichtsreduktion).
Merke
Frühe Interventionsmaßnahmen können bei einer gestörten Glukosetoleranz präventiv wirksam sein. Durch eine Lebensstiländerung (z.B. mehr Bewegung, gesunde Ernährung usw.) und ggf. den Einsatz von Medikamenten kann einer Diabetesmanifestation vorgebeugt werden (Hien et al. 2013).
Die Bestimmung der Blutglukose kann über verschiedene Probenarten erfolgen. Dabei ist zu beachten, dass die Werte zwischen den einzelnen Messverfahren variieren können. Die Glukosewerte im Plasma liegen in der Regel 10–15 % über denen des Vollblutes (diabetesDE) ( ▶ Tab. 38.3 ).
|
Regelhafte Glukosewerte |
Gestörte Nüchternglukosewerte (IFG) |
Diagnostische Kriterien für Diabetes mellitus |
|
|
Plasma, venös |
<100 mg/dl <5,6 mmol/l |
≥100 mg/dl / <126 mg/dl ≥5,6 mmol/l / <7,0 mmol/l |
≥126 mg/dl ≥7,0 mmol/l |
|
Vollblut, kapillär |
<90 mg/dl <5,0 mmol/l |
≥90 mg/dl / <110 mg/dl ≥5,0 mmol/l / <6,1 mmol/l |
≥110 mg/dl <6,1 mmol/l |
|
Regelhafte Glukosewerte nach 2 Std. |
Gestörte Glukosetoleranz (IGT) nach 2 Std. |
Diagnostische Kriterien für Diabetes mellitus |
|
|
Plasma, venös |
<140 mg/dl <7,8 mmol/l |
≥140 mg/dl / <200 mg/dl ≥7,8 mmol/l / <11,1 mmol/l |
≥200 mg/dl ≥11,1 mmol/l |
|
Vollblut, kapillär |
<140 mg/dl <7,8 mmol/l |
≥140 mg/dl / <200 mg/dl ≥7,8 mmol/l / <11,1 mmol/l |
≥200 mg/dl ≥11,1 mmol/l |
HbA1c-Wert (glykosyliertes Hämoglobin) Der HbA1c-Wert ist ein Maß für die Qualität der Blutzuckereinstellung der vergangenen 8–12 Wochen. Glukose lagert sich irreversibel an Hämoglobin an. Dieser Prozess wird als Glykierung bezeichnet.
Normalerweise wird der HbA1c alle 3 Monate bestimmt und lässt retrograde Rückschlüsse auf die Stoffwechseleinstellung zu. Die Bestimmung des HbA1c und die täglichen Blutzuckerwerte sind unerlässlich für therapeutische Entscheidungen. Falsche Werte können vorliegen bei einer verkürzten Erythrozytenlebensdauer, Hämoglobinopathien, Niereninsuffizienz.
In Deutschland wird der HbA1c oft noch in Prozent (%) angegeben. International wird inzwischen jedoch die Einheit Promille (‰) bevorzugt, also mmol Glukose pro mol Hämoglobin. Beide Angaben sind in der Praxis anzutreffen.
Fallbeispiel
Frau Sendlinger ist 68 Jahre alt. Seit dem Tod ihres Ehemanns vor 2 Jahren lebt sie allein in ihrer Eigentumswohnung im dritten Stock eines Mehrfamilienhauses. Frau Sendlinger hat eine verheiratete Tochter, die ca. 300 km entfernt wohnt.
Im Alter von 65 Jahren wird bei Frau Sendlinger ein Diabetes mellitus Typ 2 diagnostiziert, der zunächst mit oralen Antidiabetika behandelt wird. Nach einer Schulung wird Frau Sendlinger im Alter von 67 Jahren auf eine konventionelle Insulintherapie mit morgens 40 IE und abends 24 IE Mischinsulin eingestellt. Frau Sendlinger hat einen BMI-Wert von 30 und einen Blutdruck von 155/90 mmHg, wobei Blutdruckspitzen bis 190/110 mmHg vorkommen. Der HbA1c-Wert im letzten halben Jahr liegt bei 8 % (64 mmol/mol).
Vor 2 Jahren erlitt Frau Sendlinger einen leichten Schlaganfall, von dem eine leichte Bewegungseinschränkung des linken Armes sowie eine Sensibilitätsstörung der linken Hand zurückgeblieben sind, die sie als Rechtshänderin nur gering behindern. Nach der Erholungsphase kann sich Frau Sendlinger weiterhin selbst versorgen.
Frau Sendlinger hat zunehmend Schwierigkeiten, die Treppe zu ihrer Wohnung in den dritten Stock zu bewältigen. Dabei klagt sie über Schmerzen in den Beinen. An der linken Ferse hat sich eine dicke Hornhautschicht entwickelt und die Zehenzwischenräume weisen eine Mykosis auf. An der dritten Zehe des linken Fußes hat sich ein Hühnerauge (Clavus) gebildet.
Frau Sendlinger hat guten Kontakt zu ihren Nachbarn, die sich etwas um sie kümmern. Sie ist geistig noch fit, nimmt regelmäßig an den Treffen des Seniorenkreises ihrer Gemeinde teil und unternimmt gerne Ausflüge. An Sonntagen trifft sie sich mit ihrer Freundin zu Kaffee und Kuchen.
Seit Wochen fühlt sich Frau Sendlinger nicht ganz wohl und klagt immer wieder über Schwindelanfälle und Schwächegefühl. Beim Kaffee am letzten Wochenende fällt der Freundin Frau Hübner auf, dass Frau Sendlinger wenig isst, obwohl die Mokkacremetorte ihr erklärter Lieblingskuchen ist. Sie trinkt auch weniger als sonst. Als Frau Hübner sie darauf anspricht, sagt Frau Sendlinger: „Ich bin seit ein paar Tagen nicht so richtig auf dem Damm, mir wird immer schwindlig und ich fühle mich müde und schlapp, zudem muss ich dauernd auf die Toilette.“ Frau Hübner entgegnet darauf: „Wenn du dir die Blase verkühlt hast, dann solltest du dringend zum Arzt gehen.“ Frau Sendlinger entgegnet darauf: „Ich trinke morgens und abends meinen Blasentee, der hat mir schon öfter geholfen. Und bei diesen Temperaturschwankungen ist es kein Wunder, dass ich Kreislaufprobleme habe. Das geht wieder vorüber, da muss ich nicht zum Arzt gehen, der kann mir ja doch nicht helfen. Der sagt höchstens wieder, dass ich Diät halten soll.“
Als eine Nachbarin am Sonntagvormittag bei Frau Sendlinger läutet, um sie zur Kirche abzuholen, trifft sie diese verwirrt, unruhig und desorientiert in der Wohnung an und ruft den Notarzt. Dieser holt von der Nachbarin nähere Informationen über Frau Sendlinger ein. Er erfährt ihre Vorgeschichte und weist sie mit Verdacht auf einen erneuten Apoplex in die Klinik ein.
Eine erste schnelle Einschätzung durch die aufnehmende Gesundheits- und Krankenpflegerin ergibt: Die Patientin wirkt verwirrt, spricht verwaschen. Die Patientin ist stark exsikkiert. Die Blutzuckermessung ergibt einen Blutzucker von 421 mg/dl (23,4 mmol/l). Der Blutdruck beträgt 186/102 mmHg am rechten Arm und 178/98 mmHg am linken Arm. Das Ergebnis der Blutanalyse zeigt eine Hypokaliämie sowie erhöhte Fettstoffwechselwerte.
38.1.1.6 Therapie
Das therapeutische Handlungsfeld bei Diabetes mellitus ist vielfältig und geht weit über die rein medikamentöse Therapie hinaus. So ist die genaue Betrachtung des Lebensstils ebenso wichtig wie die Teilnahme an speziellen Schulungen und die Anleitung nahestehender Angehöriger (z.B. Eltern, Ehepartner etc.).
Diabetes mellitus Typ 1
Die Therapie des DMT1 wird heute stärker denn je an den individuellen Bedürfnissen des Patienten ausgerichtet. Die Betroffenen müssen wegen der fortschreitenden autoimmun gesteuerten Zerstörung der körpereigenen Insulinzellen lebenslang mit Insulin behandelt werden. Das Therapieziel ist ein normaler oder normnaher Blutzucker ( ▶ Tab. 38.5 ), um mögliche diabetesbedingte Folgeerkrankungen zu vermeiden und ▶ akute Entgleisungen wie ketoazidotisches Koma oder Hypoglykämie zu verhindern.
Lebensphase Kind
DMT1
Neueste Therapieansätze bei DMT1 basieren darauf, dass Kinder mit DMT1 gesunde Kinder sind, die sich lediglich durch einen Insulinmangel auszeichnen (Danne, Kordonouri u. Lange 2015).
|
Orientierungsgröße |
stoffwechselgesund |
gut |
mäßig (Maßnahmen empfohlen) |
schlecht (Maßnahmen erforderlich) |
|
Blutglukose (BG) präprandial (vor dem Essen) oder nüchtern |
3,6–5,6 65–100 |
5–8 90–145 |
> 8 > 145 |
> 9 > 162 |
|
BG postprandial (nach dem Essen) |
4,5–7,0 80–126 |
5–10 90–180 |
10–14 10–250 |
> 14 > 250 |
|
nächtliche BG |
3,6–5,6 65–100 |
4,5–9 80–162 |
< 4,2 oder >9 < 75 oder >162 |
< 4,0 oder > 11 < 70 oder > 200 |
|
HbA1c-Wert in % |
< 6,05 |
< 7,5 |
7,5–9 |
> 9 |
Diabetes mellitus Typ 2
Die Therapie des DTM2 zielt ebenso wie die Therapie bei DTM1 auf eine normale Blutglukose ab, unterscheidet sich von dieser jedoch aufgrund der unterschiedlichen Entstehungsursache wesentlich im Therapieansatz. Dieser basiert bei DTM2 auf einer Anpassung des Lebensstils. Eine Ernährungsumstellung und regelmäßige Bewegung sind die Grundlage. Langfristig sollte eine Gewichtsreduktion angestrebt werden ( ▶ Tab. 38.6 ). Auch das Rauchen sollte eingestellt werden, um das Risiko z.B. für mikro- und makrovaskuläre Folgeerkrankungen zu reduzieren (Landgraf et al. 2015).
|
Indikatior |
Therapieziel |
|
Präprandiale Plasmaglukose (venös)/nüchtern |
100–125 mg/dl oder 5,6–6,9 mmol/l |
|
Postprandiale Plasmaglukose (venös) |
140–199 mg/dl oder 7,8–11,0 mmol/l |
|
HbA1c |
|
|
Lipide |
|
|
Gewichtsabnahme bei Übergewicht |
|
|
Bluthochdruck |
|
Je nach Stadium der Erkrankung werden Antidiabetika und/oder Insulin verordnet. Ziel dieser zahlreichen Maßnahmen ist eine verbesserte Stoffwechsellage mit vermindertem Risiko für Folgeerkrankungen. Sind Begleiterkrankungen wie Hypertonie, Hyperlipidämie und Gerinnungsstörungen bereits aufgetreten, müssen diese ebenfalls medikamentös therapiert werden.
Merke
Weitere Ziele in der Diabetesbehandlung:
-
Erhalt und Wiederherstellung der Lebensqualität
-
Empowerment der Betroffenen im Umgang mit der Erkrankung
-
Verminderung des Krankheitsstigmas
-
Förderung der Therapieadhärenz
-
Reduktion des Risikos für ▶ makrovaskuläre Folgeerkrankungen
-
Vermeidung und Behandlung von ▶ mikrovaskulären Folgeerkrankungen
-
Vermeidung und Behandlung von Folge- und Begleiterkrankungen
Die Ziele müssen immer an die individuelle Situation des Patienten angepasst werden
38.1.2 Basistherapie bei Diabetes mellitus
Die Basistherapie besteht aus:
-
Glukoseselbstmessung (auch: Blutzuckermessung)
-
Ernährungstherapie
-
Schulung und Beratung
Um die Blutzuckermessung, die Berechnung von Kohlenhydrateinheiten (KE) und die Insulininjektion zu lernen, stehen den Patienten speziell qualifizierte Pflegende, sog. Diabetesberater, zur Seite. Diese vermitteln umfassendes Wissen rund um das Thema Diabetes und schulen den Patienten intensiv im Umgang mit seiner Erkrankung.
38.1.2.1 Blutzuckermessung
Die regelmäßige Kontrolle des Blutzuckers ist ein fester Bestandteil im Alltag eines Patienten mit Diabetes mellitus ( ▶ Abb. 38.4).
Blutzuckermessung.
Abb. 38.4
Abb. 38.4a Benötigte Materialien vorbereiten: unsterile Einmalhandschuhe, Tupfer, Lanzette mit Stechhilfe, Hautdesinfektionsmittel, BZ-Teststreifen, Blutzuckermessgerät.
(Foto: K. Oborny, Thieme)
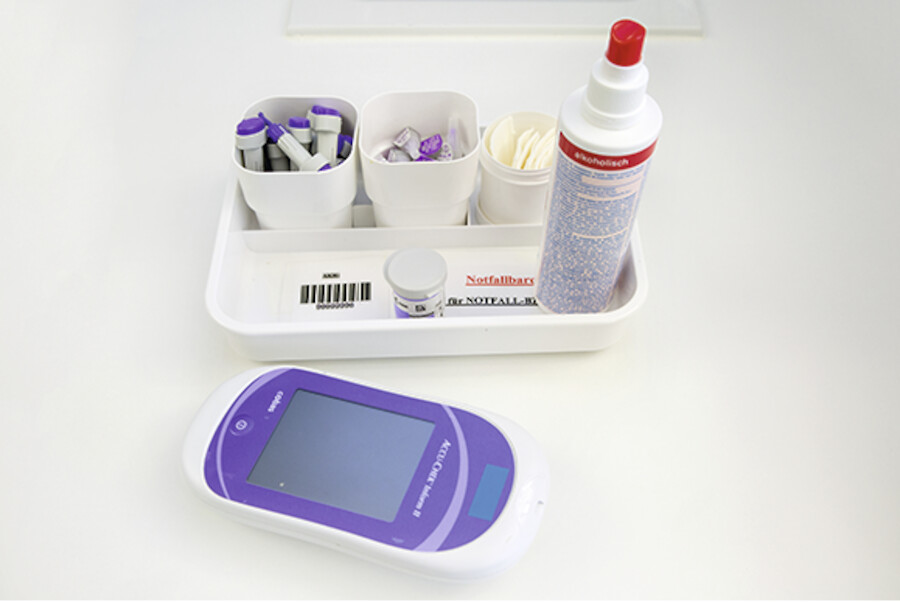
Abb. 38.4b Vor der Messung sollte der Patient die Hände waschen und gründlich abtrocknen (bei immobilen Patienten können die Hände mit einem nassen Waschlappen gesäubert werden). Anschließend wird die Einstichstelle desinfiziert. Dabei macht es keinen Unterschied, ob dies mittels Wisch- oder Sprühdesinfektion geschieht (wichtig: vorgeschriebene Einwirkzeit abwarten!).
(Foto: K. Oborny, Thieme)
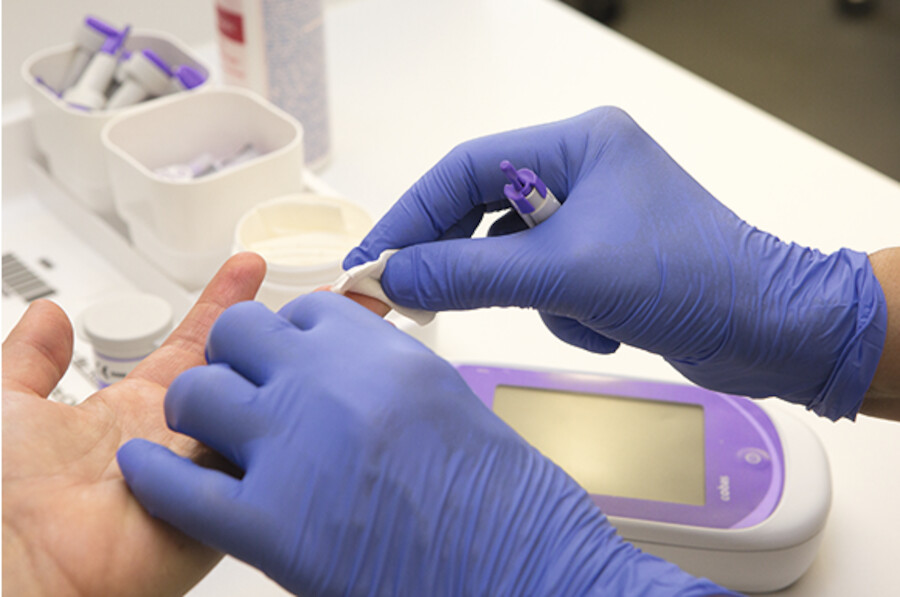
Abb. 38.4c BZ-Teststreifen in das Blutzuckermessgerät stecken. Stechhilfe seitlich auf die Fingerbeere aufsetzen und Auslöser drücken (Zeigefinger und Daumen möglichst nicht anstechen, da diese im Alltag häufig genutzt werden). Alternativ kann auch das Ohrläppchen verwendet werden.
(Foto: K. Oborny, Thieme)
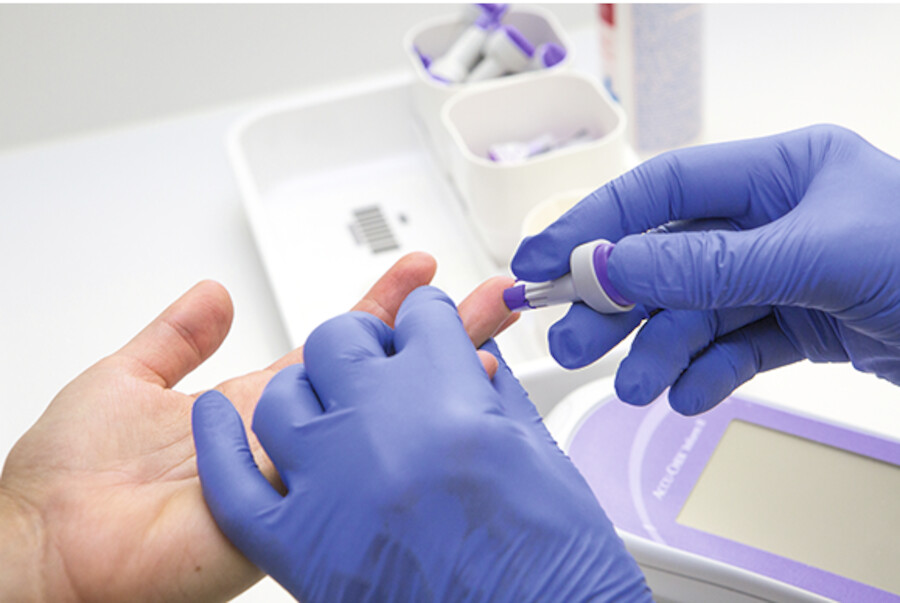
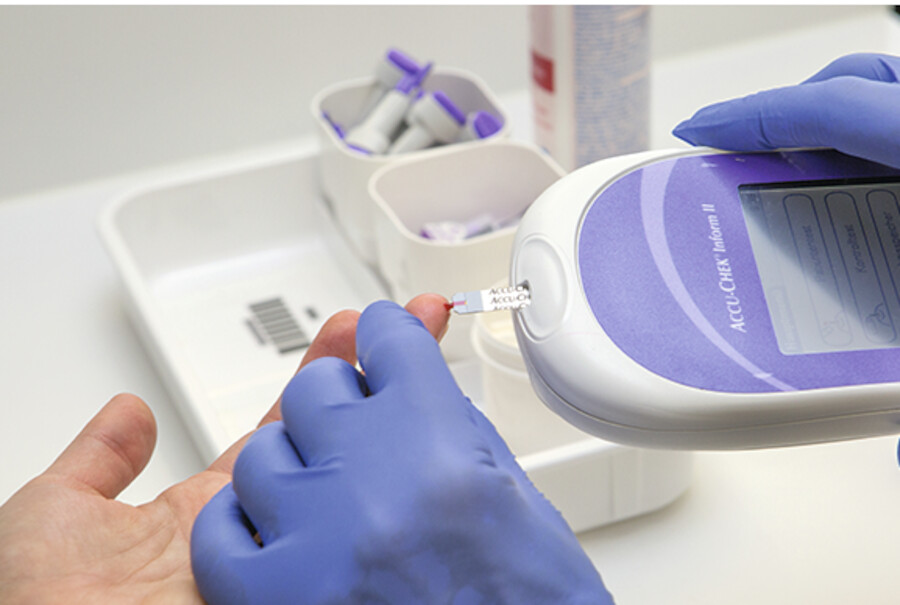
Abb. 38.4d Sofern die vorherigen Handlungsschritte korrekt durchgeführt wurden, wird der erste Tropfen Blut zur Messung genutzt. Halten Sie dazu den Teststreifen an den Blutstropfen (moderne Geräte benötigen nur noch sehr wenig Blut. Sollte es dennoch zu wenig sein, können Sie den Finger sanft in Richtung Fingerkuppe ausstreichen). Das Gerät zeigt Ihnen an, ob die Messung erfolgreich war. Anschließend wird die Einstichstelle mit einem Tupfer komprimiert und der gemessene Wert dokumentiert.
(Foto: K. Oborny, Thieme)
Bei DMT1 muss der Blutzucker bis zu 7-mal täglich überprüft werden. Individuelle Umstände können eine häufigere Messung notwendig machen (Neu et al. 2015). Die Ergebnisse der Blutzuckerkontrolle hängen von der Nahrungsaufnahme ab und geben Auskunft über die benötigte Insulindosis.
Bei Patienten mit DMT2 sind meist nur Gelegenheitsmessungen des Blutzuckers nötig. Es gibt jedoch auch Situationen, bei denen eine regelmäßige Kontrolle notwendig ist. So z.B. bei
-
neu diagnostizierten Manifestationen,
-
häufigen Unterzuckerungen,
-
zusätzlichen Erkrankungen (z.B. schwere Infektionen),
-
geplanten Operationen,
-
Insulintherapie mit Notwendigkeit der Selbstanpassung der Insulindosis,
-
bestimmten ▶ Diabetes-Therapien, z.B. Insulinpumpentherapie oder Konventioneller Insulintherapie,
-
während der medikamentösen Einstellungsphase (Landgraf et al. 2015).
38.1.2.2 Diabetes und Ernährung
Neben der körperlichen Aktivität ist die Ernährung ein wesentlicher Bestandteil der Therapie bei Patienten mit Diabetes mellitus. Ist für den Typ-1-Diabetiker die Kenntnis des Gehalts an Kohlenhydraten in Lebensmitteln die Basis für die Insulinbedarfsberechnung, so steht besonders für den Typ-2-Diabetiker die Körpergewichtsreduktion im Vordergrund. Eine bedarfsgerechte Ernährung wird angestrebt und sollte nicht nur aufgrund der chronischen Erkrankung fokussiert werden. Die Blutzuckerregulation wird in besonderem Maße von den verzehrten Lebensmitteln beeinflusst. Grundlage einer guten Ernährungsberatung ist es, Vorlieben der Betroffenen zu erfragen und diese in die Empfehlungen zu integrieren. Verbote, wie sie früher in der Diabetesbehandlung vermittelt wurden, gibt es nicht mehr!
Ziel Ziel einer bedarfsgerechten Ernährung ist es, den Blutzucker im normnahen Bereich zu halten und – falls möglich – Übergewicht abzubauen.
Grundnährstoffe Die drei Grundnährstoffe sind Kohlenhydrate, Fett und Eiweiß. Die Richtlinien der Fachgesellschaften (DGE, DDG) empfehlen eine Nahrungszusammensetzung für Diabetiker von
-
45 – 60 % Kohlenhydraten (1 g hat 4,1 kcal),
-
30 %–35% Fett (1 g hat 9,3 kcal), bei Übergewicht < 30 %
-
10% –20% Eiweiß (1 g hat 4,1 kcal).
In Deutschland steigt die Zahl übergewichtiger Menschen seit Jahren stetig an. Die Vermittlung von Wissen über eine bedarfsgerechte Ernährung und deren Umsetzung im Alltag sind daher ein wesentlicher Bestandteil der Ernährungsschulung. Die Tabelle Nahrungsmittel im Überblick gibt einen Überblick über kalorienreiche und -ärmere Nahrungsmittel ( ▶ Tab. 38.7 ).
|
kalorienreiche Nahrungsmittel |
kalorienärmere Nahrungsmittel |
Bemerkungen und Pflegetipps |
|
|
einfache Kohlenhydrate |
Kuchen, Torte, Marmelade, Bonbons, Gummibärchen |
||
|
komplexe Kohlenhydrate (ballaststoffreich) |
Obst, Gemüse, Hülsenfrüchte, Kartoffeln, Vollkornreis, Vollkornbrot, Nudeln |
Blutzucker steigt langsamer an |
|
|
Getränke ohne Zucker |
Mineralwasser, Tee, Kaffee, Lightgetränke |
mit Süßstoff süßen |
|
|
Getränke, die gemieden werden sollten |
normale Cola, Fanta usw., Fruchtsaft, Traubensaft |
lassen den BZ sehr schnell ansteigen helfen am besten bei einer Hypoglykämie |
|
|
Getränke, die eingeschränkt getrunken werden können |
Alkohol |
Lightbier, Weinschorle |
nach größerer Menge Alkohol Blutzucker vor dem Schlafengehen messen; bei < 140 mg/dl (7,8 mmol/l) mind. 2 BE essen |
|
Fette |
pflanzliche Fette, Öle, Margarine, Butter, oft verborgen in Fleisch und Wurst |
Halbfett-Margarine oder Halbfett-Butter |
pflanzliche Fette und Öle bei gestörtem Fettstoffwechsel bevorzugen |
|
Eiweiß |
Fisch, Fleisch, Milch, Milchprodukte, Wurst, Soja |
fettarmer Joghurt, Milch, usw. |
Eiweiß ist meistens mit Fett verbunden (z.B. in Wurst)! helles Fleisch ist gesünder als rotes! |
38.1.2.3 Kohlenhydrate
Einfache Kohlenhydrate in Süßigkeiten, Keksen und Marmelade usw. führen zu einem schnellen Blutzuckeranstieg nach dem Essen. Der Konsum sollte gering sein (am besten in Verbindung mit anderen Kohlenhydraten, Eiweiß und Fett aufnehmen).
Komplexe Kohlenhydrate (Polysaccharide, Disaccharide) in Vollkornprodukten werden langsamer zu Glukose (Monosaccharide) abgebaut und sollten einen großen Teil in der Ernährung ausmachen.
Ballaststoffe lassen den Blutzucker nur sehr gering und langsam ansteigen. Dementsprechend werden Gemüse und Salat (reich an Ballaststoffen) nicht in die Berechnung einbezogen (Toeller et al. 2005, DGG 2010).
Berechnungseinheiten Für die ▶ Berechnung des zur Nahrungsaufnahme erforderlichen Insulins ist es üblich, die Kohlenhydratmenge (KH) in der Berechnungseinheit BE (Broteinheit) anzugeben. Der Begriff der Kohlenhydrat-Einheit (KE) wird oft synonym zum Begriff der Berechnungseinheit (BE) genutzt.
Eine BE/KH entspricht ca. 10 bis 12 g Kohlenhydraten. Beispiele:
-
mittelgroße Kartoffel von 80 g oder 2 Kroketten von 40 g → 1 BE
-
kleiner Apfel von 100 g oder ½ Banane von 60 g → 1 BE
-
mittelgroßes Brötchen von 50 g oder 1 Scheibe Brot (60 g) → 2 BE.
-
Essteller große Pizza → 6 bis 8 BE
Diese besonders für Typ-1-Diabetiker wichtige Berechnungsgrundlage wird in Schulungen erlernt und verinnerlicht. Dabei ist es nicht zielführend, ein Leben lang Lebensmittel zu wiegen und auf das Gramm genau zu berechnen. Vielmehr ist es mittlerweile üblich, dass der Patient lernt, seine Tellerportion korrekt einzuschätzen, um so die entsprechenden BE zu ermitteln. Dies erhöht die Lebensqualität des Betroffenen immens, da er sich an keine feste BE-Menge pro Mahlzeit halten muss (veraltete Therapieform).
Die Einschätzung der BE-Menge muss täglich geübt werden. Für Berechnungseinheiten und Austauschmöglichkeiten wie Brot gegen Obst gibt es Austauschtabellen, die Patienten in jeder Diabetesschulung für die persönliche Auswahl der Nahrungsmittel erhalten ( ▶ Tab. 38.8 ).
|
Nahrungsmittel |
Menge |
Gramm |
|
Grundnahrungsmittel |
||
|
Brot |
1 Scheibe |
30 |
|
Brötchen |
½ Brötchen |
25 |
|
Croissant |
½ Croissant |
30 |
|
Kartoffel |
1 mittelgroße |
80 |
|
Kartoffelpüree |
2 gehäufte EL |
100 |
|
Nudeln gekocht |
2 gehäufte EL |
45 |
|
Obst |
||
|
Apfel |
1 kleiner |
100 |
|
Banane |
ca. ½ |
60 |
|
Pflaumen |
3 Stück |
125 |
|
Johannisbeeren |
1½ Tassen |
250 |
|
Milch und Milchprodukte |
||
|
Milch natur 1,5 % |
¼ l |
250 |
|
Milch natur 3,5 % |
¼ l |
250 |
|
Buttermilch |
¼ l |
250 |
|
Back-Süßwaren |
||
|
Buttercremetorte |
ca. ⅓ Stück |
40 |
|
Butterkeks |
3 Stück |
15 |
|
Vollmilchschokolade |
1 Riegel |
20 |
|
Eis |
1 Kugel |
40 |
|
Knabberartikel |
||
|
Erdnussflips |
48 Stück |
25 |
|
Salzstangen |
20 Stück |
15 |
Zuckeraustauschstoffe Fruchtzucker (Fruktose) und Zuckeralkohole wie Xylit, Mannit, Isomalt sind Kohlenhydrate, haben genauso viele Kalorien wie Zucker und werden in die Berechnung einbezogen. Ihr Vorteil liegt darin, dass sie nur zu einem schwachen Anstieg des Blutzuckers führen. In größeren Mengen gegessen wirken sie abführend.
Merke
Von Fruktose als Zuckeraustauschstoff für Diabetiker wird abgeraten, da diese eine ungünstige Wirkung auf den Fettstoffwechsel hat (Bundesinstitut für Risikobewertung 2009).
Zuckerersatzstoffe Dies sind Süßstoffe, die in flüssiger Form, als Streusüße oder Tabletten im Handel erhältlich sind. Sie erhöhen den Blutzucker nicht und haben keine Kalorien.
38.1.2.4 Eiweiß
Eiweiß ist für den Organismus ein essenzieller Baustoff und fast in allen Nahrungsmitteln mehr oder weniger enthalten. Der tägliche Bedarf eines Jugendlichen/Erwachsenen liegt bei 0,8 g pro kg Körpergewicht. Die tatsächliche Aufnahme liegt in Deutschland jedoch doppelt so hoch. Menschen mit Diabetes und/oder Hypertonie haben oft eine eingeschränkte Nierenfunktion und sollten sich an die Empfehlung halten (Toeller et al. 2005, DDG 2010).
38.1.2.5 Fette
Fette und v.a. versteckte Fette haben einen hohen Energiegehalt und finden sich z.B. in Pommes frites, Kroketten, Bratwurst, Leberwurst, Sahne, Torten usw. (Toeller et al. 2005, DGG 2010) Fettreiche Ernährung ist die häufigste Ursache für Übergewicht und Herz-Kreislauf-Erkrankungen.
Prävention und Gesundheitsförderung
Empfehlung Fettreduktion: Wird ein Patient mit Insulin behandelt, kommt es aufgrund der anabolen Insulinwirkung oft zu einer Gewichtszunahme. Hier gilt es, den Patienten zu beraten, ihn zu unterstützen und mit ihm die Kalorienbewertung und -aufnahme (fettreduziert) abzustimmen. Als geeignet wird heute eine mediterrane Kostform mit reichlich Gemüse und mit Fisch statt Fleisch unter Verwendung pflanzlicher Öle mit einem hohen Gehalt an ungesättigten Fettsäuren eingeschätzt.
38.1.2.6 Beratung und Schulung
Der Erfolg von Therapiemaßnahmen ist entscheidend von der aktiven Mitarbeit der Betroffenen abhängig. Die Akzeptanz von Maßnahmen ist nicht selbstverständlich und erfordert oft ein hohes Maß an Disziplin und zeitlichen Ressourcen. Besonders in speziellen Lebenssituationen (z.B. Pubertät bei Jugendlichen) fällt es den Betroffenen mitunter schwer, die nötige Motivation aufzubringen. So ist die Schulung und Beratung von Patienten mit Diabetes ein fester Bestandteil der Therapie.
Schulungsprogramme
Schulung und Beratung werden vom interdisziplinären Team geplant und durchgeführt. Zum Team zählen u.a. speziell ausgebildete Diabetesberater oder Diabetesassistenten, Arzthelferinnen, Ärzte, Ökotrophologen, Diätassistentinnen und Psychologen.
Grundlage des Schulungsprogramms ist die Annahme, dass der Patient selbst Experte für seine körperliche und seelische Verfassung ist und das multidisziplinäre Team für die professionelle Therapie verantwortlich ist. Das Sich-aufeinander-Einlassen und der Dialog mit dem Schwerpunkt auf der individuellen Situation und Persönlichkeit des erkrankten Menschen ist die Voraussetzung für eine gute und erfolgversprechende Beratung.
Fachkenntnis und verschiedene Konzepte für eine individuelle Schulung und Beratung sind dabei wegweisend, um das richtige Modell für den Betroffenen zu finden. Dabei muss das interdisziplinäre Team die individuelle gesundheitliche Ansicht des Patienten sowie seine Laienkonzepte im Kontext seiner gesellschaftlichen, kulturellen, alters-, geschlechts-, umweltspezifischen und ökonomischen Situation erfassen und in die Schulung integrieren.
Für Pflegende, die Patienten mit Diabetes mellitus und diabetesbedingten Folgeerkrankungen betreuen, bedeutet dies eine enorme, breit gefächerte Beratungsaufgabe. Aufzuklären, anzuleiten und zu begleiten sind die Patienten über
-
Ernährung, Gewichtsreduktion,
-
Nichtrauchen,
-
körperliche Aktivität/Sport,
-
regelmäßige Medikamenteneinnahme,
-
Blutdruck- und Blutzuckermessen,
-
psychosoziale Betreuung.
Praxistipp
Informationen sind wichtig! Achten Sie jedoch darauf, den Patienten nicht durch zu viele Informationen zu überfordern. Planen Sie gezielte, kurze Anleitungen, sodass der Patient folgen kann. Geben Sie ihm genügend Zeit, Vertrauen zu fassen, sich mit der neuen Situation auseinanderzusetzten und über persönliche Probleme zu sprechen. Helfen Sie ihm, eigene Lösungsansätze zu finden, und loben Sie den Patienten auch für kleine Fortschritte.
Im Sinne von ▶ Empowerment ist es wichtig, nicht direktiv auf den Patienten einzuwirken, sondern ihn im Prozess, Experte für seine eigene Erkrankung zu werden, zu begleiten. Damit geht einher, dass der Patient aktiv in Entscheidungsprozesse einbezogen und zur Selbstmedikation sowie zur Selbstmessung befähigt wird (Teilnahme an Schulungen). Therapieziele sollten immer gemeinsam festgelegt werden.
38.1.3 Antidiabetika
Ist eine optimale Blutzuckereinstellung über die Basistherapie allein nicht möglich, kommen meist orale Antidiabetika zum Einsatz.
▶ Tab. 38.9 zeigt eine Auswahl insulinsekretionssteigernder Medikamente (β-zytrope-Antidiabetika). Nicht-insulinsekretionssteigernde Substanzen (nicht-β-zytrope-Antidiabetika) werden in ▶ Tab. 38.10 aufgeführt.
|
Wirkstoffgruppe |
Wirkstoffe |
Handelsname (Beispiele) |
Wirkung |
Unerwünschte Wirkung |
Kontraindikationen |
Besonderheit |
|
Sulfonylharnstoffe |
|
|
|
|
|
|
|
Glinide |
|
|
|
|||
|
GLP-1 Analoga |
|
|
|
|
|
|
|
DDP-4-Inhibitoren (Gliptine) |
|
|
|
|
|
|
Wirkstoffgruppe |
Wirkstoffe |
Handelsnamen (Beispiele) |
Wirkung |
Unerwünschte Wirkung |
Kontraindikationen |
Besonderheit |
|
Biguanide |
|
|
|
|
|
|
|
α-Glukosidasehemmer |
|
|
|
|
|
|
|
Glitazone |
Pioglitazon |
Actos |
Steigerung der Insulinwirkung |
|
|
|
|
SGLT-2-Inhibitoren |
|
|
|
|
|
|
Die meisten Patienten nehmen viele Medikamente ein, weil Begleiterkrankungen wie Fettstoffwechselstörungen, Hypertonie, orale Antidiabetika und/oder Insulin, Gerinnungsstörungen, Hyperurikämie therapiert werden müssen. Oft lassen Patienten Medikamente wie Antihypertensiva einfach weg, wenn sie sich relativ wohl fühlen.
Folgende Handlungsweisen sind zu vermeiden:
-
Mahnungen, Anordnungen, dirigieren oder Befehle aussprechen.
-
Patienten überreden, manipulieren.
-
Gefühle, Gedanken und Lösungsversuche der Betroffenen missachten, ignorieren oder bagatellisieren.
-
Lehrsätze und Dogmen vertreten und dabei die Lebenswelt des Patienten außer Acht lassen.
-
Monologe halten und dabei den anderen aus den Augen verlieren.
-
Eigene subjektive Erfahrungen, Gedanken und Gefühle auf den anderen projizieren.
38.1.3.1 Basistherapie bei Diabetes mellitus Typ 1
Die Insulin produzierenden β-Zellen werden durch den fortschreitenden Autoimmunprozess zerstört. Sofort bei Diagnose müssen alle Patienten mit Insulin therapiert werden. Blutzuckermessungen , Insulininjektion und -dosisanpassung, Berechnung von Kohlenhydraten, Sport, Hypoglykämie usw. erlernen Patienten in einer Diabetesschulung von speziell qualifizierten Pflegenden, den Diabetesberatern.
Insulin wird mehrmals täglich injiziert, als basales Insulin zum Abdecken des Grundbedarfs und für die Nahrungsaufnahme als Bolus-Insulin. Diese Insulintherapie wird ICT – Intensivierte Konventionelle Insulintherapie genannt. Eine weitere Art der Therapie ist die Insulinpumpentherapie (continuous subcutaneous insulin infusion = CSII).
Die Formen der unterschiedlichen Insulintherapien sind im Abschnitt ▶ „Intensivierte, konventionelle Insulin-Therapie“ beschrieben.
38.1.3.2 Basistherapie bei Diabetes mellitus Typ 2
Entsprechend den Leitlinien erfolgt die Behandlung in einem Stufenmodell. In den folgenden drei Monaten soll durch Basisschulung eine Verhaltensänderung bezüglich Ernährung und körperlicher Aktivität erfolgen. Ziel ist ein HbA1c-Wert von 7 % (< 53 mmol/mol). Gelingt dem Patienten eine Änderung seines Lebensstils, ist dies die beste Prognose für den Langzeitverlauf des Diabetes. Wie jeder aus eigener Erfahrung weiß, ist es aber sehr schwer, das eigene Verhalten und eingefahrene Gewohnheiten zu verändern!
Häufig reicht die Basistherapie über einen längeren Zeitraum aus. Kriterium ist der HbA1c-Wert (Zielwert zwischen 6,5 und 7 %, 48 – 53 mmol/mol) je nach Alter und weiteren Erkrankungen des Patienten. Wird der HbA1c-Wert von 7 % (53 mmol/mol) trotz Ernährungsumstellung und Bewegung überschritten, ist eine Therapieanpassung mit Insulin unterstützenden Medikamenten und/oder Insulin angezeigt.
38.1.4 Insulintherapie und Insulininjektion
Die Grundlage für eine erfolgreiche Diabetes-Therapie wurde von den Deutschen Oskar Minkowski und Joseph von Mering gelegt. Durch Tierexperimente fanden sie 1890 heraus, dass der Diabetes mit der Funktion des Pankreas zusammenhängt. Den größten Forschungserfolg hatten die kanadischen Forscher Banting und Best. Sie extrahierten 1921 aus Bauchspeicheldrüsen von Tieren eine Lösung, die bei einem zuckerkranken Hund den Blutzucker erfolgreich senkte. Dies führte zur lebensnotwendigen Insulintherapie (Heinrich, Müller, Graeve 2014).
Das Hormon Insulin ist ein Polypeptid, das aus einer A- und B-Kette besteht. Die Vorstufe von Insulin wird Proinsulin genannt und durch Abspaltung entsteht C-Peptid. Insulin muss immer parenteral verabreicht werden, da es sonst von der Magensäure zerstört wird. Menschliches Insulin (Humaninsulin) wird entweder aus Tierpankreata (Schwein) oder von gentechnisch veränderten Bakterien hergestellt, die dann Humaninsulin produzieren.
Arzneimittel im Fokus
Wirkungen und Nebenwirkungen von Insulin
Wirkungen von Insulin
-
senkt den Blutzucker durch Einschleusung von Glukose in Körperzellen
-
unterstützt die Speicherung von Glukose als Glykogen in Leber und Muskulatur
-
hemmt den Fettabbau (Lipolyse)
-
fördert die Fettaufnahme in das Fettgewebe (Lipogenese)
-
bewirkt einen Muskelaufbau (Proteinsynthese) durch Erhöhung des Proteinaufbaus (Offermanns 2016)
Nebenwirkungen von injiziertem Insulin
-
Hypoglykämie
-
Lipohypertrophie im s. c. Gewebe (bei zu häufiger Injektion im selben Bereich)
-
Insulinallergie bzw. auf die Beimengungen; Inzidenz mit hochreinem Humaninsulin stark gesunken (Hien et al. 2013)
38.1.4.1 Physiologische Insulinsekretion
Die physiologische Insulinsekretion setzt sich aus der kontinuierlichen Basalsekretion und der prandialen Sekretion (während und nach Mahlzeiten) zusammen ( ▶ Abb. 38.5). Dabei deckt die Basalsekretion den Grundbedarf des Körpers an Insulin ab. Um den Stoffwechsel aufrechtzuerhalten, ist eine kontinuierliche Verfügbarkeit von Glukose wichtig. Eine kontinuierliche Insulinausschüttung muss sichergestellt sein.
Während der Mahlzeiten wird dem Körper eine große Menge an Kohlenhydraten zugeführt. Darauf reagiert das Pankreas mit einer erhöhten Insulinausschüttung, um den entstehenden Blutzuckeranstieg zu regulieren. Überschüssige Kohlenhydrate werden für eine spätere Verwendung in Form von Glykogen in der Leber zwischengespeichert.
Die Insulintherapie zielt darauf ab, die physiologische Insulinsekretion möglichst nachzuahmen. Individuelle Lebensumstände sowie der Tagesrhythmus des Betroffenen müssen berücksichtigt werden.
Physiologische Insulinsekretion.
Abb. 38.5 Die Insulinfreisetzung erfolgt in Abhängigkeit von der Kohlenhydrataufnahme und Sport (bzw. körperlicher Aktivität).

Die physiologische Insulinausschüttung wird mit verschiedenen Strategien nachgeahmt:
-
CT: Konventionelle Therapie
-
ICT: Intensivierte konventionelle Therapie
-
BOT: Basal unterstützte orale Therapie
-
SIT: Supplementäre Insulintherapie
-
CSII: Kontinuierliche subkutane Insulin-Infusion (Insulinpumpe)
Für diese unterschiedlichen Therapien stehen verschiedene Insuline mit unterschiedlichen Wirkprofilen zur Auswahl (Wagner 2015) ( ▶ Tab. 38.11 ).
|
Insulinart |
Handelsname |
Wirkeintritt |
Wirkdauer |
|
Normalinsulin (auch Alt-Insulin) |
Actrapid, Huminsulin Normal, Insuman Rapid, |
nach 30 Min. |
5 – 7 Std. |
|
kurzwirksame Insulinanaloga |
Apidra, Humalog, NovoRapid, |
nach 10–15 Min. |
1 Std. |
|
Verzögerungsinsulin (Basal- oder NPH-Insulin) |
Protaphane, Huminsulin Basal, Berlinsulin H Basal |
nach 60–120 Min. |
12–16 Std. |
|
langwirksame Insulinanaloga |
Lantus |
60–120 Min. |
20–30 Std. |
|
Levemir |
60–120 Min. |
16–20 Std. |
|
|
Tresiba |
60–120 Min. |
> 40 Std. |
|
|
Mischinsuline (Mischung aus Normal- und Verzögerungsinsulin in verschiedenen Konzentrationen) |
Actraphane 30 oder 50, Berlinsulin H 30/70, Insuman Comb 15, 25 , 50, Huminsulin Profil III |
30–60 Min. (Normalinsulinanteil möglicherweise früher) |
12 – 16 Std. |
|
Je höher die injizierte Insulinmenge ist, umso größer ist das subkutane Depot und desto länger wirkt das Insulin. So kommen die Zeitspannen in der Wirkdauer zustande (Hien et al. 2013). |
|||
38.1.4.2 Konventionelle Insulintherapie (CT)
Die konventionelle Insulintherapie ist (immer noch) die am häufigsten eingesetzte Therapieform und eignet sich für Typ-2-Diabetiker. In der Regel wird nach einem festgelegten Schema (meist 2 x täglich) ein Mischinsulin injiziert ( ▶ Abb. 38.6).
Konventionelle Insulintherapie.
Abb. 38.6 Mischinsulingabe vor dem Frühstück und dem Abendessen.
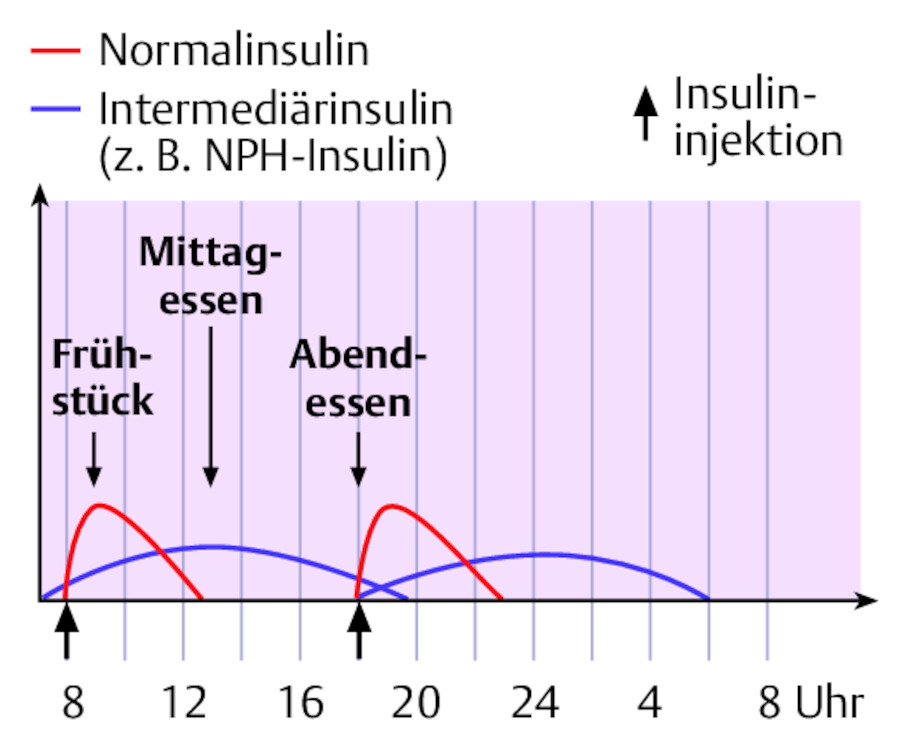
Der Insulinbedarf ist individuell sehr unterschiedlich und hängt von der Insulinresistenz und der noch teilweise eigenen Insulinproduktion ab. Vor Therapiebeginn muss deshalb der Insulinbedarf bestimmt werden. Die festgelegte tägliche Insulindosis wird meistens im Verhältnis 2/3 morgens und 1/3 abends aufgeteilt. Das Mischverhältnis ist ebenfalls individuell und richtet sich u.a. nach den Essensgewohnheiten des Patienten. Die in der Mischung enthaltenen Insuline bestehen immer aus einem schnell wirksamen Anteil (Normal- oder Analoginsulin) und einem langsam wirksamen Basalinsulin. So ist nur eine Injektion notwendig, um beide Formen zu applizieren.
Praxistipp
Mischinsuline müssen vor der Injektion mindestens 20-mal geschwenkt werden, damit sich die beiden Anteile durchmischen können. Sonst besteht die Gefahr, dass das Insulin nicht im richtigen Mischverhältnis verabreicht wird.
Um einen ausreichenden Insulinspiegel zu den Mahlzeiten zu erreichen, sollte der Spritz-Ess-Abstand (SEA) bei Mischinsulinen mit Normalinsulinanteil 15–30 Min. betragen. Wenn das Mischinsulin ein kurzwirksames Analogon enthält, ist kein SEA notwendig. Um eine Hypoglykämie zu vermeiden, muss zu jeder Mahlzeit eine gleichbleibende Menge an Kohlenhydraten aufgenommen werden. Auch Zwischenmahlzeiten sind erforderlich. Die Insulindosierung ist zu Beginn der konventionellen Insulintherapie (CT) immer niedrig angesetzt und wird im Verlauf angepasst. Deshalb sind auch bei der CT tägliche BZ-Kontrollen wünschenswert und sinnvoll (Hien et al. 2013).
Lebensphase alter Mensch
Präprandialier Blutzucker
Um einer Hypoglykämie vorzubeugen, sollte bei alten Menschen mit einem präprandialen Blutzucker (BZ vor dem Essen) unter 130 mg/dl (~7 mmol/l) die Insulingabe erst nach der Mahlzeit erfolgen.
Vorteile Die CT-Therapie hat folgende Vorteile:
-
einfache Handhabung, da das Behandlungsschema vorgegeben ist und sich nur wenig verändert
-
wenig BZ-Kontrollen
Nachteile Die CT-Therapie hat folgende Nachteile:
-
häufige Nahrungsaufnahme nötig, um Hypoglykämien zu vermeiden
-
starres Schema, das Unregelmäßigkeiten wie Sport oder eine Veränderung des Tag-Nacht-Rhythmus kaum möglich macht
-
oft Gewichtszunahme durch den (relativ) hohen Insulinspiegel und die häufigen Mahlzeiten
Lebensphase alter Mensch
Konventionelle Insulintherapie (CT)
Die CT wird oft bei älteren Menschen eingesetzt, da sie meist einen geregelten Tagesablauf haben. Zudem ist die Therapie gut durch einen ambulanten Pflegedienst oder pflegende Angehörige umsetzbar, da das Insulin nur 2-mal täglich gespritzt werden muss.
38.1.4.3 Intensivierte, konventionelle Insulin-Therapie (ICT)
Für Menschen, die an Diabetes Typ 1 erkrankt sind, ist die ICT Standard. Selbstverständlich können alle Diabetesformen mit einer ICT therapiert werden. Die ICT kommt der physiologischen Insulinsekretion am nächsten.
Anwendung
Der basale Grundbedarf wird mit der Gabe von Verzögerungsinsulin (Basal-Insulin) imitiert. Dieses injiziert sich der Patient 1 – 3-mal täglich. Hinzu kommt die Injektion von Bolus-Insulin zu den Mahlzeiten (Kohlenhydrate) ( ▶ Abb. 38.7).
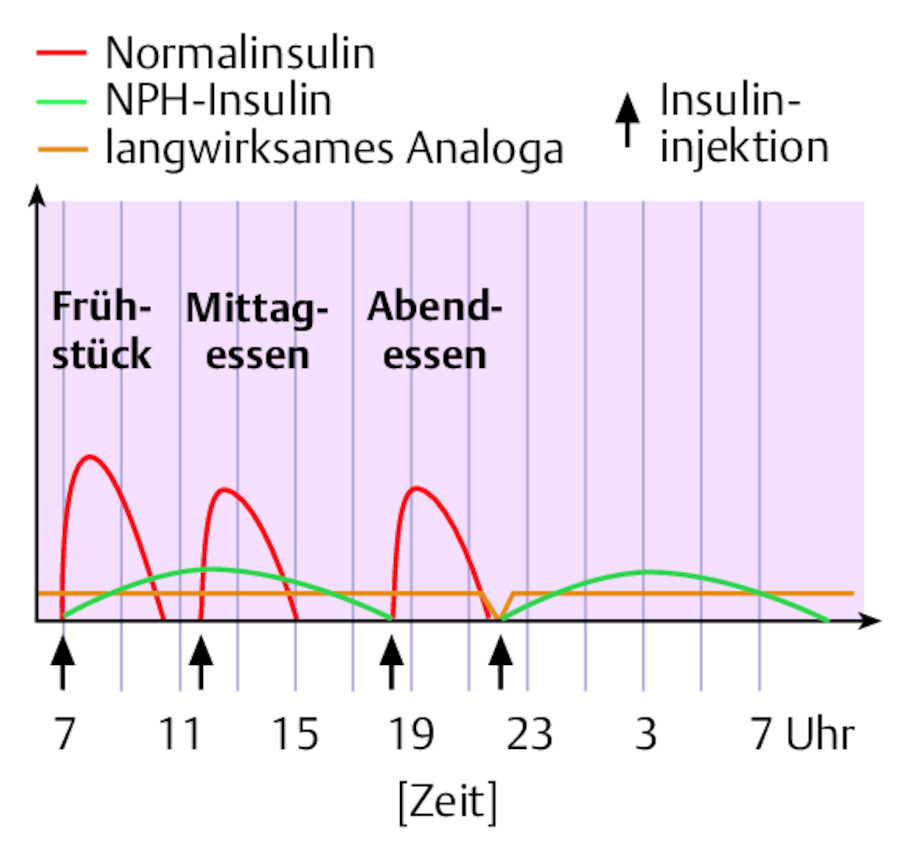
Intensivierte konventionelle Insulintherapie (ICT).
Abb. 38.7 Basis: je eine Injektion morgens und spätabends, plus Bolus: 3-mal täglich vor jeder Hauptmahlzeit.
Voraussetzung Da die Umsetzung der ICT sehr komplex ist und viel Eigeninitiative vom Patienten fordert, müssen die Betroffenen intensiv geschult werden, um die Therapie korrekt durchführen zu können. Besonders der Umgang mit Insulin, die Berechnung von Insulineinheiten und Notfallmaßnahmen müssen gelernt und beherrscht werden. Die Schulungen werden von ausgebildeten Diabetesberatern durchgeführt.
Durchführung
Der Arzt berechnet für jeden Patienten individuell die Basalrate. Diese macht ungefähr 40% des Gesamtinsulinbedarfs (0,7 IE/kg KG) aus und liegt beim Erwachsenen bei ca. 0,2–04 IE/kg KG. Jugendliche haben besonders in Wachstumsphasen einen deutlich höheren Insulinbedarf. Die Basalrate wird mit 1–3 Injektionen (je nach Insulin und Bedarf) pro Tag verabreicht.
Zusätzlich zur Basalrate rechnen die Betroffenen selbst ihren prandialen Insulinbedarf aus. Dazu müssen sie die glykämische Wirkung ihrer Mahlzeit abschätzen. Anfangs kann es sinnvoll sein, die Lebensmittel zu wiegen, um so die glykämische Wirkung zu berechnen. Da jedoch nicht allein das Lebensmittel, sondern auch die Zubereitungsart, die Zusammenstellung der Mahlzeit sowie die individuelle Essgeschwindigkeit die glykämische Wirkung von Kohlenhydraten beeinflussen, ist der Effekt des Wiegens langfristig zu vernachlässigen. Hinzu kommt, dass auch die tageszeitliche Insulinsensitivität miteinbezogen werden muss.
Um eine BE/KE auszugleichen, benötigt der Körper je nach Tageszeit unterschiedliche Mengen an Insulin (Beispiel):
-
morgens: 1,3–2,5 IE
-
mittags: 1 IE
-
abends: 1–1,5 IE
Diese Werte sind sehr individuell und müssen von einem Diabetologen patientenbezogen festgelegt werden. Die anschließend erstellte Tabelle zeigt auf, wie viel Insulin der Patient bei welcher Mahlzeit (entsprechend der ermittelten BE/KE) spritzen muss.
Auch zu hohe präprandiale BZ-Werte werden durch Bolus-Insulin ausgeglichen. Dazu wird das Korrekturinsulin zum prandialen Insulin hinzugerechnet. Als Faustformel beim Erwachsenen gilt:
1 IE kurzwirksames Insulin senkt den BZ um 30–50 mg/dl.
Je höher der Blutzucker ist, desto mehr Einheiten werden benötigt (Hien et al. 2013).
Praxistipp
Morgendlich erhöhte Nüchtern-BZ-Werte können auf eine nächtliche Hypoglykämie hinweisen. Der Blutzucker am Morgen ist erhöht, weil der Körper als Notfallmaßnahme die Glykogenreserven in Glukose umwandelt, um genügend Energie zur Verfügung zu haben. Hier werden nächtliche BZ-Kontrollen notwendig und eine Anpassung der abendlichen Basalinsulindosis (Somogyi-Phänomen) (Wagner 2015).
Vorteile
-
Bestmögliche BZ-Einstellung, durch Selbstkontrolle können Entgleisungen selbständig korrigiert werden.
-
Tagesablauf ist durch individuelle Insulinberechnung flexibel gestaltbar.
-
Mahlzeiten können flexibel eingenommen werden.
-
Therapie kann an Sport- und Freizeitaktivitäten angepasst werden.
-
Oft wird die Stoffwechseleinstellung verbessert und so das Risiko für Folgeerkrankungen reduziert.
Nachteile
-
häufige BZ-Kontrollen (bis zu 7-mal tgl.)
-
häufige Insulininjektionen (bis zu 7-mal tgl.)
-
Hypoglykämien; leichte Hypoglykämien kommen selbst bei guter BZ-Einstellung öfters vor. Der Betroffene muss Anzeichen früh erkennen und behandeln.
38.1.4.4 Basal unterstützte orale Therapie (BOT)
Bei der BOT wird die orale medikamentöse Therapie durch die Injektion eines Verzögerungsinsulins unterstützt, das die Basalsekretion nachahmt. Diese Therapie kommt zum Einsatz, wenn sich der Blutzucker (BZ) nicht mehr ausreichend über orale Antidiabetika absenken lässt (Offermanns 2016).
Vorteile
-
einfaches Behandlungsschema ohne großen Schulungsbedarf
-
eine Injektion pro Tag reicht aus
38.1.4.5 Supplementäre Insulin-Therapie (SIT)
Diese Therapie eignet sich nur für Diabetiker, die noch über eine basale Insulinsekretion (z.B. bei DMT2) verfügen. Zu den Mahlzeiten injizieren sich die Patienten individuell berechnete Einheiten eines Normalinsulins oder kurzwirksamen Insulin-Analogon. Es sind mindestens 3 Injektionen täglich notwendig, um die physiologische Insulinsekretion zu imitieren (Hien et al. 2013).
Vorteile
-
flexible Gestaltung des Tagesablaufs
38.1.4.6 Kontinuierliche subkutane Insulininfusionstherapie (CSII)
Bei der CSII wird über einen dünnen Kunststoffkatheter kontinuierlich Normal- oder Analoginsulin abgegeben. Gesteuert wird dies über eine programmierbare Pumpe. Diese Form der Applikation kommt der physiologischen Insulinsekretion am nächsten, da kein Depot gebildet, sondern das Insulin kontinuierlich abgegeben wird.
Zu den Mahlzeiten können Boli abgerufen werden. Die Nadel darf max. 48 Std. liegen bleiben. Dies macht eine Desinfektion der Einstichstelle bei einem Wechsel zwingend nötig.
Die größte Gefahr bei dieser Behandlungsform stellen Hyperglykämien dar. Durch unbemerktes Abknicken oder Herausrutschen des Katheters wird die Insulinzufuhr gestoppt. Da (fast) kein Depot vorhanden ist, kommt es sehr schnell zu einem Insulinmangel mit steigenden Blutzuckerwerten. Hypoglykämien sind dagegen seltener.
Die modernste (aber noch nicht ausgereifte) Form der Insulinbehandlung ist eine Insulinpumpe in Kombination mit einer kontinuierlichen Blutzuckermessung. Die beiden Geräte sind aufeinander abgestimmt; die Pumpe gibt automatisch die zum Blutzucker passende Menge Insulin frei (Closed-Loop-System).
Vom Anwender verlangt die CSII ein hohes Maß an Wissen und technischem Verständnis. Daher sollte er in einer Schulung den Umgang mit allen Materialien erlernen. Außerdem muss eine Betreuung durch eine diabetologische Facheinrichtung sichergestellt sein.
Indikationen sind ein Typ-1-Diabetes, eine geplante Schwangerschaft und ein berufsbedingt unregelmäßiger Tagesablauf (Schatz u. Pfeiffer 2014). Da die Kosten für die Durchführung einer CSII sehr hoch sind, bedarf es eines Notwendigkeitsgutachtens durch den MDK. Auch im weiteren Verlauf werden Verlaufsgutachten angefertigt, die den Nutzen der Therapie belegen müssen (MDS 2012).
Praxistipp
Sollte auf Ihrer Station ein Patient mit einer Insulinpumpe behandelt werden, suchen Sie ggf. den Kontakt zu einem Diabetesberater. Dieser berät und unterstützt Sie gerne in der speziellen Betreuung des Patienten.
Die Thematik und Technik der CSII ist zu speziell und bedarf konkreter Praxiserfahrung, als dass dies über dieses Kapitel vermittelbar wäre.
Vorteile
-
verdeckte Insulingabe möglich und dadurch Reduzierung des Krankheitsgefühls
-
wenig Injektionen
-
hohe Flexibilität
38.1.5 Verabreichen von Insulin
38.1.5.1 Insulin-Pen
Seit Mitte der 80er Jahre gibt es neben der Insulin-Spritze auch die sog. Pens, die einem Füllhalter ähnlich sind. Viele Patienten akzeptieren diese Pens für die Injektionen deutlich besser als Spritzen.
Die Handhabung ist sehr einfach und das Aufziehen und Mischen des Insulins fällt weg, da eine große Anzahl von Herstellern auch Mischinsuline in jedem Verhältnis anbieten. Der Pen besteht im Grundsatz aus einer Dosiereinheit, einer (austauschbaren) Insulinpatrone, dem Patronenhalter und der Nadel sowie einer Verschlusskappe ( ▶ Abb. 38.8).
Die Dosis kann an einem Drehknopf am Ende der Dosiereinheit eingestellt werden. Die Abstufungen sind von Hersteller zu Hersteller unterschiedlich. Welcher Pen zu welchem Patienten passt, muss dieser selbst ausprobieren. Die Diabetesberaterin ist ihm bei der Auswahl behilflich und stellt verschiedene Modelle vor. Die Pflegekraft unterstützt den Patienten in der täglichen Anwendung des gewählten Pens.
Insulinpens.
Abb. 38.8
(Foto: R. Stöppler, Thieme)
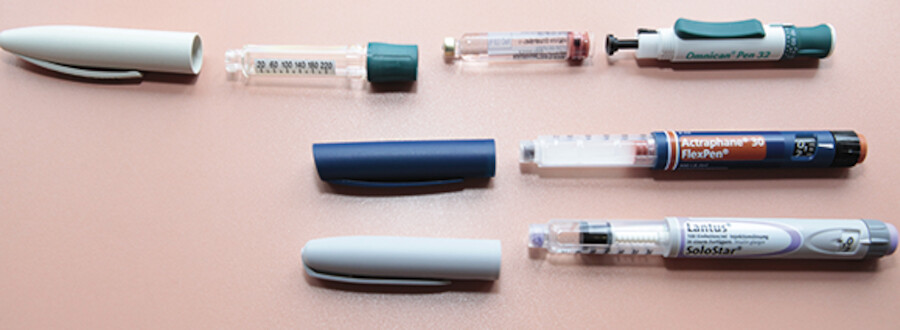
Alle Insulinfirmen vertreiben eigene, produktgebundene Pens. Unbedingt zu beachten ist, dass Patrone, Nadel und Pen zusammenpassen. Bei fast allen Pens kann die eingestellte Dosierung korrigiert werden, viele haben eine Dosisanzeige und einige sogar ein Display mit Anzeige der gewählten Insulineinheiten und der Zeit der letzten Applikation. Es gibt Pens zum Wiederauffüllen mit Patrone und Pens als Einmalartikel für Menschen, die die Patronen selbst nicht wechseln können. Für Patienten, die verschiedene Insuline spritzen, gibt es zur schnelleren Orientierung und um eine Verwechslung zu vermeiden, verschieden farbige Injektionshilfen.
Praxistipp
Vor jeder Insulinapplikation ist eine Funktionsprüfung durchzuführen. Dazu die Nadel festschrauben und die kleinste einstellbare Einheit aus dem senkrecht gehaltenen Pen applizieren. Sollte kein Insulin an der Nadelspitze erkennbar sein, den Vorgang wiederholen. Sollte auch nach der zweiten Wiederholung kein Insulin austreten, darf der Pen nicht verwendet werden.
Auch im Krankenhaus wird ein Pen immer nur von einer Person benutzt. Pennadeln sind Einmalprodukte und entsprechend nach Gebrauch zu entsorgen (VDBD 2011).
38.1.5.2 Insulininjektion
Injektionsort
Am besten ▶ geeignete Injektionsareale sind der Bauchbereich, die Außenseite der Oberschenkel und auch das Gesäß. Jeder Injektionsort besitzt eine unterschiedliche Resorptionsrate. Daher sollten Pflegende immer darauf achten, den Injektionsort entsprechend dem jeweiligen Insulin auszuwählen ( ▶ Tab. 38.12 ).
|
Injektionsort |
Resorptionsgeschwindigkeit |
bevorzugtes Insulin |
|
Oberschenkel |
langsame Resorption |
Basal-Insulin |
|
Bauch |
schnelle Resorption |
Bolus-Insulin zu den Mahlzeiten |
|
Gesäß |
langsame Resorption |
Basal-Insulin |
Die Oberarme als Injektionsort zu nutzen wird nicht mehr empfohlen, da es hier in der Vergangenheit oft zu versehentlichen intramuskulären Verabreichungen gekommen ist. Bei einer intramuskulären Injektion erhöht sich die Resorptionsrate und es besteht die Gefahr einer Hypoglykämie.
Unbedingt erforderlich ist es, die Spritzstellen immer zu wechseln, um Veränderungen des subkutanen Gewebes (Lipodystrophie) vorzubeugen. Ein festgelegtes Spritzschema kann dabei helfen (Hien et al. 2013). Viele Hersteller von Insulinpens bieten zu diesem Zweck Spritzschemata an, die auf den entsprechenden Bereich gelegt werden können. Sollten Hautveränderungen (wie Entzündungen, Ödeme, Tattoos oder Narben) vorliegen, wird in diesem Bereich nicht injiziert (VDBD 2011).
Durchführung Insulininjektion
Die Injektion von Insulin erfolgt subkutan. Die Nadellänge liegt bei Erwachsenen zwischen 4 und 8 mm, bei Kindern zwischen 4 und 6 mm. Durch diese Nadellängen ist eine nahezu schmerzfreie Insulininjektion möglich. Wird die empfohlene Nadellänge verwendet, ist die Bildung einer Hautfalte i.d.R. nicht erforderlich; sie kann jedoch präventiv gefasst werden, um eine versehentliche i. m.-Injektion zu vermeiden.
Merke
Bei der Verwendung zu langer Nadeln steigt das Risiko einer intramuskulären Injektion.
Die Nadel wird im 90°-Winkel eingestochen und das Insulin langsam appliziert. Nach erfolgter Injektion wird die Nadel noch mind. 10 Sek. in der Haut belassen, um einen Rückfluss des Medikaments durch den Einstichkanal zu verhindern. So ist sichergestellt, dass auch die gesamte Menge an Wirkstoff verabreicht wird (VDBD 2011).
Praxistipp
Müssen größere Dosen Insulin injiziert werden (> 30 IE/Injektion), so wird empfohlen, die Menge auf 2 Injektionen aufzuteilen und die Injektionsstellen zu wechseln. Das Teilen der Dosis verringert die Gesamtwirkzeit des Insulins. Eine zu lange Wirkung wird so vermieden ( ▶ Tab. 38.12 ). Die doppelte Injektion wird von geschulten Diabetikern i.d.R. problemlos akzeptiert (Hien et al. 2013).
Insulinlagerung Insulin wird bei 2 – 8 °C im Kühlschrank gelagert (es darf nicht gefrieren!). Vor dem ersten Gebrauch muss das Insulin bei Raumtemperatur mind. 30 Min. angewärmt werden. Im Gebrauch befindliches Insulin sollte nicht mehr im Kühlschrank aufbewahrt werden, sondern bei Raumtemperatur, geschützt vor Sonnenlicht lagern. Angebrochenes Insulin kann bis zu 28 Tage verwendet werden, danach muss es verworfen werden.
Merke
Beschriften Sie angebrochenes Insulin immer mit Anbruchdatum und notieren Sie das Datum der Ablauffrist.
Beispiel: „angebrochen am: 28.10.2016; verwendbar bis: 25.11.2016“
Blutzuckerschwankungen Der Blutzucker wird von vielen Faktoren beeinflusst. Die folgenden Fragen sollen dabei helfen, die Gründe für die Blutzuckerschwankung herauszufinden:
-
Hat der Betroffene sich in letzter Zeit anders ernährt also sonst?
-
Wurde der Zeitpunkt der Insulininjektion verändert oder wurde die Dosis angepasst?
-
Ist der gewählte Injektionsort frei von Veränderungen?
-
Wurde die richtige Nadellänge gewählt?
-
Ist der Spritz-Ess-Abstand eingehalten worden?
-
Wurden neue Medikamente eingenommen?
-
Besteht eine neue Erkrankung oder liegen Infektionen oder Entzündungen vor?
-
Ist das Blutzuckermessgerät funktionsbereit?
-
Wurde der Tagesablauf verändert, ohne die Insulindosierung anzupassen?
-
Ist der Pen funktionstüchtig und die Patrone noch befüllt?
Wenn Sie diese Fragen im Kopf haben, können Sie den Grund für die meisten Blutzuckerschwankungen herausfinden.
38.1.6 Diabetesbedingte Akutkomplikationen
Es gibt 2 diabetische Akutkomplikationen:
-
Hypoglykämie (Unterzuckerung)
-
Hyperglykämie (Überzuckerung)
Die Hypoglykämie tritt sehr akut auf und erfordert sofortiges Handeln, wohingegen sich die hyperglykämischen Komplikationen langsamer entwickeln. Beide Notfallsituationen können zur Bewusstlosigkeit und einer akuten vitalen Bedrohung führen. Deshalb ist es wichtig, Frühwarnzeichen rechtzeitig zu erkennen und schnell Gegenmaßnahmen einzuleiten.
38.1.6.1 Hypoglykämie
Die Hypoglykämie ist nicht einheitlich definiert. In der aktuellen deutschen „Nationalen VersorgungsLeitlinie“ (NVL) werden 2 Formen der Hypoglykämie unterschieden:
-
klinisch leichte Hypoglykämie (Patient erkennt Unterzuckerung und kann sie selbst beheben)
-
schwere Hypoglykämie (Fremdhilfe ist notwendig)
Diese Definition ist bei differenzierter Betrachtung nicht ausreichend. Auch die Grenzwerte werden in der Literatur kontrovers diskutiert. Die „American Diabetes Association“ (ADA) hat den Grenzwert für eine Hypoglykämie auf 70 mg/dl (3,9 mmol/l) gesetzt. Das hat pragmatische Gründe. Ab diesem Wert reagiert der Körper mit gegenregulatorischen Maßnahmen.
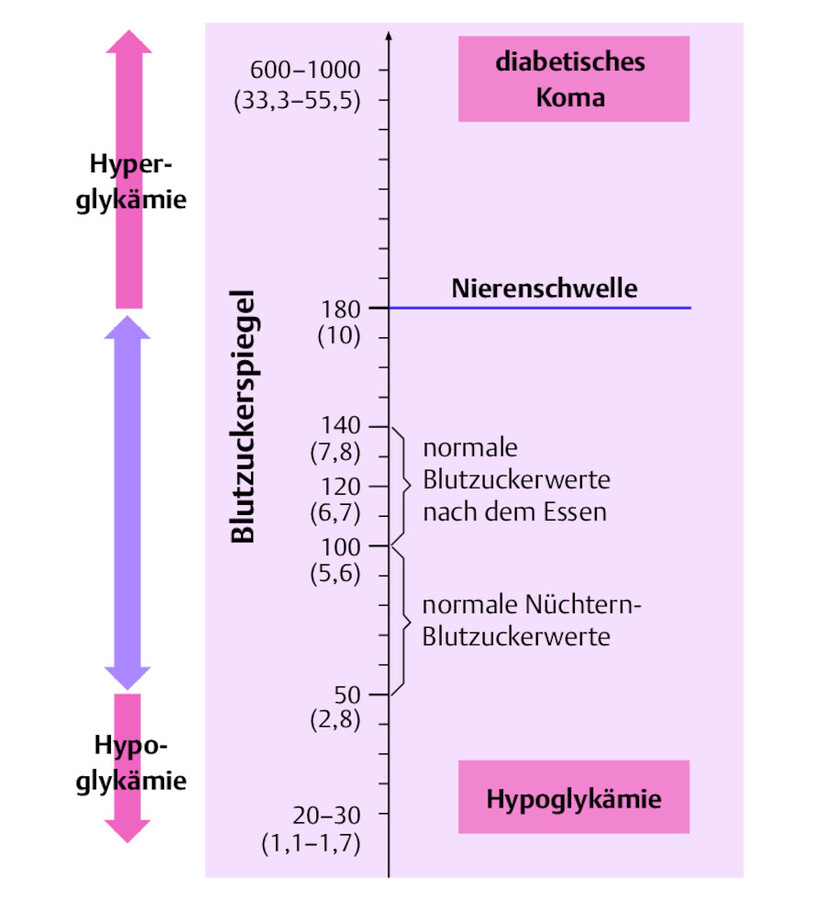
Andere Fachgesellschaften definieren niedrigere Werte. Vielfach wird von einem Schwellenwert von 50 mg/dl (2,8 mmol/l) ausgegangen, da sich zu diesem Zeitpunkt meist die ersten klinischen Symptome zeigen ( ▶ Abb. 38.9) (Schatz u. Pfeiffer 2014).
Blutzuckerspiegel.
Abb. 38.9 Normale und pathologische Blutzuckerwerte. Angaben in mg/dl, in Klammern in mmol/l.
Ursachen einer Hypoglykämie sind häufig eine
-
unzureichende Nahrungsaufnahme,
-
überhöhte physische Aktivität oder
-
Medikamentenüberdosierung.
Es ist auch möglich, dass Betroffene zu ehrgeizige Therapieziele verfolgen und deshalb öfter hypoglykämisch werden.
Die Symptome sind in ▶ Tab. 38.13 zusammengefasst.
|
autonome Symptome |
neuroglykopenische Symptome |
unspezifische Symptome |
|
|
|
Als Reaktion auf einen niedrigen Blutzuckerspiegel schüttet der Körper gegenregulatorische Hormone aus (v.a. Glukagon, Adrenalin, Kortisol). Dieser Vorgang wird auch als adrenerge Reaktion bezeichnet und löst die autonomen Symptome aus.
Sinken die Blutzuckerwerte über einen gewissen Zeitraum weiter ab, so zeigen sich neuroglykopenische Symptome ( ▶ Tab. 38.13 ). Diese sind Anzeichen für einen akuten Glukosemangel im Gehirn. Wann Symptome bei Betroffenen auftreten, ist individuell unterschiedlich. Aus diesem Grund werden hier keine Schwellenwerte für den Symptomauftritt genannt. Hypoglykämien in der Vorgeschichte verzögern das Auftreten der Symptome zusätzlich (Hypoglykämie-Wahrnehmungsstörung) (Siegmund u. Schumm-Draeger 2014).
Praxistipp
Nächtliche Hypoglykämien werden häufig nicht erkannt. Sie äußern sich mit Nachtschweiß, Alpträumen und einem unruhigen Schlaf. Am Morgen können Kopfschmerzen und Abgeschlagenheit Hinweise sein. Sollten diese Anzeichen bemerkt werden, so muss auch nachts der BZ 2–3-mal kontrolliert und die Therapie ggf. angepasst werden (Hien et al. 2013).
Maßnahmen Bei ersten Anzeichen einer Hypoglykämie muss schnell gehandelt werden. Es gilt der Grundsatz: „Erst essen, dann messen.“
Patienten, die bei Bewusstsein sind, essen 15–20g (z.B. 3–4 Plättchen Traubenzucker) schnell resorbierbare Kohlenhydrate, kombiniert mit 1–2 BE/KE langsam wirkender Kohlenhydrate. Nach 15 Min. wird der BZ gemessen. Sollte dieser unter 80 mg/dl (4,4 mmol/l) liegen, wird die Behandlung wiederholt. Der BZ muss auch bei Erreichen des Grenzwertes weiter engmaschig kontrolliert werden, um einen erneuten Abfall frühzeitig zu erkennen.
Bei Bewusstlosigkeit bringt die Pflegende den Patienten in die stabile Seitenlage und löst den Notruf aus. Entweder bekommt der Patient das Hormon Glukagon s.c./i.m. injiziert oder 40 – 50ml 40 %ige Glukoselösung i.v. infundiert. Der BZ wird nach 15–20 Min. kontrolliert; Ziel ist ein Blutzucker um 200 mg/dl (11,1 mmol/l). Ist der BZ nicht ausreichend angestiegen, wird die Behandlung wiederholt. Im Anschluss wird eine stabilisierende Glukoseinfusion von 2mg/kg/Min. empfohlen (Siegmund u. Schumm-Draeger 2014).
Praxistipp
Ist die Hypoglykämie durch eine Sulfonylharnstoffüberdosierung entstanden, kann es innerhalb von 72 Std. erneut zu BZ-Abfällen kommen. Eine engmaschige Kontrolle des BZ ist in diesem Zeitraum zwingend.
Prophylaxe Hypoglykämie Um eine drohende Hypoglykämie zu vermeiden, müssen die Betroffenen zu individuellen Anzeichen, Ursachen und Auslösern einer Hypoglykämie geschult werden. In speziellen Diabetesschulungen wird das dafür notwendige Wissen vermittelt und Handlungsabläufe eingeübt (BÄK 2014, KBV u. AWMF 2014). Häufige Ursachen für eine Hypoglykämie sind z.B.:
-
Alkohol in Kombination mit Antidiabetika
-
ausgelassene oder verspätete Mahlzeiten
-
Verwechslung der Insuline (Bolus- statt Basal-Insulin gespritzt)
-
zu hohe Insulindosierung
-
erhöhte sportliche Aktivität
-
zu langer Spritz-Ess-Abstand
38.1.6.2 Hyperglykämie
Bei der Hyperglykämie werden 2 hyperglykämische Akutkomplikationen unterschieden:
-
diabetische Ketoazidose (DKA)
-
hyperosmolare hyperglykämische Entgleisung (HHE)
Während die DKA fast ausschließlich bei Typ-1-Diabetikern vorkommt, ist die HHE die Akutkomplikation des Typ-2-Diabetikers. Beide Formen stellen potenziell vital bedrohliche Situationen dar (Sigrist u. Brändle 2015).
Diabetische Ketoazidose (DKA)
Die DKA ist charakteristisch für den Typ-1-Diabetes und Folge eines schweren Insulinmangels. Bei ca. 15% der Betroffenen wird die Diagnose aufgrund der Erstmanifestation gestellt. Im weiteren Krankheitsverlauf tritt sie gehäuft bei fehlender oder mangelhafter Insulinzufuhr auf. Auch akute Stoffwechselbelastungen, z.B. bei Infektionen, können eine DKA auslösen. Die DKA ist aufgrund der Schwere der Stoffwechselentgleisung (Ketoazidose) sehr gefährlich. Etwa 1–5% der betroffenen Patienten versterben an den Folgen der DKA (Sigrist u. Brändle 2015).
Aufgrund des schweren Insulinmangels ist der Organismus gezwungen, durch andere Verfahren Glukose zu bilden (Glukoneogenese), und baut große Mengen von Eiweiß- und Fettreserven um ( ▶ Abb. 38.10).
Ablauf einer Ketoazidose bei Diabetes Typ 1.
Abb. 38.10

Beim Abbau von Fetten entstehen freie Fettsäuren und Ketonkörper, die zu einer metabolischen Azidose (Übersäuerung des Blutes aufgrund von Stoffwechselvorgängen) führen. Da Ketonkörper unabhängig von Insulin verstoffwechselt werden, stellen sie in dieser Situation eine wichtige Energiequelle für den Körper dar. Folgen dieses Vorgangs sind die Symptome, die in ▶ Abb. 38.10 unter Lipolyse dargestellt sind. Außerdem kann eine vertiefte In- und Exspiration beobachtet werden, die ▶ Tab. 16.1 genannt wird.
Der Insulinmangel führt zu einer Hyperglykämie, da Glukose nicht mehr in die Zellen transferiert werden kann. Bei Überschreiten der Nierenschwelle (BZ >180 mg/dl) führt dies zu den in ▶ Abb. 38.10 unter Hyperglykämie aufgeführten Symptomen (Kitabchi et al. 2009).
Die DKA entwickelt sich meist schnell (innerhalb von 24–36 Std.) und kann so weit fortschreiten, dass Betroffene das Bewusstsein verlieren. Man spricht dann von einem ketoazidotischem Koma.
Diagnostik Die Diagnosestellung erfolgt über eine Blutgasanalyse, den Nachweis von Ketonkörpern im Urin, ein Blutbild (Messen der Elektrolyte) und die Bestimmung des Blutzuckers. Bei der DKA ist „nur“ mit einer moderaten Hyperglykämie (>250 mg/dl [14 mmol/l]) zu rechnen (Hien et al. 2013).
Praxistipp
Ketonkörper können einfach über Teststreifen im Urin nachgewiesen werden. Achten Sie auf die genaue Einhaltung des Ablesezeitpunkts. Sonst werden falsch-hohe oder falsch-niedrige Werte abzulesen sein.
Hyperosmolare hyperglykämische Entgleisung (HHE)
Die HHE kommt meist bei Typ-2-Diabetikern vor und entwickelt sich schleichend über mehrere Tage. Oft liegt die Ursache in einem nicht ausreichend therapierten oder einem noch nicht diagnostizierten Diabetes mellitus.
Beim DMT 2 verhindert eine Restproduktion von Insulin den massiven Fettabbau, es entstehen kaum Ketonkörper, eine Azidose tritt nur selten auf. Die Patienten sind meist älter, alleinstehend, nehmen wenig Flüssigkeit auf und sind exsikkiert. Bedingt durch die massive Hyperglykämie (Werte von > 600 mg/dl [33,3 mmol/l]) kommt es zu einem hohen Wasser- und Elektrolytverlust. Komorbiditäten wie Infekte begünstigen das Fortschreiten. Das klinische Bild stellt sich wie folgt dar:
-
Tachykardie
-
Hypotonie
-
Schwindel und Eintrübung bis hin zum Koma (dann hyperosmolares Koma genannt)
Durch den Elektrolytverlust kann es zu fokalen oder generalisierten Krampfanfällen und Herzrhythmusstörungen kommen. In späten Stadien können neurologische Ausfälle (z.B. Paresen) beobachtet werden.
Die HHE entwickelt sich meist schleichend über einige Tage hinweg. Die Mortalität liegt höher als bei der DKA und beträgt im Falle eines Komas 20–30%. Werden Betroffene vorher therapiert, liegt die Mortalität bei 5–15%.
Diagnostik Die Diagnosestellung verläuft wie bei der der DKA. Symptomatisch weisen ein fehlender Azetongeruch in der Ausatemluft und die Abwesenheit von Ketonkörpern im Urin auf eine HHE hin (Hien et al., 2013).
Therapie der Akutkomplikationen
Die Therapie der DKA und der HHE sind weitestgehend identisch. Betroffene müssen immer intensivmedizinisch überwacht werden. Neben der engmaschigen Kontrolle der Vitalzeichen und der stündlichen Bilanzierung von Ein- und Ausfuhr (Wagner 2015) sind die sofortige Flüssigkeitssubstitution und der Ausgleich des Kaliummangels von zentraler Bedeutung für die Genese.
So werden in der ersten Stunde 1–2 Liter NaCl 0,9% verabreicht. Der Gesamtflüssigkeitsbedarf liegt zwischen 5 und 10 Litern. Nach der ersten Stunde wird die weitere Flüssigkeitssubstitution vom stündlich gemessenen ZVD und der kardialen Situation des Betroffenen abhängig gemacht. Da eine Insulingabe den Kaliumspiegel weiter absinken lässt, muss dieser, bevor eine Insulintherapie zur Senkung des BZ eingeleitet wird, ausgeglichen werden.
Akutmaßnahmen
-
Monitoring (Vitalzeichen inkl. EKG, SpO2)
-
Laborkontrollen (Natrium, Kalium, pH-Wert, BZ) alle 30–60 Min.
-
ZVD-Messung stündlich
-
Flüssigkeitssubstitution
-
Elektrolytausgleich
Weitere Maßnahmen Sind die Akutmaßnahmen abgeschlossen, kann anschließend mit der Insulintherapie begonnen werden. Diese wird i.v. mit einem Perfusor durchgeführt.
Komplikationen
-
schneller BZ-Abfall: BZ-Senkung bei Insulintherapie darf nicht über 50 mg/dl (2,8 mmol/l) innerhalb einer Stunde liegen (Gefahr Hirnödem!)
-
Lungenödem: unkontrollierte Flüssigkeitsgabe, Schock, Azidose
-
Herzrhythmusstörungen: bedingt durch Kaliumschwankungen
-
Hirnödem: zu schnelles Absinken der Serumosmolarität, z.B. durch Natriumbikarbonatgabe; sensible Dosierung und engmaschige Überwachung des Blut-pH-Wertes und der Vitalzeichen (Hien et al. 2013).
-
Krämpfe: durch Elektrolytschwankungen oder fortschreitende Exsikkose
Praxistipp
Entwickelt ein Diabetiker plötzlich unklare Bewusstseinsstörungen, verabreichen Sie niemals Insulin ohne eine vorherige BZ-Kontrolle. Insulin kann bei einer Hypoglykämie tödlich sein! Verabreichen Sie bei unklarer Bewusstseinsstörung Glukose; ein kurzfristiger Überzucker ist nicht schlimm. Auch dann nicht, wenn eine Hyperglykämie vorliegen sollte (Wagner 2015).
38.1.7 Diabetische Folgeerkrankungen
Eine chronische Hyperglykämie kann bereits nach wenigen Jahren zur Endothelschädigung der kleinen (Mikroangiopathie) und großen Gefäße (Makroangiopathie) führen. Auch Nerven können betroffen sein.
-
Mikroangiopathien
-
diabetische Retino- und Makulopathie
-
diabetische Nephropathie
-
diabetische Neuropathie
-
diabetisches Fußsyndrom
-
-
Makroangiopathien
-
periphere arterielle Verschlusskrankheit (pAVK)
-
koronare Herzerkrankung und Herzinfarkt
-
Apoplex
-
Um Spätschäden zu vermeiden, ist eine gute Einstellung des HbA1c besonders wichtig. Auch die erhöhte Mortalitätsrate von Diabetikern kann so reduziert werden (Hien et al. 2013).
38.1.7.1 Mikroangiopathien
Die Mikroangiopathie ist die charakteristische Komplikation des Diabetes mellitus. Sie betrifft die Kapillargefäße aller Organe, insbesondere der Augen (80%), der Nieren (30%) und des Nervensystems. Die Entstehungshintergründe sind bislang nicht eindeutig geklärt. Möglicherweise besteht eine genetische Disposition als mitverantwortlicher Faktor.
Bedingt durch die chronische Hyperglykämie kommt es zu einer „Verzuckerung“ (Glykierung) von Proteinen. Die Gefäßwände verdicken und verhärten zunehmend; der Sauerstoffaustausch ist gestört. Dies führt langfristig zum vollständigen Funktionsverlust der betroffenen Gefäße. Mikroangiopathien sind eine direkte Folge der Grunderkrankung (Schatz u. Pfeiffer 2014).
Diabetische Retinopathie und Makulopathie
Die diabetische Retinopathie ist die häufigste Ursache für Erblindung im Erwachsenenalter.
Etwa 40% der Typ-1-Diabetiker erwerben im Verlauf der Erkrankung eine Retinopathie, 35% der Typ-2-Diabetiker zeigen bereits erste Anzeichen bei Diagnosestellung. Ungünstig ist, dass sich klinische Symptome erst im fortgeschrittenen Stadium zeigen.
Das Auftreten der diabetischen Retinopathie hängt von der Diabetesdauer, der Hyperglykämie und der genetischen Prädisposition ab. Durch die Hyperglykämie kommt es zu Schäden an den die Endothelzellen der Netzhaut versorgenden Gefäßen. Die Gefäße degenerieren, wodurch die feinen Kapillaren nicht mehr ausreichend durchblutet werden (Hien et al. 2013). Dieses Stadium wird als nichtproliferative Retinopathie (Blutung und Bildung von Mirkoaneurysmen) bezeichnet. Die sich anschließende Phase ist die sog. proliferative Retinopathie mit Neubildung von Blutgefäßen, Ablösung der Netzhaut, Einblutung in den Glaskörper.
Bei der diabetischen Makulopathie kommt es durch die gesteigerte Gefäßpermeabilität zu Ödemen im Bereich des schärfsten Sehens. Sollte es dort zu Ischämien kommen, ist die Visusprognose sehr schlecht (Schatz u. Pfeiffer 2014).
Diagnostik Die Diagnose wird durch eine Fluoreszenzangiografie gesichert. Zudem werden die Sehschärfe und der Augeninnendruck gemessen. Der wird Augenhintergrund mittels einer Funduskopie untersucht (Hien et al. 2013).
Therapie Die Behandlungsziele sind eine
-
normnahe BZ-Einstellung,
-
Blutdrucknormalisierung,
-
ophthalmologische Therapie (Ophthalmologie = Augenheilkunde).
Diese beinhaltet die Koagulation von Gefäßen mittels Lasertherapie, das Einbringen von Medikamenten in den Glaskörper oder dessen chirurgische Entfernung.
Augenärztliche Untersuchungen sollen jährlich durchgeführt werden. Bei bestehender Retinopathie verkürzt sich das Intervall auf 3–6 Monate oder nach Vorgaben des Arztes (Hammes et al. 2015).
Praxistipp
Für Augenuntersuchungen werden die Pupillen mit Augentropfen erweitert. Die daraus resultierende Sehbeeinträchtigung hält auch noch nach der Untersuchung an. Beachten Sie dies bei der Versorgung des Patienten.
Diabetische Nephropathie
Pathologisch liegt bei der diabetischen Nephropathie eine Verdickung der glomerulären Kapillarmembranen vor. Diese wird durch eine Hyperglykämie mit Glykierung von Eiweißen ausgelöst (Glomerulosklerose vom Typ Kimmelstiel-Wilson). Die Entstehung der Glomerulosklereose ist von vielen Faktoren abhängig:
-
genetische Prädisposition,
-
Alter,
-
Diabetesdauer,
-
Stoffwechselgüte.
Weitere Einflussfaktoren, die das Fortschreiten der Nephropathie fördern, sind Rauchen, Anämie und erhöhte Eiweißzufuhr. Kommen Entzündungen hinzu, wird die Durchlässigkeit der Basalmembran erhöht. Direkte Folge ist eine Schädigung der Filterfunktion mit Albuminurie.
Diagnostik Diagnostisch wird ein Albuminscreening im Urin durchgeführt. Dies ist der Goldstandard in der Frühdiagnostik.
Praxistipp
Der Albuminwert wird i.d.R. mittels eines ▶ 24-Stunden-Sammelurins nachgewiesen. Um verwertbare Werte zu erhalten, ist es wichtig, dass die Sammelperiode eingehalten wird.
Weitere Untersuchungen sind:
-
Ultraschall der Nieren
-
24-Stunden-Blutdruckmessung
-
Labor (Blutbild, Lipide)
-
Messung der glomerulären Filtrationsrate (Menge des Primarharns)
-
Bestimmung der Kreatinin-Clearance (Beurteilung der Nierenfunktion)
Therapie Die kardiovaskuläre Mortalität von Patienten mit Nephropathie ist stark erhöht, da Risikofaktoren wie z.B. Arteriosklerose oder Dyslipidämie begünstigt werden.
Um eine diabetische Nephropathie zu verhindern oder zu verlangsamen, sind die negativen Einflussfaktoren zu reduzieren. Angestrebt wird eine normnahe Einstellung der folgenden Faktoren:
-
Eiweißaufnahme auf 0,8 mg/kgKG/Tag begrenzen
-
normnahe Blutzuckereinstellung
-
Zielblutdruck (systolisch bis 140 mmHg, diastolisch bei ca. 80 mmHg)
Die Blutdrucksenkung erfolgt u.a. mittels eines medikamentösen Kombinationspräparates (Rüster et al. 2015). Sprechen Sie mit dem Patienten über die Notwendigkeit der regelmäßigen Einnahme der Antihypertensiva. Zudem sollte der Patient über Möglichkeiten der nichtmedikamentösen Blutdrucksenkung (lifestyle modification) informiert werden ▶ Tab. 38.14 .
|
Modifikation |
Ziel |
Zu erwartende RR-Senkung |
|
Gewichtsreduktion |
Normalgewicht (BMI 18,5–24,9 kg/m2) |
5–20 mmHg/10 kg |
|
Ernährung |
Obst, Gemüse, Reduktion tierischer Fette |
8–14 mmHg |
|
Kochsalzreduktion |
weniger als 6g Kochsalz pro Tag |
2–8 mmHg |
|
Körperliche Aktivität |
aerobe Belastung, z.B. täglich 30–40 Min. strammes Gehen |
4–9 mmHg |
|
Alkoholreduktion |
max. ein Glas Wein/Bier pro Tag |
2–4 mmHg |
Diabetische Neuropathie
Unter dem Begriff „diabetische Polyneuropathien“ werden alle diabetischen Nervenstörungen zusammengefasst. Eine langjährige Hyperglykämie begünstigt das Entwickeln einer sekundären Polyneuropathie mit Schädigungen der motorischen, sensiblen und autonomen Nerven des peripheren Nervensystems: Jeder Nerv kann betroffen sein.
Die Therapie der Polyneuropathien besteht in einer normnahen Blutzuckereinstellung sowie einer individuellen Schmerztherapie. Ziel ist die Erhaltung und Verbesserung der Lebensqualität und die Verhinderung weiterer Folgeerkrankungen (z.B. diabetisches Fußsyndrom). Auf den Konsum neurotoxisch wirkender Substanzen wie Alkohol oder Nikotin sollte verzichtet werden (Ziegler et al. 2015). Im Folgenden wird auf die häufigsten Nervenstörungen eingegangen:
-
autonome Neuropathie
-
sensomotorische Neuropathie
Autonome Neuropathie
Das autonome Nervensystem (Synonym: Vegetatives Nervensystem) wird in das sympathische, parasympathische sowie das enterische Nervensystem unterteilt. Es steuert viele Organfunktionen, wie z.B.:
-
Herzfrequenz und Blutdruck
-
Darmperistaltik und Ausscheidung
-
Weite der Bronchien
-
Erektion von Penis und Klitoris
Die autonome Neuropathie beeinträchtigt die Funktionen verschiedener Organsysteme (Schwegler u. Lucius 2016). Zunächst verläuft sie meist asymptomatisch, kann jedoch schnell zu vital bedrohlichen Dysregulationen führen. Bei etwa 20% der Diabetiker lassen sich entsprechende Einschränkungen der Organfunktion finden (Schatz u. Pfeiffer 2014).
Kardio-vaskuläres System Durch eine Schädigung des N. vagus kommt es zu einer Verminderung der Herzfrequenzvariabilität (HRV). Das heißt, dass sich die Herzfrequenz nicht mehr oder nur unzureichend an unterschiedliche Belastungssituationen (z.B. körperliche Aktivität) anpassen kann. Im späteren Verlauf kann sich eine Ruhetachykardie zeigen. Aufgrund der Schädigung des sympathischen Systems kommt es zu orthostatischen Hypotonien. Das Mortalitätsrisiko ist deutlich erhöht (Ziegler et al. 2015).
Magen-Darm-Trakt (Gastrointestinaltrakt) Bei einer autonomen Neuropathie des Magen-Darm-Traktes können alle Abschnitte betroffen sein. Magenentleerungsstörungen, die zu einer unregelmäßigen Kohlenhydrataufnahme führen, machen eine BZ-Einstellung schwer. Im Bereich des Ösophagus kann es zu atonischen Veränderungen mit Dysphagie (Störung des Schluckvorgangs) kommen. Im Dünndarmbereich können abdominale Beschwerden, Meteorismus und Diarrhö auftreten. Ist das Kolon betroffen, können Obstipation und/oder Diarrhöen vorkommen.
Diese Symptome können zu einer gravierenden Einschränkung der Lebensqualität führen. Die Diagnose ist nicht einfach zu stellen, da andere Erkrankungen (z.B. Malignome, Zöliakie, peptisches Ulkus) differenzialdiagnostisch ausgeschlossen werden müssen (Ziegler et al. 2015).
Urogenitaltrakt Durch die verminderte Blasensensibilität verlängert sich das Intervall der Miktionen zunehmend. Meist werden dann große Urinportionen entleert. Oft kommt es zur Restharnbildung. Die Folge sind häufig Harnwegsinfekte.
Pflegerisch ist mit dem Betroffenen ein Blasentraining durchzuführen, das konsequent umgesetzt werden muss. In schweren Fällen kann eine Einmalkatheterisierung oder die Anlage eines Dauerkatheters notwendig sein. Bei Männern kann es zu retrograden Ejakulationen (Ejakulation in die Blase) und ▶ erektiler Dysfunktion kommen. Dies ist ein ernstzunehmendes Problem, das viel Empathie und Fachwissen in der Behandlung erfordert. Es gibt verschiedene Therapiemöglichkeiten, die hier in ihrer Ausführlichkeit nicht angesprochen werden können (Schatz u. Pfeiffer 2014).
Sensomotorische Neuropathie
Die sensomotorische periphere Neuropathie ist zu 85 – 90 % am Entstehen des Diabetischen Fußsyndroms (DFS) beteiligt (Ziegler et al. 2015).
Sensible Störungen Sie zeigen sich mit Taubheit der sensiblen Nervenleitung oder in Schmerzempfindungen. Ein Frühwarnzeichen ist ein gestörtes Vibrationsempfinden. Bei fortschreitender Neuropathie zeigen sich weitere klinische Symptome. Vor allem Kribbelparästhesien, Taubheit und ein nachts auftretender, stechender Schmerz in den Füßen sind charakteristisch. Dieser wird typischerweise als brennend, manchmal elektrisierend beschrieben und wirkt sich stark negativ auf die Lebensqualität der Betroffenen aus. Teilweise kommt es zu einer Allodynie (üblicherweise nicht schmerzhafte Reize werden schmerzhaft wahrgenommen).
Kontrolluntersuchungen sollten ohne Verdacht einmal jährlich durchgeführt werden. Besteht ein Verdacht oder eine gesicherte Diagnose, verkürzt sich das Intervall auf mindestens alle 6 Monate (Schatz u. Pfeiffer 2014).
Motorische Störungen Ursache ist eine muskuläre Schwäche (Atrophie) der kleinen Fußmuskeln mit Veränderung des Gangbildes und Gangunsicherheit. Durch die gestörte Tiefensensibilität kann es zu einer mangelhaften Koordination der Bewegungsabläufe kommen. Betroffene beschreiben dies mit „wie auf Watte gehen“ (Schätz u. Pfeiffer 2014).
Diabetisches Fußsyndrom
Ein diabetisches Fußsyndrom (DFS) kann sowohl bei DMT1 als auch bei DMT2 entstehen. Viele Diabetiker bemerken aufgrund der Polyneuropathie sowie mikro- und makroangiopathischen Veränderungen Druckstellen oder Verletzungen am Fuß erst spät. Dies begünstigt die Entstehung eines DFS. Bei der Entwicklung eines DFS wirken mehrere Faktoren zusammen:
-
periphere Durchblutungsstörungen aufgrund der Makroangiopathie (pAVK)
-
Gefühlsstörungen/Empfindungslosigkeit gegenüber Druck und Verletzungen aufgrund der sensiblen Neuropathie
-
trophische Hautstörungen aufgrund der autonomen Neuropathie (→ Hyperkeratose)
-
Veränderungen des Bindegewebes und der Muskulatur aufgrund der motorischen Neuropathie (führen zur Veränderung der Fußstatik)
-
Trauma, Verletzungen
-
Sehstörungen (erste Läsionen werden z.B. nicht richtig gesehen oder durch Seheinschränkung bei der Pflege selbst herbei geführt)
-
Einschränkungen in der Beweglichkeit (der Fuß kann zur Fußpflege nicht erreicht werden)
-
sozioökonomische Faktoren
Differenzierung diabetischer Fuß Die beiden Hauptformen des diabetischen Fußes sind der „ischämische Fuß“ (bei Makroangiopathie) und der „neuropathische Fuß“ (auch Charcot-Fuß). ▶ Tab. 38.15 zeigt die Merkmale und Hauptformen des DFS auf – oft bestehen auch Mischformen.
|
Ischämischer Fuß (Häufigkeit: Reinform 25%, Mischform 15%) |
Neuropathischer Fuß (Häufigkeit: 60% der diabetischen Füße) |
|
|
|
|
|
|
|
|
Prävention
Im Jahr 2012 wurde in Deutschland bei ca. 40.000 Diabetikern eine Amputation der unteren Extremitäten vorgenommen. Laut Expertenaussagen wären davon rund 80% vermeidbar gewesen. Folglich kommt der Prävention gegen das DFS eine besondere Bedeutung zu (DDG 2012).
Das Pflegepersonal erfüllt in diesem Rahmen verschiedene Aufgaben:
-
Entstehungsmechanismen des DFS kennen
-
Ulkusrisiko identifizieren (Risikofaktoren erfassen)
-
Patienten und Angehörige in der täglichen Fußpflege anleiten und beraten
-
Patienten nach Abheilung eines Ulkus über weitere Präventionsmaßnahmen informieren
Die Pflegeanamnese für Patienten mit Diabetes mellitus sollte mit einem speziellen Fokus auf das DFS erhoben werden, um Risiken einzuschätzen und erste Anzeichen zu erkennen. Dabei steht die Beurteilung des Schuhwerks und der ▶ Zustand der Füße im Vordergrund. Es empfiehlt sich die Nutzung eines speziellen Fußdokumentationsbogens, wie er z.B. von der DDG zum Download bereitgestellt wird (http://www.ag-fuss-ddg.de).
Therapie
Bestehen Auffälligkeiten der Fußstellung oder der Haut, wird vor Therapiebeginn zuerst die Durchblutungssituation überprüft; ggf. muss vor Therapiestart zuerst eine Verbesserung der arteriellen Versorgung herbeiführt werden. Liegt bereits ein Ulkus vor, wird eine langwierige, konservative Therapie nach folgenden Grundsätzen eingeleitet:
-
Druckentlastung: Fuß/Extremität ruhigstellen (es darf nicht mehr auf das Ulkus getreten werden)
-
Revaskularisation: u.a. Blutzucker optimal einstellen (auf Insulin umstellen)
-
Infektionsbehandlung: Infektion nach Antibiogramm behandeln (MRSA – Kontamination beachten)
-
Lokale Wundbehandlung: Nekrosen abtragen, Granulation fördern
Die Therapie erfolgt durch das multidisziplinäre Team (Ärzte, Pflegepersonal, Podologe, Diabetesberater, Hausärzte usw.). Eine empathische Haltung des Personals gegenüber dem Patienten ist sehr wichtig, da die Einschränkungen durch die Erkrankung und die Angst vor einer drohenden Amputation sehr belastend sein können.
Fuß- und Hautpflege
Die autonome Neuropathie macht die Haut trocken, spröde und rissig. Durch die herabgesetzte Schweißproduktion entsteht ein erhöhter transepidermaler Wasserverlust. Deshalb kommt der Fuß- und Hautpflege bei Diabetes mellitus eine besondere Bedeutung zu.
Kann der Patient seine Fußpflege selbst nicht mehr oder nur unzureichend durchführen, sollte immer eine geschulte Fachperson (Podologe) hinzugezogen werden. Pflegende sollten die in ▶ Tab. 38.16 aufgeführten Pflegemaßnahmen in die tägliche Körperpflege des Patienten einbeziehen.
|
Aufgabe |
Durchführung |
Hinweis |
|
Füße beobachten |
Die Füße einmal täglich und zusätzlich nach längeren Spaziergängen auf Rötung, Druckstellen, Schwellungen, Verletzungen kontrollieren. |
Ggf. Handspiegel zu Hilfe anbieten. |
|
Füße waschen |
Die Füße täglich mit lauwarmem Wasser und rückfettenden Substanzen waschen. |
|
|
Füße abtrocknen |
Die Füße mit einem weichen Handtuch gut abtrocknen. |
Für die Zehenzwischenräume können Wattestäbchen genutzt werden (einer Mykosis vorbeugen). |
|
Füße eincremen |
Füße zweimal täglich mit feuchtigkeitsspendenden, harnstoffhaltigen Cremes/Schäumen eincremen. |
Die Zehenzwischenräume aussparen, um ein feuchtes Milieu zu vermeiden. |
|
Nagelpflege durchführen |
Die Nägel mit der Feile kürzen. Ecken leicht abrunden, um Druck auf benachbarte Zehen zu vermeiden. |
|
|
Füße ankleiden |
Keine einschnürenden Socken oder Kompressionsbinden tragen, da sie den venösen Rückfluss behindern und eine Ödembildung fördern. |
Socken ggf. auf links drehen, um Druckstellen durch Nähte zu vermeiden. |
|
Schuhwerk auswählen |
|
|
|
Füße wärmen |
Patienten mit gestörtem Temperaturempfinden klagen oft über kalte Füße. Fußmassagen, weiche Socken aus Baumwolle oder ein Fußsack bewirken ein gefahrloses „Erwärmen“ der objektiv nicht kalten Füße. |
Heizkissen und Wärmflaschen dürfen wegen der Verbrennungsgefahr auf keinen Fall genutzt werden. |
|
Verletzungen versorgen |
Verletzungen stets mit großer Sorgfalt nach angemessenem Wundstandard versorgen. |
Immer einen Arzt, Podologen oder Wundmanager hinzuzuziehen. |
|
Mit Bettlägerigkeit umgehen |
Bei bettlägerigen Patienten auf eine gute Dekubitusprophylaxe besonders im Bereich der Ferse und Knöchel achten. |
Da der Patient aufgrund der Neuropathie ggf. keine Schmerzen äußert, Hautbeobachtung intensivieren. |
Gefahren für den Fuß bei Menschen mit Diabetes mellitus.
Abb. 38.11
Rezidivprophylaxe
Merke
Rezidivprophylaxe bedeutet:
-
Befähigung zum Selbstmanagement (Patient, Angehörige)
-
Anleitung zur täglichen Kontrolle der Füße mit intensiver Fuß- und Hautpflege
-
Mithilfe/Unterstützung durch Pflegepersonal, Podologen und Diabetesberater
-
normnahe Blutzuckereinstellung
Fußkontrolle Besonders ältere Menschen erfahren in ihrem täglichen Leben oft Einschränkungen, die ihre Selbstpflege erschweren. So ist die Selbstkontrolle der Füße durch die Betroffenen oft aufgrund eines eingeschränkten Sehvermögens, eines Knie- und Hüftleidens oder aufgrund von Übergewicht nur schwer umsetzbar. Hier müssen Pflegende (Angehörige/Betreuende) die Inspektion für den Patienten übernehmen. Da der Patient seine Füße nicht fühlt, braucht er zur täglichen Kontrolle Hilfe und Unterstützung von außen. Ständige Ermahnungen, Appelle und Informationsbroschüren bewirken in der Regel wenig.
Fußübungen Zur Erhaltung der Mobilität und zur Durchblutungsförderung erlernen der Patient und ggf. auch seine Angehörigen einfache gymnastische Fußübungen, die auch im Sitzen durchgeführt werden können.
38.1.7.2 Makroangiopathien
Makroangiopathien sind arteriosklerotische Veränderungen der großen Blutgefäße. Die Pathogenese ist eng mit dem ▶ metabolischen Syndrom verbunden. Faktoren, die die Makroangiopathie fördern, sind Hyperglykämie, viszerale Adipositas, Dyslipidämie und Hypertonie. Sie begünstigen auch die Ausbildung von Plaques. Je nach Ausprägung der Plaques kann es zur Stenosierung eines Gefäßes oder gar zum Komplettverschluss (Infarkt) kommen.
Typische Folgeerkrankungen sind:
-
periphere arterielle Verschlusskrankheit (pAVK),
-
koronare Herzerkrankung (KHK) und Herzinfarkt (häufigste Todesursache bei Diabetikern),
-
Apoplex.
Praxistipp
Liegt eine Nervenschädigung bei einem Diabetiker vor, kann ein Myokardinfarkt stumm verlaufen. Das heißt, dass der Patient keine Schmerzen äußert (stiller Herzinfarkt). Einziges Anzeichen für einen Herzinfarkt ist dann die Dyspnoe. Denken Sie deshalb bei Diabetikern mit unklarer Dyspnoe immer an ein akutes Koronarsyndrom!
Therapie Die Therapie basiert auf nicht-invasiven Maßnahmen, wie
-
der Beseitigung von Risikofaktoren (z.B. Nikotinabusus) sowie
-
der Einstellung von Blutzucker, Blutfetten und Blutdruck.
Weiterführend stehen auch invasive Maßnahmen zur Verfügung. Zu diesen zählen
-
die Thrombektomie sowie
-
Bypass- oder Dilatationsverfahren (Hien et al. 2013).
Unzulänglich therapiert, birgt die Makroangiopathie für die Betroffenen ein hohes Mortalitäts-Risiko. Fast 75% der Diabetiker versterben an Erkrankungen des kardiovaskulären Systems.
38.2 Pflege von Patienten mit Krankheiten der Schilddrüse
Anatomie und Physiologie im Fokus
(nach Silverthorn 2009)
Die Schilddrüse im Überblick
Die schmetterlingsförmige Schilddrüse (Glandula thyroidea) besteht aus 2 miteinander verbundenen Lappen und liegt beidseits der Trachea, unterhalb des Kehlkopfes. Das kleine, nur 15–20 g schwere Organ ist von Bindegewebe umgeben und durchzogen. In diesem Bindegewebe liegen einzelne Läppchen, in denen sich zahlreiche und unterschiedlich große flüssigkeitsgefüllte Follikel finden, die von Drüsenepithelzellen umgeben sind. Mithilfe des aus dem Blut aufgenommenen Jods speichern diese die gebildeten Hormone in größeren Mengen ( ▶ Abb. 38.12).
Schnitt durch die Schilddrüse.
Abb. 38.12 Links: Prall gefüllte Follikel der Schilddrüse, die Epithelzellen rund um den Follikel herum produzieren die Schilddrüsenhormone und vergrößern deren Inhalt. Rechts: Nach Ausschüttung des Hormons schrumpfen die Follikel dann erheblich zusammen.
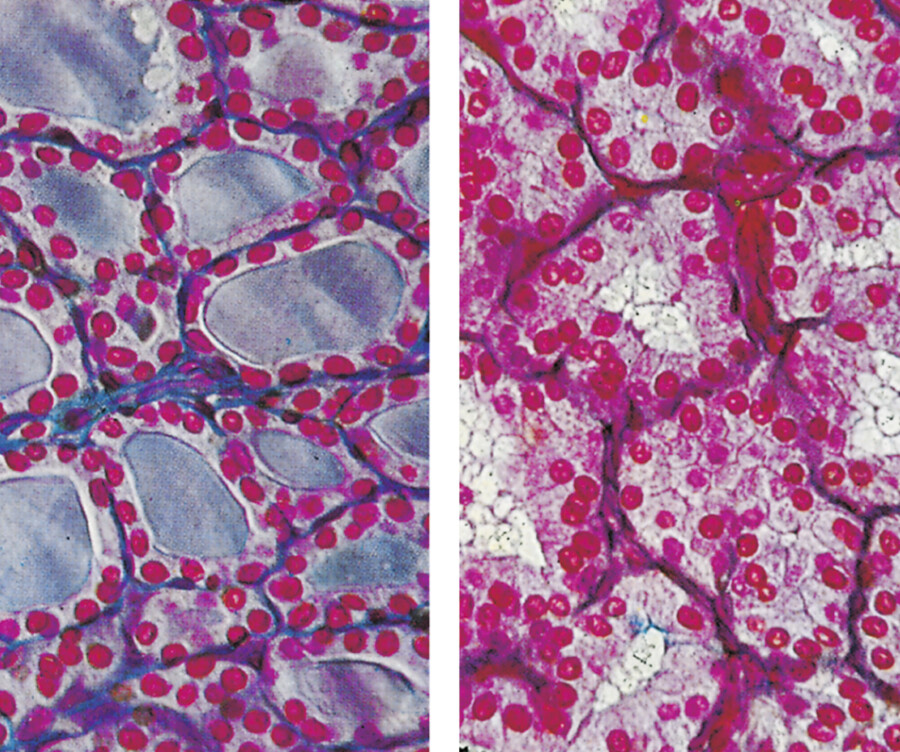
Schilddrüsenhormone T4 und T3
Die übergeordnete Steuerungseinheit ist der Hypophysenvorderlappen (Adenohypophyse). Sie produziert das Thyroidea-stimulierende Hormon (TSH), das die bedarfsgerechte Produktion und Abgabe von Schilddrüsenhormonen anregt. Sinkt z.B. der Thyroxinspiegel (Thyroxin = Schilddrüsenhormon) im Blut ab, führt dies im Hypothalamus zu der Reaktion, das Thyreotropin-Releasing-Hormon (TRH) auszuschütten. Das TRH stimuliert die Adenohypohyse, TSH zu bilden. TSH regt nun wiederum die Schilddrüse an, ihre Hormone abzugeben ( ▶ Abb. 38.13).
Schilddrüsenfunktion.
Abb. 38.13 Die TSH-Sekretion der Hypophyse steuert die Produktion und Sekretion der Schilddrüsenhormone.

Die in der Schilddrüse gebildeten Hormone Thyroxin (T4) und Triiodthyronin (T3) bewirken:
-
Reifung und Entwicklung des Nervensystems (v.a. im ersten Lebensjahr)
-
Knochenwachstum und körperliche Entwicklung im heranwachsenden Organismus
-
Einfluss auf Stoffwechselprozesse; Steigerung des Energieumsatzes mit Erhöhung der Temperatur, des O2-Verbrauchs und der Herzfrequenz
-
Stimulation des Kohlenhydratstoffwechsels und des Fettabbaus
-
Eiweißaufbau (anabole Wirkung)
-
Beeinflussung der Funktion des Fortpflanzungssystems (wichtig für normalen Schwangerschaftsverlauf)
Calcitonin
Ein weiteres Hormon der Schilddrüse ist das Calcitonin. Es baut Kalzium und Phosphat in den Knochen ein und senkt den Kalizium- und Phosphatspiegel im Blut. Die Ausscheidung von Phosphat-Kalziumionen aus dem Blut wird erhöht und die Aufnahme aus dem Darm gehemmt. Die Nebenschilddrüsen (Epithelkörperchen), vier kleine Knötchen an der Rückseite der Schilddrüse, produzieren mit dem Parathormon ein weiteres Hormon, das als Gegenspieler des Calcitonins wirkt. Es stimuliert die Freisetzung des Kalziums im Körper aus dem Knochen, erhöht die Aufnahme von Kalzium im Darm und reduziert die Kalziumausscheidung über die Niere bei gleichzeitig erhöhter Phosphatausscheidung.
Für die postoperative Pflege nach Strumektomie ist das Wissen um dieses weitere Hormon sehr wichtig, weil ein operatives Mitentfernen aufgrund von Kalziummangel beim Patienten zu starken Muskelkrämpfen (Hypokalzämische Tetanie) führen kann.
38.2.1 Medizinischer Überblick
Viele Schilddrüsenerkrankungen zeigen sich durch eine Vergrößerung der Schilddrüse (Struma). Bei ca. 40% der Kinder und Jugendlichen in Deutschland kann eine unzureichende Jodaufnahme festgestellt werden (Jod-Monitoring im Rahmen von KiGGS, 2002–2007). Frauen sind von einem Jodmangel 4-mal häufiger betroffen als Männer. Die Struma ist ein zentrales Symptom, das die Organgröße beschreibt, jedoch keine Anhaltspunkte für Funktion oder Histologie der Schilddrüse gibt. Diagnostisch müssen eine Schilddrüsenüber-/unterfunktion, seltener vorkommende Entzündungen der Schilddrüse (Thyreoiditis) sowie die Nebenwirkungen bestimmter Medikamente, z. B. Lithium (Therapie von manisch-depressiven Menschen), als Ursachen einer Struma abgeklärt werden.
Die häufigste Ursache für das Entstehen einer Struma ist der ernährungsbedingte Jodmangel. Deutschland gilt als Jodmangelgebiet, nur in den Küstenregionen enthält das Trinkwasser genügend Jod, während es in den Gebirgsregionen in Süddeutschland zu wenig vorhanden ist. Das familiäre Auftreten ist nicht genetisch bedingt, sondern erklärt sich aus der gemeinsamen Ursache – dem regionalen Jodmangel. Häufig liegen einer Struma eine Schilddrüsenüber- bzw. -unterfunktion zugrunde.
Die Krankheitsbilder der Schilddrüse mit und ohne Struma sind vielfältig ( ▶ Tab. 38.17 ).
|
Bezeichnung |
Formen |
Therapie |
|
Überfunktion |
||
|
Hyperthyreose |
|
|
|
Unterfunktion |
||
|
Hypothyreose |
|
Hormongabe (Euthyrox, L-Thyroxin) |
|
vergrößerte Drüse ohne Funktionsstörung |
||
|
Euthyreose |
Euthyreote/blande Struma |
OP, wenn es zu mechanischen Druckschäden kommt |
|
Krebserkrankung |
||
|
Karzinom |
maligne Struma |
Operation |
38.2.1.1 Hyperthyreose
Definition
Bei der Hyperthyreose (sog. Schilddrüsenüberfunktion) produziert die Schilddrüse zu viele Schilddrüsenhormone. Durch die zu hohe Thyroxinkonzentration im Blut kommt es zu Veränderungen im Stoffwechsel, am Nervensystem und am Herzen (Arastéh et al. 2012).
Ursachen
Als häufige Ursachen der Hyperthyreose gelten eine funktionelle Schilddrüsenautonomie und Autoimmunerkrankungen (z. B. Morbus Basedow). Seltene Ursachen sind eine Thyreoiditis, ein hormonaktives Schilddrüsenkarzinom, ein Jodexzess oder eine exogene Hormonüberdosierung (Arastéh et al. 2012).
Merke
Die Schilddrüsenüberfunktion (Hyperthyreose) ist kein einheitliches Krankheitsbild. Verschiedene Ursachen führen zu einer exzessiven Produktion und Ausschüttung von Schilddrüsenhormonen.
Funktionelle Schilddrüsen-Autonomie (nichtimmunogene Form) Ein Teil der Schilddrüse hat sich vom Regelkreislauf „verselbstständigt“ und produziert autonom Schilddrüsenhormone. Die Zunahme dieser autonomen Zellen führt dann zur Schilddrüsenüberfunktion. Als Hauptursache der sich meist im höheren Lebensalter manifestierenden Erkrankung gilt ein Jodmangel (Arastéh et al. 2012).
Immunhyperthyreose oder Morbus Basedow Bei Morbus Basedow handelt es sich um eine Autoimmunkrankheit, die eine Überfunktion der Schilddrüse zur Folge hat. Der Körper bildet Antikörper gegen das eigene Schilddrüsengewebe und diese binden sich an den Rezeptor für TSH. Diese TSH-Rezeptor-Antikörper stimulieren nun permanent die hormonbildenden Zellen der Schilddrüse, wodurch es zu einer Überproduktion der Hormone T3 und T4 kommt. Es wird eine genetische, familiäre Prädisposition angenommen. Frauen erkranken wesentlich häufiger als Männer (Arastéh et al. 2012).
Merke
Der klassische Morbus Basedow ist gekennzeichnet durch die Merseburger-Trias: Exophthalmus, Struma und Tachykardie.
Die häufigsten Ursachen für eine Hyperthyreose und ihre Auswirkungen sind in ▶ Tab. 38.18 zusammengefasst. Allen Überfunktionen ist die krankhaft gesteigerte Hormonproduktion gemeinsam.
|
immunogen (z. B. M. Basedow) |
nicht immunogen (z. B. autonomes Adenom) |
entzündlich (z. B. Hashimoto-Thyreoiditis) |
|
Verlauf der Erkrankung |
||
|
akut |
länger, schleichend |
akut oder langsam |
|
Alter |
||
|
jünger |
älter |
jünger |
|
Labor: Autoantikörper |
||
|
ja (TSH-R-AK) |
nein |
Antikörper Hashimoto-Thyreoiditis |
|
Labor: Hormone TSH, T 3, T 4 |
||
|
TSH↓, fT3↑, fT4↑ |
TSH↓, fT3↑, fT4↑ |
|
|
Orbitopathie (Augenbefund) |
||
|
ja |
nein |
nein |
|
Struma |
||
|
diffus |
knotig |
diffus |
|
Jodmangel |
||
|
selten |
meistens |
oft mit Diabetes mellitus Typ 1 |
Symptome
Die Symptome der Hyperthyreose resultieren aus der Wirkung der im Überschuss vorhandenen Schilddrüsenhormone. Die Patienten berichten über Haarausfall, Menstruationsstörungen und ungewollten Gewichtsverlust (durch erhöhten Grundumsatz in Zellen). Auf Nachfragen wird oft über häufige Stuhlgänge bis zur Diarrhö berichtet. Allgemein berichten die Patienten von Unruhe, Nervosität, Schlaflosigkeit und vermehrtem Schwitzen auch bei normaler Umgebungstemperatur. Eine Wärmeintoleranz kann sich einstellen. Zum Teil bestehen Augenbeschwerden wie Tränen, Lidschwellung, Fremdkörpergefühl; die Augäpfel können hervortreten (Exophthalmus) und die Pupillen sind geweitet. Die Patienten haben eine beschleunigte Herztätigkeit (Tachykardie, Rhythmusstörungen) und einen feinschlägigen Tremor (Arastéh et al. 2012).
Bei ca. 50% der Patienten mit Morbus Basedow kommt es zu einer endokrinen Orbitopathie. Durch Autoantikörper kommt es zum Hervortreten der Augen (Exophthalmus) und zur periorbitalen (die Augenhöhle umgebenden) Ödembildung, durch die Schwellung des retroorbitalen (hinter der Augenhöhle liegenden) Gewebes zur Entwicklung von Doppelbildern oder Sehnervenschädigungen. Der Schweregrad kann variieren, wobei kein Zusammenhang zwischen der Ausprägung der Schilddrüsenüberfunktion und der Schwere der endokrinen Orbitopathie besteht. Nikotin beschleunigt oder verschlimmert die Symptomatik (Arastéh et al. 2012).
Fallbeispiel
Frau Förster ist 52 Jahre alt, ledig und hat im Oktober ein neues Engagement als Sängerin am Theater einer bayerischen Kleinstadt angetreten. Seit dem darauffolgenden Weihnachtsfest leidet sie unter Stimmungsschwankungen. Vor Auftritten ist sie extrem nervös, manchmal schnürt ihr das Lampenfieber fast die Kehle zu. Durch Atem- und Stimmübungen bekommt sie das Problem meist in den Griff. Zudem hat sie immer wieder Schweißausbrüche und wacht nachts mit starkem Herzklopfen auf.
Sie liest regelmäßig die Apothekerzeitschrift. In einem darin vor kurzem veröffentlichten Artikel zum Klimakterium meint sie ihre Befindlichkeitsstörungen zu erkennen und denkt sich: „Das ist was ganz Normales, da muss ich halt durch.“ Sie ist daher über ihren Zustand nicht weiter besorgt und eine leichte Gewichtsabnahme seit dem Umzug und dem Beginn des neuen Engagements erklärt sie sich mit dem Stress des Umzugs und der neuen beruflichen Anforderung.
Eines Tages, bei einer Theaterprobe, erschrickt Frau Förster sehr. Sie merkt, dass sie keine langen gleichmäßigen Töne mehr halten kann, die durch Entspannungstechniken auch nicht beherrschbar sind. Sie bricht die Probe ab und geht zum Arzt.
Der Arzt stellt eine Hyperthyreose aufgrund eines autonomen Adenoms und eine leichte Struma fest. Frau Förster muss operiert werden und wird präoperativ auf ein Thyreostatikum (Carbimazol) eingestellt. Zwei Wochen nach Diagnosestellung wird Frau Förster in die Klinik zur Schilddrüsenoperation (Teilresektion) aufgenommen.
Komplikation: thyreotoxische Krise Eine thyreotoxische Krise stellt eine lebensbedrohliche Komplikation dar und muss wegen der hohen Letalität (30–50%) intensivmedizinisch und -pflegerisch versorgt werden. Die Lebensfunktionen müssen sofort stabilisiert werden: Therapie der Tachyarrhythmie, Senkung der Körpertemperatur, Substitution von Flüssigkeit und Elektrolyten, intravenöse Gabe von Thyreostatika und Antibiotika usw.
Anzeichen einer thyreotoxischen Krise sind (Arastéh et al. 2012):
-
Dehydratation, Durchfälle und Erbrechen
-
Schweißausbrüche
-
Tachykardie (140–160/Min.), Herzrhythmusstörungen
-
hohes Fieber (bis 41 °C)
-
verstärkter Tremor, Unruhe, Agitiertheit, Hyperkinesie
-
Adynamie (ausgeprägte Kraft- und Antriebslosigkeit)
-
Bewusstseinsstörungen bis hin zum Koma, Desorientierung
Diagnostik
Die Diagnose wird durch Anamnese (z.B. Gabe jodhaltiger Kontrastmittel) und Palpation der Schilddrüse (typische Symptome?) sowie Labordiagnostik (hohe T4- und T3-Werte, TSH erniedrigt) und Sonografie gestellt. Die Sonografie der Schilddrüse zeigt eine Echoarmut, im Farbduplex ist eine Hypervaskularisierung nachweisbar ( ▶ Abb. 38.14). Aufgrund der Tachykardie und oft systolischer Hypertonie erfolgt eine kardiologische Diagnostik. Bei einer Schilddrüsen-Szintigrafie werden Lage, Form, Größe und Vorliegen von heißen/kalten Knoten bestimmt.
Morbus Basedow.
Abb. 38.14 Das Farbduplexsonogramm zeigt im Längsschnitt eine vermehrte Durchblutung der Schilddrüse.
Merke
-
kalter Knoten: inaktives Gewebe, das kein Radionuklid speichert (z. B. Zyste, Verkalkung, Karzinom)
-
heißer Knoten: überaktive Speicherung von Radionuklid, z. B. autonomes Adenom
38.2.1.2 Therapie/Pflege- und Behandlungsplan Hyperthyreose
Die Pflege von Patienten mit einer Schilddrüsenüberfunktion erklärt sich aus dem hohen Grundumsatz. So ist besonderes pflegerisches Augenmerk auf die Kontrolle der Vitalzeichen zu richten, um eine thyreotoxische Krise rechtzeitig zu erkennen. Bei starkem Gewichtsverlust durch Durchfälle muss das Gewicht regelmäßig kontrolliert werden und das Ernährungs-/Flüssigkeitsdefizit durch hochkalorische Nahrungsmittel und Flüssigkeitssubstitution ausgeglichen werden. Bei Exophthalmus sollten, um die Austrocknungsgefahr zu vermeiden, künstliche Tränenflüssigkeit oder Augentropfen nach Anordnung verabreicht werden.
Bei Unruhe und Schlafstörungen sollten die Patienten auf anregende Getränke (Kaffee, Tee) verzichten und eher Kräutertees mit beruhigender Wirkung bevorzugen. Weitere pflegerische Maßnahmen ergeben sich aus der gewählten Therapie.
Grundsätzlich haben die Betroffenen einen großen Informationsbedarf, da der Zusammenhang zwischen der Schilddrüse und ihrem reduzierten körperlichen Befinden mit der Alltagsvorstellung körperlicher Funktionen nicht hinreichend erklärbar ist (Arastéh et al. 2012).
Medikamentöse Therapie mit Thyreostatika
Für die Behandlung stehen verschiedene Medikamente zur Verfügung. Diese müssen wegen der besseren Resorption frühmorgens eingenommen werden. Dies wird bei der Übergabe vom Spät- zum Nachtdienst mit der zuständigen Pflegekraft besprochen. Je nach Symptomatik wird ergänzend ein β-Rezeptoren-Blocker verordnet, der die Tachykardie herabsetzt und auch auf die Schilddrüsenhormone wirkt. Die Patienten müssen hinsichtlich der Nebenwirkungen und der regelmäßigen Einnahme der Medikamente beraten werden (Arastéh et al. 2012, Bieber et al. 2012).
Radiojodtherapie
Die Radiojodtherapie ist ein nuklearmedizinisches Verfahren zur Behandlung eines autonomen Adenoms der Schilddrüse und der Basedow-Erkrankung. Die Therapie wird in Deutschland immer stationär auf dafür besonders ausgestatteten Stationen durchgeführt. Per os (über den Mund) wird eine radioaktive Substanz (Iod-Isotop131) gegeben, die sich in den Schilddrüsenfollikel speichert und die Zellen zerstört. Der Patient darf für die Zeit der Behandlung die Therapiestation nicht verlassen. Die Patienten sind i. d. R. mobil und versorgen sich selbst. Die Ausscheidungen, Waschwasser usw. sind kontaminiert und werden über eine getrennte Abwasserinstallation entsorgt. Da der Patient auch keinen Besuch empfangen darf, sind Gespräche und Beschäftigungsangebote eine zentrale pflegerische Aufgabe (Arastéh et al. 2012).
Kontraindikationen Kontraindikationen sind Schwangerschaft, Stillzeit und Wachstumsalter. Der Verdacht auf maligne Veränderungen der Schilddrüse bedarf einer anderen Therapieform.
Nebenwirkungen Häufigste Nebenwirkung der Radiojodtherapie ist die harmlose, aber schmerzhafte Entzündungsreaktion der Schilddrüse. Es kann zudem zu einer Schwellung der Tyreoidea kommen, wodurch über mehrere Tage ein Druck auf die Trachea ausgeübt wird. Diese sehr unangenehme Nebenwirkung kann zu einem Gefühl der Luftnot führen. Dem Patienten werden Kühlelemente angeboten, medikamentös wird ggf. Kortison angeordnet (Arastéh et al. 2012, Bieber et al. 2012).
Praxistipp
Die Einhaltung von Arbeitsschutzvorgaben ist besonders wichtig! Schwangere dürfen nicht auf einer Radiojodstation arbeiten. Das Pflegepersonal wird mit Dosimetern ausgestattet, die zum Schutz des Mitarbeiters regelmäßig ausgelesen werden. Ein körperlicher Abstand zum Patienten ist einzuhalten.
Operation – Strumektomie
Eine Strumektomie hat ebenfalls das Ziel, das Wiederauftreten einer Hyperthyreose dauerhaft zu unterbinden. Es wird eine subtotale Resektion durchgeführt. Im Anschluss wird der Patient eine Substitutionstherapie erhalten, die auch ein Rezidiv verhindern soll. Wenn die Ursache der Struma ein Jodmangel war, dann führt der Patient Jod oral zu.
38.2.1.3 Hypothyreose
Definition
Die Hypothyreose zeichnet sich durch einen Mangel an dem Schilddrüsenhormon Thyroxin aus.
Ursachen
Der häufigste Grund für eine Unterfunktion ist der Jodmangel der Nahrung: Die Hypophyse schüttet deshalb vermehrt TSH aus. Die Schilddrüse vergrößert sich und es entsteht ein sog. Jodmangelkropf oder eine Struma.
Als sekundäre Ursache wird eine Unterfunktion/Insuffizienz der Adenohypophyse beschrieben, die zu einer verminderten Ausschüttung von Thyrotropin (TSH) und den Symptomen einer Hypothyreose führt. Frauen sind deutlich häufiger betroffen als Männer. Die Krankheitshäufigkeit nimmt mit steigendem Lebensalter zu. Hypothyreosen sind gekennzeichnet von den Auswirkungen des Hormonmangels, der sich in verlangsamten Stoffwechselprozessen und Körperfunktionen äußert (Wagner 2015). Weiter lässt sich zwischen einer angeborenen und einer erworbenen Hypothyreose unterscheiden.
Angeborene Hypothyreose Primäre Ursachen der angeborenen Hypothyreose (1:5000 Geburten/Jahr) sind die mangelhafte Ausbildung der Schilddrüse (Aplasie, Hypoplasie), eine gestörte/fehlerhafte Hormonsynthese (10–20% der Fälle) und intrauterine Einflüsse (Jodmangel, Medikamente wie Thyreostatika u. a.) (Wagner 2015). Als sekundäre Ursache kommt ein TSH-Mangel in Betracht.
Erworbene Hypothyreose Häufigste Ursache für eine primär erworbene Hypothyreose ist eine Thyreoditis vom Typ Hashimoto. Weitere Ursachen können iatrogen (durch ärztliche Therapie) sein:
-
Thyreoidektomie
-
Radiojodtherapie
-
Medikamente (z.B. Thyreostatika, Lithium oder Amiodaron)
Sekundäre Formen sind meistens durch einen Hypophysentumor bzw. durch dessen Resektion oder Bestrahlung bedingt (Wagner 2015).
Symptome und Diagnostik
Angeborene Hypothyreose Eine angeborene Hypothyreose kann heute frühzeitig durch das Neugeborenen-Screening erkannt werden. Durch die sofortige Therapie (Hormonsubstitution) kann eine Ausbildung des Krankheitsbildes verhindert werden. Sonografie und oder weitere Blutuntersuchungen können folgen (Wagner 2015).
Leitsymptome sind:
-
Trink- und Essensunlust
-
Obstipation
-
übersteigertes Schlafbedürfnis
-
raue, heisere Stimme
-
trockene, spröde Haut
Hinzukommen können ein verlängerter Neugeborenenikterus sowie ein Reifungs- und Wachstumsrückstand.
Erworbene Hypothyreose Die Symptome sind abhängig von der Verlaufsform. Oft ist der Krankheitsbeginn schleichend und die Krankheit wird erst spät diagnostiziert. Charakteristisch ist eine globale Herabsetzung der Stoffwechselprozesse und Körperfunktionen. Einen Überblick über die Symptome gibt ▶ Abb. 38.15.
Symptome der Hypothyreose.
Abb. 38.15 Überblick über die Symptome einer Hypothyreose.
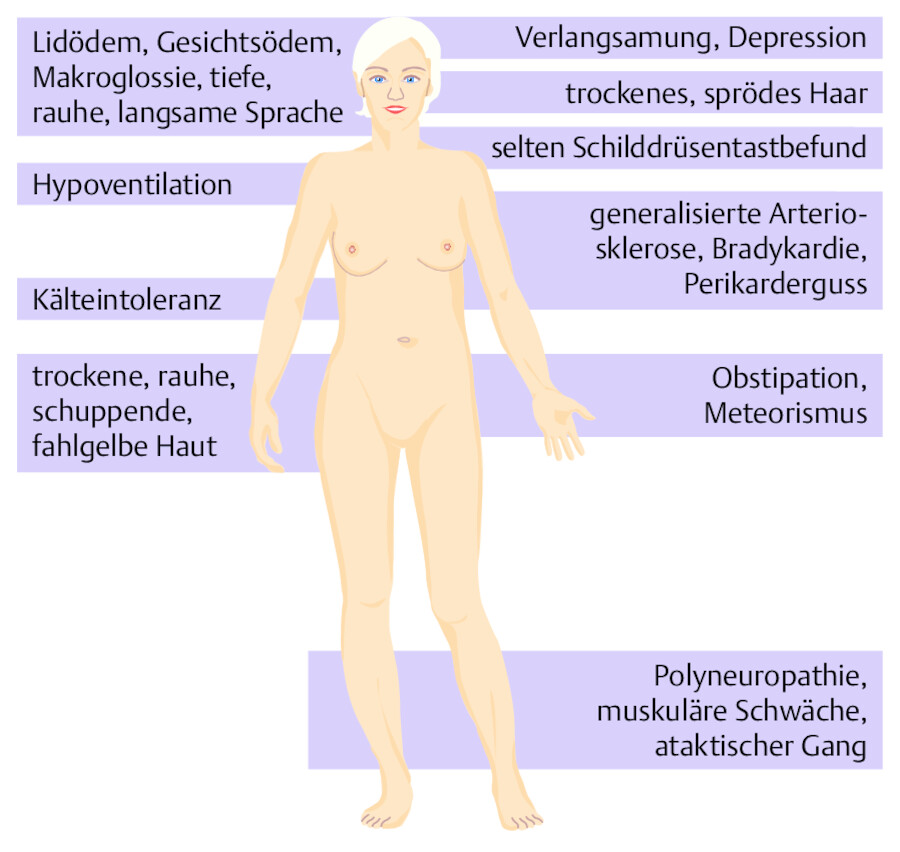
Die schwerste Verlaufsform ist das heute seltene hypothyreote Koma, einhergehend mit:
-
Hypothermie < 30°C
-
Bradypnoe < 5/Min.
-
Hypotonie
-
Bewusstseinsstörungen
-
Krämpfen
-
generalisierten Gewebsschwellungen
Diagnostisch wird das Blut auf die typischen Schilddrüsenparameter untersucht. Hinzu kommen sonografische Untersuchungen sowie EKG, Szintigrafie und eine Feinnadelpunktion. Differenzialdiagnostisch sollten eine alleinige Depression, eine Demenz sowie eine Herzinsuffizienz ausgeschlossen werden (Wagner 2015).
Therapie
Die Therapie besteht, unabhängig von der Ursache, aus einer lebenslangen Substitution von L-Thyroxin. Begonnen wird mit niedrigen Dosen, die langsam gesteigert werden, damit es nicht zu Herzrhythmusstörungen oder Angina-pectoris-Anfällen kommt. Es sollten keine Auslassversuche unternommen werden. Während Schwangerschaften ist mit einer Dosiserhöhung zu rechnen. Die Unterbrechung der Substitution für Operationen oder schwerwiegende andere Erkrankungen ist nicht erforderlich, aber bis zu einer Woche möglich (Wagner 2015).
Pflege bei Hypothyreose
Die medikamentöse Neueinstellung bedeutet eine Belastung für das Herz-Kreislauf-System. Daher umfasst die pflegerische Beobachtung die regelmäßige Kontrolle von Puls und Blutdruck. Bei verlangsamten Patienten wird aktivierend gepflegt und die Eigenaktivität des Betroffenen gefördert. Eine Überforderung ist jedoch immer zu vermeiden.
Trockene und schuppige Haut bedingt eine adäquate Hautpflege. Viele Betroffene sind sehr Kälteempfindlich. Fragen Sie den Patienten deshalb nach seinem persönlichen Kälte-/Wärmeempfinden und bieten Sie ihm bei Bedarf z.B. eine zusätzliche Bettdecke an.
Praxistipp
L-Thyroxin sollte am besten morgens, unzerkaut, mind. 30 Min. vor dem Frühstück eingenommen werden, da es so besser vom Körper resorbiert werden kann (Menche u. Brandt 2013).
Da hypothyreotische Menschen oft übergewichtig sind, sollte auf eine bedarfsgerechte Ernährung geachtet werden. Wichtig ist zudem die Durchführung obstipations- sowie pneumonieprophylaktischer Maßnahmen. Der Patient muss wissen, dass die regelmäßige Einnahme von L-Thyroxin wichtig für sein Wohlbefinden ist und im Therapieverlauf die medikamentöse Einstellung immer wieder überprüft werden muss (Menche u. Brandt 2013).
38.2.1.4 Struma
Grundlagen
Jede sicht- oder tastbare Vergrößerung der Schilddrüse wird als Struma bezeichnet. Dabei ist es unerheblich, was die Ursache ist und ob Funktionen des Organs verändert sind. Die Vergrößerung wird in 3 Stadien unterteilt:
-
Stadium 1: Schilddrüse ist tastbar und bei rekliniertem Kopf (rückwärts geneigtem Kopf) sichtbar.
-
Stadium 2: Vergrößerung ist tastbar und ohne Reklination sichtbar.
-
Stadium 3: Struma ist bereits aus größerer Entfernung sichtbar.
Weiter findet eine Einteilung nach Konsistenz des Gewebes statt. Eine weiche und gleichmäßige Vergrößerung wird Struma diffusa genannt. Im Verlauf können sich knotige Veränderungen zeigen. Dies wird als Struma nodosa bezeichnet (Schweitzer, 2011).
Tritt die Vergrößerung zusammen mit einer Überfunktion der Schilddrüse auf, so wird diese als hyperthyreote Struma bezeichnet. Bei einer Unterfunktion entsprechend hypothyreote Struma. Die häufigste Form ist die blande Struma, bei der eine normale (euthyreote) Stoffwechsellage vorherrscht (Paetz 2013). Diese ist ätiologisch auf einen nahrungsbedingten Jodmangel zurückzuführen, welcher zu einer Ausschüttung von Wachstumshormonen in der Schilddrüse führt. Epidemiologisch sind ca. 50 % der Erwachsenen betroffen; Verhältnis Frauen zu Männern = 5:1 (Wagner 2015).
Symptome
Zunächst verläuft eine Struma asymptomatisch. Bei zunehmender Vergrößerung zeigen sich unspezifische Symptome. Patienten berichten von einem unangenehmen Gefühl beim Tragen von geschlossenen Kragen. Außerdem können Kloß- oder Druck- bis hin zu Fremdkörpergefühlen im Halsbereich auftreten. Ist die Struma weit fortgeschritten, zeigen sich Symptome durch Beeinträchtigungen von Nachbarstrukturen (Wagner 2015) ( ▶ Tab. 38.19 ).
|
Beeinträchtigte Nachbarstrukturen |
Mögliche Symptome |
|
Einengung der Trachea |
Belastungsdyspnoe (auch bei bestimmten Kopfhaltungen), Stridor |
|
Schädigung des N. recurrens |
Heiserkeit |
|
Einengung des Ösophagus |
Dysphagie |
Diagnostik
Bei der Diagnostik wird die Funktion und Größe der Schilddrüse sowie ihre Beschaffenheit (z. B. Knoten) beurteilt. Dazu dienen die klinischen Symptome des Patienten, Labor (Hormone und Bestimmung der Antikörper im Blut, BSG, CRP), Sonografie (Volumenbestimmung der Schilddrüse), ggf. Szintigrafie/Feinnadelpunktion (bei v.a. Karzinom) der Schilddrüse (Menche u. Brandt 2013). Wichtig ist die Strumaanamnese (Zeit, Dynamik des Wachstums, Schluckbeschwerden, Druckgefühl im Hals).
Therapie
Die blande Struma wird zunächst konservativ mit Jodid behandelt, um der Schilddrüse den Wachstumsreiz zu nehmen. Reicht dies nicht aus, wird zusätzlich L-Thyroxin verabreicht. Dabei ist auf die regelmäßige Einnahme sowie auf den Einnahmezeitpunkt zu achten. In der Regel bildet sich eine (frühzeitig) erkannte Struma unter Jodgabe nach 3–6 Monaten zurück. Darüber hinaus werden operative Verfahren eingesetzt:
-
Subtotale Resektion: Entfernung eines Teils der Schilddrüse. Kann ein- oder beidseitig durchgeführt werden.
-
Thyreoidektomie (auch Strumektomie): Vollständige Entfernung der Schilddrüse. Meist bei malignen Tumoren indiziert.
Dabei ist die subtotale Resektion der häufigste Eingriff an der Schilddrüse (Paetz 2013). Indikationen für eine chirurgische Therapie sind große Knotenstrumen, kalte Knoten, Verdacht auf einen malignen Tumor, bestehende oder drohende Tracheomalazie sowie eine Einflussstauung (Wagner 2015).
38.2.1.5 Pflege- und Behandlungsplan Struma
Situation des Patienten Eine Struma bedeutet für viele Patienten nicht nur ein optisches Problem, sondern führt oft zu erheblichen Beschwerden beim Schlucken und Atmen. Insbesondere das Engegefühl im Halsbereich kann beim Patienten Angst auslösen, hinzu kommen die Angst vor einer Operation und die Möglichkeit, dass die Sprache durch eine Verletzung des Nervus recurrens bleibend geschädigt wird. Dementsprechend ist ein Einfühlen in die Lage des Patienten wichtig für den Aufbau einer pflegerischen Beziehung, über die der Patient im Behandlungsverlauf begleitet und gestützt werden kann.
Präoperative Pflege
Grundsätzlich wird Folgendes präoperativ erfasst und kontrolliert:
-
Befinden des Patienten (Appetit, Schlaf, Ausscheidung, Nervosität, Schwitzen)
-
Vitalzeichen (insbesondere Tachyarrhythmie)
-
Halsumfang
-
Körpergewicht
-
Hormonstatus (TSH, T3/fT3, T4/fT4), Blutbild wegen möglicher hämatotoxischer Nebenwirkungen der Medikamente
Zur präoperativen Vorbereitung bei Schilddrüsen-Operationen gehören folgende Maßnahmen:
-
Aus rechtlichen Gründen muss ein HNO-Konsil zur Beurteilung der Stimmbandfunktion (N. recurrens) erfolgen.
-
Laborbestimmungen, EKG, Röntgen-Thorax
-
ggf. Rasur (vom Kinn bis hinter die Ohren, Hals, Brust bis zu den Mamillen)
-
Haare zusammenbinden, OP-Haube aufsetzen lassen
-
ggf. Gebiss, Piercings, Schmuck ablegen lassen
Postoperative Pflege
Zur postoperativen Pflege gehören folgende Pflegemaßnahmen:
-
Auf Atemstörungen achten (können ein Hinweis auf Schwellungen oder Blutungen sein).
-
Verband regelmäßig, auch im Nacken, auf Nachblutungen kontrollieren.
-
Regelmäßig Redonflasche bzw. Lasche auf vermehrte Blutmenge kontrollieren.
-
Überwachungsbogen führen mit regelmäßiger Aufzeichnung der Vitalzeichen (RR-Abfall, Tachykardie, Tachypnoe, Stridor).
-
Oberkörper erhöht (auf 45°) positionieren oder bei stabilen Patienten höher, damit sich das Wundödem zurückbilden kann und das Wundsekret besser abfließt (außerdem wirkt die Positionierung druckentlastend und damit auch schmerzlindernd).
-
Hals durch kleines Kissen oder Nackenrolle unterstützen (entlastet den Kopf).
-
Patienten anleiten, Seitwärtsbewegungen des Kopfes mit dem gesamten Oberkörper durchzuführen und ruckartige Körperbewegungen zu vermeiden.
-
Patienten am Abend des OP-Tages mobilisieren.
-
Bei der Körperpflege unterstützen, da Kopfbewegungen noch schmerzen und der Patient noch nicht mobil ist.
-
Auf Aspirationsgefahr durch Gefahr des Verschluckens beim Trinken achten.
-
Wenn keine Schluckbeschwerden auftreten, mit dem Kostaufbau beginnen (kein Zwieback usw. → keine Krümel!).
-
Aufgrund schmerzbedingter Schonatmung Maßnahmen zur ▶ Pneumonieprophylaxe durchführen.
▶ Tab. 38.20 gibt eine Übersicht über die Komplikationen nach einer Schilddrüsen-OP sowie deren Anzeichen und pflegerische Überwachung.
|
Komplikationen |
Symptome |
Überwachungsparameter |
|
Nachblutung nach innen |
|
|
|
Nachblutung nach außen |
|
|
|
Lähmung des Nervus recurrens durch intraoperative Verletzung, Wundödem oder Nachblutung |
|
|
|
Hyperparathyreoidismus = Abfall des Parathormonspiegels (wegen Entfernung der Nebenschilddrüse) |
|
|
Postoperative Schmerzreduktion
Pflegemaßnahmen zur postoperativen Schmerzreduktion sind:
-
Patienten dazu anhalten, dass er den Kopf beim Aufstehen am eigenen Haarschopf hält.
-
Ein kleines Kissen unter den Kopf legen, damit ein Überstrecken vermieden wird.
-
Unterarme auf ein Kissen legen, damit der Zug auf die Halsmuskeln reduziert wird.
-
Ein gefaltetes Handtuch längs unter den Kopf legen, sodass der Patient die Handtuchenden selbst fassen und so seinen Kopf selbst umpositionieren kann.
Strumaprophylaxe (Strumaprävention)
In Deutschland liegt das tägliche Joddefizit bei 100–200 µg. Nur 10% der deutschen Bevölkerung deckt ihren Jodbedarf ausreichend. Indikationen für eine Strumaprophylaxe sind:
-
positive Familienanamnese
-
Kindes- und Jugendalter (aufgrund sehr hoher Prävalenz)
-
Schwangerschaft und Stillzeit
-
nach erfolgreicher Strumatherapie
Es wird empfohlen jodiertes Speisesalz zu verwenden und regelmäßig Fisch zu essen, der reich an Jod ist (Schellfisch, Seelachs, Kabeljau, Scholle, Hering und Thunfisch). Es hat sich gezeigt, dass ein Ausgleich des Defizits durch diese Maßnahmen nur unzureichend möglich ist. Eine wirksame Prophylaxe kann nur über die Einnahme von Jodid in Tablettenform sichergestellt werden (Wagner 2015).
Nachsorge
Nach erfolgreicher Therapie sollten regelmäßig die Schilddrüsenhormone kontrolliert werden (anfangs nach 3, 6, 12 Monaten, später 1-mal jährlich bzw. beim Auftreten von Symptomen). Bei der Kontrolluntersuchung wird immer ein Anamnesegespräch geführt, eine körperliche Untersuchung (einschließlich einer Halsumfangsmessung) vorgenommen und die Blutwerte kontrolliert. Ggf. kann eine Sonografie notwendig sein (Wagner 2015).
38.3 Lern- und Leseservice
38.3.1 Literatur
38.3.1.1 Diabetes mellitus
[1914] Bahrmann A, Hodeck K. Pflegewissen Diabetes. Heidelberg: Springer; 2014
[1915] Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF), Hrsg. Nationale Versorgungsleitlinie. Therapie des Typ-2-Diabetes (2014). Im Internet: http://www.leitlinien.de/mdb/downloads/nvl/diabetes-mellitus/dm-therapie-1aufl-vers4-lang.pdf; Stand: 18.12.2016
[1916] Bundesinstitut für Risikobewertung. Erhöhte Aufnahme von Fruktose ist für Diabetiker nicht empfehlenswert. Stellungnahme Nr. 041/2009 (06.03.2009). Im Internet: http://www.bfr.bund.de/cm/343/erhoehte_aufnahme_von_fruktose_ist_fuer_diabetiker_nicht_empfehlenswert.pdf; Stand: 18.12.201
[1917] Danne T, Kordonouri O, Lange K. Diabetes bei Kindern und Jugendlichen. 7. Aufl. Berlin: Springer; 2015
[1918] Deutsche Diabetes Gesellschaft. Die meisten Amputationen in Deutschland sind Folge von Diabetes – und ließen sich verhindern. (28.09.2012) Im Internet: http://www.deutsche-diabetes-gesellschaft.de/presse/ddg-pressemeldungen/meldungen-detailansicht/article/die-meisten-amputationen-in-deutschland-sind-folge-von-diabetes-und-liessen-sich-verhindern.html; Stand: 18.12.2016
[1919] Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Study Research Group (DCCT/EDIC). Intensive Diabetes Treatment and Cardiovascular Disease in Patients with Type 1 Diabetes. N Eng J Med 2005; 353: 2643–2653
[1920] DiabetesDE – Deutsche Diabetes-Hilfe, Hrsg., Deutscher gesundheitsbericht Diabetes 2016. (13.11.2015). Im Internet: http://www.diabetesde.org/index.php?id=6417&tx_ttnews[tt_news]=12913&tx_ttnews[backPid]=6391; Stand: 18.12.2016
[1921] Hammes HP, Lemmen KD, Bertram B. Diabetische Retinopathie und Makulopathie. DDG Praxisempfehlung. Diabetologie 2015; 10: 119–123
[1922] Heinrich PC, Müller M, Graeve L, Hrsg. Löffler/Petrides Biochemie und Pathobiochemie. 9. Aufl. Berlin: Springer; 2014
[1923] Hien P, Böhm B, Claudi-Böhm S et al. Diabetes-Handbuch. 7. Aufl. Berlin: Springer; 2013
[1924] Huppertz E, Köster I, Hauner H et al. Ergebnisse der KoDIM-Studie 2010 – Diabetes: Häufigkeit und Kosten der Grunderkrankung, von Komplikationen und Begleiterkrankungen. Diabetologie und Stoffwechsel 2014, DOI: 10.1055/s-0034–1375004International Diabetes Federation, Hrsg., IDF Diabetes Atlas. 7th Edition. (2015). Im Internet: http://www.diabetesatlas.org; Stand: 18.12.2016
[1925] Kerner W, Brückel J. Definition. Klassifikation und Diagnostik des Diabetes mellitus. DDG Praxisempfehlung. Diabetologie und Stoffwechsel. 2015; 10: 98–101
[1926] Kitabchi AE, Umpierrez GE, Miles JM et al. Hyperglycemic Crises in Adult Patients With Diabetes. Diabetes Care 2009; 32: 1335–1343
[1927] Landgraf R, Kellerer M, Fach E. Praxisempfehlungen DDG/ DGIM. Therapie des Typ-2-Diabetes. DDG Praxisempfehlung. Diabetologie und Stoffwechsel. 2015; 10: 140–151
[1928] Matthaei S, Bierwirth A, Fritsche B et al. Medikamentöse antihyperglykämische Therapie des Diabetes mellitus Typ 2. Update der Evidenzbasierten Leitlinie der Deutschen Diabetes-Gesellschaft. Update vom Oktober 2008. Im Internet: http://www.awmf.org/uploads/tx_szleitlinien/057–012_S3_Medikamentoese_antihyperglykaemische_Therapie_des_Diabetes_mellitus_Typ_2_10–2008_10–2013.pdf; Stand: 10.03.2017
[1929] Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen e. V. (MDS), Hrsg. Ergänzender Begutachtungsleitfaden zum Begutachtungsleitfaden „Begutachtung der Versorgung mit Hilfsmitteln“. Insulinpumpen bei Kindern und Jugendlichen mit Diabetes mellitus Typ 1. (21.08.2012) Im Internet http://www.bdsn.de/fileadmin/user_upload/Download/MDK_Leitlinie_f%C3%BCr_Insulinpumpengenehmigung_f%C3%BCr_Kinder_2012.pdf; Stand: 18.12.2016
[1930] Neu A, Beyer P, Bürger-Büsing J et al. Diagnostik, Therapie und Verlaufskontrollen des Diabetes mellitus im Kindes- und Jugendalter. DDG Praxisempfehlung. Diabetologie und Stoffwechsel. 2015; 10: 181–191
[1931] Offermanns S. Antidiabetika. In: Freissmuth L, Offermanns S, Böhm S. Pharmakologie & Toxikologie. Heidelberg: Springer; 2016: 645–667
[1932] Rüster C, Hasslacher C, Wolf G. Nephropathie bei Diabetes. DDG Praxisempfehlung. Diabetologie 2015; 10: 113–118
[1933] Schatz H, Pfeiffer AFH, Hrsg. Diabetologie kompakt. Grundlagen und Praxis. 5.Aufl. Berlin: Springer; 2014
[1934] Schwegler J, Lucius R. Der Mensch. Anatomie und Physiologie. 6. Aufl. Stuttgart: Thieme; 2016
[1935] Siegmund T, Schumm-Draeger PM. Diabetische Notfallsituationen – die Hypoglykämie. Diabetologe 2014; 10: 628–637
[1936] Sigrist S, Brädndle M. Hyperglykämische Notfallsituationen beim Erwachsenen. Swiss Medial Forum 2015; 33: 723–728
[1937] Silverthorn D. Physiologie. 4., aktualisierte Aufl. München: Pearson Education; 2009
[1938] Toeller M, Mann J, De Leeuw et al. Evidenz-basierte Ernährungsempfehlung zur Behandlung und Prävention des Diabetes mellitus. Diabetes und Stoffwechsel 2005; 14: 75–94. Erschienen als Leitlinie der DDG 06/2010
[1939] Verband der Diabetes-Beratungs-und Schulungsberufe in Deutschland e.V. (VDBD), Hrsg. Die Injektion bei Diabetes mellitus (2011). Im Internet: http://www.vdbd.de/Downloads/VDBD_Leitfaden_Insulininjektion_PM107_HR_FINAL.pdf; Stand: 18.12.2016
[1940] Wagner H. Krankheiten der Inselzellen des Pankreas. In: Gerlach U, Wagner H, Wirth W, Hrsg. Innere Medizin für Pflegeberufe. 8. Aufl. Stuttgart: Thieme; 2015: 294–322
[1941] Ziegler D, Keller J, Maier C et al. Diabetische Neuropathie. DDG Praxisempfehlung. Diabetologie 2015; 10: 102–112
38.3.1.2 Schilddrüsenerkrankungen
[1942] Arastéh K, Baenkler H-W, Bieber C, Roland B, Chatterjee T. Duale Reihe Innere Medizin. Stuttgart: Thieme; 2012
[1943] Freissmuth M. Schilddrüse. In: Freissmuth L, Offermanns S, Böhm S. Pharmakologie & Toxikologie. Heidelberg: Springer; 2016: 617–626
[1944] Menche N, Brandt I, Hrsg. Pflege konkret. Innere Medizin. 6. Aufl. München: Elsevier; 2013
[1945] Paetz B. Schilddrüse und Nebenschilddrüse. In: Paetz B, Hrsg. Chirurgie für Pflegeberufe. 22. Aufl. Stuttgart: Thieme; 2013: 261–273
[1946] Schwegler J, Lucius R. Der Mensch. Anatomie und Physiologie. 6. Aufl. Stuttgart: Thieme; 2016
[1947] Schweitzer R. Endokrinologie mit Stoffwechsel. 2. Aufl. München: Elsevier; 2014
[1948] Silverthorn D. Physiologie. 4., aktualisierte Aufl. München: Pearson Education; 2009
[1949] Wagner H. Krankheiten der Schilddrüse. In: Wagner H, Wirth W, Hrsg. Innere Medizin für Pflegeberufe. 8. Aufl. Stuttgart: Thieme; 2015: 354–376
[1950] Deutsche Gesellschaft für Allgemein- und Viszeralchirurgie (DGAV), Hrsg. Operative Therapie benigner Schilddrüsenerkrankungen (2015). Im Internet: http://www.awmf.org/uploads/tx_szleitlinien/088–007l_S2k_operative_Therapie_benigner_Schilddr%C3%BCsenerkrankungen_2015–10.pdf; Stand:18.12.2016
38.3.2 Internetadressen
[1951] www.deutsche-diabetes-gesellschaft.de; Stand:18.12.2016
[1952] www.diabetes.org; Stand:18.12.2016
[1953] www.diabetesde.org; Stand:18.12.2016
[1954] www.dzd-ev.de; Stand:18.12.2016
[1955] www.idf.org; Stand:18.12.2016
[1956] www.leitlinien.de/nvl/diabetes; Stand:18.12.2016